Спосіб одержання рекомбінантного білка шляхом транзієнтної експресії трансгену в рослині виду nicotiana excelsior
Номер патенту: 31239
Опубліковано: 25.03.2008
Автори: Кучук Микола Вікторович, Сіндаровська Яна Рудольфівна, Шелудько Юрій Всеволодович, Герасименко Ірина Михайлівна
Формула / Реферат
1. Спосіб одержання рекомбінантних білків шляхом Agrobacterium-опосередкованої транзієнтної експресії трансгену, що включає нарощування суспензії агробактерій, заміну поживного середовища на інфільтраційний буфер, введення агробактеріальної суспензії у листки рослин в умовах in vivo, підтримання рослин в стабільних тепличних умовах протягом кількох днів, збирання листкової біомаси, екстракції сумарної розчинної білкової фракції, який відрізняється тим, що як рослину-хазяїн використовують таксономічний вид Nicotiana excelsior.
2. Спосіб за п. 1, який відрізняється тим, що введення агробактеріальної суспензії та збирання листкової біомаси здійснюють на стадії дорослих рослин до цвітіння.
3. Спосіб за п. 1 або 2, який відрізняється тим, що введення агробактеріальної суспензії здійснюють у 2, 3 та 4 листки від апікальної точки.
Текст
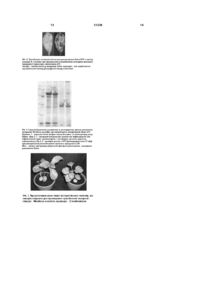
1. Спосіб одержання рекомбінантних білків шляхом Agrobacterium-опосередкованої транзієнтної експресії трансгену, що включає нарощування суспензії агробактерій, заміну поживного середовища на інфільтраційний буфер, U 2 (11) 1 ШЛЯХОМ UA ДЕРЖАВНИЙ Д ЕПАРТАМЕНТ ІНТЕЛ ЕКТУАЛЬНОЇ ВЛАСНОСТІ ОПИС (19) МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ 3 31239 Agrobacterium, 2004, PNAS, V.101, No. 18, P.68526857]. Такий спосіб особливо привабливий у випадку необхідності негайного отримання препаративних кількостей бажаного білку, наприклад, це стосується продукції пацієнтспецифічних антитіл до клітин злоякісних пухлин, які швидко прогресують (деякі лімфоми) [McCormick А.А. et al. Rapid production of specific vaccines for lymphoma by expression of the tumorderived single-chain Fv epitopes in tobacco plants, 1999, PNAS, V.96, lssue2, P.703-708]. Як модельні об'єкти для транзієнтної експресії зазвичай використовуються два представники роду Nicotiana (тютюнів): сільськогосподарський вид - N. tabacum (рослина, яка походить з американського континенту) та його австралійський родич - N. benthamiana. Відомий спосіб Agrobacterium-опосередкованої транзієнтної експресії (трансген потрапляє в клітину за допомогою ґрунтової бактерії А. tumefacience), який включає нарощування суспензії агробактерій, які несуть відповідні генетичні конструкції на бактеріальному поживному середовищі, заміну поживного середовища на інфільтраційний буфер або дистильовану воду, введення аробактеріальної суспензії у листок рослини, підтримання рослин в стабільних тепличних умовах протягом кількох днів, збирання листкової біомаси, екстракції сумарної розчинної білкової фракції, в якому як рослину-господар використовують сільськогосподарський вид N. tabacum (рослина, яка походить з американського континенту) [наприклад, Zeiada A. et al. Expression of tuberculosis antigen ESAT6 in Nicotiana tabacum using a potato virus X-based vector, 2006, Tuberculosis, V.86, P.263-267]. Недоліком проведення Agrobacferiumопосередкованої транзієнтної експресії генів в рослинах виду N. tabacum є не завжди високий вміст цільового білка в листках. Крім того, при використанні вірусних генетичних векторів, даний вид може утворювати значні некротичні ділянки в місцях інфільтрації (реакція гіперчутливого типу рослини), що перешкоджає накопиченню кінцевого продукту. Найбільш близьким є спосіб Agrobacteriumопосередкованоі транзієнтної експресії, який включає нарощування суспензії агробактерій, які несуть відповідні генетичні конструкції на бактеріальному поживному середовищі, заміну поживного середовища на інфільтраційний буфер або дистильовану воду, введення аробактеріальної суспензії у листок рослини, підтримання рослин в стабільних тепличних умовах протягом кількох днів, збирання листкової біомаси, екстракції сумарної розчинної білкової фракції, в якому як рослину-господар використовують таксономічний вид N. benthamiana [наприклад, Wydro М. et al. Optimization of transient Agrobacterium-mediated gene expression system in leaves of Nicotiana benthamiana, 2006, Acta Biochimica Polonica, V.53, No.2, P.289-298]. Австралійський тютюн N. benthamiana, на відміну від N. tabacum, чутливий не лише до агробактерії, 4 але й до широкого кола рослинних вірусів. На сьогодні рослинні вірусні вектори або векторні системи з елементами вірусного геному частково витісняють традиційні вектори з генами під контролем сильних конститутивних промоторів, оскільки є більш ефективними. Така тенденція спостерігається і у випадку проведення Agrobacterium-опосередкованої транзієнтної експресії. Тому чутливість виду до вірусів відіграє не останню роль. Використовуючи різні типи векторних систем, в рослинах виду N. benthamiana уже отримали цілий ряд рекомбінантних білків, серед яких чимало фармацевтично-цінних, для багатьох з них показана наявність біологічної активності. Основним недоліком при отриманні білків в даному виді є все ще низькі рівні експресії трансгену (якщо не використовувати удосконалених векторних конструкцій) та невелика листкова біомаса рослини (в кілька разів менша ніж у виді N. tabacum), що перешкоджає отримувати рекомбінантний білок у препаративних кількостях. Завданням даної корисної моделі є створення такого способу одержання рекомбінантних білків методом транзієнтної експресії, при якому шляхом вибору іншої рослини-господаря досягається підвищений вміст рекомбінантних білків в перерахунку на одиницю рослинної біомаси та/ або в перерахунку на цілу рослину. Такий спосіб дозволить отримувати рекомбінантні білки у препаративних кількостях (достатніх для біотехнологічного виробництва фармацевтичноцінних препаратів). Для вирішення завдання запропонований спосіб Agrobacterium-опосередкованої транзієнтної експресії, який включає нарощування суспензії агробактерій з генетичними конструкціями на бактеріальному поживному середовищі, заміну поживного середовища на інфільтраційний буфер, введення аробактеріальної суспензії у листки рослин в умовах in vivo, підтримання рослин в стабільних тепличних умовах протягом кількох днів, збирання листкової біомаси, екстракції сумарної розчинної білкової фракції, в якому, згідно з корисною моделлю, як рослину-господар використовують австралійський вид тютюну Nicotiana excelsior. Відповідно до даної корисної моделі технічний результат досягається завдяки більшій листковій біомасі рослин N. excelsior в порівнянні з листками рослин N. benthamiana на фоні незмінного або підвищеного вмісту цільового білка. Завдання вирішували шля хом відбору перспективного господаря (зі збільшеними рівнями накопичення цільового білка та/або зі збільшеною біомасою листків) для проведення Agrobacteriumопосередкованої транзієнтної експресії генів, які входять до складу векторних систем різних типів, серед австралійських представників роду Nicotiana; а також шляхом оптимізації умов проведення транзієнтної експресії в перспективному господарі. Вид N. excelsior був відібраний як перспективний господар серед 6 видів 5 31239 австралійських тютюнів: N. excelsior, N. debneyi, N. exigua, N. maritima, N. simulans, N. cavicola, показники порівнювали з даними отриманими для модельного виду - N. benthamiana. Австралійські види були обрані не лише через поширене використання виду N. benthamiana, але й тому, що серед роду Nicotiana найбільшу чутливість до широкого кола рослинних вірусів має підрід Petunioides, секція Suaveolentes, до якої належать всі австралійські представники роду [Dijk P. et al. Accession of Australian Nicotiana species suitable as indicator hosts in the diagnosis of plant virus diseases, 1987, European J. of Plant Pathology, V.93, No.2, P.73-85]. У даній корисної моделі, рослини виду N. excelsior накопичували рекомбінантний білок у кількості, яку можна зіставити з такою, показаною для виду N. benthamiana, у випадку використання системи з геном під контролем конститутивного промотору. Використання модульної рекомбіназної векторної системи, створеної на основі вірусних векторів (рекомбіназна система) дозволило підвищити середній показник накопичення репортерного білка в порівнянні з тим самим видом (приблизно 60% від сумарних розчинних білків (СРБ) для N. excelsior (Фіг.1, 2) та близько 16% від СРБ для N. benthamiana). Крім того, рослини виду N. excelsior мають великі листки, біомаса яких не менш ніж в чотири рази перевищує масу листків N. benthamiana (Фіг.3). Отже кількість рекомбінантного білка, отриманого з однієї рослини N. excelsior (при використанні будь-якої зі згаданих векторних систем), перевищує таку, отриману з однієї рослини N. benthamiana, причому при використанні рекомбіназної системи кількість цільового білка збільшується приблизно в 20 разів. У даній корисній моделі високий вміст рекомбінантного білка для рослин виду N. e xcelsior досягається при використанні оптимальної стадії розвитку рослини-господаря (а саме, дорослі рослини, які не утворили квітки), та при використанні певних порядків листків (верхні та середні) рослин. Перевагою запропонованої корисної моделі є те, що в рослинах виду N. excelsior може ефективно відбуватись експресія цільового гена, що знаходиться під контролем 35S промотору вірусу мозаїки цвітної капусти (ВМЦК), а також гена у складі рекомбіназної системи. У випадку з рекомбіназною системою експресії білок накопичувався в знаних кількостях, що не менш ніж на порядок перевищували вміст білка при використанні 35S промотору ВМЦК. Хоча даний спосіб підвищення білкової продукції було розроблено для репортерного білка GFP, але потенційно він може бути застосований для отримання будь-якого рекомбінантного білка, ген якого стоїть на місці гена репортерного білка у складі таких самих векторних конструкцій. Експериментальна частина. Рослина виду N. e xcelsior - австралійський представник тютюнів - має хороші біотехнологічні показники (високі рівні транзієнтної експресії трангену на фоні значної біомаси листків), проте її 6 використання для продукції рекомбінантних білків не досить поширене [Nagi N. et al. Construction of plant transformation vectors carrying beet necrotic yellow vein virus coat protein gene (II) - plant transformation, 2005, Biotechnol. & Biotechnol. Eq., V.19, P.39-45], а в якості господаря для транзієнтної експресії білків вона досі не використовувалась. Векторні системи. Для транзієнтного накопичення рекомбінтних білків використовували два типи векторних систем. Генетичні конструкції містили цільові гени та допоміжні елементи, які знаходились між лівою та правою границями Т-ДНК бінарного вектора. Перша містить цільовий ген (синтетичний ген зеленого флуоресцентного білка медузи (Aequorea Victoria)) під контролем сильного конститутивного промотору (35S промотор вірусу мозаїки цвітної капусти (ВМЦК)) та термінатора гена нопалiнсинтази агробактерії. Друга векторна система містить елементи геному вірусу тютюнової мозаїки та вірусу сві тлих жилок турнепсу, які забезпечують реплікацію (РНКзалежна-РНК-полiмераза) та розповсюдження транскрипту цільового гену по сусідніх рослинних клітинах (транспортний білок - "movement protein"). Ця векторна система існує у вигляді двох модулів, які в рослинній клітині об'єднуються в один блок за допомогою сайт-специфічної рекомбінази (третій модуль) [Marillonnet S. et al. In planta engineering of viral RJMA replicons: efficient assembly by recombination of DNA moduls delivered by Agrobacterinm. 2004, PNAS, V.101, No. 18, P.68526857]. Для підсилення транзієнтної експресії введеного гена використовували конструкцію, що містила ген супресора сайленсингу р19 вірусу кущистої карликовості томатів під контролем 35S промотору ВМЦК та термінатора гена октапінсинтази агробактерії. Стерилізація та пророщування насіння. Утримання рослин в умовах теплиці. Насіння рослин 7 видів австралійських тютюнів: N. benthamiana, N. excelsior, N. debneyi, N. exigua, N. maritima, N. simulans, N. cavicola (отримане з колекції Національного банку зародкової плазми світової флори Інституту клітинної біології та генетичної інженерії НАНУ, Київ, Україна) попередньо стерилізували та пророщували в умовах in vitro на твердому поживному середовищі Мураши ге-Скуга (MS) [Murashige Т., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue culture, 1962, Physiol. Plant. V.15, P.473-497] при 25°C та 16-годинному освітленні (3000 люкс) протягом 7-10 днів. Стерилізацію проводили наступним чином: ситечко з насінням занурювали на 45сек. в 70% етанол, спиртовий розчин відмивали протягом 1хв. в стерильній дистильованій воді і переносили в розчин гіпохлориду натрію (1:1) на 2хв.; далі насіння відмивали у 3-х порціях стерильної дистильованої води, просушували на фільтрувальному папері та переносили на чашку Петрі з поживним середовищем. 7 31239 Через 7-10 днів молоді проростки висаджували в ґрунт та утримували в теплиці зі стандартними умовами: температура - 22-26°С, 14-годинний світловий період, освітленість - 30004500 люкс. Нарощування бактерії для ін'єкції. Agrobacterium tumefaciens штам GV3101 вирощували на рідкому середовищі Лурія-Бертані (LB) рН 7,0 [Sambrook J. et al. Molecular cloning: a laboratory manual, 2nd ed., New York: Cold Spring Harbor Laboratory Press, 1989] в поєднанні з відповідними антибіотиками рифампіцин - 50мг/л та карбеніцилін/канаміцин - 50мг/л та додаванням 100мкМ ацетосирингону (в якості індуктора агробактеріальної трансформації), при 25-26°С в інкубаційному шейкері 180-200об./хв. протягом 2024 годин. Підготовка бактерій до інфільтрації та введення агробактеріальної суспензії в рослину. Свіжонарощену культур у агробактерій осаджували центрифугуванням протягом 10-15хв. при 5000g та 26°С. Осаджені бактерії ресуспендували в ін'єкційному буфері [Liu L. et al. Agroinfection as a rapid method for propagating Cowpea mosaic virus-based constructs, 2002, J. of Virological Methods, V.105, P.343-348], що мав рівень рН 5,5 (близький до такого в рослинній клітині) та містив додаткову кількість ацетосирингону: 10мМ MES, рН 5,5, 10мМ MgSO4, 100мкМ ацетосирингону. Бактеріальну суспензію розводили так, що оптична густина OD600 складала приблизно 2.0 оптичних одиниць. Агробактеріальні культури, що несли різні плазмідні вектори однієї експресійної системи, попередньо змішувались у рівних співвідношеннях. До кожної системи додавали бактерії. Що несли вектор з геном білку р19 (супресору сайленсингу генів) в рівній пропорції. Отриману суспензію інкубували при кімнатній температурі протягом 1 години, після чого використовували для ін'єкції рослин. Інфільтрацію оранжерейних рослини проводили за методом Шоба [Schob Н. et al. Silencing of transgenes introduced into leaves by agroinfiltration: a simple, rapid method for investigation sequence requirements for gene silencing, 1997, Моl. Gen. Genet., V.256, P.581-585] з невеликими модифікаціями: лист проколювали наскрізь та вводили суспензію безпосередньо через травмоване місце. В дослідах в листок вводили по 50мкл агробактеріальної суміші. Після проведення інфільтрації рослини повертали в теплицю зі стандартними умовами утримання. Збирання та екстракція білкової фракції. Час збирання досліджуваного рослинного матеріалу залежав від типу векторної системи. Використовуючи систему з геном під контролем 35S промотору ВЦМК, рослинний матеріал збирали на 4-5 добу після ін'єкції. Для рекомбіназної системи збирання матеріалу проводили на 18 добу після інфільтрації. Використання вітального білку GFP дозволило контролювати його накопичення в умовах in planta, тобто безпосередньо в прикріпленому до рослини листку, за допомогою лампи з довгохвильовим 8 ультрафіолетовим спектром (hand-held black ray lamp-UVP, Upland, США). Ділянку, яка світилась зеленим кольором, вирізали, зважували та екстрагували. Екстракцію білкової фракції проводили при +4°С шляхом механічного руйнування клітинних оболонок листка у 500мкл охолодженого 0,05М натрій фосфатного буфера: 50мМ Na2HPO4/NaH2PO4, pH 7,0. Зруйновану тканину осаджували центрифугуванням протягом 5ти-7ти хвилин при 12000g, відбирали супернатант, а до осаду додавали свіжу порцію фосфатного буфера (500мкл) та повторювали процедуру. С упернатант використовували для подальшого аналізу. Вимірювання сумарного розчинного білку за методом Бредфорда. Концентрацію сумарного білка в рослинному екстракті вимірювали за методом Бредфорда [Bradford M.M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein due binding, 1976, Analytical Biochemistry, V.72, P.248-254], використовуючи бичачий сироватковий альбумін ("Merck", Німеччина) як стандарт. Оптичне поглинання суміші реактив-білок вимірювали при 595нм на спектрофотометрі "BioPhotometer" (Eppendorf). Калібровочну криву було побудовано для концентрацій стандарту 10-100мкг/мл. В разі необхідності зразки розводили до концентрацій вказаного діапазону. Вимірювання інтенсивності випромінювання та кількісна оцінка GFP у зразках. Кількісний вміст маркерного білку GFP визначали, вимірюючи інтенсивність його флуоресценції при довжині хвилі збудження 395нм та випромінювання 509нм на флуоресцентному спектрофотометрі Hitachi 850 (Hitachi, Токіо, Японія). Інтерпретація отриманих даних проводилась за допомогою калібровочної кривої, побудованої на основі стандартних розведень GFP (GFP стандарт був люб'язно наданий фірмою Icon Genetics GmbH Halle/Saale, Німеччина). Від флуоресценції дослідних екстрактів віднімали фонову флуоресценцію контрольних екстрактів (екстракти з листків, інфільтрованих бактерією, що містила конструкцію з геном білку р19). Якщо вимагалося, зразки розводили до концентрацій діапазону калібровочного графіку. Ідентичність GFP в екстрактах підтвердили записом спектра флуоресценції. Білковий електрофорез. Електрофоретичне розділення білкових екстрактів проводили в 12% поліакриламідному гелі з додаванням додецилсульфату натрію. Білкові екстракти змішували з 3-кратним буфером для нанесення зразків (30% гліцерол; 150мМ ТрисНСІ, рН 6,8; 0,3% бромфеноловий синій; 300мМ 2меркаптоетанол; 6% додецилсульфат натрію), кип'ятили на водяній бані протягом 5 хвилин та наносили на гель. Електрофорез проводили в трис-гліциновому буфері: 50мМ Трис-НСІ, 200мМ гліцин, 0,15% додецилсульфат натрію. Розділення в стартовому гелі проводили під напругою 150В, при переході білків у розподільчий гель напругу підвищували до 300В. Після завершення 9 31239 електрофорезу гель заливали розчином для фарбування (0,25% Coomassie Brilliant Blue R250 ("Serva"); 45% метанол; 9% льодяна оцтова кислота) та залишали на 4 години на шейкері. Фіксацію білків та відмивання неспецифічнозв'язаної фарби проводили протягом 3-6 годин, змінюючи кілька разів розчин для відмивання: 45мл метанол, 45мл дистильована вода, 10мл льодяна оцтова кислота. З метою безпосередньої візуалізації маркерного білку GFP на гелі екстракт попередньо не кип'ятили, а також виключили стадію фарбування. Наявність GFP визначали за допомогою ручної лампи з довгохвильовим ультрафіолетовим спектром (hand-held black ray lamp - UVP, Upland, США). Статистична обробка даних. Для статистичної обробки даних використовували такі критерії: середнє квадратичне відхилення (для визначення показника варіювання величини) та t-критерій Ст'юдента (для порівняння середніх вибіркових величин). Результати. Серед обраних видів одного роду спостерігали відмінності у рівнях накопичення GFP, крім того один і той самий вид виявляв неоднакові показники при використанні різних експресійних систем. Визначення рівнів експресії рекомбінантного білка при використанні вектору з геном GFP під контролем 35S промотору ВМЦК. Використання даної експресійної системи дозволило задетектувати репортерний білок у всіх досліджених вида х. Проте найбільший вміст GFP спостерігали у видах N. cavicola, N. benthamiana, N. excelsior та N. exigua (6,0±1,51; 3,84±1,31; 3,72±1,72; 3,14±Н,22% GFP від сумарного розчинного білка (СРБ) відповідно). В перерахунку на масу це склало 0,44±0,14; 0,19±0,07; 0,19±0,09; 0,13±0,05мг GFP/г свіжої ваги листа відповідно. Дані показники демонструють перспективність використання в якості господаря для проведення транзієнтної експресії рекомбінантних білків не лише виду N. benthamiana, але й інших представників роду, а саме N. cavicola, N. excelsior та N. e xigua. Застосування методу відбору кращого господаря для одержання бажаного білка може не лише сприяти збільшенню абсолютної кількості білка на грам сирої ваги, але й збільшити відносну кількість рекомбінантного білка, що полегшуватиме процедуру очищення. Для промислового одержання білка важливим показником є також кількість білка, яку можна отримати безпосередньо з окремої рослини. Листки у представників роду Nicotiana характеризуються великою морфологічною різноманітністю. Тому листкова маса кожної окремої рослини може сильно варіювати в залежності від виду. Крім того, лише частина листків (переважно верхні) має високі рівні експресії цільового білка. Серед австралійських видів, що демонстрували найбільший вміст репортерного 10 білка, середні значення листкової біомаси, яка може бути ефективно використана для експресії, в перерахунку на одну рослину така: N. excelsior 14,6±4,61г; N. exigua - 5,3±0,79г; N. cavicola 3,5±0,88г та N. benthamiana - 2,7±0,3г. Отже, з однієї рослини N. excelsior можна отримати біля 2,5мг рекомбінантного білка, з рослини N. cavicola - 1,5мг; N. exigua - 0,7мг та N. benthamiana - 0,5мг. Таким чином, у виді N. excelsior відсоток рекомбінантного білка від СРБ не менше ніж для N. benthamiana (різниця статистичне не достовірна), а використання цілої рослини дозволяє підвищити загальну кількість цільового білка в порівнянні з цим же видом. Визначення рівнів експресії рекомбінантного білка при використанні гена GFP у складі рекомбіназної векторної системи. Інші результати були отримані при введені в рослину модульної рекомбіназної векторної системи. Система базується на формуванні функціональних вірусних векторів в умовах in planta з окремих про-векторних модулів. Така система показала значну варіабельність в залежності від обраного об'єкту. Для видів N. excelsior та N. benthamiana рекомбіназна система значно підвищила рівні GFP: 63,49±27,35% та 16,2±12,75% від СРБ відповідно, в порівнянні з системою, де ген знаходився під контролем 35S промотору ВЦМК. Вид N. cavicola збільшив вміст рекомбінантного білку до 12,6±6,5% СРБ, вид N. simulans - до 5±2,9% СРБ, вид N. Exigua зменшив відсоток до 0,5±0,17% СРБ, в інших видах GFP не задетектували (інтенсивність флуоресценції дослідної групи не перевищувала фонову флуоресценцію контролю). Необхідно відмітити, що одним із наслідків використання рекомбіназної системи, що характеризується більш пролонгованим часом накопичення бажаного продукту, є зниження загального рівня розчинних клітинних білків, що може бути пов'язано зі зниженням білоксинтетичної активності старіючого протягом періоду проведення експерименту листка [Halfhill M.D. et al. Spatial and temporal patterns of green fluorescent protein (GFP) fluorescence during leaf canopy development in transgenic oilseed rape, Brassica napus L., 2003, Plant Cell Reproduction, No.22, P.338-343]. В даному випадку цінність використання рекомбіназної системи полягає не лише у збільшені продукції цільового білка у деяких видів, але й в зменшенні кількості власних рослинних білків, оскільки це полегшуватиме процедуру очищення кінцевого продукту. Для рослин, що мали найвищий рівень транзієнтної експресії при використанні модульної векторної системи, розрахували можливий вихід кінцевого продукту на одиницю сирої ваги та в перерахунку на одну рослину. Для рослини виду N. excelsior середнє значення кількості рекомбінантного білка склало 1,5мг GFP/г свіжої ваги листа, що в перерахунку на рослину складатиме біля 21,5мг рекомбінантного білка; для рослини N. benthamiana кількість білка - 0,4м г GFP/г свіжої ваги листа, в перерахунку на рослину 11 31239 - 1мг рекомбінантного білка; для рослини N. cavicola кількість білка - 0,5мг GFP/г свіжої ваги листа, в перерахунку на рослину - 1,7мг рекомбінантного білка. Отже, рослини виду N. e xcelsior для даної експресійної системи мають не лише найвищий відсоток накопичення GFP, але й значно вищий вихід бажаного продукту в перерахунку на одну рослину. В поєднанні з наведеними вище даними про перспективність даного виду для отримання рекомбінантного білка при використанні векторів з геном під контролем конститутивного 35S промотору ВМЦК, продукція білків шляхом транзієнтної експресії може бути підвищена, якщо замість виду Х benthamiana використати вид N. excelsior. Недоліком нового методу є сильне варіювання відсотку маркерного білка по відношенню до СРВ, особливо для рекомбіназної векторної системи. Оптимальна стадія розвитку при проведенні транзієнтної експресії в перспективному господарі Nicotiana excelsior. Протягом життєвого циклу в рослині відбуваються зміни, пов'язані з її проростанням, ростом, закладанням генеративних органів, продукцією насіння та смертю. В цей час метаболічні реакції в одних клітинах знижуються, в інших залишаються постійними або підсилюються. Такі фізіологічні зміни в клітині, тканині або самій рослині можуть мати суттєвий вплив не лише на експресію власних білків, але й на експресію рекомбінантних білків, що вже показано деякими авторами [наприклад, Wroblewski Т. et al. Optimization of Agrobacterium-mediated transient assays of gene expression in lettuce, tomato and Arabidopsis, 2005, Plant Biotechnology J, V.3, P.259273]. Для рослин виду N. e xcelsior перевірена експресія трансгену під час проходження 2 стадій розвитку: дорослі рослини перед цвітінням та рослини, які активно квітнуть., використовуючи в якості модельної рекомбіназну векторну систему. На противагу 63,5±27,35% GFP від сумарних розчинних білків, отриманих з рослин перед цвітінням; рослини, які вже мали квітки, накопичували лише 1,41±0,98% GFP від СРБ. Результати вказують на те, що кращою стадією розвитку для накопичення рекомбінантного білка є стадія дорослих рослин перед цвітінням; рослини, які вже квітнуть, різко знижують рівень максимального накопичення бажаного продукту. Тому підбір оптимальної стадії розвитку рослини також може підвищити рівень рекомбінантних білків. Порівняння продукції білків в листках різного порядку при транзієнтній експресії в перспективному господарі Nicotiana excelsior. Частковою проекцією стадії розвитку рослини є вік її окремих листків, інакше кажучи стадія розвитку тканини листка. Навіть в межах однієї рослини фізіологічна активність молодих листків сильно відрізняється від такої у старих. Для стабільних трансформантів тютюн у вже показано, 12 що вміст рекомбінантного IgG, як і ендогених білків, сильно зменшується протягом розвитку листка [Stevens L.H. et al. Effect of climate condition and plant developmental stage on the stability of antibodies expressed in transgenic tobacco, 2000, Plant Physiology, V.124, P.173-182]. В літературі також висловлювались припущення, що порядок листка або його фізіологічний статус можуть впливати на Agrobacterium-опосередковану транзієнтну експресію [Li J. et al. Transient expression of an active human interteron-beta in lettuce, 2007, Scientia Horticulure, V.112, P.258-265]. Отриманні результати підтвердили, що існувала залежність між кількістю репортерного білка (вираженого у відсотках від загальної кількості розчинних білків) та порядком листка, в якому відбувалась експресія гену GFP, що знаходився під контролем 35S промотору ВМЦК. Для даної експресійної системи високі рівні GFP від 2,1 до 4,5% спостерігали у 2му-4му листках від апексу. Листки, що розташовані нижче, послаблювали експресію GFP в перерахунку до загального розчинного білку. Відносно невисокий рівень маркерного білку 1,4% отримали також в першому листку. Накопиченню білку в 1му листку, який ще не повністю розкрився, швидше за все перешкоджало нерівномірне потрапляння агробактеріальної суспензії в листкову пластинку внаслідок недостатньо розвинених міжклітинників. Аналогічні дані наводять й інші автори, вказуючи на послаблення трнзієнтної експресії у старих листках та низькі рівні експресії в молодих листках, які ще не достатньо розкрилися; високі рівні експресії спостерігали в перших справжніх листках різних рослин [наприклад, Zhou F. et al. Efficient transient expression of human GM-CSF protein in Nicotiana benthamiana using potato virus X vector, 2006, Applied Microbiology and Biotechnology, V.72, No.4, P.756-762]. Зафіксоване зменшення рекомбінантного білка в нижніх (старших) листках є не лише наслідком зниження експресії введеного гену, але й послабленням загальної білок-синтетичної активності в клітинах, в результаті зміни фізіологічної активності старіючих листків. При використанні рекомбіназної векторної системи, що транзієнтно накопичує бажаний білок протягом 15-18 діб, рослина встигає сформувати від одного до трьох молодих листків. Отже, експресія в двох нижніх листках де що зменшується, оскільки за такий період вони старіють. Але як і у попередньому випадку, найбільші рівні рекомбінантного білка для наведеної системи спостерігали у 2му-4му листках від апекса (на момент проведення інфільтраційної процедури). Загалом, для експресії рекомбінантного білка в рослинах N. excelsior найбільш прийнятними виявились 2ий-4ий листки від апікальної точки росту. 13 31239 14
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation recombinant protein by means of transient expression of transgene in plant of species nicotiana excelsior
Автори англійськоюSindarovska Yana Rudolfivna, Sheludko Yurii Vsevolodovych, Herasymenko Iryna Mykhailivna, Kuchuk Mykola Viktorovych
Назва патенту російськоюСпособ получения рекомбинантного белка путем транзиентной экспрессии трансгена в растении вида nicotiana excelsior
Автори російськоюСиндаровская Яна Рудольфовна, Шелудько Юрий Всеволодович, Герасименко Ирина Михайловна, Кучук Николай Викторович
МПК / Мітки
МПК: C07K 14/00, C12P 21/00, C12N 15/63, C12N 15/84, A01H 5/12, A01H 5/00
Мітки: excelsior, одержання, білка, спосіб, рекомбінантного, рослини, шляхом, виду, транзієнтної, експресії, nicotiana, трансгену
Код посилання
<a href="https://ua.patents.su/7-31239-sposib-oderzhannya-rekombinantnogo-bilka-shlyakhom-tranziehntno-ekspresi-transgenu-v-roslini-vidu-nicotiana-excelsior.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання рекомбінантного білка шляхом транзієнтної експресії трансгену в рослині виду nicotiana excelsior</a>
Попередній патент: Спосіб відновлення психофізіологічного стану пацієнта
Наступний патент: Спосіб контролю стану мастила у картері двигуна внутрішнього згоряння
Випадковий патент: Тістомісильна машина безперервної дії