Стабільна поліморфна модифікація флібансерину, спосіб її промислового одержання та її застосування для одержання лікарських засобів
Номер патенту: 76767
Опубліковано: 15.09.2006
Автори: Бомбарда Карло, Ежая Антоіне, Дубіні Енріка, ШНАЙДЕР Хайнріх
Формула / Реферат
1. Кристалічна поліморфна модифікація А (форма А) флібансерину формули 1
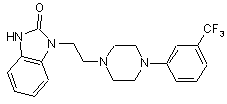 1,
1,
у якої ендотермічний максимум при її термічному аналізі диференціальною сканувальною калориметрією припадає на температуру 161°С.
2. Флібансерин формули 1 у формі А за п. 1.
3. Спосіб промислового одержання флібансерину формули 1 за п. 1 або п. 2

який відрізняється тим, що на першій стадії бензимідазолон формули 2
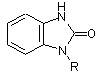 , 2
, 2
у якій R означає прийнятну амінозахисну групу, піддають у прийнятному розчиннику, вибраному з групи, яка включає воду, спирти, суміші води зі спиртами, полярні апротонні розчинники і їх суміші з водою, у присутності прийнятної основи взаємодії з піперазином формули 3
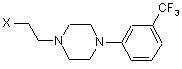 , 3
, 3
у якій X означає групу, яка вилучається, вибрану з хлору, брому, йоду, метансульфонату, трифторметансульфонату і пара-толуолсульфонату, і на другій стадії видаляють амінозахисну групу R у прийнятних для такого видалення умовах.
4. Спосіб за п. 3, який відрізняється тим, що взаємодію сполуки формули 2 із сполукою формули 3 проводять при температурі, яка становить принаймні 50°С.
5. Спосіб за п. 4, який відрізняється тим, що нагріту до необхідної температури реакційну суміш витримують при цій температурі протягом проміжку часу, який становить приблизно від 10 хв до приблизно 12 год.
6. Поліморфна модифікація А флібансерину формули 1, яка одержується способом за будь-яким з пп. 3-5.
7. Поліморфна модифікація А флібансерину формули 1 за пп. 1, 2 або 6 для застосування як лікарського засобу.
8. Застосування поліморфної модифікації А флібансерину формули 1 за пп. 1, 2 або 6 для одержання лікарського засобу, призначеного для лікування захворювань, при яких застосування сполук, які мають спорідненість до 5-НТ1А- і 5-НТ2-рецепторів, у терапевтично ефективних кількостях має ефективну терапевтичну дію.
9. Застосування поліморфної модифікації А флібансерину формули 1 за пп. 1, 2 або 6 для одержання лікарського засобу, призначеного для лікування захворювань, вибраних із групи, яка включає депресію, шизофренію, хворобу Паркінсона, стани тривоги, порушення сну, сексуальні і психічні розлади і вікові порушення пам'яті.
10. Фармацевтична композиція, яка містить як діючу речовину поліморфну модифікацію А флібансерину формули 1 за пп. 1, 2 або 6, необов'язково в суміші з одним або декількома фармацевтичними носіями, розріджувачами або ексципієнтами.
Текст
1. Кристалічна поліморфна модифікація А (форма А) флібансерину формули 1 2 3 Даний винахід стосується поліморфної модифікації А флібансерину, способу її промислового одержання, а також її застосування для одержання лікарських засобів. Передумови створення винаходу. Сполука 1-[2-(4-(3трифторметилфеніл)піперазин-1-іл)етил]-2,3дигідро-1Н-бензимідазол-2-он (флібансерин) описана у формі її гідрохлориду [в заявці ЕР-А 526434] і має таку хімічну структуру Флібансерин виявляє спорідненість (афінність) до 5-НТ1А- і 5-НТ2-рецепторів. З урахуванням цього така сполука є перспективним терапевтичним агентом, який може використовуватися для лікування різних захворювань, наприклад депресії, шизофренії, хвороби Паркінсона, станів тривоги, порушень сну, сексуальних та психічних розладів, а також вікових порушень пам'яті. Очевидно, що основною попередньою умовою, дотримання якої служить необхідною передумовою для початку комерційного виробництва фармацевтичної діючої речовини і її надходження в продаж як апробованого лікарського засобу, є точне визначення її фармацевтичної активності. Однак до фармацевтичної діючої речовини пред'являється й багато різних інших вимог. Подібні вимоги, яким повинна відповідати фармацевтична діюча речовина, засновані на різних параметрах, пов'язаних із природою самої діючої речовини. Як приклад таких параметрів можна назвати, але не обмежуючись тільки ними, стабільність діючої речовини в різних навколишніх умовах, її стабільність у процесі приготування лікарського засобу, а також її стабільність у кінцевих лікарських препаратах. Фармацевтична діюча речовина, яка використовується для одержання фармацевтичних препаратів або композицій, повинна мати максимально можливий ступінь чистоти, а також повинна залишатися стабільною при її тривалому зберіганні в різних навколишніх умовах. Обов'язкове дотримання цієї вимоги зумовлено необхідністю виключити застосування лікарських препаратів, у яких разом із власне діючою речовиною присутні, наприклад, продукти її розкладу. У цих випадках лікарський препарат може містити діючу речовину в кількості, яка менша за вказану виробником. Важливе значення має також рівномірний розподіл діючої речовини в лікарській композиції і, зокрема, при необхідності її введення в низькому дозуванні. Забезпечити рівномірний розподіл діючої речовини в лікарській композиції можна за рахунок зменшення величини її частинок до прийнятного рівня, наприклад подрібненням. Оскільки при одержанні лікарського препарату слід по можливості практично повністю виключити розкладання фармацевтичної діючої речовини, яке супроводжує її подрібнення (або мікронізацію), незважаючи на наявність жорстких умов, необхідних для проведення цього процесу, обов'язковою вимогою, якій повинна відповідати діюча речовина, є її висо 76767 4 ка стабільність у процесі подрібнення. Одержання гомогенної фармацевтичної композиції з постійно відтворюваним заданим вмістом у ній діючої речовини можливо тільки при досить високій її стабільності в процесі її подрібнення. Інша проблема, яка може виникати в процесі подрібнення діючої речовини при одержанні необхідної фармацевтичної композиції, пов'язана із підведенням енергії до кристалів, що супроводжує подібний процес, і з прикладенням до їх поверхні механічного навантаження. За певних умов вказані фактори можуть приводити до поліморфних змін, до перетворення кристалічної структури в аморфну або до зміни кристалічних ґрат. Оскільки для одержання фармацевтичної композиції потрібної фармацевтичної якості необхідно забезпечити наявність у кристалів діючої речовини завжди однієї і тієї ж морфології, до стабільності і властивостей кристалічної діючої речовини з урахуванням цього аспекту також пред'являються підвищені вимоги. Стабільність фармацевтичної діючої речовини у фармацевтичних композиціях має також важливе значення для встановлення терміну придатності конкретного лікарського засобу, який визначається як проміжок часу, протягом якого лікарський засіб можна без якого-небудь ризику вводити в організм. З цієї причини наявність у діючої речовини, яка входить до складу вказаних лікарських засобів, високої стабільності при різних умовах зберігання є ще однією перевагою і для пацієнта, і для виробника. Крім розглянутих вище вимог, які пред'являються до фармацевтичних діючих речовинах, загалом слід враховувати і той факт, що будь-яка зміна твердофазного стану фармацевтичної композиції, яка дозволяє поліпшити її фізичну і хімічну стабільність, забезпечує досягнення істотних переваг перед формами того ж самого лікарського засобу, які мають меншу стабільність. Виходячи з вищевикладеного, в основу даного винаходу була покладена задача одержати нову стабільну кристалічну форму флібансерину, яка задовольняла б вказаним вище строгим вимогам, які пред'являються до фармацевтичних діючих речовин. При створенні винаходу несподівано було встановлено, що флібансерин у вигляді вільної основи у певній поліморфній модифікації задовольняє вказаним вище вимогам. При створенні винаходу було встановлено також, що залежно від вибору умов, які можна використовувати в процесі синтезу флібансерину, він утворюється у вигляді вільної основи в різних кристалічних модифікаціях, а саме, у поліморфних модифікаціях А і В. Так, зокрема, було встановлено, що можливість цілеспрямованого одержання подібних різних модифікацій визначається відповідним вибором технологічних умов проведення процесу синтезу флібансерину. Крім цього несподівано було встановлено, що поліморфна модифікація А, яку можна одержувати в кристалічній формі за рахунок вибору особливих умов проведення реакції, задовольняє вказаним 5 76767 6 вище строгим вимогам і тим самим дозволяє видля проведення реакції можна використовувати рішити покладену в основу винаходу задачу. Відводу, спирти, суміші води зі спиртами, а також поповідно до цього в даному винаході пропонується лярні апротонні розчинники і їх суміші з водою. поліморфна модифікація А флібансерину. ТемпеПереважними для проведення реакції розчинниратура плавлення цієї поліморфної модифікації А ками є диметилформамід, диметилсульфоксид, флібансерину становить близько 161°С (при виацетонітрил, тетрагідрофуран, діоксан, метанол, значенні за допомогою диференціальної скануваетанол, ізопропанол і суміші одного або декількох льної калориметрії (ДСК) при швидкості нагрівання вказаних розчинників з водою. Найбільш переваж10К/хв.). но використовувати розчинники, які добре змішуПоліморфна модифікація В є менш стабільною ються з водою. Переважно при цьому використомодифікацією флібансерину з температурою плавувати як розчинник суміш води з одним з таких влення близько 120°С (при визначенні за допомоспиртів, як метанол, етанол або ізопропанол. У гою ДСК при швидкості нагрівання 10К/хв.). На переважному варіанті як розчинник використовувідміну від поліморфної модифікації В, яка виявють суміш води і ізопропанолу. Як основу можна ляє меншу стабільність під впливом, наприклад, використовувати карбонати лужних або лужноземеханічного навантаження в процесі подрібнення, мельних металів, таких як літій, натрій, калій і каполіморфна модифікація А відповідає вищезгадальцій, тобто карбонат натрію, карбонат літію, карним вимогам до стабільності фармацевтичної діюбонат калію і карбонат кальцію, переважним з яких чої речовини. є карбонат калію. Крім цього як основу можна таЩе одним об'єктом даного винаходу є спосіб кож використовувати гідрокарбонати літію, натрію і одержання поліморфної модифікації А флібансекалію. В іншому переважному варіанті можна тарину в промисловому масштабі. Цей запропоновакож використовувати гідроксиди лужних або лужний у винаході спосіб проілюстрований на схемі 1. ноземельних металів, таких як літій, натрій, калій, магній і кальцій, при цьому більш переважно використовувати розчини гідроксиду натрію, гідроксиду калію, гідроксиду літію і гідроксиду кальцію в спиртах або у воді. Найбільш переважною основою є гідроксид натрію. Основу переважно додавати до реакційної суміші у вигляді її водного розчину, переважно у вигляді її концентрованих водних розчинів, наприклад при концентрації від 30 до 50% у відношенні маси до об'єму. У переважному варіанті використовують водний розчин гідроксиду наВідповідно до цієї схеми бензимідазолон фортрію з концентрацією приблизно 45% у відношенні мули 2 піддають у лужних реакційних умовах у маси до об'єму. прийнятному розчиннику взаємодії з похідним піСполуки формул 2 і 3 піддають взаємодії між перазину формули 3 з одержанням сполуки форсобою з молярному співвідношенні від 1:1 до 1:2, мули 1. Група R у сполуці формули 2 означає аміпереважно від 1:1,1 до 1:1,5. Як вказано вище, нозахисну групу. Такою захисною групою може переважною для проведення реакції відповідно до служити будь-яка з груп, які звичайно використозапропонованого у винаході способу сумішшю ровуються для захисту функціональної аміногрупи. зчинників є суміш води і ізопропанолу. У такій суЯк приклад подібних захисних груп можна назвати міші масове співвідношення між водою і ізопропаалкіл, заміщений алкіл, гетерозаміщений алкіл, нолом переважно становить від 10:1 до 1:1, більш ненасичений алкіл, алкілзаміщені гетероатоми, переважно від 8:1 до 3:1, найбільш переважно від заміщений або незаміщений феніл, заміщений або 7:1 до 5:1. На моль сполуки формули 2 вищевканезаміщений бензил, а також алкоксикарбонільні й зану суміш розчинників використовують у кількості арилоксикарбонільні групи. Переважними захисприблизно від 2 до 10кг, переважно від 3 до 8кг, ними групами є бутил, 1,1-дифенілметил, метокнайбільш переважно від 4 до 7кг. У переважному симетил, бензил оксиметил, трихлоретоксиметил, варіанті реакцію проводять з використанням як піролідинометил, ціанометил, півалоїлоксиметил, основи водного розчину гідроксиду натрію з коналіл, 2-пропеніл, трет-бутилдиметилсиліл, метокцентрацією приблизно 45% у відношенні маси до сигрупу, тіометил, 4-метоксифеніл, бензил, 4об'єму. На моль сполуки формули 2 такий розчин метоксибензил, 2,4-диметоксибензил, 2гідроксиду натрію використовують у кількості принітробензил, трет-бутоксикарбоніл, бензилоксикаблизно від 0,1 до 1,5кг, переважно від 0,2 до 1,0кг, рбоніл, феноксикарбоніл, 4-хлорфеноксикарбоніл, найбільш переважно від 0,3 до 0,6кг. Реакційну 4-нітрофеноксикарбоніл, метоксикарбоніл і етоксисуміш, яка складається зі сполук формул 2, 3 і оскарбоніл. Серед цих захисних груп найбільш перенови, розчинених у прийнятному розчиннику з певажними є трет-бутоксикарбоніл, етоксикарбоніл, реліку вказаних вище, переважно нагрівають до метоксикарбоніл, бензилоксикарбоніл, феноксикатемператури принаймні 50°С. У переважному варбоніл і 2-пропеніл, при цьому остання з вказаних ріанті реакцію проводять в інтервалі температур груп є найбільш переважною. X у сполуці формули від 60°С до температури кипіння використовувано3 означає групу, яка вилучається, вибрану з хлору, го розчинника. Найбільш переважно проводити брому, йоду, метансульфонату, трифторметансуреакцію в інтервалі температур від 70 до 90°С. льфонату і пара-толуолсульфонату. Переважно X Реакційну суміш витримують при вказаній темпеявляє собою хлор, бром або йод, з яких хлор є ратурі протягом проміжку часу, який становить від найбільш переважним. Як відповідні розчинники приблизно 10хв. до приблизно 12год., переважно 7 76767 8 від приблизно 15хв. до приблизно 6год., більш до 250 г, переважно від приблизно 100 до 200г, на переважно від приблизно 30хв. до приблизно 3год. моль сполуки формули 2), а потім знову промиваНайбільш переважна тривалість витримування ють водою до повного видалення хлоридів. Отриреакційної суміші при вищевказаній температурі маний таким шляхом продукт при необхідності становить приблизно від 45 до 60хв. можна піддавати додатковому очищенню. ПереНа наступній стадії видаляють захисну групу важно таке очищення проводити шляхом кристаліR. Умови видалення захисної групи залежать від зації сполуки формули 1, наприклад з ацетону. вибору групи R. Так, наприклад, якщо R означає Ще одним об'єктом даного винаходу є полібензил, то таку захисну групу видаляють гідруванморфна модифікація А флібансерину, яка одержуням в оцтовій кислоті в присутності прийнятного ється описаним вище способом. каталізатора (наприклад Pd на вугіллі) або ж її Нижче спосіб одержання поліморфної модифівидаляють обробкою водною НВr. У тому ж випадкації А флібансерину проілюстрований на прикладі ку, якщо R означає метоксикарбоніл, етоксикарбоїї синтезу. Слід, однак, відзначити, що в цьому ніл, феноксикарбоніл або 4-нітрофеноксикарбоніл, прикладі розглянутий тільки один з можливих ватаку захисну групу можна видаляти, наприклад, ріантів здійснення винаходу, який не обмежує його обробкою водними розчинами лугів, такими як обсягу. (водний) розчин NaOH або (водний) розчин КОН. Приклад Якщо ж R означає трет-бутоксикарбоніл, то його У реактор, який містить 2500кг води і 200кг можна видаляти, наприклад, у водній НСl або НВr. 45%-ного водного гідроксиду натрію, завантажуЯкщо R означає 2-пропеніл, який є переважною ють 375кг 1-[(3-трифторметил)феніл]-4-(2захисною групою, то в цьому випадку його видахлоретил)піперазину. Потім при перемішуванні ляють у кислому реакційному середовищі. У найдодають 169,2кг 1-(2-пропеніл)-1,3більш переважному варіанті 2-пропенільну групу дигідробензимідазол-2Н-ону, 780кг ізопропанолу, видаляють обробкою сильною мінеральною кис2000кг води і 220кг 45%-ного водного гідроксиду лотою, переважно кислотою, вибраною з групи, натрію. Реакційну суміш нагрівають до 75-85°С і яка включає бромистоводневу кислоту, хлористододають 160кг концентрованої соляної кислоти і водневу кислоту і сірчану кислоту, більш переваж200кг води. Реакційну суміш перемішують при посно обробкою хлористоводневою кислотою. Хлоритійній температурі протягом приблизно 45хв. Осад, стоводневу кислоту можна додавати до реакційної отриманий після відгону суміші води і ізопропаносуміші в газоподібному вигляді або ж у вигляді її лу (близько 3000кг), охолоджують до температури водних розчинів, при цьому її додавання у вигляді приблизно 65-75°С і його значення рН встановлюводних розчинів є переважним. Хлористоводневу ють на 6,5-7,5 додаванням 125кг 45%-ного водного кислоту особливо переважно додавати у вигляді її гідроксиду натрію. Після охолодження залишку до концентрованого розчину (приблизно 36%-ного у температури приблизно 45-50°С його значення рН відношенні маси до об'єму). На моль сполуки фовстановлюють на 8-9 додаванням приблизно 4кг рмули 2 слід додавати принаймні один моль хло45%-ного водного гідроксиду натрію. Потім реакристоводневої кислоти. Кількість концентрованої ційну суміш охолоджують до 30-35°С і центрифухлористоводневої кислоти, яка додається до реакгують. Отриманий у результаті залишок промиваційної суміші, (36%-ної у відношенні маси до об'єють 340л води і 126л ізопропанолу, а потім водою му) переважно становить від 50 до 500г, більш до повного видалення хлоридів. Вологий продукт переважно від 80 до 250г, на моль сполуки форсушать у вакуумі при 45-55°С, одержуючи 358кг мули 2. На моль використовуваної сполуки форсирого флібансерину у вигляді його поліморфної мули 2 найбільш переважно додавати приблизно модифікації А. Отриманий таким шляхом сирий від 120 до 160г концентрованої водної хлористопродукт завантажують у реактор, який містить водневої кислоти (36%-ної у відношенні маси до 1750кг ацетону, і отриману суміш при перемішуоб'єму). При необхідності до реакційної суміші мованні нагрівають із зворотним холодильником. жна додавати додаткову кількість води. Після заПотім отриманий розчин фільтрують і фільтрат вершення реакції приблизно від 30 до 70%, переконцентрують перегонкою. Далі протягом прибливажно від 35 до 60%, розчинника видаляють зно 1 год температуру підтримують на рівні 0-5°С, шляхом його відгону при температурі приблизно після чого тверду речовину, яка випала в осад, від 70 до 90°С. Потім значення рН залишку додавідокремлюють фільтрацією і сушать при 55°С ванням водного гідроксиду натрію (45%-ного у протягом принаймні 12год. Остаточний вихід чисвідношенні маси до об'єму) встановлюють при того флібансерину в поліморфній модифікації А температурі від 60 до 80°С приблизно на 5-9, пестановить 280кг. реважно приблизно на 6-8. Після цього значення Характеристики описаної вище поліморфної рН додаванням водного гідроксиду натрію (45%модифікації А флібансерину визначали за допомоного у відношенні маси до об'єму) встановлюють гою ДСК (диференціальна сканувальна калоримепри температурі приблизно від 40 до 55°С приблитрія). За даними ДСК-аналізу ендотермічний макзно на 8-9. Потім реакційну суміш охолоджують до симум для поліморфної модифікації А температури приблизно 20-40°С, переважно прибфлібансерину припадає на температуру приблизлизно 30-35°С, і центрифугують. Отриманий у рено 161°С. Для визначення характеристик полізультаті залишок промивають водою в кількості морфної модифікації А флібансерину за допомоприблизно від 100 до 750мл, переважно від 200 до гою ДСК використовували систему Mettler ТА 3000, 500мл, найбільш переважно від приблизно 300 до обладнану процесором ТС 10-А і коміркою DSC 400мл, на моль використовуваної сполуки форму20. Дані одержували при швидкості нагрівання ли 2 і ізопропанолом (у кількості приблизно від 50 10К/хв. 9 76767 10 Характеристики поліморфної модифікації А генограму поліморфної модифікації А одержували флібансерину визначали також рентгенівською з використанням наступних умов. порошковою дифрактометрією. Порошкову рентУстаткування Встановлювальні параметри Генератор: дифрактометр Philips PW 1800/10, обладнаний цифровим MicroVax 2000 Рентгенівське випромінювання: тип трубки: Сu (довге гостре фокусування) довжини хвиль ( ): K 1=1,54060 Å K 2=1,54439 Å співвідношення інтенсивностей ( 2/ 1):0,500 початковий кут [°2 ]: 2,000 кінцевий кут [°2 ]: 60,000 крок сканування [°2 ]: 0,020 максимальна інтенсивність [с]: 7310,250 режим сканування: безперервний мінімальна ширина піка біля вершини: 0,00 максимальна ширина піка біля вершини: 1,00 базова ширина піка: 2,00 мінімальна значущість: 0,75 кількість піків: 69 висока напруга: 50кВ сила струму на трубці: 30мА комп'ютером Порошкова рентгенограма, отримана для поліморфної модифікації А, представлена на доданому до опису кресленні. Значення, які відповідають цій рентгенограмі, наведені нижче в таблиці 1. Таблиця 1 Кут [°2 ] 5,195 9,045 9,335 10,025 10,595 11,290 13,225 14,595 15,460 16,655 17,085 17,285 17,420 18,140 18,650 19,140 19,820 20,080 20,385 21,215 21,890 22,630 23,210 24,355 24,610 24,995 25,260 26,575 27,155 27,310 27,865 28,210 28,325 28,650 29,520 30,250 31,105 31,905 Значення d Значення d Ширина піка 1 [Å] 2 [Å] [°2 ] 16,9967 17,0390 0,960 9,7689 9,7931 0,100 9,4660 9,4896 0,080 8,8160 8,8379 0,140 8,3430 8,3637 0,140 7,8309 7,8503 0,140 6,6891 6,7058 0,180 6,0642 6,0793 0,180 5,7268 5,7410 0,140 5,3185 5,3317 0,200 5,1856 5,1985 0,100 5,1260 5,1388 0,060 5,0866 5,0992 0,100 4,8863 4,8984 0,180 4,7538 4,7656 0,120 4,6332 4,6447 0,140 4,4757 4,4869 0,160 4,4184 4,4294 0,140 4,3530 4,3638 0,160 4,1845 4,1949 0,160 4,0570 4,0670 0,200 3,9259 3,9357 0,280 3,8291 3,8386 0,120 3,6516 3,6607 0,060 3,6144 3,6234 0,140 3,5596 3,5684 0,100 3,5228 3,5316 0,120 3,3514 3,3597 0,240 3,2811 3,2893 0,140 3,2629 3,2710 0,100 3,1991 3,2071 0,120 3,1608 3,1686 0,100 3,1482 3,1560 0,140 3,1132 3,1210 0,180 3,0234 3,0309 0,220 2,9521 2,9594 0,120 2,8729 2,8800 0,360 2,8026 2,8096 0,100 Інтенс-ть піка [к-сть імпульсів] 8 92 114 400 204 467 548 404 4186 515 1347 1399 1204 1043 1063 7310 3624 5402 2652 369 773 4277 484 2725 3540 529 557 2421 676 767 420 1467 1789 1204 1011 159 282 339 Інтенс-ть фону [к-сть імпульсів] 69 96 98 100 102 104 112 121 125 130 132 135 135 139 142 144 146 149 149 154 156 161 164 169 172 174 174 182 185 185 188 190 190 190 196 199 204 207 Відносна інтенс-ть [%] 0,1 1,3 1,6 5,5 2,8 6,4 7,5 5,5 57,3 7,0 18,4 19,1 16,5 14,3 14,5 100,0 49,6 73,9 36,3 5,0 10,6 58,5 6,6 37,3 48,4 7,2 7,6 33,1 9,2 10,5 5,7 20,1 24,5 16,5 13,8 2,2 3,9 4,6 Значущість 1,05 0,97 0,88 7,18 3,46 6,91 13,10 9,17 23,20 12,38 2,78 2,26 4,71 13,14 0,91 32,77 9,02 21,06 23,25 5,78 3,09 74,66 3,33 1,16 17,08 1,01 3,02 42,58 1,32 2,75 1,08 0,79 4,41 11,65 15,74 1,22 8,14 0,96 11 76767 12 Продовження таблиці 1 32,350 33,300 33,640 34,880 35,275 36,055 36,910 37,160 37,680 39,435 39,675 40,325 40,930 41,445 41,990 42,670 43,145 44,190 46,095 46,510 48,305 48,900 50,330 51,035 53,550 54,500 55,420 56,220 56,770 57,405 58,500 2,7651 2,6884 2,6620 2,5701 2,5422 2,4890 2,4333 2,4175 2,3853 2,2831 2,2698 2,2347 2,2031 2,1769 2,1499 2,1172 2,0950 2,0478 1,9675 1,9509 1,8826 1,8610 1,8115 1,7881 1,7099 1,6823 1,6565 1,6348 1,6203 1,6039 1,5764 2,7720 2,6950 2,6686 2,5765 2,5486 2,4952 2,4393 2,4235 2,3912 2,2888 2,2755 2,2403 2,2086 2,1823 2,1552 2,1225 2,1002 2,0529 1,9724 1,9558 1,8872 1,8657 1,8160 1,7925 1,7141 1,6865 1,6606 1,6389 1,6243 1,6079 1,5804 0,120 0,180 0,100 0,200 0,240 0,280 0,320 0,120 0,240 0,280 0,080 0,160 0,120 0,240 0,120 0,160 0,120 0,160 0,160 0,240 0,200 0,240 0,160 0,080 0,480 0,400 0,320 0,320 0,240 0,240 0,240 З урахуванням фармацевтичної ефективності флібансерину ще одним об'єктом даного винаходу є застосування поліморфної модифікації А флібансерину як лікарського засобу. Наступним об'єктом даного винаходу є застосування поліморфної модифікації А флібансерину для одержання фармацевтичної композиції, призначеної для лікування захворювань, при яких застосування сполук, які мають спорідненість до 5НТ1А- і 5-НТ2-рецепторів, може мати ефективну терапевтичну дію. Ще одним об'єктом даного винаходу є застосування поліморфної модифікації А флібансерину для одержання фармацевтичної композиції, призначеної для лікування захворювань, вибраних із групи, яка включає депресію, шизофренію, хворобу Паркінсона, стани тривоги, порушення сну, сексуальні і психічні розлади, а також вікові порушення пам'яті. Даний винахід стосується, зокрема, застосування поліморфної модифікації А флібансерину для одержання лікарського засобу, призначеного для лікування розладів статевого потягу. У переважному варіанті даний винахід стосується застосування поліморфної модифікації А флібансерину для одержання лікарського засобу, призначеного для лікування порушень і розладів, вибраних із групи, яка включає гіпоактивний статевий потяг, втрату статевого потягу, відсутність статевого потягу, зниження статевого потягу, пригнічення статевого потягу, втрату лібідо, порушення лібідо і фригідність. Найбільш переважним є відповідно до вина 237 1347 404 202 299 202 169 216 240 449 396 520 480 372 538 428 433 376 279 310 506 615 437 416 177 130 130 121 142 112 67 210 216 216 222 225 228 234 234 237 246 246 250 253 256 259 262 266 269 279 282 292 296 303 306 317 324 328 331 335 339 342 3,2 18,4 5,5 2,8 4,1 2,8 2,3 3,0 3,3 6,1 5,4 7,1 6,6 5,1 7,4 5,9 5,9 5Д 3,8 4,2 6,9 8,4 6,0 5,7 2,4 1,8 1,8 1,7 1,9 1,5 0,9 3,01 14,06 1,45 1,04 4,84 3,78 0,90 2,14 1,58 2,67 0,82 0,95 2,66 2,65 1,31 1,45 1,50 0,89 0,86 0,87 2,06 1,67 1,73 0,93 2,84 1,37 1,72 0,87 1,59 1,19 1,57 ходу застосування поліморфної модифікації А флібансерину для одержання лікарського засобу, призначеного для лікування порушень і розладів, вибраних із групи, яка включає гіипоактивний статевий потяг, втрату статевого потягу, відсутність статевого потягу, зниження статевого потягу і пригнічення статевого потягу. В особливо переважному варіанті винахід стосується застосування поліморфної модифікації А флібансерину для одержання лікарського засобу, призначеного для лікування порушень і розладів, вибраних із групи, яка включає гіпоактивний статевий потяг і втрату статевого потягу. Згаданий вище терапевтичний ефект від застосування поліморфної модифікації А флібансерину може в однаковому ступені виявлятися і при лікуванні чоловіків, і при лікуванні жінок. Однак відповідно до ще одного об'єкту даного винаходу в ньому пропонується застосування поліморфної модифікації А флібансерину для одержання лікарського засобу, призначеного для лікування сексуальної дисфункції в жінок. Позитивний ефект від застосування поліморфної модифікації А флібансерину можна спостерігати незалежно від того, чи є той чи інший розлад або порушення вродженим або ж набутим, а також незалежно від його етіології (чи зумовлено воно органічними факторами, до яких належать і фізичні, і індуковані ліками фактори, психогенними факторами, комбінаціями органічних факторів, до яких належать і фізичні, і індуковані ліками фактори, і психогенних факторів або ж не встановленими факторами). 13 76767 14 У винаході пропонуються також фармацевтичДіючу речовину можна поміщати в ексципієнти ні композиції, які крім одного або декількох фарабо носії, які звичайно використовуються у фармацевтичних носіїв, розріджувачів або ексципієнтів мацевтичних композиціях, такі, наприклад, як містять як діючу речовину поліморфну модифікатальк, гуміарабік, лактоза, желатин, стеар^т магцію А флібансерину. Для фармацевтичного застонію, кукурудзяний крохмаль, водні або неводні сування поліморфну модифікацію А флібансерину наповнювачі, полівінілпіролідон, напівсинтетичні можна включати до складу звичайного фармацевгліцериди жирних кислот, бензалконійхлорид, фотичного препарату у твердій або рідкій формі або у сфат натрію, ЕДТК і полісорбат 80. Фармацевтичні вигляді спрею. Запропонована у винаході фармакомпозиції переважно одержувати у вигляді розрацевтична композиція може бути представлена у хованих на одне введення в організм лікарський формі, придатній для перорального, ректального форм, кожна з яких містить діючу речовину в уніабо парентерального введення або для назальної фікованій разовій дозі. Вміст Діючої речовини в інгаляції, при цьому до переважних лікарських кожній лікарській формі, розрахованій на одне форм належать, наприклад, капсули, таблетки, введення в організм, може становити від 0,01 до таблетки з покриттям, ампули, супозиторії і наза100мг, переважно від 0,1 до 50мг. льний спрей. Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюStable polymorph modification of flibanserin, method for industrial production thereof and use thereof for preparing medicaments
Назва патенту російськоюСтабильная полиморфная модификация флибансерина, способ ее промышленного получения и ее использование для получения лекарственных средств
МПК / Мітки
МПК: A61P 15/00, A61P 25/20, A61P 25/00, A61P 25/18, A61P 25/16, A61P 25/28, C07D 235/26, A61K 31/496, A61P 25/22, C07D 233/26, A61P 25/24
Мітки: одержання, стабільна, засобів, застосування, промислового, поліморфна, модифікація, спосіб, лікарських, флібансерину
Код посилання
<a href="https://ua.patents.su/7-76767-stabilna-polimorfna-modifikaciya-flibanserinu-sposib-promislovogo-oderzhannya-ta-zastosuvannya-dlya-oderzhannya-likarskikh-zasobiv.html" target="_blank" rel="follow" title="База патентів України">Стабільна поліморфна модифікація флібансерину, спосіб її промислового одержання та її застосування для одержання лікарських засобів</a>
Попередній патент: Електрогідравлічний підсилювач
Наступний патент: Насосна установка з занурюваним пневмогідравлічним насосом мілінського ю.м.
Випадковий патент: Пристрій для подрібнення матеріалів











