Спосіб одержання r-(+)-6-карбоксамідо-3-n-метиламіно-1,2,3,4-тетрагідрокарбазолу
Номер патенту: 70943
Опубліковано: 15.11.2004
Автори: Хартлі Девід, Блекенрідж Ян, МакІнтайр Стівен, Найт Джон, МакДжі Керолайн
Формула / Реферат
1. Спосіб одержання R-(+)-6-карбоксамідо-3-N-метиламіно-1,2,3,4-тетрагідрокарбазолу, при якому здійснюють стадію розділення енантіомерної суміші сполуки формули (І)
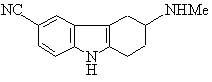 (I)
(I)
з подальшим гідролізом R-(+)-6-ціано-3-N-метиламіно-1,2,3,4-тетрагідрокарбазолу або його солі чи сольвату, з наступним можливим утворенням солі, причому розділення енантіомерів здійснюють шляхом обробки вказаної суміші L-піроглутаміновою кислотою.
2. Спосіб за п. 1, який відрізняється тим, що сполука формули (І) включає рацемічну суміш енантіомерів.
3. Спосіб одержання R-(+)-6-карбоксамідо-3-N-метиламіно-1,2,3,4-тетрагідрокарбазолу або його солі чи сольвату за будь-яким з пп. 1 або 2, який відрізняється тим, що здійснюють розділення енантіомерної суміші 6-ціано-3-N-метиламіно-1,2,3,4-тетрагідрокарбазолу з утворенням R-(+)-6-ціано-3-N-метиламіно-1,2,3,4-тетрагідрокарбазолу або його солі чи сольвату та гідроліз R-(+)-6-ціано-3-N-метиламіно-1,2,3,4-тетрагідрокарбазолу або його солі чи сольвату, з наступним можливим утворенням солі.
4. Спосіб за будь-яким з пп. 1-3, який відрізняється тим, що 6-ціано-3-N-метиламіно-1,2,3,4-тетрагідрокарбазол формули (І) одержують за реакцією 4-ціанофенілгідразину з 4-метиламіноциклогексаноном або його захищеною похідною.
5. Спосіб за п. 4, який відрізняється тим, що захищена похідна 4-метиламіноциклогексанону являє собою 4-метиламіноциклогексанон(2',2'-диметилтриметилен)кеталь гідрохлорид.
6. Спосіб за п. 5, який відрізняється тим, що 4-метиламіноциклогексанон(2',2'-диметилтриметилен)кеталь гідрохлорид одержують за реакцією 1,4-циклогександіонмоно-2,2-диметилтриметиленкеталю з метиламіном.
7. Спосіб за п. 1, який відрізняється тим, що здійснюють стадії реакції захищеного 1,4-циклогександіону з метиламіном, реакції 4-ціанофенілгідразину з 4-метиламіноциклогексанон(2',2'-диметилтриметилен)кеталем або його сіллю, розділення суміші індолнітрильних енантіомерів формули (І) та гідролізу R-(+)-6-ціано-3-N-метиламіно-1,2,3,4-тетрагідрокарбазолу формули (І) або його солі чи сольвату для одержання R-(+)-6-карбоксамідо-3-N-метиламіно-1,2,3,4-тетрагідрокарбазолу або його солі чи сольвату.
8. Сполука формули II
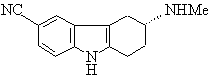 (II)
(II)
або її сіль чи сольват.
9. R-(+)-6-ціано-3-N-метиламіно-1,2,3,4-тетрагідрокарбазол L-піроглутамат.
10. Застосування L-піроглутамінової кислоти у розділенні енантіомерної суміші сполуки формули І
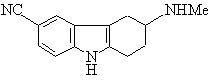 (І).
(І).
Текст
1. Спосіб одержання R-(+)-6-карбоксамідо-3N-метиламіно-1,2,3,4-тетрагідрокарбазолу, при якому здійснюють стадію розділення енантіомерної суміші сполуки формули (І) NC NHMe 2 (19) 1 3 70943 Даний винахід стосується нового способу одержання R-(+)-6-карбоксамідо-3-N-метиламіно1,2,3,4-тетрапдрокарбазолу. У WO-A-93/00086 подано опис групи тетрагідрокарбазолових похідних, що активні як 5НТ1 рецепторні агоністи і тому корисні у лікуванні мігрені. Розкриті і специфічні сполуки включають, окрім усього іншого, 3-метиламіно-6-карбоксамідо1,2,3,4-тетрагідрокарбазол гідрохлорид. У WO-A93/00086 розглянуто також спосіб одержання 3метиламіно-6-карбоксамідо-1,2,3,4тетрагідрокарбазол гідрохлориду, котрий включає шестистадійний процес, через 3-метиламіно-6ціано-1,2,3,4-тетрагідрокарбазол, включаючи ряд стадій протестування та депротектування. У WO-A-94/14772 подано опис енантіомерів деяких карбазолових похідних, що включає вищезазначену сполуку. Розкритими енантіомерами є наступні: R-(+)-6-карбоксамідо-3-N-метиламіно-1,2,3,4тетрагідрокарбазол; S-(-)-6-карбоксамідо-3-N-метиламіно-1,2,3,4тетрагідрокарбазол; R-(+)-6-карбоксамідо-3-N-етиламіно-1,2,3,4тетрагідрокарбазол; S-(-)-6-карбоксамідо-3-N-етиламіно-1,2,3,4тетрагідрокарбазол; та 3 їх солі та сольвати. У даний час проводяться клінічні випробування R-(+)-6-карбоксамідо-3-N-метиламіно-1,2,3,4тетрагідрокарбазол сукцинату для лікування мігрені. WO-A-94/14772 запроваджує різні способи, за допомогою яких можуть бути одержані окремі енантіомери, а саме: (і) розділення енантіомерної суміші даної сполуки або її похідної методом хроматографії, наприклад, на хіральній колонці методом високоефективної рідинної хроматографії; (іі) розділення діастереоізомерів хіральної похідної (наприклад, хіральної солі) даної сполуки, наприклад, кристалізацією або хроматографією; або (ііі) алкілування (+) або (-) енантіомера 3аміно-6-карбоксамідо-1,2,3,4-тетрагідрокарбазолу або його солі. Хоча розглянуті вище процедури (і)-(ііі) можуть бути використані для одержання потрібного енантіомера, вони невигідні в плані "масштабування" та виробництва комерційних кількостей даної сполуки. Зокрема, було встановлено, що проведення розділення на кінцевій стадії синтезу та використання R-2-піролідон-5-карбонової кислоти (відомої також як D-піроглутамінова кислота) для утворення хіральної солі призводить до одержання проміжної сполуки, що має низьку розчинність, і тому дає низький вихід потрібного енантіомера, незважаючи на те, що R-2-піролідон-5-карбонова кислота подана як оптично активна кислота, якій віддається перевага у способі, котрий описаний у WOA-94/14772. У зв'язку з цим виникає потреба у розробці більш ефективного способу, який є більш придатним для виробництва у комерційному масштабі. Авторами був розроблений такий спосіб для оде 4 ржання R-(+)-6-карбоксамідо-3-N-метиламіно1,2,3,4-тетрагідрокарбазолу. Даний спосіб базується на розділенні індол нітрильної проміжної сполуки на відносно ранній стадії процесу. Автори встановили, що зазначена проміжна сполука має добру розчинність і дозволяє отримувати потрібний енантіомер з високим виходом. Дійсно, хоча даний новий спосіб включає на одну стадію більше ніж спосіб WO-A-94/14772, він дає більший загальний вихід кінцевого продукту. Крім того, проведення процедури розділення на стадії нітрильної проміжної сполуки дає гарантії, що наступні стадії будуть виконуватися на потрібній енантіомерній формі проміжних сполук, що забезпечить пряме одержання потрібної сполуки без застосування хроматографії або подібних методів. Таким чином, у першому аспекті даний винахід запроваджує спосіб для одержання К-(+)-6карбоксамідо-3-М-метиламіно-1,2,3,4тетрагідрокарбазолу, який включає стадію розділення суміші енантіомерів індол нітрильної сполуки формули (І): Сполуці формули (І) можна дати назву 6-ціано3-N-метиламіно-1,2,3,4-тетрагідрокарбазол. Зрозуміло, що сполука формули (І) може включати різні співвідношення двох її енантіомерів. Зокрема, вона може існувати як рацемічна суміш. Було встановлено, що досить легке розділення суміші індол нітрильних енантіомерів може досягатись з використанням L-піроглутамінової кислоти. Дійсно, було встановлено, що використання D-піроглутамінової кислоти дає "невірний" енантіомер, тоді як L-піроглутамінова кислота дає бажаний енантіомер з добрим виходом. Використання L-піроглутамінової кислоти має також економічні переваги, оскільки вона є природною формою і тому значно дешевша, ніж D-форма. Реакція з оптично активною кислотою для утворення хіральної солі може здійснюватись у прийнятному розчиннику, наприклад, спирті, такому як метанол або етанол, і при температурі у межах 0-100°С. Потрібний енантіомер одержують кристалізацією з використанням добре відомих у цій галузі методів. Кристалізація може ініціюватися спонтанно або у деяких випадках з використанням затравки. Реакційну суміш бажано обробляти оцтовою кислотою, переважно після початку кристалізації. Як було встановлено, це сприяє селективній кристалізації потрібного енантіомера. Одержану в результаті Lпіроглутаматну сіль можна піддати перекристалізації з водного метанолу або, краще, з водного етанолу з метою підвищити оптичну чистоту даного продукту. Одержана хіральна сіль може бути конвертована у вільну основу з використанням стандартних процедур, що дає (+)-6-ціано-3-Nметиламіно-1,2,3,4-тетрагідрокарбазол. При потребі, дану сполуку можна прямо піддати реакції in situ для одержання відповідної карбоксамідо сполуки. 5 70943 6 (+)-6-ціано-3-N-метиламіно-1,2,3,4Зазначена вище кеталева похідна (IV) являє тетрагідрокарбазол є новою сполукою. Тому у пособою сполуку, що є у продажу. Вона може бути дальшому аспекті даний винахід запроваджує (+)одержана, наприклад, за допомогою способу, що 6-ціано-3-N-метиламіно-1,2,3,4-тетрагідрокарбазол описаний у WO-A-94/14772, шляхом реакції відпоформули (II); відного захищеного 1,4-циклогександіону формули (V): та його солі і сольвати. Варіантом даного аспекту винаходу, якому віддається перевага, є (+)-6-ціано-3-N-метиламіно1,2,3,4-тетрагідрокарбазол L-піроглутамат. Сполука формули (II) може бути конвертована у потрібний R-(+)-6-карбоксамід-3-N-метиламіно1,2,3,4-тетрагідрокарбазол або його сіль чи сольват. Тому у подальшому аспекті даний винахід запроваджує спосіб одержання R-(+)-6карбоксамідо-3-N-метиламіно-1,2,3,4тетрагідрокарбазолу або його солі чи сольвату, спосіб, що включає гідроліз R-(+)-6-ціано-3-Nметиламіно-1,2,3,4-тетрагідрокарбазолу або його солі чи сольвату. Як легко зрозуміти фахівцям у даній галузі, нітрил може бути гідролізований з утворенням або аміду, або карбонової кислоти, що залежить від застосованих умов. Тому зрозуміло, що у даному способі умови гідролізу мають бути такими, щоб забезпечити утворення аміду, а не карбонової кислоти. Перевага віддається гідролізу з використанням оцтової кислоти та комплексу трифтористий бор (ВF3)/оцтова кислота. Інші засоби гідролізу, що можуть бути використані, включають перекис водню у присутності лужного гідроксиду, такого як гідроксид натрію, у такому розчиннику як спирт; або мурашину кислоту та бромистоводневу чи хлористоводневу кислоту. 6-ціано-3-N-метиламіно-1,2,3,4тетрагідрокарбазол, що використовується як вихідний матеріал для стадії розділення, може бути одержаний з використанням способів, котрі описані у WO-A-93/00086. Як альтернатива, якій віддається перевага, 6-ціано-3-N-метиламіно-1,2,3,4тетрагідрокарбазол може бути одержаний шляхом реакції 4-ціанофеніл гідразину формули (III): з метиламіном. Краще, коли дану реакцію проводять у прийнятному розчиннику, такому як спирт, або в їх суміші, наприклад, денатурованому метиловим спиртом етиловому спирті чи метанолі, з каталітичною гідрогенізацією з використанням, наприклад, паладію на вугіллі. Повна синтетична послідовність від кетокеталів формули (V) до R-(+)-6-карбоксамідо-3-Nметиламіно-1,2,3,4-тетрагідрокарбазолу наступна: або його солі, наприклад, гідрохлориду, з 4метиламіноциклогексаноном або його захищеною похідною. Краще, коли використовується кеталева похідна 4-метиламіноциклогексанон (2',2'диметилтриметилен)кеталь або її сіль, наприклад, гідрохлорид: Краще, коли дана реакція проводиться у водному кислому середовищі. Умови реакції для різних стадій, яким віддається перевага, наступні: (і) IMS (денатурований метиловим спиртом 7 70943 8 етиловий спирт), МеNН 2, Н2, Pd-C потім THF (тетбув у межах 0,7-2% (вага/об'єм). Дану суміш нагрірагідрофуран), НСІ, 0-10°С, наприклад, 0-5°С або, вали із оберненим холодильником для утворення краще, 5-10°С (вихід: 77-94% теор.); розчину і потім охолоджували до 25°С, уводили (іі) НСІ (водн.), 80-90°С, краще, 85-90°С з назатравку, і протягом 30 хвилин при 25-28°C додаступною 0-5°С, потім NaOH (водн.), THF з наступвали оцтову кислоту (0,6мол.еквів., 59мл). Дану ною 0-5°С (вихід: 62-85% теор.); суміш піддавали старінню протягом 30 хвилин при (ііі) МеОН, L-піроглутамінова кислота (L-PGA), 25°С, потім охолоджували до 0-3°С і додатково АсОН, 50°С або, краще, нагрівання із оберненим витримували 2 години. Утворену в результаті твехолодильником з наступною 0-5°С, потім перекрирду речовину виділяли фільтруванням та висушусталізація з водного МеОН або, краще, ЕtOH (вивали у вакуумі при кімнатній температурі з одерхід: 14-30% теор.); жанням R-(+)-6-ціано-3-N-метиламіно-1,2,3,4(iv) АсОН, BF3(AcOH)2, 90-95°С, потім NaOH, тетрагідрокарбазолу, піроглутаматної солі (180,8г), BuOH, потім Na2CO3 або, краще, водна промивка як продукту проміжної чистоти. (вихід: 70-100% теор.). (б) Перекристалізація Як можлива стадія (ν), сполука (II), що утвореПіроглутаматну сіль проміжної чистоти на на стадії (iv), може бути легко перетворена у (147,4г), отриману на стадії (а), змішували з водою відповідну сольову форму, наприклад, сіль бурш(120,6мл) та 96% етанолом (363мл), і суміш перетинової кислоти, за реакцією з бурштиновою кисмішували та нагрівали з оберненим холодильнилотою у спирті, такому як етанол, або суміші спирком з утворенням розчину. До розчину, що нагрітів, таких як етанол та бутанол. Краще, коли дану вався з оберненим холодильником, протягом 30 реакцію проводять при температурі у межах 60хвилин додатково додавали 96% етанол (1,03л), і 100°С, наприклад, 60-65°С, або, краще, 70-100°С, потім суміш затравлювали. Дану суміш протягом 2 потім 20-25°С, (вихід: 87-90% теор.). Дана сіль, годин охолоджували до 0-5°С і додатково витринаприклад, сукцинат, може бути, при потребі, пемували 1-2 години. Тверду речовину виділяли фірекристалізована, краще, з використанням воднольтрацією та висушували у вакуумі при кімнатній го етанолу. температурі з одержанням -R-(+)-6-ціано-3-NТому у подальшому аспекті даний винахід заметиламіно-1,2,3,4-тетрагідрокарбазолу, піроглупроваджує спосіб одержання R-(+)-6таматної солі (123,2г), з ее >98%, згідно з даними карбоксамідо-3-N-метиламіно-1,2,3,4аналізу методом високоефективної рідинної хротетрагідрокарбазолу або його солі чи сольвату, матографії. який включає розглянуті вище реакційні стадії (і)ПРИКЛАД 2: Показове одержання R-(+)-6(iv) та додаткову можливу стадію утворення солі карбоксамідо-3-N-метиламіно-1,2,3,4(ν). тетрагідрокарбазол сукцинатної солі Оскільки аміно кеталевий гідрохлоридний ма2.1 Одержання 4-метиламіноциклогексанон теріал, що використовується на стадії (іі), являє (2'2'-диметилтриметилен)кеталь гідрохлориду собою сполуку, що є у продажу, даний спосіб мо(амін кеталь гідрохлориду) же, по суті, складатися лише зі стадій (іі)-(iv). Стадія 1 У іншому аспекті даний винахід запроваджує Реакційну посудину (RV2; номінальна місткість використання L-глутамінової кислоти у розділенні 100л; робоча місткість приблизно 130л) завантаенантіомерної суміші індол нітрильної сполуки жували 5% паладієм на вугіллі (50ваг.% паста, формули (І): 1,25кг) з наступним уведенням 1,4-циклогександіон моно-2-(2',2'-диметилтриметилен)кеталю (кето кеталь) (125кг). Потім реакційну посудину продували азотом перед уведенням IMS (75л). Потім реакційну суміш перемішували протягом 30 хвилин до розчинення кето кеталю. Потім завантажували розчин метиламіну в етанолі (33% вага/об'єм, 2,6мол.еквів., 15,5л), і утворену в результаті суміш Далі винахід буде описаний з посиланням на перемішували в а тмосфері водню під тиском 1атм наступні приклади, які не слід тлумачити як такі, при 20-25°С до завершення реакції, що контролющо обмежують у будь-якій мірі даний винахід. валося методом газової хроматографії (приблизно ПРИКЛАД 1: Розділення рацемічної суміші 612-14 годин). Каталізатор відфільтровували шляціано-3-N-метиламіно-1,2,3,4-тетрагідрокарбазолу хом перепускання крізь 1мкм фільтр у другу посу(індол нітрилу) дину (RV3; номінальна місткість 250л; робоча міст(а) Одержання солі кість приблизно 300л) з наступним промиванням Рацемічний індол нітрил (1,72моль, 387г) зміIMS (2 х6,25л) у другу посудину. Об'єднані фільтшували з метанолом (1,94л), і суміш перемішували рат та промивні води концентрували у вакуумі при та нагрівали з оберненим холодильником з утвотемпературі 35-40°С для вилучення IMS. Одержаренням розчину. У той же час другу колбу заванний концентрат зберігали під атмосферою азоту тажували L-піроглутаміновою кислотою при
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for obtaining r-(+)-6-carboxamido-3-n-methylamino-1,2,3,4-tetrahydrocarbazole
Назва патенту російськоюСпособ получения r-(+)-6-карбоксамидо-3-n-метиламино-1,2,3,4-тетрагидрокарбазола
МПК / Мітки
МПК: A61K 31/403, A61P 25/06, C07D 209/88
Мітки: спосіб, r-(+)-6-карбоксамідо-3-n-метиламіно-1,2,3,4-тетрагідрокарбазолу, одержання
Код посилання
<a href="https://ua.patents.su/8-70943-sposib-oderzhannya-r-6-karboksamido-3-n-metilamino-1234-tetragidrokarbazolu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання r-(+)-6-карбоксамідо-3-n-метиламіно-1,2,3,4-тетрагідрокарбазолу</a>
Наступний патент: Спосіб одержання літієвих пластичних мастил
Випадковий патент: Композиція інгредієнтів для настоянки "кмин"












