Похідні піразолу та способи їх одержання
Формула / Реферат
1. Похідне піразолу загальної формули [І] або його сіль:
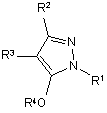 [I],
[I],
де R1 означає С1-С6-алкілгрупу, R2 означає С1-С3-галогеналкілгрупу, R3 означає атом водню, С1-С3-алкілгрупу, яка може бути заміщена одним або декількома замісниками, вибраними з наступної групи замісників α, або формілгрупу, R4 означає атом водню, С1-С3-галогеналкілгрупу за умови, що R4 являє собою С1-С3-галогеналкілгрупу у випадку, коли R3 означає водень або формілгрупу, і R4 являє собою водень або С1-С3-галогеналкілгрупу у випадку, коли R3 означає С1-С3-алкілгрупу, яка може бути заміщена одним або декількома замісниками, вибраними з наступної групи замісників α, де група замісників α включає атоми галогену, групу -SH, групу -SC(=NH)NH2.
2. Похідне піразолу або його сіль за п. 1, яке відрізняється тим, що R4 означає С1-С3-галогеналкілгрупу.
3. Похідне піразолу або його сіль за п. 1, яке відрізняється тим, що R3 означає С1-С3-алкілгрупу і R4 означає атом водню.
4. Похідне піразолу або його сіль за п. 1, яке відрізняється тим, що R3 означає метилгрупу, яка може бути заміщена одним або декількома замісниками, вибраними з групи замісників α.
5. Похідне піразолу або його сіль за п. 1, яке відрізняється тим, що R3 означає метилгрупу.
6. Спосіб одержання похідного піразолу загальної формули [3], який відрізняється тим, що включає стадію взаємодії сполуки загальної формули [1] із сполукою загальної формули [2]:
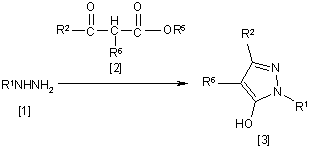 ,
,
де R1 і R2 мають ті ж значення, які вказані вище, R5 означає С1-С3-алкілгрупу, фенілгрупу, яка може бути заміщена, або бензилгрупу, яка може бути заміщена, і R6 означає С1-С3-алкілгрупу.
7. Спосіб одержання похідного піразолу загальної формули [6], який відрізняється тим, що включає стадію взаємодії сполуки загальної формули [3] із сполукою загальної формули [5] в присутності основи:
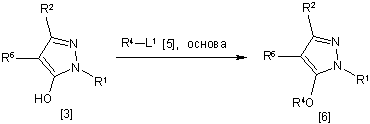 ,
,
де R1, R2, R4 і R6 мають ті ж значення, які вказані вище, і L1 означає відхідну групу, яка є більш реакційноздатною, ніж атом галогену, що залишається після галогеналкілування, і являє собою атом галогену, С1-С3-алкілсульфонілоксигрупу, С1-С3-галогеналкілсульфонілоксигрупу, фенілсульфонілоксигрупу, яка може бути заміщена, або бензилсульфонілоксигрупу, яка може бути заміщена, і тому подібне.
8. Спосіб одержання похідного піразолу загальної формули [6], який відрізняється тим, що включає стадію взаємодії сполуки загальної формули [3] з трифенілфосфіном та сполукою загальної формули [7], і азосполукою [8] в присутності розчинника:
 ,
,
де R1, R2, R4 і R6 мають ті ж значення, які вказані вище.
9. Спосіб одержання похідного піразолу загальної формули [10], який відрізняється тим, що включає стадію взаємодії сполуки загальної формули [9] з агентом галогенування:
 ,
,
де R1, R2 і R4 мають ті ж значення, які вказані вище, R7 означає атом водню, R8
означає С1-С2-алкілгрупу і Χ означає атом галогену.
10. Спосіб одержання похідного піразолу загальної формули [12], який відрізняється тим, що включає стадію взаємодії сполуки загальної формули [10] із сполукою загальної формули [11] у присутності розчинника:
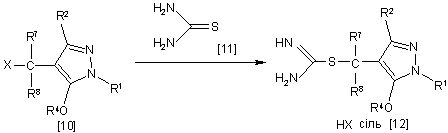 ,
,
де R1, R2, R4, R7, R8 i Х мають ті ж значення, які вказані вище.
11. Спосіб одержання похідного піразолу загальної формули [13], який відрізняється тим, що сполуку загальної формули [12] піддають гідролізу у присутності розчинника:
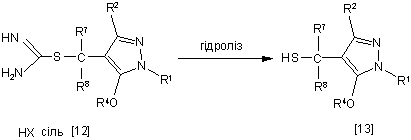 ,
,
де R1, R2, R4, R7, R8 i Х мають ті ж значення, які вказані вище.
12. Спосіб одержання похідного піразолу загальної формули [13], який відрізняється тим, що сполуку загальної формули [10] піддають взаємодії з сульфідом у присутності розчинника:
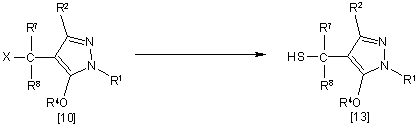 ,
,
де R1, R2, R4, R7, R8 i Х мають ті ж значення, які вказані вище.
13. Спосіб одержання похідного піразолу загальної формули [15], який відрізняється тим, що включає стадію формілування сполуки загальної формули [14]:
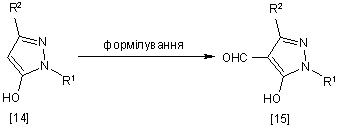 ,
,
де R1 і R2 мають ті ж значення, які вказані вище.
14. Спосіб одержання похідного піразолу загальної формули [17], який відрізняється тим, що включає стадію взаємодії сполуки загальної формули [15] із сполукою загальної формули [5] в присутності основи:
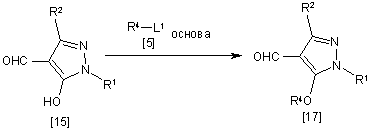 ,
,
де R1, R2, R4 і L1 мають ті ж значення, які вказані вище.
15. Спосіб одержання похідного піразолу загальної формули [19], який відрізняється тим, що включає стадію галогенметилування сполуки загальної формули [18] у присутності розчинника:
 ,
,
де R1, R2, R4 і Χ мають ті ж значення, які вказані вище.
Текст
1. Похідне піразолу загальної формули [І] або його сіль: 2 3 трифенілфосфін азоспол ука [8] R4 OH R2 N R6 79483 4 загальної формули [10] піддають взаємодії з сульфідом у присутності розчинника: R2 R6 N [6] R2 R2 R7 X C R1 H2 N H2 N [11] HN H2 N R1 H2N , де R і R мають ті ж значення, які вказані вище. 14. Спосіб одержання похідного піразолу загальної формули [17], який відрізняється тим, що включає стадію взаємодії сполуки загальної формули [15] із сполукою загальної формули [5] в присутності основи: гідроліз N R1 R4O N R1 R4O [17] [15] , де R1, R2, R4 і L1 мають ті ж значення, які вказані вище. 15. Спосіб одержання похідного піразолу загальної формули [19], який відрізняється тим, що включає стадію галогенметилування сполуки загальної формули [18] у присутності розчинника: R2 R2 N N R 4O галогенметилування N XH2C N R1 R1 R1 R8 N OHC HO N C L1 основа [5] N N HS R2 R4 R7 R8 2 R2 R1 R2 N C [15] 1 N R4 O HX сіль [12] R7 S [14] R1 , де R1, R2, R4 , R7, R8 i Х мають ті ж значення, які вказані вище. 11. Спосіб одержання похідного піразолу загальної формули [13], який відрізняється тим, що сполуку загальної формули [12] піддають гідролізу у присутності розчинника: HN HO OHC N C R2 N R1 HO N R8 R4 O [10] N OHC R1 R7 S N R8 формілування N R2 S N R2 N , де R1, R2 і R4 мають ті ж значення, які вказані вище, R7 означає атом водню, R8 означає С1-С2-алкілгрупу і Χ означає атом галогену. 10. Спосіб одержання похідного піразолу загальної формули [12], який відрізняється тим, що включає стадію взаємодії сполуки загальної формули [10] із сполукою загальної формули [11] у присутності розчинника: C R1 R 4O [13] , де R , R , R4 , R7, R8 i Х мають ті ж значення, які вказані вище. 13. Спосіб одержання похідного піразолу загальної формули [15], який відрізняється тим, що включає стадію формілування сполуки загальної формули [14]: R1 R 4O [10] R2 N R8 R 4O [10] 1 2 N R8 R4O [9] R7 R1 C N N R8 HS N R2 R7 агент галогенування я N C X C R8 , де R1, R2, R4 і R6 мають ті ж значення, які вказані вище. 9. Спосіб одержання похідного піразолу загальної формули [10], який відрізняється тим, що включає стадію взаємодії сполуки загальної формули [9] з агентом галогенування: H X R 4O [3] N N R1 HO R7 R7 N R1 R2 R2 N [7] R4O [18] R4 O [19] , де R , R , R , R , R i Х мають ті ж значення, які вказані вище. 12. Спосіб одержання похідного піразолу загальної формули [13], який відрізняється тим, що сполуку , де R1, R2, R4 і Χ мають ті ж значення, які вказані вище. Даний винахід відноситься до похідних піразолу, які застосовуються як проміжні сполуки для отримання агрохімікатів і медикаментів. Як спосіб отримання похідного ізоксазоліну, застосовного як гербіциду, [наприклад, японська викладена патентна заявка №308857/2002] розкриває приклади отримання похідних ізоксазоліну, що мають кільце піразолу, де вихідний матеріал, що має кільце ізоксазоліну, піддають взаємодії з гідратом гідросульфіду натрію з подальшою взає модією з 4-бромметил-5-хлор-1-феніл-3трифторметил-1Н-піразолом в присутності карбонату калію і Rongalit. Мета винаходу - надати корисні проміжні сполуки для отримання вказаних похідних ізоксазоліну і способи отримання цих проміжних сполук. Внаслідок всебічних досліджень для розв'язання вказаних проблем автори даного винаходу виявили, що вказані похідні ізоксазоліну можуть бути отримані більш ефективно і легко при вико HX сіль [ 12] 1 2 [13] 4 7 8 5 79483 6 ристанні як проміжних сполук специфічних похідде R1, R , R4 і R мають ті ж значення, які вканих піразолу, отримання яких можливе з легко зані вище, і L1 означає відхідн у гр уп у, яка є більш доступних вихідних матеріалів. Таким чином, вони реакційноздатною, ніж атом галогену, що залишареалізовували те, що похідні піразолу стають проється після галогеналкілування, і являє собою міжними сполуками, надзвичайно корисними у атом галогену, С1-С3алкілсульфонілоксигрупу, С1виробництві вказаних похідних ізоксазоліну і, отже, С3галогеналкіл сульфонілоксигрупу, феніл сульстворили винахід. фонілоксигрупу, яка може бути заміщена, або бенА саме, даний ви нахід вирішує вказані прозил сульфонілоксигрупу, яка може бути заміщена, і блеми наступними винаходами від (1) до (15). тому подібне. Похідне піразолу, представлене загальною (8) Спосіб отримання похідного піразолу, формулою (І) або його сіль: представленого загальною формулою [6], що включає стадію взаємодії сполуки, представленої загальною формулою [4], з трифенілфосфіном, [1] сполукою, представленою загальною формулою [7], і азосполукою [8]: де R1 означає С 1-С6алкілгрупу, R2 означає С 1С3галогеналкілгрупу, R3 означає атом водню, С1С3алкілгрупу, яка може бути заміщена одним або декількома замісниками, вибраними з наступної групи замісників α, або формілгрупу, R4 означає атом водню або С 1-С3галогеналкілгрупу, за умови, що R4 являє собою С 1-С3галогеналкілгрупу у випаде R1, R2, R4 і R6 мають ті ж значення, які вкадку, коли R3 означає атом водню або формілгрупу, 4 зані вище. і R являє собою атом водню або С 1(9) Спосіб отримання похідного піразолу, С3галогеналкілгрупу у випадку, коли R3 означає представленого загальною формулою [10], що С1-С3алкілгрупу, яка може бути заміщена одним включає стадію взаємодії сполуки, представленої або декількома замісниками, вибраними з наступзагальною формулою [9], з агентом галогенування: ної групи замісників α; "Група замісників α" - атоми галогену, гр упа -SH, гр упа -SC(=NH)NH 2. (2) Похідне піразолу або його сіль за п.(1), де R4 означає С1-С3галогеналкілгрупу. (3) Похідне піразолу або його сіль за п.(1), де R3 означає С1-С3алкілгрупу і R 4 означає атом водде R1, R2 і R4 мають ті ж значення, які вказані ню. вище, (4) Похідне піразолу або його сіль за п.(1), де 3 R7 і R8, кожний, означають атом водню або С1R означає метилгрупу, яка може бути заміщена С2алкілгрупу і X означає атом галогену. одним або декількома замісниками, вибраними з (10) Спосіб отримання похідного піразолу, групи замісників α. представленого загальною формулою [12], що (5) Похідне піразолу або його сіль за п.(3), де включає стадію взаємодії сполуки, представленої R3 означає метилгрупу. загальною формулою [10], із сполукою, представ(6) Спосіб отримання похідного піразолу, леною загальною формулою [11]: представленого загальною формулою [3], що включає стадію взаємодії сполуки, представленої загальною формулою [1], із сполукою, представленою загальною формулою [2]: де R1 і R2 мають ті ж значення, які вказані вище, R5 означає С 1-С3алкілгрупу, фенілгруп у, яка може бути заміщена, або бензилгрупу, яка може бути заміщена, і R6 означає С1-С3алкілгрупу. (7) Спосіб отримання похідного піразолу, представленого загальною формулою [6], що включає стадію взаємодії сполуки, представленої загальною формулою [4], із сполукою, представленою загальною формулою [5], в присутності основи: де R1, R2, R4, R 7, R8 і X мають ті ж значення, які вказані вище. (11) Спосіб отримання похідного піразолу, представленого загальною формулою [13], де сполуку, представлену загальною формулою [12] за п.(10), піддають гідролізу. (12) Спосіб отримання похідного піразолу, представленого загальною формулою [13], де сполуку, представлену загальною формулою [10] за п.(10), піддають взаємодії з сульфідом. (13) Спосіб отримання похідного піразолу, представленого загальною формулою [15], що 7 79483 8 включає стадію форматування сполуки, представ(С1-С4алкіл)-SО2-О-групи, де алкілгрупа має ті ж леної загальною формулою [14]: значення, які вказані вище, і приклади її включають метансульфонілоксигрупу, етансульфонілоксигрупу і тому подібне. С1-С3галогеналкілсульфонілоксигрупа відноситься до (С1-С3галогеналкіл)-SO2-O-групи, де галогеналкілгрупа має ті ж значення, які вказані вище, і приклади її включають трифторметансуде R і R мають ті ж значення, які вказані вище. льфонілоксигрупу, трихлорметансульфонілоксиг(14) Спосіб отримання похідного піразолу, рупу і тому подібне. представленого загальною формулою [17], що "Група, яка може бути заміщена," в фенілгрупі включає стадію взаємодії сполуки, представленої (яка може бути заміщена), фенілсульфонілоксигзагальною формулою [16], із сполукою, представрупі (яка може бути заміщена), бензилгрупі (яка леною загальною формулою [5], в присутності осможе бути заміщена) або бензилсульфонілоксигнови: рупі (яка може бути заміщена) відноситься до групи, яка може бути заміщена, наприклад, атомом галогену, С1-С10алкілгрупою, С1С4галогеналкілгрупою, С1-С10алкоксіалкілгрупою, С1-С10алкоксигрупою, С1-С10алкілтіогрупою, С1С10алкілсульфонілгрупою, ацилгрупою, С1де R1, R , R і L мають ті ж значення, які вказані С10алкоксикарбонілгрупою, ціаногрупою, карбамовище. їлгрупою (її атом азоту може бути заміщений С 1(15) Спосіб отримання похідного піразолу, С10алкілгрупами, які можуть бути однаковими або представленого загальною формулою [19], що відмінними одна від одної), нітрогрупою або аміновключає стадію галогенметилування сполуки, групою (її атом азоту може бути заміщений С 1представленої загальною формулою [18]: С10алкілгрупами, С1-С6ацилгрупами, С1С4галогеналкілкарбонілгрупами, С1С10алкілсульфонілгрупами і С 1С4галогеналкілсульфонілгрупами, які можуть бути однаковими або відмінними одна від одної). 1 2 4 Сіль є сіллю сполуки загальної формули [1], в де R , R , R і X мають ті ж значення, які вкаструктурі якої присутня гідроксильна група, група зані вище. SH, група SC(=NH)NH2 або тому подібне, з метаУ зв'язку з цим, визначення термінів, що виколом, або органічною основою, або з мінеральною ристовуютьсяв даному описі, наведені нижче. кислотою або з органічною кислотою. Метал в Вираз "С1-С6" і тому подібне вказує, що замісцьому випадку включає лужні метали, такі як наник, що з'являється після виразу, має від 1 до 6 трій і калій, і лужноземельні метали, такі як магній і атомів вуглецю у випадку "С1-С6". кальцій. Органічна основа включає триетиламін і Атом галогену відноситься до атома фтору, діізопропіламін. Мінеральна кислота включає хлоатома хлору, атома брому або атома йоду. ристоводневу кислоту, бромистоводневу кислоту, С1-С3алкілгрупа відноситься, якщо не визнасірчану кислоту і тому подібне. Органічна кислота чено іншим чином, до лінійної або розгалуженої включає оцтову кислоту, метансульфонову кислоалкілгрупи, що має від 1 до 3 атомів вуглецю, і ту, паратолуолсульфонову кислоту і тому подібне. приклади її включають метилгрупу, етилгр упу, нНайкращий варіант здійснення винаходу пропілгрупу, ізопропілгрупу і тому подібне. Далі, типові приклади похідних піразолу, предС1-С6алкілгрупа відноситься, якщо не визнаставлених загальною формулою [1], або їх солей чено іншим чином, до лінійної або розгалуженої (сполуки за винаходом) показані в таблицях з 1 по алкілгрупи, що має від 1 до 6 атомів вуглецю, і 11. Однак сполуки за даним винаходом не обмеприклади її включають метилгрупу, етилгр упу, нжуються приведеними прикладами. пропілгрупу, ізопропілгрупу, н-бутилгр упу, ізобутиНаступні позначення в таблицях в даному лгруп у, втор-бутилгр упу, трет-бутилгруп у, нописі представляють відповідні групи, як показано пентилгрупу, ізопентилгрупу, неопентилгрупу, ннижче. гексилгрупу, ізогексилгрупу, 3,3Me: метилгр упа диметилбутилгруп у і тому подібне. Et: етилгр упа С1-С3галогеналкілгрупа відноситься, якщо не Рг-n: н-пропілгрупа визначено іншим чином, до лінійної або розгалуPr-і: ізопропілгрупа женої алкілгрупи, що має від 1 до 3 атомів вуглеBu-n: н-бутилгр упа цю, які заміщені 1-7 атомами галогену, які є однаBu-і: ізобутилгрупа ковими або відмінними одна від одної, і приклади Bu-s: втор-бутилгр упа її включають фторметилгруп у, хлорметилгрупу, Bu-t: трет-бутилгрупа бромметилгрупу, дифторметилгрупу, три фтормеPen-n: н-пентилгрупа тилгруп у, ди хлорфторметилгрупу, хлордифтормеHex-n: н-гексилгрупа тилгруп у, 2,2-ди фторетилгруп у, 2,2,2Коли сполука за даним винаходом містить гідтрифторетилгр упу, пентафторетилгр упу, 1-фтор-1роксильну групу як замісник, можуть існувати спометил етилгрупу, 1-трифторметил-2,2,2луки, що мають кето-енольні таутомери. Будь-які трифторетилгр упу і тому подібне. таутомери і будь-які їх суміші включені в сполуки С -С алкілсульфонілоксигрупа відноситься до 1 4 9 за даним винаходом. 79483 10 11 79483 12 13 79483 14 до 1 еквівалента сполуки, представленої загальною формулою [1]. Приклади розчинника включають простий ефір, такий як діоксан, тетрагідрофуран і диметоксіетан; галогеновані вуглеводні, такі як дихлоретан, тетра хлорид вуглецю, хлорбензол і дихлорбензол; аміди, такі як Ν,Ν-диметилацетамід, Ν,Νдиметилформамід і N-метил-2-піролідинон; сполуки сірки, такі як диметилсульфоксид і сульфолан; ароматичні вуглеводні, такі як бензол, толуол і ксилол; спирти, такі як метанол, етанол, нпропанол, 2-пропанол, н-бутанол і 2-метил-2пропанол; карбонові кислоти, такі як мурашина кислота і оцтова кислота; воду; і їх суміші. Кількість розчинника, яка повинна бути використана, знаходиться в співвідношенні від 0,1 до 20 літрів, переважно від 0,1 до 5 літрів, розчинника на 1моль сполуки, представленої загальною формулою [1]. Приклади кислотного каталізатора включають мінеральні кислоти, такі як хлористоводнева кислота, бромистоводнева кислота і сірчана кислота; і органічні кислоти, такі як мурашина кислота, оцтова кислота, метансульфонова кислота і паратолуолсульфонова кислота. Сполуки за винаходом, представлені загальною формулою [1], можуть бути отримані, наприклад, наступними способами отримання, але спосіб отримання їх не обмежується такими способами. Далі буде описаний кожний з способів отримання детально. де R1 і R2 мають ті ж значення, які вказані вище, R5 означає С 1-С3алкілгрупу, фенілгруп у, яка може бути заміщена, або бензилгрупу, яка може бути заміщена, і R6 означає С1-С3алкілгрупу. (Стадія 1) Сполука, представлена загальною формулою [3], може бути отримана при взаємодії сполуки, представленої загальною формулою [1], із сполукою, представленою загальною формулою [2], в розчиннику або за відсутності розчинника (переважно у відповідному розчиннику) в присутності кислотного каталізатора або без нього. Що стосується температури реакції, всі реакції проводять при температурі від -50°С до температури кипіння реакційної суміші, переважно в температурних межах від -20°С до 100°С, і реакція може бути завершена протягом періоду від 0,5 години до 72 годин, хоч період змінюється в залежності від сполук. Що стосується кількостей реагентів, які повинні бути використані в реакції, кількість сполуки, представленої загальною формулою [2], дорівнює 1-3 еквівалентам і, коли кислотний каталізатор використовують, кількість кислотного каталізатора дорівнює 0,01-2 еквівалентам, всі по відношенню де R1, R2, R4 і R6 мають ті ж значення, які вказані вище, і L1 означає відхідн у гр уп у, яка є більш реакційноздатною, ніж атом галогену, що залишається після галогеналкілування, і являє собою атом галогену, С1-С3алкілсульфонілоксигрупу, С1С3галогеналкілсульфонілоксигрупу, феніл сульфонілоксигрупу, яка може бути заміщена, бензилсульфонілоксигрупу, яка може бути заміщена, або тому подібне, наприклад, вона являє собою атом хлору або атом брому, коли R4 означає групу CHF2, і являє собою атом хлору, атом брому, атом йоду, паратолуолсульфонілоксигрупу, три фторметансульфонілоксигрупу, метансульфонілоксигрупу або тому подібне, коли R4 означає групу CH2CF 3. (Стадія 2) Сполука, представлена загальною формулою [6], може бути отримана при взаємодії сполуки, представленої загальною формулою [4], із сполукою, представленою загальною формулою [5], в розчиннику або за відсутності розчинника (переважно у відповідному розчиннику) в присутності каталізатора або без нього в присутності основи. Що стосується температури реакції, всі реакції проводять при температурі від 0°С до температури кипіння реакційної суміші, переважно в температурних межах від 0°С до 100°С, і реакція може бути завершена протягом періоду від 0,5 години до 24 годин, хоч період змінюється в залежності від сполук. Що стосується кількостей реагентів, які повинні бути використані в реакції, кількість сполуки, представленої загальною формулою [5], дорівнює 1-5 еквівалентам, переважно 1-3 еквівалентам, кількість основи дорівнює 1-20 еквівалентам, переважно 1-10 еквівалентам, і кількість каталізато 15 79483 16 ра дорівнює 0,01-2,0 еквівалентам, переважно ватися в залежності від умов реакції. 0,01-0,5 еквівалентам, всі по відношенню до 1 екПриклади розчинника включають прості ефіри, вівалента сполуки, представленої загальною фотакий як діоксан і тетрагідрофуран; галогеновані рмулою [4]. вуглеводні, такі як 1,2-дихлоретан, тетрахлорид Приклади основ включають карбонати лужних вуглецю, хлорбензол і дихлорбензол; аміди, такі металів, такі як карбонат натрію і карбонат калію; як Ν,Ν-диметилацетамід, Ν,Ν-диметилформамід і гідрокарбонати лужних металів, такі як гідрокарбоN-метил-2-піролідинон; сполуки сірки, такі як динат натрію і гідрокарбонат калію; гідроксиди лужметилсульфоксид і сульфолан; ароматичні вуглених металів, такі як гідроксид натрію і гідроксид водні, такі як бензол, толуол і ксилол; нітрили, такі калію; гідриди лужних металів, такі як гідрид калію як ацетонітрил, і їх суміші. Кількість розчинника, і гідрид натрію; алкоголяти лужних металів, такі як яка повинна бути використана, знаходиться в співетоксид натрію і метоксид натрію; і органічні основідношенні від 0,1 до 20 літрів, переважно від 0,1 ви, такі як 1,8-діазабіцикло[5,4,0]-7-ундецен, тридо 5 літрів, розчинника на 1моль сполуки, предетиламін і піридин. ставленої загальною формулою [4]. Приклади розчинника включають простий Приклади азосполуки [8] включають діетилаефір, такий як діоксан, тетрагідрофуран і 1,2зодикарбоксилат, діізопропілазодикарбоксилат і диметоксіетан; галогеновані вугле водні, такі як тому подібне. дихлоретан, тетрахлорид вуглецю, хлорбензол і дихлорбензол; аміди, такі як Ν,Νдиметилацетамід, Ν,Ν-диметилформамід і Nметил-2-піролідинон; сполуки сірки, такі як диметилсульфоксид і сульфолан; ароматичні вуглеводні, такі як бензол, толуол і ксилол; спирти, такі як метанол, етанол, н-пропанол, 2-пропанол, нде R1, R2 і R4 мають ті ж значення, які вказані бутанол і 2-метил-2-пропанол; кетон, такий як ацевище, R7 і R8, кожний, означають атом водню або тон і метилетилкетон; нітрили, такі як ацетонітрил; С1-С3алкілгруну і X означає атом галогену. воду; і їх суміші. Кількість розчинника, яка повинна (Стадія 4) бути використана, знаходиться в співвідношенні Сполука, представлена загальною формулою від 0,1 до 20 літрів, переважно від 0,1 до 5 літрів, [10], може бути отримана при взаємодії сполуки, розчинника на 1моль сполуки, представленої запредставленої загальною формулою [9], з агентом гальною формулою [4]. галогенування в розчиннику в присутності каталіПриклади каталізатора включають прості кразатора або без нього. На цій стадії реакція може ун-ефіри, такі як 18-краун-6 і 15-краун-5; солі четбути проведена при опроміненні світлом. Крім товертинного амонію, такі як бромід тетра-нго, щоб улови ти кислоту, що утворюється як побічбутиламонію і бромід бензилтриметиламонію, і ний продукт, реакція може бути проведена в присолі четвертинного фосфонію, такі як бромід тетсутності основи. ра-н-бутилфосфонію. Цю реакцію проводять звичайно при темпера турі реакції від 20 до 150°С протягом часу від 10 хвилин до 48 годин. Що стосується кількостей реагентів, які повинні бути використані в реакції, кількість агента галогенування бажана 1-10 еквівалентів по відношенню до 1 еквівалента сполуки, представленої загальною формулою [9], але кількості можуть необов'язково змінюватися в залежності від умов реакції. Кількість каталізатора дорівнює 0,01-3,0 де R1, R2, R4 і R6 мають ті ж значення, які вкаеквівалентам, переважно 0,01-1,5 еквіваленти. зані вище. Приклади агента галогенування включають (Стадія 3) галогени, такі як бром і хлор; NСполука, представлена загальною формулою галогенсукциніміди, такі як N-бромсукцинімід і N[6], може бути отримана при взаємодії сполуки, хлорсукцинімід; солі піридину, такі як пербромід представленої загальною формулою [4], із сполупіридинію; сульфурилхлорид, 1,3-бром-5,6кою, представленою загальною формулою [7], в диметилгидантоїн і тому подібне. присутності азосполуки [8] і трифенілфосфіну в Приклади розчинника включають галогеновані розчиннику відповідно до способу, [описаного в вуглеводні, такі як 1,2-дихлоретан, тетрахлорид Synthesis, 1981, 1-28]. вуглецю, хлорбензол, фторбензол і дихлорбензол; Цю реакцію проводять звичайно при темперабензол; карбонові кислоти, такі як мурашина кистурі реакції від -30 до 100°С протягом часу від 10 лота і оцтова кислота; воду; і їх суміші. Кількість хвилин до 24 годин. розчинника, яка повинна бути використана, знахоЩо стосується кількостей реагентів, які повидиться в співвідношенні від 0,1 до 20 літрів, перенні бути використані в реакції, бажано, щоб кільважно від 0,1 до 5 літрів, розчинника на 1моль кість сполуки, представленої загальною формулою сполуки, представленої загальною формулою [9]. [7], була 1-1,5 еквіваленти, кількість азосполуки [8] Приклади каталізатора включають пероксид 1-1,5 еквіваленти і кількість трифенілфосфіну 1-1,5 бензоїлу, розчин пероксиду водню, α,α'еквіваленти, всі по відношенню до 1 еквівалента азобісізобутиронітрил і їх суміші. сполуки, представленої загальною формулою [4], Приклади основ включають гідроксиди лужних але вказані кількості можуть необов'язково зміню 17 79483 18 металів, такі як гідроксид натрію і гідроксид калію; такі як діоксан і тетрагідрофуран; галогеновані карбонати лужних металів, такі як карбонат натрію вуглеводні, такі як дихлоретан, тетрахлорид вугі карбонат калію; гідрокарбонати лужних металів, лецю, хлорбензол і дихлорбензол; ароматичні такі як гідрокарбонат натрію і гідрокарбонат калію, вуглеводні, такі як бензол, толуол і ксилол; аміди, і тому подібне. такі як Ν,Ν-диметилацетамід, Ν,Ν диметилформамід і N-метил-2-піролідинон; сполуки сірки, такі як диметилсульфоксид і сульфолан; нітрили, такі як ацетонітрил; спирти, такі як метанол, етанол і 2-пропанол; кетони, такі як ацетон і метилетилкетон; воду; і їх суміші. Кількість розчинника, яка повинна бути використана, знаходиться в співвідношенні від 0,1 до 20 літрів, переважно від 0,1 до 5 літрів, розчинника на 1моль сполуки, представленої загальною формулою [12]. Приклади основ включають карбонати лужних металів, такі як карбонат натрію і карбонат калію; гідроксиди лужних металів, такі як гідроксид натрію і гідроксид калію; гідрокарбонати лужних металів, такі як гідрокарбонат натрію і гідрокарбонат калію; алкоголяти лужних металів, такі як етоксид 1 2 4 7 8 натрію і метоксид натрію, і органічні основи, такі як де R , R , R , R , R і X мають ті ж значення, які 1,8-діазабіцикло[5,4,0]-7-ундецен. вказані вище. Приклади відновника включають боргідрид на(Стадія 5) трію і тому подібне. Сполука, представлена загальною формулою Приклади інертного газу включають азот, ар[12], може бути отримана при взаємодії сполуки, гон і тому подібне. представленої загальною формулою [10], із сполу(Стадія 7) кою, представленою загальною формулою [11], Сполука, представлена загальною формулою (тіосечовина) в розчиннику. [13], може бути отримана при взаємодії сполуки, Що стосується кількостей реагентів, які повипредставленої загальною формулою [10], з сульнні бути використані, кількість сполуки, представфідом в розчиннику в присутності основи або без леної загальною формулою [11], бажана від 1 до неї. На цій стадії сполука може бути отримана в 1,5 еквівалентів по відношенню до 1 еквівалента присутності відновника або без нього або в потоці сполуки загальної формули [10], але вона може інертного газу. Більш того сполука, представлена необов'язково змінюватися в залежності від умов загальною формулою [13], може бути використана реакції. в наступній реакції без виділення і очищення. Приклади розчинника включають прості ефіри, Що стосується кількостей реагентів, які повитакі як діоксан і тетрагідрофуран; галогеновані нні бути використані, бажано, щоб кількість сульвуглеводні, такі як дихлоретан, тетрахлорид вугфіду була 1-5 еквівалентів і кількість основи бажалецю, хлорбензол і дихлорбензол; ароматичні но 1-10 еквівалентів, всі по відношенню до 1 вуглеводні, такі як бензол, толуол і ксилол; аміди, еквівалента сполуки загальної формули [10], але такі як Ν,Ν-диметилацетамід, Ν,Νце може необов'язково змінюватися в залежності диметилформамід і N-метил-2-піролідинон; спирвід умов реакції. ти, такі як метанол, етанол і 2-пропанол; нітрили, Приклади розчинника включають прості ефіри, такі як ацетонітрил; кетони, такі як ацетон і метилтакі як діоксан і тетрагідрофуран; галогеновані етилкетон; воду; і їх суміші. Кількість розчинника, вуглеводні, такі як дихлоретан, тетрахлорид вугяка повинна бути використана, знаходиться в співлецю, хлорбензол і дихлорбензол; ароматичні відношенні від 0,1 до 20 літрів, переважно від 0,1 вуглеводні, такі як бензол, толуол і ксилол; аміди, до 5 літрів, розчинника на 1моль сполуки, предтакі як Ν,Ν-диметилацетамід, Ν,Νставленої загальною формулою [10]. диметилформамід і N-метил-2-піролідинон; сполу(Стадія 6) ки сірки, такі як диметилсульфоксид і сульфолан; Сполука, представлена загальною формулою нітрили, такі як ацетонітрил; спирти, такі як мета[13], може бути отримана гідролізом сполуки, нол, етанол і 2-пропанол; кетони, такі як ацетон і представленої загальною формулою [12], в розметилетилкетон; воду; і їх суміші. Кількість розчиннику в присутності основи або без неї. На цій чинника, яка повинна бути використана, знахостадії сполука може бути отримана в присутності диться в співвідношенні від 0,1 до 20 літрів, перевідновника або без нього або в потоці інертного важно від 0,1 до 5 літрів, розчинника на 1моль газу. Більш того сполука, представлена загальною сполуки, представленої загальною формулою [10]. формулою [13], може бути використана в наступПриклади сульфіду включають сульфіди луж ній реакції без виділення і очищення. них металів, такі як сульфід натрію і сульфід каЩо стосується кількостей реагентів, які повилію; гідросульфіди лужних металів, такі як гідронні бути використані, кількість основи бажана 1-10 сульфід натрію і гідросульфід калію; сульфід еквівалентів по відношенню до 1 еквівалента споводню, сульфід амонію, тіоацетат натрію, тіоацелуки загальної формули [12], але вона може нетат калію і тому подібне. обов'язково змінюватися в залежності від умов Приклади основ включають карбонати лужних реакції. металів, такі як карбонат натрію і карбонат калію; Приклади розчинника включають прості ефіри, 19 79483 20 гідроксиди лужних металів, такі як гідроксид на(Стадія 9) трію і гідроксид калію; гідриди лужних металів, такі Сполука, представлена загальною формулою як гідрид калію і гідрид натрію; алкоголяти лужних [17], може бути отримана при взаємодії сполуки, металів, такі як етоксид натрію і метоксид натрію, і представленої загальною формулою [16], із сполуорганічні основи, такі як 1,8-діазабіцикло[5,4,0]-7кою, представленою загальною формулою [5], в ундецен. розчиннику або без розчинника (переважно у відЯк відновник і інертний газ можуть бути назваповідному розчиннику), в присутності каталізатора ні ті ж, що і на стадії 6 способу отримання 5. або без нього, в присутності основи. Що стосується температури реакції, всі реакції проводять при температурі від 0°С до температури кипіння реакційної суміші, переважно в температурних межах від 0°С до 100°С, і реакція може бути проведена протягом періоду від 0,5 години до 24 годин, хоч період змінюється в залежності від сполук. де R1 і R2 мають ті ж значення, які вказані виЩо стосується кількостей реагентів, які повище. (Стадія 8) нні бути використані в реакції, кількість сполуки, Сполука, представлена загальною формулою представленої загальною формулою [5], дорівнює [15], може бути отримана при взаємодії сполуки, 1-5 еквівалентам, переважно 1-3 еквівалентам, представленої загальною формулою [14], з Ν,Νкількість основи дорівнює 1-20 еквівалентам, педиметилформамідом в розчиннику або без розреважно 1-10 еквівалентам, і кількість каталізаточинника в присутності фосфорилхлориду, фосгену ра дорівнює 0,01-2,0 еквівалентам, переважно або тіонілхлориду відповідно до способу Vilsmeier, 0,01-0,5 еквіваленти, всі по відношенню до 1 екві[описаного в Org. Synth., Vol.IV, 831 (1963)], або валента сполуки, представленої загальною форпри взаємодії сполуки, представленої загальною мулою [16]. формулою [14], з дигалогенметиловим простим Як розчинник, основа і каталізатор можуть буефіром в розчиннику в присутності кислоти Льюїса ти згадані ті ж, що і на стадії 2 способу отриманз подальшим гідролізом відповідно до способу, ня 2. [описаного в Chem. Ber, 93, 88 (1960)]. Цю реакцію звичайно проводять при температурі від -40 до 150°С протягом часу від 10 хвилин до 24 годин. Що стосується кількостей реагентів, які повинні бути використані в реакції, бажано, щоб кількість фосфорилхлориду, фосгену, тіонілхлориду, Ν,Ν-диметилформаміду, кислоти Льюїса або дигаде R1, R2, R4 і X мають ті ж значення, які вкалогенметилового простого ефіру була 1-1,5 еквізані вище. валенти по відношенню до 1 еквівалента сполуки (Стадія 10) загальної формули [14], але кількість може необоСполука, представлена загальною формулою в'язково змінюватися в залежності від умов реак[19], може бути отримана при взаємодії сполуки, ції. представленої загальною формулою [18], з галоПриклади кислоти Льюїса включають тетрахгенідом водню і формальдегідом або параформалорид титану, тетра хлорид олова, хлорид цинку, льдегідом в розчиннику в присутності кислоти хлорид алюмінію, бромід цинку і тому подібне. Льюїса або без неї відповідно до способу, [описаПриклади дигалогенметилового простого ефіного в Org. Synth., Vol.Ill, 557 (1955) або в J. Amer. ру включають дихлорметиловий простий ефір і Chem. Soc, 72, 2216 (1950)], або при взаємодії тому подібне. сполуки, представленої загальною формулою [18], Приклади розчинника включають галогеновані з галогенметиловим простим ефіром в розчиннику вуглеводні, такі як дихлоретан, тетрахлорид вугабо без розчинника в присутності кислоти Льюїса лецю і хлороформ; аліфатичні вуглеводні, такі як відповідно до способу, [описаного в J. Amer. Chem. гексан і гептан; простий ефір, такий як діоксан і Soc, 97, 6155 (1975)]. тетрагідрофуран; карбонові кислоти, такі як оцтова Цю реакцію проводять звичайно при темперакислота; аміди, такі як Ν,Ν-диметилформамід; дитурі від -40 до 150°С протягом часу від 10 хвилин сульфід вуглецю, і їх суміші. Кількість розчинника, до 24 годин. яка повинна бути використана, знаходиться в співЩо стосується кількостей реагентів, що виковідношенні від 0,1 до 20 літрів, переважно від 0,2 ристовуються, бажано, щоб кількість галогеніду до 5 літрів, розчинника на 1моль сполуки, предводню була від 1 до 2 еквівалентів, кількість форставленої загальною формулою [14]. мальдегіду або параформальдегіду від 1 до 2 ек вівалентів, кількість кислоти Льюїса від 1 до 2 еквівалентів і кількість галогенметилового простого ефіру була від 1 до 2 еквівалентів, всі по відношенню до 1 еквівалента сполуки загальної формули [18]. Однак вказані кількості можуть необов'язково змінюватися в залежності від умов реакції. Приклади кислоти Льюїса включають тетрахде R1, R2, R4 і L1 мають ті ж значення, які вкалорид титану, хлорид цинку, хлорид алюмінію, зані вище. бромід цинку і тому подібне. 21 79483 22 Приклади галогеніду водню включають хлорид водою і сушать над безводним сульфатом магнію. водню, бромід водню і йодид водню. Розчинник видаляють випарюванням при знижеПриклади галогенметилового простого ефіру ному тиску, і залишок переганяють при зниженому включають хлорметилметиловий простий ефір, тиску, отримуючи 38,2г (ви хід: 58,4%) 1-третбромметилметиловий простий ефір і тому подібне. бутил-5-(2,2-дифторетокси)-3-трифторметил-1НПриклади розчинника включають галогеновані піразолу. вуглеводні, такі як дихлоретан, тетрахлорид вугТемпература кипіння: від 98 до 100°С/6кПа лецю і хлороформу; аліфатичні вуглеводні, такі як (45ммHg) гексан і гептан; прості ефіри, такі як діоксан і тетПоказник заломлення (nD20): 1,3921 1 рагідрофуран; карбонові кислоти, такі як оцтова Н-ЯМР (CDCI3/TMS δ (м. ч.)): 6,10 (1Н, тт, кислота; дисульфід вуглецю і їх суміші. Кількість J=3,8, 54,5Гц), 5,84 (1Н, с), 4,25 (2H, дт, J=3,8, розчинника, яка повинна бути використана, знахо13,0Гц), 1,60 (9Н, с). диться в співвідношенні від 0,1 до 20 літрів, переПриклад 3 важно від 0,1 до 5 літрів, розчинника на 1моль Отримання 1-трет-бутил-4-хлорметил-5-Г2,2сполуки, представленої загальною формулою [18]. дифторетокси)-3-трифторметил-1Н-піразолу (СпоУ зв'язку з цим, сполука, представлена загалука за винаходом №141) льною формулою [18], може бути отримана переДо розчину 13,6г (50,0ммоль) 1-трет-бутил-5творенням атома водню відповідної сполуки, де R 4 (2,2-дифторетокси)-3-трифторметил-1Н-піразолу в означає атом водню, в R4 відповідно до способу 50мл оцтової кислоти додають 5,0г (чистота: 90%, отримання 2 або 3. 150,0ммоль) параформальдегіду і 20,5г Далі йде пояснення способів отримання спо(150,0ммоль) хлориду цинку при кімнатній темпелук за винаходом конкретно. Представлені також ратурі з подальшим перемішуванням. Крім того, фізичні властивості сполук за винаходом, отриманадмірну кількість хлориду водню вводять в реакних у відповідних прикладах або отриманих відпоційний розчин при охолоджуванні льодом, потім відно до відповідних прикладів. Приклади привеперемішують протягом 1 години. Після підтвердені. дження про завершення реакції реакційний розчин Приклад 1 виливають у воду і екстрагують діетиловим просОтримання 1-трет-бутил-5-дифторметокси-3тим ефіром. Отриманий органічний шар промиватрифторметил-1Н-піразолу (Сполука за винаходом ють водою і сушать над безводним сульфатом №021) магнію. Розчинник видаляють випарюванням при До розчину 10,4г (50,0ммоль) 1-трет-бутил-5зниженому тиску і проводять аналіз газовою хрогідрокси-3-трифторметил-1Н-піразолу в 50мл Ν,Νматографією, отримуючи підтвердження про утводиметилформаміду додають 7,6г (55,0ммоль) безрення 1-трет-бутил-4-хлорметил-5-(2,2водного карбонату калію при кімнатній температудифторетокси)-3-трифторметил-1Н-піразолу у рі. При перемішуванні реакційного розчину в нього кількості 50,1%. вводять надмірну кількість хлордифторметану при Приклад 4 80°С. Після підтвердження про зникнення вихідноОтримання 5-гідрокси-1-метил-3го матеріалу, введення хлордифторметану припитрифторметил-1Н-піразол-4-карбальдегіду няють, і реакційний розчин охолоджують до кімна(Сполука за винаходом №281) тної температури. Після цього реакційний розчин До 16,6г (100,0ммоль) 5-гідрокси-1-метил-3виливають у воду і екстрагують діізопропіловим трифторметил-1Н-піразолу в 15,4г Ν,Νпростим ефіром. Отриманий органічний шар продиметилформальдегіду додають 16,2г мивають водою і сушать над безводним сульфа(105,0ммоль) оксихлориду фосфору при 0°С, потім том магнію. Розчинник видаляють випарюванням перемішують протягом 1 години при кімнатній тепри зниженому тиску, і залишок переганяють при мпературі. Крім того, все перемішують при 100°С зниженому тиску, отримуючи 10,8г (вихід: 83,7%) протягом 1 години. Після підтвердження про заве1-трет-бутил-5-дифторметокси-3-трифторметилршення реакції реакційний розчин виливають у 1Н-піразолу у вигляді жовтої рідини. воду і рН доводять до 10 або більше 25% розчи1 H-ЯМР (CDCI3/TMS δ (м. ч.)): 6,53 (1Н, т, ном гідроксиду натрію і потім водний шар промиJ=71,9Гц), 6,14 (1Н, с), 1,63 (9Н, с)ю вають етилацетатом. рН отриманого водного шару Приклад 2 доводять до біля 4 насиченим розчином лимонної Отримання 1-трет-бутил-5-(2,2-дифторетокси)кислоти і потім екстрагують діетиловим простим 3-трифторметил-1Н-піразолу ефіром. Отриманий органічний шар промивають (Сполука за винаходом №022) водою і насиченим сольовим розчином послідовно До розчину 50,0г (240,2ммоль) 1-трет-бутил-5і потім сушать над безводним сульфатом магнію. гідрокси-3-трифторметил-1Н-піразолу в 1000мл Розчинник видаляють випарюванням при знижететрагідрофурану додають 75,6г (288,2ммоль) ному тиску, і залишок очищають колонковою хротрифенілфосфіну і 23,7г (288,8ммоль) 2,2матографією на силікагелі, отримуючи 4,5г (вихід: дифторетанолу при кімнатній температурі з пода23,2%) 5-гідрокси-1-метил-3-трифторметил-1Нльшим перемішуванням. При охолоджуванні льопіразол-4-карбальдегіду. дом 58,3г (288,3ммоль) діізопропілазодикарбоксиПриклад 5 лату додають в реакційний розчин з подальшим 5Отримання 5-дифторметокси-1-метил-3годинним перемішуванням. Після підтвердження трифторметил-1Н-піразол-4-карбальдегіду про завершення реакції реакційний розчин вили(Сполука за винаходом №026) вають у воду і екстрагують діетиловим простим До 1,7г (8,8ммоль) 5-гідрокси-1-метил-3ефіром. Отриманий органічний шар промивають трифторметил-1Н-піразолу в 20мл тетрагідрофу 23 79483 24 рану додають 2,5г (43,8ммоль) порошкоподібного Розчинник видаляють випарюванням при знижегідроксиду калію і 0,14г (0,44ммоль) броміду тетному тиску, і залишок переганяють, отримуючи рабутиламонію при кімнатній температурі з пода88,9г (вихід: 88,5%) 5-дифторметокси-1,4-диметилльшим перемішуванням. Крім того, хлордифтор3-трифторметил-1Н-піразолу у вигляді безбарвної метан вводять в реакційний розчин доти, поки прозорої рідини. 1 реакційна система не насититься ним. Після цього Н-ЯМР (CDCI3/TMS δ (м. ч.)): 6,52 (1Н, т, все перемішують при кімнатній температуріпротяJ=71,5Гц), 3,78 (3Н, с), 2,07 (3Н, с). гом ночі. Після підтвердження про завершення Температура кипіння: 98-100°С/6кПа (45мм реакції реакційний розчин виливають у воду і екстHg). рагують діетиловим простим ефіром. Отриманий Показник заломлення (nD20): 1,3921. органічний шар промивають водою і насиченим Приклад 8 сольовим розчином послідовно і потім сушать над Отримання 4-бромметил-5-дифторметокси-1безводним сульфатом магнію. Розчинник видаляметил-3-трифторметил-1Н-піразолу (Сполука за ють випарюванням при зниженому тиску і прововинаходом №151) дять аналіз газовою хроматографією, отримуючи До розчину 11,5г (50,0ммоль) 5підтвердження про утворення 5-дифторметокси-1дифторметокси-1,4-диметил-3-трифторметил-1Нметил-3-трифторметил1Н-піразол-4піразолу в 50мл тетрахлориду вуглецю додають карбальдегіду в кількості 8,8%. 9,8г (55,0ммоль) N-бромсукциніміду і 0,41г Приклад 6 (2,5ммоль) α,α'-азобісізобутиронітрилу з подальОтримання 1,4-диметил-5-гідрокси-3шим нагріванням і кип'ятінням із зворотним холотрифторметил-1Н-піразолу (Сполука за винаходом дильником при перемішуванні. Реакційний розчин №036) піддають опроміненню світлом з використанням До розчину 20,9г (454,2ммоль) метилгідразину зовнішнього джерела протягом 1 години. Після в 500мл етанолу додають по краплях при переміпідтвердження про завершення реакції реакційний шуванні 90,0г (454,2ммоль) етил-4,4,4-трифтор-2розчин виливають у воду і екстрагують хлороформетил-3-оксобутаноату при охолоджуванні льодом мом. Отриманий органічний шар промивають вотак, щоб температура не перевищувала 10°С. Пісдою і насиченим сольовим розчином послідовно і ля завершення додання по краплях все переміпотім сушать над безводним сульфатом магнію. шують при кімнатній температурі протягом 30 хвиРозчинник видаляють випарюванням при знижелин. Потім 10мл концентрованої хлористоводневої ному тиску, отримуючи 17,8г (чистота: 72,0%, викислоти додають в реакційний розчин і перемішухід: 82,7%) 4-бромметил-5-дифторметокси-1ють протягом 2 діб при кип'ятінні із зворотним хометил-3 -трифторметил-1Н-піразолу. 1 лодильником. Після підтвердження про завершенН-ЯМР (CDCI3/TMS δ (м. ч.)): 6,73 (1Н, т, ня реакції розчинник видаляють випарюванням J=71,5Гц), 4,39 (2Н, с), 3,82 (3Н, д). при зниженому тиску. До залишку додають воду, Показник заломлення (nD20): 1,4401. потім екстрагують етилацетатом. Отриманий оргаПриклад 9 нічний шар промивають водою і насиченим сольоОтримання 4-бромметил-5-дифторметокси-1вим розчином послідовно і потім сушать над безметил-3-трифторметил-1Н-піразолу (Сполука за водним сульфатом магнію. Розчинник видаляють винаходом №151) випарюванням при зниженому тиску, і залишок До розчину 0,50г (2,17ммоль) 5промивають н-гексаном, отримуючи 61,0г (вихід: дифторметокси-1,4-диметил-3-трифторметил-1Н74,6%) 1,4-диметил-5-гідрокси-3-трифторметилпіразолу в 5мл тетрахлориду вуглецю додають 1Н-піразолу у ви гляді білих кристалів (температу0,90г (5,64ммоль) брому і невелику кількість перора плавлення: 148-151°С). ксиду бензоїлу з подальшим нагріванням і кип'я 1 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 3,70 (3Н, д), 1,99 тінням із зворотним холодильником при перемішу(3Н, д). ванні. Реакційний розчин піддають опроміненню Температура плавлення: 148-151°С. світлом з використанням зовнішнього джерела Приклад 7 протягом 2 годин і 30 хвилин. Після завершення Отримання 5-дифторметокси-1,4-диметил-3реакції проводять аналіз газовою хроматографією, трифторметил-1Н-піразолу (Сполука за винаходом отримуючи підтвердження про утворення 4№076) бромметил-5-дифторметокси-1-метил-3У 78,6г (436,4ммоль) 1,4-диметил-5-гідрокси-3трифторметил-1Н-піразолу в кількості 80,2%. трифторметил-1Н-піразолу в 500мл 2-пропанолу Приклад 10 додають 153,1г (2728,6ммоль) порошкоподібного Отримання гідроброміду 2-(5-дифторметоксигідроксиду калію при кімнатній температурі з пода1-метил-3-трифторметил-1Н-піразол-4льшим перемішуванням. Крім того, надмірну кільілметил)ізотіосечовини (Сполука за винаходом кість хлордифторметану вводять в реакційний №197) розчин при перемішуванні. Після цього температуДо розчину 19,1г (чистота: 75,0%, 46,3ммоль) ра реакції відразу підвищується до 70°С за раху4-бромметил-5-дифторметокси-1-метил-3нок екзотермічного тепла і потім повертається до трифторметил-1Н-піразолу в 30мл етанолу додакімнатної температури через 2 години. Після підють 3,5г (46,3ммоль) тіосечовини, потім протягом 1 твердження про завершення реакції реакційний години нагрівають і кип'ятять із зворотним холодирозчин виливають у воду і екстрагують етилацетальником при перемішуванні. Розчинник видаляють том. Отриманий органічний шар промивають вовипарюванням при зниженому тиску, і залишок дою і насиченим сольовим розчином послідовно і промивають змішаним розчинником з етилацетату потім сушать над безводним сульфатом магнію. і н-гексану, отримуючи 13,8г (вихід: 77,5%) гідро 25 79483 26 броміду 2-(5-дифторметокси-1-метил-3J=71,5Гц), 4,51 (2Н, с), 3,82 (3Н, с). трифторметил-1Н-піразол-4Показник заломлення (nD20): 1,4157. ілметил)ізотіосечовини у вигляді білих кристалів Приклад 14 (температура плавлення: 130-131°С). Отримання 4-хлорметил-5-дифторметокси-11 Н-ЯМР (CDCl3+DMSO-d6/TMS δ (м. ч.)): 9,21 метил-3-трифторметил-1Н-піразолу (Сполука за (2Н, шир.), 9,12 (2Н, шир.), 6,92 (1H, т, J=71,2Гц), винаходом №123) 4,40 (2H, с), 3,83 (3Н, с). До розчину 1,00г (4,35ммоль) 5Приклад 11 дифторметокси-1,4-диметил-3-трифторметил-1НОтримання (5-дифторметокси-1-метил-3піразолу в 10мл тетрахлориду вуглецю додають трифторметил-1Н-піразол-4-іл)метантіолу (Сполу0,55г (6,52ммоль) гідрокарбонату натрію з подака за винаходом №216) льшим нагріванням і кип'ятінням із зворотним хоДо розчину 1,00г (2,60ммоль) гідроброміду 2лодильником при перемішуванні. Реакційний роз(5-дифторметокси-1-метил-3-трифторметил-1Нчин опромінюють з поверхні світлом і газоподібний піразол-4-ілметил) ізотіосечовини в 2мл Ν,Νхлор вводять у відповідній кількості, в той час як диметилформаміду додають 0,43г (3,12ммоль) кількість цільової сполуки, що утворилася, підтвебезводного карбонату калію і 1мл води з подальрджують газовою хроматографією. Після завершим перемішуванням протягом 1 години при кімшення реакції проводять аналіз газовою хроматогнатній температурі. Після підтвердження про зарафією, отримуючи підтвердження про утворення вершення реакції реакційний розчин виливають у 4-хлорметил-5-дифторметокси-1-метил-3воду і екстрагують діетиловим простим ефіром. трифторметил-1Н-піразолу в кількості 61,7%. Отриманий органічний шар промивають водою і Приклад 15 потім сушать над безводним сульфатом магнію. Отримання гідро хлориду 2-(5-дифторметоксиРозчинник видаляють випарюванням при зниже1-метил-3-трифторметил-1Н-піразол-4ному тиску, отримуючи 0,66г (чистота: 84,9%, виілметил)ізотіосечовини (Сполука за винаходом хід: 82,4%) (5-дифторметокси-1-метил-3№178) трифторметил-1Н-піразол-4-іл)метантіолу. До розчину 3,7г (чистота: 83,4%, 11,7ммоль) 41 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 6,72 (1Н, т, хлорметил-5-дифторметокси-1-метил-3J=71,7Гц), 3,81 (3Н, с), 3,63 (2Н, с), 3,20 (1Н, шир.). трифторметил-1Н-піразолу в 20мл етанолу додаПриклад 12 ють 0,8г (11,1ммоль) тіосечовини з подальшим Отримання (5-дифторметокси-1-метил-3перемішуванням при кімнатній температурі протятрифторметил-1Н-піразол-4-іл)метантіолу (Сполугом ночі і додатковим нагріванням і перемішуванка за винаходом №216) ням при 50°С протягом 1 години. Розчинник видаДо розчину 1,55г (5,00ммоль) 4-бромметил-5ляють випарюванням при зниженому тиску, і дифторметокси-1-метил-3-трифторметил-1Нзалишок промивають н-гексаном, отримуючи 3,8г піразолу в 10мл етанолу додають 0,48г (чистота: (вихід: 96,4%) гідрохлориду 2-(5-дифторметокси-170,0%, 6,00ммоль) н-гідрату гідросульфіду натрію метил-3-трифторметил-1Н-піразол-4з подальшим перемішуванням протягом 1 години ілметил)ізотіосечовини у вигляді білих кристалів при кімнатній температурі. Після завершення реа(температура плавлення: 117-119°С). кції проводять аналіз газовою хроматографією, Приклад 16 отримуючи підтвердження про утворення (5Отримання 1-етил-5-гідрокси-4-метил-3дифторметокси-1-метил-3-трифторметил-1Нтрифторметил-1Н-піразолу (Сполука за винаходом піразол-4-іл)метантіолу в кількості 40,0%. №037) Приклад 13 До розчину 1,2г (20,0ммоль) етилгідразину в Отримання 4-хлорметил-5-дифторметокси-120мл етанолу додають по краплях при перемішуметил-3-трифторметил-1Н-піразолу (Сполука за ванні 4,4г (20,0ммоль) етил-4,4,4-трифтор-2винаходом №123) метил-3-оксобутаноату при охолоджуванні льодом До розчину 11,5г (50,0ммоль) 5так, щоб температура в реакційній системі не педифторметокси-1,4-диметил-3-трифторметил-1Нревищувала 10°С. Після додання по краплях все піразолу в 50мл тетрахлориду вуглецю додають перемішують при кімнатній температурі протягом 10,1г (75,0ммоль) сульфурилхлориду і 0,8г 30 хвилин. Потім 1мл концентрованої хлористово(5,0ммоль) α,α'-азобісізобутиронітрилу з подальдневої кислоти додають в реакційний розчин і прошим нагріванням і кип'ятінням із зворотним холотягом 2 діб перемішують і кип'ятять із зворотним дильником при перемішуванні. Реакційний розчин холодильником. Після підтвердження про заверзовні опромінюють світлом протягом 11 годин. шення реакції розчинник видаляють випарюванПісля підтвердження про завершення реакції реаням при зниженому тиску. До залишку додають кційний розчин виливають у воду і екстрагують воду, потім екстрагують етилацетатом. Отриманий хлороформом. Отриманий органічний шар промиорганічний шар промивають водою і насиченим вають водою і насиченим сольовим розчином посольовим розчином послідовно і потім сушать над слідовно і потім сушать над безводним сульфатом безводним сульфатом магнію. Розчинник видалямагнію. Розчинник видаляють випарюванням при ють випарюванням при зниженому тиску, і зализниженому тиску, і залишок очищають колонковою шок промивають н-гексаном, отримуючи 2,8г (вихроматографією на силікагелі, отримуючи 4,8г (чихід: 71,8%) 1-етил-5-гідрокси-4-метил-3стота: 83,4%, вихід: 30,3%) 4-хлорметил-5трифторметил-1Н-піразолу у вигляді білих кристадифторметокси-1-метил-3-трифторметил-1Нлів (температура плавлення: 150-152°С). 1 піразолу у вигляді безбарвної прозорої рідини Н-ЯМР (CDCI3/TMS δ (м. ч.)): 6,78 (1Н, шир.), 1 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 6,69 (1Н, т, 4,06 (2Н, кв), 1,98 (3Н, д), 1,37 (3Н, т). 27 79483 28 Приклад 17 вуглецю додають 7,8г (44,0ммоль) NОтримання 5-гідрокси-4-метил-1-ізопропіл-3бромсукциніміду і 0,3 (2,0ммоль) α,α’трифторметил-1Н-піразолу (Сполука за винаходом азобісізобутиронітрилу з подальшим нагріванням і №038) кип'ятінням із зворотним холодильником при пеДо розчину 7,4г (100,0ммоль) ізопропілгідраремішуванні. Реакційний розчин опромінюють з зину в 100мл етанолу додають по краплях при поверхні світлом протягом 1 години. Після підтвеперемішуванні 23,3г (чистота: 85,0%, 100,0ммоль) рдження про завершення реакції реакційний розетил-4,4,4-трифтор-2-метил-3-оксобутаноату при чин виливають у воду і екстрагують хлороформом. охолоджуванні льодом так, щоб температура в Отриманий органічний шар промивають водою і реакційній системі не перевищувала 10°С. Після насиченим сольовим розчином послідовно і потім додання по краплях все перемішують при кімнатсушать над безводним сульфатом магнію. Розній температурі протягом 30 хвилин. Потім 1мл чинник видаляють випарюванням при зниженому концентрованої хлористоводневої кислоти додатиску, і залишок очищають колонковою хроматогють в реакційний розчин і протягом наступних 2 рафією на силікагелі, отримуючи 5,5г (вихід: діб перемішують при кип'ятінні із зворотним холо40,7%) 4-бромметил-5-дифторметоксі-1 -ізопропілдильником. Після підтвердження про завершення 3 -трифторметил-1Н-піразолу. 1 реакції розчинник видаляють випарюванням при Н-ЯМР (CDCI3/TMS δ (м. ч.)): 6,72 (1Н, т, зниженому тиску. До залишку додають воду, а поJ=71,9Гц), 4,62 (1Н, м), 4,40 (2Н, с), 1,47 (6Н, тім екстрагують етилацетатом. Отриманий органід,J=6,8Гц). чний шар промивають водою і насиченим сольоПоказник заломлення (nD20): 1,4383. вим розчином послідовно і потім сушать над Приклад 20 безводним сульфатом магнію. Розчинник видаляОтримання 4-диметил-5-(2,2,2ють випарюванням при зниженому тиску, і залитрифторетокси)-3-трифторметил-1Н-піразолу шок промивають н-гексаном, отримуючи 18,1г (ви(Сполука за винаходом №079) хід: 87,0%) 5-гідрокси-4-метил-1-ізопропіл-3До розчину 4,4г (24,4ммоль) 1,4-диметил-5трифторметил-1Н-піразолу у вигляді білих кристагідрокси-3-трифторметил-1Н-піразолу в 50мл Ν,Νлів (температура плавлення: 150-153°С). диметилформаміду додають 5,1г (36,6ммоль) без1 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 4,58 (1Н, м), водного карбонату калію і 6,3г (26,8ммоль) 2,2,21,98 (3Н, д), 1,44 (6Н, д). трифторетилтрифторметансульфонату, потім проПриклад 18 тягом 3 годин перемішують при кімнатній темпераОтримання 5-дифторметокси-4-метил-1турі. Після підтвердження про завершення реакції ізопропіл-3-трифторметил-1Н-піразолу (Сполука реакційний розчин виливають у воду і екстрагують за винаходом №084) етилацетатом. Отриманий органічний шар промиДо 17,1г (82,1ммоль) 5-гідрокси-4-метил-1вають водою і насиченим сольовим розчином поізопропіл-3-трифторметил-1Н-піразолу в 100мл 2слідовно і потім сушать над безводним сульфатом пропанолу додають 23,0г (410,7ммоль) порошкомагнію. Розчинник видаляють випарюванням при подібного гідроксиду калію при кімнатній темперазниженому тиску, о тримуючи 6,1г (ви хід: 95,3%) турі з подальшим перемішуванням. Більш того 1,4-диметил-5-(2,2,2-трифторетокси)-3перемішування продовжують, в той час як надміртрифторметил-1Н-піразолу у вигляді блідо-жовтої ну кількість хлордифторметану вводять в реакційрідини. 1 ний розчин. Після цього температура реакції відН-ЯМР (CDCI3/TMS δ (м. ч.)): 4,41 (2Н, кв), разу підвищується до 70°С за рахунок 3,74 (3Н, д), 2,08 (3Н, д). екзотермічного тепла і потім повертається до кімПоказник заломлення (nD20): 1,3872. натної температури через 2 години. Після підтверПриклад 21 дження про завершення реакції реакційний розчин Отримання 5-(2,2-дифторетокси)-1,4-диметилвиливають у воду і екстрагують етилацетатом. 3-трифторметил-1Н-піразолу (Сполука за винахоОтриманий органічний шар промивають водою і дом №078) насиченим сольовим розчином послідовно і потім До розчину 9,0г (50,0ммоль) 1,4-диметил-5сушать над безводним сульфатом магнію. Розгідрокси-3-трифторметил-1Н-піразолу в 50мл тетчинник видаляють випарюванням при зниженому рагідрофурану додають 14,4г (55,0ммоль) трифетиску, і залишок переганяють, отримуючи 15,9г нілфосфіну і 4,5г (55,0ммоль) 2,2-дифторетанолу (вихід: 75,0%) 5-дифторметокси-4-метил-1при кімнатній температурі з подальшим перемішуізопропіл-3-трифторметил-1Н-піразолу у вигляді ванням. Крім того, 12,3г (60,0ммоль) діізопропілабезбарвної прозорої рідини зодикарбоксилату додають туди ж при охолоджу1 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 6,52 (1Н, т, ванні льодом з подальшим перемішуванням при J=71,5Гц), 4,58 (1Н, м), 1,98 (3Н, д), 1,44 (6Н, д). кімнатній температурі протягом ночі. Після підтвеТемпература кипіння: 84-86°С/3,33кПа (25мм рдження про завершення реакції реакційний розHg). чин виливають у воду і екстрагують етилацетатом. Показник заломлення (nD20): 1,3974. Отриманий органічний шар промивають водою і Приклад 19 насиченим сольовим розчином послідовно і потім Отримання 4-бромметил-5-дифторметокси-1сушать над безводним сульфатом магнію. Розізопропіл-3-трифторметил-1Н-піразолу (Сполука чинник видаляють випарюванням при зниженому за винаходом №158) тиску, і залишок очищають колонковою хроматогДо розчину 10,3г (40,0ммоль) 5рафією на силікагелі, отримуючи 6,8г (вихід: дифторметокси-4-метил-1-ізопропіл-355,7%) 1,4-диметил-5-(2,2-дифторетокси)-3трифторметил-1Н-піразолу в 40мл тетрахлориду трифторметил-1Н-піразолу у вигляді блідо-жовтої 29 79483 30 рідини. Приклад 31 1 H-ЯМР (CDCI3/TMS δ (м. ч.)): 6,05 (1Н, тт, 4-Етил-1-метил-5-дифторметокси-3J=3,8, 54,3Гц), 4,27 (2Н, дт, J=3,8, 13,5Гц), 3,73 трифторметил-1Н-піразол (Сполука за винаходом (3Н, с), 2,08 (3Н, д). №105) 1 Показник заломлення (nD20): 1,4070. Н-ЯМР (CDCI3/TMS δ (м. ч.)): 6,50 (1Η, т, Приклад 22 J=71,7Гц), 3,78 (3Н, с), 2,51 (2Н, кв),1,15(3Н,т). 5-Гідрокси-4-метил-1-н-пропіл-3Показник заломлення (nD20): 1,4021. трифторметил-1Н-піразол (Сполука за винаходом Приклад 32 №039) 4-Бромметил-1-метил-5-(2,2-дифторетокси)-31 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 8,75 (1Н, шир.), трифторметил-1Н-піразол (Сполука за винаходом 3,94 (2Н, т), 1,96 (3Н, д), 1,77 (2Н, м), 0,88 (3Н, т). №153) 1 Температура плавлення: 133-134°С. H-ЯМР (CDCI3/TMS δ (м. ч.)): 6,11 (1Н, тт, Приклад 23 J=3,5, 54,2Гц), 4,52 (2Н, дт, J=3,5, 13,5Гц), 4,43 1-н-Бутил-5-гідрокси-4-метил-3-трифторметил(2Н, с), 3,76 (3Н, с). 1Н-піразол (Сполука за винаходом №040) Показник заломлення (nD2o): 1,4490. 1 Н-ЯМР (CDCI/TMS δ (м. ч.)): 7,73 (1Н, шир.), Приклад 33 3,98 (2Н, т), 1,97 (3Н, д), 1,74 (2Н, м), 1,29 (2Н, м), 4-Бромметил-1-метил-5-(2,2,20,91 (3Н, т). трифторетокси)-3-трифторметил-1Н-піразол (СпоТемпература плавлення: 132-133°С. лука за винаходом №154) 1 Приклад 24 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 4,68 (2Н, кв), 1-трет-Бутил-5-гідрокси-4-метил-34,41 (2Н, с), 3,77 (3Н, с). трифторметил-1Н-піразол (Сполука за винаходом Показник заломлення (nD20): 1,3872. №043) Приклад 34 1 Н-ЯМР (CDCI/TMS δ (м. ч.)): 5,45 (1Н, шир.), 4-Бромметил-5-дифторметокси-1-етил-31,97 (3Н, д), 1,60 (9Н, с). трифторметил-1Н-піразол (Сполука за винаходом Температура плавлення: 159-160°С. №155) 1 Приклад 25 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 6,73 (1Н, т, 5-Дифторметокси-4-метил-1-етил-3J=71,7Гц), 4,40 (2Н, с), 4,13 (2Н, кв), 1,46 (3Н, т). трифторметил-1Н-піразол (Сполука за винаходом Приклад 35 №080) 4-Бромметил-1-трет-бутил-5-(2,21 H-ЯМР (CDCI3/TMS δ (м. ч.)): 6,49 (1Η, т, дифторетокси)-3-трифторметил-1Н-піразол (СпоJ=71,9Гц), 4,10 (2H, кв), 2,07 (3Н, д), 1,42 (3Н, т). лука за винаходом №168) 1 Температура кипіння: 88-91°С/3,73кПа (28мм Н-ЯМР (CDCI3/TMS δ (м. ч.)): 6,15 (1Η, тт, Hg). J=3,7, 54,1Гц), 4,56 (2H, дт, J=3,7, 13,4Гц), 4,45 Показник заломлення (nD20): 1,3971. (2Н, с), 1,60 (9Н, с). Приклад 26 Приклад 36 1-Етил-4-метил-5-(2,2,2-трифторетокси)-3Гідробромід 2-(5-(2,2-дифторетокси)-1-метилтрифторметил-1Н-піразол (Сполука за винаходом 3-трифторметил-1Н-піразол-4№083) ілметил)ізотіосечовини (Сполука за винаходом 1 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 4,42 (2Н, кв), №199) 1 4,07 (2Н, кв), 2,09 (3Н, д), 1,41 (3Н, т). Н-ЯМР (CD3OD/TMS δ (м. ч.)): 6,26 (1Н, тт, Приклад 27 J=3,4, 53,9Гц), 4,51 (2Н, дт, J=3,2, 14,1Гц), 4,41 4-Метил-1-ізопропіл-5-(2,2,2-трифторетокси)-3(2Н, с), 3,78 (3Н, с). трифторметил-1Н-піразол (Сполука за винаходом Приклад 37 №087) Гідробромід 2-(5-(2,2,2-трифторетокси)-11 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 4,55 (1Н, м), метил-3-трифторметил-1Н-піразол-44,41 (2Н, кв), 2.08 (3Н, д), 1,45 (6Н, д). ілметил)ізотіосечовини (Сполука за винаходом Приклад 28 №200) 4-Метил-1-н-пропіл-5-(2,2,2-трифторетокси)-3Температура плавлення: 128-131°С. трифторметил-1Н-піразол (Сполука за винаходом Приклад 38 №090) Гідробромід 2-(5-дифторметокси-1-етил-31 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 4,41 (2Н, кв), трифторметил-1Н-піразол-43,97 (2Н, т), 2.09 (3Н, д), 1,84 (2Н, м), 0,91 (3Н, т). ілметил)ізотіосечовини (Сполука за винаходом Приклад 29 №201) Температура плавлення: 139-141°С 1-н-Бутил-4-метил-5-(2,2,2-трифторетокси)-3Приклад 39 трифторметил-1Н-піразол (Сполука за винаходом Гідро бромід 2-(5-дифторметокси-1-ізопропіл№093) 3-трифторметил-1Н-піразол-41 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 4,41 (2Н, кв), ілметапрізотіосечовини (Сполука за винаходом 4,00 (2Н, т), 2,09 (3Н, д), 1,80 (2Н, м), 1,30 (2Н, м), №204) 0,93 (3Н, т). Температура плавлення: 146-148°С. Приклад 30 Приклад 40 1-трет-Бутил-4-метил-5-(2,2,2-трифторетокси)(5-Дифторметокси-1-ізопропіл-33-трифторметил-1Н-піразол (Сполука за винахотрифторметил-1Н-піразол-4-іл)метан тіол (Сполудом №102) ка за винаходом №223) 1 1 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 4,43 (2Н, кв), Н-ЯМР (CDCI3/TMS δ (м. ч.)): 6,72 (1Н, т, 2,09 (3Н, д), 1,59 (9Н, с). J=72,2Гц), 4,60 (1Н, м), 3,62 (2Н, с), 1,46 (6Н, д). 31 79483 32 У доповнення до вказаних сполук, відносно ним з ними. R13 означає С1-С4алкілгрупу, фенілгсполук, вказаних номерами в наступній таблиці, рупу, яка може бути заміщена, або бензилгрупу, підтверджені їх фізичні властивості і дані інструяка може бути заміщена, і L означає відхідну гр упу, ментального аналізу. таку як атом галогену, С1-С4алкілсульфонілгрупа, фенілсульфонілгрупа, яка може бути заміщена, Таблиця 12 або бензилсульфонілгрупа, яка може бути заміщена. Сполука Дані по фізичних Наступне буде пояснювати кожну стадію вка№ в ластив остях або даних ЯМР заних вище способів отримання похідних ізоксазо037 температура плав лення: 150-152°С ліну. 038 температура плав лення: 150-153°С (Стадія 11) 1 значення H-ЯМР (CDCI3/TMS δ (м. ч.): 6,73 Похідне сульфіду, представлене загальною 151 (1Н, т, J=71,5Гц), 4,39 (2Н, с), 3,82 (3Н, д); поформулою [23], може бути отримане при взаємодії казник заломлення (nD20): 1,4401 сполуки, представленої загальною формулою [20], 178 температура плав лення: 117-119°С з гідратом гідросульфіду натрію, представленим 197 температура плав лення: 130-131°С загальною формулою [21], в розчиннику або без розчинника (переважно у відповідному розчинниНаступне буде поясненням отримання похідку) в присутності основи до утворення солі мерканих ізоксазоліну [описаних в японській викладеній птану, представленої загальною формулою [22], в патентній заявці №308857/2002] з використанням реакційній системі і потім взаємодією солі меркапсполук за винаходом, представлених загальною тану [22], яку не розділяють, з похідним галогену, формулою [1], як проміжні сполуки і гербіцидна дія представленим загальною формулою [10], яке є похідних ізоксазоліну. сполукою за винаходом (необов'язково реакцію Спочатку буде пояснене отримання похідних проводять в атмосфері інертного газу, або може ізоксазоліну (описаних в японській викладеній пабути доданий відновник). тентній заявці №308857/2002) з використанням (Стадія 12) сполук за винаходом, представлених загальною Похідне сульфоксиду, представлене загальформулою [1]. ною формулою [25], може бути отримане при взаємодії похідного сульфіду, представленого загальною формулою [23], з окислювачем у відповідному розчиннику. (Стадія 13) Похідне сульфону, представлене загальною формулою [26], може бути отримане при взаємодії похідного сульфоксиду, представленого загальною формулою [25], з окислювачем у відповідному розчиннику. (Стадія 14) Похідне сульфону, представлене загальною формулою [26], може бути отримане при взаємодії похідного сульфіду, представленого загальною формулою [23], з відповідною кількістю окислювача у відповідному розчиннику без виділення похідного сульфоксиду, представленого загальною формулою [25]. (Стадія 15) Похідне сульфіду, представлене загальною формулою [23], може бути отримане при взаємодії сполуки, представленої загальною формулою [24], з похідним меркаптану, представленим загальною формулою [13], яке є сполукою за винаходом, в розчиннику або без розчинника (переважно у відповідному розчиннику) в присутності основи (необов'язково, реакцію проводять в атмосфері інерде R1, R2, R4, R 7, R8 і X мають ті ж значення, які тного газу або може бути доданий відновник). вказані вище, R9 і R10 є однаковими або відмінниПохідне меркаптану, представлене загальною фоми один від одного, і кожний означає атом водню, рмулою [13], яке є сполукою за винаходом може алкілгрупу, циклоалкілгрупу або циклоалкілалкілгбути також отримане в реакційній системі спосорупу, або R9 і R10 об'єднані разом з атомом вуглебом, описаним на стадіях 6 або 7 способи отрицю, до якого вони приєднані, з утворенням С 3мання 5, і потім може бути використане. С7спірокільця, R11 і R12 є однаковими або відмінНаступне буде конкретно пояснювати отриними один від одного, і кожний означає атом водмання похідних ізоксазоліну [описаних в японській ню, алкілгрупу або циклоалкілгрупу, або R11 і R12 викладеній патентній заявці №308857/2002] з виоб'єднані разом з атомом вуглецю, до якого вони користанням сполук за винаходом, представлених приєднані, з утворенням С 3-С7спірокільця, і додатзагальною формулою [1], з посиланням на довідково R9, R10, R11 і R12 можуть утворювати 5-8кові приклади. членне кільце разом з атомом вуглецю, пов'яза 33 79483 34 над безводним сульфатом магнію. Розчинник виОтримання 3-(5-дифторметокси-1-метил-3даляють випарюванням при зниженому тиску, і трифторметил-1Н-піразол-4-илметилтіо)-5,5залишок очищають колонковою хроматографією диметил-2-ізоксазоліну на силікагелі, отримуючи 1,55г (ви хід: 86,1%) 3-(51) До розчину 6,1г (35,0ммоль) 3дифторметокси-1-метил-3-трифторметил-1Нетансульфоніл-5,5-диметил-2-ізоксазоліну в 50мл піразол-4-илметилтіо)-5,5-диметил-2-ізоксазоліну. Ν,Ν-диметилформаміду додають 5,6г (чистота: 70%, 70,0ммоль) гідросульфіду натрію з подальОтримання 3-(5-дифторметокси-1-метил-3шим перемішуванням протягом 1 години при кімтрифторметил-1Н-піразол-4-ілметансульфініл)натній температурі. Після цього туди додають 4,8г 5,5-диметил-2-ізоксязоліну (35,0ммоль) карбонату калію і 10,8г (35,0ммоль) 4До розчину 6,2г (17,3ммоль) 3-(5бромметил-5-дифторметокси-1-метил-3дифторметокси-1-метил-3-трифторметил-1Нтрифторметил-1Н-піразолу з подальшим переміпіразол-4-ілметилтіо)-5,5-диметил-2-ізоксазоліну в шуванням при кімнатній температурі протягом но40мл хлороформу додають 3,4г (чистота: 70%, чі. Після підтвердження про завершення реакції 13,8ммоль) м-хлорпербензойної кислоти при охореакційний розчин виливають у воду і екстрагують лоджуванні льодом з подальшим перемішуванням етилацетатом. Отриманий органічний шар промипротягом 1 години. Після цього все додатково певають водою і насиченим сольовим розчином і ремішують при кімнатній температурі протягом 3 потім сушать над безводним сульфатом магнію. годин. Після підтвердження про завершення реакРозчинник видаляють випарюванням при знижеції реакційний розчин виливають у воду і екстраному тиску, і залишок очищають колонковою хрогують хлороформом. Отриманий органічний шар матографією на силікагелі, отримуючи 7,3г (вихід: промивають водним розчином гідросульфіту на57,9%) 3-(5-дифторметокси-1-метил-3трію, водним гідрокарбонатом натрію, водою і натрифторметил-1Н-піразол-4-ілметилтіо)-5,5сиченим сольовим розчином послідовно і потім диметил-2-ізоксазоліну у вигляді білих кристалів сушать над безводним сульфатом магнію. Роз(температура плавлення: 39-40°С). чинник видаляють випарюванням при зниженому 1 Н-ЯМP (CDCI3/TMS δ (м. ч.)): 6,72 (1Н, т, тиску, і отриману тверду речовину промивають нJ=72,0Гц), 4,19 (2Н, с), 3,81 (3Н, с), 2,78 (2Н, с), гексаном, отримуючи 4,1г (вихід: 63,2 %) 3-(51,42 (6Н, с). дифторметокси-1-метил-3-трифторметил-1Н2) До розчину 1,93г (5,00ммоль) гідроброміду піразол-4-ілметансульфініл)-5,5-диметил-22-(5-дифторметокси-1-метил-3-трифторметил-1Нізоксазоліну у вигляді білого порошку (температупіразол-4-ілметил) ізотіосечовини в 10мл етанолу ра плавлення: 112-114°С). 1 додають 0,48г (12,00ммоль) гідроксиду натрію і H-ЯМР (CDCI3/TMS δ (м. ч.)): 6,95 (1Н, кв, 10мл води з подальшим перемішуванням протяJ=69,5, 74,4Гц), 4,16 (2Н, с), 3,85 (3Н, с), 3,11 (2Н, гом 30 хвилин при кімнатній температурі. Туди ж кв, J=17,2Гц), 1,52 (6Н, д, J=5,5Гц). додають 0,67г (5,00ммоль) 3-хлор-5,5-диметил-2 ізоксазоліну при кімнатній температурі з подальОтримання 3-(5-дифторметокси-1-метил-3шим перемішуванням протягом ще 12 годин при трифторметил-1Н-піразол-4-ілметансульфоніл)кип'ятінні із зворотним холодильником. Після під5,5-диметил-2-ізоксазоліну твердження про завершення реакції розчинник До розчину 7,3г (20,3ммоль) 3-(5видаляють випарюванням при зниженому тиску. дифторметокси-1-метил-3-трифторметил-1НОтриманий залишок виливають у воду і екстрагупіразол-4-ілметилтіо)-5,5-диметил-2-ізоксазоліну в ють етилацетатом. Отриманий органічний шар 50мл хлороформу додають 12,5г (чистота: 70%, промивають водою і потім сушать над безводним 50,8ммоль) м-хлорпербензойної кислоти при охосульфатом магнію. Розчинник видаляють випарюлоджуванні льодом з подальшим перемішуванням ванням при зниженому тиску, і залишок очищають протягом 1 години. Після цього всі додатково пеколонковою хроматографією на силікагелі, отриремішують при кімнатній температурі протягом муючи 1,02г (ви хід: 56,7%) 3-(5-дифторметокси-1ночі. Після підтвердження про завершення реакції метил-3-трифторметил-1Н-піразол-4-ілметилтіо)реакційний розчин виливають у воду і екстрагують 5,5-диметил-2-ізоксазоліну. хлороформом. Отриманий органічний шар проми3) До розчину 1,93г (5,00ммоль) гідроброміду вають водним розчином гідросульфіту натрію, во2-(5-дифторметокси-1-метил-3-трифторметил-1Ндним гідрокарбонатом натрію, водою і насиченим піразол-4-ілметил) ізотіосечовини в 10мл етанолу сольовим розчином послідовно і потім сушать над додають 0,83г (6,00ммоль) безводного карбонату безводним сульфатом магнію. Розчинник видалякалію і 5мл води з подальшим перемішуванням ють випарюванням при зниженому тиску, і отрипротягом 30 хвилин при кімнатній температурі. ману тверду речовину промивають н-гексаном, Туди ж додають розчин 0,95г (5,00ммоль) 3отримуючи 6,4г (вихід: 80,6 %) 3-(5етансульфоніл-5,5-диметил-2-ізоксазоліну в 5мл дифторметокси-1-метил-3-трифторметил-1НΝ,Ν-диметилформаміду і 0,83г (6,00ммоль) безвопіразол-4-ілметансульфоніл)-5,5-диметил-2дного карбонату калію при кімнатній температурі з ізоксазоліну у вигляді білого порошку (температуподальшим перемішуванням протягом ще 3 годин ра плавлення: 129-130°С). 1 при 50°С. Після підтвердження про завершення Н-ЯМР (CDCI3/TMS δ (м. ч.)): 6,83 (1Н, т, реакції розчинник видаляють випарюванням при J=71,9Гц), 4,60 (2Н, с), 3,88 (3Н, с), 3,11 (2Н, с), зниженому тиску. Отриманий залишок виливають 1,52 (6Н, с). у ,воду і екстрагують етилацетатом. Отриманий органічний шар промивають водою і потім сушать 3-(5-Дифторметокси-1-етил-3-трифторметил 35 79483 36 1Н-піразол-4-ілметансульфоніл)-5,5-диметил-2азаспіро[2,4]-5-гептен ізоксазолін Температура плавлення: 125-126°С 1 Температура плавлення: 98-100°С Н-ЯMP (CDCI3/TMS δ (м. ч.)): 6,83 (1Н, т, 1 Н-ЯМР (CDCl3/TMS δ (м. ч.)): 6 ,83 (1Н, т, J=71,9Гц), 4,61 (2Н, с), 3,88 (3Н, с), 3,42 (2Н, с), J=72,0Гц), 4,60 (2Н, с), 4,19 (2Н, кв), 3,11 (2Н, с), 1,31 (2Н, т), 0,91 (2Н, т). 1,51 (6Н, с), 1,49 (3Н, с). 3-[1-(5-дифторметокси-1-метил-33-(5-Дифторметоксі-1-ізопропіл-3трифторметил-1Н-піразол-4-іл)етансульфоніл]-5,5трифторметил-1Н-піразол-4-ілметансульфоніл)диметил-2-ізоксазолін 5,5-диметил-2-ізоксазолін Показник заломлення (nD20): 1,4657 D 1 Показник заломлення (n 20): 1,4621. H-ΗΜΡ (CDCI3/TMS δ (м. ч.)): 6,92 (1Н, м), 1 H-ЯМР (CDCl3/TMS δ (м. ч.)): 6 ,83 (1Н, т, 4,83 (1Н, кв), 3,88 (3Н, с), 3,07 (2Н,д), 1,83 (3Н,д), J=72,lГц), 4,70 (1Н, м), 4,60 (2Н, с), 3,10 (2Н, с), 1,50 (6Н, д). 1,52 (6Н, с), 1,49 (6Н, с). 3-(5-Дифторметокси-1-метил-3-трифторметил3-(5-Дифторметокси-1-н-пропіл-31Н-піразол-4-ілметансульфоніл)-3а,4,5,6,7,7атрифторметил-1Н-піразол-4-ілметансульфоніл)гексагідробензо[d]ізоксазол 5,5-диметил-2-ізоксазолін Температура плавлення: 97-98°С 1 Показник заломлення (nD20): 1,4629. Н-ЯМР (CDCl3/TMS δ (м. ч.)): 6 ,84 (1Н, т, 1 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 6,82 (1Η, т, J=72,0Гц), 4,69 (1Н, м), 4,61 (2Н, с), 3,88 (3Н, с), J=71,7Гц), 4,60 (2Н, с), 4,09 (2Н, т), 3,10 (2Н, с), 3,48 (1Н, м), 1,26-2,17 (9Н, м). 1,92 (2Н, м), 1,52 (6Н, с), 0,94 (3Н, т). 3-(5-Дифторметокси-1-метил-3-трифторметил3-(1-ізобутил-5-дифторметокси-31Н-піразол-4-ілметансульфоніл)-5-метил-2трифторметил-1Н-піразол-4-ілметансульфоніл)ізоксазолін 5,5-диметил-2-ізоксазолін Температура плавлення: 106-107°С 1 Показник заломлення (nD20): 1,4601. Н-ЯМР (CDCI3/TMS δ (м. ч.)): 6,83 (1Н, т, 1 Н-ЯМР (CDCVTMS δ (м. ч.)): 6,81 (1Н, т, J=71,9Гц), 5,05 (1Н, м), 4,60 (2Н, с), 3,88 (3Н, с), J=71,7Гц), 4,60 (2Н, с), 3,94 (2Н, д), 3,10 (2Н, с), 3,44 (1Н, дд), 2,96 (1Н, дд), 1,48 (3Н, д). 2,30 (1Н, м), 1,51 (6Н, м), 0,92 (6Н, д). 3-(5-Дифторметокси-1-метил-3-трифторметил3-(5-Дифторметокси-1-метил-3-трифторметил1Н-піразол-4-ілметансульфоніл)-5-ізопропіл-21Н-піразол-4-ілметансульфоніл)-5-етил-5-метил-2ізоксазолін ізоксазолін Температура плавлення: 85-86°С 1 Температура плавлення: 77-78°С H-ЯМР (CDCI3/TMS 5 (м. ч.)): 6,83 (1Η, т, 1 Н-ЯМР (CDCb/TMS δ (м. ч.)): 6,83 (1Н, т, J=71,7Гц), 4,67 (1Н, м), 4,59 (2H, с), 3,88 (3Н, с), J=71,9Гц), 4,60 (2Н, с), 3,88 (3Н, с), 3,09 (2Н, АВкв, 3,30 (1Н, дд), 3,08 (1Н, дд), 1,97 (1Н, м), 0,98 (6Н, дд). J=17,4 Гц, Δn=46,7Гц), 1,78 (2Н, кв), 1,47 (3Н, с), 0,98 (3Н, т). 3-(5-Дифторметокси-1-метил-3-трифторметил 1Н-піразол-4-ілметансульфоніл)-4,5,5-триметил-23-(5-Дифторметокси-1-метил-3-трифторметилізоксазолін 1Н-піразол-4-ілметансульфоніл)-5-метил-5циклопропіл-2-ізоксазолін Показник заломлення (nD20): 1,4646 1 H-ЯMP (CDCI3/TMS δ (м. ч.)): 6,84 (1Η, т, Температура плавлення: 96-98°С 1 J=71,9Гц), 4,61 (2Н, кв), 3,88 (3Н, с), 3,36 (1Н, кв), Н-ЯМР (CDCI3/TMS δ (м. ч.)): 6,83 (1Н, т, 1,44 (3Н, с), 1,38 (3Н, с), 1,30 (3Н, д). J=71,9Гц), 4,59 (2Н, с), 3,88 (3Н, с), 3,13 (2Н, АВкв, J=17,3 Гц, Δn=53,4Гц), 1,48 (3Н, с), 1,14 (1Н, м), 3-(5-Дифторметокси-1-метил-3-трифторметил0,36-0,58 (4Н, м). 1Н-піразол-4-ілметансульфоніл)-4-метил-2 ізоксазолін 7-(5-Дифторметокси-1-метил-3-трифторметилПоказник заломлення (nD20): 1,4673 1Н-піразол-4-ілметансульфоніл)-5-окса-61 H-ЯМР (CDCI3/TMS δ (м. ч.)): 6,83 (1Η, т, азаспіро[3,4]-6-октен J=71,8Гц), 4,71 (1Н, τ), 4,62 (2Н, кв), 4,25 (1Н, т), Температура плавлення: 149-151°С 1 3,88 (3Н, с), 3,81 (1Н, м), 1,44 (3Н, д). Н-ЯМР (CDCI3/TMS Δ (м. ч.)): 6,83 (1Н, т, J=71,9Гц), 4,58 (2H, с), 3,87 (3Н, с), 3,40 (2Н, с), 3-[1-(5-Дифторметокси-1-метил-32,62 (2Н, м), 2,27 (2Н, м), 1,91 (1Н, м), 1,67 (1Н, м). трифторметил-1Н-піразол-4-іл)пропан-1 сульфоніл]-5,5-диметил-2-ізоксазолін 3-(5-Дифторметокси-1-метил-3-трифторметилПоказник заломлення (nD20): 1,4669 1Н-піразол-4-ілметансульфоніл)-2-ізоксазолін 1 H-ЯMP (CDCI3/TMS δ (м. ч.)): 6,91 (1Η, т, Температура плавлення: 115-117°С 1 J=72,9Гц), 4,60 (1Н, кв), 3,89 (3Н, с), 3,05 (2Н, д), H-ЯМР (CDCI3/TMS δ (м. ч.)): 6,83 (1Н, т, 2,30 (2Н, м), 1,49 (6Н, д), 0,94 (3Н, т). J=71,7Гц), 4,66 (2Н, τ), 4,61 (2Н, с), 3,88 (3Н, с), 3,37 (2Н, т). 3-[5-(2,2,2-Трифторетокси)-1-метил-3 трифторметил-1Н-піразол-4-ілметансульфоніл]6-(5-Дифторметокси-1-метил-3-трифторметил5,5-диметил-2-ізоксазолін 1Н-піразол-4-ілметансульфоніл)-4-окса-5 37 79483 38 Температура плавлення: 93-95°С 4,59 (2Н, с), 4,07 (2Н, т), 3,10 (2Н, с), 1,84 (2Н, м), 1 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 4,68 (2Н, кв), 1,52 (6Н, с), 1,35 (2Н, м), 0,95 (3Н, т). 4,59 (2Н, с), 3,84 (3Н, с), 3,12 (2Н, с), 1,53 (6Н, с). 3-[1-Етил-5-(2,2,2-трифторетокси)-33-[5-(2,2-Дифторетокси)-1-метил-3трифторметил-1Н-піразол-4-ілметансульфоніл]трифторметил-1Н-піразол-4-ілметансульфоніл]5,5-диметил-2-ізоксазолін 5,5-диметил-2-ізоксазолін Температура плавлення: 84-86°С 1 Температура плавлення: 89-91°С Н-ЯМР (CDCI3/TMS δ (м. ч.)): 4,68 (2Н, кв), 1 H-ЯМР (CDCI3/TMS δ (м. ч.)): 6,11 (1Н, тт, 4,59 (2Н, с), 4,14 (2Н, кв), 3,11 (2Н,с), 1,52 (6Н,с), J=3,5, 54,4Гц), 4,58 (2Н, с), 4,48 (2Н, дт, J=3,7, 1,47 (3Н,т). 15,3Гц), 3,88 (3Н, с), 3,11 (2Н, с), 1,52 (6Н, с). 3-[1-трет-бутил-5-(2,2,2-трифторетокси)-33-[1-трет-бутил-5-(2,2-дифторетокси)-3трифторметил-1Н-піразол-4-ілметансульфоніл]трифторметил-1Н-піразол-4-ілметансульфоніл]5,5-диметил-2-ізоксазолін 5,5-диметил-2-ізоксазолін Температура плавлення: 91-92°С 1 1 H-ЯМР (CDCI3/TMS δ (м. ч.)): 6,14 (1Н, тт, Н-ЯМР (CDCI3/TMS δ (м. ч.)): 4,77 (2Н, кв), J=3,9, 54,4Гц), 4,61 (2Н, с), 4,54 (2Н, дт, J=3,6, 4,60 (2Н, с), 3,11 (2Н, с), 1,63 (9H, с), 1,52 (ОН, с). 13,4Гц), 3,08 (2Н, с), 1,63 (9Н, с), 1,51 (6Н, с). Наступне буде поясненням гербіцидної дії, що проявляється сполукою, представленою загаль3-[5-(2,2-Дифторетокси)-1-ізопропіл-3ною формулою [26], похідне ізоксазоліну, [описане трифторметил-1Н-піразол-4-ілметансульфоніл]в японській викладеній патентній заявці 5,5-диметил-2-ізоксазолін №308857/2002], яка може бути отримана з викориТемпература плавлення: 88-89°С станням похідного піразолу, представленого зага1 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 6,11 (1Н, тт, льною формулою [1], або її солі (сполуки за винаJ=3,4, 54,6Гц), 4,58-4,65 (3Н, м), 4,47 (2Н, дт, ходом). J=3,7, 13,4Гц), 3,10 (2Н, с), 1,52 (6Н, с), 1,46 (6Н, При застосуванні сполуки, представленої зад). гальною формулою [26], похідне ізоксазоліну, [описане в японській викладеній патентній заявці 3-[1-Етил-5-(2,2-дифторетокси)-3№308857/2002], як гербіцид сполука може бути трифторметил-1Н-піразол-4-ілметансульфоніл]використана сама по собі, може бути також вико5,5-диметил-2-ізоксазолін ристана в складі, такому як дуст, змочуваний поПоказник заломлення (nD20): 1,4687 рошок, емульгований концентрат, текучий склад, 1 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 6,11 (1Н, тт, мікрогранула, гранула і тому подібне, отриманому J=3,7, 54,5Гц), 4.58 (2Н, с), 4,48 (2Н, дт, J=3,7, змішуванням з носієм, поверхнево-активною речо13,4Гц), 4,16 (2Н, кв), 3,10 (2Н, с), 1,52 (6Н, с), 1,47 виною, диспергуючим агентом, допоміжним аген(3Н, т). том або тому подібним, які звичайно використову ються для приготування складу. 3-[5-(2,2-Дифторетокси)-1-н-пропіл-3Приклади носія, який повинен бути використатрифторметил-1Н-піразол-4-ілметансульфоніл]ний для складу, включають тверді носії, такі як 5,5-диметил-2-ізоксазолін тальк, бентоніт, глина, каолін, діатомова земля, Показник заломлення (nD20): 1,4658. біла сажа, вермикуліт, карбонат кальцію, гашене 1 H-ЯМP (CDCVTMS δ (м. ч.)): 6,11 (1Н, тг, вапно, кварцовий пісок, сульфат амонію і сечовиJ=3,7, 54,3Гц), 4,59 (2H, с), 4,47 (2Н, дт, J=3,7, на; рідкі носії, такі як ізопропіловий спирт, ксилол, 13,5Гц), 4,04 (2Н, т), 3,09 (2Н, т), 1,90 (2Н, м), 1,52 циклогексан і метилнафталін, і тому подібне. (6Н, с), 0,94 (3Н, т). Приклади поверхнево-активної речовини і ди спергуючого агента включають солі металів алкіл3-[5-(2,2,2-Трифторетокси)-1-ізопропіл-3бензолсульфонових кислот, солі металів динафтрифторметил-1Н-піразол-4-ілметансульфоніл]тилметандисульфонової кислоти, солі складних 5,5-диметил-2-ізоксазолін ефірів сульфатів спиртів, солі алкіларилсульфоТемпература плавлення: 109-110°С нової кислоти, солі лігносульфонової кислоти, глі1 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 4,55-4,70 (5Η, колевий простий ефір поліоксіетилену, алкіларим), 3,11 (2Н, с), 1,52 (6Н, с), 1,49 (6Н, д). ловий простий ефір поліоксіетилену, моноалкілати поліоксіетиленангідросорбіту і тому подібне. При3-[5-(2,2,2-Трифторетокси)-1-н-пропіл-3клади допоміжного агента включають карбоксиметрифторметил-1Н-піразол-4-ілметансульфоніл] тилцелюлозу, поліетиленгліколь, гуміарабік і тому 5,5 -диметил-2-ізоксазолін подібне. При застосуванні його розбавляють до Температура плавлення: 49-51°С відповідної концентрації і потім розпилюють або 1 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 4,68 (2Η, кв), наносять безпосередньо. 4,59 (2Н, с), 4,04 (2Н, τ), 3,11 (2Н, с), 1,88 (2Н, м), Сполука, представлена загальною формулою 1,52 (6Н, с), 0,94 (3Н, т). [26], може бути застосована розпиленням на лис тя, нанесенням на ґрунт, нанесенням на поверхню 3-[1-н-бутил-5-(2,2,2-трифторетокси)-3води або тому подібним чином. Кількість активного трифторметил-1Н-піразол-4-ілметансульфоніл]інгредієнта, яка повинна бути введена в суміш, 5,5-диметил-2-ізоксазолін відповідно визначають згідно з необхідністю. Коли Показник заломлення (nD20): 1,4533. отримують порошок або гранули, кількість може 1 Н-ЯМР (CDCI3/TMS δ (м. ч.)): 4,67 (2Н, кв), бути відповідно визначена в межах від 0,01 до 39 79483 40 10% за масою, переважно від 0,05 до 5% за мальгований концентрат. сою. Коли отримують емульгований концентрат Гранула або змочуваний порошок, кількість може бути, відДесять частин води додають до 10 частин повідно, визначена в межах від 1 до 50% за масполуки, представленої загальною формулою [26], сою, переважно від 5 до 30% за масою. Коли 80 частинам наповнювача, в якому тальк і бентоніт отримують текучий склад, кількість може бути, змішані в співвідношенні 1:3, 5 частинам білої сажі відповідно, визначена в межах від 1 до 40% за і 5 частинам суміші поверхнево-активних речовин, масою, переважно від 5 до 30% за масою. алкілату поліоксіетиленангідросорбіту, поліоксіеКількість сполуки, представленої загальною тиленалкіларилового полімеру і алкіларилсульфоформулою [26], яка повинна бути нанесена як гернату. Отриману суміш ретельно змішують до утвобіцид, змінюється в залежності від виду сполуки, рення пасти. Пасту екструдують через сито з що використовується, цільового бур'яну, тенденції комірками, що мають діаметр 0,7мм. Екструдат появи сходів бур'янів, умов навколишнього сересушать і потім ріжуть на довжину від 0,5 до 1мм, довища, форми, яка повинна бути використана, і щоб отримати гранули. тому подібного. Коли сполуку використовують саДалі йде пояснення ефектів сполуки, предстаму по собі, як у разі порошку або гранул, кількість, вленої загальною формулою [26], з посиланням на відповідно, визначають в межах від 1г до 50кг, пеприклади випробувань. реважно від 10г до 10кг на 1 гектар в розрахунку Випрона активний інгредієнт. Коли сполуки використобування гербіцидного ефекту шля хом обробки вують в рідкій формі, як у випадку емульгованого ґрунту рисового поля концентрату, змочуваного порошку або текучого Ґрунт рисового поля набивають в пластмасоскладу, кількість, відповідно, визначають в межах вий горщик 100см 2 і піддають скаламучуванню. від 0,1 до 50000м.ч., переважно від 10 до Потім висівають насіння Echinochloa oryzicola 10000м.ч. Vasing і Monochoria vaginalis var. plantaginea і заСполука, представлена загальною формулою повнюють водою на глибину 3см. На наступний [26], може бути змішана при необхідності з інсекдень кожний змочуваний порошок, отриманий відтицидом, фунгіцидом, іншим гербіцидом, агентом, повідно до прикладу складу 1, розбавляють водою регулюючим ріст рослини добривом і тому подібі капають на поверхню води. Застосовуван у кільним. кість змочуваного порошку - 250г або 1000г на 1 Наступне буде поясненням способу отримання гектар з розрахунку на активний інгредієнт. Потім складів конкретно з посиланням на типові приклавирощують в теплиці і гербіцидний ефект змочуди складів. Види сполук і добавок і співвідношенваного порошку перевіряють на 21 день після обня, в яких їх змішують, не є обмежувальними і моробки відповідно до стандартів, показаних в табжуть змінюватися в широких межах. У наступному лиці 13. Результати показані в таблиці 14. описі "частини" відносяться до частин за масою. Таблиця 13 Змочуваний порошок Гербіцидний ефект (ступінь інгібування росту) і До 10 частин сполуки, представленої загальІндекс фітотоксичність ною формулою [26], домішують і розпилюють 0,5 Гербіцидний ефект або фітотоксичність 90% частини поліоксіетиленоктилфенілового простого 5 або більше ефіру, 0,5 частини натрієвої солі продукту конденГербіцидний ефект або фітотоксичність в ід 4 сації формаліну і β-нафталінсульфонової кислоти, 70% до менш ніж 90% 20 частин діатомової землі і 69 частин глини, Гербіцидний ефект або фітотоксичність в ід 3 отримуючи тим самим змочуваний порошок. 50% до менш ніж 70% Текучий склад Гербіцидний ефект або фітотоксичність в ід 2 В 69 частинах води диспергують 20 частин 30% до менш ніж 50% Гербіцидний ефект або фітотоксичність в ід груборозпиленої сполуки, представленої загаль1 10% до менш ніж 30% ною формулою [26]. До цього додають чотири часГербіцидний ефект або фітотоксичність 0% до тини сульфату фенілового простого ефіру поліо0 менш ніж 10% ксіетилену, модифікованого стиролом, 7 частин етиленгліколю і додають 200м.ч. силікону AF-118N Таблиця 14 (що виробляється Asahi Kasei Corporation) по відношенню до зібраного продукту. Отриману суміш Дов ідков ий Кількість актив- Echinochloa Monochoria перемішують протягом 30 хвилин у високошвидкіного інгреoryzicola vaginalis var. приклад № сному змішувачі і потім подрібнюють в млині для дієнта (г а. і. /га) Vasing plantaginea тонкого мокрого помелу, щоб отримати текучий 5 1000 5 5 склад. 8 1000 5 5 10 250 5 5 Концентрат, 11 250 5 5 який емульгується 15 1000 5 5 До 30 частин сполуки, представленої загаль18 250 5 5 ною формулою [26], додають 60 частин суміші 20 1000 5 5 рівних об'ємів ксилолу і ізофорону і 10 частин су21 1000 5 5 міші поверхнево-активних речовин, алкілату поліоксіетиленангідросорбіту, поліоксіетиленалкілариДовідковий приклад випробування 2> Випролового полімеру і алкіларилсульфонату. Отриману бування гербіцидного ефекту шля хом обробки суміш ретельно перемішують, щоб отримати ему 41 79483 42 ґрунту поля. могою малого розпилювача на все листя вказаних Ґрунт поля набивають в пластмасовий горщик рослин в кількості 1000 літрів на 1 гектар, так що 80см 2. Насіння Echinochloa crus-galli var. crus-galli i кількість кожного активного інгредієнта стає 250г Setaria viridis висівають і потім покривають тим же або 1000г на 1 гектар. Потім проводять вирощуґрунтом. Кожний змочуваний порошок, отриманий вання в теплиці і гербіцидний ефект досліджують відповідно до прикладу складу 1, розбавляють на 14-й день після обробки відповідно до стандарводою і рівномірно розбризкують з допомогою матів, показаних в таблиці 13. Результати показані в лого розпилювача на поверхню ґрунту в кількості таблиці 16. 1000 літрів на 1 гектар, так що кількість кожного Таблиця 16 активного інгредієнта стає 250г або 1000г на 1 гектар. Потім проводять вирощування в теплиці і гербіцидний ефект досліджують на 21-й день після Дов ідков ий Кількість активного Echinochloa Setaria інгредієнта (г а. crus-galli var. viridis обробки відповідно до стандартів, показаних в приклад № і./га.) crus-galli таблиці 13. Результати показані в таблиці 15. 3 6 7 9 13 14 23 24 Таблиця 15 Дов ідков ий Кількість активно- Echinochloa Setaria приклад № го інгредієнта (г а. crus-galli var. viridis и./га) crus-galli 3 1000 5 5 4 1000 5 5 5 1000 5 5 8 1000 5 5 15 1000 5 5 17 1000 5 5 20 250 5 5 24 250 5 5 Випробування гербіцидного ефекту шля хом обробки листяного покриву поля Пісок набивають в пластмасовий горщик 80см 2. Насіння Echinochloa crus-galli var. crus-galli i Setaria viridis висівають. Вирощування проводять в теплиці протягом 2 тижнів. Кожний змочуваний порошок, отриманий відповідно до прикладу складу 1, розбавляють водою і розбризкують за допо Комп’ютерна в ерстка Т. Чепелев а 1000 250 250 250 1000 1000 250 250 5 5 5 5 5 5 5 5 5 4 4 4 4 4 4 4 Промислова застосовність Згідно з даним винаходом запропоновані похідні піразолу, представлені загальною формулою [1] або їх солі, які застосовні як проміжні сполуки для отримання похідних ізоксазоліну, що мають чудову гербіцидну дію [описаних в японській викладеній патентній заявці №308857/2002]. Застосування сполук за винаходом як проміжних сполук дає можливість зручного отримання похідних ізоксазоліну, що мають чудову гербіцидну дію і [описаних в японській викладеній патентній заявці №308857/2002], з більш короткими стадіями (меншим числом стадій) з хорошими загальними виходами. Тому сполуки за винаходом є дуже корисними. Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrazole derivatives and processes of preparation thereof
Назва патенту російськоюПроизводные пиразола и способы их получения
Автори російськоюIto, Minoru
МПК / Мітки
МПК: C07D 231/20
Мітки: похідні, одержання, способи, піразолу
Код посилання
<a href="https://ua.patents.su/21-79483-pokhidni-pirazolu-ta-sposobi-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідні піразолу та способи їх одержання</a>












