7-арил-4,5,6,7-тетрагідро-1,2,4-триазоло[1,5-а]піримідин-5-тіони та спосіб їх одержання
Номер патенту: 87649
Опубліковано: 27.07.2009
Автори: Афанасіаді Людмила Михайлівна, Сизов Валерій В'ячеславович, Десенко Сергій Михайлович, Петрова Марина Генадіївна, Комихов Сергій Олександрович
Формула / Реферат
1. 7-Арил-4,5,6,7-тетрагідро-1,2,4-триазоло[1,5-а]піримідин-5-тіони загальної формули І
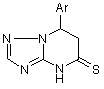 , (I)
, (I)
де Ar = C6H5, 4-CH3OC6H5, 4-ClC6H5.
2. Спосіб одержання сполук загальної формули І
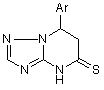 , (I)
, (I)
де Ar = C6H5, 4-CH3OC6H5, 4-ClC6H5,
який відрізняється тим, що проводять реакцію взаємодії еквімолярних кількостей 3-аміно-1,2,4-триазолу з метиловими ефірами коричних кислот формули АrСН=СНСООМе у органічному розчиннику - диметилформаміді при кипінні; одержаний заміщений триазолопіримідин піддають взаємодії з пентасульфідом фосфору у середовищі ксилолу або діоксану при кипінні протягом 2-3 годин до утворення цільового продукту.
Текст
1. 7-Арил-4,5,6,7-тетрагідро-1,2,4триазоло[1,5-а]піримідин-5-тіони загальної формули І Ar N N N N H S , (I) де Ar = C6H5, 4-CH3OC6H5, 4-ClC6H5, який відрізняється тим, що проводять реакцію взаємодії еквімолярних кількостей 3-аміно-1,2,4триазолу з метиловими ефірами коричних кислот формули АrСН=СНСООМе у органічному розчин нику - диметилформаміді при кипінні; одержаний заміщений триазолопіримідин піддають взаємодії з пентасульфідом фосфору у середовищі ксилолу або діоксану при кипінні протягом 2-3 годин до утворення цільового продукту. , (I) Винахід належить до галузі органічної хімії, а саме, до складних нітрогенвмісних гетероциклічних сполук -7-арил-4,5,6,7-тетрагідро-1,2,4триазоло[1,5-a]піримідин-5-тіонів загальної формули І: де Аr = С6Н5, 4-СН3ОС6Н4, 4-СlС6Н4. Похідні азолопіримідинів є основною субстанцією багатьох лікарських препаратів, що успішно застосовуються для лікування захворювань, що викликані вірусом ВІЛ, є ефективними при лікуванні ендокринної та серцево-судинної систем [Т. Yasuda et al, Jpn. J. Pharmacol., 79, 65 (1999); пат. Японії № 63101383, C07D 487/04; G. Η. Yang et al, Chin. J. Chem., 18, 435 (2000); пат. Японії № 62077387, C07D 487/04]. Сполуки, що заявляються, являють собою частково гідровані азини з анельованим азольним циклом та хімічно активним тіоамідним фрагментом. Вони є аналогами природних дигідропіридинів (нікотинамід-аденіндинуклеотиду) або азолопіримідинів (пуринів) та штучно синтезованих кардіостимулюючих препаратів на основі дигідропіридину (ніфедипін, тощо). Тому цього часу синтез сполук подібної структури з різними фармакофорними фрагментами є досить актуальним, тому що вони можуть грати важливу роль у біологічних процесах живих організмів і людини. 87649 S (11) N H UA N (13) N (19) N де Ar = C6H5, 4-CH3OC6H5, 4-ClC6H5. 2. Спосіб одержання сполук загальної формули І C2 Ar 2 3 Є відомим структурний аналог сполук, що заявляються, -2-метилтіо-4,5,6,7-тетрагідро-1,2,4триазоло[1,5-а]піримідин-5-он формули І: та спосіб його отримання [J. Reiter et al, J. Heterocyclic Chem., 22, 385 (1985)]. Сполука II є добре розчинною у полярних, гірше - у неполярних розчинниках, спиртах, оцтовій кислоті; нерозчинною в ефірах, воді. На першій стадії до суспензії гідриду натрія у абсолютному диметилформаміді додають розчин 3-аміно-5-метилтіотриазолу у абсолютному диметилформаміді при 0°С та інтенсивному перемішуванні протягом 1 години. Суміш нагрівають ще півгодини, після чого при тій самій температурі приливають розчин 2-ціаноетилброміду у невеликій кількості абсолютного диметилформаміду. Суміш перемішують 3 години при 0°С та нагрівають до кімнатної температури, перемішують ще 5 годин, після чого виливають у воду та екстрагують хлороформом (двічі по 100 мл). Екстракт сушать над безводним Na2SO4, випаровують насухо, залишок хроматографують на силікагелі. Після перекристалізації з води т. пл. 5-аміно-3-метилтіо-1-(2ціанометил)-1,2,4-триазолу 142-143 °С, вихід складає 38 %. На другій стадії нагрівають суміш 5-аміно-3метилтіо-1-(2-ціанометил)-1,2,4-триазолу та 5н розчин гідроксиду натрія протягом 2 годин. Одержаний розчин підкислюють 20 % H2SO4 (рН = 1) та залишають кристалізуватися протягом декількох діб. Отримують 2-метилтіо-4,5,6,7-тетрагідро-1,2,4триазоло[1,5-а]піримідин-5-он з виходом 37 %. Після перекристалізації з суміші метанолу (2 ч) та води (1 ч) т. пл. 2-метилтіо-4,5,6,7-тетрагідро1,2,4-триазоло[1,5-а]піримідин-5-ону складає 254 256 °С. 87649 4 Недоліком структури сполуки II є низька реакційна здатність до реакції алкілування по NH-групі. У випадку, коли якщо навіть таке алкілування можливе з використанням сильно основного середовища, це призведе до сторонніх процесів з розкриттям піримідинового циклу та повної деструкції сполуки формули II. Крім того, відсутність арильного радикалу у положенні 4 (у піримідиновому фрагменті) призводить до додаткової нестабільності молекули. Всі ці недоліки звужують можливості подальшої хімічної модифікації структури. Спосіб отримання відомої сполуки формули II складається з двох стадій та здійснюється за схемою: Загальний час реакції визначити, виходячи з джерела інформації, є неможливим, тому що автори вказують, що на останній стадії сполуки II кристалізація проходить протягом декількох діб. До недоліків способу отримання відомого аналога формули II належить використання гідриду натрія - конденсуючого засобу сильноосновної природи, що енергійно розкладається водою; тому синтез треба проводити у безводних умовах у присутності абсолютного розчинника диметилформаміду. Абсолютування диметилформаміду - тривалий процес, що передбачає сушку розчинника над безводним MgSO4 протягом 10-12 годин та вакуумну перегонку. Крім того, обидві стадії реакції потребують очистки речовин кристалізацією, а на першій стадії - навіть хроматографування, що суттєво збільшує не тільки час реакції, а також і матеріальні та енергетичні затрати. Низька температура (0°С), при якій на першій стадії проходить конденсація, потребує використання охолоджуючих агентів. Виходи речовин на кожній стадії дуже низькі (37-38 %), що також слід віднести до недоліків способу отримання відомого аналога. Серед заміщених 1,2,4-триазоло[1,5а]піримідинів відомі також 5-бромометил-7-арил4,7-дигідро-1,2,4-триазоло[1,5-а]піримідин-6карбонової кислоти етилові ефіри - сполуки формули III: 5 87649 6 та спосіб їх отримання [пат. Японії № 63101383, C07D 487/04, А61К 31/505]. Розчинність сполук формули III є невеликою навіть у полярних розчинниках: вони розчиняються тільки у диметилформаміді та диметилсульфоксиді, є нерозчинними у неполярних розчинниках (бензол, толуол), у воді, ефірі, ацетоні. Недоліком структури сполук формули III є обмежена можливість хімічної модифікації. Так, алкі лування по NH-групі можливе тільки у суперосновному середовищі у високополярних розчинниках з протіканням сторонніх процесів окиснення, ароматизації та навіть деструкції. Сполуки формули III використовуються як антигіпертензивні засоби, ліки при лікуванні ангіни; покращують серцевий та церебральний кровообіг. Спосіб отримання сполук формули III складається з трьох стадій та реалізується за схемою: На першій стадії еквімолярні кількості 4нітробензальдегіду та ацетооцтового ефіру змішують в етанолі, охолоджують до -10 °С, додають каталітичну кількість піперидину, не допускаючи підвищення температури вище 0°С. Суміш залишають у холодильнику на 12 годин. Осад, що виділився, відфільтровують, висушують. Після перекристалізації з етанолу отримують етил-а-ацетил4-нітроциннамат. На другій стадії 9,7 г етил-a-ацетил-4нітроциннамату, 3,4 г 3-аміно-1,2,4-триазолу в 150 мл етанолу кип'ятять 10 годин. Кристали, що випали при охолодженні, відфільтровують, кристалізують з метанолу. Отримують 5,6 г 5-метил-7-(4нітрофеніл)-4,7-дигідро-1,2,4-триазоло[1,5а]піримідин-6-карбонової кислоти етиловий ефір з т. пл. 222 - 224 °С. На третій стадії 5-метил-7-(4-нітрофеніл)-4,7дигідро-1,2,4-триазоло[1,5-а]піримідин-6карбонової кислоти етиловий ефір розчиняють у 50 мл оцтової кислоти, при інтенсивному перемішуванні краплями протягом 40 хв додають розчин 3 г брому в 15 мл оцтової кислоти при температурі 50-55 °С. Реакційну суміш перемішують ще 4,5 години при 45-50 °С, випаровують оцтову кислоту на роторному випарювачі. До залишку додають воду та екстрагують хлороформом. Екстракт промивають водою та розчином NaHCO3, охолоджують льодом, висушують над безводним MgSO4, хлороформ випаровують на роторному випарювачі. Вихід 5-бромометил-7-(4-нітрофеніл)-4,7дигідро-1,2,4-триазоло[1,5-а]піримідин-6карбонової кислоти етилового ефіру - 6,9 г (41 %), який потім кристалізують із суміші метанолдиметилформамід. Загальний час проведення реакції складає приблизно 37-39 годин. До недоліків способу отримання відомого аналога III належить багатостадійність, тривалість процесу. Крім того, використання лакріматора та високотоксичної речовини (брому), низькотемпературних хладоагентів (синтез проводять при 10°С), екстракція цільового продукту хлороформом значно ускладнюють та здорожчують спосіб отримання, що також є недоліком відомого способу. Відомим є аналог сполук, що заявляються, 5,7-діарил-4,7-дигідро-1,2,4-триазоло[1,5а]піримідину загальної формулой IV: та спосіб його отримання [В. Д. Орлов и др., Химия гетероцикл. соедин., 1988, №2, С. 229]. Сполуки формули IV є розчинними у полярних розчинниках (диметилформамід, диметилсульфоксид), погано розчинними у спиртах, нерозчинними у неполярних розчинниках, воді, ефірі, діоксані, ацетоні. Сполуки формули IV є стійкими при зберіганні, але легко ароматизуються при обробці Nбромсукцинімідом у іншу структуру -триазоло[1,5 7 а]піримідини. Таку нестабільність відомої структури можна віднести до її недоліків. Крім того, хімічна модифікація є досить ускладненою, тому не є можливим використання цих сполук як вихідних при пошуку нових фізіологічно активних сполук, у тому числі вмішуючих атоми оксигену та сульфуру, що також належить до недоліків структури. Спосіб отримання відомого аналога формули IV складається з двох стадій та здійснюється за схемою: На першій стадії проводять реакцію взаємодії заміщених ацетофенонів з ароматичними альдегідами у етиловому спирті за присутністю 10 % розчину гідроксиду натрія при кімнатній температурі протягом 2-10 годин (залежно від електронної природи замісника) при інтенсивному перемішуванні. Реакційну суміш залишають на 12 годин до повного випадіння халконів, після чого відфільтровують, промивають спиртом, висушують. Час протікання реакції складає приблизно 14-22 години. На другій стадії халкони, отримані у першій стадії, конденсують з 3-аміно-1,2,4-триазолом у диметилформаміді при кипінні протягом 1 години, після чого висаджують бензолом. Суміш залишають на 0,5 годин для отримання 5,7-дигідро-1,2,4триазоло[1,5-а]піримідинів, які потім очищують кристалізацією з суміші бензол-диметилформамід (3:1). Загальний час отримання відомого аналога складає 18-25 годин. До недоліків способу отримання відомого аналога формули IV належить тривалість технологічного процесу, використання ароматичних альдегідів, які легко окиснюються повітряним киснем та сприяють утворенню значної кількості смолистих продуктів, що відображується на чистоті кінцевих речовин. Крім того, вказаний спосіб розповсюджується тільки на отримання триазолопіримідинів, що містять ароматичні замісники у піримідиновому фрагменті. У основу винаходу покладено завдання пошуку нових сполук в ряду заміщених 7-арил-4,5,6,7тетрагідро-1,2,4-триазоло[1,5-а]піримідин-5-тіонів, а також розробки простого та доступного способу отримання цих сполук, який дозволяє зменшити тривалість технологічного процесу, покращити якість кінцевих продуктів. Вирішення поставленого завдання забезпечується розробкою заміщених 7-арил-4,5,6,7тетрагідро-1,2,4-триазоло[1.5-а]піримідин-5,-тіонів - сполук загальної формули І: 87649 8 Вирішення поставленого завдання забезпечується також і тим, що у способі отримання сполук загальної формули І, згідно винаходу, проводять реакцію взаємодії еквімолярних кількостей 3аміно-1,2,4-триазолу з метиловими ефірами коричних кислот формули АrСН==СНСООСН3 у органічному розчиннику - диметилформаміді при кипінні, отриманий заміщений триазолопіримідин піддають взаємодії з пентасульфідом фосфора у середовищі ксилола або діоксана при кипінні протягом 23 годин до утворення цільового продукту. Можливість хімічної модифікації структури сполук формули І варіюванням замісників у арильному радикалі, при NH-групі та у атомі сульфуру дозволяє отримувати більш широкий асортимент нових перспективних фізіологічно активних речовин триазолопіримідинового ряду. Введення у піримідиновий фрагмент атому сульфуру забезпечує кращі сольватаційні властивості та є причиною підвищення розчинності цих речовин у полярних та слабополярних розчинниках. Для даної структури триазолопіримідину це є досить суттєвою ознакою. Сполуки, що заявляються, можуть бути використані безпосередньо у пошуці нових медичних препаратів або як напівпродукти для подальшого синтезу нових гетероциклічних сполук з потенційною фізіологічною активністю. Висока розчинність у органічних розчинниках (спирти, ацетон, етилацетат та ін.) розширюють можливості використання їх для біологічних досліджень та медичної діагностики, в якості хімічних засобів захисту рослин у сільському господарстві тощо. Високореакційний тіоамідний фрагмент дозволяє легко здійснювати хімічну модифікацію, наприклад, алкілування по атому сульфуру проходить у м'яких умовах у ацетоні за присутністю К2СО3. Взаємодія 3-аміно-1,2,4-триазолу з метиловими ефірами заміщених коричних кислот дозволяє одразу отримувати циклічні продукти - 4,5,6,7тетрагідро-1,2,4-триазоло[1,5-а]піримідин-5-они, які потім підлягають взаємодії з пентасульфідом фосфору. Реакція проходить швидко, в дві стадії, протягом 7-8 годин, чому сприяє, як показали наші дослідження, вдалий вибір умов проведення. Експериментальним шляхом встановлено, що використання для синтезу сполук, що заявляються, в якості реакційного середовища низькокиплячих розчинників - діоксану (т. кип. 101°С) або ксилолу (т. кип. 138°С) дозволяє отримувати кінцеві продукти без домішок смолистих сторонніх продуктів, що дає можливість виділяти чисті продукти без додаткових кристалізацій. Це, в свою чергу, дозволяє підвищити якість цих сполук, зменшити тривалість всього процесу, а також знизити затрати робочого часу, зберегти матеріальні та енергетичні ресурси. 9 87649 10 Використання будь-якого з компонентів реакції у більшому або меншому співвідношенні, ніж еквімолярні, призводить до отримання суміші продуктів, яку важко аналізувати і практично неможливо розділити. Час протікання реакції протягом 2-3 годин встановлений експериментально, причому зменшення часу призводить до значного зниження виходів сполук, що заявляються. Збільшення часу проходження реакції є недоцільним, тому що вже 3 годин достатньо для утворення цільового продукту. Вибір пентасульфіду фосфора у якості компоненту реакції заміни гетероатома оксигену на сульфур у молекулі триазолопіримідину заважає утворенню смолистих напівпродуктів, що відображується на чистоті кінцевих речовин. Підібрані та розроблені експериментально умови проведення реакції також впливають на чистоту цільових продуктів. Так, після виділення з реакційної маси та промивання етанолом сполуки формули І є достатньо чистими, що підтверджено даними спектроскопії ЯМР 1Н. У таблиці 1 наведені характеристики способу отримання, що заявляється, для сполук формули І та сполук, одержаних за способами-аналогами. У таблиці 2 наведені характеристики сполук, що заявляються, та їх спектральні дані за заявленим способом. Спосіб, що заявляється, здійснюється у дві стадії за схемою: Суміш еквімолярних кількостей 3-аміно-1,2,4триазолу та метилового ефіру заміщених коричних кислот у диметилформаміді нагрівають при кипінні протягом 3 годин, продукт висаджують етанолом. Осад, що випав, відфільтровують, промивають етанолом, сушать. Отримані 7-арил-4,5,6,7-тетрагідро-1,2,4триазоло[1,5-а]піримідин-5-они заливають діоксаном або ксилолом, додають пентасульфід фосфора, суміш кип'ятять 2-3 години. Розчинення вихідної сполуки відбувається протягом першої години кип'ятіння. Реакційну суміш після охолодження виливають у воду. Осад промивають водою або етанолом та сушать. Сполуки формули І, що заявляються, є досить чистими та не потребують додаткових кристалізацій. Спосіб отримання сполук формули І, що заявляються, ілюструється наступними прикладами. Приклад 1. Отримання 7-феніл-4,5,6,7тетрагідро-1,2,4-триазоло[1,5-а]піримідин-5-тіону (див. табл. 2, поз. 1). До 8 г (0.095 моль) 3-аміно-1,2,4-триазолу у 6 мл диметилформаміду додають 19 г (0,11 моль) метилового ефіру коричної кислоти. Суміш нагрівають при кипінні протягом 3 годин, потім додають етанол. Осад 7-феніл-4,5,6,7-тетрагідро-1,2,4триазоло[1,5-а]піримідин-5-ону, що виділився при охолодженні, відфільтровують, сушать. Вихід 6,6 г (32 %), т. пл. 215-217 °С. До суміші 6,6 г (0,032 моль) 7-феніл-4,5,6,7тетрагідро-1,2,4-триазоло[1,5-а]піримідин-5-ону у 150 мл діоксану додають 2 г P2S5, кип'ятять 2 години. Після охолодження реакційну масу виливають у воду. Осад, що виділився, промивають во дою та етанолом та висушують. Т. пл. 228-230°С, вихід складає 3,0 г (40%). Спектр ЯМР 1H, d, м. д. (J, Гц): 3,50 (1Н, д. д., 2 JAB = 17,0 Гц, 3JAX = 4,6 Гц), 3,77 (1H, д. д., 3JBX= 6,8 Гц), 5,67 (1Н, д. д.), 7,07-7,36 (5Н, м, АrН), 7,84 (1Н,с, 2-Н), 13,35 (1H, с, NH). Приклад 2. Отримання 7-феніл-4,5,6,7тетрагідро-1,2,4-триазоло[1,5-а]піримідин-5-тіону (див. табл. 2, поз. 2). Отримують аналогічно прикладу 1 з тією різницею, що замість діоксану використовують ксилол. Суміш 7-феніл-4,5,6,7-тетрагідро-1,2,4триазоло[1,5-а]піримідин-5-ону у 100 мл ксилолу та P2S5, кип'ятять 3 години, охолоджують та висаджують гексаном. Вихідні дані: Т. пл. 228-230°С, вихід складає 2,5 г-(33 %). Інші приклади наведені у таблиці. Структуру 7-арил-4,5,6,7-тетрагідро-1,2,4триазоло[1,5-а]піримідин-5-тіонів підтверджено методом спектроскопії ЯМР 1Н спектроскопії. Спектри ядерного магнітного резонансу вимірені на спектрометрі VARIAN Mercury VX-200 (200 МГц) у дейтерованому диметилсульфоксиді (DMSO-d6), внутрішній стандарт - тетраметилсилан (ТМС). Як видно з описання матеріалів винаходу, структура сполук формули І, що заявляються, забезпечує отримання широкого асортименту похідних 7-арил-4,5,6,7-тетрагідро-1,2,4-триазоло[ 1,5а]піримідин-5-тіонів з покращеними характеристиками (розчинність, високий ступінь чистоти). Спосіб отримання сполук, що заявляються, дозволяє: - отримати принципово нові сполуки з новими якостями; 11 - значно зменшити тривалість процесу отримання (до 7-8 годин); 87649 12 - широко варіювати у молекулі замісники різної електронної природи. 13 Комп’ютерна верстка І. Скворцова 87649 Підписне 14 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською7-aryl-4,5,6,7-tetrahydro-1,2,4-triazolo[1,5-a]pyrimidine-5-thiones and process for the preparation thereof
Автори англійськоюKomikhov Serhii Oleksandrovych, Petrova Maryna Hennadiivna, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna, Syzov Valerii Viacheslavovych
Назва патенту російськоюАрил-4,5,6,7-тетрагидро-1,2,4-триазоло[1,5-а]пиримидин-5-тионы и способ их получения
Автори російськоюКомихов Сергей Александрович, Петрова Марина Геннадиевна, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна, Сизов Валерий Вячеславович
МПК / Мітки
МПК: C07D 487/04
Мітки: 7-арил-4,5,6,7-тетрагідро-1,2,4-триазоло[1,5-а]піримідин-5-тіони, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/7-87649-7-aril-4567-tetragidro-124-triazolo15-apirimidin-5-tioni-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">7-арил-4,5,6,7-тетрагідро-1,2,4-триазоло[1,5-а]піримідин-5-тіони та спосіб їх одержання</a>
Попередній патент: Спосіб акупунктури і двостороння голка для акупунктури
Наступний патент: Синхронна магнітоелектрична машина
Випадковий патент: Слабоалкогольний коктейль











