Спосіб отримання триметоксисилілвмісних амінополікарбонових кислот
Номер патенту: 89146
Опубліковано: 10.04.2014
Автори: Смола Сергій Сергійович, Фадєєв Євген Миколайович, Русакова Наталя Володимирівна, Снурнікова Ольга Віталіївна
Формула / Реферат
Спосіб отримання триметоксисилілвмісних амінополікарбонових кислот загальної формули:
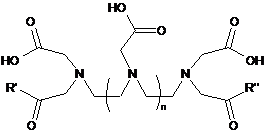 ,
,
де
n=0; R'=ОН; R"=NH(СН2)3Sі(ОСН3)3 (5)
n=0; R'=R"=NH(CH2)3Si(OCH3)3 (6)
n=1; R'=ОН; R"=NH(CH2)3Si(OCH3)3 (7)
n=l; R'=R"=NH(CH2)3Si(OCH3)3 (8),
що включає взаємодію діангідридів етилендіамінтетраоцтової та діетилентриамінпентаоцтової кислот із 3-(амінопропіл)триметоксисиланом, який відрізняється тим, що взаємодію проводять при температурі 80 °C у середовищі висококиплячого основного розчиника (ДМФА) при використанні співвідношення діангідрид кислоти:3-(амінопропіл)-триметоксисилан = 1:1.
Текст
Реферат: Спосіб отримання триметоксисилілвмісних амінополікарбонових кислот загальної формули:де n=0; R'=ОН; R"=NH(СН2)3Sі(ОСН3)3, (5) n=0; R'=R"=NH(CH2)3Si(OCH3)3, (6) n=1; R'=ОН; R"=NH(CH2)3Si(OCH3)3, (7) n=1; R'=R"=NH(CH2)3Si(OCH3)3, (8) включає взаємодію діангідридів етилендіамінтетраоцтової та діетилентриамінпентаоцтової кислот із 3-(амінопропіл)триметоксисиланом. Взаємодію проводять при температурі 80 °C у середі висококиплячого основного розчиника (ДМФА) при використанні співвідношення діангідрид кислоти:3-(амінопропіл)-триметоксисилан = 1:1. UA 89146 U (54) СПОСІБ ОТРИМАННЯ ТРИМЕТОКСИСИЛІЛВМІСНИХ АМІНОПОЛІКАРБОНОВИХ КИСЛОТ UA 89146 U UA 89146 U 5 10 15 20 25 Корисна модель належить до способу отримання нових органічних сполук моно- та дитриметоксисилілпропілзаміщених етилендіамінтетраоцтової (ЕДТА) та діетилентриамінпентаоцтової (ДТПА) кислот, які можуть бути використані як основа функціональних ковалентно закріплених гібридних органо-неорганічних матеріалів. Алкоксисилілвмісні амінополікарбонові кислоти, спосіб отримання яких заявляється, є необхідними для отримання гібридних матеріалів, в яких ковалентне закріплення в структурі неорганічної матриці відбувається за рахунок силілпропільного замісника. Увага, яка приділяється створенню та дослідженню гібридних матеріалів, що утворюються за рахунок взаємодії різних за хімічною будовою компонентів (найчастіше неорганічних і органічних), викликана їх застосуванням як фото- та електрохромних оптичних матеріалів, різних покриттів, які мають підвищену механічну міцність, гідрофобність і стійкість, біосумісних матеріалів для протезування, гібридних твердих електролітів, електродних матеріалів для сучасних хімічних джерел струму, люмінесцентних та електричних сенсорів, гетерогенних каталізаторів, магнітних рідин, підкладок для іммобілізації ферментів, а також сорбентів важких металів і органічних забруднювачів тощо. Зокрема, такі системи використовуються для створення модифікованих силікатних наночасток як контрастних агентів для МРТ (див. заявка USA 2009/0087381 А1). Неорганічними компонентами таких матеріалів можуть бути шаруваті та пористі речовини, включаючи природні та синтетичні цеоліти, глини, ксерогелі (силікагель, цирконогель, титаногель, алюмогель тощо). Число органічних компонентів величезне, у тому числі ациклічні та циклічні сполуки та їх металокомплекси. Наявність ковалентних зв'язків між неорганічними і органічними компонентами є принципово важливою вимогою у тому випадку, коли передбачається застосування даних сполук у контакті з рідинами, оскільки за відсутності їх відбувається часткове вимивання одного з компонентів. Також є дані, що свідчать про збільшення фото-, термо- та хімічної стабільності матеріалів при наявності ковалентних зв'язків між складовими. Відомі сполуки з загальною формулою: R' O R' O O N N R' N R'' R''' n 30 35 40 45 50 O , де: n=0; R'=R"=ONa; R'"=(CH2)3Si(OCH3)3 (1) n=0; R'=R"=OK; R"'=(CH2)3Si(OCH3)3 (2) n=1; R'=R"=ONa; R'"=(CH2)3Si(OCH3)3 (3) n=1; R'=ОН; R"=NH(CH2)3Si(OCH2CH3)3 (4) R'"=CH2CONH(CH2)3Si(OCH2CH3)3. Відомий спосіб отримання сполук формули (1) та (2) який включає перемішування водного розчину хлороцтової кислоти з незаміщеним аміном N-[3(триметоксисиліл)пропіл]етилендіаміном протягом 2 год. при температурі не вище за 60 °C і додавання 50 % водного розчину гідроксиду відповідного металу (NaOH чи KOH) із наступним перемішуванням при кімнатній температурі. В результаті отримують 52.53 % розчин калієвої (1) або 49.10 % розчин натрієвої (2) солі N-(триметоксисиліл-пропіл)етилендіамінтриоцтової кислоти (див. патент USA № 6,489,499 В1). Головним недоліком цього способу є висока вартість вихідного N-[3-(триметоксисилі)пропіл]етилендіаміну, а також невідповідність між констатованими формулами сполук та реально існуючими у водному розчині молекулами, що піддані гідролізу та поліконденсації через триметоксисилільні замісники. Відомий спосіб отримання сполуки формули (3) – натрієвої солі [3(триметоксисиліл)пропіл]діетилентриамінтетраоцтової кислоти, який включає розчинення у воді 1 бромоцтової кислоти і N -[3-(триметоксисиліл)пропіл]діетилентриаміну у співвідношенні 4:1 при додаванні 2М розчину гідроксиду натрію, поступове нагрівання реакційної суміші до 50 °C при перемішуванні на магнітній мішалці, додавання 2М розчину гідроксиду натрію по краплях протягом 30 хв., перемішування 2 год. при 50 °C і упарювання розчинника при зниженому тиску з утворенням жовтого густого масла (див. заявка USA 2009/0317335 А1). Білий гігроскопічний порошок цільової сполуки з виходом 90 % був отриманий додаванням етанолу та сушінні у 1 вакуумі. Недоліком цього способу, як і в попередньому випадку, є велика вартість вихідного N 1 UA 89146 U 5 10 15 20 25 30 [3-(триметоксисиліл)-пропіл]діетилентриаміну та той факт, що констатована формула сполуки не відповідає формі її існування як у розчині, так і у твердому стані. Найбільш близьким до корисної моделі, що заявляється, є спосіб отримання сполуки (4) біс[3-(триетоксисиліл)пропілкарбамоїлметил]-діетилентриамінтриоцтової кислоти, що включає розчинення діангідриду діетилентриамінпентаоцтової кислоти в абсолютному піридині в атмосфері азоту, додавання 2.2-кратної кількості 3-(амінопропіл)триетоксисилану, перемішування отриманої суміші протягом 24 год. при кімнатній температурі в атмосфері азоту із застосуванням техніки лінії Шленка, осадження продукту гексаном, центрифугування та промивання продукту реакції гексаном (див. заявка USA 2009/0317335 А1). Вихід продукту складає 93.2 %. Даний спосіб вибраний прототипом. Прототип і спосіб, що заявляється, мають наступні спільні ознаки: 1. Використання діангідриду діетилентриамінпентаоцтової кислоти як електрофільного та 3(амінопропіл)триалкоксисилану як нуклеофільного реагенту; 2. Використання однакового співвідношення електорфільного та нуклеофільного реагентів (1:2.2) при отриманні дизаміщених похідних амінополікарбонових кислот. Проте відомий спосіб отримання характеризується тривалим часом синтезу (до 24 годин), необхідністю застосування складної техніки (лінія Шленка, центрифугування), використання атмосфери сухого азоту а також екологічно небезпечного і токсичного розчинника - піридину. В основу корисної моделі поставлено задачу селективного отримання моно- та дизаміщених триметоксисилілпропілвмісних амінополікарбонових кислот із скороченою тривалістю синтезу. Поставлена задача вирішується шляхом взаємодії діангідридів двох амінополікарбонових кислот, а саме етилендіамінтетраоцтової (ЕДТА) та діетилентриамінпентаоцтової (ДТПА) кислот, з 3-(амінопропіл)-триетоксисиланом при температурі 80 °C у середі ДМФА, який, аналогічно піридину, проявляє основні властивості і позбавляє необхідності використання додаткових каталізаторів реакції. Селективне утворення монозаміщених сполук формули (5, 7) та дизаміщених похідних формули (6, 8) можливо завдяки варіюванню умов синтезу. Для отримання монозаміщених сполук використовується співвідношення діангідрид кислоти: (3амінопропіл)-триетоксисилан = 1:1, для дизаміщених це співвідношення складає 1:2.2. У разі синтезу монозаміщених на 1 ммоль діангідриду необхідна кількість розчиннику складає 50 мл, у той час як для дизаміщених - лише 20 мл. Підвищена температура дає змогу скоротити час синтезу дизаміщених похідних з 24 до 5 годин у порівнянні з часом синтезу прототипу (4). Для монозаміщених необхідний час синтезу складає 10 годин. HO O HO O O N N OH N R' R'' n 35 40 45 50 O O , де n=0; R'=OH; R"=NH(CH2)3Si(OCH3)3 (5) n=0; R'=R"=NH(CH2)3Si(OCH3)3 (6) n=1; R'=OH; R"=NH(CH2)3Si(OCH3)3 (7) n=1; R'=R"=NH(CH2)3Si(OCH3)3 (8). Наведені суттєві ознаки дозволяють отримати наступний технічний результат - скоротити тривалість синтезу у 3-5 разів та отримати наведені похідні (4, 5, 6, 7). Отримані сполуки являють собою порошки білого кольору, розчинні у воді при рН>7 (при додаванні лугів) та малорозчинні у ДМФА і ДМСО. У водних розчинах відбувається гідроліз триметоксисилільних груп, в результаті якого утворюються силанольні групи Si-OH, здатні до конденсації з утворенням силоксанових зв'язків Si-O-Si. При додаванні водних розчинів лугів утворюються алкілсилоксаноляти лужних металів із загальною формулою RSi(OH) x(OM)y (Rалкільний радикал, М - лужний метал, х+у=3). В твердому вигляді і у розчині вони можуть існувати у вигляді як ізольованих молекул, так і олігомерів складу (RSiOOMe) n (n>2), ці форми можуть співіснувати одночасно. Саме до цього типу належать описані раніше сполуки (1, 2, 3), що таким чином, є сполуками нестехіометричного складу. В той же час сполуки (5-8) та 2 UA 89146 U прототип (4) виділяються з розчинів у твердому вигляді і можуть бути використані для приготування розчинів точної концентрації. Сполуки формули (5-8) були одержані реакцією нуклеофільного заміщення при карбонільному атомі карбону. Ці реакції відбуваються за схемами: 5 MeO 1 екв., 10 год MeO HOOC H N Si MeO APTMS O N N O O OMe OMe DMF,80 oC HOOC MeO 2.2 екв., 5 год Si HOOC H N MeO MeO Si MeO COOH O O N N O N O O 20 25 30 35 40 OMe Si OMe N H 6) OMe COOH COOH N N N COOH O 7) OMe Si OMe DMF,80 oC MeO 2.2 екв., 5 год 15 O OMe H2N MeO 10 N N H MeO 1 екв., 10 год COOH N O MeO O COOH OMe Si H 2N O 5) N O O O COOH N Si HOOC H N COOH N N N COOH H N OMe Si OMe 8) OMe MeO O O Отримані сполуки були охарактеризовані методами елементного аналізу, ESI-мас1 спектрометрії, ІЧ- та ЯМР Н -спектроскопії. Елементний аналіз проведений на С, Н, Nаналізаторі Perkin-Elmer CHN-240. ESI-мас-спектри були записані на спектрометрі Waters ESI 1 TOF Premier. ЯМР Н спектри були отримані на спектрометрі Bruker Avarice AV 400 (400 МГц) в D2O при рН ≈ 10 (додавання NaOD) при 25 °C. Реєстрацію ІЧ-спектрів проводили на ІЧ-Фур'є спектрометрі Perkin-Elmer Frontier в таблетках з КВг. Дані мас-спектрометрії підтверджують приєднання триметоксисиліл-пропільних замісників до молекул кислот. В спектрах були виявлені сигнали, що відповідають молекулярним іонам а також фрагментам, в яких відбувається відрив гліцинових груп і розрив зв'язків силільного фрагмента. 1 Про утворення модифікованих кислот свідчать також ЯМР Н -спектри. В них спостерігається поява трьох сигналів при 0.43-0.79, 1.37-1.77 і 2.84-3.04 м.ч., які відповідають трьом метиленовим групам пропільного фрагменту. Сигнали метиленових груп етилендіамінового фрагмента присутні у вигляді триплетів при 2.55-3.09 м.ч., гліцинових фрагментів - у вигляді мультиплету в області 2.90-3.75 м.ч. В ІЧ-спектрах модифікованих кислот у порівнянні зі спектрами вихідних ЕДТА та ДТПА -1 -1 спостерігаються широкі смуги в області 1051-1144 см і 911-915 см , що відповідають -1 асиметричним і симетричним коливанням зв'язків Si-0-С, та смуги при 480-484 см , які відповідають деформаційним коливанням зв'язків O-Si-O. Частоти vas(COO ) знаходяться при -1 -1 1632-1647 см ; vs(COO ) - при 1385-1398 см . Смуги, відповідні неіонізованим карбоксигрупам -1 присутні у вигляді плечей при 1723-1733 см . Частота деформаційних коливань аміногрупи, -1 присутня в спектрі АПТМС при 1577 см , зникає в спектрах модифікованих кислот, що підтверджує утвердження амідного зв'язку. Частоти коливань "амід І", ймовірно, накладаються на широку смугу іонізованих карбоксильних груп, а "амід II" - спостерігаються у вигляді смуг при -1 1560-1564 см . Спосіб реалізується наступним чином: наважку діангідриду кислоти (ЕДТА чи ДТПА) поміщали у тригорлу колбу на 100 мл, що забезпечена магнітною мішалкою і зворотним холодильником із хлоркальцієвою трубкою. Додавали потрібну кількість абсолютного диметилформаміду і перемішували отриману суспензію при нагріванні до повного розчинення діангідриду, після чого по краплях додавали розчин (3-амінопропіл)триметоксисилану. Розчин перемішували при температурі 80 °C, після чого охолоджували і додавали тетрагідрофуран, утворений білий осад відфільтровували та перекристалізовували з суміші ДМФА-бензол. Приклад 1. Методика отримання [(3-триметоксисиліл)пропілкарбамоїлметил]етилендіамінтриоцтової кислоти (5). 1 ммоль діангідриду етилендіамінтетраоцтової кислоти розчиняли в 50 мл абсолютного диметилформаміду при 3 UA 89146 U 5 10 15 20 25 30 35 40 45 50 55 80 °C. Потім по краплях протягом 10 хвилин додавали розчин 1 ммоль (3амінопропіл)триметоксисилану в 5 мл диметилформаміду. Синтез продовжували при перемішуванні протягом 10 годин при температурі 80 °C. Після цього додавали 100 мл тетрагідрофурану, утворений білий осад відфільтровували і перекристалізовували з суміші ДМФА-бензол (1:1). Вихід 76 %. Т. пл. > 250 °C (розкл.). Елементний аналіз: знайдено для С16Н31N3О10Sі %: С, 42.35; Н, 6.91; N, 9.11; розраховано, %: С, 42.37; Н, 6.89; N, 9.27. ESI-MASS, m/z: 453 ([М] ), 393 ([М - 2СН3 - ОСН3] ), 334 ([М-2СН3-ОСН3-СН2СООН] ). 1 Н ЯМР-спектр, δ, м.ч. (D2O): 0.71 т (2Н, -CH2-Si, J=8.29 Hz), 1.64 м (2Н, -CH2-CH2-Si, J=7.53 Hz), 3.00 т (2Н, -CH2-CH2-CH2-Si, J=7.15 Hz), 3.20-3.35 м (4Н, N-CH2-CH2-N), 3.09 с (2Н, -CH2CONR-), 3.52 с (6Н, -CH2-СОО ). -1 ІЧ-спектр, см : 482 (5 O-Si-O), 861 (v Si-C), 913 (vs Si-O-C), 1055-1136 (vas Si-O-C), 1395 (vs COO ), 1561 (v CONH), 1642 (vas COO ), 2942, 2981, 3019 (vC-H). Приклад 2. Методика отримання біс[(3-триметоксисиліл)пропілкарбамоїлметил]етилендіаміндіоцтової кислоти (6). 1 ммоль діангідриду етилендіамінтетраоцтової кислоти розчиняли в 20 мл абсолютного диметилформаміду при 80 °C. Потім по краплях протягом 10 хвилин додавали розчин 2.2 ммоль (3амінопропіл)триметоксисилану в 5 мл диметилформаміду. Синтез продовжували при перемішуванні протягом 5 годин при температурі 80 °C. Після цього додавали 100 мл тетрагідрофурану, утворений білий осад відфільтровували, розчиняли у мінімальній кількості гарячого диметилформаміду і осаджували бензолом. Вихід 86 %. Т.пл. > 250 °C (розкл.). Елементний аналіз: знайдено для C22H46N4O12Si2, %: С, 43.03; Н, 7.60; N 9.09; розраховано, %: С, 42.98; Н, 7.54; N, 9.11. ESI-мас-спектр, m/z: 614 ([M] ), 494 ([M-4СН3 -ОСН3] ), 290 ([М-2(CH2)3Si(OMe)3] ). 1 ЯМР Н-спектр, δ, м.ч. (D2O): 0.63 т (4Н, -CH2-Si), 1.56 м (4Н, -СН2-CH2-Si), 2.63 с (4Н, N-CH2CH2-N), 2.93 т (4Н, -CH2-СН2-СН2-8і), 3.05-3.30 м (8Н, -CH2СО-). -1 ІЧ-спектр, см : 479 (δ O-Si-O), 850 (v Si-C), 911 (vs Si-O-C), 1056-1128 (vas Si-O-C), 1395, 1439 (vs COO ), 1563 (v CONH), 1647 (vas COO ), 2885, 2939, 3021 (vC-H). Приклад 3. Методика отримання [(3-триметоксисиліл)пропілкарбамоїлметил]діетилентриамінтетраоцтової кислоти (7). Синтез виконується аналогічно описаному вище (приклад 1), але як ацилюючий реагент використовується діангідрид діетилентриамінпентаоцтової кислоти. Вихід 79%. Т. пл. > 250 °C (розкл.). Елементний аналіз: знайдено для C20H38N4O12Si, %: С, 43.47; Н, 6.79; N 10.31; розраховано, %: С, 43.31; Н, 6.91; N 10.10. ESI-мас-спектр, m/z: 554 ([М] ), 493 ([М - 2СН3 - ОСН3] ), 391 ([М -(CH2)3Si(OMe)3] ). 1 Н ЯМР-спектр, δ, м.ч. (D2O): 0.59 т (2Н, -CH2-Si, J=7.79 Hz), 1.67 м (2Н, -CH2-CH2-Si, J=7.60 Hz), 2.90 т (2H, -CH2-CH2-CH2-Si, J=6.02 Hz), 2.97 т (4H, N-CH2-CH2-N, J=5.77 Hz), 3.09 т (4Н, NCH2-CH2-N, J=5.77 Hz), 3.33 с (8H, -CH2-COO ), 3.49 с (2Н, -CH2-CONH-). -1 ІЧ-спектр, см : 480 (δ O-Si-O), 863 (v Si-C), 911 (vs Si-O-C), 1052-1144 (vas Si-O-C), 1398 (vs COO ), 1560 (v CONH), 1634 (vas COO ), 2936, 2972, 3026 (vC-H). Приклад 4. Методика отримання біс[(3-триметоксисиліл)пропілкарбамоїлметил]діетилентриамінтриоцтової кислоти (8). Синтез виконується аналогічно описаному вище (приклад 2), але як ацилюючий реагент використовується діангідрид діетилентриамінпентаоцтової кислоти. Вихід 83 %. Т. пл. > 250 °C (розкл.). Елементний аналіз: знайдено для C26H53N5O14S12 %: С, 43.65; Н, 7.43; N, 9.74; розраховано, %: С, 43.62; Н, 7.46; N, 9.78. ESI-мас-спектр, m/z: 715 ([М] ), 655 ([М -2ОСН3] ), 519 ([М -CH2Si(OCH3)3-2СН3 -ОСН3] ), 434 ([М -CH2CONH(CH2)3Si(OCH3)3-2CH3 -ОСН3] ). 1 ЯМР Н -спектр, δ, м.ч. (D2O): 0.43 т (4Н, -CH2-Si), 1.37 м (4Н, -СН2-CH2-Si), 2.84 т (4Н, -CH2CH2-CH2-Si), 2.53 с (8Н, N-CH2-CH2-N), 2.90-3.15 м (10Н, -CH2-СО-). -1 ІЧ-спектр, см : 484 (δ O-Si-O), 850 (v Si-C), 915 (vs Si-O-C), 1051-1132 (vas Si-O-C), 1400, 1440 (vs СОO ), 1560 (v CONH), 1632 (vas COO ), 2898, 2941 (v C-H). 4 UA 89146 U ФОРМУЛА КОРИСНОЇ МОДЕЛІ Спосіб отримання триметоксисилілвмісних амінополікарбонових кислот загальної формули: HO O HO O O N N OH N R' R'' n 5 10 O O , де n=0; R'=ОН; R"=NH(СН2)3Sі(ОСН3)3, (5) n=0; R'=R"=NH(CH2)3Si(OCH3)3, (6) n=1; R'=ОН; R"=NH(CH2)3Si(OCH3)3, (7) n=1; R'=R"=NH(CH2)3Si(OCH3)3, (8) що включає взаємодію діангідридів етилендіамінтетраоцтової та діетилентриамінпентаоцтової кислот із 3-(амінопропіл)триметоксисиланом, який відрізняється тим, що взаємодію проводять при температурі 80 °C у середовищі висококиплячого основного розчиника (ДМФА) при використанні співвідношення діангідрид кислоти:3-(амінопропіл)-триметоксисилан = 1:1. 15 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
Автори англійськоюRusakova Nataliia Volodymyrivna
Автори російськоюРусакова Наталья Владимировна
МПК / Мітки
МПК: C07F 7/10
Мітки: кислот, амінополікарбонових, отримання, триметоксисилілвмісних, спосіб
Код посилання
<a href="https://ua.patents.su/7-89146-sposib-otrimannya-trimetoksisililvmisnikh-aminopolikarbonovikh-kislot.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання триметоксисилілвмісних амінополікарбонових кислот</a>
Попередній патент: Спосіб одержання безперервного мінерального волокна
Наступний патент: Спосіб контролю місцезнаходження речей в приміщенні
Випадковий патент: Способи та пристрої для аналізу сільськогосподарських продуктів











