6-аміноетил-6н-індоло-[2,3-b]хіноксаліни як противірусні агенти відносно вірусу везикулярного стоматиту та індуктори інтерферонів
Номер патенту: 92174
Опубліковано: 11.10.2010
Автори: Андронаті Сергій Андрійович, Шибінська Марина Олегівна, Жолобак Надія Михайлівна, Співак Микола Якович, Ляхов Сергій Анатолійович
Формула / Реферат
6-Аміноетил-6Н-індоло-[2,3-b]хіноксаліни загальної формули:
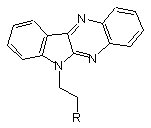 , де
, де
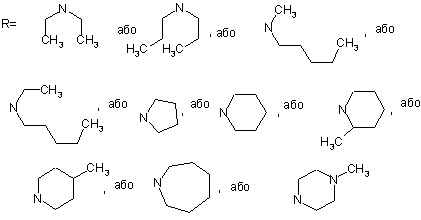 ,
,
як противірусні агенти відносно вірусу везикулярного стоматиту та індуктори інтерферонів.
Текст
6-Аміноетил-6Н-індоло-[2,3-b]хіноксаліни загальної формули: 2 3 де R= Сполуки 2-12 отримували амінодегідробромуванням продукту 15 дією надлишку вторинних амінів при кип'ятінні у бензолі. На відміну від них сполуку 1 одержували при кімнатній температурі в диметилформаміді, тому що використовували водний розчин диметиламіну. Чистота усіх синтезованих сполук підтверджена тонкошаровою хроматографією, будова - даними спектроскопії 1H-ЯМР та мас-спектрометрії. Вивчення біологічної активності препаратів 112 проводили за схемою і в умовах, що враховували адекватність тест-моделі можливому механізму інтерфероногенної активності, що передбачався на підставі аналізу структури хімічної сполуки, яка вивчалась [Вильнер Л.М. Актуальные вопросы скрининга и последующего изучения противовирусных препаратов типа интерфероногенов / В сб.: Методические вопросы научной разработки противовирусных средств. - Минск, 1977. - С. 134136]. Цитотоксичність, інтерфероніндукуючу та противірусну активність синтезованих сполук вивчали як описано [Доклінічні дослідження лікарських засобів. Методичні рекомендації. / За ред. чл.кор. АМН України О.В. Стефанова. - К: МОЗ, України. ДФЦ, 2001. - 392 с.]. Отримання сполук, що заявляються, та їхні біологічні властивості підтверджено наступними прикладами. Приклад 1. 1-(2-Бромоетил)-1Н-індол-2,3-діон (14). 92174 4 Сполуки, що заявляються, отримували у три стадії виходячи з 1Н-індол-2,3-діону (13). Алкілування 1Н-індол-2,3-діону дією надлишку диброметану у диметилформаміді у присутності карбонату калія при кімнатній температурі приводило до 1-(2бромоетил)-1Н-індол-2,3-діону (14), подальшою конденсацією якого із о-фенілендіаміном в киплячій крижаній оцтовій кислоті отримували 6-(2бромоетил)-6Н-індоло[2,3-b]хіноксалін (15). До розчину 10 г (0.068 моль) 1Н-індол-2,3діону у диметилформаміді додали 33.5 г (0.17 моль) карбонату калія та ретельно перемішали, потім додали 117.2 см3 (255.5 г, 1.36 моль) дибромоетану. Отриману реакційну суміш перемішували протягом 2 год. при кімнатній температурі. Відфільтрували неорганічний осад, промили на фільтрі диметилформамідом 3 5 см3. Фільтрат випарили, кубовий залишок промили водою та відфільтрували. Продукт перекристалізували із етанолу. Вихід: 13.8 г (80%); С10Н8BrNО2; M.W. 254.08; Τ пл.=132.8-133.4°С. Мас-спектр - m/z (I, %): 255 (21), 253 (20) - М+; 146 (100); 132 (55); 90 (7), 77 (10). Спектр ПМР (CDCl3): аліфатичні СН: т. 3.601 м.д., 6.9 Гц (2Н, BrCH2CH2N); т. 4.136 м.д., 6.9 Гц (2Н, BrCH2CH2N); ароматичні СН: д. 7.007 м.д., 8.4 Гц (1Н); т. 7.134 м.д., 7.5 Гц (1Н); м. 7.577-7.627 м.д. (2Н). Rf 0.43 (бензол-триетиламін 10:1); Rf 0.63 (хлороформ-ацетон 10:1). Приклад 2. 6-(2-бромоетил)-6Н-індоло[2,3-b]хіноксалін (15). Суміш 10 г (0.04 моль) 1-(2-бромоетил)- 1Ніндол-2,3-діону (14), 4.32 г (0.04 моль) офенілендіаміну та 60 см3 крижаної оцтової кислоти кип'ятили протягом 4 год. Осад, що утворився після охолодження реакційної суміші, відфільтрували та промили на фільтрі крижаною оцтовою кислотою 3 5 см3. Продукт перекристалізували із крижаної оцтової кислоти. Вихід: 10.4 г (80%). C16H12BrN3; M.W. 326.20. Τ пл.=169-170°С. Мас 5 92174 6 спектр - m/z (I, %): 329 (14); 327 (21) - М+; 232 (4); Синтез проводили як описано у прикладі 4, ви220 (5); 219 (96); 102 (8); 90 (15); 69 (6); 60 (32); 45 ходячи із 0.81 г (0.0025 моль) 6-(2-бромоетил)-6Н(100); 43 (58). Спектр ПМР (CDCl3): аліфатичні СН: індоло[2,3-b]хіноксаліну (15) та 0.85 см3 (0.63 г, т. 3.863 м.д., 7.2 Гц (2Н, BrCH2CH2N); т. 4.843 м.д., 0.00625 моль) дипропіламіну. Вихід: 0.70 г (82%). 7.2 Гц (2Н, BrCH2CH2N); ароматичні СН: т. 7.386 C22H26N4. M.W. 346.48. Τ пл.=75-76°С. Мас-спектр + м.д., 7.5 Гц (1Н); д. 7.523 м.д., 8.1 Гц (1Н); м. 7.662m/z (I, %): 347 (100) - МH ; 246 (20); 232 (6); 220 7.791 м.д. (3H); д.д. 8.132 м.д., 8.4 Гц, 1.5 Гц (1Н); (9); 128 (17); 114 (83); 72 (5). Спектр ПМР (CDCl3): д.д. 8.333 м.д., 8.1 Гц, 1.5 Гц (1Н); д. 8.503 м.д., 7.5 аліфатичні СН: т. 0.802 м.д., 7.2 Гц (6Н, Гц (1Н). Rf 0.60 (бензол-триетиламін 10:1); Rf 0.84 (СН3СН2СН2)2N); м. 1.339-1.463 м.д. (4Н, (хлороформ-ацетон 10:1). (СН3СН2СН2)2N); т. 2.504 м.д., 7.5 Гц (4Н, Приклад 3. (CH3CH2CH2)2N); т. 2.945 м.д., 7.5 Гц (2Н, (2-Iндоло[2,3-b]хіноксалін-6-іл-етил)Ν(аліф)CH2CH2N(аром)); т. 4.569 м.д., 7.5 Гц (2Н, диметиламін (1). Ν(аліф)CH2CH2N(аром)); ароматичні СН: т. 7.364 м.д., Розчинили 0.81 г (0.0025 моль) 6-(26.9 Гц (1Н); д. 7.518 м.д., 8.4 Гц (1Н); м. 7.639бромоетил)-6Н-індоло[2,3-b]хіноксаліну (15) в 50 7.775 м.д. (3H); д.д. 8.136 м.д., 8.4 Гц, 1.2 Гц (1Н); см3 ДМФА, додали 1.3 см3 (0.225 г, 0.005 моль) д.д. 8.306 м.д., 8.1 Гц, 1.2 Гц (1Н); д. 8.476 м.д., 7.8 33%-вого водяного розчину диметиламіну. РеакГц (1Н). Rf 0.71 (бензол-триетиламін 10:1); Rf 0.09 ційну суміш перемішували при кімнатній темпера(хлороформ-ацетон 10:1). турі протягом 6 год., потім випарили. Кубовий заПриклад 6. лишок розчинили в 25 см3 бензолу, екстрагували Бутил-(2-індоло[2,3-b]хіноксалін-6-іл-етил)метиламін (4). 10%-ою оцтовою кислотою (3 30 см3). У водний Синтез проводили як описано у прикладі 4, виекстракт додали насичений розчин Na2СО3 до ходячи із 0.81 г (0.0025 моль) 6-(2-бромоетил)-6НрН=9. Осад, що випав, відфільтрували, промили індоло[2,3-b]хіноксаліну (15) та 0.75 см3 (0.54 г, на фільтрі водою (3 5 см3) та висушили. Вихід: 0.00625 моль) метилбутиламіну. Вихід: 0.66 г 0.57 г (78%). C18H18N4. M.W. 290.37. Τ пл.=95-95.5 (80%). C21H24N4. M.W. 332.45. Τ пл. гідрохлори°С. Мас-спектр - m/z (I, %): 291 (100) - МН+; 246 ду=214-215°С. Мас-спектр - m/z (I, %): 333 (100) (16); 232 (8); 219 (12); 72 (20); 57 (55). Спектр ПМР MH+; 246 (8); 232 (6), 100 (12); 53 (5). Спектр ПМР (CDCl3): аліфатичні СН: с 2.408 м.д. (6Н, (CH3)2N); (CDCl3): аліфатичні СН: т. 0.926 м.д., 7.5 Гц (3H, т. 2.878 м.д., 6.9 Гц (2Н, Ν(аліф)CH2CH2N(аром)); т. СН3(СН2)3Ν(аліф)СН3); с. 1.281 м.д. (3H, 4.613 м.д., 7.2 Гц (2Н, Ν(аліф)CH2CH2N(аром)); аромаCH3(CH2)3Ν(аліф)CH3); м. 1.302-1.491 м.д. (2Н, тичні СН: т. 7.355 м.д., 7.5 Гц (1Н); д. 7.520 м.д., СН3CH2(CH2)2Ν(аліф)СН3); м. 1.694-1.977 м.д. (2Н, 7.8 Гц (1Н); м. 7.625-7.752 м.д. (3H); д.д. 8.124 м.д., СН3CH2CH2CH2Ν(аліф)СН3); т. 2.921 м.д., 6.6 Гц (2Н, 8.1 Гц, 1.2 Гц (1Н); д.д. 8.289 м.д., 8.1 Гц, 1.5 Гц СН3(СН2)2CH2Ν(аліф)СН3); т. 3.619 м.д., 8.1 Гц (2Н, (1Н); д. 8.460 м.д., 7.5 Гц (1Н). Rf 0.46 (бензолΝ(аліф)CH2CH2N(аром)); т. 5.220 м.д., 7.8 Гц (2Н, триетиламін 10:1); Rf 0.08 (хлороформ-ацетон Ν(аліф)CH2CH2N(аром)); ароматичні СН: т. 7.446 м.д., 10:1). 8.2 Гц (1Н); м. 7.718-7.830 м.д. (3H); д. 8.126 м.д., Приклад 4. 7.8 Гц (1Н); д.д. 8.193 м.д., 7.8 Гц, 1.2 Гц (1Н); д.д. Діетил-(2-індоло[2,3-b]хіноксалін-6-іл-етил)8.374 м.д., 8.1 Гц, 1.2 Гц (1H); д. 8.512 м.д., 8.1 Гц амін (2). (1Н). Rf 0.53 (бензол-триетиламін 10:1); R{ 0.01 Розчинили 0.81 г (0.0025 моль) 6-(2(хлороформ-ацетон 10:1). бромоетил)-6Н-індоло[2,3-b]хіноксаліну (15) в 50 Приклад 7. см3 бензолу, додали 0.64 см3 (0.46 г, 0.00625 Бутил-етил-(2-індоло[2,3-b]хіноксалін-6-ілмоль) діетиламіну. Реакційну суміш кип'ятили при етил)-амін (5). перемішуванні протягом 6 год. Потім охолодили, Синтез проводили як описано у прикладі 4, вивідфільтрували, осад на фільтрі промили бензоходячи із 0.81 г (0.0025 моль) 6-(2-бромоетил)-6Нлом (3 3 см3). Фільтрат випарили, кубовий залиіндоло[2,3-b]хіноксаліну (15) та 0.85 см3 (0.63 г, шок розчинили в 25 см3 бензолу, екстрагували 0.00625 моль) етилбутиламіну. Вихід: 0.73 г (84%). 10%-ою оцтовою кислотою (3 30 см ). У водний C22H26N4. M.W. 346.48. Τ пл.=53-54°C. Mac-спектр екстракт додали насичений розчин Nа2СО3 до m/z (I, %): 347 (100) - МН+; 246 (8); 232 (6), 114 рН=9. Осад, що випав, відфільтрували, промили 3 (10). Спектр ПМР (CDCl3): аліфатичні СН: т. 0.917 на фільтрі водою (3 5 см ). Вихід: 0.66 г (83%). м.д., 7.2 Гц (3H, СН3(СН2)3Ν(аліф)СН2СН3); м. 1.243C20H22N4. M.W. 318.43. Τ пл.=107-107.5 °С. Мас+ 1.404 м.д. (5Н, СН3CH2(СН2)2Ν(аліф)СН2СН3); м. спектр - m/z (I, %): 319 (100) - МН ; 246 (10); 232 1.758-1.915 м.д. (2Н, (8); 100 (6); 86 (12); 69 (6); 53 (8). Спектр ПМР СН3СН2CH2CH2Ν(аліф)CH2CH3); м. 3.047-3.126 м.д. (CDCl3): аліфатичні СН: т. 1.029 м.д., 5.4 Гц (6Н, (2Н, CH3(CH2)2CH2Ν(аліф)CH2CH3); м. 3.184-3.315 (CH3CH2)2N); кв. 2.863 м.д, 3.9 Гц (4Н, (СН3CH2)2N); м.д. (2Н, СН3(СН2)3Ν(аліф)CH2СН3); т. 3.460 м.д., 7.8 т. 2.980 м.д., 6·9 Гц (2Н, Ν(аліф)CH2CH2N(аром)); т. Гц (2Н, Ν(аліф)CH2CH2N(аром)); т. 5.075 м.д., 7.5 Гц 4.592 м.д., 7.5 Гц (2Н, Ν(аліф)CH2CH2N(аром)); арома(2Н, Ν(аліф)CH2CH2N(аром)); ароматичні СН: т. 7.414 тичні СН: т. 7.380 м.д., 7.5 Гц (1Н); д. 7.541 м.д., м.д., 7.8 Гц (1Н); м. 7.677-7.799 м.д. (3H); д. 7.943 7.8 Гц (1Н); м. 7.680-7.760 м.д. (3H); д. 8.151 м.д., м.д., 7.8 Гц (1Н); д.д. 8.095 м.д., 7.8 Гц, 1.5 Гц (1Н); 8.1 Гц (1Н); д. 8.316 м.д., 8.1 Гц (1Н); д. 8.491 м.д., д.д. 8.324 м.д., 8.1 Гц, 1.5 Гц (1Н); д. 8.467 м.д., 8.1 7.2 Гц (1Н). Rf 0.62 (бензол-триетиламін 10:1); Rf Гц (1Н). Rf 0.68 (бензол-триетиламін 10:1); Rf 0.02 0.04 (хлороформ-ацетон 10:1). (хлороформ-ацетон 10:1). Приклад 5. Приклад 8. (2-Індоло[2,3-b]хіноксалін-6-іл-етил)дипропіламін (3). 7 92174 8 6-(2-Піролідин-1-іл-етил)-6Н-індоло[2,3Синтез проводили як описано у прикладі 4, виb]хіноксалін (6). ходячи із 0.81 г (0.0025 моль) 6-(2-бромоетил)-6НСинтез проводили як описано у прикладі 4, виіндоло[2,3-b]хіноксаліну (15) та 0.74 см3 (0.62 г, ходячи із 0.81 г (0.0025 моль) 6-(2-бромоетил)-6Н0.00625 моль) 4-метилпіперидину. Вихід: 0.70 г індоло[2,3-b]хіноксаліну (15) та 0.52 см3 (0.44 г, (80%). C22H24N4. M.W. 344.46. Τ пл.=141-142°С. + 0.00625 моль) піролідину. Вихід: 0.63 г (79%). Мас-спектр - m/z (I, %): 345 (100) - MH ; 246 (15); C20H20N4. Μ.W. 316.41. Τ пл.=93-95°С. Мас-спектр 232 (8); 126 (17); 112 (75); 69 (5); 53(8). Спектр m/z (I, %): 317 (100) - MH+; 247 (18); 233 (8); 221 ПМР (CDCl3): аліфатичні СН: д. 0.916 м.д., 5.7 Гц (10); 84 (45); 54 (5). Спектр ПМР (CDCl3): аліфати(3H, СН3СН); м. 1.234-1.346 м.д. (3H, чні СН: м. 1.698-1.875 м.д. (4Η, (CH2CH2)2Ν(аліф)); м. СН3CH(СН2CH2A)2Ν(аліф)); м. 1.619-1.662 м.д. (2Н, 2.616-2.831 м.д. (4Н, (СН2СН2)2Ν(аліф)): т. 3.049 CH3CH(CH2ACH2)2Ν(аліф)); м. 2.156-2.227 м.д. (2Н, м.д., 7.8 Гц (2Н, Ν(аліф)CH2CH2N(аром)); т. 4.657 м.д., CH3CH(CH2CH2B)2Ν(аліф)); т. 2.910 м.д., 7.2 Гц (2Н, 7.8 Гц (2Н, Ν(аліф)CH2CH2N(аром)); ароматичні СН: т. Ν(аліф)CH2CH2N(аром)); м. 3.094-3.131 м.д. (2Н, 7.346 м.д., 7.5 Гц (1Н); д. 7.553 м.д., 8.1 Гц (1H); м. СН3СH(CH2BCH2)2Ν(аліф)); т. 4.651 м.д., 7.2 Гц (2Н, 7.619-7.751 м.д. (3H); д.д. 8.120 м.д., 8.4 Гц, 1.8 Гц Ν(аліф)CH2CH2N(аром)); ароматичні СН: т. 7.353 м.д., (1Н); д.д. 8.284 м.д., 8.1 Гц, 1.5 Гц (1Н); д. 8.451 6.9 Гц (1Н); д. 7.585 м.д., 8.1 Гц (1Н); м. 7.624м.д., 7.8 Гц (1Н). Rt 0.46 (бензол-триетиламін 10:1); 7.757 м.д. (3H); д.д. 8.116 м.д., 8.4 Гц, 1.2 Гц (1Н); Rf 0.08 (хлороформ-ацетон 10:1). д.д. 8.289 м.д., 8.4 Гц, 1.2 Гц (1Н); д. 8.454 м.д., 7.5 Приклад 9. Гц (1Н). Rf 0.62 (бензол-триетиламін 10:1); Rf 0.08 6-(2-Піперидин-1-іл-етил)-6Н-індоло[2,3(хлороформ-ацетон 10:1). b]хіноксалін (7). Приклад 12. Синтез проводили як описано у прикладі 4, ви6-(2-Азепан-1-іл)-етил]-6Н-індоло [2,3ходячи із 0.81 г (0.0025 моль) 6-(2-бромоетил)-6Нb]хіноксалін (10). індоло[2,3-b]хіноксаліну (15) та 0.62 см3 (0.53 г, Синтез проводили як описано у прикладі 4, ви0.00625 моль) піперидину. Вихід: 0.72 г (87%). ходячи із 0.81 г (0.0025 моль) 6-(2-бромоетил)-6НC21H22N4. M.W. 330.44. Τ пл.=130-131°С. Масіндоло[2,3-b]хіноксаліну (15) та 0.70 см3 (0.62 г, спектр - m/z (I, %): 331 (100) - MH+; 246 (17); 232 0.00625 моль) азепану. Вихід: 0.73 г (84%). (7); 220 (9); 112 (20); 98 (60); 53(7). Спектр ПМР C22H24N4. M.W. 344.46. Τ пл.=75-76°С. Мас-спектр (CDCl3): аліфатичні СН: м. 1.432-1.480 м.д. (2Н, m/z (I, %): 345 (100) - MH+; 246 (16); 232 (7); 219 CH2(CH2CH2)2Ν(аліф)); м. 1.580-1.615 м.д. (4Н, (8); 126 (17); 112 (52); 69 (17); 53 (35). Спектр ПМР CH2(CH2CH2)2Ν(аліф)); м. 2.451-2.603 м.д. (4Н, (CDCl3): аліфатичні СН: м. 0.822-0.888 м.д. (4Н, СН2(СН2СН2)2N(аліф)); т. 2.865 м.д., 7.2 Гц (2Н, (CH2CH2CH2)2Ν(аліф)); м. 1.563-1.592 м.д. (4Н, Ν(аліф)CH2CH2N(аром)); т. 4.647 м.д., 7.2 Гц (2Н, (CH2CH2CH2)2Ν(аліф)); м. 2.940-3.055 м.д. (4Н, Ν(аліф)CH2CH2N(аром)); ароматичні СН: т. 7.354 м.д., (CH2CH2CH2)2Ν(аліф)); т. 3.160 м.д., 7.2 Гц (2Н, 7.2 Гц (1Н); д. 7.561 м.д., 8.1 Гц (1Н); м. 7.629Ν(аліф)CH2CH2N(аром)); т. 4.710 м.д., 7.2 Гц (2Н, 7.760 м.д. (3H); д.д. 8.127 м.д., 8.4 Гц, 1.5 Гц (1Н); Ν(аліф)CH2CH2N(аром)); ароматичні СН: т. 7.381 м.д., д.д. 8.298 м.д., 8.1 Гц, 1.2 Гц (1Н); д. 8.463 м.д., 7.8 7.2 Гц (1Н); д. 7.624 м.д., 8.1 Гц (1Н); м. 7.649Гц (1Н). Rf 0.59 (бензол-триетиламін 10:1); Rf 0.09 7.781 м.д. (3H); д.д. 8.136 м.д., 8.1 Гц, 1.8 Гц (1Н); (хлороформ-ацетон 10:1). д.д. 8.311 м.д., 8.1 Гц, 1.2 Гц (1Н); д. 8.477 м.д., 7.8 Приклад 10. Гц (1Н). Rf 0.56 (бензол-триетиламін 10:1); Rf 0.01 6-[2-(2-Метил-піперидин-1-іл)-етил]-6Н(хлороформ-ацетон 10:1). індоло[2,3-b]хіноксалін (8). Приклад 13. Синтез проводили як описано у прикладі 4, ви6-[2-(4-Метил-піперазин-1-іл)-етил]-6Нходячи із 0.81 г (0.0025 моль) 6-(2-бромоетил)-6Ніндоло[2,3-b]хіноксалін (11). індоло[2,3-b]хіноксаліну (15) та 0.74 см3 (0.62 г, Синтез проводили як описано у прикладі 4, ви0.00625 моль) 2-метилпіперидину. Вихід: 0.75 г ходячи із 0.81 г (0.0025 моль) 6-(2-бромоетил)-6Н(85%). C22H24N4. M.W. 344.46. Τ пл.=113-115°С. індоло[2,3-b]хіноксаліну (15) та 0.70 см3 (0.63 г, + Мас-спектр - m/z (I, %): 345 (100) - МН ; 247 (17); 0.00625 моль) 1-метилпіперазину. Вихід: 0.76 г 233 (5); 221 (7); 126 (15); 113 (63); 54 (8). Спектр (88%). C21H23N5. M.W. 345.45. Τ пл.=143-144°С. ПМР (CDCl3): аліфатичні СН: д. 1.120 м.д., 6.3 Гц Мас-спектр - m/z (I, %): 346 (100) - МН+; 247 (13); (2Н, СН(СН3)Ν(аліф)); м. 1.307-1.434 м.д. (2Н, 233 (8); 221 (10); 114 (26); 70 (22). Спектр ПМР CH2(CH2)2CH2СН); м. 1.634-1.813 м.д. (4Н, (CDCl3): аліфатичні СН: с. 2.270 м.д. (3H, CH3N); м. СН2(СН2)2СН2СН); м. 2.486-2.548 м.д. (4Н, 2.347-2.443 м.д. (4Н, CH3N(CH2CH2)2Ν(аліф)); м. CH2(CH2)2CH2CH(CH3)Ν(аліф)); м. 2.834-2.925 м.д. 2.598-2.696 м.д. (4Н, СН3N(CH2CH2)2Ν(аліф)); т. (1Н, СН2СН(СН3)Ν(аліф)); м. 3.098-3.270 м.д. (2Н, 2.874 м.д., 7.2 Гц (2Н, Ν(аліф)CH2CH2N(аром)); т. 4.583 Ν(аліф)CH2CH2N(аром)); м. 4.607-4.688 м.д. (2Н, м.д., 6.9 Гц (2Н, Ν(аліф)CH2CH2N(аром)); ароматичні Ν(аліф)CH2CH2N(аром)); ароматичні СН: т. 7.350 м.д., СН: т. 7.350 м.д., 7.8 Гц (1Н); д. 7.473 м.д., 8.1 Гц 7.5 Гц (1Н); д. 7.577 м.д., 7.8 Гц (1Н); м. 7.647(1Н); м. 7.621-7.753 м.д. (3H); д.д. 8.094 м.д., 8.4 7.756 м.д. (3H); д.д. 8.114 м.д., 8.4 Гц, 1.5 Гц (1Н); Гц, 1.5 Гц (1Н); д.д. 8.288 м.д., 8.4 Гц, 1.5 Гц (1Н); д.д. 8.291 м.д., 8.4 Гц, 1.8 Гц (1Н); д. 8.454 м.д., 7.8 д. 8.460 м.д., 7.8 Гц (1Н). Rf 0.19 (бензолГц (1Н). Rf 0.19 (бензол-триетиламін 10:1); Rf 0.02 триетиламін 10:1); Rf 0.02 (хлороформ-ацетон (хлороформ-ацетон 10:1). 10:1). Приклад 11. Приклад 14. 6-[2-(4-Метил-піперидин-1-іл)-етил]-6Н6-(2-Морфолін-1-іл)-етил]-6Н-індоло[2,3індоло[2,3-b]хіноксалін (9). b]хіноксалін (12). 9 92174 10 Синтез проводили як описано у прикладі 4, виПриклад 16. ходячи із 0.81 г (0.0025 моль) 6-(2-бромоетил)-6НВивчення антивірусної активності на культурах індоло[2,3-b]хіноксаліну (15) та 0.54 см3 (0.54 г, клітин L929 та ПТП. 0.00625 моль) 2-морфоліну. Вихід: 0.78 г (93%). Вплив сполук на противірусну резистентність C20H20N4O. M.W. 332.41. Τ пл.=125-126°С. Маскультур клітин L929 та ПТП вивчали за допомогою + спектр - m/z (I, %): 333 (100) - МH ; 247 (22); 233 мікрометоду скринінгу антивірусних сполук [Пер(10); 220 (14); 100 (43); 77 (6). Спектр ПМР (CDCl3): вичное изучение антивирусных свойств синтетиаліфатичні СН: т. 2.600 м.д., 4.5 Гц (4Н, ческих и природных соединений: Метод, рекоменO(CH2CH2)2N(al)); т. 2.864 м.д., 6.9 Гц (2Н, дации / Вотяков В.И., Бореко Е.И., Владыко Г.В. и Ν(аліф)CH2CH2N(аром)); 3.613 м.д., 4.8 Гц (4Н, др. - Минск. - 1986]. O(CH2CH2)2N(aI)); т. 4.613 м.д., 6.9 Гц (2Н, В 96-лункові пластикові панелі вносили суΝ(аліф)CH2CH2N(аром));ароматичні СН: т. 7.377 м.д., спензію клітин в концентрації, необхідній для фо7.2 Гц (1Н); д. 7.502 м.д., 8.1 Гц (1Н); м. 7.643рмування суцільного шару клітин. На 2-3-й день (в 7.774 м.д. (3H); д.д. 8.113 м.д., 7.8 Гц, 1.2 Гц (1Н); залежності від активності росту культури) середод.д. 8.292 м.д., 7.8 Гц, 1.5 Гц (1Н); д. 8.487 м.д., 7.8 вище зливали, моношар промивали середовищем Гц (1Н). Rf 0.53 (бензол-триетиламін 10:1); Rf 0.29 для культур клітин без сироватки і вносили дослі(хлороформ-ацетон 10:1). джувані препарати в серійних розведеннях в верПриклад 15. тикальних рядах. На кожне розведення відводили Визначення цитотоксичності препаратів в умо3 лунки для визначення антивірусної активності, вах in vitro клітин за дією на моношар клітин та одну - для контролю токсичності. Враховували пригніченням їх життєздатності на культурах клітин також контроль клітин та вірусу. Клітини інкубуваL929 та ПТП. ли з препаратами 24 год. при 37°С, після чого сеКультури клітин перевивної лінії фібробластів редовище вилучали з лунок. В лунки для визнамишей (L929) та текстикул поросяти (ПТП) вирочення контролю клітин та токсичності вносили щували у 96-лункових мікроплатах (в атмосфері, середовище для підтримання росту клітин, у всі що містить 5% СО2). Через 24 год з лунок, де сфоінші - суспензію вірусу везикулярного стоматиту рмувався суцільний моношар клітин видаляли (ВВС). Для визначення ефективності захисту клісередовище росту і вносили підтримуюче середотин проводили досліди із застосуванням ВВС в вище із розчиненими препаратами в діапазоні різних дозах: 10, 100, 1000 ЦТД50. Мікропанелі інкубували в термостаті з постійконцентрацій від 0.1-100 Μ (на одне розведення ним рівнем СО2 при 37°С та вологості 98% до нане менше 4 лунок). Контроль - лунки, в які було стання 100% цитопатичного ефекту (ЦПЕ) в лунвнесене тільки середовище для підтримання росках контролю вірусу. Потім визначали ступінь ту. Плати поміщали в термостат. Через 24 та 48 інгібування вірусоспецифічного ЦПЕ. Аналіз приггод після інкубації плат при 36°С в умовах 5% СО2 нічення вірусної реплікації проводили через 24 клітини розглядали за допомогою інвертованого год. Антивірусну активність препаратів МК оцінюмікроскопу при малому збільшенні з метою вияввали за цитопатичним ефектом в формі некрозу лення цитопатичної дії (ЦПД) препаратів, яку оці(визначення проценту клітин, що загинули за донювали за порушенням цілісності моношару, пояпомогою прямого підрахунку під мікроскопом). вою осередків дегенерованих клітин та визначали Визначали: ІД100 - дозу препарату (мкг/мл), що за чотирьохплюсовою системою. Визначали: повністю інгібує розвиток вірусспецифічного ЦПЕ; ТЦД100 - тканинну цитотоксичну дозу (мкг/см3), що ІД50 - дозу (мкг/мл), що затримує ЦПЕ вірусу на викликає повну деструкцію клітин, ТЦД50 - тканин50%. ну цитотоксичну дозу (мкг/см3), що викликає зміну Дані про антивірусну активність сполук 1-12 50% моношару клітин; МВК - максимально витринаведені у таблиці 2. мувану концентрацію - максимальну із досліджеПриклад 17. них доз речовини (мкг/см3), що не викликає незвоВивчення інтерфероніндукуючих властивостей ротних змін у морфології та життєздатності клітин на культурах клітин L929 та ПТП. у порівнянні з контролем (фактично вона відповіІнтерфероніндукуючу активність синтезованих дає ТЦД0). сполук вивчали як описано [Доклінічні дослідження Розрахунок ТЦД50 проводили за методом Ріда лікарських засобів. Методичні рекомендації. За і Менча за формулами: редакцією член-кореспондента АМН України О.В. Стефанова. / Міністерство охорони здоров'я Украlog2ТЦД50=log2A-(50-b)·log2d/(а-b) чи їни. Державний фармакологічний центр., Київ, log2ТЦД50=log2В+(a-50)·log2d/(a-b), 2001. С. 392]. Інтерфероніндукуючу активність препаратів в де log2А і log2В - логарифми концентрацій за умовах in vitro вивчали в культурах клітин L929 та основою 2, що викликали ефекти відповідно більПТП. Препарати в різних дозах додавали до сфоше чи менше 50%, але найближчі до 50%: а і b рмованого моношару клітин і культивували при ефект, викликаний концентраціями А і В, %: log2d 37°С на протязі 24 та 48 год, після чого надосадологарифм за основою 2 співвідношення між досліву рідину збирали і в ній визначали активність інджуваними концентраціями. терферону за раніше опублікованою методикою. Статистичну обробку результатів виконували [Доклінічні дослідження лікарських засобів. Метозгідно з [Лакин Г.Ф. Биометрия. - Μ.: Высшая шкодичні рекомендації. За редакцією членла, 1990, с. 298-303] при Ρ
ДивитисяДодаткова інформація
Назва патенту англійськоюAminoethyl-6h-indolo-[2,3-b]quinoxalines as antiviral agents against vesicular stomatitis virus and interferon inducers
Автори англійськоюShybinska Maryna Olehivna, Liakhov Serhii Anatoliiovych, Andronati Serhii Andriiovych, Zholobak Nadia Mykhailivna, Spivak Mykola Yakovych
Назва патенту російськоюАминоэтил-6н-индоло-[2,3-в]хиноксалины как противовирусные агенты по отношению к вирусу везикулярного стоматита и индукторы интерферонов
Автори російськоюШибинская Марина Олеговна, Ляхов Сергей Анатольевич, Андронати Сергей Андреевич, Жолобак Надежда Михайловна, Спивак Николай Яковлевич
МПК / Мітки
МПК: C07C 209/00, C07D 213/00
Мітки: інтерферонів, вірусу, індуктори, відносної, противірусні, агенти, везикулярного, стоматиту, 6-аміноетил-6н-індоло-[2,3-b]хіноксаліни
Код посилання
<a href="https://ua.patents.su/7-92174-6-aminoetil-6n-indolo-23-bkhinoksalini-yak-protivirusni-agenti-vidnosno-virusu-vezikulyarnogo-stomatitu-ta-induktori-interferoniv.html" target="_blank" rel="follow" title="База патентів України">6-аміноетил-6н-індоло-[2,3-b]хіноксаліни як противірусні агенти відносно вірусу везикулярного стоматиту та індуктори інтерферонів</a>
Попередній патент: Спосіб циклічної термообробки відпалюваного матеріалу
Наступний патент: Похідні хіноліну як антибактеріальні агенти
Випадковий патент: Штам дріжджів saccharomyces cerevisiae imb y-5055, що використовується для зброджування квасного сусла при виробництві квасу











