Макроциклічні інгібітори вірусу гепатиту с
Номер патенту: 93377
Опубліковано: 10.02.2011
Автори: Велінг Хорст Юрген, Сіммен Кеннет Алан, Розенквіст Еса Анніка Крістіна, Белфраге Анна Карін Гертруд Ліннеа, Ху Лілі, Нілссон Карл Магнус, Де Кок Герман Аугустінус, Рабуассон П'єр Жан-Марі Бернар, Ліндстром Матс Стефан, Валльберг Ханс Крістіан, Ліндквіст Карін Шарлотта, Канберг Піа Сесілія, Сальберг Свен Крістер, Самуельссон Бенгт Бертіл, Классон Бьорн Олоф
Формула / Реферат
1. Сполука формули І:

або її N-оксиди, солі й стереоізомери, де
А являє собою OR1, NHS(=O)рR2; де
R1 являє собою водень, С1-С6алкіл, С0-С3алкіленкарбоцикліл, C0-С3алкіленгетероцикліл;
R2 являє собою С1-С6алкіл, С0-С3алкіленкарбоцикліл, С0-С3алкіленгетероцикліл;
р незалежно дорівнює 1 або 2;
n дорівнює 3, 4, 5 або 6;
--- означає необов'язковий додатковий зв'язок;
L являє собою N або CRz;
Rz являє собою Н або утворює подвійний зв'язок з відзначеним зірочкою атомом вуглецю;
Rq являє собою Н, або, коли L являє собою CRz, Rq може бути також С1-С6алкілом;
Rr являє собою хіназолініл, необов'язково заміщений одним, двома або трьома замісниками, кожен з яких незалежно вибраний з С1-С6алкілу, С1-С6алкокси, гідроксилу, галогену, галоген С1-С6алкілу, аміно, моно- або діалкіламіно, моно- або діалкіламінокарбонілу, С1-С6алкілкарбоніламіно, С0-С3алкіленкарбоциклілу й С0-С3алкіленгетероциклілу;
R5 являє собою водень, С1-С6алкіл, С1-С6алкоксіС1-С6алкіл або С3-С7циклоалкіл; і де кожен С1-С6алкіл, С0-С3алкіленкарбоцикліл або С0-С3алкіленгетероцикліл необов'язково заміщений 1-3 замісниками, незалежно вибраними з групи, що складається з галогену, оксо, нітрилу, азидо, нітро, С1-С6алкілу, С0-С3алкіленкарбоциклілу, С0-С3алкіленгетероциклілу, NH2C(=O)-, Y-NRaRb, Y-O-Rb, Y-C(=O)Rb, Y-(C=О)NRaRb,Y-NRa(=O)Rb, Y-NHS(=Op)Rb, Y-S(=O)pRb і Y-S(=O)pNraRb, Y-С(=О)ORb, Y-NRaC(=O)ORb;
Y незалежно являє собою зв'язок або С1-С3алкілен;
Ra являє собою незалежно Н, С1-С6алкокси, С1-С3алкіл; і
Rb являє собою незалежно Н, С1-С6алкіл, С1-С6алкокси, С0-С3алкіленкарбоцикліл або С0-С3алкіленгетероцикліл;
або Ra і Rb разом з атомом азоту, до якого вони приєднані, з'єднуються з утворенням гетероциклільної групи.
2. Сполука за п. 1 з частковою структурою:
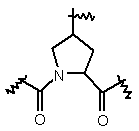 або
або  .
.
3. Сполука за п. 1, де n дорівнює 4 або 5.
4. Сполука за п. 3, де зв'язок ---, сусідній із циклопропільною частиною, є додатковим зв'язком.
5. Сполука за п. 1, де R5 являє собою водень або метил.
6. Сполука за п. 1, де А являє собою -ОН або -NHS(=O)2-циклопропіл.
7. Сполука за п. 1, де А являє собою NHS(=O)2-С1-C6алкілзаміщений циклопропіл.
8. Сполука за п. 1 формули:
 ,
,
де n, A, L, Rq і R5 мають значення, згадані в п. 1, і
R6 являє собою водень, С1-С6алкіл, С1-С6алкокси, С0-С3алкіленкарбоцикліл, С0-С3алкіленгетероцикліл, гідрокси, бром, хлор або фтор;
R9 являє собою водень, С1-С6алкіл, С1-С6алкокси, NRаRb, С0-С3алкіленкарбоцикліл, С0-С3алкіленгетероцикліл, де зазначений карбоцикліл або гетероцикліл R9 необов'язково заміщений R10;
R10 являє собою С1-С6алкіл, С0-С3алкіленциклоалкіл, С0-С3алкіленгетероцикліл, С1-С6алкокси, С1-С6алкоксіС1-С6алкіл, аміно, амідо, азидо, меркапто, ціано, сульфоніл, (С1-С3алкіл)сульфоніл, нітро, гідрокси, карбокси, меркапто, галоген, галогенС1-С6алкіл, галогенС1-С6алкілокси;
Ra і Rb мають значення, згадані в п. 1;
R11 являє собою водень або С1-С6алкокси.
9. Сполука за п. 8, де R6 являє собою С1-С3алкіл, хлор або фтор, переважно бром або водень.
10. Сполука за п. 8, де R11 являє собою водень або метокси.
11. Сполука за п. 8. де R9 являє собою феніл або гетероарил, причому кожен з них необов'язково заміщений одним або двома R10, де
R10 являє собою водень, C1-С6алкіл, С3-С7циклоалкіл, С3-С7гетероцикліл, (С1-С6алкокси, галоген, аміно, необов'язково моно- або дизаміщений С1-С6алкілом, або амідо, необов'язково моно- або дизаміщений С1-С6алкілом.
12. Сполука за п. 11, де R9 являє собою феніл, піридил, тіазоліл, оксазоліл або піразоліл, кожен з яких необов'язково заміщений, як зазначено, R10.
13. Сполука за п. 12, де R10 являє собою водень, фтор, дифтор, метил, етил, ізопропіл, трет-бутил, С1-С6алкокси, аміно, моно- або діС1-С6алкіламіно, піролідинил, піперидиніл, піперазиніл, N-метилпіперазиніл, морфолініл або моно- або діС1-С6алкіламідо.
14. Сполука за п. 13, де R10 являє собою водень, фтор або метокси.
15. Сполука за п. 12, де R9 вибраний з
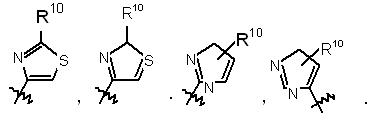
16. Сполука за п. 12, де R9 вибраний з
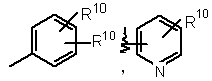 .
.
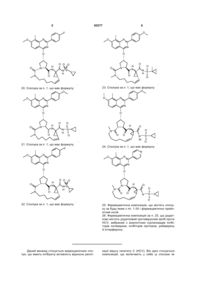
17. Сполука за п. 1, що має формулу:
 .
.
18. Сполука за п. 1, що має формулу:
 .
.
19. Сполука за п. 1, що має формулу:
 .
.
20. Сполука за п. 1, що має формулу:
 .
.
21. Сполука за п. 1, що має формулу:
 .
.
22. Сполука за п. 1, що має формулу:
 .
.
23. Сполука за п. 1, що має формулу:
 .
.
24. Сполука за п. 1, що має формулу:
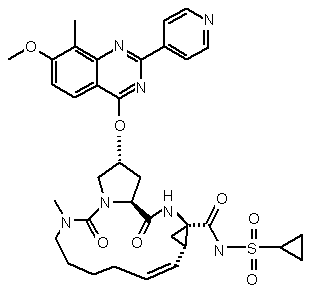 .
.
25. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-24 і фармацевтично прийнятний носій.
26. Фармацевтична композиція за п. 25, що додатково містить додатковий противірусний засіб проти HCV, вибраний з аналогічних нуклеозидам інгібіторів полімерази, інгібіторів протеази, рибавірину й інтерферону.
Текст
УКРАЇНА (19) UA (11) 93377 (13) C2 (51) МПК (2011.01) C07D 417/04 (2006.01) C07D 239/72 (2006.01) A61K 31/517 A61P 31/12 (2006.01) МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ОПИС ДО ПАТЕНТУ НА ВИНАХІД (54) МАКРОЦИКЛІЧНІ ІНГІБІТОРИ ВІРУСУ ГЕПАТИТУ С O Rq O R5 O * L N H A O N [ ] I n або її N-оксиди, солі й стереоізомери, де А являє собою OR1, NHS(=O)рR2; де R1 являє собою водень, С1-С6алкіл, С0С3алкіленкарбоцикліл, C0-С3алкіленгетероцикліл; C2 (13) 93377 (11) R2 являє собою С1-С6алкіл, С0 С3алкіленкарбоцикліл, С0-С3алкіленгетероцикліл; р незалежно дорівнює 1 або 2; n дорівнює 3, 4, 5 або 6; --- означає необов'язковий додатковий зв'язок; L являє собою N або CRz; Rz являє собою Н або утворює подвійний зв'язок з відзначеним зірочкою атомом вуглецю; Rq являє собою Н, або, коли L являє собою CRz, Rq може бути також С1-С6алкілом; Rr являє собою хіназолініл, необов'язково заміщений одним, двома або трьома замісниками, кожен з яких незалежно вибраний з С1-С6алкілу, С1С6алкокси, гідроксилу, галогену, галоген С1С6алкілу, аміно, моно- або діалкіламіно, моно- або діалкіламінокарбонілу, С1-С6алкілкарбоніламіно, С0-С3алкіленкарбоциклілу й С 0С3алкіленгетероциклілу; R5 являє собою водень, С1-С6алкіл, С1С6алкоксіС1-С6алкіл або С3-С7циклоалкіл; і де кожен С1-С6алкіл, С0-С3алкіленкарбоцикліл або С0С3алкіленгетероцикліл необов'язково заміщений 13 замісниками, незалежно вибраними з групи, що складається з галогену, оксо, нітрилу, азидо, нітро, С1-С6алкілу, С0-С3алкіленкарбоциклілу, С0С3алкіленгетероциклілу, NH2C(=O)-, Y-NRaRb, YO-Rb, Y-C(=O)Rb, Y-(C=О)NRaRb,Y-NRa(=O)Rb, YNHS(=Op)Rb, Y-S(=O)pRb і Y-S(=O)pNRaRb, YС(=О)ORb, Y-NRaC(=O)ORb; Y незалежно являє собою зв'язок або С1С3алкілен; Ra являє собою незалежно Н, С1-С6алкокси, С1С3алкіл; і Rb являє собою незалежно Н, С1-С6алкіл, С1С6алкокси, С0-С3алкіленкарбоцикліл або С0С3алкіленгетероцикліл; або Ra і Rb разом з атомом азоту, до якого вони приєднані, з'єднуються з утворенням гетероциклільної групи. 2. Сполука за п. 1 з частковою структурою: UA (21) a200800492 (22) 28.07.2006 (24) 10.02.2011 (86) PCT/EP2006/064822, 28.07.2006 (31) 05107057.1 (32) 29.07.2005 (33) EP (31) 06113097.7 (32) 25.04.2006 (33) EP (46) 10.02.2011, Бюл.№ 3, 2011 р. (72) РАБУАССОН П'ЄР ЖАН-МАРІ БЕРНАР, FR/BE, ДЕ КОК ГЕРМАН АУГУСТІНУС, BE, ХУ ЛІЛІ, NL/BE, СІММЕН КЕННЕТ АЛАН, GB/BE, ЛІНДКВІСТ КАРІН ШАРЛОТТА, SE, ЛІНДСТРОМ МАТС СТЕФАН, SE, БЕЛФРАГЕ АННА КАРІН ГЕРТРУД ЛІННЕА, SE, ВЕЛІНГ ХОРСТ ЮРГЕН, DE/SE, НІЛССОН КАРЛ МАГНУС, SE, САМУЕЛЬССОН БЕНГТ БЕРТІЛ, SE, РОЗЕНКВІСТ ЕСА АННІКА КРІСТІНА, SE, САЛЬБЕРГ СВЕН КРІСТЕР, SE, ВАЛЛЬБЕРГ ХАНС КРІСТІАН, SE, КАНБЕРГ ПІА СЕСІЛІЯ, SE, КЛАССОН БЬОРН ОЛОФ, SE (73) ТІБОТЕК ФАРМАСЬЮТІКЕЛЗ ЛТД., IE, МЕДІВІР АБ, SE (56) WO 2005028501 A WO 2004037855 A WO 03053349 A (57) 1. Сполука формули І: Rr 2 (19) 1 3 93377 N O O O або . 3. Сполука за п. 1, де n дорівнює 4 або 5. 4. Сполука за п. 3, де зв'язок ---, сусідній із циклопропільною частиною, є додатковим зв'язком. 5. Сполука за п. 1, де R5 являє собою водень або метил. 6. Сполука за п. 1, де А являє собою -ОН або NHS(=O)2-циклопропіл. 7. Сполука за п. 1, де А являє собою NHS(=O)2-С1C6алкілзаміщений циклопропіл. 8. Сполука за п. 1 формули: O R 4 12. Сполука за п. 11, де R9 являє собою феніл, піридил, тіазоліл, оксазоліл або піразоліл, кожен з яких необов'язково заміщений, як зазначено, R10. 13. Сполука за п. 12, де R10 являє собою водень, фтор, дифтор, метил, етил, ізопропіл, трет-бутил, С1-С6алкокси, аміно, моно- або діС1-С6алкіламіно, піролідинил, піперидиніл, піперазиніл, Nметилпіперазиніл, морфолініл або моно- або діС1С6алкіламідо. 14. Сполука за п. 13, де R10 являє собою водень, фтор або метокси. 15. Сполука за п. 12, де R9 вибраний з 10 R10 R N 11 N R N S . R 5 N , N . 16. Сполука за п. 12, де R вибраний з 10 R10 R 9 R10 , N . 17. Сполука за п. 1, що має формулу: O O * L O R10 N 9 N R q 10 N S , 6 R R N H A N O O N N [ ] O n I , де n, A, L, Rq і R5 мають значення, згадані в п. 1, і R6 являє собою водень, С1-С6алкіл, С1-С6алкокси, С0-С3алкіленкарбоцикліл, С0 С3алкіленгетероцикліл, гідрокси, бром, хлор або фтор; R9 являє собою водень, С1-С6алкіл, С1-С6алкокси, NRаRb, С0-С3алкіленкарбоцикліл, С0С3алкіленгетероцикліл, де зазначений карбоцикліл або гетероцикліл R9 необов'язково заміщений R10; R10 являє собою С1-С6алкіл, С0С3алкіленциклоалкіл, С0-С3алкіленгетероцикліл, С1-С6алкокси, С1-С6алкоксіС1-С6алкіл, аміно, амідо, азидо, меркапто, ціано, сульфоніл, (С1С3алкіл)сульфоніл, нітро, гідрокси, карбокси, меркапто, галоген, галогенС1-С6алкіл, галогенС1С6алкілокси; Ra і Rb мають значення, згадані в п. 1; R11 являє собою водень або С1-С6алкокси. 9. Сполука за п. 8, де R6 являє собою С1-С3алкіл, хлор або фтор, переважно бром або водень. 10. Сполука за п. 8, де R11 являє собою водень або метокси. 11. Сполука за п. 8. де R9 являє собою феніл або гетероарил, причому кожен з них необов'язково заміщений одним або двома R10, де 10 R являє собою водень, C1-С6алкіл, С3С7циклоалкіл, С3-С7гетероцикліл, (С1-С6алкокси, галоген, аміно, необов'язково моно- або дизаміщений С1-С6алкілом, або амідо, необов'язково моно- або дизаміщений С1-С6алкілом. N N O O O O N S O . 18. Сполука за п. 1, що має формулу: N O N O N N O N O O O N S O 19. Сполука за п. 1, що має формулу: . 5 93377 6 O F N O N O N N O O O H N N O O O N S H O N H N N O . . 23. Сполука за п. 1, що має формулу: O O N O N O N N O O H N N O O N O O N H S H N N O O O O O H O . 24. Сполука за п. 1, що має формулу: F N N N O N N O O H N O N S N . 21. Сполука за п. 1, що має формулу: O O N S H O O N 20. Сполука за п. 1, що має формулу: O O O O O H N N N S H N O . 22. Сполука за п. 1, що має формулу: Даний винахід стосується макроциклічних сполук, що мають інгібуючу активність відносно реплі O O O N S O . 25. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-24 і фармацевтично прийнятний носій. 26. Фармацевтична композиція за п. 25, що додатково містить додатковий противірусний засіб проти HCV, вибраний з аналогічних нуклеозидам інгібіторів полімерази, інгібіторів протеази, рибавірину й інтерферону. кації вірусу гепатиту С (HCV). Він далі стосується композицій, що включають у себе ці сполуки як 7 активні інгредієнти, а також способів одержання цих сполук і композицій. Вірус гепатиту С є основною причиною хронічного захворювання печінки в усьому світі й стає фокусом значних медичних досліджень. HCV є членом сімейства вірусів Flaviviridae роду hepacivirus і близько пов'язаний з родом flavivirus, що містить у собі ряд вірусів, що беруть участь у захворюванні людини, як-от вірус денге й вірус жовтої лихоманки, і з сімейством пестивірусів тварин, які містять у собі вірус бичачої вірусної діареї (BVDV). HCV є вірусом одиоланцюгової(+)-РНК з геномом, що має приблизно 9600 основ. Геном містить у собі як 5'-, так і 3'-нетрансльовані ділянки, які вибирають вторинні структури РНК, і центральну відкриту рамку зчитування, що кодує один поліпротеїн приблизно з 3010-3030 амінокислотами. Поліпротеїн складається з десяти генних продуктів, які генеруються з поліпротеїнупопередника оркестрованим рядом спів- і післетрансляційних ендопротеолітичних розщеплень, опосередковуваних як протеазами хазяїна, так і вірусними протеазами. Вірусні структурні білки містять у собі коров'ячий нуклеокапсидний білок і два оболонкових глікопротеїни Е1 і Е2. Неструктурні (NS) білки містять у собі білки з деякими істотними вірусними ферментативними функціями (гелікази, полімерази, протеази), а також білки невідомої функції. Реплікація вірусного геному опосредуется РНК-залежною РНК-полімеразою, кодованою геном неструктурного білка 5b (NS5B). Виявлено, що, крім полімерази функції вірусної гелікази й протеази, обидві з яких властиві біфункціональному білку NS3, є істотними для реплікації РНК HCV. Крім серинпротеази NS3 HCV кодує також металопротеїназу в ділянці NS2. Після початкового гострого інфікування в основній частині інфікованих індивідуумів розвивається хронічний гепатит, оскільки HCV реплікується переважно в гепатоцитах, але не є безпосередньо цитопатичним. Зокрема, виявляється, що відсутність сильної реакції на Тлімфоцити й висока схильність вірусу до мутації стимулюють високий ступінь хронічної інфекції. Хронічний гепатит може розвитися у фіброз печінки, що призводить до цирозу, останньої стадії захворювання печінки, і НСС (гепатоклітинної карциноми), що є основною причиною трансплантацій печінки. Є 6 основних генотипів HCV і більш, ніж 50 підтипів, які по-різному розподілені по географічних зонах. Тип 1 HCV є переважним генотипом у Європі й США. Екстенсивна генетична гетерогенність HCV має важливе діагностичне й клінічне значення, можливо, це пояснює труднощі у розробці вакцини й відсутність реакції на терапію. Передача інфекції HCV може мати місце за допомогою контактування з інфікованою кров'ю або продуктами крові, наприклад, після переливання крові або внутрішньовенного введення лікарського засобу. Введення діагностичних тестів, застосовуваних при проведенні скринінгу крові, призвело до понижувальної тенденції в частоті інфікування HCV після переливання крові. Однак, за наявності повільного розвитку захворювання 93377 8 печінки до кінцевої стадії, існуючі інфекції будуть продовжувати являти собою серйозний медичний і економічний тягар протягом десятиліть. Сучасні терапії HCV засновані на застосуванні (пегільованого) інгерферону-альфа (IFN-) у комбінації з рибавірином Ця комбінована терапія дає стійко підтримувану вірологічну реакцію у більш, ніж 40% пацієнтів, інфікованих вірусами генотипу 1, і приблизно у 80% пацієнтів, інфікованих генотипами 2 і 3 Крім обмеженої ефективності для HCV типу 1, ця комбінована терапія має значні побічні дії й погано переноситься багатьма пацієнтами. Основні побічні дії містять у собі подібні до грипу симптоми, гематологічні аномальності й невропсихиатричні симптоми. Тому існує потреба в більш ефективних, придатних і краще стерпних лікуваннях. В останній час привернули увагу два пептидоміметичних інгібітори протеази WCW як клінічні кандидати, а саме, B1LN-2061, описаний у WO 00/59929 і VX-950, описаний у WO03/87092. Ряд аналогічних інгібіторів протеази HCV був описаний в академічній і патентній літературі. Стало вже очевидним, що в результаті тривалого введення BILN-2061 або VX-950 відбувається відбір мутантів HCV, які є резистентними до відповідного лікарського засобу, так звані «рятовані» від лікарського засобу мутанти. Ці «рятовані» від лікарського засобу мутанти мають характеристичні мутації в геномі протеази HCV, а саме, D168V, D168A і/або A156S. Відповідно до цього, потрібні додаткові лікарські засоби з іншими картинами резистентності для забезпечення уражених пацієнтів вибором лікування, і можливо, що комбінована терапія з декількома лікарськими засобами буде нормою в майбутньому, навіть для першого сукупного лікування. Досвід роботи з лікарськими засобами проти HIV, зокрема інгібіторами протеази HIV додатково показав, що субоптимальна фармакокінетика і комплексні схеми прийому лікарських засобів швидко призводять до ненавмисного порушення хворим схеми прийому лікарського засобу. Це, у свою чергу, означає, що 24-годинна концентрація «западини» (мінімальні концентрація в плазмі) для відповідних лікарських засобів у схемі лікарського лікування НIV часто опускається нижче граничної величини ІС90 або ED90 протягом більших періодів дня. Вважається, що 24-годинний проміжок рівня «западини», щонайменше, ІС50, і більш реально, ІС90 або ED90, є істотним для вповільнення розвитку «рятованих» від лікарського засобу мутантів. Досягнення необхідної фармакокінетики й метаболізму лікарського засобу, що дозволяє досягти таких рівнів «западини», забезпечує суворі вимоги для розробки лікарського засобу. Стійка пептидоміметична природа інгібіторів протеази HCV із множинними пептидними зв'язками попереднього рівня техніки ставить фармакокінетичні бар'єри для ефективних схем прийому лікарських засобів. Існує потреба в інгібіторах HCV, які можуть переборювати недоліки сучасної терапії HCV такі як побічні дії, обмежена ефективність, поява резистентності й недостатності в сприйнятливості. 9 Даний винахід стосується інгібіторів реплікації HCV, які проявляють щонайменше одну поліпшену властивість у порівнянні зі сполуками відомого рівня техніки. Зокрема, інгібітори даного винаходу перевершують в одній або декількох наступних фармакологічних родинних властивостях, тобто активності, зниженій цитотоксичності, поліпшеній фармакокінетиці, поліпшеному профілі резистентності, прийнятній дозі й завантаженні пігулки. Крім того, сполуки даного винаходу мають відносно низьку молекулярну масу й звичайно легко синтезуються з вихідних речовин, які є комерційно доступними або легко доступними за допомогою відомих у даній галузі синтетичних методик. Даний винахід стосується інгібіторів реплікації HCV, які можна представити сполуками формули (І): і N-оксидами, солями й стереоізомерами цих сполук, де А являє собою OR1, NHS(-O)pR2; де R1 являє собою водень, С1-С6алкіл, С0С3алкіленкарбоцикліл, С0-С3-алкіленгетероцикліл; R2 являє собою С1-С6алкіл, С0С3алкіленкарбоцикліл, С0-С3алкіленгетероцикліл; р незалежно дорівнює 1 або 2; n дорівнює 3, 4 5 або 6; --- означає необов'язковий додатковий зв'язок; L являє собою N або CRz; Rz являє собою Η або утворює подвійний зв'язок з відзначеним зірочкою атомом вуглецю; Rq являє собою Η або, коли L являє собою CRz, Rq може бути також С1-С6алкілом; Rr являє собою хіназолініл, необов'язково заміщений одним, двома або трьома замісниками, кожен з яких незалежно вибраний з С1-С6алкілу, С1-С6алкокси, гідроксилу, галогену, галоген С1С6алкілу, аміно, моно- або діалкіламіно, моно- або діалкіламінокарбонілу, С1-С6алкілкарбоніламіно, С0-С3алкіленкарбоциклілу й С 0С3алкіленгетероциклілу; R5 являє собою водень, С1-С6алкіл, С1С6алкоксиС1-С6алкіл або С3-С7циклоaлкiл; і де кожний С1-С6алкіл, С0-С3алкіленкарбоцикліл або С0-С3алкіленгетероцикліл необов'язково заміщений 1-3 замісниками, незалежно вибраними з групи, що включає галоген оксо нітрил, азидо, нітро, С1-С6алкіл, С0-С3алкіленкарбоцикліл, С0С3алкіленгетероцикліл, NH2C(=O)-, Y-NRaRb, Y-ORb, Y-C(=O)Rb, Y-(C=O)NRaRb, Y-NRaC(=O)Rb, Y 93377 10 NHSOpRb, Y-S(=O)pRb і Υ-S(=O)pNRaRb, YC(=O)ORb, Y-NRaC(=O)ORb; Υ незалежно являє собою зв'язок або С1С3алкілен; Ra являє собою незалежно Н, С1-С6алкокси, С1-С3алкіл або Rb являє собою незалежно Н, С1-С6алкіл, С1С6алкокси, С0-С3алкіленкарбоцикліл або С0С3алкіленгетероцикліл; або Ra і Rb разом з атомом азоту, до якого вони приєднані, з'єднуються з утворенням гетероциклільної групи. Винахід далі має відношення до способів одержання сполук формули (I), їхніх проліків, Nоксидів, адитивних солей, четвертинних амінів, комплексів металів і стереохімічних ізомерних і форм, їхніх проміжних сполук і застосування проміжних сполук при одержанні сполуки формули (І). Винахід стосується сполук формули (I) per se, їхніх проліків, N-оксидів, адитивних солей, четвертинних амінів, комплексів металів і стереохімічних ізомерних форм для застосування як лікарський засіб. Винахід далі стосується фармацевтичних композицій, що включають у себе вищевказані сполуки, для введення суб'єктові, що страждає на інфекцію HCV. Фармацевтичні композиції можуть містити в собі комбінації вищевказаних сполук з іншими анти-НСV-агентами. Винахід також має відношення до застосування сполуки формули (І), її проліків, N-оксиду, адитивної солі, четвертинного аміну, комплексу металу або стереохімічної ізомерної форми для виготовлення лікарського засобу для інгібування реплікації HCV. Або винахід стосується способу інгібування реплікації HCV у теплокровної тварини, причому зазначений спосіб включає введення ефективної кількості сполуки формули (І) або її проліків, N-оксиду, адитивної солі, четвертинного аміну, комплексу металу або стереохімічної ізомерної форми. Винахід далі пропонує сполуки формули І, представлені формулою (It): та їхні N-оксиди, солі й стереоізомери, де Xt являє собою N, СН і, коли Xt має подвійний зв'язок, він означає С; Rt1 являє собою -ORt5, - NH-SO2Rt6; Rt2 являє собою водень і, коли Xt являє собою С або СН, Rt2 може також бути С1-6алкілом; 11 Rt3 являє собою водень, С1-6алкіл, С1алкоксиС1-6алкіл або С3-7циклоалкіл; 6 Rt4 являє собою хіназолініл, необов'язково заміщений одним, двома або трьома замісниками, кожен з яких незалежно вибраний з С1-6алкілу, С1гідрокси, галогену, полігалоген С16алкокси, 6алкілу, полігалогенС1-6алкокси, аміно, моно- або диС1-6алкіламіно, моноабо диС16алкіламінокарбонілу, С1-6алкілкарбоніламіно, арилу й Het; n дорівнює 3, 4, 5 або 6; де кожна пунктирна лінія (представлена ---) являє собою необов'язковий додатковий зв'язок; Rt5 являє собою водень; арил; Het; С37циклоалкіл, необов'язково заміщений С1-6алкілом; або С1-6алкіл, необов'язково заміщений С37циклоалкілом, арилом або Het; Rt6 являє собою арил; Het; С3-7циклоалкіл, необов'язково заміщений С1-6алкілом; або С1-6алкіл, необов'язково заміщений С3-7циклоалкілом, арилом або Het; кожний арил, як група або частина групи, являє собою феніл, необов'язково заміщений одним, двома або трьома замісниками, вибраними з галогену, гідрокси, нітро, ціано, карбоксилу, С1-6алкілу, С1-6алкокси, С1-6алкоксиС1-6алкілу, С1аміно, моноабо диС16алкілкарбонілу, азидо, меркапто, полігалогенС16алкіламіно, 6алкілу, полігалогенС1-6алкокси, циклопропілу, піролідинілу, піперидинілу, піперазинілу, 4-С1-6алкілпіперазинілу, 4-С1-6алкілкарбонілпіперазинілу й морфолінілу, і кожний Het, як група або частина групи, являє собою 5- або 6-членне насичене, частково ненасичене або повністю ненасичене гетероциклічне кільце, що містить 1-4 гетероатоми, кожен з яких незалежно вибраний з атомів азоту, кисню й сірки, і необов'язково заміщене одним, двома або трьома замісниками, кожен з яких незалежно вибраний з групи, що включає галоген, гідрокси, нітро, ціано, карбоксил, С1-6алкіл, С1-6алкокси, С1-6алкоксиС16алкіл, С1-6алкілкарбоніл, аміно, моно- або диС16алкіламіно, азидо, меркапто, полігалогенС1-6алкіл, полігалогенС1-6алкокси, циклопропіл, піролідиніл, піперидиніл, піперазиніл, 4-С1-6алкілпіперазиніл, 4С1-6алкіл-карбонілпіперазиніл й морфолініл. Має бути очевидно, що в альтернативному варіанті здійснення винаходу в безпосередньо вище наведеному абзаці Rt1 у широкому сенсі відповідає A, Rt2 у широкому сенсі відповідає Rq, Rt3 у широкому сенсі відповідає R5, X у широкому сенсі відповідає L, арил у широкому сенсі містить у собі С0-С3алкіленкарбоцикліл, де С0-С3алкілен відсутній (тобто є зв'язком), і Het у широкому сенсі включає у себе С0-С3алкіленгетероцикліл, де С0С3алкілен відсутній (тобто є зв'язком) Переваги, зазначені нижче для формули І, застосовують навіть для відповідних значень у формулі It і посилання на формулу (І) мають тлумачитися як такі, що включають відповідні сполуки формули (It) Застосовувані в описі вище й нижче по тексту терміни мають нижченаведені визначення, якщо не застережено особливо. Термін галоген є родовим для фтору, хлору, брому та йоду. 93377 12 Термін «галогенС1-6алкіл», як група або частина групи, наприклад, у галогенС1-6алкокси, визначається як моно- або полігалогензаміщений С16алил, зокрема, С1-6алкіл, заміщений одним, двома, трьома, чотирма, п'ятьома, шістьома або більшим числом атомів галогену, як-от метил або етил з одним або більшим числом атомів фтору, наприклад, дифторметил, трифторметил, трифторетил. Кращим є трифторметил. Включені також перфторС1-6алкільні групи, ям є С1-6алкільними групами, де всі атоми водню замінені атомами фтору, наприклад пентафторетил. У випадку, коли більш, ніж один атом галогену приєднаний до алкільної групи у визначенні полігалогенС1-6алкіл, атоми галогену можуть бути однаковими або різними. Застосовуваний тут «С1-4алкіл», як група або частина групи, означає насичені вуглеводневі радикали з нерозгалуженим або розгалуженим ланцюгом, що мають 1-4 атоми вуглецю, такі як, наприклад, метил, етил, 1-пропіл, 2-пропіл, 1-бутил, 2-бутил, 2-метил-1-пропіл «С1-6алкіл» містить у собі С1-4алкільні радикали й більш високі його гомологи, що мають 5 або 6 атомів вуглецю, такі як, наприклад, 1-пентил, 2-пентил, 3-пентил, 1-гексил, 2-гексил, 2-метил-1-бутил, 2-метил-1-пентил, 2етил-1-бутил, 3-метил-2-пентил тощо. Цікавим серед С1-6алкілів є С1-4алкіл. Термін «С2-6алкеніл», як група або частина групи, означає вуглеводневі радикали з нерозгалуженим або розгалуженим ланцюгом, що мають насичені вуглець-вуглецеві зв'язки й, щонайменше, один подвійний зв'язок і що мають 2-6 атомів вуглецю, такі як, наприклад, етеніл (або вініл), 1пропеніл, 2-пропеніл (або аліл), 1-бутеніл, 2бутеніл, 3-бутеніл, 2-метил-2-пропеніл, 2-пентеніл, 3-пентеніл, 2-гексеніл, 3-гексеніл, 4-гексеніл, 2метил-2-бутеніл, 2-метил-2-пентеніл тощо. Цікавим серед С1-6алкенілів є С2-4алкеніл. Термін «С2-6алкініл», як група або частина групи, означає вуглеводневі радикали з нерозгалуженим або розгалуженим ланцюгом, що мають насичені вуглець-вуглецеві зв'язки й щонайменше один потрійний зв'язок і що мають 2-6 атомів вуглецю, такі як, наприклад, етиніл, 1-пропініл, 2-пропініл, 1бутиніл, 2-бутиніл, 3-бутиніл, 2-пентиніл, 3пентиніл, 2-гексиніл, 3-гексеніл тощо. Цікавим серед С1-6алкінілів є С2-4алкініл. С3-7циклоалкіл є родовим терміном для циклопропілу, циклобутилу, циклопентилу, циклогексилу й циклогептилу. С0-3Алкілен означає зв'язок (C0) або двовалентні насичені вуглеводневі радикали з нерозгалуженим або розгалуженим ланцюгом, що мають 1-3 атоми вуглецю, такі як, наприклад, метилен, етилен, 1,3-пропандиіл, 1,2-пропандиїл тощо, особливо метилен. С1-6Алкокси означає С1-С6алкілокси, у якого С16алкіл має значення, згадані вище. Застосовуваний тут вище термін (=О) або оксо утворює карбонільну частину, що приєднана до атома вуглецю, сульфоксидну частину, що приєднана до атома сірки, і сульфонільну частину, коли два із зазначених термінів приєднані до атома сірки. Щоразу, коли кільце або система кілець за 13 міщена оксогрупою, атом вуглецю, з яким зв'язана оксо, є насиченим атомом вуглецю. «Аміно», якщо в контексті не мається на увазі інше, містить у собі NH2, NHC1-С6алкіл або N(C1С6алкіл)2, де у визначеннях аміно кожний С1С6алкіл являє собою особливо С1-С3алкільні варіанти, або насичені циклічні аміни, такі як піролідиніл, піперидиніл, піперазиніл, 4-C1С6алкілпіперазиніл, такий як 4-метилпіперазиніл, 4-C1-С6алкілкарбонілпіперазиніл і морфолініл. «Амідо» містить у собі C(=О)NH2 і алкіламідо, такий як С(=О)NНC1-С6алкіл, С(=О)N(С1-С6алкіл)2, особливо, С(=О)NHC1-С3алкіл, С(=О)N(C1С3алкіл)2 або -NH(C=O)C1-С6алкіл, наприклад, NHC(=O)CHC(CH3)3, включаючи -NH(С=О)С1С6алкіл. Мається на увазі, що термін «С0С3алкіленарил», застосовуваний тут, містить у собі арильну частину, як-от феніл, нафтил або феніл, конденсований із С3-С7циклоалкілом (наприклад інданіл), де арил зв'язаний безпосередньо (тобто C0) або через проміжну метильну, етильну або пропільну групу, як зазначено вище для С1С3алкілену. Якщо не застережено особливо, арил і/або його конденсована з циклоалкілом частина необов'язково заміщена 1-3 замісниками, вибраними з галогену, гідрокси, нітро, ціано, карбокси, С1-С6алкілу, С1-С6алкокси, С1-С6алкоксиС1С6алкілу, С1-С6алканоїлу, аміно, азидо, оксо, меркапто, нітро, С0-С3алкіленкарбоциклілу, С0С3алкіленгетероциклілу, причому зрозуміло, що гетероциклічна й карбоциклічна частина в С0С3алкіленкарбоциклільному або С 0С3алкіленгетероциклільному заміснику самі можуть самі бути заміщені, як зазначено тут, але звичайно не додатковим С 0С3алкіленкарбоциклілом або С 0С3алкіленгетероциклілом. «Арил» має відповідне значення, тобто коли С0-С3алкільний зв'язок відсутній. Мається на увазі, що термін «С0-С3алкіленС3С7циклоалкіл», застосовуваний тут, містить у собі С3-С7циклоалкільну групу, як-от циклопропіл, циклобутил, циклопентил, циклогексил або циклогептил, зв'язаний безпосередньо (тобто С0алкіл) або через проміжну метильну, етильну, пропільну або ізопропільну групу, як зазначено вище для С1С3алкілену. Циклоалкільна частина може містити ненасичений зв'язок. Якщо не застережено особливо, циклоалкільна частина необов'язково заміщена 1-3 замісниками, вибраними з галогену, гідрокси, нітро, ціано, карбокси, С1-С6алкілу, С1С6алкокси, С1-С6алкоксиС1-С6алкілу, С 1С6алканоїлу, аміно, азидо, оксо, меркапто, нітро, С0-С3алкілкарбоциклілу, С0-С3алкілгетероциклілу, причому зрозуміло, що гетероциклічна й карбоциклічна частини в С0-С3алкіленкарбоциклільному або С0-С3алкіленгетероциклільному заміснику можуть бути самі заміщені, як зазначено тут, але звичайно не додатковим С 0С3алкіленкарбоциклілом або С 0С3алкіленгетероциклілом. Мається на увазі, що термін «С0С3алкілкарбоцикліл», застосовуваний тут, містить у собі С0-С3алкіларил і С0-С3алкілС3-С7циклоалкіл. 93377 14 Якщо не застережено особливо, зазначена арильна або циклоалкільна група необов'язково заміщена 1-3 замісниками, вибраними з галогену, гідрокси, нітро, ціано, карбокси, C1-С6алкілу, C1С6алкокси, C1-С6алкоксиC1-С6алкілу, C1 С6алканоїлу, аміно, азидо, оксо, меркапто, нітро, С0-С3алкілкарбоциклілу та/або С 0С3алкілгетероциклілу, причому зрозуміло, що гетероциклічна й карбоциклічна частини у С0С3алкіленкарбоциклільному або С 0С3алкіленгетероциклільному заміснику можуть бути самі заміщені, як зазначено тут, але звичайно не додатковим С0-С3алкіленкарбоциклілом або С0С3алкіленгетероциклілом «Карбоцикліл» має відповідне значення, тобто коли С0-С3алкільний зв'язок відсутній. Мається на увазі, що термін «С0С3алкіленгетероцикліл», застосовуваний тут, містить у собі моноциклічне, насичене або ненасичене, гетероатомумісне кільце, таке як піперидиніл, морфолініл, піперазиніл, піразоліл, імідазоліл, оксазоліл, ізоксазоліл, тіазиноліл, ізотіазиноліл, тіазоліл, оксадіазоліл, 1,2,3-триазоліл, 1,2,4триазоліл, тетразоліл, фураніл, тієніл, піридил, піримідил, піридазиніл або кожна з таких груп, конденсована з фенільним кільцем, така як хінолініл, бензимідазоліл, бензоксазоліл, бензизоксазоліл, бензотіазиноліл, бензизотіазиноліл, бензотіазоліл, бензоксадіазоліл, бензо-1,2,3-триазоліл, бензо1,2,4-триазоліл, бензотетразоліл, бензофураніл, бензотієніл, бензопіридил, бензопіримідил, бензопіридазиніл, бензопіразоліл тощо, це кільце зв'язане безпосередньо, тобто (C0), або через проміжну метильну, етильну, пропільну або ізопропільну групу, як зазначено вище для С1-С3алкілену. Будьякі такі ненасичені кільця, що мають ароматичний характер, можуть тут називатися гетероарилом. Якщо не застережено особливо, зазначене гетерокільце й/або його конденсована фенільна частина необов'язково заміщена 1-3 замісниками, вибраними з галогену, гідрокси, нітро, ціано, карбокси, C1-С6алкілу, C1-С6алкокси, C1-С6алкоксиC1С6алкілу, C1-С6алканоїлу, аміно, азидо, оксо, меркапто, нітро, С0-С3алкілкарбоциклілу, С0С3алкілгетероциклілу. «Гетероциклілл і «гетероарил» мають відповідне, значення, тобто коли С0С3алкільний зв'язок відсутній. Звичайно гетероциклільна й карбоциклільна частини в обсязі зазначених вище визначень є в такий спосіб моноциклічним кільцем з 5 або особливо 6 атомами кільця або біциклічною структурою кілець, що включає в себе 6-членне кільце, конденсоване з 4-, 5- або 6-членним кільцем. Типові такі групи містять у собі С3С8циклоалкіл, феніл, бензил, тетрагідронафтил, інденіл, інданіл, гетероцикліл, такий як азепаніл, азоканіл, піролідиніл, піперидиніл, морфолініл, тіоморфолініл, піперазиніл, індолініл, піраніл, тетрагідропіраніл, тетрагідротіопіраніл, тіопіраніл, фураніл, тетрагідрофураніл, тієніл, піроліл, оксазоліл, ізоксазоліл, тіазоліл, імідазоліл, піридиніл, піримідиніл, піразиніл, піридазиніл, тетразоліл, піразоліл, індоліл, бензофураніл, бензотієніл, бензимідазоліл, бензтіазоліл, бензоксазоліл, бензизоксазоліл, хінолініл, тетрагідрохінолініл, ізохінолініл, 15 тетрагідроізохінолініл, хіназолініл, тетрагідрохіназолініл і хіноксалініл, кожен з яких може бути необов'язково заміщений, як тут зазначено. Насичена гетероциклільна частина в такий спосіб містить у собі такі радикали, як піролініл, піролідиніл, піразолініл, піразолідиніл, піперидиніл, морфолініл, тіоморфолініл, піраніл, тіопіраніл, піперазиніл, індолініл, азетидиніл, тетрагідропіраніл, тетрагідротіопіраніл, тетрагідрофураніл, гексагідропіримідиніл, гексагідропіридазиніл, 1,4,5,6тетрагідропіримідиніламін, дигідрооксазоліл, 1,2тіазинаніл-1,1-діоксид, 1,2,6-тіадіазинаніл-1,1діоксид, ізотіазолідиніл-1,1-діоксид та імідазолідиніл-2,4-діон, тоді як ненасичений гетероцикл містить у собі радикали ароматичного характеру, такі як фураніл, тієніл, піроліл, оксазоліл, тіазоліл, імідазоліл, піразоліл, ізоксазоліл, ізотіазоліл, оксадіазоліл, триазоліл, тетразоліл, тіадіазоліл, піридиніл, піридазиніл, піримідиніл, піразиніл, індолізиніл, індоліл, ізоіндоліл. У кожному випадку гетероцикл може бути конденсований з фенільним кільцем з утворенням біциклічної системи кілець. Радикал Het являє собою гетероцикл, як зазначається в даному описі й формулі винаходу. Приклади Het містять у собі, наприклад, піролідиніл, піперидиніл, морфолініл, тіоморфолініл, піперазиніл, піроліл, піразоліл, імідазоліл, оксазоліл, ізоксазоліл, тіазиноліл, ізотіазиноліл, тіазоліл, ізотіазоліл, оксадіазоліл, тіадіазоліл, триазоліл (включаючи 1,2,3триазоліл, 1,2,4-триазоліл), тетразоліл, фураніл, тієніл, піридил, піримідил, піридазиніл, піразоліл, триазиніл тощо. Цікавими серед радикалів Het є радикали, які є ненасиченими, особливо радикали, що мають ароматичний характер. Крім того, цікавими є радикали Het, що мають один або два атоми азоту. Кожний з радикалів Het, зазначених вище, може бути необов'язково заміщений кількістю й типом замісників, зазначених у визначеннях сполук формули (І), (It) або будь-якої з підгруп сполук формули (І). Деякі з радикалів Het, зазначених у цьому й наступному абзаці, можуть бути заміщені одним, двома або трьома гідроксизамісниками. Такі гідроксизаміщені кільця можуть бути у вигляді їхніх таутомерних форм, що мають кетогрупи. Наприклад, 3-гідроксипіридизинова частина може бути в и таутомерній формі 2Н-піридазин-3-ону. Слід зазначити, що положення радикалів на будь-якій молекулярній частині, застосовуваній у визначеннях, може бути де завгодно на такій частині, поки вона є хімічно стабільною. Радикали, застосовувані у визначеннях символів, містять у собі всі можливі ізомери, якщо не застережено особливо. Наприклад, піридил містить у собі 2-піридил, 3-пірпдил і 4-піридил, пентил містить у собі 1-пентил, 2-пентил і 3-пентил. Коли будь-який символ зустрічається більше, ніж один раз у будь-якій складовій частині, кожне визначення є незалежним. Мається на увазі, що щоразу застосовуваний надалі термін «сполуки формули (І)» або «дані сполуки», або аналогічні терміни містять у собі сполуки формули (І), їхні проліки, N-оксиди, адитивні солі, четвертинні аміни, комплекси металів і стереохімічні ізомерні форми. Один варіант здійс 93377 16 нення містить у собі сполуки формули (І) або будьяку підгрупу сполук формули (І), зазначених тут, а також їхні N-оксиди, солі, так само як можливі стереоізомерні форми. Інший варіант здійснення містить у собі сполуки формули (І) або будь-яку підгрупу сполук формули (І), зазначених тут, а також їхні солі, так само як можливі стереоізомерні форми. Сполуки формули (1) мають кілька центрів хіральності та існують у вигляді стереохімічних ізомерних форм. Термін «стереохімічні ізомерні форми», застосовуваний тут, означає всі можливі сполуки, побудовані з таких же атомів, зв'язаних такою ж послідовністю зв'язків, але що мають різні тривимірні структури, які не є взаємозамінними і які можуть мати сполуки формули (І). Що стосується випадків, у яких (R) або (S) застосовують для позначення абсолютної конфігурації хірального атома в заміснику, уводять позначення, беручи до уваги всі сполуки, а не окремий замісник. Якщо не зазначено або не позначено особливо, хімічне позначення сполуки містить у собі суміш всіх можливих стереохімічних ізомерних форм, які може мати зазначена сполука. Зазначена суміш може містити всі діастереомери й/або енантіомери основної молекулярної структури зазначеної сполуки. Передбачається, що всі стереохімічні ізомерні форми сполук даного винаходу, як у чистій формі, так і у формі суміші один з одним, включені в обсяг даного винаходу. Чисті стереоізомерні форми сполук і проміжних сполук, як зазначено тут, визначають як ізомери, що по суті не містять інші енантіомерні або діастереомерні форми однієї й тієї ж основної молекулярної структури зазначених сполук або проміжних сполук. Зокрема, термін «стереоізомерно чистий» стосується сполук або проміжних сполук, що мають стереоізомерний надлишок, щонайменше, 80% (тобто мінімум 90% одного ізомеру й максимум 10% іншого можливого ізомеру) і аж до стереоізомерного надлишку 100% (тобто 100% одного ізомеру й відсутність іншого), більш виразно, сполуки або проміжні сполуки, що мають стереоізомерний надлишок від 90% до 100%, навіть більш виразно, що мають стереоізомерний надлишок від 94% до 100% і найбільш виразно, що мають стереоізомерний надлишок від 97% до 100%. Терміни «енантіомерно чистий» і «діастереоізомерно чистий» варто розуміти аналогічним чином, але до того ж, як такі, що мають відношення до енантіомерного надлишку й діастереомерного надлишку, відповідно, розглянутої суміші. Чисті стереоізомерні форми сполук і проміжних сполук даного винаходу можна одержати застосуванням відомих у даній галузі методик. Наприклад, енантіомери можна відокремити один від одного селективною кристалізацією їхніх діастереоізомерних солей з оптично активними кислотами або основами. Прикладами їх є винна кислота, дибензоїлвинна кислота, дитолуоїлвинна кислота й камфорасульфонова кислота. В альтернативному випадку, енантіомери можна розділити хроматографічними методиками із застосуванням хіральних нерухливих фаз. Зазначені чисті 17 стереохімічні ізомерні форми можна також одержати з відповідних чистих стереохімічних ізомерних форм придатних вихідних речовин, за умови, що реакція протікає стереоспецифічно. Якщо потрібен певний стереоізомер, зазначену сполуку краще буде синтезовано стереоспецифічними методами одержання. Ці методи будуть переважно застосовувати енантіомерно чисті вихідні речовини. Діастереомерні рацемати сполук формули (І) можна розділяти загальноприйнятими методами. Придатними методами фізичного поділу, які можна переважно застосовувати, є, наприклад, селективна кристалізація й хроматографія, наприклад колонкова хроматографія. Для певних сполук формули (І), їхніх проліків, N-оксидів, солей, сольватів, четвертинних амінів або комплексів металів і проміжних сполук, застосовуваних при їх одержанні, абсолютну стереохімічну конфігурацію експериментально не визначали. Фахівець у даній галузі здатний визначити абсолютну конфігурацію таких сполук із застосуванням методів, відомих у даній галузі, таких як, наприклад, дифракція рентгенівських променів. Передбачається, що даний винахід містить у собі також всі ізотопи атомів, наявні в даних сполуках. Ізотопи містять у собі атоми, що мають однаковий атомний номер, але різні масові числа. Як загальний приклад і без обмеження, ізотопи водню містять у собі тритій і дейтерій. Ізотопи вуглецю містять у собі С-13 і С-14. Термін «проліки», застосовуваний протягом усього даного тексту, означає фармакологічно прийнятні похідні, як-от складні ефіри, аміди й фосфати, так що утворений in vivo продукт біоперетворення похідної є активним лікарським засобом, обумовленим у сполуках формули (І). Публікація Goodman and Gilman (The Pharmacological Basis of Therapeutics, 8th ed, McGraw-Hill, Int Ed 1992, "Biotransformation of Drugs", р. 13-15), що описує в загальному проліки, у такий спосіб включена тут. Проліки переважно мають чудову водну розчинність, підвищену біологічну доступність й легко метаболізуються в активні інгібітори in vivo. Проліки сполуки даного винаходу можна одержати модифікацією функціональних груп, що наявні у сполуці, таким шляхом, щоб модифікації розщеплювалися або звичайною маніпуляцією, або in vivo з утворенням. «батьківської» сполуки. Кращими є проліки у вигляді фармацевтично прийнятних складних ефірів, які здатні, гідролізуватися in vivo і які одержують зі сполук формули (І), що мають гідроксильні або карбоксильні групи. Гідролізованим in vivo складним ефіром є складний ефір, що гідролізується в тілі людини або тварини з утворенням «батьківської» кислоти або спирту. Придатні фармацевтично прийнятні складні ефіри карбоксигрупи містять у собі С1-6 алкоксиметилові і складні ефіри, наприклад метоксиметиловий ефір, С1-6алканоїл-оксиметилові складні ефіри, наприклад, півалоїлоксиметиловий, фталідилові складні ефіри, С 3С8циклоалкоксикарбонілоксиС1-6алкілові складні ефіри, наприклад, 1циклогексилкарбонілоксіетиловий ефір, 1,3 93377 18 діоксолен-2-онілметилові складні ефіри, наприклад, 5-метил-1,3-діоксолен-2-онілметиловий ефір, і С1-6алкокси-карбонілоксіетилові складні ефіри, наприклад, 1-метоксикарбонілоксіетиловий ефір, що може бути утворений у будь-якій карбоксигрупі в сполуках даного винаходу. Гідролізований in vivo складний ефір сполуки формули (І), що містить гідроксигрупу, містить у собі неорганічні складні ефіри, як-от фосфатні ефіри й -ацилоксіалкілові прості ефіри й родинні сполуки, які в результаті гідролізу in vivo складного ефіру розпадаються з утворенням вихідної гідроксигрупи. Приклади -ацилоксіалкілових простих ефірів містять у собі ацетоксиметокси- і 2,2диметилпропіонілоксиметоксисполуки. Групи, що утворюють гідролізовані in vivo складні ефіри для гідрокси, містять у собі алканоїл, бензоїл, фенілацетил і заміщений бензоїл і фенілацетил, алкоксикарбоніл (утворює алкілкарбонатні ефіри), діалкілкарбамоїл і N-(діалкіламіноетил)-N-алкілкарбамоїл (утворюють карбамати), діалкіламіноацетил і карбоксіацетил. Приклади замісників на бензоїлі містять у собі морфоліно й піперазино, що зв'язують атом азоту кільця через метиленову групу з 3- або 4-положенням кільця бензоїлу. Для терапевтичного застосування солями сполук формули (І) є солі, у яких протиіон є фармацевтично прийнятним. Однак, солі кислот і основ, які не є фармацевтично прийнятними, можуть також знайти застосування, наприклад, при одержанні або очищенні фармацевтично прийнятної сполуки. Всі солі, незалежно від того, є вони фармацевтично прийнятними чи ні, включені в межі даного винаходу. Мається на увазі, що фармацевтично прийнятні кислотно- і основно-адитивні солі, що вказуються вище, містять у собі форми терапевтично активних нетоксичних кислотно- і основноадитивних солей, які здатні утворювати сполуки формули (І). Фармацевтично прийнятні кислотноадитивні солі можна придатним чином одержувати обробкою форми основи такою придатною кислотою. Придатні кислоти містять у собі, наприклад, неорганічні кислоти, такі як галогеноводневі кислоти, наприклад хлористоводневу або бромистоводневу кислоту, сірчану, азотну, фосфорну й подібну кислоти, або органічні кислоти, як-от, наприклад, оцтова, пропанова, гідроксіоцтова, молочна, піровиноградна, щавлева (тобто етандіова), малонова, бурштинова (тобто бутандіова кислота), малеїнова, фумарова, яблучна (тобто гідроксибутандіонова кислота), винна, лимонна, метансульфонова, етансульфонова, бутансульфонова, птолуолсульфонова, цикламова, саліцилова, паміносаліцилова, памоєва й подібні кислоти. І навпаки, зазначені форми солей можна перетворити обробкою придатною основою на форму вільної основи. Сполуки формули (І), що містять кислотну частину, можна також перетворити на їхні нетоксичні форми солей металів або форми адитивних солей амінів обробкою придатними органічними й неорганічними основами. Придатні форми солей з основами містять у собі, наприклад, амонієві солі, солі лужних і лужноземельних металів, наприклад 19 солі літію, натрію, калію, магнію, кальцію тощо, солі з органічними основами, наприклад, солі бензатину, N-метил-D-глюкаміну, гідрабаміну, й солі з амінокислотами, як-от, наприклад, аргінін, лізин тощо. Термін адитивна сіль, застосовуваний вище, містить у собі також сольвати, які здатні утворювати сполуки формули (І), а також їхні солі. Такими сольватами є, наприклад, гідрати, алкоголяти тощо. Термін «четвертинний амін», застосовуваний тут раніше, означає четвертинні амонієві солі, які сполуки формули (І) здатні утворювати реакцією між основним атомом азоту сполуки формули (І) і придатним кватернізуючим агентом, таким як, наприклад, необов'язково заміщений алкілгалогенід, арилгалогенід або арилалкілгалогенід, наприклад, метиліодид або бензиліодид. Можна також застосовувати інші реагенти групами, що легко йдуть, як-от алкілтрифторметансульфонати, алкілметансульфонати й алкіл-п-толуолсульфонати. Четвертинний амін має позитивно заряджений атом азоту. Фармацевтично прийнятні протиіони містять у собі хлор, бром, йод, трифторацетат і ацетат. Обраний протиіон можна ввести із застосуванням іонообмінних смол. Мається на увазі, що N-оксидні форми даних сполук містять у собі сполуки формули (І), у яких один або кілька атомів азоту окислені в так званий N-оксид. Має бути зрозуміло, що сполуки формули (І) мають властивості зв'язування, хелатування, утворення комплексу металу й тому можуть існувати у вигляді комплексів металів або хелатів металів. Передбачається, що такі металовані похідні сполук формули (І) включені в обсяг даного винаходу. Деякі зі сполук формули (І) можуть існувати також у їхній таутомерній формі. Такі форми хоча й не зазначені безпосередньо в зазначеній вище формулі, передбачається, що вони включені в обсяг даного винаходу. Як зазначено вище, сполуки формули (І) мають кілька асиметричних центрів. Щоб більш раціонально вказати кожен з цих асиметричних центрів, можна застосовувати систему нумерації, як зазначено на наступній структурній формулі 93377 20 Асиметричні центри присутні в положеннях 1, 4 і 6 макроциклу, а також у атома вуглецю 3' в 5членному кільці, в атома вуглецю 2’, коли замісник Rq являє собою С1-6алкіл, і в атома вуглецю 1’, коли L являє собою СН. Кожен з цих асиметричних центрів може бути в його R- або S-конфігурації. Стереохімія в положенні 1 переважно відповідає стереохімії конфігурації L-аміноміслоти, т.е. стереохімії L-проліну. Коли L являє собою СН, 2 карбоніли, наявні у кільця циклопентану, переважно перебувають у транс-положенні відносно один одного, як показано нижче Структура формули (І) містить у собі циклопропільну групу, як представлено нижче на фрагменті Р1. де С7 являє собою атом вуглецю в положенні 7 і атоми вуглецю в положеннях 4 і 6 є асиметричними атомами вуглецю кільця циклопентану. Попри інші можливі асиметричні центри в інших сегментів сполук винаходу, наявність цих двох асиметричних центрів означає, що сполуки можуть існувати у вигляді суміші діастереомерів, як-от 21 93377 22 діастереомери сполук формули (І), де атом вуглецю в положенні 7 має або син-конфігурацію до карбонілу, або син-конфігурацію до аміду, як показано нижче. Структура формули (І) може містити в собі також залишок проліну (коли L являє собою Ν). Кращими є сполуки формули (І), де замісник у положенні 1 (або 5') і замісник -O-Rr (у положенні 3') перебувають у транс-конфігурації. Особливо цікавими є сполуки формули (І), де положення 1 має конфігурацію, що відповідає конфігурації Lпроліну, і замісник -O-Rr перебуває в трансконфігурації щодо положення 1. Сполуки формули (І) переважно мають стереохімію, показану нижче на структурах формул (І-а) і (І-b): Один варіант здійснення даного винаходу стосується сполук формули (I) або формули (I-а) або будь-якої підгрупи сполук формули (І), де дотримується одна або кілька з наступних умов: (a) Rq являє собою водень; (b) L являє собою атом азоту, (c) подвійний зв'язок присутній між атомами вуглецю 7 і 8. Один варіант здійснення даного винаходу стосується сполук формули (І) або формули (I-а), (I-b) або будь-якої підгрупи сполук формули (I), де дотримується одна або кілька з наступних умов: (a) Rq являє собою водень; (b) X являє собою СН; (c) подвійний зв'язок присутній між атомами вуглецю 7 і 8. Один варіант здійснення даного винаходу містить у собі сполуки, що включають у себе часткову структуру: або Конкретними підгрупами сполук формули (І) є сполуки, представлені наступними структурними формулами: 23 Серед сполук формул (І-с) і (I-d) сполуки, що мають стереохімічну конфігурацію сполук формул (І-а) і (І-b) відповідно, є особливо цікавими. Подвійний зв'язок між атомами вуглецю 7 і 8 у сполуках формули (І) або в будь-якій підгрупі сполук формули (I) може мати цис- або трансконфігурацію. Подвійний зв'язок між атомами вуглецю 7 і 8 переважно має цис-конфігурацію, як показано на формулах (I-c) і (I-d). Подвійний зв'язок між атомами вуглецю 7 і 8 у сполуках формули (I) або в будь-якій підгрупі сполук формули (I) може мати цис- або трансконфігурацію. Подвійний зв'язок між атомами вуглецю 7 і 8 переважно має цис-конфігурацію, як показано на формулах (I-c) і (I-d). У формулах (І-а), (І-b), (I-c) і (I-d), де в придатних випадках A, L, n, Rr, Rq, R5 мають значення, згадані для сполук формули (І) або будь-якої із зазначених тут підгруп сполук формули (І). Має бути зрозуміло, що зазначені вище підгрупи сполук формули (I-а), (I-b), (I-c) і (I-d), a також будь-якої іншої зазначеної тут підгрупи містять у собі також будь-які проліки, N-оксиди, адитивні солі, четвертинні аміни, комплекси металів і стереохімічні ізомерні форми таких сполук Коли n дорівнює 2, частина -CH2-, подана в дужках зі знаком "n", відповідає етандиїлу в сполуках формули (І) або в будь-якій підгрупі сполук формули (І). Коли n дорівнює 3, частина -СН2-, подана в дужках зі знаком "n", відповідає пропандиїлу в сполуках формули (І) або в будь-якій підгрупі сполук формули (І). Коли n дорівнює 4, частина -СН2-, подана в дужках зі знаком "n", відповідає бутандиїлу в сполуках формули (І) або в будь-якій підгрупі сполук формули (І). Коли n дорівнює 5, частина -СH2-, подана в дужках зі знаком "n", відповідає пентандиїлу в сполуках формули (І) або в будь-якій підгрупі сполук формули (І). Коли n дорівнює 6, частина -СН2-, подана в дужках зі знаком "n", відповідає гександиїлу в сполуках формули (I) або в будь-якій підгрупі сполук формули (І). Особливими підгрупами сполук формули (І) є ті сполуки, у яких n дорівнює 4 або 5. Варіантами здійснення винаходу є сполуки формули (І) або будь-якої з підгруп сполук формули (І), де 93377 24 (a) А являє собою -OR1, особливо, коли R1 являє собою С1-6алкіл, такий як метил, етил або трет-бутил, і найбільш переважно, коли R1 являє собою водень, або (b) А являє собою -NHS(=O)2R2, особливо, коли R2 являє собою C1-С6алкіл, необов'язково заміщений С3-С7циклоалкілом, С3-С7циклоалкіл, необов'язково заміщений C1-С6алкілом, або арил, наприклад, коли R2 являє собою метил, циклопропіл або феніл. Наприклад, R2 може бути 1метилциклопропілом. Наступними варіантами здійснення винаходу є сполуки формули (І) або будь-якої з підгруп сполук формули (І), де (a) Rq являє собою водень; L являє собою СН або N; (b) Rq являє собою метил, L являє собою С і пунктирна лінія являє собою додатковий зв'язок. Наступними варіантами здійснення винаходу є сполуки формули (І) або будь-якої з підгруп сполук формули (I), де (a) R5 являє собою водень; (b) R5 являє собою C1-С6алкіл; (c) R5 являє собою C1-С6алкоксиC1-С6алкіл або С3-С7циклоалкіл. Кращими варіантами здійснення винаходу є сполуки формули (І) або будь-якої з підгруп сполук формули (I), де R5 являє собою водень або C1С6алкіл, більш переважно, водень або метил Варіантами здійснення винаходу є сполуки формули (І) або будь-якої з підгруп сполук формули (І), у яких Rr являє собою хіназолін-4-іл. Звичайно Rr являє собою хіназолін-4-іл, необов'язково моно-, ди- або тризаміщений, наприклад, C1С6алкілом, C1-С6алкокси, гідрокси, галогеном, трифторметилом, моно- або диC1-С6алкіламіно, моно- або диC1-С6алкіламінокарбонілом, арилом, гетероарилом або гетероциклілом, де арил, гетероарил або гетероцикліл, кожний незалежно, необов'язково заміщений галогеном, C1-С6алкілом, C1-С6алкокси, полігалогенC1-С6алкокси, аміно, моно- або диC1-С6алкіламіно, циклопропілом, піролідинілом, піперидинілом, піперазинілом, Nметилпіперазинілом або морфолінілом. Хіназолініві варіанти здійснення Rr містять у собі радикал (f-1): ' 25 або особливо радикал (f-1-a): де R9, R6 і R11 мають значення, згадані для замісників Rr або Rt4, де особливо R9 являє собою С37циклоалкіл, арил або Het, кожен з яких необов'язково заміщений одним, двома або трьома (особливо одним) R10; де R10 являє собою водень, C1С6алкіл, С3-7циклоалкіл, арил, Het (переважно, моно- або дизаміщений C1-С6алкілом), піролідиніл, піперидиніл, піперазиніл, 4-метилпіперазиніл, тіоморфолініл або морфолініл, амінокарбоніл, моноабо диC1-С6алкіламінокарбоніл; де піперидиніл, морфолініл або тіоморфолініл може бути необов'язково заміщений одним або двома C19 С6алкільними радикалами; або R являє собою C1С6алкокси; R6 являє собою водень, галоген, C1-С6алкіл, особливо метил, С3-7циклоалкіл, арил, Het, галоген, особливо бром, хлор або фтор; де R10 має згадані вище значення або зокрема являє собою водень, C1-С6алкіл (такий як метил, етил, ізопропіл, трет-бутил), піролідиніл, піперидиніл, піперазиніл, 4-C1-С6алкілпіперазиніл, N-метилпіперазиніл, тіоморфолініл або морфолініл, C1-С6алкіламіно, (C1-С6алкіл)2аміно або амінокарбоніл, моно- або C1-С6алкіламінокарбоніл. R9 для хіназолінів може містити в собі 93377 26 R11 являє собою водень або C1-С6алкокси. Кращі варіанти здійснення R9 для хіназолінів містять у собі арил або Het, особливо, коли R9 являє собою феніл, піридил, тіазоліл, оксазоліл або піразоліл, кожен з яких необов'язково заміщений одним, двома або трьома (особливо одним) зазначеними R10. У наступному альтернативному варіанті здійснення R9 являє собою алкокси, особливо етокси й ізопропокси. Варіанти здійснення R10 для хіназолінів містять у собі водень, метил, етил, ізопропіл, третбутил, алкокси, такий як метокси, галоген (включаючи дигалоген, такий як дифтор), піролідиніл, піперидиніл, піперазиніл, 4-C1-С6алкілпіперазиніл (наприклад, 4-метилпіперазиніл), тіоморфолініл або морфолініл, C1-С6алкіламіно, (C1С6алкіл)2аміно, амінокарбоніл, моно- або диC1С6алкіламінокарбоніл або С3-С7циклоалкіл (особливо циклопропіл). Кращі варіанти здійснення R9 для хіназолінів містять у собі феніл, заміщений однією або двома групами R10, такими як водень, метил, етил, ізопропіл, трет-бутил, алкокси, такий як метокси, насичений моноциклічний аміно, C1-С6алкіламіно, (C1С6алкіл)2аміно або C1-С6алкіламідо або галоген (зокрема, фтор), особливо, коли R6 являє собою водень, метил або бром. Переважно, замісник фенілу перебуває в пара-положенні. Особливо кращими структурами для R9 відповідно до даного варіанта здійснення є феніл, п-метоксифеніл і пфторфеніл. Додаткові конфігурації для R9 у хіназолільному радикалі, зазначеному для (f-1) або (f-1-a), містять у собі кожний з радикалів: де R10 являє собою C1-С6алкіл (такий як метил, етил, ізопропіл, трет-бутил), C1-С6алкіламіно, (C1-С6алкіл)2аміно, C1-С6алкіламідо, морфолініл, тіоморфолініл або піперидин-1-іл, причому морфолін або піперидин необов'язково заміщений одним або двома C1-С6алкільними групами. Варіанти здійснення R6 для хіназолінів містять у собі C1-С6алкіл, зокрема, метил, галоген (наприклад, бром, хлор, фтор), особливо бром. Варіанти здійснення R11 для хіназолінів містять у собі водень, C1-С6алкілокси (зокрема, метокси). Певними варіантами здійснення сполук формули (І) або будь-яких інших з підгруп сполук формули (I) є сполуки, у яких Rr являє собою: 27 93377 28 де R10, R10' і R11 мають значення, згадані вище, і зокрема R11 являє собою водень або C1С6алкокси (наприклад, метокси) і R10 і R10' являють собою зокрема водень, метокси або галоген, такий як фтор або дифтор. Придатними є сполуки, у яких, коли R10 або R10' не є воднем, то він перебуває в пара-положенні кільця фенілу. Наступними кращими структурами є сполуки формули (І) або будь-який іншої з підгруп сполук формули (І), де Rr являє собою де R10, R10' і R11 мають значення, згадані вище, і зокрема R11 являє собою водень або C1С6алкокси (наприклад, метокси) і R10 і R10' являють собою зокрема водень, метокси або галоген, такий як фтор або дифтор. Придатними є сполуки, коли R10 або R10' перебуває в пара-положенні кільця фенілу. Особливо кращими сполуками даного варіанта здійснення є сполуки, у яких Rr відповідає формулі (f-4), (f-5) або (f-6) Сполуки винаходу одержують, як у загальному описано нижче й докладно описано в експериментальній частині. Придатною проміжною сполукою для сполук формули (І), де Rr являє собою 8метилзаміщену хіназолінілпохідну, є тризаміщений анілін формули (II): причому зазначена похідна аніліну є наступним аспектом даного винаходу. Наступними проміжними сполуками, придатними для одержання сполук формули (І), є хіназолінілпохідні, що мають загальну формулу (III) і зокрема формули (III-а) 29 93377 30 де X являє собою ОН або відхідну групу, таку як галогенід, подібний до хлориду, броміду або йодиду, або похідну сульфонової кислоти, таке як тозилат, трифлат, мезилат або тому подібне. Переважно, X являє собою ОН, R6, R9 і R11 мають значення, згадані вище для сполук формул (f-1) і (f-1-a). Сполуки (III) і (IIIа) є новими сполуками й утворюють наступний аспект даного винаходу. Різні варіанти здійснення, описані вище для хіназолінільної частини, застосовують також для сполук формул (III) і (IIIа). Кращі варіанти здійснення R9 для сполук формул (III) і (IIIа) містять у собі піридил і феніл, необов'язково заміщені однією або двома групами R10, такими як водень, метил, етил, ізопропіл, третбутил, насичений моноциклічний аміно, C1С6алкіламіно, (C1-С6алкіл)2аміно або C1 С6алкіламідо або галоген (зокрема, фтор), особливо, коли R6 представляє собою водень, метил або бром. Замісник, переважно, перебуває в параположенні фенільного кільця. Кращим значенням для R9 є парафторфеніл. Певними варіантами здійснення сполук формули (III) є сполуки, що мають структуру, зазначену у формулі (IIІ-2) і (ІІІ-3): де X, R10, R10' і R11 мають значення, згадані 11 вище, і, зокрема, R являє собою водень або C1С6алкокси (наприклад, метокси) і R10 або R10' зокрема являє собою водень, метокси або галоген, такий як фтор або дифтор. У придатному випадку R10 або R10' перебуває в пара-положенні фенільного кільця. Наступними кращими структурами для сполук формули (III) є структури відповідно до формули (III-2-Ме) і (III-3-Ме). де X, R10, R10' і R11 мають значення, згадані вище, і, зокрема, R11 являє собою водень або C1С6алкокси (наприклад, метокси) і R10 або R10' зокрема являють собою водень, метокси або галоген, такий як фтор або дифтор. У придатному випадку R10 або R10' перебуває в пара-положенні фенільного кільця. Особливо кращими сполуками формули (III) є сполуки, що мають формулу (III-4) або (III-5): 31 де X має значення, описані вище. Варіантами здійснення винаходу є сполуки формули (I) або будь-якої з підгруп сполук формули (І), де Rr являє собою хіназолін-4-іл, необов'язково моно-, ди- або тризаміщений метилом, етилом, ізопропілом, трет-бутилом (або т-бутилом), метокси, трифторметилом, трифторметокси, фтором, хлором, бромом, моно- або диC1С6алкіламіно, моноабо диC1С6алкіламінокарбонілом, фенілом, метоксифенілом, ціанофенілом, галогенфенілом, піридилом, C1-С4алкілпіридилом, піримідинілом, морфолінілом, піперазинілом, C1-С4алкілпіперазинілом, піролідинілом, піразолілом, C1-С4алкілпіразолілом, тіазолілом, C1-С4алкілтіазолілом, циклопропілтіазолілом або моноабо диC1С4алкіламінотіазолілом. Варіантами здійснення винаходу є сполуки формули (І) або будь-якої з підгруп сполук формули (І), де Rr являє собою: 93377 32 де R9 являє собою водень, галоген, C1С6алкіл, C1-С6алкокси, моноабо диC1С6алкіламіно, аміно, арил, гетероарил або гетероцикліл, причому кожний зазначений арил або гетероарил або гетероцикліл незалежно необов'язково заміщений одним або двома C1-С6алкілами, C1С6алкокси, полігалогенC1-С6алкокси, атомами галогену, аміно, моно- або диC1-С6алкіламіно, і кожний з R6 і R11’ незалежно являє собою водень, C1С6алкіл, C1-С6алкокси, моноабо диC1С6алкіламіно, моноабо диC1С6алкіламінокарбоніл, гідрокси, галоген, трифторметил, арил; гетероарил або гетероцикліл, причому кожний зазначений арил, гетероарил або гегероцикліл незалежно необов'язково заміщений C1С6алкілом, C1-С6алкокси, полігалогенC1-С6алкокси, аміно, насиченим циклічним аміно, моно- або диC1-С6алкіламіно. Варіантами здійснення винаходу є сполуки формули (І) або будь-якої з підгруп сполук формули (І), де R9 вибраний з групи, що складається з: де R10, кожний незалежно, являє собою водень, галоген, C1-С6алкіл, аміно, насичений циклічний аміно або моно- або диC1-С6алкіламіно. Варіантами здійснення винаходу є сполуки формули (І) або будь-якої з підгруп сполук формули (І), де Rr являє собою: де R6 і R11 незалежно являють собою водень, C1-С6алкіл, C1-С6алкокси, моно- або диC1С6алкіламіно, моноабо диC1С6алкіламінокарбоніл, гідрокси, галоген, трифтор10 метил, арил, гетероарил або гетероцикліл і R незалежно являє собою водень, C1-С6алкіл, C1С6алкокси або галоген. Наступними варіантами здійснення винаходу є сполуки формули (І) або будь-якої з підгруп сполук формули (І), де Rr являє собою: де R6 і R11 незалежно являють собою водень, C1-С6алкіл, C1-С6алкокси, моно- або диC1С6алкіламіно, моноабо диC1С6алкіламінокарбоніл, гідрокси, галоген, трифторметил, арил або Het і R10 являє собою водень, C1-С6алкіл, C1С6алкокси або галоген. Варіантами здійснення винаходу є сполуки формули (І) або будь-якої з підгруп сполук формули (І), де Rr являє собою: 33 де R6 і R11 незалежно являють собою водень, C1-С6алкіл, C1-С6алкокси, моно- або диC1С6алкіламіно, моноабо диC1С6алкіламінокарбоніл, гідрокси, галоген, трифтор4b метил; R переважно являє собою C1-С6алкокси, найбільше переважно, метокси, і R10 являє собою водень, C1-С6алкіл, аміно, моно- або диC1С6алкіламіно, піролідиніл, піперидиніл, піперазиніл, N-метилпіперазиніл або морфолініл. Варіантами здійснення винаходу є сполуки формули (І) або будь-якої з підгруп сполук формули (I), де R4 являє собою: де R6 і R11 незалежно являють собою водень, C1-С6алкіл, C1-С6алкокси, моно- або диC1С6алкіламіно, моноабо диC1С6алкіламінокарбоніл, гідрокси, галоген, трифторметил, R4b переважно являє собою C1-С6алкокси, найбільше переважно, метокси, галоген або C1С3алкіл, і R10 являє собою водень, C1-С6алкіл, аміно, моно- або диC1-С6алкіламіно, піролідиніл, піперидиніл, піперазиніл, N-метилпіперазиніл або морфолініл. Варіантами здійснення винаходу є сполуки формули (І) або будь-якої з підгруп сполук формули (I), де Rr являє собою: де R6 і R11 незалежно являють собою водень, C1-С6алкіл, C1-С6алкокси, моно- або диC1С6алкіламіно, моноабо диC1С6алкіламінокарбоніл, гідрокси, галоген, трифторметил, R4b переважно являє собою C1-С6алкокси, найбільше переважно, метокси, галоген або C1С3алкіл, і R10 являє собою водень, C1-С6алкіл, аміно, моно- або диC1-С6алкіламіно, піролідиніл, піперидиніл, піперазиніл, N-метилпіперазиніл або морфолініл. Варіантами здійснення винаходу є сполуки формули (I) або будь-якої з підгруп сполук формули (I), де Rr являє собою: 93377 34 де R6 і R11 незалежно являють собою водень, C1-С6алкіл, C1-С6алкокси, моно- або диC1С6алкіламіно, моноабо диC1С6алкіламінокарбоніл, гідрокси, галоген, трифторметил, R4b переважно являє собою C1-С6алкокси, найбільше переважно, метокси, галоген або C1С6алкіл, і R4j являє собою C1-С6алкіл, аміно, моно- або диC1-С6алкіламіно, піролідиніл, піперидиніл, піперазиніл, N-метилпіперазиніл або морфолініл. Кращими варіантами здійснення винаходу є сполуки формули (І) або будь-якої з підгруп сполук формули (І), де Rr являє собою: де R9 має значення, згадані в кожній із груп або підгруп сполук формули (I), і R6 являє собою водень, галоген або трифторметил. Наступними варіантами здійснення винаходу є сполуки формули (I) або будь-якої з підгруп сполук формули (І), де R4 являє собою де R6 являє собою водень, галоген або трифторметил. Інші варіанти здійснення винаходу містять у собі сполуки, у яких R9 являє собою де R10 являє собою водень, метил, етил, ізопропіл, трет-бутил, C1-С3алкіламіно, (C1С3алкіл)2аміно, (C1-С6алкіл)амідо, морфолін-4-іл, піперидин-1-іл, причому морфолін і піперидин необов'язково заміщені C1-С3алкілом. 35 Інші варіанти здійснення винаходу містять у 93377 36 собі сполуки, у яких Rr являє собою де R11 являє собою Η або метокси. Сполуки формули (I-c) і (I-d), що мають подвійний зв'язок у макроциклі (тобто між атомами вуглецю 7 і 8 макроциклу, представленого нижче формулою (I-d), (I-е) і (I-f), складаються з трьох будівельних блоків Р1, Р2, Р3. Для хімічних цілей будівельний блок Р2 сполук формули (I-d) і (I-е) містить у собі карбонільну групу, приєднану до положення 1'. Зв'язування будівельних блоків Р1 з Р2 і Р2 з Р3 містить у собі утворення амідного зв'язку. Зв'язування блоків Р1 і Р3 містить у собі утворення подвійного зв'язку. Зв'язування будівельних боків P1, P2 і Р3 для одержання сполук (I-c) або (I-d) можна проводити в будь-якій даній послідовності. Останні стадії очевидно містять у собі циклізацію, у результаті чого утворюється макроцикл. У кращому варіанті здійснення сполуки (I-c) одержують спочатку утворенням амідних зв'язків і потім утворенням подвійного зв'язку між P3 і Р1 із супутньою циклізацією з утворенням карбоциклу.' В альтернативному випадку, у сполуці формули (I-c) утворюють перший амідний зв'язок між будівельними блоками Р2 і Р1 з наступним сполученням будівельного блоку P3 і потім утворенням амідного зв'язку між P3 і Р2 із супутнім замиканням циклу. Ще однією альтернативною синтетичною методологією є утворення амідного зв'язку між будівельними блоками Р2 і P3 з наступним сполученням будівельного блоку Р1 з P3 і утворенням останнього амідного зв'язку між Р1 і Р2 із супутнім замиканням циклу. Слід зазначити, що в сполуках формули (I-c) утворення амідного зв'язку між блоками Р2 і P3 можна виконати у двох різних положеннях залишку сечовини. Перший амідний зв'язок містить у собі атом азоту кільця піролідину й сусідній карбоніл (відзначений зірочкою). Альтернативне утворення другого амідного зв'язку містить у собі реакцію відзначеного зірочкою карбонілу із групою -NHR3. Обидва утворення амідних зв'язків між будівельними блоками Р2 і P3 є здійсненними. Сполуки формули (Θ-d) можна одержати зв'язуванням Р1 з Р2 або навпаки з наступним утворенням другого амідного зв'язку між будівельними блоками P3 і Р2 із супутньою циклізацією з утворенням макроциклу. В альтернативному випадку в сполуці формули (Θ-d) будівельний блок Р1-P3 можна також синтезувати перед його сполученням з будівельним блоком Р2. Цей будівельний блок Р1-P3 можна синтезувати реакцією метатезису, реакцією Віттига або тому подібне з наступним утворенням двох амідних зв'язків з будівельним блоком Р2 і супутньою циклізацією. Можна спочатку одержати окремі будівельні блоки й потім сполучити їх один з одним або, в альтернативному випадку, попередники будівельних блоків можна сполучити один з одним і модифікувати на останній стадії для одержання необхідної молекулярної композиції. Функціональні групи в кожному з будівельних блоків можна захистити, щоб уникнути побічної реакції. Утворення амідних зв'язків можна проводити із застосуванням стандартних методик, як-от методика, застосовувана для сполучення амінокислот у синтезі пептидів. Остання містить у собі дегідра 37 таційне сполучення карбоксильної групи одного реагенту з аміногрупою іншого реагенту з утворенням єднального амідного зв'язку. Утворення амідного зв'язку можна проводити реакцією вихідних сполук у присутності агента сполучення або перетворенням карбоксильної функціональної групи на активну форму, як-от активний ефір або ацилхлорид. Загальні описи таких реакцій сполучення й застосовуваних у них реагентів можна знайти у звичайних керівництвах з хімії пептидів, наприклад, у керівництві Μ. Bodanszky, "Peptide Chemistry", 2nd rev ed., Springer- Verlag, Berlin, Germany, (1993), далі просто називаному Bodanszky, сенс якого в такий спосіб включено як посилання. Приклади реакцій сполучення з утворенням амідного зв'язку містять у собі метод із застосуванням азиду, метод із застосуванням змішаного ангідриду вугільної й карбонової кислот (ізобутилхлорформіату), метод із застосуванням карбодиіміду (дициклогексилкарбодиіміду, діізопропілкарбодиіміду або водорозчинного карбодиіміду, такого як N-Етил-N'-[(3диметиламіно)пропіл]карбодиіміду), метод із застосуванням активного складного ефіру (пнітрофенілового складного ефіру, складного імідоефіру N-гідроксибурштинової кислоти), метод із застосуванням реагенту Вудварда К, метод із застосуванням карбонілдіімідазолу, методи із застосуванням фосфорних реагентів або окислюваннявідновлення. Деякі з цих методів можна поліпшити додаванням придатних каталізаторів, наприклад, у методі карбодиіміду додаванням 1гідроксибензотриазолу або 4-DMAP. Наступними агентами сполучення є гексафторфосфат (бензотриазол-1-ілокси)трис(диметиламіно)фосфонію, або як такий, або в присутності 1гідроксибензотриазолу або 4-DMAP, або тетрафторборат 2-(1Н-бензотриазол-1-іл)-N,N,N',N'тетрауронію або гексафторфосфат 0-(7азабензотриазол-1-iл)-N,N,N',N-тетраметилуронію. Ці реакції сполучення можна проводити або в розчині (рідкій фазі), або у твердій фазі. Реакцію сполучення переважно проводять в інертному розчиннику, як-от галогеновані вуглеводні, наприклад дихлорметан, хлороформ, диполярних апротонних розчинниках, як-от ацетонітрил, диметилформамід, диметилацетамід, простих ефірах, таких як тетрагідрофуран. У багатьох випадках реакції сполучення проводять у присутності придатної основи, як-от третинний амін, наприклад триетиламін, діізопропілетиламін (DIPEA), N-метилморфолін, Nметилпіролідин або 4-DMAP. Температура реакції може бути між 0°С і 50°С і час реакції може бути в діапазоні між 15 хв і 24 год. Функціональні групи в будівельних блоках, які зв'язують один з одним, можуть бути захищені, щоб уникнути утворення небажаних зв'язків. Придатні захисні групи, які можна застосовувати, перераховані, наприклад, у керівництвах Greene, "Protective Groups in Organic Chemistry", John Wiley & Sons, New York (1981) and "The Peptides Analysis, Synthesis, Biology", Vol. 3, Academic Press, New York (1981), далі просто називаних 93377 38 Greene, сенс яких у такий спосіб включено як посилання. Карбоксильні групи можуть бути захищені у вигляді ефіру, який можна відщепити з утворенням карбонової кислоти. Захисні групи, які можна застосовувати, містять у собі 1) алкілові ефіри, такі як метиловий, триметилсиліловий і третбутиловий, 2) аралкілові ефіри, такі як бензиловий і заміщений бензиловий, або 3) ефіри, які можна розщепити слабкою основою або м'яким відбудовним способом, такі як трихлоретиловий і фенациловий ефіри. Аміногрупи можна захистити різними Nзахисними групами, такими як 1) ацильні групи, такі як форміл, трифторацетил, фталіл і птолуолсульфоніл, 2) ароматичні карбаматні групи, такі як бензилоксикарбоніл (Cbz або Z) і заміщені бензилоксикарбоніли й 9флуоренілметилоксикарбоніл (Fmoc), 3) аліфатичні карбаматні групи, такі як трет-бутилоксикарбоніл (Вос), етоксикарбоніл, діізопропілметоксикарбоніл і алілоксикарбоніл, 4) циклічні алкілкарбаматні групи, такі як циклопентилоксикарбоніл і адамантилоксикарбоніл, 5) алкільні групи, такі як трифенілметил і бензил, 6) триалкілсиліл, такий як триметилсиліл, і 7) тіолумісні групи, такі як фенілтіокарбоніл і дитіасукциноїл. Групами, що становлять інтерес як амінозахисні, є Вос і Fmoc. -Амінозахисну групу переважно відщеплюють перед наступною стадією сполучення. Коли застосовують групу Вос, вибирають методи за участю трифтороцтової кислоти, нерозбавленої або в дихлорметані, або HCl у діоксані або в етилацетаті. Утворену амонієву сіль потім нейтралізують або перед сполученням, або in situ основними розчинами, такими як водні буфери або третинні аміни в дихлорметані або ацетонітрилі, або диметилформаміді. Коли застосовують групу Fmoc, вибраними реагентами є піперидин або заміщений піперидин у диметилформаміді, але можна застосовувати будь-який вторинний амін. Зняття захисту можна проводити при температурі між 0°С і кімнатною температурою, звичайно приблизно при 20-22°C. Інші функціональні групи, які можуть утворювати перешкоди в реакціях під час синтетичної процедури, наприклад, під час реакцій сполучення будівельних блоків, можна також захистити. Наприклад, гідроксигрупи можна захистити такими захисними групами, як групи, перераховані, наприклад, в Greene, "Protective Groups in Organic Chemistry", John Wiley & Sons, New York (1981). Гідроксизахисні групи містять у собі заміщені прості метилові ефіри, наприклад, метоксиметилові, бензилоксиметилові, 2-метоксіетоксиметилові, 2(триметилсиліл)етоксиметилові, трет-бутилові та інші нижчі прості алкілові ефіри, такі як ізопропілові, етилові й особливо метилові, бензилові й трифенілметилові, тетрагідропіранілові прості ефіри, заміщені етилові ефіри, наприклад, 2,2,2трихлоретиловий, силілові прості ефіри, наприклад, триметилсиліловий, третбутилдиметилсиліловий і третбутилдифенілсиліловий, і складні ефіри, отримані реакцією гідроксигрупи з карбоновою кислотою, наприклад ацетат, пропіонат, бензоат тощо. 39 93377 40 Далі аміногрупи можна захистити захисними групами, які можна відщепити селективно. Наприклад, коли Вос застосовують як -амінозахисну групу, придатними є наступні захисні групи бічного ланцюга: п-толуолсульфонільну (тозильну) частину можна застосовувати для захисту додаткових аміногруп; бензилові (Вn) прості ефіри можна застосовувати для захисту гідроксигруп і бензилові складні ефіри можна застосовувати для захисту додаткових карбоксильних груп. Або, коли Fmoc вибирають для захисту -аміногрупи, звичайно прийнятними є захисні групи на основі третбутилу. Наприклад, Вос можна застосовувати для додаткових аміногруп, трет-бутилові прості ефіри для гідроксигруп і трет-бутилові складні ефіри для додаткових карбоксильних груп. Кожну із захисних груп можна видалити на будь-якій стадії методики синтезу, але переважно, захисні групи кожної з функціональних груп, що не беруть участь у стадіях реакції, видаляють після завершення побудови макроциклу. Видалення захисних груп можна проводити будь-яким способом, обумовленим вибором захисних груп, такі способи добре відомі фахівцеві в даній галузі. Будівельні блоки Р1, P2 і P3 для сполуки (I-c) і (Θ-d) можна одержати, виходячи з відомих у даній галузі проміжних сполук. Ряд таких синтезів описується нижче більш докладно. Синтез будівельних блоків Р2 Будівельні блоки Р2 містять або піролідинову, циклопентанову або циклопентенову частину, заміщену групою -O-Rr. Групу Rr можна зв'язати з кожним з цих кілець на будь-якій придатній стадії синтезу сполук згідно з даним винаходом. Одним підходом є спочатку зв'язування групи Rr з придатним кільцем і наступне приєднання інших необхідних будівельних блоків, тобто Р1 і P3, з наступним утворенням макроциклу. Іншим підходом є сполучення будівельного блоку Р2, що не має замісник Rr, і блоку Р1 і приєднання групи Rr або до, або після утворення макроциклу. Синтез і введення замісника в Р2 Необхідну хіназолінову групу в циклічну структуру Р2 можна ввести різними методами на будьякій придатній стадії синтезу. На схемі 1 як приклад зазначене введення замісника в Р2 за допомогою реакції Міцунобу. Mitsunobu, 1981, Synthesis, January, 1-28; Rano et al., Tetrahedron Lett., 1995, 36, 22, 3779-3792, Krchnak et al., Tetrahedron Lett., 1995, 36, 5, 6193-6196; Richter et al., Tetrahedron Lett., 1994, 35, 27, 4705-4706). Обробка придатної циклічної гідроксизаміщеної структури Р2 (1а) необхідним хіназолінолом (1b) у присутності трифенілфосфіну й активуючого агента, подібного діетилазодикарбоксилату (DEAD), діізопропілузодикарбоксилату (DIAD) або тому подібне, дає алкілування сполуки (1с). Гідроксигрупу циклічної структури (1а) можна в альтернативному випадку перетворити на будь-яку іншу придатну відхідну групу, таку як похідна сульфонової кислоти, подібна тозилату, мезилату або трифлату або тому подібне, для цього її піддають у придатних умовах сульфонілуванню, подібному до обробки ангідридом або галогенангідридом необхідної кислоти в розчиннику, подібному до піридину, або застосовують необхідну сульфонову кислоту й трифенілфосфін у присутності DEAD у розчиннику, подібному до толуолу, або гідроксигрупу можна перетворити на галогенід обробкою спирту придатним галогенуючим агентом, наприклад, бромід можна одержати застосуванням такого реагенту, як трибромід фосфору або тому подібне. Утворену відхідну групу, можна потім замінити необхідним хіназолінолом для одержання алкілованої похідної (1с). В альтернативному випадку можна застосовувати протилежну сіратегію, у якій гідроксисполуку (1а) застосовують як нуклеофіл й обробляють її основою, як-от гідрид натрію або трет-бутоксид калію або тому подібне, у розчиннику, подібному диметилформаміду (ДМФ), з наступною реакцією утвореного алкоксиду з алкілуючим агентом Q-Lg, де Lg являє собою придатну відхідну групу, таку як галогенід, подібний до хлориду, броміду або йодиду, або похідну сульфонової кислоти, або тому подібне, і Q являє собою похідну хіназоліну, одержуючи при цьому необхідну заміщену похідну. Приклад, у якому застосовують похідну проліну, описаний E.M.Smith et al. in J. Med. Chem. (1988), 31, 875-885. Має бути очевидним, що вищевказані методи введення хіназолінової групи в циклічну структуру Р2 можна проводити на будь-якій придатній стадії синтезу сполук згідно з даним винаходом. Наприклад, замісник R8 можна ввести в придатну циклічну структуру перед введенням інших компонентів 41 93377 42 сполуки або циклічну структуру із захищеною гідроксигрупою можна застосовувати під час усього синтезу й хіназолінову групу можна ввести як останню стадію синтезу. Наприклад, синтез заміщених похідних хіназоліну показаний на схемі 2. Перетворення нітрозаміщеної похідної бензойної кислоти (2а) на відповідний бензамід, наприклад, витримуванням кислоти в умовах реакції Вільсмайера з наступним відновленням нітрогрупи в умовах, подібних до каталітичного гідрування над нікелем Ренея дає відповідний амід (2с). Отриманий амін можна потім сполучити з гетероциклічною карбоновою кислотою (2d) в умовах сполучення пептидів, таких як присутність HOBt і EDAC або будь-яких інших придатних агентів сполучення, добре відомих у даній галузі. Замикання циклу й дегідратацію можна потім виконати обробкою основою, як-от гідрокарбонат натрію, що дає похідну хіназоліну (2f). Похідну хіназоліну (2f) можна зв'язати з гідроксигрупою структури Р2 реакцією Міцунобу, як описано вище, або гідроксигрупу хіназоліну можна замінити придатною відхідною групою, як-от галогенід, подібний до хлориду, броміду або йодиду, обробкою хіназоліну (2f) придатним галогенуючим агентом, наприклад, фосфорилхлоридом тощо. Похідні 8-метилхізоліну можна також одержати з альтернативної тризаміщеної проміжної кислоти або аміду, отриманого, як показано на схемі 2А. Конденсація етилпропіонілацетату й етоксиметиленмалононітрилу в присутності придатної основи, переважно, етоксиду, як-от етоксид натрію, наприклад, в етанолі, дає тетразаміщену похідну бензойної кислоти (2Аа). Гідроліз етилового складного ефіру, виконуваного обробкою осно вою, як-от гідроксид літію, з наступною стадією декарбоксилування, що досягається нагріванням отриманої кислоти, дає потім тризаміщену похідну фенолу (2Аb). Алкіловані функціональної гідроксигрупи із застосуванням, наприклад, метиліодиду в присутності основи, як-от карбонат калію або тому 43 93377 44 подібне, дає відповідну алкоксипохідну (2Ас). Тризаміщений амід (2Ad) можна потім одержати разом з відповідною кислотою (2Ае) гідролізом ціаногрупи, проведеним нагріванням розчину ціанопохідної, наприклад, у воді й етанолі, у присутності і основи, подібної гідроксиду натрію. Амід (2Ad) можна потім піддати реакції з необхідною кислотою в умовах сполучення пептидів, як описано на схемі 2, з одержанням 8метилзаміщеного хіназолінолу й, якщо потрібно, піддати додатковій реакції для одержання відповідної 4-галогенпохідної. Кислоту (2Ae), отриману за схемою 2А, можна також застосовувати для одержання 8метилзаміщених похідних хіназоліну, що показано на схемі 2В. Захист кислотної функціональної групи кислоти (2Ае), наприклад, у вигляді метилового ефіру, можна виконати витримуванням кислоти в умовах алкілування, як-от обробка метиліодидом у присутності основи, як-от карбонат калію. Функціональну аміногрупу отриманої похідної складного ефіру можна потім поєднати з необхідною кислотою із застосуванням будь-якої придатної методики сполучення пептидів, як-от застосування хлорангідриду кислоти в присутності основи, як-от триетиламін або тому подібне, з одержанням при цьому аміду (2Вb). Гідроліз метилового складного ефіру обробкою основою, подібною гідроксиду літію, з наступним нагріванням отриманої кислоти в присутності формаміду дає хіназолінол (2Вс). Як описано вище, хіназолінол можна далі піддати реакції з одержанням відповідної 4-галогенпохідної. За схемою 2 можна застосовувати різні карбонової кислоти загальної структури (2d). Ці кислоти є або комерційно доступними, або описаними в літературі. Приклад одержання похідних 2(заміщений)амінокарбоксіамінотіазолу за методикою Berdikhina et al. Chem. Heterocycl. Compd. (Engl. Transl.) (1991), 427-433, показаний нижче. Тіосечовину (3с) з різними алкільними замісниками R' і R" можна одержати реакцією придатного аміну (3а) із трет-бутилізотіоціанатом у присутності основи, подібної діізопропілетиламіну, у розчиннику, подібному дихлорметану, з наступним видаленням трет-бутильної групи в кислотних умовах. У альтернативному випадку, тіосечовину (3с) можна одержати реакцією аміну (3а) з тіокарбонілдіімідазолом і потім з насиченим розчином аміаку в метанолі. Наступна конденсація отриманої похідної тіосечовини (3с) з 3бромпіровиноградною кислотою дає кислоту (3d). 4-Заміщені тіазол-2-карбонові кислоти, які застосовують у реакції з аміном 2с на схемі 2, можна одержати, як показано на схемі 4. 45 93377 46 Конденсація етилтіооксамату (4а) з необхідним -бромкетоном (4b) з наступним гідролізом складного ефіру, виконуваним обробкою основою, як-от гідроксид літію, дає тіазолкарбонову кислоту (4d). А-Бромкетони (4b) є комерційно доступними або їх можна одержати -бромуванням відповідного кетону по відомих методиках. Синтез і введення будівельних блоків Р1 Амінокислоти, застосовувані для одержання фрагментів Р1, є або комерційно доступними, або описаними в літературі, див , наприклад, WO 00/09543 і WO 00/59929. На схемі 5 показаний приклад одержання похідної сульфонаміду, що його застосовують як фрагмент Р1. Сульфонамідну групу можна ввести в придатним чином захищену амінокислоту (6а) обробкою амінокислоти агентом сполучення, наприклад, Ν,Ν'-карбонілдіімідазолом (CDI) або тому подібне, у розчиннику, подібному ТГФ, з наступною реакцією з необхідним сульфонамідом (5b) у присутності сильної основи, як-от 1,8діазабіцикло[5.4.0]ундец-7-ен (DBU). В альтернативному випадку амінокислоту можна обробити необхідним сульфонамідом (5b) у присутності основи, подібної діізопропілетиламіну, з наступною обробкою агентом сполучення, подібним РуВОР, для здійснення введення сульфонамід ної групи. Амінозахисну групу видаляють стандартними методами й продукт потім сполучають із частиною Р2 або її попередником. Будівельні блоки Р1 для одержання сполук відповідно до загальної формули І, де А являє собою складний ефір, можна одержати, наприклад, реакцією амінокислоти (5а) з придатним аміном або спиртом у стандартних умовах утворення складного ефіру. Загальний приклад сполучення будівельного блоку Р1 з кислотною функціональною групою структури Р2 показаний на схемі 7. 47 93377 48 Сполучення будівельного блоку Р1 (7b), отриманого, як описано вище, з кислотною функціональною групою частини Р2 із застосуванням стандартних методів для утворення амідного зв'язку, подібних до застосування агента сполучення, як HATU, у присутності основи, як-от діізопропіламін, у розчиннику, подібному диметилформаміду, дає амід (7с). В альтернативному випадку, сульфонамідну групу можна ввести на пізнішій стадії синтезу, наприклад, у останній стадії. У цьому випадку А' у схемі 7 являє собою придатним чином захищену карбонову кислоту, наприклад, її метиловий ефір, і придатним чином звільнену від захисної групи карбонову кислоту, наприклад, водним гідроксидом літію, перед сполученням сульфонамідної групи. Введення зв'язаної за допомогою сечовини ненасиченого алкільного ланцюга з гетероциклічною структурою Р2. Алкільний ланцюг, зв'язаний через функціональну сечовинну групу зі структурою Р2, можна ввести, як показано на схемі 10. Реакція похідної гідразину (10а) з формілуючим агентом, як-от п-нітрофенілхлорформіат, карбонілдіїмідазол, фосген або тому подібне, у присутності основи, подібної до гідрокарбонату натрію, з наступним приєднанням будівельного блоку Р2 дає похідну сечовини (10с). Придатні алкеніламіни, які застосовують за схемою 10, можна одержати, наприклад, алкілуванням необхідного трет-бутилкарбамату, загальний приклад одержання показаний на схемі 11 Реакція необхідного аміну, R5-NH2, з третбутилдикарбонатом дає boc-захищений амін (11а). Алкілування отриманого карбамату ненасиченим алкілуючим агентом (11b), таким як алкенілгалогенід, наприклад, -бромід або -хлорид, з наступним видаленням boc-групи із застосуван ням стандартних умов, як-от обробка розчином TFA у розчиннику, подібному дихлорметану, дає вільний амін (11с). Групу А або Rt1 можна зв'язати з будівельним блоком Р1 на будь-якій стадії синтезу, наприклад, до або після циклізації або до або після циклізації 49 93377 50 й відновлення, як описано тут раніше. Сполуки формули (І), де А або Rt1 являє собою -NHSО2R2, причому ці сполуки представлені формулою (І-k1), можна одержати зв'язуванням групи А або Rt1 з Р1 утворенням амідного зв'язку між обома частинами. Аналогічно цьому, сполуки формули (І), у яких А або Rt1 являє собою -OR1, тобто сполуки (І k-2), можна одержати зв'язуванням групи А або Rt1 з Р1 утворенням складноефірного зв'язку. В одному варіанті здійснення групи -OR1 уводять в останній стадії синтезу сполук формули (І), як показано на нижченаведених схемах реакцій, де G являє собою групу: Проміжну сполуку (2а) можна сполучити з аміном (2b) реакцією утворення аміду, наприклад будь-якої з методик для утворення амідного зв'язку, описаних нижче. Зокрема, (2а) можна обробити агентом сполучення, наприклад, Ν,Ν'карбонілдіімідазолом (CDI), EEDQ, IIDQ, EDCI або гексафторфосфатом бензотриазол-1ілокситриспіролідинофосфонію (комерційно доступний як РуВОР), у розчиннику, як-от простий ефір, наприклад, ТГФ, або галогенований вуглеводень, наприклад, дихлорметан, хлороформ, дихлорметан, і піддати реакції з необхідним сульфонамідом (2b), переважно, після реакції (2а) з агентом сполучення. Реакції (2а) з (2b) переважно проводять у присутності основи, наприклад, триалкіламіну, такої як триетиламін або діізопропілетиламін, або 1,8-діазабіцикло[5.4.0]ундец-7-ену (DBU). Проміжну сполуку (2а) можна також перетворити на активовану форму, наприклад, активовану форму загальної формули G-CO-Z, де Ζ являє собою галоген або залишок активного складного ефіру, наприклад, Ζ являє собою арилоксигрупу, таку як фенокси, п-нітрофенокси, пентафторфенокси, трихлорфенокси, пентахлорфенокси тощо; або Ζ може бути залишком змішаного ангідриду. В одному варіанті здійснення G-CO-Z є хлорангідридом кислоти (G-CO-Cl) або змішаним ангідридом кислот (G-CO-O-CO-R або G-CO-OCO-OR, причому R в останній сполуці є, наприклад, C1-С4алкілом, таким як метил, етил, пропіл, ізопропіл, бутил, трет-бутил, ізобутил або бензил). Активовану форму G-CO-Ζ піддають реакції із сульфонамідом (2b). Активація карбонової кислоти в (2а), як описано в зазначених вище реакціях, може привести до реакції внутрішньої циклізації з утворенням проміжного азалактону формули де L, Rr, Rq, R5, n мають значення, згадані вище, і де стереогенні центри можуть мати стереохімічну конфігурацію, як описано вище, наприклад, як в (I-а) або (І-b). Проміжні сполуки (2а-1) можна виділити з реакційній суміші із застосуванням загальноприйнятої методології й виділену проміжну сполуку (2а-1) потім піддають реакції з (2b) або реакційну суміш, що містить (2а-1), можна піддати додатковій реакції з (2b) без виділення (2а-1). В одному варіанті здійснення, де реакцію з агентом сполучення проводять у розчиннику, що не змішується з водою, реакційну суміш, що містить (2а-1), можна промити водою або слабкоосновною водою для видалення всіх водорозчинних побічних продуктів. У такий спосіб отриманий промитий розчин можна потім піддати реакції з (2b) без додаткових 51 93377 52 стадій очищення. З другого боку, виділення проміжних сполук (2а-1) може забезпечити деякі переваги в тому відношенні, що виділений продукт після необов'язкового додаткового очищення можна піддати реакції з (2b), що дає менше побічних продуктів і дозволяє проводити легшу обробку продукту реакції. Проміжний продукт (2а) можна сполучити зі спиртом (2с) реакцією утворення складного ефіру. Наприклад, (2а) і (2с) піддають реакції один з одним з видаленням води або фізичним методом, наприклад, азеотропним видаленням води, або хімічним методом із застосуванням збезводнювального агента. Проміжну сполуку (2а) можна також перетворити на активовану форму G-CO-Z, як-от активовані форми, зазначені вище, і потім піддати реакції зі спиртом (2с). Реакції одержання складних ефірів переважно проводять у присутності основи, як-от карбонат або, гідрокарбонат лужного металу, наприклад, гідрокарбонату натрію або калію, або третинного аміну, як-от аміни, зазначені тут відносно реакцій одержання амідів, зокрема, триалкіламіну, наприклад, триетиламіну. Розчинники, які можна застосовувати в реакціях одержання складних ефірів, містять у собі прості ефіри, такі як ТГФ, галогеновані вуглеводні, такі як дихлорметан, СН2СІ2; вуглеводні, такі як толуол, полярні апротонні розчиннику, такі як ДМФ, ДМСО, DMA, і подібні розчинники. Синтез сполук, що містять карбоциклічну ланку Р2 Типовий шлях одержання сполук, що містять насичену карбоциклічну структуру Р2, тобто сполук, у яких L являє собою СН у загальній формулі 1, показаний на схемі 14. Насичену циклоалкільну структуру (14b) можна одержати, наприклад, з 3,4біс(метоксикарбоніл)циклопентанону (14а), описаного Rosenquist et al. in Acta Chem. Scand. 46 (1992) 1127-1129, відновленням кетогрупи відновним агентом, подібним борогідриду натрію, у розчиннику, подібному до метанолу, з наступним гідролізом складних ефірів і, нарешті, замиканням циклу в оцтовому ангідриді в присутності піридину. Отриману біциклічну кислоту (14b) можна потім сполучити з функціонально аміногрупою необхідної похідної гідразину (14с) із застосуванням загальноприйнятих умов сполучення пептидів, подібних до застосування HAT і діізопропіламіну в розчиннику, подібному диметилформаміду, з одержанням (14d). Розкриття циклу лактону (14d), наприклад, гідроксидом літію дає кислоту (14е), що її потім можна сполучити з аміногрупою будівельного блоку Р1 або попередника необхідного фрагмента Р1 (14f) із застосуванням звичайних умов сполучення пептидів. Введення R8-группи карбоциклу можна потім виконати, наприклад, реакцією Міцунобу із застосуванням придатного спирту, як описано вище, або будь-яким іншим придатним, попередньо описаним методом. На схемі 15 показаний альтернативний шлях одержання сполук формули І, що включають у себе насичену структуру Р2, де будівельні блоки вводять у зворотному порядку, тобто фрагмент Р1 уводять перед введенням залишку гідразину. 53 93377 54 Захист кислотної групи (15а), наприклад у вигляді трет-бутилового ефіру, обробкою ди-третбутилдикарбонатом у присутності основи, подібної диметиламінопіридину й триетиламіну, у розчиннику, подібному дихлорметану, дає складний ефір (15b). Розкриття кільця лактону із застосуванням, наприклад, гідроксиду літію й наступне приєднання будівельного блоку Р1 (15с), як описано на схемі 12, або безпосередньо через аміногрупу фрагмента Р1 дає (15d). Введення R8-групи, як описано вище, з наступним видаленням захисної групи кислоти витримуванням складного ефіру в кислотних умовах, подібних трифтороцтовій кислоті, і обробкою триетилсиланом у розчиннику, подібному метиленхлориду, і, нарешті, приєднанням залишку гідразину (15е) із застосуванням умов реакції сполучення пептидів, як описано вище, дає похідну гідразиду (15f). Ненасичену структуру Р2, придатну для одержання сполук формули І, можна одержати, як показано на схемі 16. Реакція бромування-елімінування 3,4біс(метоксикарбоніл)циклопентанону (15а), як описано Dolby et al. in J. Org. Chem. 36 (1971) 1277-1285, з наступним відновленням функціональної кетогрупи відновним агентом, подібним борогідриду натрію, дає ненасичену гідроксисполуку (15b). Селективний гідроліз складного ефіру із застосуванням, наприклад, гідроксиду літію в розчиннику, подібному суміші діоксану й води, дає гідроксизаміщену похідну , складного моноефіру (15с). Структуру Р2, де Rq не є воднем, наприклад, являє собою метил, можна одержати, як показано на схемі 17. 55 Окислювання комерційно доступного 3-метил3-бутен-1-олу (17а) із застосуванням агента окислювання, подібного хлорхромату піридинію, з наступною обробкою ацетилхлоридом, бромом і метанолом дає складний -бромефір (17с). Отриманий ефір (17с) можна потім піддати реакції з енолятом (17е), отриманим, наприклад, обробкою відповідного складного трет-бутилового ефіру основою, як-от діізопропіламідом літію, у розчиннику, подібному тетрагідрофурану, з одержанням при цьому алкілованої сполуки (17f). третБутиловий складний ефір (17е) можна одержати обробкою відповідної комерційно доступної кислоти (17d) ди-трет-бутилдикарбонатом у присутності основи, подібної диметиламінопіридину. Циклізація (17f) реакцією метатезису олефінів, проведена, 93377 56 як описано вище, дає похідну циклопентену (17g). Стереоселективне епоксидування (17g) можна проводити застосуванням методу асиметричного епоксидування Якобсена для одержання епоксиду (17h). Нарешті, додавання основи, подібної DBN (1,5-діазабіцикло[4.3.0]нон-5-ену), дає спирт (17і). Подвійний зв'язок сполуки (17і) можна необов'язково відновити, наприклад, каталітичним гідруванням із застосуванням каталізатора, подібного до паладію на вугіллі, для одержання відповідної насиченої сполуки. Отримані циклічні структури можна потім застосовувати, як описано вище, для завершення синтезу сполук формули I. Приклад показаний на схемі 18. 57 93377 58 Аміногрупу будівельного блоку Р1 або його придатного попередника (18b) можна сполучити з кислотною групою похідної циклопентену (18а) із застосуванням стандартних умов сполучення з утворенням амідного зв'язку, як-от застосування HATU у присутності основи, подібної діізопропілфеніламіну або тому подібне, з наступним введенням групи хіназоліну, наприклад, в умовах реакції Міцунобу, як описано вище, для одержання (18d). Гідроліз залишкової групи складного ефіру й потім сполучення продукту з придатним -ненасиченим аміном (18е) з утворенням аміду й необов'язкове наступне перетворення частини Р1 дає циклопентенумісні сполуки (18f) відповідно до загальної формули І. Макроциклізація Макроцикл, що є присутнім у сполуках винаходу, звичайно одержують реакцією метатезиса олефінів (макроциклізація). Хіназолінову групу циклічної структури Р2 можна ввести кожною з раніше описаних стратегій до або після утворення макроциклу. Типовий шлях одержання макроциклічних похідних сечовини показаний на схемі 19. Сполуку (19а), отриману, як описано вище, із застосуванням етилового ефіру вінілциклопропілгліцину як частину Р1, можна перетворити на макроциклічну сполуку (19b) проведенням реакції метатезису олефінів. Для проведення реакції метатезису можна застосовувати каталізатор на основі Ru, такий як каталізатор, описаний Miller, S.J., Blackwell, Η.Ε., Grubbs, R.Η. J. Am. Chem. Soc. 118, (1996), 9606- 9614, Kingsbury, J.S., Harrity, J.Ρ.A., Bonitatebus, Ρ.J., Hoveyda, A.H., J. Am. Chem. Soc. 121, (1999), 791-799 and Huang et al., J. Am. Chem. Soc. 121, (1999), 2674-2678. Має бути також зрозуміло, що для цієї реакції можна застосовувати каталізатори, що містять інші перехідні метали, як-от Мо. Подвійний зв'язок необов'язково відновлюють із застосуванням стандартних методів гідрування, добре відомих у даній галузі, у такий спосіб одержуючи відповідну насичену макроциклічну сполуку. Макроциклізацію, описану на схемі 19, можна також застосовувати для сполук, що включають у себе насичену або ненасичену карбоциклічну структуру Р2, як приклад зазначену на схемі 20. 59 93377 60 Сполучення похідної гідразину (20b) з будівельним блоком Р2-Р1 (21а), отриманим, як описано на схемі 13 або 14, із застосуванням стандартних умов одержання пептидів, таких як застосування HATU у присутності придатної основи, наприклад, діізопропіламіну, дає проміжну сполуку (20с). Замикання циклу (20с) реакцією метатезису олефінів, як описано на схемі 18, дає макроциклічну сполуку (20d). Коли проміжні сполуки в описані вище схемах містять функціональну групу(и), їх придатним чином захищають, коли потрібно, і потім звільняють від захисної групи методами, відомими фахівцям у даній галузі. Екстенсивний опис методів див., наприклад, у цитованій вище публікації Bodanzky або Greene. Синтез будівельних блоків P3 Будівельні блоки P3 можна синтезувати відповідно до методологій, відомих фахівцеві в даній галузі Одна із цих методологій показана на зазначеній нижче схемі 28 і в ній застосовують ι моноациловані аміни, такі як трифторацетамід або Восзахищений амін. де R являє собою трет-бутокси, трифторметил; R5 і n мають значення, згадані в даному описі, і LG являє собою відхідну групу, таку як галоген. Моноациловані аміни (18а) обробляють сильною основою, як-от гідрид натрію, і потім піддають реакції з галогенС3-С6aлкенілом (28b) з утворенням відповідного захищеного аміну (28с). Зняття захисту в (28с) дає будівельний блок P3 або (28d). Зняття захисту буде залежати від функціональної групи R, так, якщо R являє собою трет-бутокси, зняття захисту у відповідного Вос-захищеного аміну можна виконати кислотною обробкою, наприклад, трифтороцтовою кислотою. В альтернативному випадку, коли R являє собою, наприклад, трифторметил, видалення групи R виконують основою, наприклад, гідроксидом натрію. На схемі 29 як приклад вказується ще один метод одержання будівельного блоку P3. Синтез Габріеля первинних С 3С6алкеніламінів, який можна проводити обробкою фталіміду (29а) основою, як-от гідроксид калію, і С3-С6алкенілгалогенідом (29b) з наступним гідролізом проміжного N-алкіліміду дає первинний С3С6алкеніламін (29с). Поєднання придатного будівельного блоку P3 з частиною Р2-Р1 можна виконати утворенням амідного зв'язку, як пояснюється тут. Одержання макроциклу Одержання макроциклу можна проводити за допомогою реакції метатезису олефінів у присутності придатного металевого каталізатора, як-от, наприклад, каталізатор на основі Ru, описаний Miller, S.J., Blackwell, H.E.; Grubbs, R.H. J. Am. Chem. Soc. 118, (1996), 9606-9614, Kingsbury, J.S., Harrity, J.P.A., Bonitatebus, P.J., Hoveyda, A.H., J. Am. Chem. Soc. 121, (1999), 791-799 and Huang et al., J. Am. Chem. Soc. 121, (1999), 2674-2678, наприклад, каталізатор Hoveyda-Grubbs. Для одержання макроциклу в більших масштабах можна застосовувати стабільні на повітрі рутенієві каталі затори, такі як біс(трициклогексилфосфін)-3-феніл1Н-інден-1-іліденрутенійхлорид (неоліст М1) або біс(трициклогексилфосфін)[(фенілтіо)метилен]рут еній(ІV)дихлорид. Для даної реакції можна також застосовувати інші каталізатори, що містять інші перехідні метали, як-от Мо. Реакції метатезису можна проводити в придатному розчиннику, як-от, наприклад, прості ефіри, наприклад, ТГФ, діоксан, галогеновані вуглеводні, наприклад, дихлорметан, СНСl3, 1,2-дихлоретан тощо, вуглеводні, наприклад, толуол. У кращому варіанті здійснення реакцію метатезиса проводять у толуолі. Ці реакції проводять при підвищених температурах в атмосфері азоту. Подвійний зв'язок необов'язково відновлюють стандартними методами гідрування, добре відомими в даній галузі, наприклад, воднем у присутності як каталізатору благородного металу, такого як Pd або Pt. Ряд певних шляхів синтезу для одержання сполук формули (І) або конкретних підгруп сполук
ДивитисяДодаткова інформація
Назва патенту англійськоюMacrocyclic inhibitors of hepatitis c virus
Автори англійськоюRaboisson Pierre Jean-Marie Bernard, De Kock Herman Augustinus, Hu Lili, Simmen Kenneth Alan, Lindquist Karin Charlotta, Lindstroem Mats Stefan, Belfrage Anna Karin Gertrud Linnea, Waehling Horst Juergen, Nilsson Karl Magnus, Samuelsson Bengt Bertil, Rosenquist Aasa Annica Kristina, Sahlberg Sven Crister, Wallberg Hans Kristian, Kahnberg Pia Cecilia, Classon Bjoern Olof
Назва патенту російськоюМакроциклические ингибиторы вируса гепатита c
Автори російськоюРабуассон Пьер Жан-Мари Бернар, де Кок Герман Аугустинус, Ху Лили, Симмен Кеннет Алан, Линдквист Карин Шарлотта, Линдстром Матс Стефан, Белфраге Анна Карин Гертруд Линнеа, Велинг Хорст Юрген, Нилссон Карл Магнус, Самуэльссон Бенгт Бертил, Розенквист Эса Анника Кристина, Сальберг Свен Кристер, Валльберг Ханс Кристиан, Канберг Пиа Сесилия, Классон Бьорн Олоф
МПК / Мітки
МПК: C07D 417/04, A61K 31/517, C07D 239/72, A61P 31/12
Мітки: інгібітори, гепатиту, вірусу, макроциклічні
Код посилання
<a href="https://ua.patents.su/77-93377-makrociklichni-ingibitori-virusu-gepatitu-s.html" target="_blank" rel="follow" title="База патентів України">Макроциклічні інгібітори вірусу гепатиту с</a>
Попередній патент: Робота на багатьох несучих в системах передачі даних
Наступний патент: 3-амінокарбазольна сполука, фармацевтична композиція, яка її містить, та спосіб її одержання
Випадковий патент: Похідні тіазолу та їх застосування