3-амінокарбазольна сполука, фармацевтична композиція, яка її містить, та спосіб її одержання
Номер патенту: 93378
Опубліковано: 10.02.2011
Автори: Каццолла Нікола, Колетта Ізабелла, Мангано Джорджина, Руссо Вінченцо, Алісі Марія Алессандра, Поленцані Лоренцо, Фурлотті Гвідо, Драгоне Патріція
Формула / Реферат
1. 3-Амінокарбазольна сполука, яка характеризується тим, що вибрана із групи, яка складається зі сполук таблиці 1 нижче:
Таблиця 1
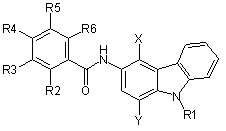 (I)
(I)
№ сполуки
R1
R2
R3
R4
R5
R6
X
Y
1
СН3
Сl
Н
Н
Н
Н
Н
Н
2
СН(СН3)2
Сl
Н
Н
Н
Н
Н
Н
3
PhCH2
Сl
Н
Н
Н
Н
Н
Н
4
СН3СН2
CF3
Н
Н
Н
Н
Н
Н
5
СН3СН2
СН3
Н
Н
Н
СН3
Н
Н
6
СН3СН2
F
Н
н
Н
CF3
Н
Н
7
СН3СН2
CF3
Н
F
Н
Н
Н
Н
8
СН3СН2
Вr
Н
Н
Н
ОСН3
Н
Н
9
СН3СН2
Сl
Н
Н
Сl
ОСН3
Н
Н
10
PhCH2
NH2
Н
Н
Н
Н
Н
Н
11
СН3СН2
N(CH3)2
Н
Н
Н
Н
Н
Н
12
СН3(СН2)4
Сl
Н
Н
Н
Н
Н
Н
13
СН3ОСН2СН2
Сl
Н
Н
Н
Н
Н
Н
14
НООС(СН2)3
Сl
Н
Н
Н
Н
Н
Н
15
СН3СН2
Сl
Н
Н
Н
Н
СН3
СН3
16
СН3СН2
Сl
Н
Н
Н
Н
CH3
H
17
СН3СН2
Сl
Н
Н
Н
Н
H
СН3
18
СН3СН2
Сl
Н
Н
Н
Н
СН3
ОСН3
та її фармацевтично прийнятна сіль.
2. Фармацевтична композиція, яка відрізняється тим, що містить терапевтично ефективну дозу 3-амінокарбазольної сполуки, вибраної із групи, яка складається зі сполук, наведених в таблиці 1 за пунктом 1 вище, або її фармацевтично прийнятної солі, разом із принаймні одним фармацевтично прийнятним інертним наповнювачем.
3. Спосіб лікування або профілактики запальних процесів, пухлин, хвороби Альцгеймера та атеросклерозу у ссавців, який включає введення терапевтично ефективної кількості 3-амінокарбазольної сполуки, вибраної із групи, яка складається зі сполук, наведених в таблиці 1 за пунктом 1 вище, або її фармацевтично прийнятної солі, індивідууму, який цього потребує.
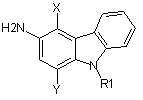
4. Спосіб одержання 3-амінокарбазолу, вказаного в таблиці 1 за пунктом 1 вище, який характеризується тим, що здійснюють наступні стадії:
а) взаємодію аміну формули (II)
 , (II)
, (II)
в якій R1, X та Y мають значення, наведені в таблиці 1,
зі сполукою формули (III)
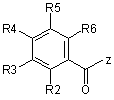 , (III)
, (III)
в якій R2, R3, R4, R5 та R6 мають значення, наведені в таблиці 1, та
Z вибраний із групи, яка включає Сl, Вr, ОН, OR та OC(O)R,
в якій R являє собою лінійний або розгалужений алкіл, який містить від 1 до 6 атомів вуглецю,
одержуючи 3-амінокарбазольну сполуку формули (І)
 , (I)
, (I)
в якій R1, R2, R3, R4, R5, R6, X та Y мають значення, наведені в таблиці 1, та
б) необов'язково утворення фармацевтично прийнятної солі сполуки формули (І), яка отримана в такий спосіб.
Текст
1. 3-Амінокарбазольна сполука, яка характеризується тим, що вибрана із групи, яка складається зі сполук таблиці 1 нижче: Таблиця 1 R5 C2 O N R1 Y № сполуки 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 R1 СН3 СН(СН3)2 PhCH2 СН3СН2 СН3СН2 СН3СН2 СН3СН2 СН3СН2 СН3СН2 PhCH2 СН3СН2 СН3(СН2)4 СН3ОСН2СН2 НООС(СН2)3 СН3СН2 СН3СН2 СН3СН2 СН3СН2 R2 Сl Сl Сl CF3 СН3 F CF3 Вr Сl NH2 N(CH3)2 Сl Сl Сl Сl Сl Сl Сl (13) R2 R3 Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н R4 Н Н Н Н Н н F Н Н Н Н Н Н Н Н Н Н Н (I) R5 Н Н Н Н Н Н Н Н Сl Н Н Н Н Н Н Н Н Н R6 Н Н Н Н СН3 CF3 Н ОСН3 ОСН3 Н Н Н Н Н Н Н Н Н X Н Н Н Н Н Н Н Н Н Н Н Н Н Н СН3 CH3 H СН3 Y Н Н Н Н Н Н Н Н Н Н Н Н Н Н СН3 H СН3 ОСН3 93378 R3 X (11) H N UA R6 (19) R4 3 та її фармацевтично прийнятна сіль. 2. Фармацевтична композиція, яка відрізняється тим, що містить терапевтично ефективну дозу 3амінокарбазольної сполуки, вибраної із групи, яка складається зі сполук, наведених в таблиці 1 за пунктом 1 вище, або її фармацевтично прийнятної солі, разом із принаймні одним фармацевтично прийнятним інертним наповнювачем. 3. Спосіб лікування або профілактики запальних процесів, пухлин, хвороби Альцгеймера та атеросклерозу у ссавців, який включає введення терапевтично ефективної кількості 3амінокарбазольної сполуки, вибраної із групи, яка складається зі сполук, наведених в таблиці 1 за пунктом 1 вище, або її фармацевтично прийнятної солі, індивідууму, який цього потребує. 4. Спосіб одержання 3-амінокарбазолу, вказаного в таблиці 1 за пунктом 1 вище, який характеризується тим, що здійснюють наступні стадії: а) взаємодію аміну формули (II) X 93378 4 R5 R4 R6 z R3 R2 , (III) в якій R2, R3, R4, R5 та R6 мають значення, наведені в таблиці 1, та Z вибраний із групи, яка включає Сl, Вr, ОН, OR та OC(O)R, в якій R являє собою лінійний або розгалужений алкіл, який містить від 1 до 6 атомів вуглецю, одержуючи 3-амінокарбазольну сполуку формули (І) R5 R4 R6 H N R3 R2 H2N X O N Y N Y O R1 , (II) в якій R1, X та Y мають значення, наведені в таблиці 1, зі сполукою формули (III) Даний винахід стосується 3-амінокарбазольної сполуки, фармацевтичної композиції, яка її містить, та способу її одержання. Більш конкретно, даний винахід стосується 3амінокарбазольної сполуки, яка корисна для лікування або запобігання порушень, зв'язаних із продукцією простагландину Е2 (PGE2), наприклад, запальних процесів, пухлин, хвороби Альцгеймера та атеросклерозу. Значення Е2 простагландинів (PGE2) зумовлене дією, яку вони здійснюються, функціонуючи як біорегулятори, разом з іншими простаноїдами, що утворюються метаболічно з арахідонової кислоти, та як медіатори запалення. Простаноїди є класом сполук, який включає простагландини, тромбоксани та простацикліни. Простаноїди є ліпідними медіаторами, які діють як місцеві гормони на клітини, суміжні з сайтом їх вивільнення. Простаноїди в основному утворюються з арахідонової кислоти шляхом циклооксигеназа-активованого ферментативного окислення. Циклооксигенази (простагландин G/H синтази) каталізують послідовне утворення PGG2 та PGH2 з арахідонової кислоти. Після цього PGH2 перетворюється в різні простаноїди за допомогою специфічних ферментів. Таким способом утворюються D2 простагландини (PGD2), Е2 простагландини (PGE2), F2 простагландини (PGF2), I2 простагландини (PGI2) та А2 тромбоксани (ТХА2). R1 , (I) в якій R1, R2, R3, R4, R5, R6, X та Y мають значення, наведені в таблиці 1, та б) необов'язково утворення фармацевтично прийнятної солі сполуки формули (І), яка отримана в такий спосіб. При викиді сім'яної рідини простаноїди не накопичуються. Після різноманітних стимулів (запальні, імунологічні, гормональні, ультрафіолет, пухлинні засоби, а також механічне перемішування), вони синтезуються та вивільняються у позаклітинний простір, з якого вони приникають у плазму, сечу та інші біологічні рідини. Простаноїди відіграють важливу роль у захисних механізмах функціонування органів та цілісності організму. Це підтверджується за допомогою клітиннозахисної функції в шлунково-кишковому тракті, регуляції функції нирок та капілярного кровообігу, шляхом регуляції агрегації тромбоцитів та зсідання крові, задіяні в диференціацію імунних клітин та в загоєнні ран, обміну речовин в кістах та овуляції. Зокрема, слід зазначити судиннозахисну дію PGI2, яка є важливою для підтримання тонусу судин та для запобігання тромбоемболії та атеросклерозу на рівні ендотелію, та протизапальну і антипроліферативну дію PGD2 простаноїдів, метаболіт яких, 15d-PGJ2, здатний проявляти протизапальні ефекти шляхом активації PPAR (рецепторгамма, який активується проліфератором пероксисом) ядерних рецепторів (Inoue та ін., 2000). Таким чином, простаноїди є біорегуляторами, а також важливими медіаторами запалення та інших патології. 5 93378 Зокрема, PGE2 простаноїди у великій кількості зустрічаються в місцях запалення та відповідають за різноманітні патологічні аспекти гострого і хронічного запалення, наприклад, набряк, утворення еритем, запального болю, запалення суглобів та гарячка. По суті, PGE2 простаноїди представляють собою ефективні прозапальні та алгогенні засоби. Антитіла до PGE2 мають протизапальну активність та у тварин, у яких відсутні рецептори PGE2, проявляють знижену відповідь на запальний стимул (Portanova та ін., 1996, Ueno та ін., 2001) та відсутність піретичної відповіді на пірогенний стимул (Ushikubi та ін., 1998). Нестероїдні протизапальні засоби (НСПЗЗ) та селективні СОХ-2 ліки зараз використовують для зменшення симптомів, пов'язаних із запаленням, шляхом неселективного інгібування продукції ейкозаноїдів (PGE2, PGD2, PGF2, PGI2 та ТХА2) завдяки інгібуючій дії на циклооксигенази 1 та 2 (FitzGerald та Patrono, 2001). Зокрема, селективні СОХ-2 ліки, які зараз надходять в продаж, мають меншу токсичну дію на шлунково-кишковий тракт в порівнянні із загальноприйнятими нестероїдними протизапальними засобами (НСПЗЗ). Незважаючи на це, вказані селективні СОХ-2 ліки зменшують продукцію судинного простацикліну (PGI2, який переважно утворюється з СОХ-2), змінюючи фізіологічну рівновагу між протромботичними та антитромботичними ейкозаноїдами на користь протромботичних (ТХА2, який переважно утворюється з СОХ-1), та зумовлюють підвищений ризик тромботичних серцево-судинних подій (S. Malhotra, MD, DM; N. Shafiq, MD; P. Pandhi, MD Medscape General Medicine 6(1), 2004; D. Mukherjee та E.J. Topol Cardiovascular risk and COX-2 inhibitors, Arthritis Res. Ther. 2003, 5:8-112002). Різні 3-амінокарбазольні сполуки досліджувалися стосовно їх активності селективно зв'язуватися з Y5 рецептором людини та модулювати його активність. Ця здатність робить їх корисними для лікування розладів апетиту та обміну речовин, наприклад, ожиріння, нейрогенної булімії, нервово-психічної анорексії, порушення сну, морфінової залежності та епілептичних нападів (WO 01/07409 А1, WO 02/051806, WO 02/096902 та US 6 399 631). 6 Несподівано, зараз було виявлено, що певні 3амінокарбазольні сполуки здатні селективно інгібувати продукцію простагландину Е2 (PGE2). Ці сполуки здатні зменшувати продукцію PGE2 і, таким чином, є активними при всіх патологічних станах, в яких PGE2 діє як медіатор (наприклад: запальні процеси, біль, гарячка, пухлини, хвороба Альцгеймера та атеросклероз). Типовими прикладами таких запальних процесів є набряк, еритема, запалення суглобів, ревматоїдний артрит та артроз. Типовими прикладами таких пухлин є колоректальна карцинома, рак легень та аденокарцинома. Сполуки відповідно до даного винаходу селективно інгібують синтез PGE2. Перевагою цієї селективності є інгібування потенційного медіатора запалення, болю та гарячки, тоді як залишається незміненою продукція інших простаноїдів, які утворюються одночасно в каскаді арахідонової кислоти, таких як PGF2, TXA2, PGI2 та PGD2. Таким чином, залишаються незміненими всі захисні механізми функціонування органів та цілісності організму, що є типовим для активності інших простаноїдів. Подібно до загальноприйнятих нестероїдних протизапальних лікарських засобів, сполуки відповідно до даного винаходу мають протизапальні, жарознижувальні та болезаспокійливі властивості, і, таким чином, активні при патологіях, таких як запалення, біль, гарячка, ревматоїдний артрит та артроз. Додатково, оскільки задіяння PGE2 в пухлини, хворобу Альцгеймера та атеросклероз відоме з літератури, то сполуки відповідно до даного винаходу застосовуються для запобігання та лікування цих патологій. Корисно є те що, ці сполуки проявляють незначні побічні дії в порівнянні із НСПЗЗ та селективними СОХ-2 ліками, які, шляхом інгібування циклооксигеназ, не відрізняються від простаноїдів. Зокрема, ці похідні корисні як для лікування, так і для профілактики запальних процесів. Зокрема, сполуки відповідно до даного винаходу проявляють зменшену шлунково-кишкову, ниркову та судинну токсичність. В першому аспекті здійснення, даний винахід стосується 3-амінокарбазольної сполуки, яка характеризується тим, що вибрана із групи, яка складається зі сполук, наведених в таблиці 1 нижче: Таблиця 1 № сполуки 1 2 3 4 R1 СН3 СН(СН3)2 PhCH2 СН3СН2 R2 СІ СІ СІ CF3 R3 Н Н Н Н R4 Н Н Н Н (І) R5 Н Н Н Н R6 Н Н Н Н X Н Н Н Н Y Н Н Н Н 7 93378 8 Продовження таблиці 1 5 6 7 8 9 10 11 12 13 14 15 16 17 18 СН3СН2 СН3СН2 СН3СН2 СН3СН2 СН3СН2 PhCH2 СН3СН2 СН3(СН2)4 СН3ОСН2СН2 НООС(СН2)3 СН3СН2 СН3СН2 СН3СН2 СН3СН2 CH3 F CF3 Вr СІ NH2 N(CH3)2 СІ СІ СІ СІ СІ СІ СІ та їх фармацевтично прийнятних солей. Як відомо фахівцю в даній галузі техніки, фармацевтично прийнятними солями сполук з таблиці 1 можуть бути: - солі приєднання кислоти, коли сполука є основною, наприклад, сполука 10 або 11, або - солі приєднання основи, коли сполука є кислотною, наприклад, сполука 14. Прикладами придатних фармацевтично прийнятних кислот є мінеральні кислоти, такі як НСl, HBr, H2SO4 та Н3РО4, і органічні кислоти, такі як щавлева кислота, винна кислота, метансульфонова кислота, n-толуолсульфонова кислота, малеїнова кислота, янтарна кислота, молочна кислота та лимонна кислота. Прикладами придатних фармацевтично прийнятних основ є лужні метали та лужноземельні метали, такі як Na+, K+, Мr++ та Са++, і органічні основи, такі як трометамін, холін та лізин. В другому варіанті здійснення, даний винахід стосується фармацевтичної композиції, яка характеризується тим, що вона містить терапевтично ефективну дозу 3-амінокарбазольної сполуки, вибраної із групи, яка складається зі сполук, наведених в таблиці 1 вище або її фармацевтично прийнятної солі, разом із принаймні одним фармацевтично прийнятним інертним наповнювачем. Переважно, фармацевтичні композиції за даним винаходом приготовлені в підходящих дозованих формах. Прикладами підходящих дозованих форм є таблетки, капсули, таблетки з покриттям, гранули, та розчини і сиропи для перорального введення; креми, мазі та антисептичні пластирі для місцевого введення; супозиторії для ректального введення і стерильні розчини для введення шляхом ін'єкції, або аерозольного або офтальмологічного введення. Сприятливо, ці дозовані форми можуть бути приготовлені у вигляді лікарського препарату таким чином, щоб забезпечити контрольоване вивільнення в часі сполуки з таблиці 1 вище або її фармацевтично прийнятної солі. Особливо, залежно від типу лікування, потрібний час вивільнення може бути дуже коротким, нормальним або довгим. Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н F Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н СІ Н Н Н Н Н Н Н Н Н СН3 CF3 Н ОСН3 ОСН3 Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н СН3 СН3 Н СН3 Н Н Н Н Н Н Н Н Н Н СН3 Н СН3 ОСН3 Дозовані форми також можуть містить інші загальноприйняті компоненти, наприклад: консерванти, стабілізатори, поверхнево-активні речовини, буфери, солі для регуляції осмотичного тиску, емульсифікатори, підсолоджувачі, барвники, ароматизатори та ін. Додатково, коли це необхідно для конкретних терапій, фармацевтична композиція відповідно до даного винаходу також може містити інші фармацевтично активні компоненти, які корисні для спільного введення. Кількість сполуки за даним винаходом у фармацевтичній композиції змінюється в широкому інтервалі залежно від відомих факторів, наприклад, типу захворювання, яке піддається лікуванню, тяжкості захворювання, ваги тіла організму пацієнта, дозованої форми, вибраного шляху введення, кількості введень на добу та ефективності вибраної сполуки. Однак, оптимальна кількість може бути легко і загальноприйнято визначена фахівцем в даній галузі техніки. Звичайно, кількість сполуки відповідно до даного винаходу у фармацевтичній композиції буде такою, щоб забезпечити рівень введення між 0,0001 та 100мг/кг/добу та більш переважно між 0,01 та 10мг/кг/добу. Дозовані форми фармацевтичних композицій за даним винаходом можуть бути приготовлені відповідно до методик, які добре відомі фармацевтам, включаючи змішування, гранулювання, таблетування, розчинення, стерилізацію та інші. В третьому варіанті здійснення винаходу, даний винахід стосується способу лікування або профілактики запальних процесів, пухлин, хвороби Альцгеймера та атеросклерозу у ссавців, який включає введення терапевтично ефективної кількості 3-амінокарбазольної сполуки, вибраної із групи, яка складається зі сполук, наведених в таблиці 1 вище або її фармацевтично прийнятної солі індивідууму, який цього потребує. Переважно, запальний процес вибирають із групи, яка включає набряк, еритему, запалення суглобів, ревматоїдний артрит та артроз, і пухлину вибирають із групи, яка включає колоректальну карциному, рак легень та аденокарциному. 9 93378 3-амінокарбазоли, наведені в таблиці 1 вище, можуть бути отримані відповідно до відомих способів, наприклад, шляхом взаємодії кислоти або її реакційно-здатного похідного, з вибраним аміном (патентна заявка WO 02/096902 А1, WO 02/051806, J. Med. Chem. 2002 том 45, стор. 35093523). Типовими прикладами реакційно-здатних похідних є ацилгалогеніди, ангідриди або складні ефіри. В четвертому аспекті здійснення винаходу, даний винахід, таким чином, стосується способу одержання 3-амінокарбазолу з таблиці 1 вище, який характеризується тим, що включає наступні стадії: а) взаємодію аміну формули (II) (ll) в якій R1, X та Υ мають значення, вказані в таблиці 1, зі сполукою формули (III) (lll) в якій R2, R3, R4, R5 та R6 мають значення, вказані в таблиці 1, та Ζ вибраний із групи, яка включає СІ, Br, OH, OR та OC(O)R, в якій R являє собою лінійний або розгалужений алкіл, який містить від 1 до 6 атомів вуглецю, одержуючи 3-амінокарбазольну сполуку формули (І) (l) в якій R1, R2, R3, R4, R5, R6, X та Υ мають значення, вказані в таблиці 1, та б) необов'язково утворення фармацевтично прийнятної солі сполуки формули (І), яка отримана в такий спосіб. Звичайно, стадію (а) здійснюють в присутності підходящого розчинника при температурі в інтервалі від 0 до 140°С, впродовж періоду часу в інтервалі від 0,5 до 24 годин. Переважно, температура реакції знаходиться в інтервалі від 15 до 40°С. Сприятливо, час реакції становить від 2 до 18 годин. Переважно, розчинник є апротонним, полярним або неполярним. Ще більш переважним є полярний апротонний розчинник. Прикладами прийнятних апротонних розчинників є диметилформамід та дихлорметан. 10 У варіанті здійснення, в якому Ζ являє собою СІ або Вr, реакцію сприйнятливо здійснюють в присутності придатного акцептора органічної або мінеральної кислоти. Прикладами придатних органічних акцепторів є діізопропілетилендіамін, триетиленамін, піридин та диметиламінопіридин. Прикладами мінеральних акцепторів є карбонати або бікарбонати лужних металів. У варіанті здійснення, в якому Ζ являє собою ОН, реакцію переважно здійснюють в присутності придатної сполучної речовини, наприклад, дициклогексилкарбодііміду (який також знаходиться на основі з полістирольного полімеру) або карбонілдіімідазолу. Приклади, наведені далі, більш докладно ілюструють винахід, але ніяким чином його не обмежують. Приклад 1 Одержання сполуки 1 (R1=CH3, R2=Cl, R3=R4=R5=R6=X=Y=H) а) 9-метил-9H-карбазол До розчину карбазолу (5г; 0,030 моль) в диметилформаміді (50мл) порціями додавали гідрид натрію (60% суспензію в мінеральному маслі, 1,15г; 0,030 моль) та отриману суспензію перемішували при кімнатній температурі протягом 30 хвилин, потім по краплях додавали йодметан (1,43мл; 0,030 моль). Суспензію, отриману в такий спосіб, перемішували протягом 16 годин та Н2О потім обережно додавали до завершення осадження. Осад збирали шляхом фільтрації в вакуумі та висушували в вакуумній сушарці. 5,3г бажаного продукту отримували в такий спосіб та використовували без додаткового очищення. 1 Н ЯМР (300МГц, ДМСО-d6) част, на млн. 3,87 (s, 3 Η), 7,20 (t, J = 7,5 Гц, 2 Η), 7,43-7,49 (m, 2 Η), 7,56-7,61 (m, 2 Η), 8,15 (d, J = 7,5 Гц, 2Н). б) 9-метил-3-нітро-9H-карбазол Продукт, отриманий як описано на стадії а) вище (3,9г; 0,022 моль), розчиняли в льодяній оцтовій кислоті (70мл). Потім по краплях додавали суміш, яка містить димлячу азотну кислоту (1,05мл) в льодяній оцтовій кислоті (3,11мл) протягом 30 хвилин. Розчин, отриманий таким способом, перемішували додатково протягом 30 хвилин. Потім реакційну суміш вливали в Н2О та лід, перемішували протягом 15 хвилин та фільтрували. Осад, отриманий таким способом, (4г) очищали за допомогою флеш-хроматографії, елююючи сумішшю 85/15 гексан/етилацетат. Бажаний продукт (2,2г) отримували таким способом. 1 Н ЯМР (300МГц, хлороформ-d); част, на млн. 3,92 (s, 3Η), 7,27-7,51 (m, 3 Η), 7,54-7,63 (m, 1 Η), 8,15 (d, J = 7,9 Гц, 1 Η), 8,40 (dd, J = 8,9, 2,2 Гц, 1 Η), 9,01 (d, J = 2,0 Гц, 1H). в) 9-метил-9H-карбазол-3-амін Продукт, отриманий як описано на стадії б) вище (1,94г; 0,009 моль), розчиняли в абсолютному етанолі (20мл). Потім додавали дигідрат хлориду олова (II) (8,16г; 0,043 моль). Суміш, отрима 11 93378 ну таким способом, нагрівали в колбі зі зворотним холодильником протягом 16 годин. Реакційну суміш охолоджували до кімнатної температури та потім розчинник видаляли при зниженому тиску. Залишок ресуспендували в Н2О. Значення рН доводили до 7,5 шляхом додавання насиченого розчину бікарбонату натрію та суміш переносили в ділильну лійку. Органічну фазу екстрагували етилацетатом (2100мл). Органічні екстракти об'єднували та промивали водою, насиченою NaCl (2100мл). Органічну фазу відділяли та висушували над Na2SO4. Органічну фазу відділяли та висушували над Na2SO4. Потім розчинник видаляли шляхом упарювання при зниженому тиску та осад, отриманий таким способом, (1,5г) використовували без додаткового очищення. 1 Н ЯМР (300МГц, ДМСО-d6) част, намлн. 3,76 (s, 3Η), 4,72 (br, s, 2 Η), 6,84 (dd, J = 8,8, 2,0 Гц, 1 Η), 7,04 - 7,11 (m, 1 Η), 7,25 - 7,30 (m, 2 Η), 7,32 - 7,39 (m, 1H), 7,44 (d, J = 8,1 Гц, 1 Η), 7,93 (dt, J = 7,6, 1,0 Гц, 1 Η). г) 2-хлор-N-(9-метил-9H-карбазол-3іл)бензамід Продукт, отриманий як описано на стадії в) вище (1,5г; 0,008 моль), розчиняли в дихлорметані (20мл). Потім до розчину додавали діізопропілетилендіамін (1,19г; 0,009 моль) та 2-хлорбензоїл хлорид (1,16мл; 0,009 моль). Суміш, отриману таким способом, перемішували протягом 3 годин. Реакційну суміш переносилив ділильну лійку та промивали 1 н. розчином НСl (50мл), 1 н. NaOH (50мл) та Н2О (50мл). Органічну фазу відділяли та висушували над Na2SO4. Потім розчинник видаляли шляхом упарювання при зниженому тиску та осад, отриманий таким способом, (3г) кристалізували з суміші 1/2 гексан/етилацетат. 2-Хлор-N-(9-метил-9H-карбазол-3-іл)бензамід (1,2г) отримували таким способом, tпл.: 206°С. Елементарний аналіз для C20H15ClN2О Знайдено % Розраховано % С 71,81 71,75 Η 4,34 4,52 Ν 8,37 8,37 Н ЯМР (300МГц, ДМСО-d6) част, на млн. 3,88 (s, 3 Η), 7,20 (t, J = 6,9 Гц, 1 Η), 7,43 - 7,73 (m, 8 Η), 8,09 (d, J = 7,6 Гц, 1 Η), 8,57 (d, J = 1,7 Гц, 1 Η), 10,48 (br.s, 1 Η). Приклад 2 Одержання сполуки 2 (R1=CH(CH3)2, R2=Cд, R3=R4=R5=R6=X=Y=H) а) 9-(1-метилетил)-9Н-карбазол Карбазол (5г; 0,03 моль), піддавали реакції з ізопропілбромідом (5,61мл; 0,06 моль) за способом, аналогічним до описаного в прикладі 1а). Твердий продукт, отриманий після фільтрації (4г), очищали за допомогою флеш-хроматографії, елююючи сумішшю 97/3 гексан/етилацетат, й отримували 3,3г бажаного продукту. 1 Н ЯМР (300МГц, ДМСО-d6) част, на млн., 1,63 (d, J = 7,0 Гц, 6 Η), 5,11 (гепт, J = 7,0, Гц, 1 Η), 7,18 (t, J = 7,5 Гц, 2 Η), 7,38 - 7,45 (m, 2 Η), 7,69 (d, J = 8,2 Гц, 2 Η), 8,15 (dt, J = 7,6, 1,0 Гц, 2 Η). 1 12 б) 9-(1-метилетил)-3-нітро-9Н-карбазол Продукт, отриманий як описано на стадії а) вище (3,3г; 0,016 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 1б). Твердий продукт, отриманий після фільтрації (3,7г), очищали за допомогою флешхроматографії, елююючи сумішшю 95/5 гексан/етилацетат, й отримували 1,8г бажаного продукту. 1 Н ЯМР (300МГц, ДМСО-d6) част, на млн., 1,67 (d, J = 7,0 Гц, 6 Η), 5,23 (гепт, J = 7,0, Гц, 6 Η), 7,33 (t, J = 7,0 Гц, 1 Η), 7,53 - 7,60 (m, 1 Η), 7,85 (d, J = 8,0 Гц, 1 Η), 7,90 (d, J = 9,2 Гц, 1 Η), 8,31 (dd, J = 9,2, 2,3 Гц, 1 Η), 8,43 (dq, J = 8,0, 0,7 Гц, 1 Η), 9,18(d, J = 2,3 Гц, 1H). в) 9-(1-метилетил)-9Н-карбазол-3-амін Продукт, отриманий як описано на стадії б) вище (1,7г; 0,007 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 1в). Продукт, отриманий таким способом, (1,3г) використовували без додаткового очищення. 1 Н ЯМР (300МГц, ДМСО-d6) част, на млн. 1,57 (d, J = 7,0 Гц, 6 Η), 4,71 (br, s, 2 Η), 4,95 (гепт, J = 7,0 Гц, 1 Η), 6,80 (dd, J = 8,6, 2,2 Гц, 1 Η), 7,04 (t, J = 6,9 Гц, 1 Η), 7,25 - 7,34 (m, 2 Η), 7,38 (d, J = 8,8 Гц, 1 Η), 7,53 (d, J = 8,6 Гц, 1 Η), 7,92 (dq, J = 7,8, 0,7 Гц, 1 Η). г) 2-хлор-N-[9-(1-метилетил)-9H-карбазол-3іл]бензамід Продукт, отриманий як описано на стадії в) вище (1,2г; 0,005 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 1г). Продукт, отриманий таким способом, (2,2г) два рази кристалізували з суміші 1/9 гексан/етилацетат. 2-Хлор-N-[9-(1-метилетил)-9H-карбазол-3іл]бензамід (1,1г) отримували таким способом, tпл.: 195°С Елементарний аналіз для C22H19ClN2O Знайдено % Розраховано % С 72,71 72,82 Η 5,16 5,28 Ν 7,88 7,72 Н ЯМР (300МГц, ДМСО-d6) част, на млн. 1,63 (d, J = 6,9 Гц, 6 Η), 5,09 (гепт, J = 6,9 Гц, 1 Η), 7,18 (t, J = 7,4 Гц, 1 Η), 7,38 - 7,73 (m, 8 Η), 8,08 (d, J = 7,3 Гц, 1 Η), 8,56 (d, J = 1,7 Гц, 1H), 10,47 (br,s, 1 Η). Приклад 3 Одержання сполуки 3 (R1=CH2Ph, R2=Cl, R3=R4=R5=R6=X=Y=H) а) 9-(фенілметил)-9H-карбазол Карбазол (5г; 0,03 моль), піддавали реакції з бензилбромідом (7,11мл; 0,06 моль) за способом, аналогічним до описаного в прикладі 1а). Твердий продукт, отриманий після фільтрації (8г) промивали гексаном, отримуючи 7,2г бажаного продукту. 1 Н ЯМР (300МГц, ДМСО-d6) част, на млн. 5,66 (s, 2 Η), 7,13 - 7,47 (m, 9 Η), 7,62 (d, J = 8,2 Гц, 2 Η), 8,18 (d, J = 7,6 Гц, 2 Η). б) 3-нітро-9-(фенілметил)-9H-карбазол 1 13 93378 Продукт, отриманий як описано на стадії а) вище (6,7г; 0,026 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 16). Твердий продукт, отриманий після фільтрації (7г) очищали за допомогою флеш-хроматографії, елююючи сумішшю 95/5 гексан/етилацетат, й отримували 2,5г бажаного продукту. 1 Н ЯМР (300МГц, ДМСО-d6) част, на млн. 5,78 (s, 2 Η), 7,15 - 7,39 (m, 6 Η), 7,52 -7,60 (m, 1 Η), 7,75 (d, J = 8,5 Гц, 1 Η), 7,85 (d, J = 9,1 Гц, 1 Η), 8,34 (dd, J = 9,1, 2,3 Гц, 1 Η), 8,45 (d, J = 7,3 Гц, 1 Η), 9,22 (d, J = 2,3 Гц, 1 Η). в) 9-(фенілметил)-9H-карбазол-3-амін Продукт, отриманий як описано на стадії б) вище (1г; 0,003 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 1в). Продукт, отриманий таким способом (1г), використовували без додаткового очищення. 1 Н ЯМР (300МГц, ДМСО-d6) част, на млн. 4,75 (br, s, 2 Η), 5,52 (s, 2 Η), 6,79 (dd, J = 8,6, 2,2 Гц, 1 Η), 7,05 - 7,36 (m, 9 Η), 7,48 (d, J = 8,5 Гц, 1 Η), 7,95 (d, J = 7,3 Гц, 1 Η). г) 2-хлор-N-[9-(фенілметил)-9H-карбазол-3іл]бензамід Продукт, отриманий як описано на стадії в) вище (0,9г; 0,003 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 1г). Продукт, отриманий таким способом (1,5г), кристалізували з етилацетату. 2-Хлор-N-[9-(фенілметил)-9H-карбазол-3іл)бензамід (550мг) отримували таким способом. 1 Н ЯМР (300МГц, ДМСО-d6) част, на млн. 5,66 (s, 2 Η), 7,11 - 7,31 (m, 6 Η), 7,39 - 7,68 (m, 8 Η), 8,12 (d, J = 7,6 Гц, 1 Η), 8,59 (d,J = 1,4 Гц, 1 Η), 10,48 (br.s, 1 Η). Приклад 4 Одержання сполуки 4 (R1=CH3CH2, R2=CF3, R3=R4=R5=R6=X=Y=H) а) N-(9-етил-9H-карбазол-3-іл)-2(трифторметил)бензамід До розчину З-аміно-9-етилкарбазолу (4г; 0,019 моль) в дихлорметані (30мл) додавали триетиламін (2,9мл; 0,021 моль) та 2(трифторметил)бензоїл хлорид (3,1мл; 0,021 моль). Суміш, отриману таким способом, перемішували протягом 16 годин. Реакційну суміш переносили в ділильну лійку та промивали Н2О (250мл). Органічну фазу відділяли та висушували над Na2SO4, розчинник видаляли шляхом упарювання при зниженому тиску та осад, отриманий таким способом (4г), кристалізували з етанолу. N-(9-Етил-9H-карбазол-3-іл)-2(трифторметил)бензамід (3,5г) отримували таким способом. tпл.: 206-207°С Елементарний аналіз для C22H17F3N2O Знайдено % Розраховано % С 68,87 69,01 Η 4,26 4,48 Ν 7,30 7,33 Н ЯМР (300МГц, ДМСО-d6) част, на млн. 1,32 (t, J = 7,1 Гц, 3 Η), 4,44 (q, J = 7,1 Гц, 2 Η), 7,16 1 14 - 7,23 (m, 1 Η), 7,42 - 7,50 (m, 1 Η), 7,55 -7,90 (m, 7 Η), 8,09 (d, J = 7,7 Гц, 1 Η), 8,51 (d, J = 1,2 Гц, 1 Η), 10,53 (br, s, 1 Η). Приклад 5 Одержання сполуки 5 (R1=CH3CH2, R2=R6=CH3, R3=R4=R5=X=Y=H) а) 2,6-Диметилбензоїл хлорид До суміші 2,6-диметилбензойної кислоти (3г; 0,02 моль) в толуолі (50мл) додавали тіонілхлорид (3,6мл; 0,05 моль). Суміш, отриману таким способом, нагрівали в колбі зі зворотним холодильником протягом 2 годин. Потім розчинник та надлишок тіонілхлориду упарювали при зниженому тиску. Осад, отриманий таким способом, ресуспендували в толуолі (50мл) три рази та упарювали при зниженому тиску. Продукт, отриманий таким способом (3,6г), використовували без додаткового очищення. б) N-(9-етил-9H-карбазол-3-іл)-2,6диметилбензамід Продукт, отриманий як описано на стадії а) вище (3,3г; 0,020 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 4. Отриманий продукт (2,4г) кристалізували з ізопропанолу. N-(9-Етил-9H-карбазол-3-іл)-2,6диметилбензамід (1,4г) отримували таким способом. tпл.: 192-193°С Елементарний аналіз для C23H22N2O Знайдено % Розраховано % С 80,57 80,67 Η 6,48 6,48 Ν 8,16 8,18 Н ЯМР (300МГц, ДМСО-d6) част, на млн. 1,31 (t, J = 7,1 Гц, 3 Н), 2,34 (s, 6 Η), 4,43 (q, J = 7,1 Гц, 2 Η), 7,08 - 7,27 (m, 4 Η), 7,41 - 7,49 (m, 1 Η), 7,54 - 7,62 (m, 2 Η), 7,68 (dd, J = 8,8, 1,8 Гц, 1 Η), 8,10 (d, J = 7,6 Гц, 1 Η), 8,59 (d, J = 1,8 Гц, 1 Η), 10,34 (br, s, 1 Η). Приклади 6-9 Одержання сполук 6-9 Суспензію, яка містить 9-етил-3-амінокарбазол (0,1г; 0,48 ммоль) та підходящу бензойну кислоту (0,70 ммоль), де R2, R3, R4, R5 та R6 мають значення, вказані в таблиці 1, в дихлорметані (4мл) та ДМФА (0,8мл), перемішували протягом 10 хвилин. Полістирол-дивінілбенозол карбодіімідний полімер (PS-карбодіімід) (0,73г; 0,9 ммоль) додавали до реакційної суміші, отриманої таким способом, в інертній атмосфері. Після цього суспензію перемішували протягом 16 годин. Реакційну суміш фільтрували та отриманий твердий продукт промивали дихлорметаном. Після цього розчин обробляли полімером Amberlyst 15 (200мг; 0,8 ммоль) та полімером Amberlyst A21 (250 мг; 1 ммоль) та перемішували протягом 2 годин. Полімери відділяли шляхом фільтрації та промивали дихлорметаном (25мл) та органічний розчинник упарювали при зниженому тиску, отримуючи бажаний продукт. 1 15 № сполуки 6 7 8 9 MM 400,38 400,38 423,31 413,31 93378 Вихід (мг) РХ/МС (М+Н)+ 51 401,3 129 401,3 80 423,2 18 413,1 Приклад 10 Одержання сполуки 10 (R1=PhCH2, R2=NH2, X=R3=R4=R5=R6=Y=H) а) 2-[(третбутоксикарбоніл)аміно]бензойна кислота Суміш антранілової кислоти (6,8г; 0,050 моль), дитретбутил дикарбонату (16,4мл; 0,071 моль), 0,5 н. NaOH (100мл), діоксану (50мл) та ацетонітрилу (10мл) витримували при перемішуванні при кімнатній температурі протягом 16 годин. Розчинник видаляли шляхом упарювання при зниженому тиску та осад обробляли сумішшю 100г льоду та 100мл 10% водного розчину лимонної кислоти. Розчин екстрагували етилацетатом (3100мл). Об'єднані органічні фази промивали насиченим розчином NaCl (50мл) та потім висушували на Na2SO4. Після фільтрації розчинник видаляли шляхом упарювання при зниженому тиску. Залишок, отриманий таким способом, кристалізували з суміші гексан:етилацетат = 3:1, отримуючи вказаний в заголовку продукт (4,9г). 1Н ЯМР (300МГц, ДМСО-d6) част, на млн. 1,49 (s, 9 Η), 7,07 (td, J = 7,80, 7,50, 1,20 Гц, 1 Η), 7,57 (td, J = 8,53, 7,22, 1,82 Гц, 1 Η), 7,96 (dd, J = 7,97, 1,72 Гц, 1 Η), 8,28 (dd, J = 8,58, 0,91 Гц, 1 Η), 10,51 (s, 1 Η), 13,55 (br.s., 1 Η). б) 2-аміно-N-(9-бензил-9Н-карбазол-3іл)бензамід гідрохлорид 4-диметиламінопіридин (0,31г, 0,0025 моль) та 9-(фенілметил)-9H-карбазол-3-амін, отриманий, як описано в прикладі 3в) (0,626г, 0,0023 моль), додавали до розчину продукту, отриманого на попередній стадії а) (0,496г, 0,0021 моль) в дихлорметані (5мл). Суміш перемішували при кімнатній температурі протягом 5 хвилин, додавали Ν.Νдициклогексилкарбодіімід (0,475г, 0,0023 моль) та витримували при перемішуванні при кімнатній температурі протягом 2 днів. Після цього суміш розводили дихлорметаном (15мл) та фільтрували через шар силікагелю. Розчин промивали 10% водним розчином лимонної кислоти (310мл), водою (210мл) та насиченим розчином NaCl (10мл), відповідно. Органічну фазу висушували на Na2SO4 та розчинник видаляли при зниженому тиску. Продукт, отриманий таким способом (1,3г), очищали за допомогою флеш-хроматографії, елююючи сумішшю гексан:етилацетат = 7:3, та потім кристалізували з суміші гексан:етилацетат = 95:5. Продукт, отриманий таким способом (350мг, 0,712 ммоль), розчиняли в етилацетаті (50мл) та обробляли розчином НСl в етанолі 3М (26мл). Розчинник видаляли шляхом упарювання при зниженому тиску та осад кристалізували з суміш абсолютний етанол:етилацетат = 1:1. 2-аміно-N-(9 16 бензил-9Н-карбазол-3-іл)бензамід гідрохлорид (0,2г) отримували таким способом. 1Н ЯМР (300МГц, ДМСО-d6) част, на млн. 5,66 (s, 2 Η), 7,01 (t, J = 7,51 Гц, 1 Η), 7,08 - 7,50 (m, 12 Η), 7,62 (d, J = 8,59 Гц, 2 Η), 7,70 (dd, J = 8,82, 1,80 Гц, 1 Η), 7,84 (dd, J = 7,76, 0,99 Гц, 1 Η), 8,10 (d, J = 7,60 Гц, 1 Η), 8,56 (d, J = 1,65 Гц, 1 Η), 10,34 (br. s., 1 Η). Приклад 11 Одержання сполуки 11 (R1=CH3CH2, R2=N(CH3)2, R3=R4=R5=R6=X=Y=H) а) 2-диметиламіно-N-(9-етил-9Н-карбазол-3іл)бензамід гідрохлорид З-аміно-9-етилкарбазол (0,484г, 0,0023 моль), піддавали реакції з N-диметил антраніловою кислотою (0,347г, 0,0021 моль) за способом, аналогічним до описаного в прикладі 106. Продукт, отриманий таким способом (0,9г) очищали за допомогою флеш-хроматографії, елююючи сумішшю гексан:етилацетат = 8:2. Після цього, його розчиняли в етанолі, обробляли розчином НСl в 3Μ етанолі (2,0мл) та витримували при кімнатній температурі протягом 3 годин. Потім розчинник видаляли при зниженому тиску та залишок кристалізували з суміші ізопропіловий спирт:простий ізопропіловий ефір =1:3. 2-диметиламіно-N-(9-етил-9H-карбазол-3іл)бензамід гідрохлорид (0,25г) отримували таким способом. 1Н ЯМР (300МГц, ДМСО-d6+D2O) част, на млн. 1,29-1,38 (m, J = 7,01, 7,01 Гц, 3 Η), 3,21 (s, 6 Η), 4,45 (q, J = 7,16 Гц, 2 Η), 7,24 (td, J = 7,86, 7,05, 0,88 Гц, 1 Η), 7,50 (td, J = 8,26, 7,09, 1,17 Гц, 1 Η), 7,56 - 7,69 (m, 3 Η), 7,73 - 7,83 (m, 2 Η), 7,91 (d, J = 8,00 Гц, 1 Η), 8,09 - 8,16 (m, 2Η), 8,56 (d, J = 1,75 Гц, 1 Η). Приклад 12 Одержання сполуки 12 (R1=CH3(CH2)4, R2=Cl, R3=R4=R5=R6=X=Y=H) а) 9-пентил-9H-карбазол Карбазол (5г, 0,030 моль), піддавали реакції з 1-бромпентаном (7,5мл, 0,06 моль) за способом, аналогічним до описаного в прикладі 1а). Твердий продукт, отриманий після холодної фільтрації (8г), очищали шляхом фільтрації через шар силікагелю, елююючи сумішшю гексан:етилацетат = 8:2. Таким способом отримували бажаний продукт (6г). 1Н ЯМР (300МГц, ХЛОРОФОРМ-d) част, на млн. 0,82 - 0,94 (m, J = 7,00, 7,00 Гц, 3 Η), 1,28 1,44 (m, 4 Η), 1,79 - 1,94 (m, 2 Η), 4,28 (t, J = 7,23 Гц, 2 Η), 7,21 (td, J = 7,86, 6,76, 1,32 Гц, 2 Η), 7,36 7,49 (m, 4 Η), 8,09 (d, J = 7,75 Гц, 2 Η). б) 3-нітро-9-пентил-9H-карбазол Продукт, отриманий, як описано на попередній стадії а) (1г, 0,0042 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 1б). Продукт, отриманий таким способом (0,9г) очищали за допомогою флеш-хроматографії, елююючи сумішшю гексан:етилацетат = 10:1 та отриманий продукт (0,54г) використовували без додаткового очищення. 17 1Н ЯМР (300МГц, ДМСО-d6) част, на млн. 0,75 - 0,85 (m, J = 7,00, 7,00 Гц. 3 Η), 1,19 -1,37 (m, 4 Η), 1,70 - 1,86 (m, 2 Η), 4,47 (t, J = 7,10 Гц, 2 Η), 7,33 (td, J = 7,90, 7,00, 0,80 Гц, 1 Η), 7,58 (td, J = 7,68, 1,16 Гц, 1 Η), 7,72 (d, J = 8,42 Гц, 1 Η), 7,78 (d, J = 9,08 Гц, 1 Η), 8,33 (dd, J = 9,17, 2,39 Гц, 1 Η), 8,40 (d, J = 7,76 Гц, 1 Η), 9,17 (d, J = 2,31 Гц, 1 Η). в) 9-пентил-9H-карбазол-3-амін Продукт, отриманий, як описано на попередній стадії б) (2,6г, 0,0092 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 1в). Продукт, отриманий таким способом (2г), очищали шляхом кристалізації з гексану, отримуючи бажаний продукт (1,3г). ГХ/МС (m/z): 252 (молекулярний іон), 195 (основний пік) г) 2-хлор-N-(9-пентил-9H-карбазол-3іл)бензамід Продукт, отриманий, як описано на попередній стадії в) (0,6г, 0,0024 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 1г). Продукт, отриманий таким способом (0,9г) очищали шляхом кристалізації з суміші гексан:етилацетат = 4:1. 2-Хлор-N-(9-пентил-9Hкарбазол-3-іл)бензамід (0,3г) отримували таким способом. 1Н ЯМР (300МГц, ДМСО-d6) част, на млн. 0,81 (t, J = 7,00 Гц, 3 Η), 1,21 - 1,36 (m, 4 Η), 1,71 1,86 (m, 2 Η), 4,38 (t, J = 6,97 Гц, 2 Η), 7,19 (td, J = 7,90, 7,00, 0,80 Гц, 1 Η), 7,41 - 7,71 (m, 8 Η), 8,09 (d, J = 7,49 Гц, 1 Η), 8,56 (d, J = 1,74 Гц, 1 Η), 10,47 (s, 1 Η). Приклад 13 Одержання сполуки 13 (R1=CH3OCH2CH2, R2=Cl, R3=R4=R5=R6=X=Y=H) а) 9-(2-метоксіетил)-9Н-карбазол Карбонат цезію (19,5г, 0,06 моль) додавали до розчину карбазолу (5г, 0,030 моль) в ДМФА (100мл) та суміш витримували при перемішуванні протягом 1 години при кімнатній температурі. Додавали 2-брометилметиловий простий ефір (5,6мл, 0,06 моль) та суміш витримували при перемішуванні при 90°С протягом 5 годин. Після цього реакційну суміш вливали в воду (300мл) та перемішували при кімнатній температурі протягом 2 годин. Тверду речовину (4,8г) фільтрували та використовували без будь-якого додаткового очищення. 1Н ЯМР (300МГц, ДМСО-d6) част, на млн. 3,18 (s, 3 Η), 3,71 (t, J = 5,41 Гц, 2 Η), 4,55 (t, J = 5,41 Гц, 2 Η), 7,19 (td, J = 7,80, 7,10, 1,00 Гц, 2 Η), 7,44 (td, J = 8,26, 7,09, 1,17 Гц, 2 Η), 7,60 (d, J = 8,18 Гц, 2 Η), 8,14 (dt, J = 7,75, 0,90 Гц, 2 Η). б) 3-нітро-9-(2-метоксіетил)-9Н-карбазол Продукт, отриманий, як описано на попередній стадії а) (6г, 0,027 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 16). Продукт, отриманий таким способом (7,2г) очищали шляхом кристалізації з толуолу, отримуючи бажаний продукт (4,5г). 1Н ЯМР (300МГц, ДМСО-d6) част, на млн. 3,16 (s, 3 Η), 3,74 (t, J = 5,19 Гц, 2 Η), 4,66 (t, J = 93378 18 5,19 Гц, 2 Η), 7,33 (ddd, J = 8,00, 7,00, 0,88 Гц, 1 Η), 7,57 (ddd, J = 8,25, 7,20, 1,17 Гц, 1 Η), 7,74 (dt, J = 8,18, 0,88 Гц, 1 Η), 7,79 (d, J = 9,06 Гц, 1 Η), 8,33 (dd, J = 9,21, 2,34 Гц, 1 Η), 8,40 (dt, J = 7,75, 0,88 Гц, 1 Η), 9,16 (d, J = 2,34 Гц, 1 Η). в) 9-(2-метоксіетил)-9H-карбазол-3-амін Продукт, отриманий, як описано на попередній стадії б) (3г, 0,011 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 1в). Продукт, отриманий таким способом (2,7г), кристалізували з суміш гексан:етилацетат = 2:1, отримуючи бажаний продукт (1,1г). 1Н ЯМР (300МГц, ДМСО-d6) част, на млн. 3,18 (s, 3 Η), 3,66 (t, J = 5,55 Гц, 2 Η), 4,42 (t, J = 5,48 Гц, 2 Η), 4,70 (s, 2 Η), 6,81 (dd, J = 8,48, 2,19 Гц, 1 Η), 7,06 (ddd, J = 7,80, 7,00, 0,88 Гц, 1 Η), 7,26 (d, J = 1,90 Гц, 1 Η), 7,29 (d, J = 8,48 Гц, 1 Η), 7,32 (ddd, J = 8,25, 7,00, 1,25 Гц, 1 Η), 7,46 (dt, J = 8,25, 0,88 Гц, 1 Η), 7,91 (dt, J = 7,60, 0,88 Гц, 1 Η). г) 2-хлор-N-[9-(2-метоксіетил)-9H-карбазол-3іл]бензамід Продукт, отриманий, як описано на попередній стадії в) (0,58г, 0,0024 моль), піддавали реакції з 2хлорбензоїл хлоридом (0,36мл, 0,0028 моль) за способом, аналогічним до описаного в прикладі 1г). Продукт, отриманий таким способом (0,9г) кристалізували з суміш гексан:етилацетат = 2:1. Таким способом отримували 2-хлор-N-[9-(2метоксіетил)-9H-карбазол-3-іл]бензамід (0,5г). 1Н ЯМР (300МГц, ДМСО-d6) част, на млн. 3,18 (s, 3 Η), 3,72 (t, J = 5,28 Гц, 2 Η), 4,55 (t, J = 5,37 Гц, 2 Η), 7,19 (ddd, J = 7,90, 7,00, 0,88 Гц, 1 Η), 7,39 - 7,69 (m, 8 Η), 8,08 (d, J = 7,76 Гц, 1 Η), 8,54 (d, J = 1,82 Гц, 1 Η), 10,47 (s, 1 Η). Приклад 14 Одержання сполуки 14 (R1=НООС(СН2)3, R2=СІ, R3=R4=R5=R6=X=Y=H) а) 4-(9H-карбазол-9-іл)бутаннітрил Карбазол (10г, 0,060 моль), піддавали реакції з 4-бромбутиронітрилом (11,9мл, 0,12 моль) за способом, аналогічним до описаного в прикладі 1а). Твердий продукт, отриманий після холодної фільтрації (18г) очищали за допомогою флешхроматографії, елююючи сумішшю гексан:етилацетат = 8:2. Таким способом отримували бажаний продукт (10г). 1Н ЯМР (300МГц, ДМСО-d6) част, на млн. 2,03 - 2,15 (m, J = 7,23, 7,23, 7,23, 7,23 Гц, 2 Η), 2,55 (t, J = 7,23 Гц, 2 Η), 4,46 (t, J = 7,16 Гц, 2 Η), 7,21 (td, J = 7,86, 7,05, 1,02 Гц, 2 Η), 7,47 (td, J = 8,26, 7,09,1,32 Гц, 2 Η), 7,62 (dt, J = 8,22, 0,79 Гц, 2 Η), 8,16 (dq, J = 7,75, 0,73, 0,58 Гц, 2 Η). б) 4-(3-нітро-9Н-карбазол-9-іл)бутаннітрил Продукт, отриманий, як описано на попередній стадії а) (5г, 0,0213 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 1б). Продукт, отриманий таким способом (5,2г) кристалізували з 95° етанолу, отримуючи бажаний продукт (4,8г). ГХ/МС (m/z): 279 (молекулярний іон), 225 (основний пік) в) 4-(3-аміно-9Н-карбазол-9-іл)бутаннітрил 19 Продукт, отриманий, як описано на попередній стадії б) (2,3г, 0,0082 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 1в). Продукт, отриманий таким способом (2,3г), очищали за допомогою флеш-хроматографії, елююючи сумішшю гексан:етилацетат = 4:6. Таким способом отримували бажаний продукт (1,4г). 1Н ЯМР (300МГц, ДМСО-d6) част, на млн. 1,95-2,12 (m, J = 7,20, 7,20, 7,20, 7,20 Гц, 2 Η), 2,50 (t, J = 7,20 Гц, 2 Η), 4,33 (t, J = 7,16 Гц, 2 Η), 4,74 (s, 2 Η), 6,84 (dd, J = 8,62, 2,19 Гц, 1 Η), 7,09 (td, J = 7,90, 7,00, 1,00 Гц, 1 Η), 7,28 (d, J = 1,90 Гц, 1 Η), 7,31 (d, J = 8,62 Гц, 1 Η), 7,36 (td, J = 8,22, 7,05, 1,24 Гц, 1 Η), 7,48 (d, J = 8,30 Гц, 1 Η), 7,94 (d, J = 7,45 Гц, 1 Η). г) 4-(3-аміно-9Н-карбазол-9-іл)масляна кислота Продукт, отриманий, як описано на попередній стадії в) (0,7г, 2,81 ммоль), піддавали реакції в воді (5мл) з 95% сірчаною кислотою (2,8мл, 50 ммоль) в колбі зі зворотним холодильником протягом однієї ночі. Потім реакційну суміш охолоджували, виливали в лід (50г) та твердий продукт збирали шляхом фільтрації. Таким способом отримували бажаний продукт (0,83г), який використовували в наступній реакції без будь-якого додаткового очищення. д) 4-{[3-(2-хлорбензамідо)1-9Н-карбазол-9іл}масляна кислота Продукт, отриманий, як описано на попередній стадії г) (0,3г, 1,19 ммоль), піддавали реакції з 2хлорбензоїл хлоридом (0,171мл, 1,35 ммоль) за способом, аналогічним до описаного в прикладі 1г). Реакційну суміш промивали 1 н. НСl (36мл). Органічні фази відділяли. Розчинник видаляли з об'єднаних органічних фаз при зниженому тиску. Таким способом отримували 4-{[3-(2хлорбензамідо)]-9Н-карбазол-9-іл}масляну кислоту (0,15г). 1Н ЯМР (300МГц, ДМСО-d6) 5 част, на млн. 1,92 - 2,07 (m, J = 7,00, 7,00, 7,00, 7,00 Гц, 2 Η), 2,27 (t, J = 7,00 Гц, 2 Η), 4,41 (t, J = 7,14 Гц, 1 Η), 7,20 (td, J = 7,80, 7,00, 0,80 Гц, 1 Η), 7,37 - 7,80 (m, 9 Η), 8,10 (d, J = 7,50 Гц, 1 Η), 8,57 (d, J = 1,83 Гц, 1 Η), 10,48 (s, 2 Η). Приклад 15 Одержання сполуки 15 (R1=СН3СН2, R2=Cl, X=Y=СН3, R3=R4=R5=R6=H) а) 6-бром-9-етил-1,4-диметил-3-нітро-9Hкарбазол 6-бром-1,4-диметил-3-нітро-9H-карбазол (отриманий, як описано в Chem. Pharm. Bull 35(1), 425-428 (1987), (4,8г, 0,015 моль), піддавали реакції з йодетаном за способом, аналогічним до описаного в прикладі 1а). Твердий продукт, отриманий після фільтрації (5,1г), використовували без будь-якого додаткового очищення. 1Н ЯМР (300МГц, ДМСО-d6) част, на млн. 1,34 (t, J = 7,02 Гц, 3 Η), 2,83 (s, 3 Η), 2,93 (s, 3 Η), 4,67 (q, J = 7,21 Гц, 2 Η), 7,71 (dd, J = 8,70, 1,70 Гц, 93378 20 1 Η), 7,77 (d, J = 8,50 Гц, 1 Η), 7,88 (s, 1 Η), 8,38 (d, J = 1,75 Гц, 1 Η). б) 6-бром-9-етил-1,4-диметил-3-аміно-9Hкарбазол Продукт, отриманий, як описано на попередній стадії а) (5г, 0,014 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 1в). Твердий продукт, отриманий після фільтрації (5,1г), використовували без будь-якого додаткового очищення. ГХ/МС (m/z): 316, 318 (молекулярний іон, основний пік) в) 9-етил-1,4-диметил-3-аміно-9H-карбазол Розчин продукту, отриманого на попередній стадії б) (2г, 0,006 моль) в ТГФ (25мл) додавали до суспензії LiAIH4 (0,95г, 0,025 моль) в безводному ТГФ (25мл). Суспензію нагрівали в колбі зі зворотним холодильником протягом 24 годин. Після цього суспензію залишали охолоджуватися до кімнатної температури додавали до суміші Н2О та ТГФ 1:1 тa NaOH (1,9г). ТГФ видаляли шляхом упарювання при зниженому тиску та водний залишок поміщали в ділильну лійку та екстрагували етилацетатом (250мл). Органічну фазу відділяли та висушували на Na2SО4. Розчинник видаляли шляхом упарювання при зниженому тиску та залишок, отриманий таким способом (1,3г), використовували без будьякого додаткового очищення. ГХ/МС (m/z): 238 (молекулярний іон), 209 (основний пік). г) 2-хлор-N-(9-етил-1,4-диметил-9H-карбазол3-іл)бензамід Продукт, отриманий, як описано на попередній стадії в) (1,2г, 0,005 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 1г). Продукт, отриманий таким способом (2г) очищали за допомогою флеш-хроматографії, елююючи сумішшю гексан:етилацетат = 8:2 та потім кристалізували з суміші хлороформ:гексан = 1:1. Таким способом отримували 2-хлор-N-(9-етил1,4-диметил-9H-карбазол-3-іл)бензамід (0,2г). 1Н ЯМР (300МГц, ДМСО-d6) част, на млн. 1,32 (t, J = 7,00 Гц, 3 Η), 2,72 (s,3 H), 2,79 (s, 3 Η), 4,65 (q, J = 6,94 Гц, 2 Η), 7,17 (s, 1 Η), 7,22 (td, J = 8,00, 7,00, 0,80 Гц, 1 Η), 7,42 -7,70 (m, 6 Η), 8,21 (d, J = 7,93 Гц, 1 Η), 10,03 (s, 1 Η). Приклад 16 Одержання сполуки 16 (R1=CH3CH2, R2=СІ, Х=CH3, R3=R4=R5=R6=Y=H) а) 9-етил-9H-карбазол Карбазол (4г, 0,024 моль), піддавали реакції з йодетаном за способом, аналогічним до описаного в прикладі 1а). Твердий продукт, отриманий після фільтрації (4,4г) використовували без будь-якого додаткового очищення. 1Н ЯМР (300МГц, ДМСО-d6) част, на млн. 1,31 (t, J = 7,16 Гц, 3 Η), 4,44 (q, J = 7,02 Гц, 2 Η), 7,16 - 7,23 (m, J = 7,90, 7,00, 1,00 Гц, 2 Η), 7,45 (td, J = 8,30, 7,00, 1,10 Гц, 2 Η), 7,60 (d, J = 8,18 Гц, 2 Η), 8,15 (d, J = 7,60 Гц, 2 Η). б) 9-етил-3-нітро-9H-карбазол 21 Продукт, отриманий, як описано на попередній стадії а) (4г, 0,0014 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 1б). Продукт, отриманий таким способом (6г) очищали за допомогою флеш-хроматографії, елююючи сумішшю гексан:етилацетат = 8:2. Таким способом отримували бажаний продукт (2,8г). 1Н ЯМР (300МГц, ДМСO-d6) част, на млн. 1,35 (t, J = 7,16 Гц, 3 Η), 4,54 (q, J = 7,31 Гц, 2 Η), 7,34 (ddd, J = 8,20, 7,40, 0,80 Гц, 1 Η), 7,59 (ddd, J = 8,20, 7,30, 1,30 Гц, 1 Η), 7,74 (dt, J = 8,18, 0,80 Гц, 1 Η), 7,80 (d, J = 9,06 Гц, 1 Η), 8,35 (dd, J = 9,06, 2,34 Гц, 1 Η), 8,41 (dt, J = 7,60, 0,80 Гц, 1 Η), 9,18 (d, J = 2,34 Гц, 1 Η). в) 9-етил-4-метил-3-нітро-9H-карбазол Продукт, отриманий, як описано на попередній стадії б) (2,8г, 0,0012 моль), розчиняли в безводному ТГФ (приблизно 100мл). Розчин доводили до -15°С в інертній атмосфері. Додавали 3М розчин CH3MgCl в ТГФ (5,7мл, 0,012 моль) та реакційну суміш витримували при перемішуванні протягом 1 години при -15°С. Після цього додавали DDQ (2,3дихлор-5,6-диціано-1,4-бензохінон) (4,5г, 0,0020 моль) та реакційній суміші дозволяли досягти кімнатної температури та витримували при перемішуванні протягом 48 годин. Реакційну суміш розводили дихлорметаном (100мл) та промивали водою (260мл). Органічну фазу відділяли та висушували на Na2SO4. Потім розчинник видаляли шляхом упарювання при зниженому тиску та залишок, отриманий таким способом, очищали за допомогою флешхроматографії, елююючи сумішшю гексан:етилацетат = 8:2. Чисті фракції об'єднували, одержуючи бажаний продукт (0,6г). 1Н ЯМР (300МГц, ДМСО-d6) част, на млн. 1,33 (t, J = 7,16 Гц, 3 Η), 3,03 (s, 3 Η), 4,53 (q, J = 7,31 Гц, 2 Η), 7,35 (ddd, J = 8,18, 7,00, 1,20 Гц, 1 Η), 7,59 (ddd, J = 8,20, 7,30, 1,20 Гц, 1 Η), 7,67 (d, J = 9,06 Гц, 1 Η), 7,77 (d, J = 8,18 Гц, 1 Η), 8,10 (d, J = 9,06 Гц, 1 Η), 8,33 (d, J = 8,18 Гц, 1 Η). г) 9-етил-4-метил-9H-карбазол-3-амін Продукт, отриманий, як описано на попередній стадії в) (0,4г, 0,0016 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 1в). Продукт, отриманий таким способом (0,5г), очищали за допомогою флеш-хроматографії, елююючи сумішшю СНСІ3. Таким способом отримували бажаний продукт (0,3г). 1Н ЯМР (300МГц, ДМСО-d6) част, на млн. 1,24 (t, J = 7,02 Гц, 3 Η), 2,57 (s, 3 Η), 4,32 (q, J = 7,02 Гц, 2 Η), 4,55 (s, 2 Η), 6,91 (d, J = 8,48 Гц, 1 Η), 7,09 (ddd, J = 8,18, 7,00, 1,00 Гц, 1 Η), 7,18 (d, J = 8,48 Гц, 1 Η), 7,35 (ddd, J = 8,00, 7,20, 1,20 Гц, 1 Η), 7,48 (d, J = 8,18 Гц, 1 Η), 8,15 (d, J = 7,89 Гц, 1 Η). г) 2-хлор-N-9-етил-4-метил-9H-карбазол-3іл)бензамід Продукт, отриманий, як описано на попередній стадії г) (0,3г, 0,0013 моль), піддавали реакції за способом, аналогічним до описаного в прикладі 1г). Продукт, отриманий таким способом (0,5г), 2 рази кристалізували з суміші гексан:етилацетат = 93378 22 1:2. Таким способом отримували 2-хлор-N-(9-етил4-метил-9H-карбазол-3-іл)бензамід (0,23г). 1Н ЯМР (300МГц, ДМСО-d6) част, на млн. 1,31 (t, J = 7,10 Гц, 3 Η), 2,77 (s, 3 Η), 4,47 (q, J = 7,05 Гц, 2 Η), 7,23 (ddd, J = 8,00, 7,00, 1,00 Гц, 1 Η), 7,39 - 7,72 (m, 8 Η), 8,23 (d, J = 7,93 Гц, 1H), 10,09 (s, 1 Η). Приклади 17 та 18 Одержання сполук 17 та 18 Сполуки 17 та 18 можуть бути отримані за допомогою способу, аналогічного до описаного в прикладах 1-16 вище. Приклад 19 Одержання порівняльної сполуки А (R1=CH3CH2, R2=OH, R3=R4=R5=R6=X=Y=H) а) N-(9-етил-9H-карбазол-3-іл)-2метоксибензамід 3-Аміно-9-етилкарбазол (5,6г; 0,027 моль), піддавали реакції з 2-метоксибензоїл хлоридом (4,35мл; 0,029 моль) за способом, аналогічним до описаного в прикладі 4. Осад, отриманий таким способом, (3,5г) кристалізували з ізопропанолу, одержуючи бажаний продукт (2,5г). 1 Н ЯМР (300МГц, ДМСО-d6) част, на млн. 1,32 (t, J = 7,1 Гц, 3 Η), 3,96 (s, 3 Η), 4,43 (q, J = 7,1 Гц, 2 Η), 7,10 (td, J = 7,4, 1,0 Гц, 1 Η), 7,15-7,24 (m, 2 Η), 7,41 - 7,48 (m, 1 Η), 7,48 - 7,55 (m, 1 Η), 7,55 - 7,61 (m, 2 Η), 7,70 - 7,79 (m, 2 Η), 8,10 (d, J = 7,6 Гц, 1 Η), 8,58 (d, J = 1,8Гц, 1Н), 10,13 (br, s, 1 H). б) Н-(9-етил-9H-карбазол-3-іл)-2гідроксибензамід До розчину, який містить трибромід бору (1М в дихлорметані, 0,2мл; 0,001 моль) в дихлорметані (10мл), додавали продукт, отриманий, як описано на стадії а) вище (0,5г; 0,001 моль). Суміш, отриману таким способом, перемішували протягом 16 годин. Реакційну суміш переносили в ділильну лійку та промивали Н2О (250мл). Органічну фазу відділяли та висушували над Na2SO4. Розчинник видаляли шляхом упарювання при зниженому тиску та осад, отриманий таким способом, (0,4г) кристалізували з етанолу. N-(9-Етил-9H-карбазол-3-іл)-2гідроксибензамід (0,25г) отримували таким способом. 1 Н ЯМР (300МГц, ДМСО-d6, 70°С), част, на млн. 1,37 (t, J = 7,1 Гц, 3 Η), 4,45 (q, J = 7,1 Гц, 2 Η), 5,55 (br, s, 1H), 6,94 - 7,02 (m, 2 H), 7,21 (t, J = 7,0 Гц, 1 Η), 7,41 - 7,77 (m, 5 Η), 8,04 - 8,15 (m, 2 Η), 8,42 - 8,48 (m, 1 Η), 10,33 (br, s, 1 H). Приклад 20 Одержання порівняльної сполуки В (R1=CH3CH2, R2=SCH3, R3=R4=R5=R6=X=Y=H) Порівняльну сполуку В отримували способом, аналогічним до описаного для сполук 6-9, використовуючи як вихідні речовини 9-етил-3амінокарбазол та 2-метилмеркаптобензойну кислоту. РХ/МС(М+Н)+=361,2. Приклад 21 Тест в умовах in vitro 23 93378 Цей тест дозволяє оцінити інгібувальну здатність на продукцію PGE2 простагландинів та селективність по відношенню до продукції PGF2 простагландинів. Використовували клітинну лінію А549, аденокарцинома легень людини, яка переважно чутлива до стимуляції прозапальними цитокінами, наприклад IL-1, та, у відповідь на цю стимуляцію, переважно активна стосовно продукції й вивільнення двох простаноїдів: PGE2 та PGF2a (Thoren S. Jakobsson P-J, 2000). Клітини стимулювали за допомогою IL-1 (1нг/мл) та одночасно обробляли тестованою сполукою впродовж 18 годин на підходящому культуральному середовищі (DMEM - середовище Ігла, модифіковане Дульбекко), доповненому 5% фетальною телячою сироваткою та L-глутаміном (кінцева концентрація 4мМ) в термостаті при 37°С та при концентрації СО2 5%. Після інкубування, досліджували утворену та вивільнену кількість PGE2 та PGF2 в супернатанті за допомогою набору ЕІА (який виробляється та продається Cayman Chemicals, Ann Arbor, MI, USA). Використовуваними порівняльними сполуками були індометацин (Sigma-Aldrich), нестероїдний протизапальний лікарський засіб, який інгібує в однаковому ступені обидва PGE2 та PGF2, а також сполуки формули (І), в якій R1=СН3СН2, R2=OH, R3=R4=R5=R6=X=Y=H (порівняльна сполука А) та R1=CH3CH2, R2=SCH3, R3=R4=R5=R6=X=Y=H (порівняльна сполука В). Результати, виражені у відсотках інгібування продукції PGE2 та PGF2 при концентрації 10мкм, показані в таблиці 2. Таблиця 2 Сполука 1 2 3 4 5 6 7 8 А В індометацин % інгібування при 10мкМ PGE2 PGF2 59 27 90 66 86 7 67 0 93 60 76 26 90 48 77 16 88 84 на на 100 100 на = не було активності при досліджуваній концентрації З ілюстративною метою, в таблиці 3 наведені pIC50 значення для певних сполук за винаходом, де pIC50 являє собою від'ємний логарифм значення ІС50, яке, в свою чергу, являє собою концентрацію сполуки, що інгібує на 50% продукцію PGE2 або PGF2 відносно клітин, які були стимульовані, але їх не обробляли тією ж сполукою. 24 Таблиця 3 ІС50 2 3 4 6 7 8 індометацин PGE2 6,1 5,9 6,2 6,4 5,7 5,4 8,3 PGF2 5
ДивитисяДодаткова інформація
Назва патенту англійською3-aminocarbazole compounds, pharmaceutical composition containing the same and method for the preparation thereof
Автори англійськоюAlisi, Maria, Alessandra, Dragone Patrizia, Furlotti Guido, Cazzolla Nicola, Russo Vincenzo, Mangano, Giorgina, Coletta, Isabella, Polenzani, Lorenzo
Назва патенту російською3-аминокарбазольное соединение, фармацевтическая композиция, которая ee содержит, и способ ee получения
Автори російськоюАлиси Мария Алессандра, Драгоне Патриция, Фурлотти Гвидо, Каццолла Никола, Pycco Винченцо, Мангано Джорджина, Колетта Изабелла, Поленцани Лоренцо
МПК / Мітки
МПК: A61P 35/00, A61K 31/403, C07D 209/88
Мітки: спосіб, фармацевтична, 3-амінокарбазольна, яка, сполука, одержання, містить, композиція
Код посилання
<a href="https://ua.patents.su/13-93378-3-aminokarbazolna-spoluka-farmacevtichna-kompoziciya-yaka-mistit-ta-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">3-амінокарбазольна сполука, фармацевтична композиція, яка її містить, та спосіб її одержання</a>
Попередній патент: Макроциклічні інгібітори вірусу гепатиту с
Наступний патент: Одношарова картонна упаковка для харчового продукту
Випадковий патент: Спосіб діагностики розвитку остеопорозу












