Пероральні склади, які містять аналоги цитидину, і способи їх використання
Номер патенту: 101370
Опубліковано: 25.03.2013
Автори: Іттер Джеффрі Б., Бекстрем Джей Томас, Лай Мей
Формула / Реферат
1. Фармацевтична композиція для перорального введення, яка містить терапевтично ефективну кількість 5-азацитидину, де композиція являє собою таблетку з негайним вивільненням, яка не покрита ентеросолюбільним покриттям, що включає центральну частину з лікарського засобу, яка містить 5-азацитидин і додатково містить покриття центральної частини лікарського засобу, причому таблетку одержують нанесенням покриття на центральну частину лікарського засобу з використанням розчинника, який включає воду або етанол.
2. Фармацевтична композиція за п. 1, яка додатково містить додатковий терапевтичний засіб.
3. Композиція за п. 1, де кількість 5-азацитидину складає щонайменше приблизно 40 мг, щонайменше приблизно 400 мг або щонайменше приблизно 1000 мг.
4. Композиція за п. 1, де кількість 5-азацитидину складає приблизно 40 мг, приблизно 400 мг або приблизно 1000 мг.
5. Композиція за п. 1, яка додатково містить ексципієнт, вибраний з маніту, мікрокристалічної целюлози, кросповідону і стеарату магнію.
6. Композиція за п. 1, яка додатково містить посилюючий проникнення засіб.
7. Композиція за п. 6, де посилюючим проникнення засобом є d-альфа-токоферил поліетиленгліколь 1000 сукцинат.
8. Композиція за п. 7, де d-альфа-токоферил поліетиленгліколь 1000 сукцинат присутній в складі в кількості приблизно 2 % по масі відносно загальної маси складу.
9. Композиція за п. 1, яка по суті не містить інгібітор цитидиндеамінази.
10. Композиція за п. 1, яка по суті не містить тетрагідроуридин.
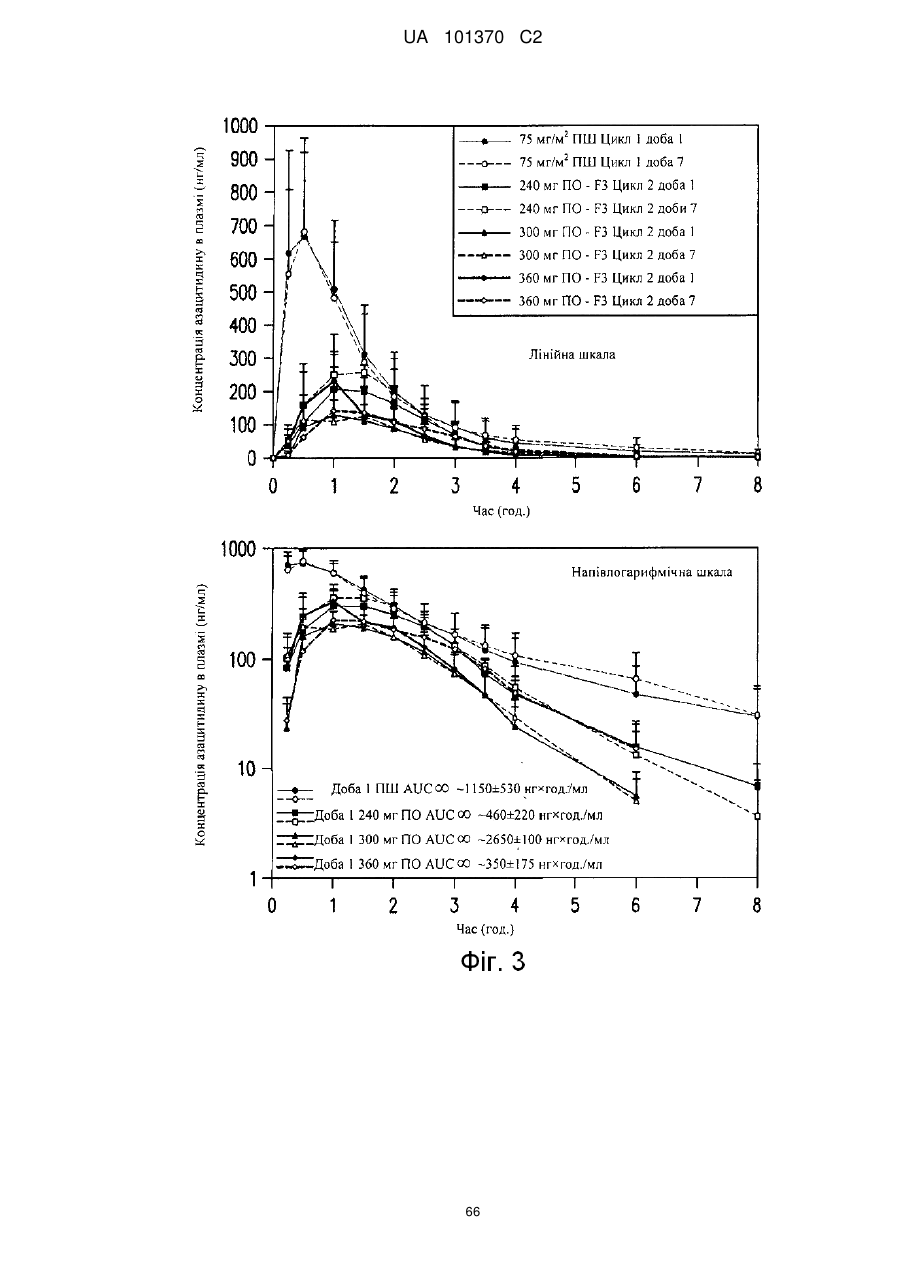
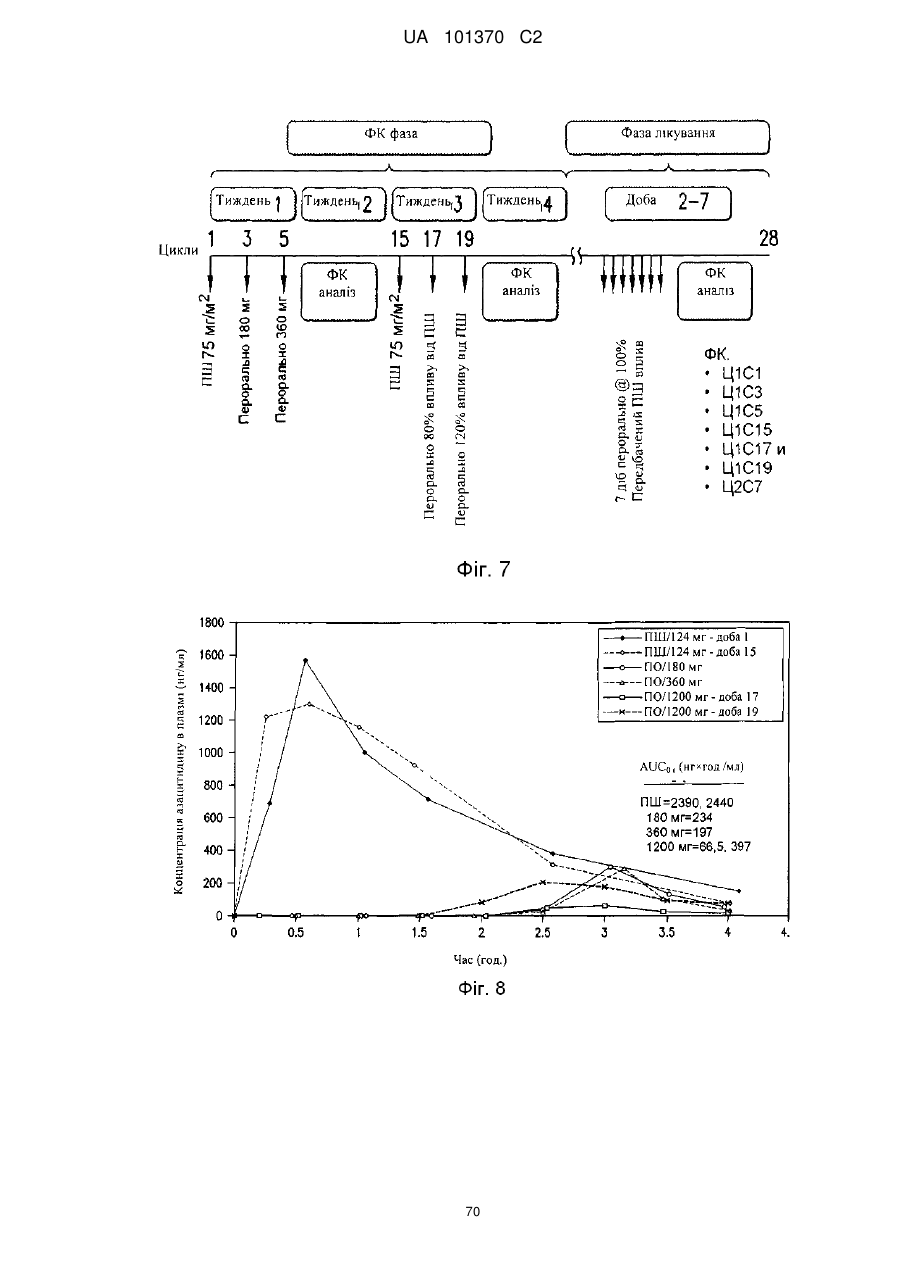
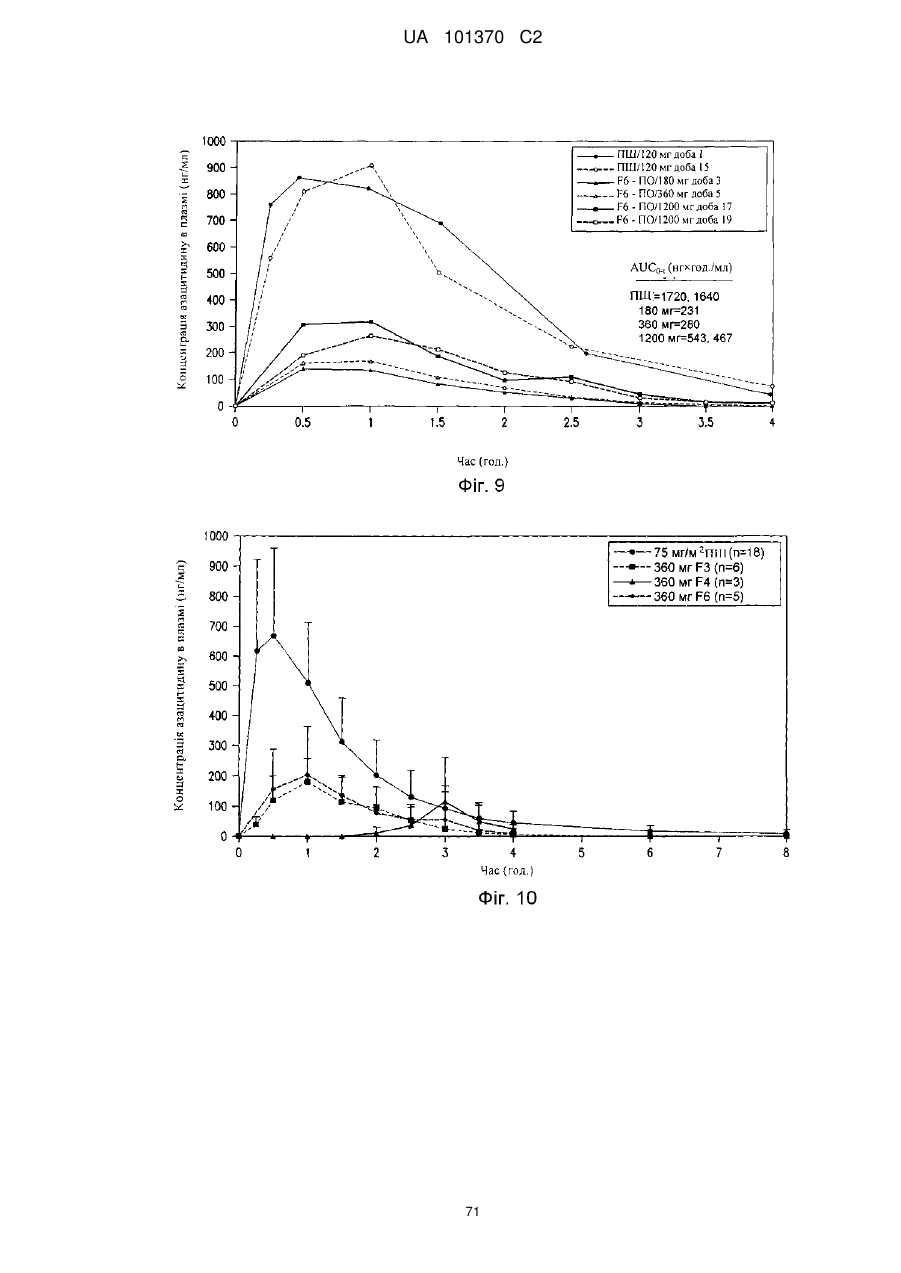
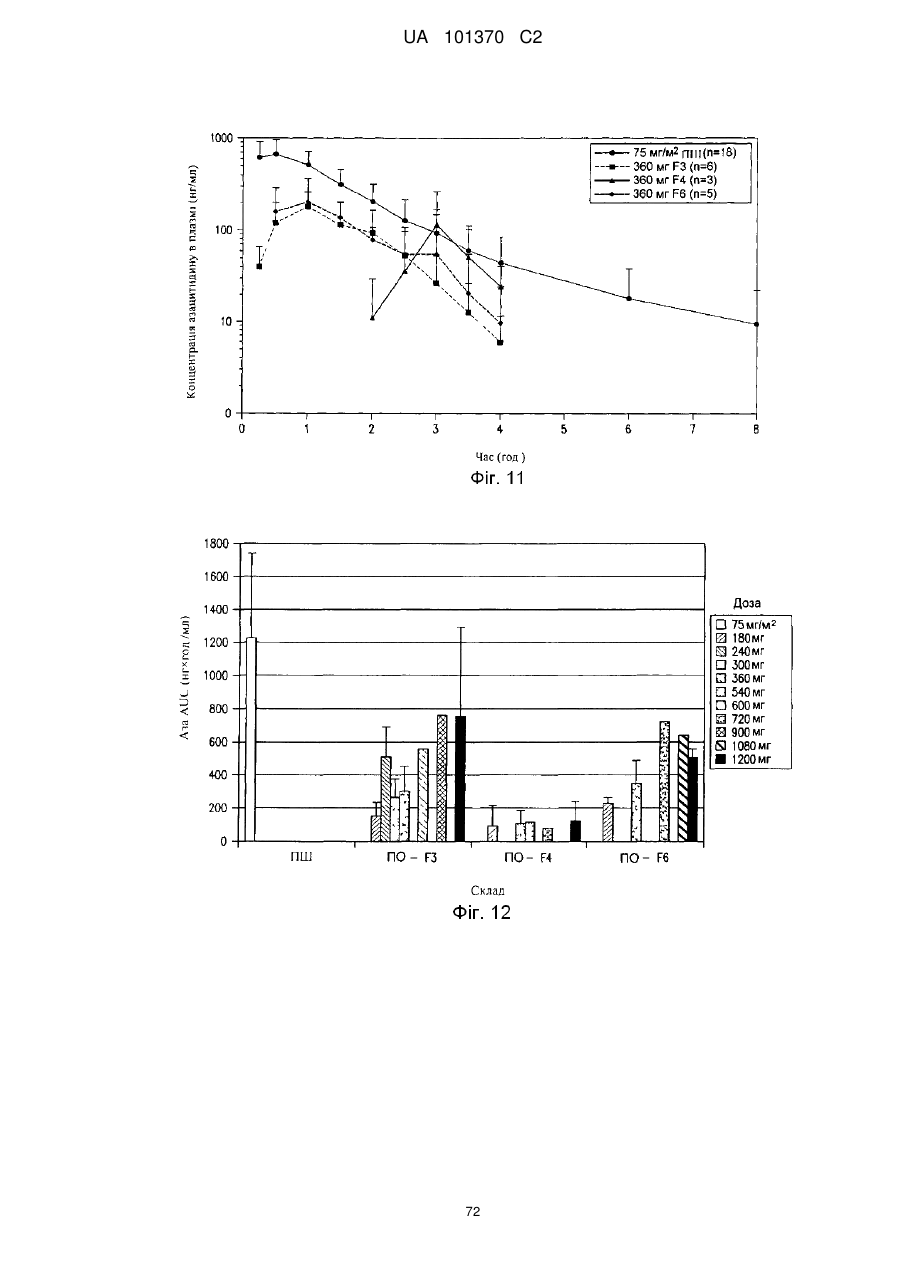
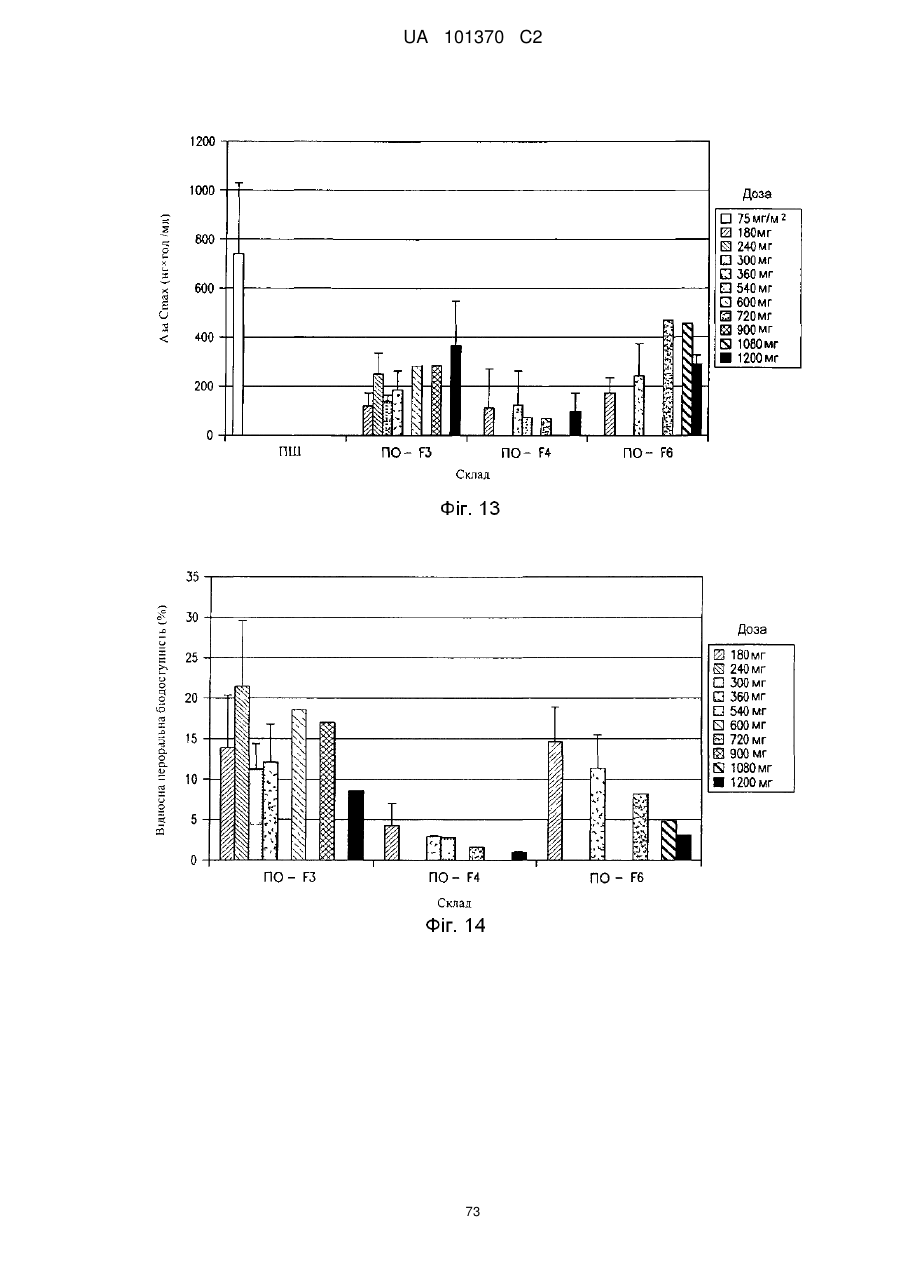
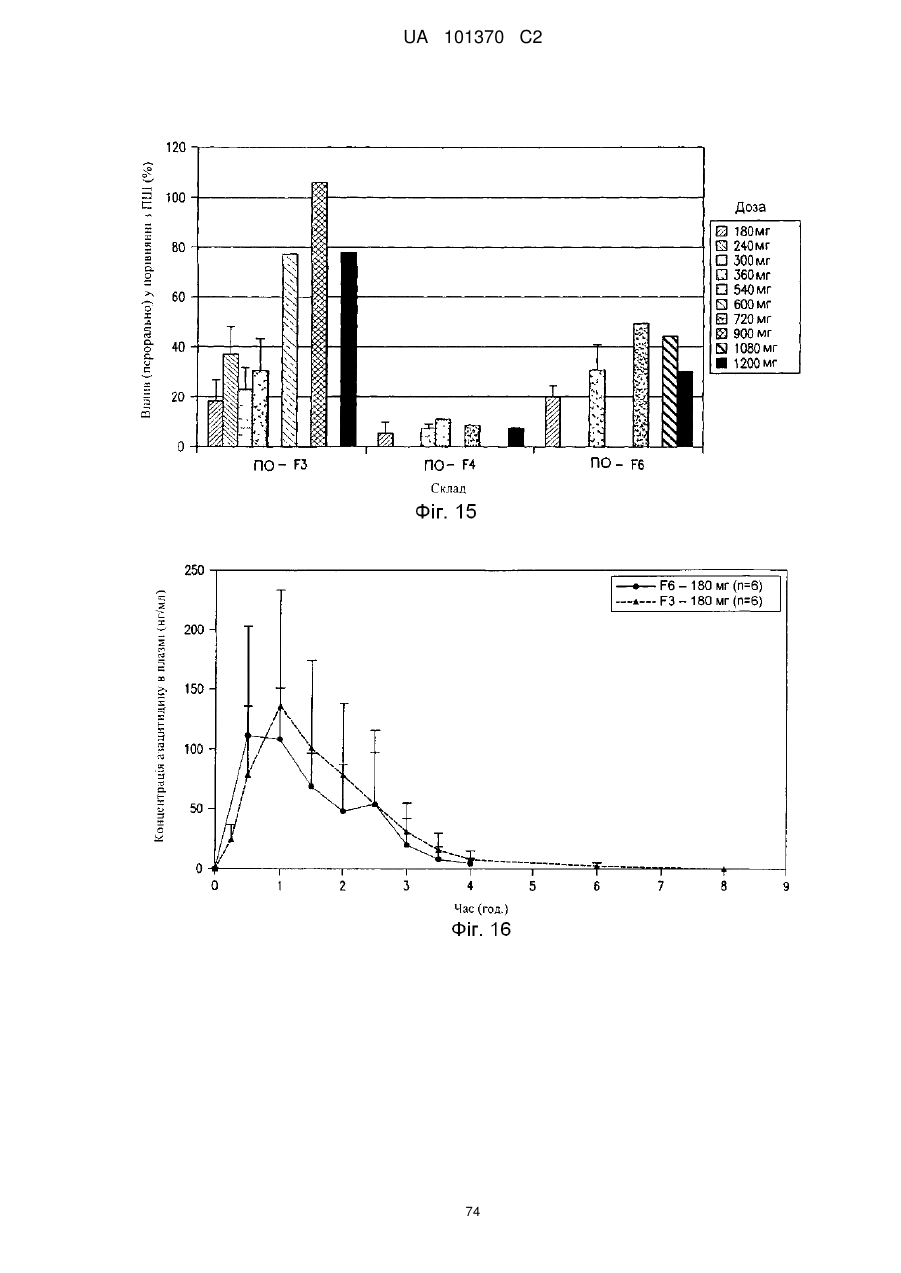
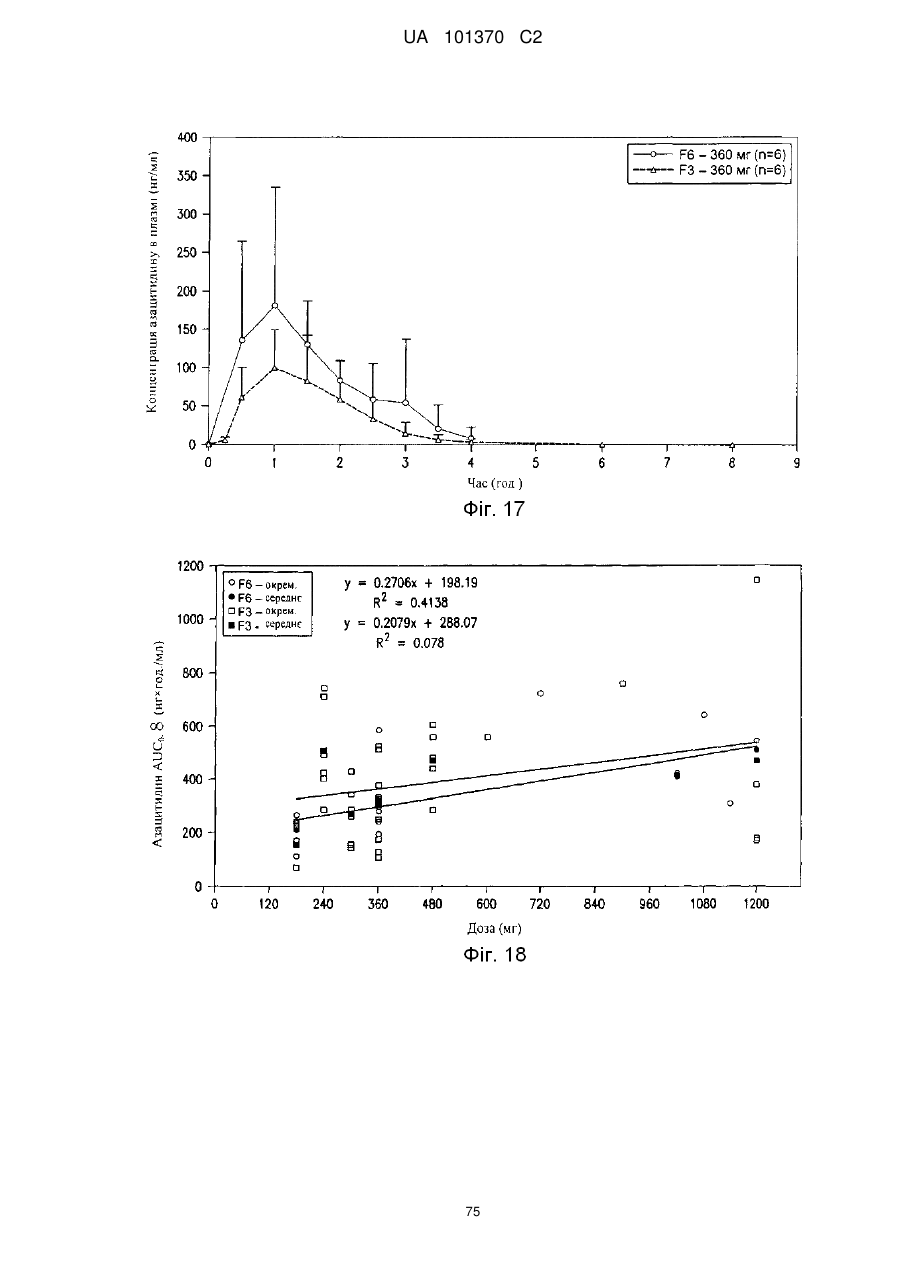
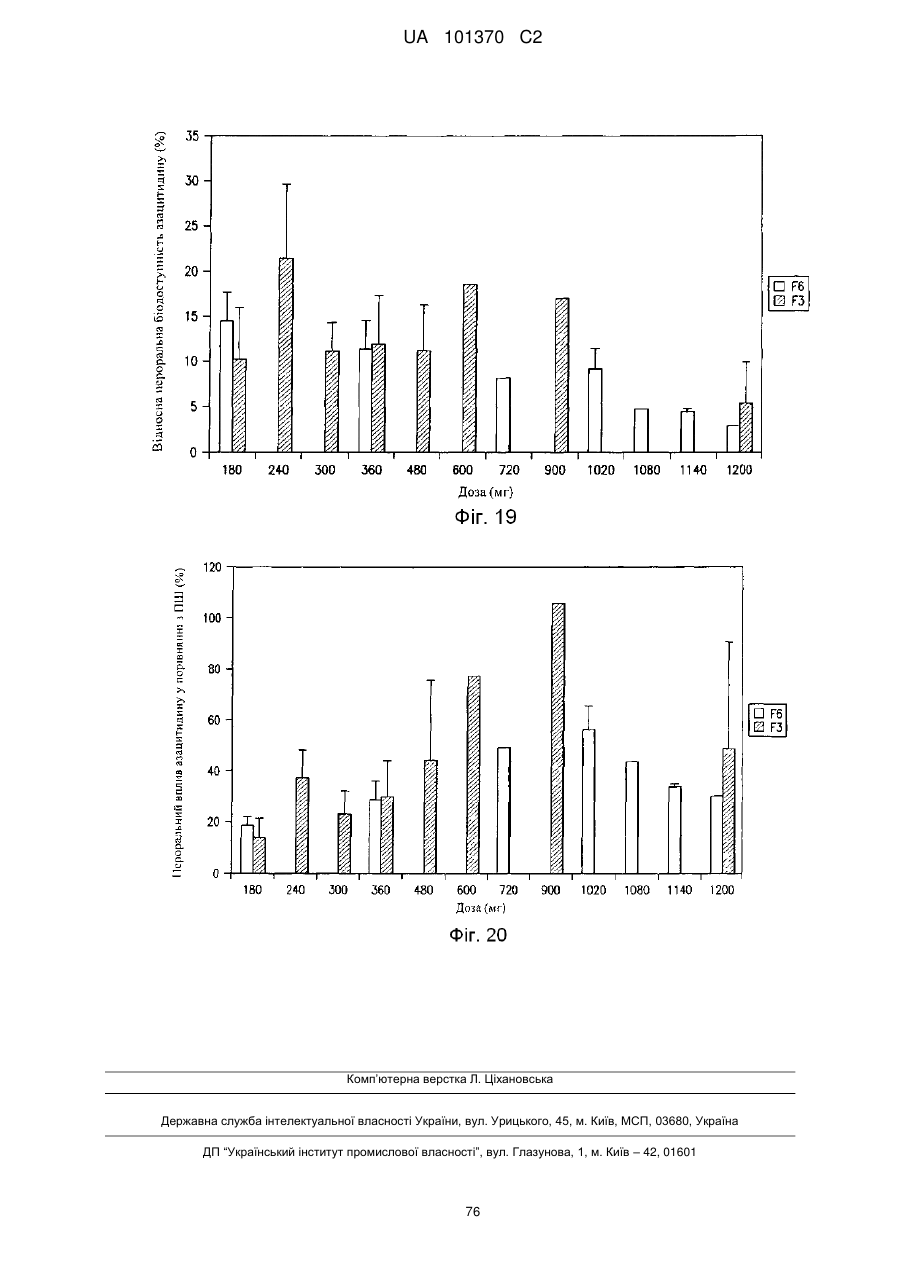
11. Композиція за п. 1, яка досягає значення площі під кривою щонайменше приблизно 200 нг×год./мл або щонайменше приблизно 400 нг×год./мл після перорального введення суб'єкту.
12. Композиція за п. 1, яка досягає значення площі під кривою щонайменше приблизно 100 нг×год./мл або щонайменше приблизно 200 нг×год./мл після перорального введення суб'єкту.
13. Композиція за п. 1, яка досягає значення часу досягнення максимальної концентрації в плазмі приблизно менше ніж 60 хвилин, менше ніж 90 хвилин або менше ніж 180 хвилин після перорального введення суб'єкту.
14. Фармацевтична композиція, яка містить терапевтично ефективну кількість 5-азацитидину для застосування при лікуванні пацієнта із захворюванням або порушенням, яке являє собою рак або гематологічне порушення, де композиція являє собою таблетку з негайним вивільненням, яка не покрита ентеросолюбільним покриттям, що включає центральну частину лікарського засобу, яка містить 5-азацитидин і додатково містить покриття центральної частини лікарського засобу, причому таблетку одержують нанесенням покриття на центральну частину лікарського засобу із застосуванням розчинника, який включає воду або етанол.
15. Фармацевтична композиція за п. 14, де композицію одержували для перорального введення в сполучені з додатковим терапевтичним засобом.
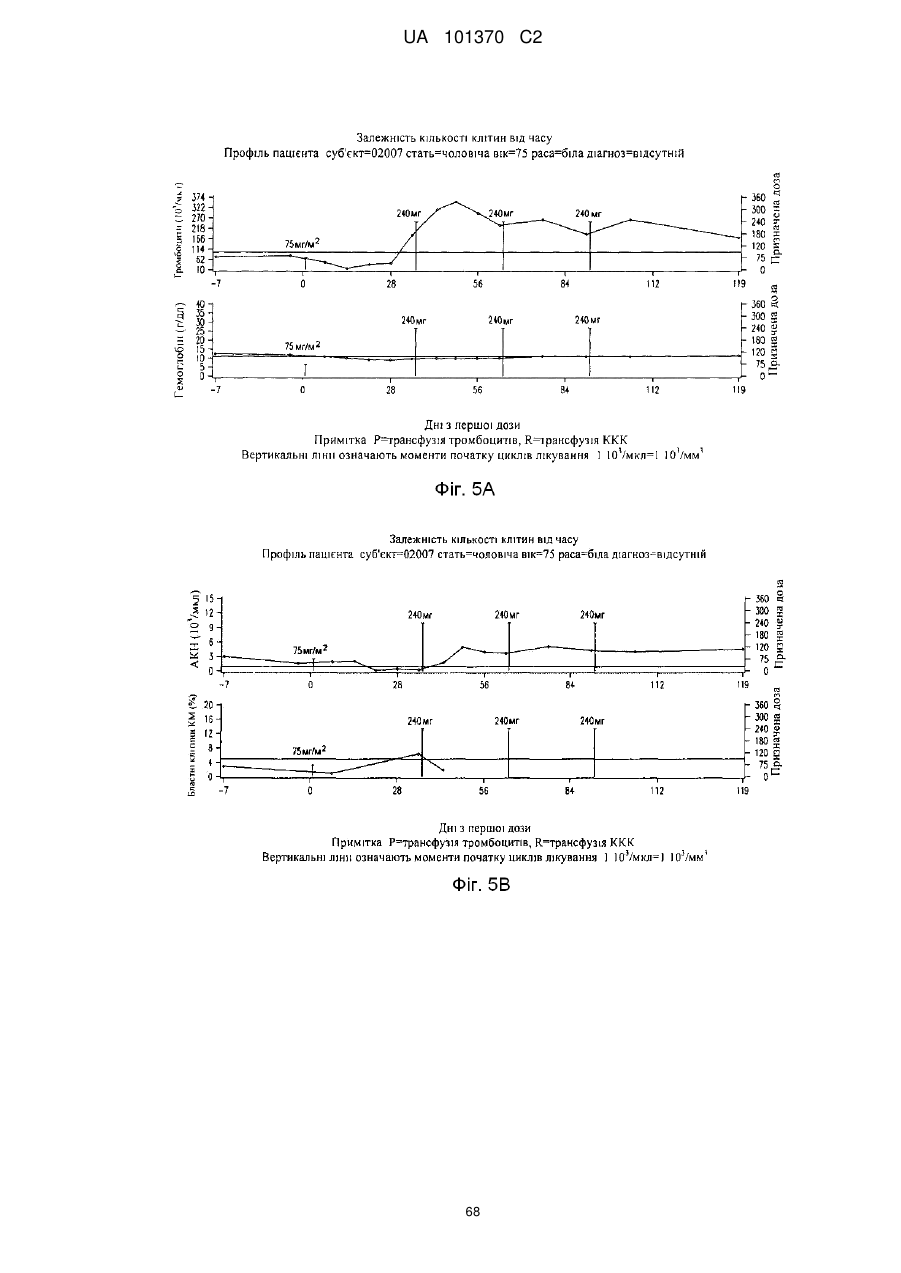
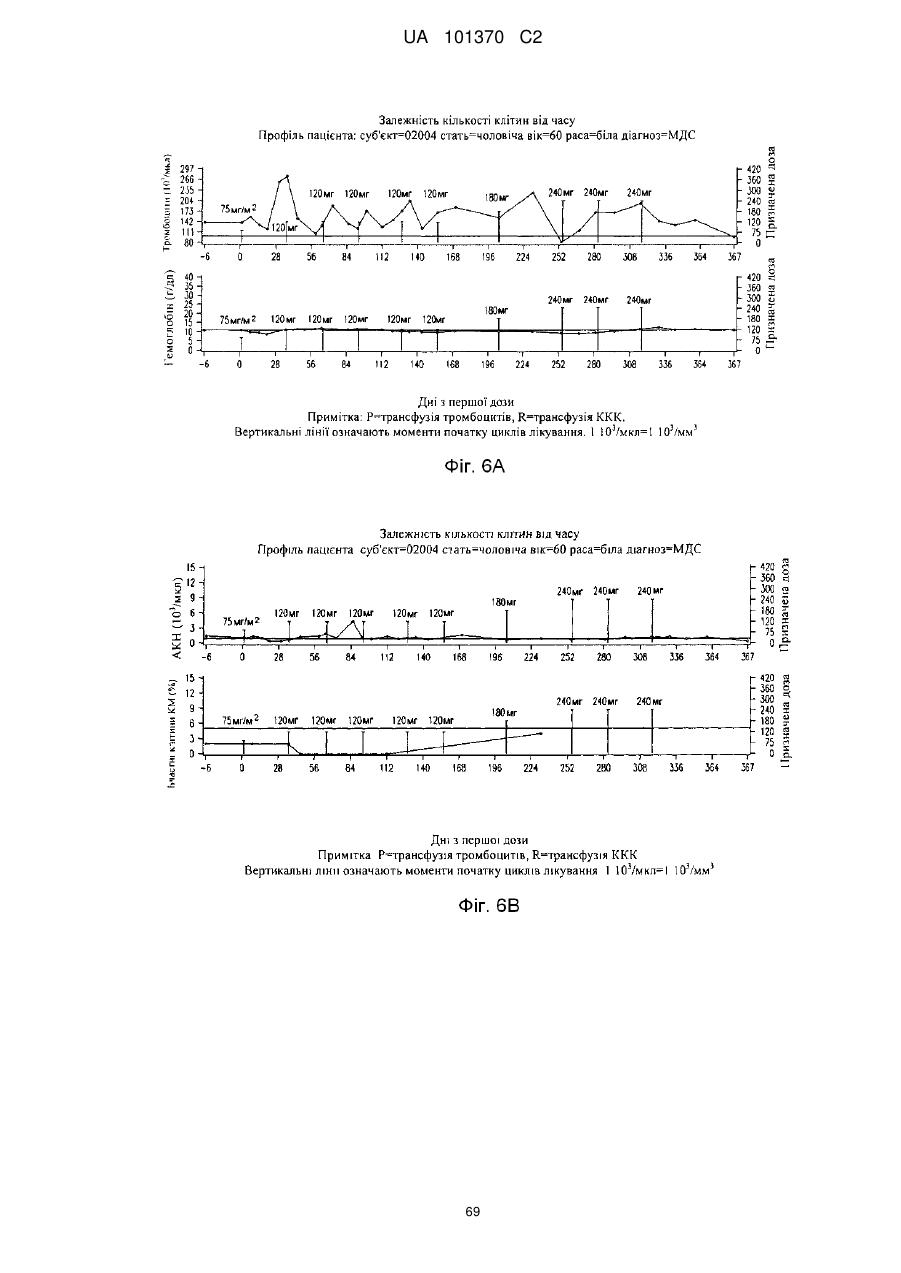
16. Фармацевтична композиція за будь-яким з пп. 14 або 15, де захворюванням або порушенням є мієлодиспластичний синдром або гострий мієлобластний лейкоз.
17. Фармацевтична композиція за будь-яким з пп. 14 або 15, де захворюванням є недрібноклітинний рак легень, злоякісна пухлина яєчників, злоякісна пухлина підшлункової залози або злоякісна пухлина товстої кишки.
18. Композиція за п. 14, де кількість 5-азацитидину становить щонайменше приблизно 40 мг, щонайменше приблизно 400 мг або щонайменше приблизно 1000 мг.
19. Композиція за п. 14, де кількість 5-азацитидину становить приблизно 40 мг, приблизно 400 мг або приблизно 1000 мг.
20. Композиція за п. 14, яка додатково містить ексципієнт, вибраний з маніту, мікрокристалічної целюлози, кросповідону і стеарату магнію.
21. Композиція за п. 14, яка додатково містить посилюючий проникнення засіб.
22. Композиція за п. 21, де посилюючим проникнення засобом є d-альфа-токоферил поліетиленгліколь 1000 сукцинат.
23. Композиція за п. 22, де d-альфа-токоферил поліетиленгліколь 1000 сукцинат присутній в складі в кількості приблизно 2 % по масі відносно загальної маси складу.
24. Композиція за п. 14, яка по суті не містить інгібітор цитидиндеамінази.
25. Композиція за п. 14, яка досягає значення площі під кривою щонайменше приблизно 200 нг×год./мл або щонайменше приблизно 400 нг×год./мл після перорального введення об'єкту.
26. Композиція за п, 14, яка досягає значення площі під кривою щонайменше приблизно 100 нг×год./мл або щонайменше приблизно 200 нг×год./мл після перорального введення суб'єкту.
27. Композиція за п. 14, яка досягає значення часу досягнення максимальної концентрації в плазмі приблизно менше ніж 60 хвилин, менше ніж 90 хвилин або менше ніж 180 хвилин після перорального введення суб'єкту.
28. Застосування 5-азацитидину для одержання фармацевтичної композиції для лікування захворювання, яке являє собою рак або гематологічне порушення, де композиція, являє собою таблетку з негайним вивільненням, яка не покрита ентеросолюбільним покриттям, що включає центральну частину лікарського засобу, яка містить 5-азацитидин і додатково містить покриття центральної частини лікарського засобу, причому таблетку одержують нанесенням покриття на центральну частину лікарського засобу з застосуванням розчинника, який включає воду або етанол.
29. Застосування за п. 28. де захворюванням є мієлодиспластичний синдром або гострий мієлобластний лейкоз.
30. Застосування за п. 28 або 29, де кількість 5-азацитидину становить приблизно 40 мг, приблизно 400 мг або приблизно 1000 мг.
31. Спосіб лікування суб'єкта, що має захворювання, асоційоване з аномальною клітинною проліферацією, який включає пероральне введення суб'єкту фармацевтичної композиції, що містить терапевтично ефективну кількість 5-азацитидину, де композиція являє собою таблетку з негайним вивільненням, яка не покрита ентеросолюбільним покриттям, що включає центральну частину лікарського засобу, яка містить 5-азацитидин і додатково містить покриття центральної частини лікарського засобу, причому таблетку одержують нанесенням покриття на центральну частину лікарського засобу з використанням розчинника, який включає воду або етанол.
32. Спосіб за п. 31, де захворюванням є мієлодиспластичний синдром або гострий мієлобластний лейкоз.
33. Спосіб за п. 31, де захворюванням є недрібноклітинний рак легень, злоякісна пухлина яєчників, злоякісна пухлина підшлункової залози або злоякісна пухлина товстої кишки.
34. Спосіб за п. 31, де спосіб додатково включає спільне введення суб'єкту, який потребує цього, додаткового терапевтичного засобу.
35. Спосіб за п. 31, де композиція додатково містить засіб, що посилює проникнення.
36. Спосіб за п. 35, де засобом, що посилює проникнення, є d-альфа-токоферил поліетиленгліколь 1000 сукцинат.
37. Спосіб за п. 36, де d-альфа-токоферил поліетиленгліколь 1000 сукцинат присутній в складі в кількості приблизно 2 % по масі відносно загальної маси складу.
38. Спосіб за п. 31, де спосіб додатково не включає спільне введення інгібітора цитидиндеамінази і аналога цитидину.
39. Спосіб за п. 31, де композиція являє собою одиничну стандартну лікарську форму.
40. Спосіб за п. 31, де композиція додатково містить ексципієнт, вибраний з маніту, мікрокристалічної целюлози, кросповідону і стеарату магнію.
41. Спосіб за п. 31, де кількість 5-азацитидину складає щонайменше приблизно 40 мг, щонайменше приблизно 400 мг або щонайменше приблизно 1000 мг.
42. Спосіб за п. 31, при якому досягають значення площі під кривою щонайменше приблизно 200 нг×год./мл або щонайменше приблизно 400 нг×год./мл після перорального введення суб'єкту.
43. Спосіб за п. 31, при якому досягають максимальної концентрації в плазмі щонайменше приблизно 100 нг/мл або щонайменше приблизно 200 нг/мл після перорального введення суб'єкту.
44. Спосіб за п. 31, при якому досягають значення часу досягнення максимальної концентрації в плазмі приблизно менше ніж 180 хвилин, менше ніж 90 хвилин або менше ніж 60 хвилин після перорального введення суб'єкту.
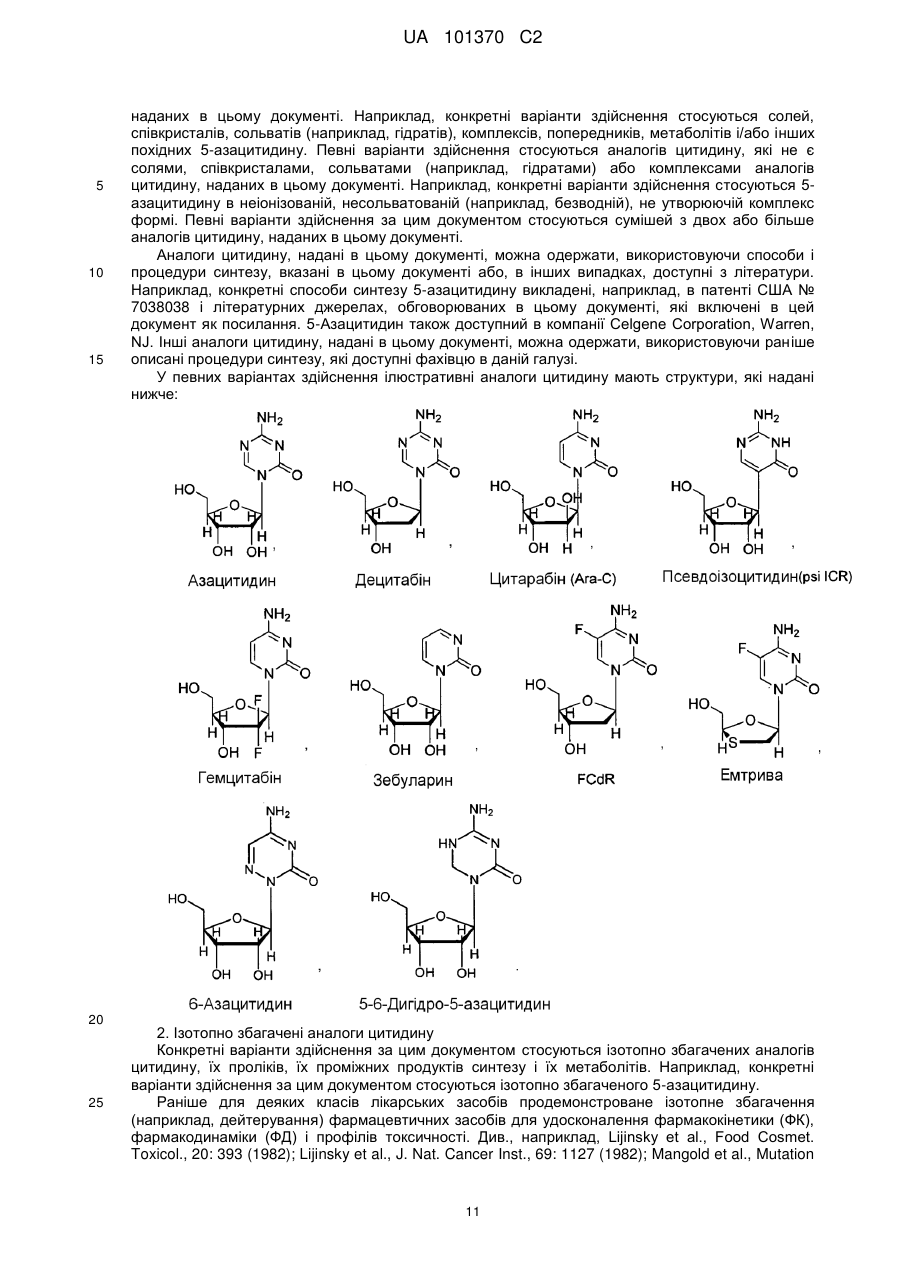
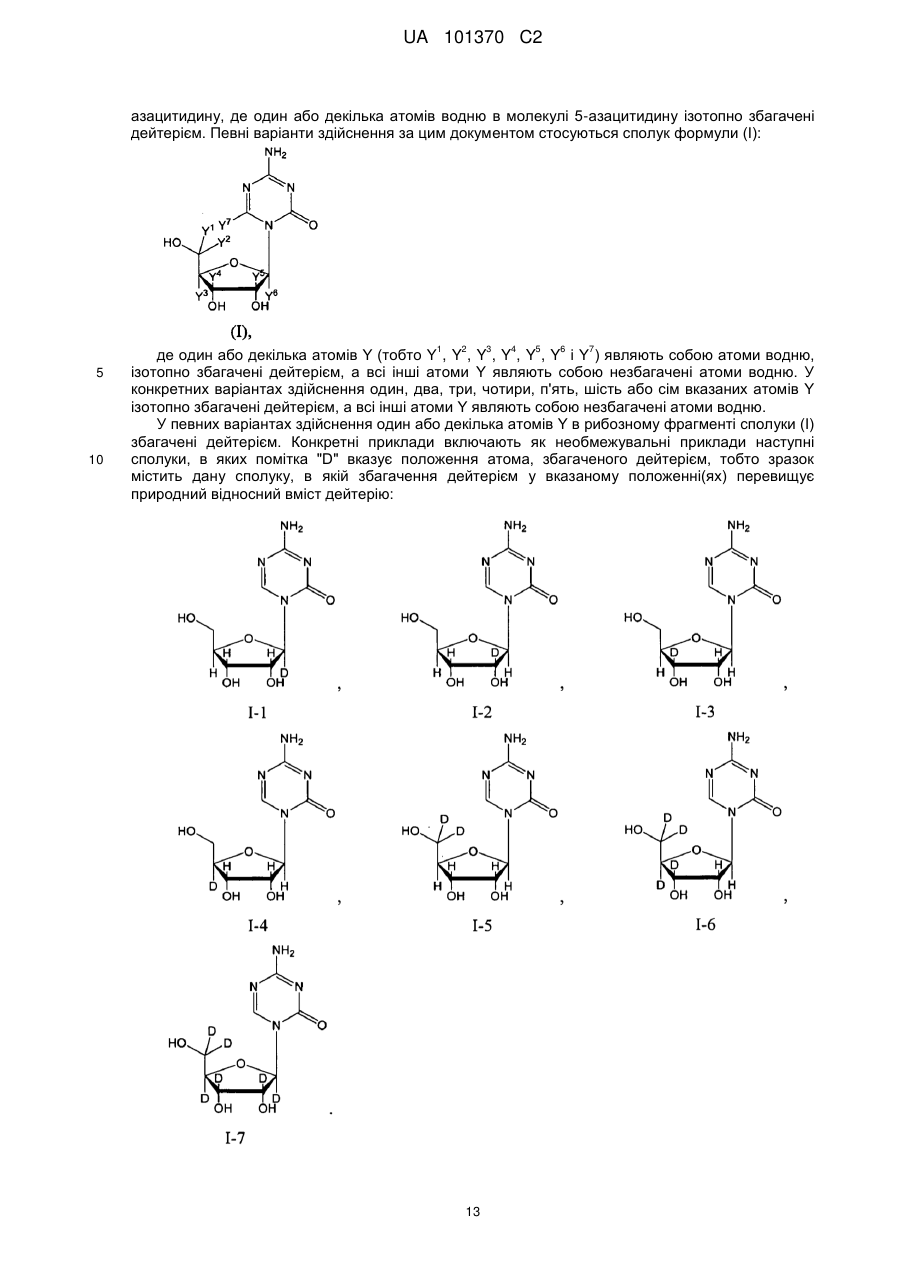
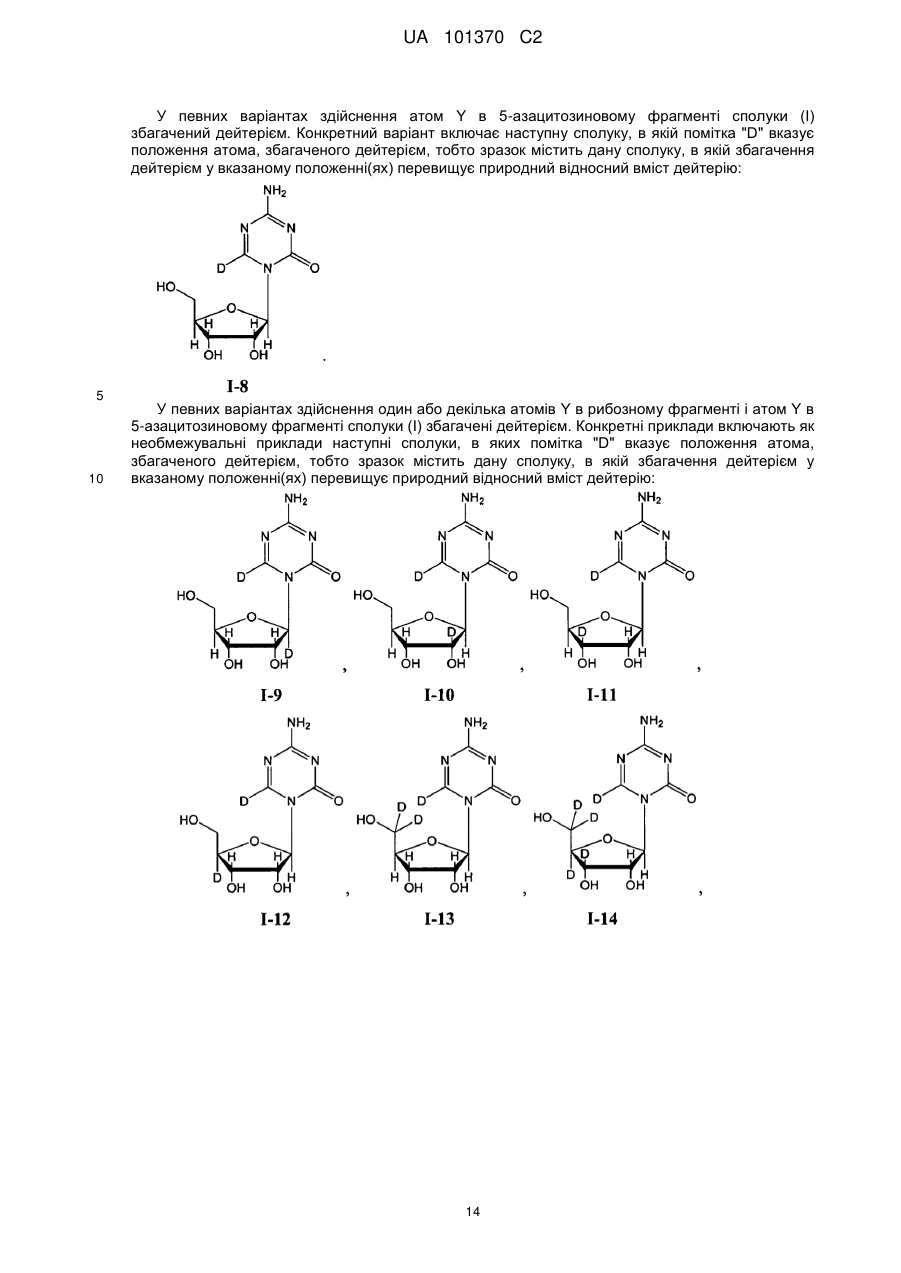
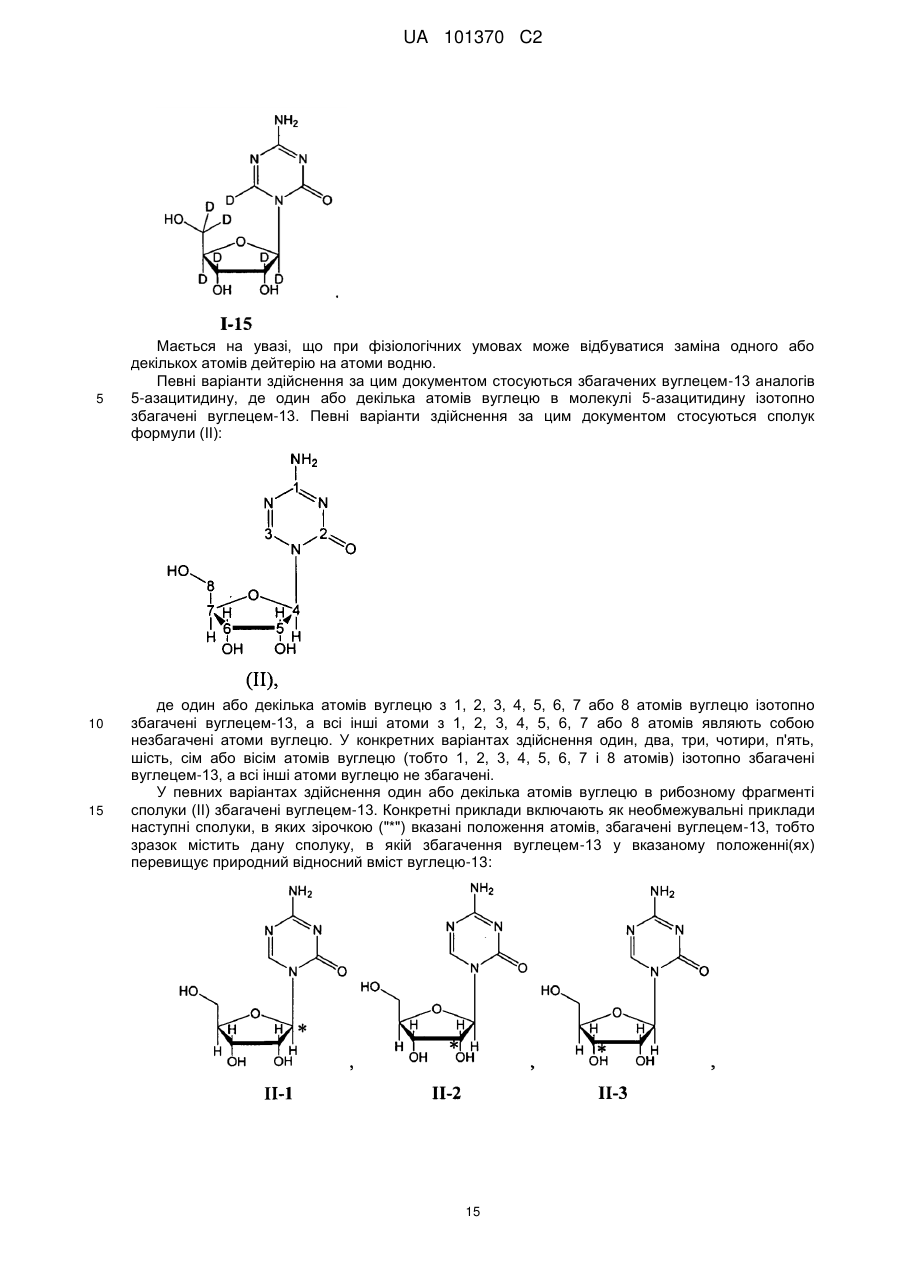
Текст
Реферат: Винахід належить до галузі медицини та фармацевтики і стосується фармацевтичних композицій для перорального введення, що містять терапевтично ефективну кількість 5азацитидину, де композиція являє собою таблетку з негайним вивільненням, яка не покрита ентеросолюбільним покриттям, й включає центральну частину з лікарського засобу, вкриту покриттям, яке нанесене з використанням розчинника, що включає воду або етанол. Також винахід стосується застосування та способу лікування захворювань і порушень, використовуючи зазначені пероральні композиції. UA 101370 C2 (12) UA 101370 C2 UA 101370 C2 5 10 15 20 25 30 35 40 45 50 55 60 I. ПЕРЕХРЕСНЕ ПОСИЛАННЯ НА ПОВ'ЯЗАНІ ЗАЯВКИ По даній заявці вимагається пріоритет по попередніх патентних заявках США № 61/053609, поданої 15 травня 2008 року, 61/201145, поданої 5 грудня 2008 року, і 61/157875, поданої 5 березня 2009 року, зміст яких включений в цей документ як посилання в повному обсязі. II. ГАЛУЗЬ ВИНАХОДУ У цьому документі описані фармацевтичні склади, які містять аналоги цитидину або їх солі, сольвати, гідрати, попередники і/або їх похідні, для перорального введення суб'єктам. Також надані способи одержання таких складів і способи використання таких складів для лікування захворювань і порушень, які включають, серед іншого, злоякісні пухлини, порушення, пов'язані з аномальною клітинною проліферацією, гематологічні порушення і імунні порушення. III. ПЕРЕДУМОВИ ВИНАХОДУ Злоякісні пухлини є основною проблемою охорони здоров'я світового масштабу; очікували, що тільки в США в 2005 році буде зареєстровано приблизно 570000 смертей, пов'язаних зі злоякісними пухлинами. Див., наприклад, Jemal et al., CA Cancer J. Clin. 55(1):10-30 (2005). В медичній літературі описано багато видів злоякісних пухлин. Приклади включають злоякісні пухлини крові, кісток, легень (наприклад, недрібноклітинний рак легень і дрібноклітинний рак легень), товстої кишки, молочної залози, простати, яєчника, мозку і кишечнику. Захворюваність злоякісними пухлинами продовжує рости із збільшенням віку населення загалом і виявленням нових видів злоякісних пухлин. Зберігається необхідність в ефективних лікарських засобах для лікування суб'єктів зі злоякісними пухлинами. Мієлодиспластичні синдроми (МДС) стосуються різнорідної групи порушень гемопоетичних стовбурових клітин. Мієлодиспластичними синдромами уражено приблизно 40000-50000 чоловік в США і 75000-85000 чоловік в Європі. МДС можуть відрізнятися порушенням морфології і дозрівання кровотворних клітин кісткового мозку (дисмієлопоез), цитопенією в периферичній крові і неоднаковими ризиками розвитку гострого лейкозу, які виникають внаслідок неефективного утворення клітин крові. Див., наприклад, The Merck Manual 953 (17th ed. 1999); List et al., J. Clin. Oncol. 8:1424 (1990). МДС об'єднані в одну групу внаслідок наявності диспластичних змін в одному або декількох відростках кровотворення, включаючи диспластичні зміни в мієлоїдному, еритроїдному і мегакаріоцитарному відростках. Ці зміни приводять до цитопеній в одному або декількох з цих трьох відростків. У пацієнтів, уражених МДС, можуть розвиватися ускладнення, пов'язані з анемією, нейтропенією (інфекції) і/або тромбоцитопенією (кровотечі). Приблизно у 10-70 % пацієнтів з МДС може розвинутися гострий лейкоз. На ранніх стадіях МДС основною причиною цитопенії є прискорення запрограмованої клітинної смерті (апоптозу). По мірі розвитку захворювання і його переродження в лейкоз проліферуючі лейкозні клітини заполоняють здоровий кістковий мозок. Перебіг захворювання відрізняється в ряді випадків, коли захворювання поводиться як повільно зростаюча пухлина або коли захворювання поводиться агресивно, має дуже коротку тривалість перебігу захворювання і перероджується в гостру форму лейкозу. Зрештою, у більшості людей з більш високим ризиком МДС настає недостатність кісткового мозку. До 50 % пацієнтів з МДС вмирають від ускладнень, таких як інфекції або кровотечі, ще до розвитку гострого мієлоцитарного лейкозу. При виявленні первинних і вторинних МДС враховують анамнез пацієнта: попереднє лікування хіміотерапевтичними засобами, променева терапія або професійна схильність дії токсичних речовин є тими факторами, які відділяють вторинний МДС (вМДС) від первинного МДС. З точки зору цитогенетики, ці дві групи розрізнюються складністю аномальних каріотипів; для первинного МДС типова аберація однієї хромосоми, тоді як множинні зміни більш часто спостерігаються при вторинних порушеннях. Деякі лікарські засоби, такі як гідроксисечовина при 17p і інгібітори топоізомераз при 11q23 і 21q22, можуть мати конкретні мішені. Генетичні зміни в злоякісних клітинах МДС ведуть, в основному, до втрати генетичного матеріалу, що містить імовірні гени-супресори пухлинного росту. Міжнародна група гематологів, French-American-British (FAB) Cooperative Group, розділила МДС на п'ять підгруп, диференціювавши їх від гострого мієлолейкозу. Див., наприклад, The Merck Manual 954 (17th ed. 1999); Bennett J.M., et al., Ann. Intern. Med., 103(4): 620-5 (1985); і Besa E.C., Med. Clin. North Am. 76(3):599-617 (1992). Основні диспластичні зміни в трьох відростках клітин кісткового мозку пацієнтів знайдені у всіх підтипах. Доступна інформація про патологічні процеси при МДС, визначених системах класифікації МДС і конкретних способах лікування і ведення МДС. Див., наприклад, патент США № 7189740 (виданий 13 березня 2007 року), який в повному обсязі включений в цей документ як посилання. Аналоги нуклеозидів використовувалися в клініці для лікування вірусних інфекцій і злоякісних пухлин. Більшість аналогів нуклеозидів класифікуються як антиметаболіти. Після 1 UA 101370 C2 5 10 15 20 25 30 35 40 45 проникнення в клітину аналоги нуклеозидів послідовно фосфорилуються до нуклеозид-5'монофосфатів, -дифосфатів і -трифосфатів. 5-Азацитидин (позначення згідно з "National Service Center" NSC-102816; реєстраційний номер CAS 320-67-2), також відомий як азацитидин, АЗА або 4-аміно-1-β-D-рибофуранозил1,3,5-триазин-2(1H)-он, на даний час представлений на ринку у вигляді готової лікарської форми VIDAZA®. 5-Азацитидин є аналогом нуклеозиду, більш конкретно аналогом цитидину. 5Азацитидин є антагоністом свого спорідненого природного нуклеозиду, цитидину. 5-Азацитидин і 5-аза-2'-дезоксицитидин (також відомий як децитабін, аналог дезоксицитидину) також є антагоністами дезоксицитидину. Структурна відмінність між цими аналогами цитидину і їх спорідненим природним нуклеозидом полягає в присутності атома азоту замість атома вуглецю в 5-положенні в кільці цитозину. 5-Азацитидин можна визначити за допомогою брутто-формули C8H12N4O5, молекулярної маси 244,21 грам/моль і наступної структурної формули: . Інші члени класу аналогів цитидину включають, наприклад, 1-β-D-арабінофуранозилцитозин (цитарабін або ара-С); 5-аза-2'-дезоксицитидин (децитабін або 5-аза-CdR); псевдоізоцитидин (psi ICR); 5- фтор-2'-дезоксицитидин (FCdR); 2'-дезокси-2',2'-дифторцитидин (гемцитабін); 5-аза2'-дезокси-2',2'-дифторцитидин; 5-аза-2'-дезокси-2'-фторцитидин; 1-β-D-рибофуранозил-2(1H)піримідинон (зебуларин); 2',3'-дидезокси-5-фтор-3'-тіацитидин (емтрива); 2'-циклоцитидин (анцитабін); 1-β-D-арабінофуранозил-5-азацитозин (фазарабін або ара-АС); 6-азацитидин (64 аза-CR); 5,6-дигідро-5-азацитидин (dH-аза-CR); N -пентилоксикарбоніл-5'-дезокси-54 фторцитидин (капецитабін); N -октадецилцитарабін і цитарабін елаїдинової кислоти. Після вбудовування в ДНК, що реплікується, 5-азацитидин або 5-аза-2'-дезоксицитидин утворює ковалентний комплекс з ДНК-метилтрансферазами. ДНК-метилтрансферази відповідають за метилування ДНК de novo, а також за дублювання патернів метилування, що склалися, реплікованої ДНК в дочірніх ланцюгах ДНК. Інгібування ДНК-метилтрансфераз 5азацитидином або 5-аза-2'-дезоксицитидином веде до зниження метилування ДНК, внаслідок чого відновлюється нормальне функціонування морфологічно диспластичних незрілих гемопоетичних клітин і злоякісних клітин шляхом відновлення експресії генів, що беруть участь в регуляції нормального клітинного циклу, диференціації і загибелі. Цитотоксичні ефекти цих аналогів цитидину викликають загибель клітин, що швидко діляться, включаючи злоякісні клітини, які більше не підкоряються нормальним механізмам контролю клітинного росту. 5Азацитидин, на відміну від 5-аза-2'-дезоксицитидину, також вбудовується в РНК. Цитотоксичні ефекти азацитидину можуть бути опосередковані багатьма механізмами, включаючи інгібування синтезу ДНК, РНК і білка, вбудовування в РНК і ДНК і активацію шляхів пошкодження ДНК. У клінічних випробуваннях тестування 5-азацитидину і 5-аза-2'-дезоксицитидину виявило значну протипухлинну активність, наприклад таку, як в лікуванні мієлодиспластичних синдромів (МДС), гострого мієлобластного лейкозу (ГМЛ), хронічного мієлобластного лейкозу (ХМЛ), гострого лімфоцитарного лейкозу (ГЛЛ) і неходжськінскої лімфоми (НХЛ). Див., наприклад, Aparicio et al., Curr. Opin. Invest. Drugs 3(4): 627-33 (2002). 5-Азацитидин проходив фінансовані Національним інститутом раку випробування по лікуванню МДС і схвалений для лікування всіх підтипів МДС по класифікації FAB. Див., наприклад, Kornblith et al., J. Clin. Oncol. 20(10): 24412452 (2002); Silverman et al., J. Clin. Oncol. 20(10): 2429-2440 (2002). За допомогою цитотоксичної активності і інгібування ДНК-метилтрансферази 5-азацитидин може змінювати нормальний перебіг МДС, знижуючи імовірність переродження в ГМЛ. У III фазі дослідження при підшкірному введенні 5-азацитидин значно продовжував виживаність і час до переродження в ГМЛ або смерті суб'єктів з МДС з високим ризиком переродження. Див., наприклад, Fenaux P. et al., Lancet Oncol., 2009, 10(3):223-32; Silverman et al., Blood 106(11): Abstract 2526 (2005). 2 UA 101370 C2 5 10 15 20 25 30 35 40 45 50 55 60 5-Азацитидин і інші аналоги цитидину схвалені для підшкірного (ПШ) або внутрішньовенного (ВВ) введення для лікування різних проліферативних порушень. Пероральне дозування аналогів цитидину більш бажане і зручне для пацієнтів і лікарів, наприклад, за рахунок позбавлення від реакцій в місцях ін'єкцій, які можуть розвиватися при підшкірному введенні і/або за рахунок можливості удосконалити додержання пацієнтом схеми лікування. Однак доведено, що пероральна доставка аналогів цитидину ускладнена поєднанням хімічної нестабільності, ферментативної нестабільності і/або поганої проникності. Наприклад, вважається, що аналоги цитидину схильні до дії кислоти і нестабільні в кислому середовищі шлунка. Розроблені раніше пероральні лікарські форми аналогів цитидину обов'язково мають таке ентеросолюбільне покриття центральної частини лікарського засобу, щоб захистити активний фармацевтичний компонент (АФК) від того, що розуміють і визнають як терапевтично неприйнятний гідроліз в шлунку, щоб лікарський засіб переважно всмоктувався в конкретних ділянках нижньої частини шлунково-кишкового тракту, такої як порожня кишка тонкого кишечнику. Див., наприклад, Sands, et al., публікацію патенту США № 2004/0162263 (заявка № 10/698983). Крім того, в даній галузі існує загальноприйняте представлення про те, що вода веде до руйнівного гідролізу аналогів цитидину в процесі одержання лікарського засобу, що надалі впливає на стабільність АФК в лікарській формі. Внаслідок цього, покриття, що наносяться на центральну частину лікарського засобу для передбачуваної пероральної доставки аналогів цитидину, раніше були обмежені системами на основі органічного розчинника, щоб мінімізувати вплив води на АФК. Зберігається значна потреба в пероральних складах і лікарських формах аналогів цитидину, таких як, наприклад, 5-азацитидин, щоб, серед іншого, потенційно забезпечити більш сприятливі рівні доз або періоди дозування; удосконалення фармакокінетичних профілів, фармакодинамічних профілів або профілів безпеки; оцінку переваг довгострокової або підтримуючої терапії; розробку вдосконалених схем лікування, які максимально збільшують біологічну активність; використання аналогів цитидину для лікування нових захворювань або порушень і/або інші потенційні сприятливі переваги. IV. КОРОТКИЙ ВИКЛАД У цьому документі описані фармацевтичні композиції, що містять аналоги цитидину, де композиції вивільняють АФК по суті в шлунку після перорального введення. Крім того, надані способи одержання таких композицій і способи використання таких композицій для лікування захворювань і порушень, включаючи, серед іншого, злоякісні пухлини, порушення, пов'язані з аномальною клітинною проліферацією, і гематологічні порушення. У певних варіантах здійснення аналогом цитидину є 5-азацитидин. У інших варіантах здійснення аналогом цитидину є 5-аза-2'-дезоксицитидин (децитабін або 5-аза-CdR). У інших варіантах здійснення аналогом цитидину є, наприклад, 1-β-D-арабінофуранозилцитозин (цитарабін або ара-С); псевдоізоцитидин (psi ICR); 5-фтор-2'-дезоксицитидин (FCdR); 2'дезокси-2',2'-дифторцитидин (гемцитабін); 5-аза-2'-дезокси-2',2'-дифторцитидин; 5-аза-2'дезокси-2'-фторцитидин; 1-β-D-рибофуранозил-2(1H)-піримідинон (зебуларин); 2',3'-дидезокси5-фтор-3'-тіацитидин (емтрива); 2'-циклоцитидин (анцитабін); 1-β-D-арабінофуранозил-5азацитозин (фазарабін або ара-АС); 6-азацитидин (6-аза-CR); 5,6-дигідро-5-азацитидин (dH4 4 аза-CR); N -пентилоксикарбоніл-5'-дезокси-5-фторцитидин (капецитабін); Nоктадецилцитарабін; цитарабін елаїдинової кислоти або їх похідні або споріднені аналоги. Певні варіанти здійснення за цим документом стосуються композицій, які являють собою одиничні стандартні лікарські форми, що містять аналог цитидину. Певні варіанти здійснення за цим документом стосуються композицій, які не покриті ентеросолюбільним покриттям. Певні варіанти здійснення за цим документом стосуються композицій, які являють собою таблетки, що містять аналог цитидину. Певні варіанти здійснення за цим документом стосуються композицій, які являють собою капсули, що містять аналог цитидину. Капсули можуть являти собою, наприклад, тверді желатинові капсули або м'які желатинові капсули; в конкретних варіантах здійснення надані капсули з гідроксипропілметилцелюлози (ГПМЦ). У певних варіантах здійснення одиничні стандартні лікарські форми необов'язково додатково містять один або декілька ексципієнтів. У певних варіантах здійснення таблетки необов'язково додатково містять один або декілька ексципієнтів. У інших варіантах здійснення капсули необов'язково додатково містять один або декілька ексципієнтів. У певних варіантах здійснення композиція являє собою таблетку, яка здійснює негайне вивільнення АФК після перорального введення. У інших варіантах здійснення композиція являє собою таблетку, яка здійснює контрольоване вивільнення АФК по суті в шлунку. У певних варіантах здійснення композиція являє собою капсулу, яка здійснює негайне вивільнення АФК після перорального введення. У інших варіантах здійснення композиція являє собою капсулу, яка забезпечує контрольоване 3 UA 101370 C2 5 10 15 20 25 30 35 40 45 50 55 60 вивільнення АФК по суті в шлунку. У конкретних варіантах здійснення таблетка містить центральну частину лікарського засобу, яка містить аналог цитидину, і необов'язково додатково містить покриття центральної частини лікарського засобу, де покриття нанесене на центральну частину лікарського засобу з використанням водного розчинника, наприклад, такого як вода, або неводного розчинника, наприклад, такого як етанол. Певні варіанти здійснення за цим документом стосуються способів одержання складів, що містять аналоги цитидину, які призначені для пероральної доставки. Крім того, надані промислові вироби, які включають пакувальний матеріал, пероральний склад, що містить аналог цитидину, і ярлик, на якому указано, що склад призначений для лікування певних захворювань або порушень, включаючи, наприклад, злоякісні пухлини, порушення, пов'язані з аномальною клітинною проліферацією, гематологічні порушення або імунні порушення. Певні варіанти здійснення за цим документом стосуються способів використання складів, наданих в цьому документі, для лікування захворювань або порушень, включаючи, серед іншого, наприклад, злоякісні пухлини, порушення, пов'язані з аномальною клітинною проліферацією, гематологічні порушення або імунні порушення. У певних варіантах здійснення склади, що містять аналоги цитидину, перорально вводять суб'єктам, потребуючим цього, для лікування злоякісної пухлини або гематологічного порушення, наприклад, такого як МДС, ГМЛ, ГЛЛ, ХМЛ, НХЛ, лейкоз або лімфома; або солідної пухлини, наприклад, такої як саркома, меланома, карцинома, або злоякісних пухлин товстої кишки, молочної залози, яєчника, шлунково-кишкового тракту, нирки, легені (наприклад, недрібноклітинний рак легень і дрібноклітинний рак легень), яєчка, простати, підшлункової залози або кістки. У певних варіантах здійснення склади, що містять аналоги цитидину, перорально вводять суб'єктам, потребуючим цього, для лікування імунного порушення. У певних варіантах здійснення пероральні склади, надані в цьому документі, спільно вводять з одним або декількома терапевтичними засобами, щоб забезпечити синергічний терапевтичний ефект у суб'єктів, потребуючих цього. У певних варіантах здійснення пероральні склади, надані в цьому документі, спільно вводять з одним або декількома терапевтичними засобами, щоб забезпечити ефект повторної сенсибілізації у суб'єктів, потребуючих цього. Засоби, що спільно вводяться, можуть являти собою терапевтичні засоби проти злоякісних пухлин, як описано в цьому документі. У певних варіантах здійснення засіб(оби), що спільно вводиться, можна дозувати, наприклад, перорально або за допомогою ін'єкції. Конкретні варіанти здійснення за цим документом стосуються таблеток, що містять 5азацитидин, і способів одержання і використання таких таблеток для лікування злоякісних пухлин, порушень, пов'язаних з аномальною клітинною проліферацією, або гематологічних порушень. У певних варіантах здійснення таблетки необов'язково додатково містять один або декілька ексципієнтів, наприклад, таких як гліданти, розріджувачі, лубриканти, барвники, дезінтегруючі засоби, гранулюючі засоби, зв'язуючі засоби, полімери і/або покриваючі засоби. Приклади компонентів, які можна використовувати при одержанні певних складів, наданих в цьому документі, описані, наприклад, в Etter et al., публікації патентної заявки США № 2008/0057086 (заявка № 11/849958), включеній в цей документ як посилання в повному обсязі. Серед іншого, конкретні варіанти здійснення за цим документом стосуються фармацевтичних композицій, які містять терапевтично ефективну кількість 5-азацитидину, де з композиції 5-азацитидин вивільняється по суті в шлунку після перорального введення суб'єкту. Додаткові варіанти здійснення стосуються вказаних вище композицій, які являють собою композиції з негайним вивільненням; не мають ентеросолюбільного покриття (тобто не покриті ентеросолюбільним покриттям); являють собою таблетки; являють собою капсули; додатково містять ексципієнт, вибраний з будь-яких ексципієнтів, описаних в цьому документі; додатково містять посилюючий проникнення засіб; додатково містять d-альфа-токоферил поліетиленгліколь 1000 сукцинат; додатково містять в складі посилюючий проникнення засіб в кількості приблизний 2 % по масі відносно загальної маси складу; по суті не містять інгібітор цитидиндеамінази; по суті не містять тетрагідроуридин; містять 5-азацитидин в кількості щонайменше приблизно 40 мг; містять 5-азацитидин в кількості щонайменше приблизно 400 мг; містять 5-азацитидин в кількості щонайменше приблизно 1000 мг; досягають значення площі під кривою щонайменше приблизно 200 нг×год./мл після перорального введення суб'єкту; досягають значення площі під кривою щонайменше приблизно 400 нг×год./мл після перорального введення суб'єкту; досягають максимальної концентрації в плазмі щонайменше приблизно 100 нг/мл після перорального введення суб'єкту; досягають максимальної концентрації в плазмі щонайменше приблизно 200 нг/мл після перорального введення суб'єкту; досягають значення часу досягнення максимальної концентрації в плазмі приблизно менше ніж 90 хвилин після перорального введення суб'єкту; і/або досягають значення часу досягнення 4 UA 101370 C2 5 10 15 20 25 30 35 40 45 50 55 60 максимальної концентрації в плазмі приблизно менше ніж 60 хвилин після перорального введення суб'єкту. Конкретні варіанти здійснення за цим документом стосуються фармацевтичної композиції для перорального введення, яка містить терапевтично ефективну кількість 5-азацитидину, з якої 5-азацитидин вивільняється по суті в шлунку і досягає значення площі під кривою щонайменше приблизно 200 нг×год./мл після перорального введення. Конкретні варіанти здійснення за цим документом стосуються фармацевтичної композиції для перорального введення, яка містить терапевтично ефективну кількість 5-азацитидину, з якої 5-азацитидин вивільняється по суті в шлунку і досягає значення площі під кривою щонайменше приблизно 400 нг×год./мл після перорального введення. Конкретні варіанти здійснення за цим документом стосуються фармацевтичної композиції для перорального введення, яка містить терапевтично ефективну кількість 5-азацитидину, з якої 5-азацитидин вивільняється по суті в шлунку і досягає максимальної концентрації в плазмі щонайменше приблизно 100 нг/мл після перорального введення. Конкретні варіанти здійснення за цим документом стосуються фармацевтичної композиції для перорального введення, яка містить терапевтично ефективну кількість 5-азацитидину, з якої 5-азацитидин вивільняється по суті в шлунку і досягає максимальної концентрації в плазмі щонайменше приблизно 200 нг/мл після перорального введення. Конкретні варіанти здійснення за цим документом стосуються фармацевтичної композиції для перорального введення, яка містить терапевтично ефективну кількість 5-азацитидину, з якої 5-азацитидин вивільняється по суті в шлунку і досягає значення часу досягнення максимальної концентрації в плазмі, наприклад, приблизно менше ніж 6 год., приблизно менше ніж 5 год., приблизно менше ніж 4 год., приблизно менше ніж 3 год., приблизно менше ніж 2,5 год., приблизно менше ніж 2 год., приблизно менше ніж 1,5 год., приблизно менше ніж 1 год., приблизно менше ніж 45 хв. або приблизно менше ніж 30 хв. після перорального введення. У конкретних варіантах здійснення присутність їжі може впливати на сумарний вплив (наприклад, збільшувати) і/або впливати на час досягнення максимальної концентрації в плазмі. Конкретні варіанти здійснення за цим документом стосуються фармацевтичної композиції для перорального введення, яка містить терапевтично ефективну кількість 5-азацитидину, з якої 5-азацитидин вивільняється по суті в шлунку і досягає значення часу досягнення максимальної концентрації в плазмі приблизно менше ніж 60 хвилин після перорального введення. Конкретні варіанти здійснення за цим документом стосуються будь-яких вказаних вище композицій у вигляді одиничних стандартних лікарських форм, таблеток або капсул. Серед іншого, конкретні варіанти здійснення за цим документом стосуються способів лікування суб'єкта, що має захворювання, пов'язане з аномальною клітинною проліферацією, які включають пероральне введення суб'єкту фармацевтичної композиції, що містить терапевтично ефективну кількість 5-азацитидину, де з композиції 5-азацитидин вивільняється по суті в шлунку після перорального введення суб'єкту. Додаткові варіанти здійснення за цим документом стосуються вказаних вище способів, в яких захворювання являє собою мієлодиспластичний синдром; захворювання являє собою гострий мієлобластний лейкоз; спосіб додатково включає спільне введення суб'єкту, потребуючому цього, додаткового терапевтичного засобу, вибраного з будь-яких додаткових терапевтичних засобів, описаних в цьому документі; композиція являє собою композицію з негайним вивільненням; композиція не має ентеросолюбільного покриття; композиція додатково містить посилюючий проникнення засіб; композиція додатково містить посилюючий проникнення засіб d-альфа-токоферил поліетиленгліколь 1000 сукцинат; до складу композиції додатково входить d-альфа-токоферил поліетиленгліколь 1000 сукцинат в кількості приблизно 2 % по масі відносно загальної маси складу; додатково спосіб не включає спільне введення інгібітору цитидиндеамінази і аналога цитидину; композиція являє собою одиничну стандартну лікарську форму; композиція являє собою таблетку; композиція являє собою капсулу; композиція додатково містить ексципієнт, вибраний з будь-яких ексципієнтів, описаних в цьому документі; кількість 5-азацитидину складає щонайменше приблизно 40 мг; кількість 5-азацитидину складає щонайменше приблизно 400 мг; кількість 5-азацитидину складає щонайменше приблизно 1000 мг; спосіб дозволяє досягнути значення площі під кривою щонайменше приблизно 200 нг×год./мл після перорального введення суб'єкту; спосіб дозволяє досягнути значення площі під кривою щонайменше приблизно 400 нг×год./мл після перорального введення суб'єкту; спосіб дозволяє досягнути максимальної концентрації в плазмі щонайменше приблизно 100 нг/мл після перорального введення суб'єкту; спосіб дозволяє досягнути максимальної концентрації в плазмі щонайменше приблизно 200 нг/мл після перорального введення суб'єкту; спосіб дозволяє досягнути значення часу досягнення максимальної концентрації в плазмі приблизно менше ніж 90 хвилин після 5 UA 101370 C2 5 10 15 20 25 30 35 40 45 50 55 60 перорального введення суб'єкту; і/або спосіб дозволяє досягнути значення часу досягнення максимальної концентрації в плазмі приблизно менше ніж 60 хвилин після перорального введення суб'єкту. Серед іншого, конкретні варіанти здійснення за цим документом стосуються фармацевтичних композицій, які містять терапевтично ефективну кількість 5-азацитидину, де композиції призначені для лікування захворювання або порушення, асоційованого з аномальною клітинною проліферацією, де композиції одержують для перорального введення і де композиції одержують для вивільнення 5-азацитидину по суті в шлунку. Додаткові варіанти здійснення за цим документом стосуються вказаних вище композицій, які містять 5-азацитидин в кількості приблизно 40 мг, приблизно 400 мг або приблизно 1000 мг; одержують, щоб досягати значення площі під кривою щонайменше приблизно 200 нг×год./мл або 400 нг×год./мл після перорального введення; одержують, щоб досягати максимальної концентрації в плазмі щонайменше приблизно 100 нг/мл або 200 нг/мл після перорального введення; одержують, щоб досягати значення часу досягнення максимальної концентрації в плазмі приблизно менше ніж 60 хвилин або 90 хвилин після введення; одержують у формі композиції з негайним вивільненням; одержують для перорального введення в поєднанні з додатковим терапевтичним засобом, вибраним з будь-яких додаткових терапевтичних засобів, описаних в цьому документі; призначені для лікування мієлодиспластичного синдрому або гострого мієлобластного лейкозу; додатково містять посилюючий проникнення засіб; які додатково містять посилюючий проникнення засіб d-альфа-токоферил поліетиленгліколь 1000 сукцинат; являють собою одиничні стандартні лікарські форми; являють собою таблетки або капсули; і/або додатково містять ексципієнт, вибраний з будь-яких ексципієнтів, описаних в цьому документі. Серед іншого, конкретні варіанти здійснення за цим документом стосуються використання 5азацитидину для одержання фармацевтичної композиції для лікування захворювання, асоційованого з аномальною клітинною проліферацією, де композицію одержують для перорального введення і де композицію одержують для вивільнення 5-азацитидину по суті в шлунку. Додаткові варіанти здійснення за цим документом стосуються вказаного вище використання, в якому захворювання являє собою мієлодиспластичний синдром або гострий мієлобластний лейкоз; кількість 5-азацитидину вибрана з будь-яких кількостей, описаних в цьому документі; і/або композицію одержують для негайного вивільнення. Додаткові варіанти здійснення, серед іншого, стосуються способів лікування суб'єкта, що має захворювання або порушення, передбачене в цьому документі, введенням фармацевтичних композицій, наданих в цьому документі, де лікування приводить до поліпшення виживаності суб'єкта. V. КОРОТКИЙ ОПИС КРЕСЛЕНЬ На фіг. 1 показані процеси і стадії, які можна використовувати для одержання конкретних таблеток, що містять азацитидин, для перорального дозування; в конкретних варіантах здійснення необов'язково можна пропустити одну або декілька стадій. 2 На фіг. 2 показані ФК профілі людини після підшкірного дозування азацитидину 75 мг/м в 1 і 7 добу в множинному дослідженні із збільшенням дози (n=18). По осі X відкладений час; по осі Y відкладена концентрація азацитидину в плазмі (середнє ± SD). 2 На фіг. 3 показані ФК профілі людини після ПШ (75 мг/м ) і ПО (240 мг, 300 мг і 360 мг) дозування азацитидину в множинному дослідженні із збільшенням дози. Проводили порівняння ФК профілів концентрації азацитидину в плазмі при різних дозах. По осі X відкладений час; по осі Y відкладена концентрація азацитидину в плазмі (середнє ± SD). На фіг. 4 наведені ФД дані окремого пацієнта (суб'єкт 02008, чоловік у віці 80 років, РАНБ-1, RAEB-1), зібрані в ході множинного дослідження із збільшенням дози. Пацієнту дозували склад 3 з азацитидином № 3, 240 мг. На графік нанесені кількість тромбоцитів (10 /мкл), Hgb (г/дл), АКН, 3 (ANC) (10 /мкл) і відносна кількість бластних клітин в кістковому мозку (%) залежно від дати одержання зразків в ході дослідження. На фіг. 5 наведені ФД дані окремого пацієнта (суб'єкт 02007, чоловік у віці 76 років, CMML), зібрані в ході множинного дослідження із збільшенням дози. Пацієнту дозували склад з 3 азацитидином № 3, 240 мг. На графік нанесені кількість тромбоцитів (10 /мкл), Hgb (г/дл), АКН 3 (10 /мкл) і відносна кількість бластних клітин в кістковому мозку (%) залежно від дати одержання зразків в ході дослідження. На фіг. 6 наведені ФД дані окремого пацієнта (суб'єкт 02004, чоловік у віці 61 року, МДС, MDACC), зібрані в ході множинного дослідження із збільшенням дози. Пацієнту дозували склад 3 з азацитидином № 1, 120 мг. На графік нанесені кількість тромбоцитів (10 /мкл), Hgb (г/дл), АКН 3 (10 /мкл) і відносна кількість бластних клітин в кістковому мозку (%) залежно від дати одержання зразків в ході дослідження. На фіг. 7 наведена схема дослідження для дослідження Rapid Aza Clinical Evaluation (RACE) 6 UA 101370 C2 5 10 15 20 25 30 35 40 45 50 55 60 CL008. Показані дози, які давали в різні доби в рамках циклу лікування. Час введення дози може становити ±1 доба, при умові, що інтервал між дозами складає щонайменше 48 годин. На фіг. 8 показані азацитидинові ФК профілі людини, одержані від окремого пацієнта (суб'єкт 2 106003, N=1) після ПШ (124 мг, 75 мг/м ) і ПО (180 мг, 360 мг, 1200 мг, склад № 4) дозування азацитидину в клінічному дослідженні RACE. Показані значення AUC(0-t) для ПШ і ПО доз. На фіг. 9 показані азацитидинові ФК профілі людини, одержані від окремого пацієнта (суб'єкт 2 106004, N=1) після ПШ (120 мг, 75 мг/м ) і ПО (180 мг, 360 мг, 1200 мг, склад № 6) дозування азацитидину в клінічному дослідженні RACE. Показані значення AUC(0- ) для ПШ і ПО доз. На фіг. 10 показані ФК профілі людини (лінійна шкала) після підшкірного і перорального введення азацитидину в клінічних дослідженнях. На фіг. 11 показані ФК профілі людини (напівлогарифмічна шкала) після підшкірного і перорального введення азацитидину в клінічних дослідженнях. На фіг. 12 показані значення AUC людини після ПШ дозування азацитидину і перорального дозування азацитидину в складах № 3, № 4 і № 6 при різних рівнях доз в клінічних дослідженнях (CL005 і CL008). На фіг. 13 показані значення Cmax людини у пацієнтів після ПШ дозування азацитидину і перорального дозування азацитидину в складах № 3, № 4 і № 6 при різних рівнях доз в клінічних дослідженнях. На фіг. 14 показана відносна біодоступність при пероральному введенні людям після перорального дозування азацитидину в складах № 3, № 4 і № 6 при різних рівнях доз. На фіг. 15 показаний процент впливу у людей відносно ПШ введення після перорального дозування азацитидину в складах № 3, № 4 і № 6 при різних рівнях доз. На фіг. 16 показані профілі концентрації в плазмі людини залежно від часу (лінійна шкала) після перорального дозування азацитидину в складах № 3 і № 6 і 180 мг (n=6). На фіг. 17 показані профілі концентрації в плазмі людини (нг/мл) (лінійна шкала) залежно від часу (год.) після перорального дозування азацитидину в складах № 3 і № 6 і 360 мг (n=6). На фіг. 18 показаний графік залежності окремих ("окрем.") і середніх значень AUC (0- ) (нг×год./мл) азацитидину від дози азацитидину (мг) і розраховані прямі лінійної регресії для складів № 3 і № 6. На фіг. 19 показане порівняння відносної біодоступності азацитидину при пероральному введенні (%) (середнє ± SD) залежно від дози азацитидину (мг) після дозування в складах № 3 або № 6. На фіг. 20 показане порівняння впливу азацитидину в порівнянні з ПШ дозою (середнє ± SD) залежно від дози азацитидину (мг) після перорального введення складу № 3 або № 6. VI. ДОКЛАДНИЙ ОПИС Якщо не визначене інше, всі технічні і наукові терміни, використані в цьому документі, мають таке значення, в якому їх звичайно розуміє фахівець в даній галузі. Всі публікації і патенти, вказані в цьому документі, включені в цей документ по посиланню в повному обсязі. А. Визначення У описі і формулі винаходу, що додається, використання єдиної форми включає множинну форму, а також окремі об'єкти, що позначаються, якщо контекст явно не диктує інше. Термін "близько" або "приблизно" означає допустиму похибку для конкретного значення, встановлену фахівцями в даній галузі, яка частково залежить від того, як це значення вимірюють або встановлюють. У певних варіантах здійснення термін "близько" або "приблизно" означає похибку в межах 1, 2, 3 або 4 стандартних відхилень. У певних варіантах здійснення термін "близько" або "приблизно" означає похибку в межах 30 %, 25 %, 20 %, 15 %, 10 %, 9 %, 8 %, 7 %, 6 %, 5 %, 4 %, 3 %, 2 %, 1 %, 0,5 %, 0,1 % або 0,05 % від заданого значення або діапазону. Як застосовують в цьому документі, і якщо не вказане інше, терміни "лікувати" і "лікування" стосуються усунення або зменшення інтенсивності захворювання або порушення або одного або декількох симптомів, асоційованих із захворюванням або порушенням. У певних варіантах здійснення терміни стосуються мінімізації поширення або збільшення тяжкості захворювання або порушення внаслідок введення одного або декількох профілактичних або терапевтичних засобів суб'єкту з таким захворюванням або порушенням. У деяких варіантах здійснення терміни стосуються введення сполуки або лікарської форми, наданої в цьому документі, яка містить або не містить один або декілька додаткових активних засобів, після початку симптомів конкретного захворювання. Як застосовують в цьому документі, і якщо не вказане інше, терміни "попереджати", "попередження" і "превентивне лікування" стосуються попередження початку, рецидиву або поширення захворювання або порушення або одного або декількох його симптомів. У певних 7 UA 101370 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіантах здійснення терміни стосуються лікування з використанням або введенням наданої в цьому документі сполуки або лікарської форми, яка містить або не містить один або декілька інших додаткових активних засобів, до початку симптомів, зокрема, суб'єктам з ризиком захворювання або порушення, передбаченого в цьому документі. Терміни включають інгібування або ослаблення симптому конкретного захворювання. Зокрема, в певних варіантах здійснення суб'єкти із захворюванням в сімейному анамнезі є кандидатами на превентивні схеми прийому. Крім того, суб'єкти, в анамнезі яких присутні рецидивуючі симптоми, також є можливими кандидатами на превентивне лікування. У цьому відношенні термін "превентивне лікування" можна використовувати взаємозамінно з терміном "профілактичне лікування". Як застосовують в цьому документі, і якщо не вказане інше, терміни "вести" і "ведення" стосуються попередження або сповільнення розвитку, поширення або ускладнення захворювання або порушення або одного або декількох його симптомів. Часто позитивний вплив, який суб'єкт одержує від профілактичного і/або терапевтичного засобу, не приводить до лікування захворювання або порушення. У цьому відношенні термін "ведення" включає лікування суб'єкта, який страждав від конкретного захворювання, в спробі попередити або мінімізувати рецидив захворювання. Як застосовують в цьому документі, зменшення інтенсивності симптомів конкретного порушення за допомогою введення конкретної фармацевтичної композиції стосується будьякого зменшення, постійного або тимчасового, стійкого або скороминущого, яке можна пояснити введенням композиції або пов'язати з ним. Як застосовують в цьому документі, і якщо не вказане інше, терміни "терапевтично ефективна кількість" і "ефективна кількість" сполуки означають кількість, достатню для забезпечення терапевтичної користі при лікуванні або веденні захворювання або порушення або для затримки або мінімізації одного або декількох симптомів, асоційованих із захворюванням або порушенням. "Терапевтично ефективна кількість" і "ефективна кількість" сполуки означають кількість терапевтичного засобу, окремо або в поєднанні з одним або декількома іншими засобами, яка забезпечує терапевтичну користь при лікуванні або веденні захворювання або порушення. Терміни "терапевтично ефективна кількість" і "ефективна кількість" можуть включати кількість, яка поліпшує терапію загалом, дозволяє уникнути або знижує симптоми або причини захворювання або порушення або збільшує терапевтичну ефективність іншого терапевтичного засобу. Як застосовують в цьому документі, і якщо не вказане інше, "профілактично ефективна кількість" сполуки являє собою кількість, достатню для попередження захворювання або порушення або попередження його рецидиву. Профілактично ефективна кількість сполуки означає кількість терапевтичного засобу, окремо або в поєднанні з одним або декількома іншими засобами, яка забезпечує профілактичну користь при превентивному лікуванні захворювання. Термін "профілактично ефективна кількість" може включати кількість, яка поліпшує профілактичне лікування загалом або збільшує профілактичну ефективність іншого профілактичного засобу. "Пухлина", як застосовують в цьому документі, стосується будь-якого росту або проліферації неопластичних клітин, злоякісних або доброякісних, і будь-яких передзлоякісних і злоякісних клітин і тканин. "Неопластичний", як застосовують в цьому документі, стосується будь-якої форми порушення або відсутності регуляції клітинного росту, злоякісної або доброякісної, яка приводить до аномального росту тканини. Таким чином, "неопластичні клітини" включають злоякісні і доброякісні клітини, у яких порушена або відсутня регуляція клітинного росту. Терміни "злоякісна пухлина" і "злоякісний" стосуються або описують фізіологічний стан ссавця, який, як правило, відрізняється нерегульованим клітинним ростом. Приклади злоякісних пухлин включають як необмежувальні приклади злоякісні пухлини гемопоетичного походження (наприклад, лімфому, лейкоз) і солідні пухлини. Терміни "композиція", "склад" і "лікарська форма", як застосовують в цьому документі, призначені для того, щоб включати композиції, що містять вказаний компонент(и) (у вказаних кількостях, якщо указано), а також будь-який продукт(и), одержаний напряму або непрямо внаслідок комбінування вказаного компонента(ів) у вказаній кількості(ах). Під "фармацевтичним" або "фармацевтично прийнятним" мається на увазі, що будь-який розріджувач(і), ексципієнт(и) або носій(ї) в композиції, складі або лікарській формі сумісний з іншим компонентом(ами) і не несе шкоди реципієнту. Якщо не вказане інше, терміни "композиція", "склад" і "лікарська форма" використовуються в цьому документі взаємозамінно. Термін "негайне вивільнення" при використанні в цьому документі застосовно до композиції, складу або лікарської форми, наданих в цьому документі, означає, що композиція, склад або 8 UA 101370 C2 5 10 15 20 25 30 35 40 45 50 55 60 лікарська форма не містить компонент (наприклад, покриття), який призначений для просторової або тимчасової затримки вивільнення деяких або всіх АФК з композиції, складу або лікарської форми після шлунка при пероральному введенні. У певних варіантах здійснення композиція, склад або лікарська форма з негайним вивільненням являє собою те, що вивільняє АФК по суті в шлунку після перорального введення. У конкретних варіантах здійснення композиція, склад або лікарська форма з негайним вивільненням являє собою те, що не забезпечує відстрочене вивільнення. У конкретних варіантах здійснення композиція, склад або лікарська форма з негайним вивільненням являє собою лікарську форму, яка не містить ентеросолюбільне покриття. Термін "не покритий ентеросолюбільним покриттям" при використанні в цьому документі стосується фармацевтичної композиції, складу або лікарської форми, які не містять покриття, призначеного для вивільнення активного інгредієнта(ів) після шлунка (наприклад, в кишечнику). У певних варіантах здійснення композиція, склад або лікарська форма, не покрита ентеросолюбільним покриттям, призначена для вивільнення активного інгредієнта(ів) по суті в шлунку. Термін "по суті в шлунку" при використанні в цьому документі відносно композиції, складу або лікарської форми, передбачених в цьому документі, означає, що щонайменше приблизно 99 %, щонайменше приблизно 95 %, щонайменше приблизно 90 %, щонайменше приблизно 85 %, щонайменше приблизно 80 %, щонайменше приблизно 75 %, щонайменше приблизно 70 %, щонайменше приблизно 65 %, щонайменше приблизно 60 %, щонайменше приблизно 55 %, щонайменше приблизно 50 %, щонайменше приблизно 45 %, щонайменше приблизно 40 %, щонайменше приблизно 35 %, щонайменше приблизно 30 %, щонайменше приблизно 25 %, щонайменше приблизно 20 %, щонайменше приблизно 15 % або щонайменше приблизно 10 % аналога цитидину вивільняється в шлунку. Термін "вивільняється в шлунку" і пов'язані терміни, як застосовують в цьому документі, стосуються процесу, за допомогою якого аналог цитидину зроблений доступним для засвоєння або транспорту клітинами, що вистилають шлунок, і, отже, зроблений доступним для організму. За визначенням, в цьому документі термін "суб'єкт" включає тварин, таких як ссавці, включаючи як необмежувальні приклади приматів (наприклад, людину), корів, овець, кіз, коней, собак, кішок, кроликів, щурів, мишей і т. п. В конкретних варіантах здійснення суб'єктом є людина. Терміни "спільне введення" і "в поєднанні з" включають одночасне, паралельне або послідовне введення двох або більше терапевтичних засобів без конкретних часових обмежень. У одному з варіантів здійснення засоби присутні в клітині або в організмі суб'єкта одночасно або виявляють свій біологічний або терапевтичний ефект одночасно. У одному з варіантів здійснення терапевтичні засоби знаходяться в одній композиції або стандартній лікарській формі. У інших варіантах здійснення терапевтичні засоби знаходяться в окремих композиціях або стандартних лікарських формах. У певних варіантах здійснення перший засіб можна вводити до (наприклад, за 5 хвилин, 15 хвилин, 30 хвилин, 45 хвилин, 1 годину, 2 години, 4 години, 6 годин, 12 годин, 24 години, 48 годин, 72 години, 96 годин, 1 тиждень, 2 тижні, 3 тижні, 4 тижні, 5 тижнів, 6 тижнів, 8 тижнів або 12 тижнів до), паралельно або після (наприклад, через 5 хвилин, 15 хвилин, 30 хвилин, 45 хвилин, 1 годину, 2 години, 4 години, 6 годин, 12 годин, 24 години, 48 годин, 72 години, 96 годин, 1 тиждень, 2 тижні, 3 тижні, 4 тижні, 5 тижнів, 6 тижнів, 8 тижнів або 12 тижнів після) введення другого терапевтичного засобу. Термін "ізотопний склад" стосується кількості кожного ізотопу, присутнього в даному положенні атома, а "природний ізотопний склад" стосується ізотопного складу, що зустрічається в природі, або відносного вмісту в даному положенні атома. Положення атомів, що мають природні ізотопні склади, також можуть позначатися в цьому документі як "незбагачені". Якщо не вказане інше, положення атомів в сполуках, перерахованих в цьому документі, означають будь-який стабільний ізотоп цього атома. Наприклад, якщо не вказане інше, коли положення конкретно позначене як "Н" або "водень", мається на увазі, що положення містить водень з природним ізотопним складом. Термін "ізотопно збагачений" стосується положення атома, що має ізотопний склад, відмінний від природного ізотопного складу атома. "Ізотопно збагачений" також може стосуватися сполуки, яка містить щонайменше одне положення атома, що має ізотопний склад, відмінний від природного ізотопного складу цього атома. Як застосовують в цьому документі, "ізотополог" являє собою ізотопно збагачену сполуку. Термін "ізотопне збагачення" стосується процентного вмісту кількості конкретного ізотопу, введеного в дане положення атома в молекулі замість атома з природним ізотопним складом. Наприклад, збагачення дейтерієм в даному положенні, що дорівнює 1 %, означає, що 1 % 9 UA 101370 C2 5 10 15 20 25 30 35 40 45 50 55 60 молекул в даному зразку містить дейтерій у вказаному положенні. Оскільки поширення дейтерію, яке зустрічається в природі, становить приблизно 0,0156 %, то в сполуці, синтезованій з використанням незбагачених вихідних речовин, в будь-якому положенні збагачення дейтерієм становить приблизно 0,0156 %. Термін "коефіцієнт збагачення ізотопом" стосується співвідношення ізотопного складу і природного ізотопного складу вказаного ізотопу. Коли відносно сполук, передбачених в цьому документі, визначено, що в конкретному положенні атома міститься дейтерій або "D", то потрібно розуміти, що відносний вміст дейтерію в цьому положенні по суті вище природного відносного вмісту дейтерію, що становить приблизно 0,015 %. Мінімальний коефіцієнт збагачення ізотопом в положеннях, позначених як такі, що містять дейтерій, в конкретних варіантах здійснення, як правило, складає щонайменше 1000 (введення 15 % дейтерію), щонайменше 2000 (введення 30 % дейтерію), щонайменше 3000 (введення 45 % дейтерію), щонайменше 3500 (введення 52,5 % дейтерію), щонайменше 4000 (введення 60 % дейтерію), щонайменше 4500 (введення 67,5 % дейтерію), щонайменше 5000 (введення 75 % дейтерію), щонайменше 5500 (введення 82,5 % дейтерію), щонайменше 6000 (введення 90 % дейтерію), щонайменше 6333,3 (введення 95 % дейтерію), щонайменше 6466,7 (введення 97 % дейтерію), щонайменше 6600 (введення 99 % дейтерію) або щонайменше 6633,3 (введення 99,5 % дейтерію) в кожному позначеному положенні дейтерію. Ізотопне збагачення і коефіцієнт збагачення ізотопом для сполук, наданих в цьому документі, можна визначити, використовуючи стандартні аналітичні способи, відомі фахівцю в даній галузі, включаючи, наприклад, мас-спектрометрію, ядерну магнітно-резонансну спектроскопію і кристалографію. В. Аналоги цитидину 1. Огляд У цьому документі надані лікарські форми, фармацевтичні склади і композиції, що містять аналоги цитидину, які вивільняють АФК по суті в шлунку після перорального введення. У певних варіантах здійснення аналогом цитидину є 5-азацитидин. У певних варіантах здійснення аналогом цитидину є 5-аза-2'-дезоксицитидин (децитабін або 5-аза-CdR). У певних варіантах здійснення аналогом цитидину є, наприклад, 1-β-D-арабінофуранозилцитозин (цитарабін або ара-С); псевдоізоцитидин (psi ICR); 5-фтор-2'-дезоксицитидин (FCdR); 2'-дезокси-2',2'дифторцитидин (гемцитабін); 5-аза-2'-дезокси-2',2'-дифторцитидин; 5-аза-2'-дезокси-2'фторцитидин; 1-β-D-рибофуранозил-2(1H)-піримідинон (зебуларин); 2',3'-дидезокси-5-фтор-3'тіацитидин (емтрива); 2'-циклоцитидин (анцитабін); 1-β-D-арабінофуранозил-5-азацитозин 4 (фазарабін або ара-АС); 6-азацитидин (6-аза-CR); 5,6-дигідро-5-азацитидин (dH-аза-CR); N 4 пентилоксикарбоніл-5'-дезокси-5-фторцитидин (капецитабін); N -октадецилцитарабін; цитарабін елаїдинової кислоти; або спряжена сполука, яка містить аналог цитидину і жирну кислоту (наприклад, кон'югат азацитидин-жирна кислота, включаючи як необмежувальні приклади CP4200 (Clavis Pharma ASA) або сполуку, описану в WO 2009/042767, таку як складний ефір аза-С5'-петроселінової кислоти або складний ефір аза-С-5'-петроселаїдової кислоти). У певних варіантах здійснення аналоги цитидину, передбачені в цьому документі, включають етерифіковані похідні аналогів цитидину, наприклад, такі як етерифіковані похідні 5азацитидину. У конкретних варіантах здійснення етерифіковані похідні являють собою аналоги цитидину, які містять складноефірний фрагмент (наприклад, ацетильну групу) в одному або декількох положеннях в молекулі аналога цитидину. Етерифіковані похідні можна одержати будь-яким відомим в даній галузі способом. У певних варіантах здійснення етерифіковані похідні аналога цитидину виконують функцію проліків аналога цитидину, так що, наприклад, після введення етерифікованого похідного, щоб одержати аналог цитидину, похідне деацетилюється in vivo. Конкретний варіант здійснення за даним документом стосується 2',3',5'триацетил-5-азацитидину (ТАЦ), який має придатні фізико-хімічні і терапевтичні властивості. Див., наприклад, міжнародну публікацію № WO 2008/092127 (міжнародна заявка № PCT/US2008/052124); Ziemba A. J., et al., "Development of Oral Demethylating Agents for the Treatment of Myelodysplastic Syndrome" (реферат № 3369) в "Proceedings of the 100th Annual Meeting of the American Association for Cancer Research"; 2009 Apr. 18-22; Denver, Co. Philadelphia (PA): AACR; 2009 (обидва джерела включені в цей документ по посиланню в повному обсязі). У певних варіантах здійснення аналоги цитидину, надані в цьому документі, включають будь-які сполуки, які мають структурну схожість з цитидином або дезоксицитидином і функціонально імітують і/або антагонізують дію цитидину або дезоксицитидину. Певні варіанти здійснення за даним документом стосуються солей, співкристалів, сольватів (наприклад, гідратів), комплексів, проліків, попередників, метаболітів і/або інших похідних аналогів цитидину, 10 UA 101370 C2 5 10 15 20 25 наданих в цьому документі. Наприклад, конкретні варіанти здійснення стосуються солей, співкристалів, сольватів (наприклад, гідратів), комплексів, попередників, метаболітів і/або інших похідних 5-азацитидину. Певні варіанти здійснення стосуються аналогів цитидину, які не є солями, співкристалами, сольватами (наприклад, гідратами) або комплексами аналогів цитидину, наданих в цьому документі. Наприклад, конкретні варіанти здійснення стосуються 5азацитидину в неіонізованій, несольватованій (наприклад, безводній), не утворюючій комплекс формі. Певні варіанти здійснення за цим документом стосуються сумішей з двох або більше аналогів цитидину, наданих в цьому документі. Аналоги цитидину, надані в цьому документі, можна одержати, використовуючи способи і процедури синтезу, вказані в цьому документі або, в інших випадках, доступні з літератури. Наприклад, конкретні способи синтезу 5-азацитидину викладені, наприклад, в патенті США № 7038038 і літературних джерелах, обговорюваних в цьому документі, які включені в цей документ як посилання. 5-Азацитидин також доступний в компанії Celgene Corporation, Warren, NJ. Інші аналоги цитидину, надані в цьому документі, можна одержати, використовуючи раніше описані процедури синтезу, які доступні фахівцю в даній галузі. У певних варіантах здійснення ілюстративні аналоги цитидину мають структури, які надані нижче: 2. Ізотопно збагачені аналоги цитидину Конкретні варіанти здійснення за цим документом стосуються ізотопно збагачених аналогів цитидину, їх проліків, їх проміжних продуктів синтезу і їх метаболітів. Наприклад, конкретні варіанти здійснення за цим документом стосуються ізотопно збагаченого 5-азацитидину. Раніше для деяких класів лікарських засобів продемонстроване ізотопне збагачення (наприклад, дейтерування) фармацевтичних засобів для удосконалення фармакокінетики (ФК), фармакодинаміки (ФД) і профілів токсичності. Див., наприклад, Lijinsky et al., Food Cosmet. Toxicol., 20: 393 (1982); Lijinsky et al., J. Nat. Cancer Inst., 69: 1127 (1982); Mangold et al., Mutation 11 UA 101370 C2 5 10 15 20 25 30 35 40 45 50 55 60 Res. 308: 33 (1994); Gordon et al., Drug Metab. Dispos., 15: 589 (1987); Zello et al., Metabolism, 43: 487 (1994); Gately et al., J. Nucl. Med., 27: 388 (1986); Wade D., Chem. Biol. Interact. 117: 191 (1999). Не обмежуючись якою-небудь конкретною теорією, ізотопне збагачення лікарського засобу можна використовувати, наприклад, для (1) зменшення кількості або усунення небажаних метаболітів; (2) збільшення часу напівжиття вихідного лікарського засобу; (3) зменшення числа доз, яке необхідне для досягнення бажаного ефекту; (4) зниження рівня дози, який необхідний для досягнення бажаного ефекту; (5) посилення утворення активних метаболітів, якщо вони утворюються; і/або (6) зниження утворення шкідливих метаболітів в конкретних тканинах і/або створення більш ефективного лікарського засобу і/або більш безпечного лікарського засобу для комбінованого лікування, з розрахунком на комбіноване лікування або без нього. Заміщення атома одним з його ізотопів часто може приводити до зміни швидкості хімічної реакції. Цей феномен відомий як кінетичний ізотопний ефект ("КІЕ"). Наприклад, якщо відбувається руйнування зв'язку C-H в ході стадії хімічної реакції, що визначає швидкість реакції (тобто стадії з найбільшою енергією перехідного стану), заміна цього водню дейтерієм викликає зниження швидкості реакції і процес сповільниться. Цей феномен відомий як кінетичний ізотопний ефект дейтерію ("КІЕД"). Див., наприклад, Foster et al., Adv. Drug Res., тому 14, стор. 1-36 (1985); Kushner et al., Can. J. Physiol. Pharmacol., том 77, стор. 79-88 (1999). Величину КІЕД можна виразити як відношення між швидкостями даної реакції, в якій відбувається руйнування зв'язку C-H, і такої ж реакції, в якій водень замінений дейтерієм. КІЕД може знаходитися в діапазоні приблизно від 1 (ізотопний ефект відсутній) до дуже великих значень, таких як 50 або більше, які означають, що реакція може протікати в п'ятдесят або більше разів повільніше, коли водень замінюють дейтерієм. Не обмежуючись конкретною теорією, високі значення КІЕД можуть бути частково зумовлені феноменом, відомим як тунелювання, який є наслідком принципу невизначеності. Тунелювання приписують малій масі атома водню, і відбувається воно тому, що перехідні стани, в які залучений протон, можуть іноді виникати за відсутності необхідної енергії активації. Оскільки дейтерій має більш значну масу, ніж водень, статистично він має значно більш низьку імовірність піддатися цьому феномену. Тритій ("Т") є радіоактивним ізотопом водню, який використовується в дослідженнях, термоядерних реакторах, генераторах нейтронів і радіофармацевтичних препаратах. Тритій являє собою атом водню, який містить 2 нейтрони в ядрі і має атомну масу, близьку до 3. В природному навколишньому середовищі він зустрічається в дуже низьких концентраціях і частіше за все виявляється у вигляді T 2O. Тритій розпадається повільно (час напівжиття=12,3 року) і випромінює низькоенергетичні бета-частинки, які не можуть проникати через зовнішній шар шкіри людини. Внутрішнє опромінення є основною загрозою, пов'язаною з цим ізотопом, однак треба проковтнути велику його кількість, щоб він представляв значний ризик для здоров'я. У порівнянні з дейтерієм, для досягнення небезпечного рівня тритію треба вжити меншу його кількість. Крім того, заміна водню тритієм ("Т") веде до утворення більш міцного зв'язку, ніж заміна дейтерієм, і дає кількісно більш виражені ізотопні ефекти. Подібним чином, заміна ізотопами інших елементів, включаючи як необмежувальні 13 14 33 34 36 15 17 приклади заміну вуглецю на C або C, сірки на S, S або S, азоту на N і кисню на O або 18 O, може вести до аналогічного кінетичного ізотопного ефекту. Організм тварини експресує множину ферментів, призначених для видалення з кровоносної системи чужорідних речовин, таких як терапевтичні засоби. Приклади таких ферментів включають ферменти сімейства цитохрому P450 ("CYP"), естерази, протеази, редуктази, дегідрогенази і моноаміноксидази для здійснення реакції з цими чужорідними речовинами і перетворення їх в більш полярні проміжні продукти або метаболіти для виведення через нирки. Деякі найбільш поширені метаболічні реакції фармацевтичних сполук включають окислення вуглець-водневого (C-H) зв'язку у вуглець-кисневий (C-O) зв'язок або у вуглець-вуглецевий (CC) pi-зв'язок. Одержувані метаболіти можуть бути стабільними або нестабільним при фізіологічних умовах і можуть мати по суті різні фармакокінетичні, фармакодинамічні профілі і профілі гострої і довгострокової токсичності в порівнянні з вихідними сполуками. Таке окислення багатьох лікарських засобів відбувається швидко. У результаті, ці лікарські засоби часто вимагають введення декількох або високих добових доз. При ізотопному збагаченні в певних положеннях сполуки, наданої в цьому документі, можна одержати КІЕ, що піддається виявленню, який впливає на фармакокінетичні, фармакологічні і/або токсикологічні профілі сполуки, наданої в цьому документі, в порівнянні з аналогічною сполукою, що має природний ізотопний склад. У одному з варіантів здійснення збагачення дейтерієм здійснюють в місці розщеплення зв'язку C-H в ході метаболізму. Певні варіанти здійснення за цим документом стосуються збагачених дейтерієм аналогів 5 12 UA 101370 C2 азацитидину, де один або декілька атомів водню в молекулі 5-азацитидину ізотопно збагачені дейтерієм. Певні варіанти здійснення за цим документом стосуються сполук формули (I): 1 5 10 2 3 4 5 6 7 де один або декілька атомів Y (тобто Y , Y , Y , Y , Y , Y і Y ) являють собою атоми водню, ізотопно збагачені дейтерієм, а всі інші атоми Y являють собою незбагачені атоми водню. У конкретних варіантах здійснення один, два, три, чотири, п'ять, шість або сім вказаних атомів Y ізотопно збагачені дейтерієм, а всі інші атоми Y являють собою незбагачені атоми водню. У певних варіантах здійснення один або декілька атомів Y в рибозному фрагменті сполуки (I) збагачені дейтерієм. Конкретні приклади включають як необмежувальні приклади наступні сполуки, в яких помітка "D" вказує положення атома, збагаченого дейтерієм, тобто зразок містить дану сполуку, в якій збагачення дейтерієм у вказаному положенні(ях) перевищує природний відносний вміст дейтерію: 13 UA 101370 C2 У певних варіантах здійснення атом Y в 5-азацитозиновому фрагменті сполуки (I) збагачений дейтерієм. Конкретний варіант включає наступну сполуку, в якій помітка "D" вказує положення атома, збагаченого дейтерієм, тобто зразок містить дану сполуку, в якій збагачення дейтерієм у вказаному положенні(ях) перевищує природний відносний вміст дейтерію: 5 10 У певних варіантах здійснення один або декілька атомів Y в рибозному фрагменті і атом Y в 5-азацитозиновому фрагменті сполуки (I) збагачені дейтерієм. Конкретні приклади включають як необмежувальні приклади наступні сполуки, в яких помітка "D" вказує положення атома, збагаченого дейтерієм, тобто зразок містить дану сполуку, в якій збагачення дейтерієм у вказаному положенні(ях) перевищує природний відносний вміст дейтерію: 14 UA 101370 C2 5 10 15 Мається на увазі, що при фізіологічних умовах може відбуватися заміна одного або декількох атомів дейтерію на атоми водню. Певні варіанти здійснення за цим документом стосуються збагачених вуглецем-13 аналогів 5-азацитидину, де один або декілька атомів вуглецю в молекулі 5-азацитидину ізотопно збагачені вуглецем-13. Певні варіанти здійснення за цим документом стосуються сполук формули (II): де один або декілька атомів вуглецю з 1, 2, 3, 4, 5, 6, 7 або 8 атомів вуглецю ізотопно збагачені вуглецем-13, а всі інші атоми з 1, 2, 3, 4, 5, 6, 7 або 8 атомів являють собою незбагачені атоми вуглецю. У конкретних варіантах здійснення один, два, три, чотири, п'ять, шість, сім або вісім атомів вуглецю (тобто 1, 2, 3, 4, 5, 6, 7 і 8 атомів) ізотопно збагачені вуглецем-13, а всі інші атоми вуглецю не збагачені. У певних варіантах здійснення один або декілька атомів вуглецю в рибозному фрагменті сполуки (II) збагачені вуглецем-13. Конкретні приклади включають як необмежувальні приклади наступні сполуки, в яких зірочкою ("*") вказані положення атомів, збагачені вуглецем-13, тобто зразок містить дану сполуку, в якій збагачення вуглецем-13 у вказаному положенні(ях) перевищує природний відносний вміст вуглецю-13: 15 UA 101370 C2 і 5 У певних варіантах здійснення один або декілька атомів вуглецю в 5-азацитозиновому фрагменті сполуки (II) збагачені вуглецем-13. Конкретні приклади включають як необмежувальні приклади наступні сполуки, в яких зірочкою ("*") вказані положення атомів, збагачені вуглецем13, тобто зразок містить дану сполуку, в якій збагачення вуглецем-13 у вказаному положенні(ях) перевищує природний відносний вміст вуглецю-13: і 10 У певних варіантах здійснення один або декілька атомів вуглецю в рибозному фрагменті і один або декілька атомів вуглецю в 5-азацитозиновому фрагменті сполуки (II) збагачені вуглецем-13, тобто цей документ включає будь-які сполучення поєднання рибозного фрагмента вуглецем-13 і збагачення азацитозинового фрагмента вуглецем-13. 16 UA 101370 C2 5 10 15 20 25 У певних варіантах здійснення один або декілька атомів водню збагачені дейтерієм і один або декілька атомів вуглецю збагачені вуглецем-13, тобто цей документ включає будь-яке поєднання збагачення 5-азацитидину дейтерієм і вуглецем-13. 3. Синтез ізотопно збагачених аналогів цитидину Сполуки, описані в даному документі, можна синтезувати, використовуючи будь-які способи, відомі фахівцям в даній галузі. Наприклад, конкретні сполуки, описані в цьому документі, синтезували з використанням стандартних способів органічного синтезу, відомих фахівцям в даній галузі. У деяких варіантах здійснення для синтезу 5-азацитидину використовували відомі процедури, де один або декілька реактивів, вихідних речовин, попередників або проміжних продуктів замінювали на один або декілька ізотопно збагачених реактивів, вихідних речовин, попередників або проміжних продуктів, включаючи як необмежувальні приклади один або декілька збагачених дейтерієм реактивів, вихідних речовин, попередників або проміжних продуктів і/або один або декілька збагачених вуглецем-13 реактивів, вихідних речовин, попередників або проміжних продуктів. Ізотопно збагачені реактиви, вихідні речовини, попередники або проміжні продукти можна придбати на ринку або одержати за допомогою стандартних хімічних реакцій, відомих фахівцю в даній галузі. У деяких варіантах здійснення шляхи синтезу основані на тих шляхах, які описані в патенті США № 7038038, який включений в цей документ як посилання в повному обсязі. У певних варіантах здійснення як вихідну речовину можна використовувати придатну ізотопно збагачену вихідну речовину, таку як збагачена дейтерієм рибоза, збагачений дейтерієм 5-азацитозин, збагачена вуглецем-13 рибоза і/або збагачений вуглецем-13 5-азацитозин, в наступній загальній схемі одержання відповідного збагаченого дейтерієм і/або вуглецем-13 5азацитидину (див. схему 1). Додержуючись процедур з патенту США № 7038038, 5-азацитозин обробляли гексаметилдисилазаном (ГМДС), щоб одержати силілований 5-азацитозин. Тетраацетил-D-рибозу одержували реакцією D-рибози з ацетатом натрію в оцтовому ангідриді, додержуючись процедур з Brown et al., Biochemical Prepараtions, 1955, 4, 70-76. Силілований 5азацитозин з'єднували з тетраацетил-D-рибозою в присутності ТМС-трифлату і одержаний захищений 5-азацитидин обробляли метилатом натрію в метанолі, щоб одержати 5-азацитидин. Див. патент США № 7038038. 30 Схема 1 17 UA 101370 C2 5 У деяких варіантах здійснення одне або декілька положень атомів водню в рибозній частині 5-азацитидину збагачені дейтерієм. Такі аналоги 5-азацитидину можна одержати, додержуючись схеми 1, з придатної збагаченої дейтерієм рибози, придбаної в комерційному джерелі або одержаної, додержуючись процедур з літератури. Конкретні приклади збагаченої дейтерієм рибози як вихідні речовини включають як необмежувальні приклади наступні сполуки, перераховані в таблиці 1, які можна перетворити у відповідні збагачені дейтерієм аналоги 5азацитидину. ТАБЛИЦЯ 1 Вихідна речовина Структура Джерело/посилання Продукт 5-азацитидин D-рибоза-1-D Cambridge Isotope Lab. I-1 D-рибоза-2-D Cambridge Isotope Lab. I-2 D-рибоза-3-D Omicron Biochemicals, Inc. I-3 D-рибоза-4-D Omicron Biochemicals, Inc. I-4 D-рибоза-5,5'-D2 Omicron Biochemicals, Inc. I-5 D-рибоза-3,4,5,5'-D4 Одержана згідно зі схемами J. Am. Chem. Soc. 1996, 118, 7929-7940 I-6 10 15 У інших варіантах здійснення положення атома водню в кільці 5-азацитозину з 5азацитидину збагачене дейтерієм. Такий аналог 5-азацитидину можна одержати, наприклад, з дейтерованого 5-азацитозину, додержуючись схеми 1. Дейтерований 5-азацитозин можна одержати, наприклад, з придатних дейтерованих реактивів, як показано на схемі 2. Див., наприклад, Grundmann et al., Chem. Ber. 1954, 87, 19-24; Piskala et al., in Zorbach and Tipson (eds.) Synthetic Procedures in Nucleic Acid Chemistry, том 1, Wiley Interscience, New York, 1968, 107-108; Piskala, Collect. Czech. Chem. Comm. 1967, 32, 3966-3976. Схема 2 20 18 UA 101370 C2 Альтернативні умови одержання 5-азацитозину: 5 10 15 У інших варіантах здійснення як положення атома водню в кільці 5-азацитозину, так і одне або декілька положень атомів водню в рибозній частині 5-азацитидину збагачені дейтерієм. Такі аналоги 5-азацитидину можна одержати, наприклад, додержуючись схеми 1, з'єднуючи придатні дейтеровані рибозні вихідні речовини з дейтерованим 5-азацитозином. Наприклад, сполуки I-9, I-10, I-11, I-12, I-13 і I-14 можна одержати з відповідних дейтерованих рибозних вихідних речовин, перерахованих в таблиці 1, і дейтерованого 5-азацитозину, одержаного згідно зі схемою 2. У деяких варіантах здійснення один або декілька атомів вуглецю в рибозній частині 5азацитидину збагачені вуглецем-13. Такі аналоги 5-азацитидину можна одержати, додержуючись схеми 1, з придатної збагаченої вуглецем-13 рибози, придбаної в комерційному джерелі або одержаної, додержуючись процедур з літератури. Конкретні приклади збагаченої вуглецем-13 рибозної вихідної речовини, включають як необмежувальні приклади наступні сполуки, перераховані в таблиці 2, які можна перетворити у відповідні збагачені вуглецем-13 аналоги 5-азацитидину (зірочкою "*" вказане положення атома, збагаченого вуглецем-13). ТАБЛИЦЯ 2 Джерело/посилання Продукт 5азацитидин 13 Sigma Aldrich II-1 13 Sigma Aldrich II-2 13 Omicron Biochemicals, Inc. II-3 13 Omicron Biochemicals, Inc. II-4 Вихідна речовина Структура D-рибоза-1- C D-рибоза-2- C D-рибоза-3- C D-рибоза-4- C 20 19 UA 101370 C2 ПРОДОВЖЕННЯ ТАБЛИЦІ 2 Джерело/посилання Продукт 5азацитидин Cambridge Isotope Lab. II-5 13 Sigma Aldrich II-6 13 Omicron Biochemicals, Inc. II-7 13 Omicron Biochemicals, Inc. II-8 D-рибоза-2,5- C2 13 Omicron Biochemicals, Inc. II-9 D-рибоза-2,3,4,513 C4 Sigma Aldrich II-10 D-рибоза-1,2,3,4,513 C5 Cambridge Isotope Lab. II-11 Вихідна речовина Структура 13 D-рибоза-5- C D-рибоза-1,2- C2 D-рибоза-1,3- C2 D-рибоза-1,5- C2 5 У інших варіантах здійснення один або декілька атомів вуглецю в кільці 5-азацитозину збагачені вуглецем-13. Такі аналоги 5-азацитидину можна одержати із збагаченого вуглецем-13 5-азацитозину, додержуючись схеми 1. Проміжні продукти синтезу збагаченого вуглецем-13 5азацитозину можна одержати з придатних збагачених вуглецем-13 реактивів, як показано на схемі 3. Див., наприклад, Grundmann et al., Chem. Ber. 1954, 87, 19-24; Piskala et al., в Zorbach and Tipson (eds.) Synthetic Procedures in Nucleic Acid Chemistry, том 1, Wiley Interscience, New York, 1968, 107-108; Piskala, Collect. Czech. Chem. Comm. 1967, 32, 3966-3976. 10 20 UA 101370 C2 Схема 3 5 10 15 20 25 30 35 У інших варіантах здійснення одне або декілька положень атомів вуглецю в кільці 5азацитозину і одне або декілька положень атомів вуглецю в рибозній частині 5-азацитидину збагачені вуглецем-13. Такі аналоги 5-азацитидину можна одержати, додержуючись схеми 1, з'єднуючи придатні збагачені вуглецем-13 рибозні вихідні речовини з придатним збагаченим вуглецем-13 5-азацитозином. Наприклад, сполуки можна одержати із збагачених вуглецем-13 рибозних вихідних речовин, перерахованих в таблиці 2, і збагаченого вуглецем-13 5азацитозину, одержаного згідно зі схемою 3. Вищеописані шляхи і способи можна модифікувати, щоб надати ізотополог 5-азацитидину, збагачений як дейтерієм, так і вуглецем-13. C. Фармацевтичні склади 1. Огляд Варіанти здійснення за цим документом включають фармацевтичні склади і композиції, що містять один або декілька аналогів цитидину, наприклад 5-азацитидин, і необов'язково посилюючий проникнення засіб, де склади і композиції одержані для перорального введення. У конкретному варіанті здійснення склади і композиції одержані для вивільнення аналога цитидину по суті в шлунку. У конкретних варіантах здійснення аналоги цитидину, наприклад 5азацитидин, і фармацевтичні склади і композиції використовують для лікування захворювань і порушень, асоційованих з аномальною клітинною проліферацією, де аналоги цитидину, склади і композиції одержані для перорального введення, переважно для вивільнення аналогів цитидину по суті в шлунку. Конкретні варіанти здійснення стосуються використання одного або декількох аналогів цитидину, наприклад 5-азацитидину, для одержання фармацевтичних складів і композицій для лікування при конкретних медичних показаннях, передбачених в цьому документі. Фармацевтичні склади і композиції, що містять аналоги цитидину, надані в цьому документі, призначені для пероральної доставки аналога цитидину суб'єктам, потребуючим цього. Форми для пероральної доставки включають як необмежувальні приклади таблетки, капсули, каплети, розчини, суспензії і сиропи, а також можуть містити деяку кількість гранул, кульок, порошку або пелетів, які необов'язково можна капсулювати. Такі форми також можуть називатися в цьому документі "центральною частиною лікарського засобу", яка містить аналог цитидину. Конкретні варіанти здійснення за даним документом стосуються твердих пероральних лікарських форм, що являють собою таблетки або капсули. У визначених варіантах здійснення склад являє собою таблетку, що містить аналог цитидину. У визначених варіантах здійснення склад являє собою капсулу, що містить аналог цитидину. У визначених варіантах здійснення таблетки або капсули, надані в даному документі, необов'язково містять один або декілька 21 UA 101370 C2 5 10 15 20 25 30 35 40 45 50 55 60 ексципієнтів, наприклад, таких як гліданти, розріджувачі, лубриканти, барвники, дезінтегруючі засоби, гранулюючі засоби, зв'язуючи засоби, полімери і покриваючі засоби. У визначених варіантах здійснення склад являє собою таблетку з негайним вивільненням. У визначених варіантах здійснення склад являє собою таблетку з контрольованим вивільненням, що вивільняє АФК, наприклад, по суті в шлунку. У визначених варіантах здійснення склад являє собою тверду желатинову капсулу. У визначених варіантах здійснення склад являє собою м'яку желатинову капсулу. У визначених варіантах здійснення капсула являє собою капсулу з гідроксипропілметилцелюлози (ГПМЦ). У визначених варіантах здійснення склад являє собою капсулу з негайним вивільненням. У визначених варіантах здійснення склад являє собою капсулу з негайним або контрольованим вивільненням, що вивільняє АФК, наприклад, по суті в шлунку. У визначених варіантах здійснення склад являє собою таблетку, що швидко розпадається, яка розчиняється по суті в роті після введення. Визначені варіанти здійснення за даним документом включають використання аналогів цитидину, наприклад 5-азацитидину, для одержання фармацевтичної композиції для лікування захворювання, асоційованого з аномальною клітинною проліферацією, де композицію одержували для перорального введення. 2. Характеристики визначених лікарських форм, наданих у даному документі У визначених варіантах здійснення склади, що містять аналоги цитидину, наприклад, такі як 5-азацитидин, здійснюють негайне вивільнення АФК після перорального введення. У конкретних варіантах здійснення склади, що містять аналоги цитидину, наприклад, такі як 5-азацитидин, містять терапевтично або профілактично ефективну кількість аналога цитидину (і, необов'язково, один або декілька ексципієнтів) і здійснюють негайне вивільнення АФК після перорального введення. У визначених варіантах здійснення склади, що містять аналоги цитидину, наприклад, такі як 5-азацитидин, здійснюють контрольоване вивільнення АФК по суті в шлунку після перорального введення. У визначених варіантах здійснення склади, що містять аналоги цитидину, наприклад, такі як 5-азацитидин, містять терапевтично або профілактично ефективну кількість аналога цитидину і компонент, що контролює вивільнення лікарського засобу, який здатний вивільняти аналог цитидину по суті в шлунку. У визначених варіантах здійснення в складі можна використовувати матриці (наприклад, полімерні матриці) для контролю над вивільненням аналога цитидину. У визначених варіантах здійснення покриття і/або оболонки можна використовувати в складі для контролю над вивільненням аналога цитидину по суті в шлунку. У визначених варіантах здійснення склади, що містять аналоги цитидину, наприклад, такі як 5-азацитидин, вивільняють АФК по суті в шлунку після перорального введення. У визначених варіантах здійснення склади здійснюють негайне вивільнення аналога цитидину після перорального введення. У визначених варіантах здійснення склади необов'язково додатково містять компонент, що контролює вивільнення лікарського засобу, де компонент, що контролює вивільнення лікарського засобу, підібраний так, що вивільнення аналога цитидину відбувається по суті в шлунку. У конкретних варіантах здійснення компонент, що контролює вивільнення лікарського засобу, підібраний так, що вивільнення аналога цитидину носить негайний характер і відбувається по суті в шлунку. У конкретних варіантах здійснення компонент, що контролює вивільнення лікарського засобу, підібраний так, що вивільнення аналога цитидину носить уповільнений характер і відбувається по суті в шлунку. У визначених варіантах здійснення, після перорального введення, склад з аналогом цитидину, наприклад, таким як 5-азацитидин, вивільняє АФК по суті в шлунку, і, надалі, вивільняє іншу частину АФК у кишечнику. Способи, якими кваліфіковані практики можуть визначити, у якому відділі шлунковокишкового тракту суб'єкта відбувається вивільнення лікарського засобу, відомі в даній галлузі і серед інших способів включають, наприклад, сцинтиграфічні дослідження, тестування в біологічно придатному середовищі, яке імітує рідке середовище в розглянутих відділах шлунково-кишкового тракту. Конкретні варіанти здійснення за даним документом стосуються фармацевтичних складів (наприклад, пероральних складів з негайним вивільненням і/або складів, що вивільняють АФК по суті в шлунку), що містять аналог цитидину (наприклад, 5-азацитидин), що забезпечують конкретний вплив на суб'єкта, якому склад ввели перорально, у порівнянні з ПШ дозою того ж аналога цитидину. Конкретні варіанти здійснення стосуються пероральних сполук, що забезпечують щонайменше приблизно 5 %, щонайменше приблизно 10 %, щонайменше приблизно 15 %, щонайменше приблизно 20 %, щонайменше приблизно 25 %, щонайменше приблизно 30 %, щонайменше приблизно 35 %, щонайменше приблизно 40 %, щонайменше приблизно 45 %, щонайменше приблизно 50 %, щонайменше приблизно 55 %, щонайменше приблизно 60 %, щонайменше приблизно 65 %, щонайменше приблизно 70 %, щонайменше приблизно 75 %, щонайменше приблизно 80 %, щонайменше приблизно 85 %, щонайменше 22 UA 101370 C2 5 10 15 20 25 30 35 40 45 50 55 60 приблизно 90 %, щонайменше приблизно 95 % або приблизно 100 % вплив у порівнянні з ПШ дозою. У визначених варіантах здійснення склад (наприклад, пероральний склад з негайним вивільненням і/або склад, що вивільняє АФК по суті в шлунку), що містить аналог цитидину, наприклад, такий як 5-азацитидин, робить визначену процентну частку аналога цитидину в складі системно біодоступною після перорального введення. У визначених варіантах здійснення, після перорального введення складу суб'єкту, аналог цитидину в складі усмоктується по суті в шлунку і стає доступним для організму за допомогою системного впливу. У конкретних варіантах здійснення біодоступність при пероральному введенні складу, що містить аналог цитидину, наданого в даному документі, складає, наприклад, приблизно більше ніж 1 %, приблизно більше ніж 5 %, приблизно більше ніж 10 %, приблизно більше ніж 15 %, приблизно більше ніж 20 %, приблизно більше ніж 25 %, приблизно більше ніж 30 %, приблизно більше ніж 35 %, приблизно більше ніж 40 %, приблизно більше ніж 45 %, приблизно більше ніж 50 %, приблизно більше ніж 55 %, приблизно більше ніж 60 %, приблизно більше ніж 65 %, приблизно більше ніж 70 %, приблизно більше ніж 75 %, приблизно більше ніж 80 %, приблизно більше ніж 85 %, приблизно більше ніж 90 %, приблизно більше ніж 95 % або приблизно 100 % загальної кількості аналога цитидину в складі. У даній галузі відомі способи, якими кваліфіковані практики можуть оцінити біодоступність при пероральному введенні лікарської форми суб'єкту. Такі способи включають, наприклад, порівняння визначених параметрів, пов'язаних з дозуванням, таке як, але без обмеження, визначення максимальної концентрації в плазмі ("Cmax"), часу досягнення максимальної концентрації в плазмі ("Tmax") або площі під кривою ("AUC"). Конкретні варіанти здійснення за даним документом стосуються фармацевтичних складів (наприклад, пероральних складів з негайним вивільненням і/або складів, що вивільняють АФК по суті в шлунку), що містять аналог цитидину (наприклад, 5-азацитидин), що забезпечують конкретне значення AUC (наприклад, AUC(0-t) або AUC(0- )) у суб'єкта (наприклад, у людини), якому перорально ввели склад. Конкретні варіанти здійснення стосуються пероральних складів, які забезпечують значення AUC щонайменше приблизно 25 нг×год./мл, щонайменше приблизно 50 нг×год./мл, щонайменше приблизно 75 нг×год./мл, щонайменше приблизно 100 нг×год./мл, щонайменше приблизно 150 нг×год./мл, щонайменше приблизно 200 нг×год./мл, щонайменше приблизно 250 нг×год./мл, щонайменше приблизно 300 нг×год./мл, щонайменше приблизно 350 нг×год./мл, щонайменше приблизно 400 нг×год./мл, щонайменше приблизно 450 нг×год./мл, щонайменше приблизно 500 нг×год./мл, щонайменше приблизно 550 нг×год./мл, щонайменше приблизно 600 нг×год./мл, щонайменше приблизно 650 нг×год./мл, щонайменше приблизно 700 нг×год./мл, щонайменше приблизно 750 нг×год./мл, щонайменше приблизно 800 нг×год./мл, щонайменше приблизно 850 нг×год./мл, щонайменше приблизно 900 нг×год./мл, щонайменше приблизно 950 нг×год./мл, щонайменше приблизно 1000 нг×год./мл, щонайменше приблизно 1100 нг×год./мл, щонайменше приблизно 1200 нг×год./мл, щонайменше приблизно 1300 нг×год./мл, щонайменше приблизно 1400 нг×год./мл, щонайменше приблизно 1500 нг×год./мл, щонайменше приблизно 1600 нг×год./мл, щонайменше приблизно 1700 нг×год./мл, щонайменше приблизно 1800 нг×год./мл, щонайменше приблизно 1900 нг×год./мл, щонайменше приблизно 2000 нг×год./мл, щонайменше приблизно 2250 нг×год./мл або щонайменше приблизно 2500 нг×год./мл. У конкретних варіантах здійснення значення AUC одержують з фармакокінетичного профілю зміни концентрації у часі, одержаного зі зразків крові тварин або добровольців після дозування. Конкретні варіанти здійснення за даним документом стосуються фармацевтичних складів (наприклад, пероральних складів з негайним вивільненням і/або складів, що вивільняють АФК по суті в шлунку), що містять аналог цитидину (наприклад, 5-азацитидин), що забезпечують конкретну максимальну концентрацію в плазмі ("Cmax") у суб'єкта, якому склад ввели перорально. Конкретні варіанти здійснення стосуються пероральних складів, що забезпечують Cmax аналога цитидину щонайменше приблизно 25 нг/мл, щонайменше приблизно 50 нг/мл, щонайменше приблизно 75 нг/мл, щонайменше приблизно 100 нг/мл, щонайменше приблизно 150 нг/мл, щонайменше приблизно 200 нг/мл, щонайменше приблизно 250 нг/мл, щонайменше приблизно 300 нг/мл, щонайменше приблизно 350 нг/мл, щонайменше приблизно 400 нг/мл, щонайменше приблизно 450 нг/мл, щонайменше приблизно 500 нг/мл, щонайменше приблизно 550 нг/мл, щонайменше приблизно 600 нг/мл, щонайменше приблизно 650 нг/мл, щонайменше приблизно 700 нг/мл, щонайменше приблизно 750 нг/мл, щонайменше приблизно 800 нг/мл, щонайменше приблизно 850 нг/мл, щонайменше приблизно 900 нг/мл, щонайменше приблизно 950 нг/мл, щонайменше приблизно 1000 нг/мл, щонайменше приблизно 1100 нг/мл, щонайменше приблизно 1200 нг/мл, щонайменше приблизно 1300 нг/мл, щонайменше 23 UA 101370 C2 5 10 15 20 25 30 35 40 45 50 55 60 приблизно 1400 нг/мл, щонайменше приблизно 1500 нг/мл, щонайменше приблизно 1600 нг/мл, щонайменше приблизно 1700 нг/мл, щонайменше приблизно 1800 нг/мл, щонайменше приблизно 1900 нг/мл, щонайменше приблизно 2000 нг/мл, щонайменше приблизно 2250 нг/мл або щонайменше приблизно 2500 нг/мл. Конкретні варіанти здійснення за даним документом стосуються фармацевтичних складів (наприклад, пероральних складів з негайним вивільненням і/або складів, що вивільняють АФК по суті в шлунку), що містять аналог цитидину (наприклад, 5-азацитидин), що забезпечують конкретний час досягнення максимальної концентрації в плазмі ("Tmax") у суб'єкта, якому склад ввели перорально. Конкретні варіанти здійснення стосуються пероральних складів, що забезпечують Tmax аналога цитидину приблизно менше ніж 10 хв., приблизно менше ніж 15 хв., приблизно менше ніж 20 хв., приблизно менше ніж 25 хв., приблизно менше ніж 30 хв., приблизно менше ніж 35 хв., приблизно менше ніж 40 хв., приблизно менше ніж 45 хв., приблизно менше ніж 50 хв., приблизно менше ніж 55 хв., приблизно менше ніж 60 хв., приблизно менше ніж 65 хв., приблизно менше ніж 70 хв., приблизно менше ніж 75 хв., приблизно менше ніж 80 хв., приблизно менше ніж 85 хв., приблизно менше ніж 90 хв., приблизно менше ніж 95 хв., приблизно менше ніж 100 хв., приблизно менше ніж 105 хв., приблизно менше ніж 110 хв., приблизно менше ніж 115 хв., приблизно менше ніж 120 хв., приблизно менше ніж 130 хв., приблизно менше ніж 140 хв., приблизно менше ніж 150 хв., приблизно менше ніж 160 хв., приблизно менше ніж 170 хв., приблизно менше ніж 180 хв., приблизно менше ніж 190 хв., приблизно менше ніж 200 хв., приблизно менше ніж 210 хв., приблизно менше ніж 220 хв., приблизно менше ніж 230 хв. або приблизно менше ніж 240 хв. У конкретних варіантах здійснення значення Tmax вимірюють з того моменту часу, коли перорально ввели склад. Конкретні варіанти здійснення за даним документом стосуються пероральних лікарських форм, що містять аналог цитидину, де пероральні лікарські форми мають ентеросолюбільне покриття. Конкретні варіанти здійснення стосуються проникного або частково проникного (наприклад, "пропускаючого") ентеросолюбільного покриття з порами. У конкретних варіантах здійснення таблетка з проникним або частково проникним ентеросолюбільним покриттям негайно вивільняє 5-азацитидин по суті в шлунку. 3. Розробка визначених лікарських форм, наданих у даному документі У даному документі надані лікарські форми, розроблені для максимального збільшення усмоктування і/або ефективної доставки визначених аналогів цитидину, наприклад 5азацитидину, після перорального введення, наприклад, для вивільнення по суті в шлунку. Таким чином, визначені варіанти здійснення за даним документом стосуються твердої пероральної лікарської форми аналога цитидину, наприклад, такого як 5-азацитидин, у якій використані фармацевтичні ексципієнти, призначені для негайного вивільнення АФК після перорального введення, наприклад, по суті в шлунку. Конкретні склади з негайним вивільненням містять конкретну кількість аналога цитидину і необов'язково один або декілька ексципієнтів. У визначених варіантах здійснення склад може являти собою таблетку з негайним вивільненням або капсулу з негайним вивільненням (наприклад, таку як капсула з ГПМЦ). У даному документі надані способи одержання складів, які надані у даному документі й містять аналоги цитидину, надані в даному документі (наприклад, пероральних складів з негайним вивільненням і/або складів, що вивільняють АФК по суті в шлунку). У конкретних варіантах здійснення склади, надані в даному документі, можна одержати стандартними способами, які відомі професіоналам в галузі фармацевтичних сполук і описані, наприклад, у відповідних посібниках. Див., наприклад, REMINGTON, THE SCIENCE AND PRACTICE OF PHARMACY, 20th Edition, Lippincott Williams & Wilkins, (2000); ANSEL et al., PHARMACEUTICAL DOSAGE FORMS AND DRUG DELIVERY SYSTEMS, 7th Edition, Lippincott Williams & Wilkins, (1999); GIBSON, PHARMACEUTICAL PREFORMULATION AND FORMULATION, CRC Press (2001). У конкретних варіантах здійснення склади, надані в даному документі (наприклад, пероральні склади з негайним вивільненням, склади, що вивільняють АФК по суті в шлунку, або склади, що швидко розпадаються, які розчиняються по суті в роті), містять конкретну кількість аналога цитидину, наприклад, такого як 5-азацитидин. У конкретних варіантах здійснення конкретна кількість аналога цитидину в складі складає, наприклад, приблизно 10 мг, приблизно 20 мг, приблизно 40 мг, приблизно 60 мг, приблизно 80 мг, приблизно 100 мг, приблизно 120 мг, приблизно 140 мг, приблизно 160 мг, приблизно 180 мг, приблизно 200 мг, приблизно 220 мг, приблизно 240 мг, приблизно 260 мг, приблизно 280 мг, приблизно 300 мг, приблизно 320 мг, приблизно 340 мг, приблизно 360 мг, приблизно 380 мг, приблизно 400 мг, приблизно 420 мг, приблизно 440 мг, приблизно 460 мг, приблизно 480 мг, приблизно 500 мг, приблизно 600 мг, 24 UA 101370 C2 5 10 15 20 25 30 35 40 45 50 55 60 приблизно 700 мг, приблизно 800 мг, приблизно 900 мг, приблизно 1000 мг, приблизно 1100 мг, приблизно 1200 мг, приблизно 1300 мг, приблизно 1400 мг, приблизно 1500 мг, приблизно 1600 мг, приблизно 1700 мг, приблизно 1800 мг, приблизно 1900 мг, приблизно 2000 мг, приблизно 2100 мг, приблизно 2200 мг, приблизно 2300 мг, приблизно 2400 мг, приблизно 2500 мг, приблизно 3000 мг, приблизно 4000 мг або приблизно 5000 мг. У конкретних варіантах здійснення конкретна кількість аналога цитидину в складі складає, наприклад, щонайменше приблизно 10 мг, щонайменше приблизно 20 мг, щонайменше приблизно 40 мг, щонайменше приблизно 60 мг, щонайменше приблизно 80 мг, щонайменше приблизно 100 мг, щонайменше приблизно 120 мг, щонайменше приблизно 140 мг, щонайменше приблизно 160 мг, щонайменше приблизно 180 мг, щонайменше приблизно 200 мг, щонайменше приблизно 220 мг, щонайменше приблизно 240 мг, щонайменше приблизно 260 мг, щонайменше приблизно 280 мг, щонайменше приблизно 300 мг, щонайменше приблизно 320 мг, щонайменше приблизно 340 мг, щонайменше приблизно 360 мг, щонайменше приблизно 380 мг, щонайменше приблизно 400 мг, щонайменше приблизно 420 мг, щонайменше приблизно 440 мг, щонайменше приблизно 460 мг, щонайменше приблизно 480 мг, щонайменше приблизно 500 мг, щонайменше приблизно 600 мг, щонайменше приблизно 700 мг, щонайменше приблизно 800 мг, щонайменше приблизно 900 мг, щонайменше приблизно 1000 мг, щонайменше приблизно 1100 мг, щонайменше приблизно 1200 мг, щонайменше приблизно 1300 мг, щонайменше приблизно 1400 мг, щонайменше приблизно 1500 мг, щонайменше приблизно 1600 мг, щонайменше приблизно 1700 мг, щонайменше приблизно 1800 мг, щонайменше приблизно 1900 мг, щонайменше приблизно 2000 мг, щонайменше приблизно 2100 мг, щонайменше приблизно 2200 мг, щонайменше приблизно 2300 мг, щонайменше приблизно 2400 мг, щонайменше приблизно 2500 мг, щонайменше приблизно 3000 мг, щонайменше приблизно 4000 мг або щонайменше приблизно 5000 мг. У визначених варіантах здійснення склад являє собою таблетку, де таблетка одержана з використанням стандартних технологічних процесів і устаткування для таблетування, визнаних у даній галузі. У визначених варіантах здійснення спосіб надання таблеткам форми являє собою пряме пресування порошкоподібної, кристалічної і/або гранульованої композиції, що містить аналог цитидину, окремо або в сполученні з одним або декількома ексципієнтами, наприклад, такими як носії, добавки, полімери і т. п. У визначених варіантах здійснення, як альтернатива прямому пресуванню, таблетки можна одержати, використовуючи процес вологої грануляції або сухої грануляції. У визначених варіантах здійснення таблетки відлиті у форму, а не спресовані, з використанням вихідного вологого або іншого матеріалу, що піддається обробці. У визначених варіантах здійснення використовують способи пресування і грануляції. У визначених варіантах здійснення склад являє собою капсулу, де капсули можна одержати з використанням стандартних технологічних процесів і устаткування для капсулювання, визнаних у даній галузі. У визначених варіантах здійснення можна одержати м'які желатинові капсули, де капсули містять суміш аналога цитидину і рослинної олії або безводних речовин, що змішуються з водою, наприклад, таких як поліетиленгліколь і т. п. У визначених варіантах здійснення можна одержати тверді желатинові капсули, що містять гранули аналога цитидину в сполученні з твердим порошкоподібним носієм, наприклад, таким як лактоза, сахароза, сорбіт, маніт, картопляний крохмаль, кукурудзяний крохмаль, амілопектин, похідні целюлози або желатин. У визначених варіантах здійснення оболонку твердої желатинової капсули можна одержати з композиції для капсул, що містить желатин і невелику кількість пластифікатора, такого як гліцерин. У визначених варіантах здійснення, як альтернатива желатину, оболонку капсули можна виконати з вуглеводного матеріалу. У визначених варіантах здійснення при необхідності композиція для капсул може додатково містити полімери, барвні речовини, ароматизатори і замутнювачі. У визначених варіантах здійснення капсула містить ГПМЦ. У визначених варіантах здійснення склад з аналогом цитидину, наприклад, таким як 5азацитидин, одержували з використанням водних розчинників, не викликаючи значного гідролізу аналога цитидину. У конкретних варіантах здійснення склад з аналогом цитидину, наприклад, таким як 5-азацитидин, являє собою таблетку, що містить покриття, нанесене на центральну частину лікарського засобу з використанням водних розчинників, не викликаючи значного гідролізу аналога цитидину в складі. У визначених варіантах здійснення воду використовують як розчинник для нанесення покриття на центральну частину лікарського засобу. У визначених варіантах здійснення пероральна лікарська форма аналога цитидину являє собою таблетку, що містить плівкове покриття, нанесене на центральну частину лікарського засобу з використанням водних розчинників. У конкретних варіантах здійснення воду використовують як розчинник для нанесення плівкового покриття. У конкретних варіантах здійснення таблетка, що містить аналог цитидину, покрита плівкою з використанням водних розчинників, що не викликають розпаду 25 UA 101370 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтичної композиції. У конкретних варіантах здійснення воду використовують як розчинник для нанесення плівкового покриття, що не викликає розпаду фармацевтичної композиції. У визначених варіантах здійснення пероральна лікарська форма, що містить 5азацитидин і водне плівкове покриття, здійснює негайне вивільнення лікарського засобу після пероральної доставки. У визначених варіантах здійснення пероральна лікарська форма, що містить 5-азацитидин і водне плівкове покриття, здійснює контрольоване вивільнення лікарського засобу у верхньому відділі шлунково-кишкового тракту, наприклад у шлунку, після перорального введення. У конкретних варіантах здійснення таблетка з плівковим покриттям на водній основі містить 5-азацитидин як АФК. Визначені варіанти здійснення за даним документом стосуються фармацевтичного складу з контрольованим вивільненням для перорального введення аналога цитидину, що вивільняє аналог цитидину по суті в шлунку, який містить a) конкретну кількість аналога цитидину; b) компонент, що контролює вивільнення лікарського засобу, для контролю над вивільненням аналога цитидину по суті у верхньому відділі шлунково-кишкового тракту, наприклад у шлунку; і c) необов'язково один або декілька ексципієнтів. У визначених варіантах здійснення пероральну лікарську форму, що містить аналог цитидину, одержували у вигляді таблетки або капсули з контрольованим вивільненням, що містить центральну частину лікарського засобу, яка містить фармацевтичну композицію, і необов'язкові ексципієнти. Необов'язково наносили "захисне покриття" або "оболонку". У визначених варіантах здійснення склад, який наданий в даному документі й містить аналог цитидину, наданий у даному документі, являє собою таблетку або капсулу з контрольованим вивільненням, що містить терапевтично ефективну кількість аналога цитидину, компонент, що контролює вивільнення лікарського засобу, який контролює вивільнення аналога цитидину по суті в шлунку після перорального введення, і, необов'язково, один або декілька ексципієнтів. Конкретні варіанти здійснення стосуються компонента, що контролює вивільнення лікарського засобу, який являє собою полімерну матрицю, що набухає під впливом рідини в шлунку, щоб здійснити утримання складу в шлунку й уповільнене вивільнення аналога цитидину з полімерної матриці по суті в шлунку. У визначених варіантах здійснення такі склади можна одержати шляхом вбудовування аналога цитидину в придатну полімерну матрицю в процесі одержання складу. Приклади таких складів відомі в даній галузі. Див., наприклад, Shell et al., публікація патенту США № 2002/0051820 (заявка № 09/990061); Shell et al., публікація патенту США № 2003/0039688 (заявка № 10/045823); Gusler et al., публікація патенту США № 2003/0104053 (заявка № 10/029134), що включені в даний документ як посилання в повному обсязі. У визначених варіантах здійснення компонент, що контролює вивільнення лікарського засобу, може містити оболонку, яка оточує центральну частину, що містить лікарський засіб, де оболонка вивільняє аналог цитидину з центральної частини, наприклад, даючи аналогу цитидину можливість дифундувати з центральної частини і сприяючи утриманню складу в шлунку за допомогою розбухання під впливом рідини в шлунку до розміру, який затримується в шлунку. У визначених варіантах здійснення такі склади можна одержати спресовуванням спочатку суміші аналога цитидину й одного або декількох ексципієнтів, щоб сформувати центральну частину лікарського засобу, і спресовуванням іншої порошкоподібної суміші поверх центральної частини лікарського засобу, щоб сформувати оболонку, або поміщенням центральної частини лікарського засобу в капсульну оболонку, виконану з придатних речовин. Приклади таких складів відомі в даній галузі. Див., наприклад, Berner et al., публікація патенту США № 2003/0104062, заявка № 10/213823, що включена в даний документ як посилання в повному обсязі. Визначені варіанти здійснення за даним документом стосуються пероральних лікарських форм, що містять аналог цитидину, де лікарська форма містить пори в стандартному ентеросолюбільному покритті. У конкретних варіантах здійснення пероральна лікарська форма аналога цитидину являє собою таблетку, що містить проникне або частково проникне (наприклад, "пропускаюче") ентеросолюбільне покриття з порами. У конкретних варіантах здійснення таблетка з проникним або частково проникним ентеросолюбільним покриттям контролює вивільнення аналога цитидину з таблетки головним чином у верхньому відділі шлунково-кишкового тракту, наприклад у шлунку. У конкретних варіантах здійснення таблетка з проникним або частково проникним ентеросолюбільним покриттям містить 5-азацитидин. У конкретних варіантах здійснення інша частина аналога цитидину, надалі, вивільняється після шлунка (наприклад, у кишечнику). У визначених варіантах здійснення фармацевтичний склад, наданий в даному документі, являє собою пресовану таблетку, що містить аналог цитидину. На доповнення до аналога 26 UA 101370 C2 5 10 15 20 25 30 35 40 45 50 55 60 цитидину, таблетка необов'язково містить один або декілька ексципієнтів, включаючи (a) розріджувачі або наповнювачі, що можуть надати складу масу, необхідну для одержання таблеток бажаного розміру; (b) зв'язуючі засоби або адгезиви, що можуть сприяти злипанню частинок складу, що дає можливість одержання гранул і збереження цілісності кінцевої таблетки; (c) дезінтегруючі засоби або дезінтегранти, що після введення можуть сприяти розпаданню таблеток на менші частинки для поліпшення приступності лікарського засобу; (d) засоби проти прилипання, гліданти, лубриканти або мастильні речовини, що можуть збільшувати сипкість таблеткової маси в прес-формі для таблеток, знижувати до мінімуму зношування пресів і прес-форм, попереджати злипання наповнювальної речовини з пресами і прес-формами і дозволяти одержувати глянсові таблетки; і (e) різні допоміжні засоби, такі як барвники і смакові добавки. Після пресування таблетки, надані в даному документі, можна покрити різними речовинами, як описано в даному документі. У визначених варіантах здійснення фармацевтичний склад, наданий в даному документі, являє собою багаторазово пресовану таблетку з аналогом цитидину. Багаторазово пресовані таблетки одержують пресуванням наповнювальної речовини більше одного разу. Результатом може бути багатошарова таблетка або таблетки-усередині-таблетки, внутрішня таблетка є центральною частиною, що містить аналог цитидину і необов'язково один або декілька ексципієнтів, а зовнішня частина є оболонкою, де оболонка містить один або декілька ексципієнтів і може містити або не містити аналог цитидину. Багатошарові таблетки можна одержати стисненням спочатку частини наповнювальної речовини у прес-формі, а потім додаткової наповнювальної речовини, і пресуванням, щоб сформувати дво- або тришарові таблетки, залежно від числа окремих наповнювачів. Через хімічну або фізичну несумісність кожен шар може містити відмінний терапевтичний засіб, окремо від іншого терапевтичного засобу, або той же терапевтичний засіб для поетапного вивільнення лікарського засобу або просто, щоб незвичайно оформити багатошарову таблетку. Кожну частину наповнювача можна забарвити у свій колір, щоб одержати різні по вигляду таблетки. При одержанні таблеток, що містять спресовану таблетку як внутрішню центральну частину, можна використовувати спеціальні пристрої для точного розміщення попередньо сформованої таблетки в прес-формі для наступного пресування навколишньої наповнювальної речовини. У певних варіантах здійснення спресовану таблетку аналога цитидину можна покрити шаром забарвленого або безбарвного цукру. Покриття може бути водорозчинним і швидко розчинятися після проковтування. Цукрове покриття може служити меті захисту поміщеного лікарського засобу від навколишнього середовища і забезпечувати бар'єр для неприємного смаку або запаху. Цукрове покриття також може збільшувати зовнішні розміри спресованої таблетки і давати можливість нанести маркування виробника. У певних варіантах здійснення таблетки з цукровим покриттям можуть бути на 50 % більше і об'ємніше, ніж вихідні непокриті таблетки. Нанесення цукрового покриття на таблетки можна розділити на наступні необов'язкові стадії: (1) забезпечення водонепроникності і ізоляція (якщо необхідно); (2) нанесення нижнього шару покриття; (3) шліфування і остаточне скруглення; (4) фінішна обробка і забарвлення (при бажанні); (5) друк (якщо необхідно); і (6) полірування. У певних варіантах здійснення спресована таблетка аналога цитидину може бути покрита плівкою. Таблетки з плівковим покриттям можуть являти собою спресовані таблетки, покриті тонким шаром полімеру, який здатний формувати skin-like плівку на таблетці. Звичайно плівка забарвлена і вигідно відрізняється підвищеною міцністю, меншим об'ємом і меншим часом, необхідним для нанесення. Можна розробити композицію покриття, яке буде руйнуватися і оголяти центральну частину таблетки в бажаному відділі шлунково-кишкового тракту. За допомогою процесу нанесення плівкового покриття, який дозволяє нанести тонке щільно прилегле покриття з пластичної речовини на спресовану таблетку, можна одержати покриті таблетки, що мають по суті таку ж масу, форму і розмір, що і вихідна спресована таблетка. Плівкове покриття може мати забарвлення, щоб зробити таблетки привабливими і відмінними. Розчини плівкових покриттів можуть бути неводними або водними. У конкретних варіантах здійснення, щоб зробити бажане покриття на таблетках, неводні розчини необов'язково можуть містити речовини одного або декількох наступних типів: (1) плівкоутворювач, що дозволяє одержувати гладкі, тонкі плівки, які можна відтворити в стандартних умовах для нанесення покриття і наносити на таблетки різної форми, наприклад, такий як ацетатофталат целюлози; (2) лігуюча речовина, що забезпечує водорозчинність або проникність плівки, щоб забезпечити проникнення рідин організму і терапевтичну доступність лікарського засобу, наприклад, така як поліетиленгліколь; (3) пластифікатор для надання гнучкості і еластичності покриттю і, таким чином, забезпечення міцності, наприклад, такий як касторова олія; (4) поверхнево-активна речовина для збільшення здатності плівки розтікатися в процесі нанесення, наприклад, така як 27 UA 101370 C2 5 10 15 20 25 30 35 40 45 50 55 60 похідні поліоксіетиленсорбітану; (5) замутнювачі і барвники, щоб зробити зовнішній вигляд покритої таблетки привабливим і відмінним, наприклад, такі як діоксид титану як замутнювач і барвники FD&С або D&С як барвник; (6) підсолоджувачі, смакові добавки або ароматизатори для збільшення прийнятності таблетки для суб'єкта, наприклад, такі як сахарин як підсолоджувач і ванілін як смакова добавка і ароматизатор; (7) засіб для надання блиску, щоб надати таблеткам блиск без окремої операції полірування, наприклад, такий як бджолиний віск; і (8) леткий розчинник для забезпечення можливості поширення інших компонентів по таблетках і при цьому забезпечити можливість швидкого випаровування, щоб дозволити швидко і ефективно виконувати операцію, наприклад, такий як суміш спирту-ацетону. У певних варіантах здійснення водний склад плівкового покриття може містити одну або декілька наступних речовин: (1) плівкоутворювальний полімер, наприклад, такий як полімер ефіру целюлози, такий як гідроксипропілметилцелюлоза, гідроксипропілцелюлоза і метилцелюлоза; (2) пластифікатор, наприклад, такий як гліцерин, пропіленгліколь, поліетиленгліколь, діетилфталат і дибутилсубацетат; (3) барвник і замутнювач, наприклад, такий як лак FD&С або D&С і залізооксидні пігменти; або (4) основу, наприклад, таку як вода. У певних варіантах здійснення спресована таблетка аналога цитидину може мати спресоване покриття. Покриваюча речовина у формі гранул або порошку можна спресувати навколо центральної таблеткової частини лікарського засобу з використанням спеціального таблеткового преса. У певних варіантах здійснення фармацевтичний склад являє собою таблетку аналога цитидину з желатиновим покриттям. Таблетка з желатиновим покриттям являє собою спресовану таблетку у формі капсули, що дозволяє покритому продукту бути меншим капсули, заповненої рівною кількістю порошку. Желатинове покриття полегшує проковтування і, в порівнянні з незапечатаними капсулами, таблетки з желатиновим покриттям можуть бути більш стійкими до зовнішніх впливів. У певних варіантах здійснення фармацевтичний склад може являти собою сублінгвальну таблетку аналога цитидину. Сублінгвальна таблетка призначена для розчинення під язиком і всмоктування через слизову рота. Сублінгвальна таблетка може розчинятися швидко і забезпечувати швидке вивільнення лікарського засобу. У певних варіантах здійснення фармацевтичний склад являє собою таблетку аналога цитидину з негайним вивільненням. У певних варіантах здійснення таблетка з негайним вивільненням призначена, наприклад, для розпаду і вивільнення АФК без яких-небудь спеціальних можливостей контролю швидкості, таких як спеціальні покриття і інші технічні прийоми. У певних варіантах здійснення склад являє собою таблетку, що швидко розпадається, яка, наприклад, розчиняється по суті у роті після введення. У певних варіантах здійснення фармацевтичний склад являє собою таблетку аналога цитидину з тривалим вивільненням. У певних варіантах здійснення таблетка з тривалим вивільненням призначена, наприклад, для вивільнення АФК протягом тривалого періоду часу і по суті в шлунку. У певних варіантах здійснення спресовані таблетки можна одержати вологою грануляцією. Волога грануляція є широко використовуваним способом одержання спресованих таблеток і в конкретних варіантах здійснення вимагає однієї або декілька наступних стадій: (1) зважування і змішування компонентів; (2) одержання вологої маси; (3) просіювання вологої маси для одержання пелет або гранул; (4) сушіння гранул; (5) сортування гранул по крупності сухим просіюванням; (6) додавання лубриканту і змішування; і (7) таблетування пресуванням. У певних варіантах здійснення спресовані таблетки можна одержати сухою грануляцією. Способом сухої грануляції порошкоподібну суміш стискають у великі шматки і надалі подрібнюють до гранул або сортують по крупності. Але для цього способу активний інгредієнт або розріджувач повинен мати когезивні властивості. Після зважування і змішування компонентів порошкоподібну суміш можна грудкувати або стискати у великі плоскі таблетки або пелети. Потім їх руйнують руками або розмелюють і пропускають через сито з комірками бажаного розміру для сортування по крупності. Лубрикант додають звичайним способом, а таблетки одержують пресуванням. Альтернативно, замість грудкування можна використовувати порошкові ущільнювачі для збільшення щільності порошку пресуванням між валами високого тиску. Потім спресовану речовину роздрібнюють, сортують по крупності і додають лубрикант, а таблетки одержують звичайним способом пресування. Часто спосіб пресування валами переважніше грудкування. Зв'язуючі засоби, використовувані в складах для пресування валами, включають метилцелюлозу або гідроксиметилцелюлозу і дозволяють одержувати таблетки з хорошою твердістю і крихкістю. У певних варіантах здійснення спресовані таблетки можна одержати прямим пресуванням. Деякі гранульовані хімічні речовини мають високу сипкість і когезивні властивості, які 28
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;heading 3;oral formulations of cytidine analogs and methods of use thereof
Автори англійськоюEtter, Jaffrey, B., Lai, Mei, Backstrom, Jay, Thomas
Назва патенту російськоюПероральные составы, которые содержат аналоги цитидина, и способы их использования
Автори російськоюИттер Джеффри Б., Лай Мей, Бекстрем Джей Томас
МПК / Мітки
МПК: A61K 31/7068, A61K 9/22, A61P 35/00
Мітки: аналоги, містять, способи, складі, використання, пероральні, цитидину
Код посилання
<a href="https://ua.patents.su/78-101370-peroralni-skladi-yaki-mistyat-analogi-citidinu-i-sposobi-kh-vikoristannya.html" target="_blank" rel="follow" title="База патентів України">Пероральні склади, які містять аналоги цитидину, і способи їх використання</a>