Фармацевтичні склади, що містять інгібітори деацетилази гістонів
Формула / Реферат
1. Фармацевтична композиція, що містить:
(а) інгібітор HDAC, причому зазначений інгібітор HDAC є сполукою наступної формули або її фармацевтично прийнятною сіллю або сольватом:
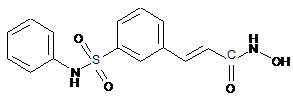 ,
,
(b) вільний аргінін або фармацевтично прийнятна сіль аргініну.
2. Фармацевтична композиція за п. 1, яка відрізняється тим, що містить:
а) інгібітор HDAC, який являє собою
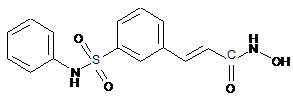 ,
,
(b) вільний аргінін або фармацевтично прийнятну сіль аргініну.
3. Фармацевтична композиція за п. 1 або 2, яка відрізняється тим, що (b) являє собою вільний L-аргінін або фармацевтично прийнятну сіль L-аргініну.
4. Фармацевтична композиція за п. 1 або 2, яка відрізняється тим, що (b) являє собою вільний аргінін.
5. Фармацевтична композиція за п. 1 або 2, яка відрізняється тим, що (b) являє собою вільний L-аргінін.
6. Фармацевтична композиція за будь-яким із пп. 1-5, яка відрізняється тим, що молярне відношення (b) до зазначеного інгібітору HDAC становить щонайменше 0,5.
7. Фармацевтична композиція за будь-яким із пп. 1-5, яка відрізняється тим, що молярне відношення (b) до зазначеного інгібітору HDAC становить від 0,5 до 5.
8. Фармацевтична композиція за будь-яким із пп. 1-7, що додатково містить один або більше з додаткових фармацевтично прийнятних компонентів.
9. Фармацевтична композиція за будь-яким із пп. 1-8, яка є стерильною й апірогенною.
10. Фармацевтична композиція за будь-яким із пп. 1-9, яка є рідкою.
11. Фармацевтична композиція за будь-яким із пп. 1-9, яка являє собою водний розчин.
12. Фармацевтична композиція за будь-яким із пп. 1-11, яка додатково містить: воду для ін'єкцій, водний сольовий розчин, водний розчин глюкози, розчин Рінгера або розчин Рінгера з лактатом.
13. Фармацевтична композиція за будь-яким із пп. 1-11, яка додатково містить: сольовий розчин для ін'єкцій/інфузій або розчин глюкози для ін'єкцій/інфузій.
14. Фармацевтична композиція за будь-яким із пп. 1-11, яка додатково містить водний сольовий розчин або водний розчин глюкози.
15. Фармацевтична композиція за будь-яким із пп. 10-14, яка містить зазначений інгібітор HDAC у концентрації 0,1-1000 мг/мл.
16. Фармацевтична композиція за будь-яким із пп. 10-14, яка містить зазначений інгібітор HDAC у концентрації 100-1000 мг/мл.
17. Фармацевтична композиція за будь-яким із пп. 10-14, яка містить зазначений інгібітор HDAC у концентрації 30-300 мг/мл.
18. Фармацевтична композиція за будь-яким із пп. 10-14, яка містить зазначений інгібітор HDAC у концентрації 0,3-3000 мМ.
19. Фармацевтична композиція за будь-яким із пп. 10-14, яка містить зазначений інгібітор HDAC у концентрації 100-1000 мМ.
20. Фармацевтична композиція за будь-яким із пп. 10-14, яка містить зазначений інгібітор HDAC у концентрації 100-500 мМ.
21. Фармацевтична композиція за будь-яким із пп. 10-14, яка містить зазначений інгібітор HDAC у концентрації 0,01-300 мг/мл.
22. Фармацевтична композиція за будь-яким із пп. 10-14, яка містить зазначений інгібітор HDAC у концентрації 1,0-10 мг/мл.
23. Фармацевтична композиція за будь-яким із пп. 10-14, яка містить зазначений інгібітор HDAC у концентрації 1,0-5 мг/мл.
24. Фармацевтична композиція за будь-яким із пп. 10-14, яка містить зазначений інгібітор HDAC у концентрації 0,01-100 мМ.
25. Фармацевтична композиція за будь-яким із пп. 10-14, яка містить зазначений інгібітор HDAC у концентрації 3-30 мМ.
26. Фармацевтична композиція за будь-яким із пп. 10-14, яка містить зазначений інгібітор HDAC у концентрації 0,1-5 мМ.
27. Фармацевтична композиція за будь-яким із пп. 1-26, яка відрізняється тим, що зазначена композиція застосована для парентерального введення пацієнтові.
28. Фармацевтична композиція за будь-яким із пп. 1-26, яка відрізняється тим, що зазначена композиція застосована для введення пацієнтові шляхом ін'єкції.
29. Фармацевтична композиція за будь-яким із пп. 1-26, яка відрізняється тим, що зазначена композиція застосована для введення пацієнтові шляхом інфузії.
30. Мішок для внутрішньовенної інфузії, який містить фармацевтичну композицію за будь-яким із пп. 10-29.
31. Флакон, що містить фармацевтичну композицію за будь-яким із пп. 1-29.
32. Ампула, що містить фармацевтичну композицію за будь-яким із пп. 1-29.
33. Фармацевтична композиція за п. 1, що містить:
(а) інгібітор HDAC, причому зазначений інгібітор HDAC являє собою:
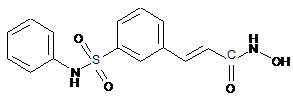 ,
,
(b) вільний L-аргінін; яка відрізняється тим, що:
зазначена фармацевтична композиція являє собою водний розчин;
зазначена фармацевтична композиція містить зазначений інгібітор HDAC у концентрації 30-300 мг/мл; і
молярне відношення вільного L-аргініну до зазначеного інгібітору HDAC становить від 0,8 до 4.
34. Фармацевтична композиція за п. 33, яка відрізняється тим, що зазначена фармацевтична композиція містить зазначений інгібітор HDAC у концентрації близько 50 мг/мл.
35. Флакон, що містить фармацевтичну композицію за п. 33 або 34.
36. Ампула, що містить фармацевтичну композицію за п. 33 або 34.
37. Фармацевтична композиція за будь-яким із пп. 1-9, яка є твердою.
38. Фармацевтична композиція за будь-яким із пп. 1-9, яка має форму порошку, гранул, таблеток або ліофілату/ліофілізату.
39. Набір, що містить:
(а) фармацевтичну композицію за будь-яким із пп. 1-29, 33, 34, 37 або 38, що надається в придатному контейнері та/або в придатній упаковці; і
(b) інструкції для застосування.
40. Набір за п. 39, який відрізняється тим, що зазначена інструкція для застосування являє собою письмову інструкцію по введенню зазначеної композиції.
41. Набір за п. 39, який відрізняється тим, що зазначена інструкція для застосування являє собою письмову інструкцію по готуванню придатного фармацевтичного складу з композиції і необов'язково по введенню згодом зазначеного складу.
42. Застосування (а) інгібітору HDAC, причому зазначений інгібітор HDAC є сполукою наступної формули або її фармацевтично прийнятною сіллю або сольватом:
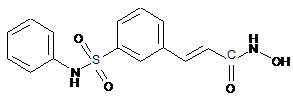 ,
,
в комбінації з
(b) вільним аргініном або фармацевтично прийнятною сіллю аргініну, у виробництві лікарського препарату для лікування патологічного стану, який опосередковуваний HDAC.
43. Застосування за п. 42, де зазначений патологічний стан являє собою проліферативний патологічний стан.
44. Застосування за п. 42, де зазначений патологічний стан являє собою ракове захворювання.
45. Фармацевтична композиція за будь-яким із пп. 1-29, 33, 34, 37 або 38 для застосування в способі лікування патологічного стану людини або тварини за допомогою терапії.
46. Фармацевтична композиція за п. 45, яка відрізняється тим, що зазначений патологічний стан опосередковуваний HDAC.
47. Фармацевтична композиція за п. 45, яка відрізняється тим, що зазначений патологічний стан являє собою проліферативний патологічний стан.
48. Фармацевтична композиція за п. 45, яка відрізняється тим, що зазначений патологічний стан являє собою ракове захворювання.
49. Застосування композиції за будь-яким із пп. 1-29, 33, 34, 37 або 38 у виробництві лікарського препарату для лікування патологічного стану, що опосередковуваний HDAC.
50. Застосування композиції за п. 49, де патологічний стан являє собою проліферативний патологічний стан.
51. Застосування композиції за п. 49, де зазначений патологічний стан являє собою ракове захворювання.
52. Спосіб лікування патологічного стану, який відрізняється тим, що зазначений патологічний стан опосередковуваний HDAC, що включає введення пацієнтові, що потребує лікування, фармацевтичної композиції за будь-яким із пп. 1-29, 33, 34, 37 або 38.
53. Спосіб за п. 52, який відрізняється тим, що зазначений патологічний стан являє собою проліферативний патологічний стан.
54. Спосіб за п. 52, який відрізняється тим, що зазначений патологічний стан являє собою ракове захворювання.
55. Спосіб інгібування проліферації клітин in vitro або in vivo, в якому приводять клітину у контакт із фармацевтичною композицією за будь-яким із пп. 1-29, 33, 34, 37 або 38.
56. Спосіб інгібування ходу клітинного циклу in vitro або in vivo, в якому приводять клітину у контакт із фармацевтичною композицією за будь-яким із пп. 1-29, 33, 34, 37 або 38.
57. Спосіб стимулювання апоптозу in vitro або in vivo, в якому приводять клітину у контакт із фармацевтичною композицією за будь-яким із пп. 1-29, 33, 34, 37 або 38.
Текст
Реферат: Даний винахід стосується фармацевтичних композицій, що включають деякі сполуки карбамінової кислоти (наприклад, які інгібують активність HDAC (деацетилази гістонів)) (наприклад, PXD-101, N-гідрокси-3-(3-фенілсульфамоїлфеніл)-акриламід)) і один або більше з додаткових компонентів, вибраних із циклодекстрину, аргініну й меглуміну. Даний винахід також стосується застосування таких композицій, наприклад, в інгібуванні HDAC і лікуванні патологічних станів, опосередковуваних HDAC, раку, проліферативних патологічних станів, псоріазу й т. п. UA 99810 C2 (12) UA 99810 C2 UA 99810 C2 5 10 15 20 25 30 35 40 45 50 55 60 РОДИННІ ЗАЯВКИ Дана заявка є родинною стосовно попередньої заявки на патент США 60/681,215, поданої 13 травня 2005; і попередньої заявки на патент США 60/681,234, поданої 13 травня 2005, зміст яких у повному обсязі включено в даний опис через посилання. ОБЛАСТЬ ТЕХНІКИ Даний винахід у цілому відноситься до області фармацевтичних препаратів і фармацевтики, і, зокрема, до фармацевтичних композицій, що включають деякі сполуки карбамінової кислоти (наприклад, сполуки, які інгібують активність деацетилази гістонів (HDAC)) і один або більше додаткових компонентів, обраних із циклодекстрину, аргініну й меглуміну. Даний винахід також відноситься до застосування таких композицій, наприклад, для інгібування HDAC і лікування патологічних станів, опосередковуваних HDAC. РІВЕНЬ ТЕХНІКИ Деацетилаза гістонів (HDAC) У клітинах еукаріот ДНК міцно пов'язана з білками (гістонами), утворюючи хроматин. Гістони являють собою невеликі позитивно заряджені білки, багаті основними амінокислотами (позитивно зарядженими при фізіологічних значеннях pН), які контактують із фосфатними групами (негативно зарядженими при фізіологічних значеннях pН) ДНК. Існує п'ять основних класів гістонів: H1, H2A, H2B, H3, і H4. Послідовності амінокислот гістонів H2A, H2B, H3 й H4 демонструють виняткову консервативність у різних видів, тоді як H1 є частково варіаційним й у деяких випадках заміщується іншим гістоном, наприклад, H5. Чотири пари кожного з H2A, H2B, H3 й H4 спільно утворюють дископодібне октомірне білкове ядро («кор»), що, разом, з «обгорненою» навколо неї ДНК (близько 140 пар основ) утворює нуклеосому. Окремі нуклеосоми сполучені невеликими ділянками лінкерної ДНК, асоційованими з іншою молекулою гістону (наприклад, H1 або в деяких випадках H5). У результаті утворюється структура, що нагадує нитку з нанизаними на неї бусинами, що, у свою чергу, укладена по спіралі, за формою схожу на соленоїд. Більшість гістонів синтезуються в ході S фази клітинного циклу, і знову синтезовані гістони швидко попадають у ядро й сполучаються із ДНК. Протягом декількох хвилин з моменту синтезу знов синтезована ДНК сполучається з гістонами з утворенням нуклеосом. Невелика частина гістонів, а саме аміногрупи їхніх бічних ланцюгів, піддаються фермантативній модифікації, що полягає в посттрансляційному приєднанні метильних, ацетильних або фосфатних груп, що нейтралізують позитивний заряд бічного ланцюга або змінюють його на негативний заряд. Наприклад, групи лізину й аргініну можуть бути метильовані, лізин може бути ацетильованим, а групи серину можуть бути фосфорильовані. Бічний ланцюг лізину -(CH2)4-NH2 може бути ацетильованим, наприклад ферментом ацетилтрансферазою, з утворенням аміду -(CH2)4- NHC(=O)CH3. Метилування, ацетилування й фосфорилування аміно-кінців гістонів, що виступають із ядра нуклеосоми, впливає на структуру хроматину й експресію генів (див., наприклад, Spencer, V.A. and Davie, J.R., 1999, Gene, Vol. 240(1), pp. 1- 12). Ацетилування й деацетилування гістонів асоційоване із процесами транскрипції, що призводять до проліферації й/або диференціюванню клітин. Ацетилування також опосередковує регуляцію функції факторів транскрипції. Останні огляди по деацетилуванню гістонів включають наступні: Kouzarides, T., 1999, "Histone acetylases and deacetylases in cell proliferation," Curr. Opin. Genet. Dev., Vol. 9, No. 1, pp. 40-48; Pazin, M.J., et al., 1997, "What's up and down with histone deacetylation and transcription?," Cell, Vol. 89, No. 3, pp. 325-328. Кореляція між станом ацетилування гістонів і транскрипцією генів відома більше 30 років (див, наприклад, Howe, L., et червоний., 1999, Crit. Rev. Eukaryot. Ген Expr., Vol. 9(3-4), pp. 231243). Деякі ферменти, зокрема, ацетилази (наприклад, гістон ацетилтрасферазу, ГАТ(НАТ)) і деацетилазу (наприклад, деацетилаза гістонів, HDAC), які регулюють стан ацетилування гістонів, виявили в багатьох організмах, і з'ясували, що вони залучені в регуляцію багатьох генів, що підтверджує існування зв'язку між ацетилуванням і транскрипцією. Див., наприклад, Davie, J.R., 1998, "Covalent modifications of histones: expression from chromatic templates," Curr. Opin. Genet. Dev., Vol. 8, pp. 173-178. В цілому, ацетилування гістонів корелює з активацією транскрипції, тоді як деацетилування гістонів пов'язане з репресією генів. Ідентифіковано велике число деацетилаз гістонів (HDAC), у тому числі HDAC1 - HDAC11 (див., наприклад, Ng, H.H. and Bird, A., 2000, Trends Biochem. Sci., Vol. 25(3), pp. 121-126). Також ідентифікований ряд деацетилаз гістонів дріжджів і деацетилаз гістонів рослин. Перша деацетилаза, HDAC1, була ідентифікована в 1996 (див., наприклад, Taunton, J., et al., 1996, Science, Vol. 272, pp. 408-411). Згодом були виявлені два інших ядерних деацетилаз ссавців, HDAC2 й HDAC3. Див., наприклад: Yang, W.M., et al., 1996, Proc. Natl. Acad. Sci. USA, Vol. 93, 1 UA 99810 C2 5 10 15 20 25 30 35 40 45 50 55 60 pp. 12845-12850; Yang, W.M., et al., 1997, J. Biol. Chem., Vol. 272, pp. 28001-28007; Emiliani, S., et al., 1998, Proc. Natl. Acad. Sci. USA, Vol. 95, p. 2795-2800; Grozinger et al., 1999, Proc. Natl. Acad. Sci. USA, Vol. 96, pp. 4868-4873; Kao et al., 2000, Genes & Dev., Vol. 14, p. 55- 66; Van den Wyngaert et al., 2000, FEBS, Vol. 478, pp. 77-83. HDAC функціонують у складі великих мультибілкових комплексів, які зв'язуються із промотором і придушують транскрипцію. Добре охарактеризовані репресори транскрипції, такі як Mad (Laherty, C.D., et al., 1997, Cell, Vol. 89(3), pp. 349-356), pRb (Brehm, A., et al., 1998, Nature, 1998, Vol. 391, pp. 597-601), ядерні репресори (Wong, J., et al., 1998, EMBO J., Vol. 17(2), pp. 520-534) і YY1 (Yang, W.M., et al., 1997, J. Biol. Chem., Vol. 272, pp. 28001-28007), асоціюють із комплексами HDAC, що забезпечує виконання їх репресійної функції. Роль HDAC у проліферації клітин Дослідження інгібіторів деацетилаз гістонів показало, що ці ферменти відіграють важливу роль у проліферації й диференціюванні клітин. Інгібітор трихостатин А (Trichostatin A, TSA) (Yoshida, M., et al., 1990, J. Biol. Chem., Vol. 265(28), pp. 17174-17179) викликає блок клітинного циклу як у фазі G1, так й в G2 (Yoshida, M., Beppu, T., 1988, Exp. Cell. Res., Vol. 177, pp. 122131), відновлює трансформований фенотип різних ліній клітин і стимулює диференціювання клітин лейкемії Фрейнда й інших (Yoshida, M., et al., 1990, J. Antibiot. (Tokyo), Vol. 43(9), pp. 1101-1106). Було показано, що TSA (як й SAHA) інгібує ріст клітин, індуціює термінальне диференціювання й запобігає утворенню пухлин у мишей (Finnin et al., 1999, Nature, Vol. 401, pp. 188-193). Блокування клітинного циклу інгібітором TSA корелює із підвищеною експресією гельзоліну (Hoshikawa, Y., et al., 1994, Exp. Cell. Res., Vol. 214(1), pp. 189-197), білка, що регулює актин, активність якого придушується при розвитку злоякісної пухлини груди (Mielnicki, L.M., et al., 1999, Exp. Cell. Res., Vol. 249(1), pp. 161-176). Аналогічний вплив на клітинний цикл і диференціювання характерні для ряду інгібіторів деацетилаз (Kim et al., 1999, Oncogene, Vol. 18(15), pp. 2461- 2470). Очевидна участь HDAC у контролі проліферації й диференціюванні клітин дозволяє припустити, що аберантна активність HDAC може відігравати роль у розвитку раку. Найбільш наочне підтвердження участі деацетилазу у розвитку раку випливає із аналізу різних типів гострої промиелоцитарної лейкемії (ГПЛ). У більшості суб'єктів, що страждають від ГПЛ, транслокація хромосом 15 й 17 (t(15;17)), приводить до експресії гібридного білка, що містить N-кінцеву частину продукту гена PML, сполучену з більшою частиною RARα (рецептор ретиноевої кислоти). У деяких випадках інша транслокація (t(11;17)) призводить до гібридизації PLZF, що містить домен «цинкові пальці» білка, і RARα. При відсутності ліганду RARα дикого типу придушує генів-мішені шляхом сполучання репресорного комплексу HDAC із ДНК промотору. У ході нормального гемопоезу ретиноева кислота (RA, РК) зв'язується з RARα і зміщує репресорний комплекс, уможливлюючи експресію генів, залучених у диференціюванні миелоідних клітин. Гібридні білки RARα, що зустрічаються в організмі в суб'єктів, які страждають від ГПЛ, уже не є чутливими до фізіологічних рівнів РК, і перешкоджають експресії генів, індуційованих РК, які стимулюють диференціювання миелоідних клітин. Це призводить до клональної експансії клітин-проміелоцитів і розвитку лейкемії. Експерименти in vitro показали, що TSA здатен відновлювати чутливість гібридних білків RARα до РК й уможливлювати диференціювання миелоідних клітин. Ці результати дозволяють встановити зв'язок між HDAC й онкогенезом і припустити, що HDAC є потенційними мішенями для фармацевтичного впливу на суб'єктів, що страждають від ГПЛ. (Див., наприклад, Kitamura, K., et al., 2000, Br. J. Haematol., Vol. 108(4), pp. 696-702; David, G., et al., 1998, Oncogene, Vol. 16(19), pp. 2549- 2556; Lin, R.J., et al., 1998, Nature, Vol. 391(6669), pp. 811- 814). Більш того, інші джерела дозволяють припустити, що HDAC можуть бути важливими мішенями терапії при інших типах раку. Інгібітори HLAC стимулюють диференціювання ліній клітин, отриманих від безлічі різних карцином (простати, колоректального раку, раку грудей, нейронів, печінки) (Yoshida, M. and Horinouchi, S., 1999, Ann. N. Y. Acad. Sci., Vol. 886, pp. 2336). Вивчено ряд інгібіторів HDAC на моделях раку у тварин. Вони сповільнюють ріст пухлин і продовжують строк життя мишей з різними типами трансплантованих пухлин, включаючи меланому, лейкемію, карциноми товстої кишки, легені, шлунка й т.п. (Ueda, H., et al., 1994, J. Antibiot. (Tokyo), Vol. 47(3), pp. 315-323; Kim et al., 1999, Oncogene, Vol. 18(15), pp. 246l-2470). Псоріаз являє собою загальне хронічне захворювання, що спотворює шкіру, і характеризується добре помітними червоними, ущільненими лускатими бляшками: вони можуть бути обмеженими або широко розповсюдженими. Ступінь поширеності псоріазу становить приблизно 2%, тобто, 12,5 мільйон хворих у країнах «тріади» (США/Європа/Японія). Незважаючи на те, що хвороба рідко є летальної, вона безсумнівно впливає на якість життя суб'єкта, що погіршується відсутністю ефективних способів терапії. Існуючі способи лікування є 2 UA 99810 C2 5 10 15 20 або неефективними, неприйнятними з косметичної точки зору, або мають небажані побічні ефекти. Таким чином, у клініці існує значна незадоволена потреба в ефективних й безпечних іHDAC для лікування даного патологічного стану. Псоріаз являє собою захворювання складної етиології. Хоча й існує явна генетична складова захворювання, що включає ряд локусів генів, існують також невизначені фактори навколишнього середовища, що стимулюють початок цього захворювання. Поза залежністю від вихідної причини псоріазу, на клітинному рівні він характеризується локальним запаленням, опосередковуваним Т-клітинами, підвищеною проліферацією кератиноцитів і локальним ангіогенезом. В усі ці процеси залучені деацетилази гістонів (див., наприклад, Saunders, N. et al, 1999, Cancer Res., Vol. 59, No. 2 pp. 399-404; Bernhard, D. et al., 1999, FASEB J., Vol. 13, No. 14, pp. 1991- 2001; Takahashi et al., 1996, J. Antibiot. (Tokyo), Vol. 49, No. 5, pp. 453-457; Kim et al., 2001, Nature Medicine, Vol. 7, No. 4, pp. 437- 443). Отже, інгібітори HDAC можна застосовувати в терапії псоріазу. Скринінг можливих іHDAC можна провести, наприклад, за допомогою аналізу проліферації T-клітин й/або кератиноцитів. ІНГІБІТОРИ HDAC Один з важливих класів інгібіторів HDAC являє собою сполуки карбамінової кислоти, що включають сульфаніламідні зв'язки, як описано, наприклад у роботі Watkins і співавторів (Watkins, C., et al., 2002), публікація міжнародної заявки на патент (PCT) WO 02/30879. Особливо перспективною сполукою є N-гідрокси-3-(3-фенілсульфамоіл-феніл)- акриламід (згадує в даній заявці як PXD-101). O N H 25 30 35 40 45 50 55 S C O H N OH PXD-101 O Одержання складів, що містять багато потенційно корисних HDAC сполучене з однієї або декількома проблемами, такими як, наприклад, низька розчинність у водних розчинах, необхідність забезпечення неприйнятно високого або низького рівня pH для солюбілізації іHDAC, фізична й/або хімічна нестабільність у водяних розчинах, фізична й/або хімічна нестабільність при наступному розведенні й т.п. Аналогічні й інші проблеми виникають при одержанні складів для таких сполук, як PXD-101. Таким чином, одне із завдань даного винаходу полягає в забезпеченні поліпшених фармацевтичних композицій (наприклад, складів і попередніх складів), що включають PXD-101 або близькі за структурою сполуки, які вирішують одну або більше з вищевказаних й інших проблем. Автори дійсного винаходу виявили конкретні комбінації компонентів, які дивним і несподіваним чином дозволяють одержати фармацевтичні композиції, що володіють значно поліпшеними властивостями. Такі фармацевтичні композиції представляють одне або більше з наступних переваг: (а) більш висока концентрація іHDAC; (б) підвищена стабільність у концентрованій рідкій формі (наприклад, для зберігання); (в) підвищена стабільність у розведеній рідкій формі (наприклад, у готовій для введення формі); (г) можливість одержання композиції, наприклад, у формі готового для застосування розчину, концентрату для екстемпорального розведення й/або ліофілату/ ліофілізату. Для більше повного опису й розкриття винаходу й рівня техніки в області, до якої належить даний винахід у даній заявці процитований ряд патентів і публікацій. Текст дійсної заявки містить повні посилання на ці джерела. Кожний із цих джерел у повному обсязі включений у дійсний опис за допомогою посилання. КОРОТКИЙ ОПИС ВИНАХОДУ Відповідно до одного аспекту даного винаходу запропонована фармацевтична композиція, що містить: (a) інгібітор HDAC (як визначений у даній заявці) і (б) один або більше з: циклодекстрину, аргініну й меглуміну. В одному з варіантів реалізації інгібіторів HDAC вибирають із сполук наступної формули і їх фармацевтично прийнятних солей, сольватів, амідів, складних ефірів, простих ефірів, хімічно захищених форм і попередників: 3 UA 99810 C2 O N H 5 10 15 20 25 30 35 40 45 50 55 S C O H N OH PXD-101 O Відповідно до одного з аспектів даного винаходу запропонована фармацевтична композиція (така як наприклад, склад, попередній склад), у підходящому контейнері (наприклад, флаконі, ампулі, ємностідля внутрішньовенної (в.в.) інфузії). Відповідно до одного аспекту даного винаходу запропоновані флакон або ампула, що містить фармацевтичну композицію (наприклад, склад, попередній складу), описану в даній заявці. Відповідно до одного аспекту даного винаходу запропонована ємність для внутрішньовенної (в.в.) інфузії, що містить фармацевтичну композицію (наприклад, склад), описану в даній заявці. Відповідно до одного аспекту даного винаходу запропонована тверда лікарська форма (наприклад, таблетка, капсула або желатинова таблетка), що містить фармацевтичну композицію (наприклад, склад), описану в даній заявці. Відповідно до одного аспекту даного винаходу запропонований спосіб одержання композиції (наприклад, попереднього складу, складу) (описаних у даній заявці) шляхом об'єднання: (a) інгібітору деацетилази гістонів (HDACi), описаного в даній заявці й (б) одного або більше з наступних додаткових компонентів: циклодекстрин, аргінін і меглумін; і можливо одного або більше з інших додаткових фармацевтично прийнятних компонентів (описаних у даній заявці). Відповідно до одного аспекту даного винаходу запропонований спосіб одержання складу інгібітору HDAC (описаного в даній заявці), що включає стадію об'єднання зазначеного іHDAC з одним або більше з наступних додаткових компонентів: циклодекстрин, аргінін і меглумін (як описаний у даній заявці); і, можливо, одного або більше із других додаткових фармацевтично прийнятних компонентів (описаних у даній заявці). Відповідно до одного аспекту даного винаходу запропонований спосіб збільшення концентрації інгібітору HDAC (описаного в даній заявці) у фармацевтичній композиції, що включає етап введення до складу склад зазначеного іHDAC з одним або більше з наступних додаткових компонентів: циклодекстрин, аргінін і меглумін (описані в даній заявці); і, можливо, одного з інших фармацевтично прийнятних компонентів (описаних у даній заявці). Відповідно до одного аспекту даного винаходу запропоновані компоненти фармацевтичної композиції, описаної в даній заявці (наприклад, інгібітор HDAC; один або більше з: циклодекстрину, аргініну й меглуміну; і т.п.) для застосування в способі лікування людини або тварини шляхом терапії. Відповідно до одного з аспектів даного винаходу запропонована фармацевтична композиція (наприклад, попередній склад, склад), описана в даній заявці, для застосування в способі лікування людини або тварини шляхом терапії. Відповідно до одного з аспектів даного винаходу запропоноване застосування компонентів фармацевтичної композиції, описаної в даній заявці (наприклад, іHDAC; одного або більше із циклодекстрину, аргініну й меглуміну; і т.п.) у виробництві лікарського препарату для лікування патологічного стану, описаного в даній заявці. Відповідно до одного з аспектів даного винаходу запропоноване застосування фармацевтичної композиції (наприклад, попереднього складу), описаної в даній заявці, у виробництві лікарського препарату для лікування патологічного стану, описаного в даній заявці. Відповідно до одного з аспектів даного винаходу запропонований спосіб лікування, що включає введення суб'єктові, що потребує лікування, фармацевтичної композиції (наприклад, препарату), описаної в даній заявці. Відповідно до одного з аспектів даного винаходу запропонований спосіб (a) регуляції (наприклад, інгібування) проліферації клітин; (б) інгібування ходу клітинного циклу; (в) стимуляції апоптозу; або (г) комбінації одного або більше з перерахованого, in vitro або in vivo, причому зазначений спосіб включає приведення клітини в контакт із фармацевтичною композицією (наприклад, складом), описаної в даній заявці. Відповідно до одного з аспектів даного винаходу запропонований спосіб введення інгібітору HDAC, описаного в даній заявці, суб'єктові, що включає введення зазначеному суб'єктові фармацевтичної композиції (наприклад, складу), описаної в даній заявці. 4 UA 99810 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до одного з аспектів даного винаходу запропонований набір (або набір компонентів) що включає: (a) фармацевтичну композицію (наприклад, попередній склад або склад), описану в даній заявці, переважно надану у підходящому контейнері й/або з підходящим упакуванням, і (б) інструкцію із застосування, наприклад, письмову інструкцію із введення складу й т.п. Відповідно до одного з аспектів даного винаходу запропонований набір (або набір компонентів), що включає: (a) фармацевтичну композицію (наприклад, попередній склад), описану в даній заявці, переважно надану у підходящому контейнері й/або з підходящим упакуванням, і (б) інструкцію із застосування, наприклад, письмову інструкцію з готування відповідного фармацевтичного складу з композиції (наприклад, попереднього складу) і наступному введенню складу, і т.п. Як очевидно для фахівця в даній області, характерні ознаки кращі варіанти реалізації одного аспекту винаходу також відносяться до інших аспектів винаходу. КОРОТКИЙ ОПИС ГРАФІЧНИХ МАТЕРІАЛІВ На Фігурі 1 представлена діаграма фазової розчинності для гідроксипропил-βциклодекстрину (HP-β-CD) у вигляді графіка залежності концентрації інгібітору HDAC (PXD-101) (мг/мол) від концентрації HP-β-CD (мг/мол). На Фігурі 2 представлений профіль розчинності в буферизованому до заданого значення рН циклодекстрині, у вигляді графіка залежності концентрації інгібітору HDAC (PXD-101) (мг/мол) від pH для 25% мас./про. HP-β-CD. На Фігурі 3 представлена діаграма фазової розчинності in situ солеутворювачів аргініну й меглуміну, що являє собою графік залежності концентрації інгібітору HDAC (PXD 101) (мг/мол) від концентрації солеутворювачів (аргінін (ромби) або меглуміну (квадрати)) (мг/мол). На Фігурі 4 представлена діаграма фазової розчинності для комбінації циклодекстрину й in situ солеутворювачів аргініну й меглуміну у вигляді графіка залежності концентрації інгібітору HDAC (PXD 101) (мг/мол) від концентрацій солеутворювача (аргініну або меглуміну) (мг/мол), як у присутності (суцільні лінії; аргінін = трикутники; меглумін = квадрати), так і під час відсутності (пунктирні лінії; аргінін =ромби; меглумін = квадрати) 25 % мас/про. HP-β-CD. На Фігурі 5 представлена діаграма профілю pH для комбінації циклодекстрину й in situ солеутворювачів аргініну й меглуміну у вигляді графіка залежності концентрації інгібітору HDAC концентрації (PXD 101) (мг/мол) від pH фосфатного буфера (ромби), аргініну (квадрати) або меглуміну (трикутники) у кожному випадку з 25% мас./про. HP-β-CD. На Фігурі 6 представлений графік, що показує середні значення Cmax (± SD) після в. в. введення PXD101 на 1-у добу, виміряні у 2-4 суб'єктів для кожного рівня дози. На Фігурі 7 представлений графік, що показує середні значення площі під кривою (ФГС) (±SD) після в. в. введення PXD101 в день 1, виміряні у 2-4 суб'єктів для кожного рівня дози. На Фігурі 8 представлений графік, що показує середні значення виведення (кліренсу) (±SD) після в. в. введення PXD101 в день 1, виміряні у 2-4 суб'єктів для кожного рівня дози. На Фігурі 9 представлені дані Вестерн-блот аналізу, що демонструють ацетилування гістонів H3 й H4 у мононуклеарах периферичної крові в зазначені моменти часу після введення дози. На Фігурі 10 представлений графік, що демонструє ступінь ацетилування, виражений у формі денситометричного показника ацетилування H4 у зразках МНПК відносно H4 в обробленій стандартній клітинній лінії (A2780) як функції часу. На Фігурі 11 представлені дані Вестерн-блот аналізу, що демонструють експресію білків SKP1 CIP1WAF1 (p19 , p21 , Apaf-1 і вінкулін), залучених у блокування клітинного циклу й апоптоз, з 2 лімфоцитів, отриманих від суб'єкта в ході 2 й 4 циклу лікування PXD101 при 900 мг/м . На Фігурі 12 представлений графік, що демонструє порівняльні дані по в. в. і пероральному введенню препарату 3 суб'єктам (обидва аналізи проведені на тих самих суб'єктах, пероральне 2 введення здійснювали на 1-у добу, цикл 3) при 900 й 1200 мг/м . Рівні в плазмі нормували по 2 дозі 900 мг/м , припускаючи пряму пропорційність доз. Значення = середнє ± SE. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Відповідно до одного з аспектів даного винаходу запропоновані фармацевтичні композиції, придатні для введення суб'єктові (надалі названі «складами»), а також фармацевтичні композиції (наприклад, ліофілат/ліофілізати, концентрати, і т.п.), з яких можна одержати такі склади (надалі названі «попередніми складами»). Введення В одному з варіантів реалізації введення являє собою парентеральне введення. В одному з варіантів реалізації введення являє собою введення шляхом ін'єкції, включаючи, наприклад, підшкірну, внутрішньошкірну, внутрішньом'язову, внутрішньовенну, 5 UA 99810 C2 5 10 15 20 25 30 35 40 45 50 55 внутрішньоартеріальну, внутрішньосерцеву, інтратекальну, інтраспінальну, інтракапсулярну, субкапсулярну, інтраорбітальну, внутрішньочеревну, внутрішньотрахеальну, субкутикулярну, внутрішньосуглобну, субарахноідальную й надчеревну ін'єкцію. В одному з варіантів реалізації введення являє собою внутрішньовенне введення. В одному з варіантів реалізації введення являє собою введення шляхом внутрішньовенної ін'єкції. В одному з варіантів реалізації введення являє собою введення шляхом інфузії. В одному з варіантів реалізації введення являє собою введення шляхом внутрішньовенної інфузії. Наприклад, в одному із кращих варіантів реалізації композицію (наприклад, попередній склад) додають до сольового розчину або розчину глюкози (наприклад, у стандартний мішок обсягом 1 л із сольовим розчином або розчином глюкози для внутрішньовенного введення), і використають отриману композицію (наприклад, склад) для введення шляхом внутрішньовенної інфузії. «Інфузія» відрізняється від «ін'єкції» тим, що термін «інфузія» описує пасивне надходження речовини (наприклад, рідини, інгібітору HDAC, електроліту й т.п.) у вену або тканини під дією сили ваги, тоді як термін «ін'єкція» описує активне введення речовини у вену або тканини за рахунок додаткових сил, наприклад, тиску в шприці. Введення можна здійснюватися у вигляді однієї дози, безупинно або із проміжками (наприклад, частинами дози через певні інтервали) протягом курсу лікування. Способи визначення найбільш ефективних засобів і дозувань введення добре відомі фахівцям у даній області й залежать від конкретного препарату, застосовуваного для терапії, завдання терапії, клітини (клітин)-мішені, на яку спрямоване лікування, і суб'єкта, що піддається лікуванню. Дози й схеми для одноразового або багаторазового введення можуть бути обрані лікарем, лікаремконсультантом або ветеринаром. Суб'єкт В одному з варіантів реалізації винаходу суб'єкт являє собою тварину; ссавця; плацентарного ссавця, гризуна (наприклад, морську свинку, хом'яка, пацюка, мишу), тварину сімейства мишачих (наприклад, миша), тварину сімейства зайцеподібних (наприклад, кролика), тварину сімейства собачих (наприклад, собаку), тварину сімейства котячих (наприклад, кішку), тварину сімейства кінських (наприклад, кінь), тварину сімейства свиней (наприклад, свиню), тварину сімейства овець (наприклад, вівцю), тварину сімейства биків (наприклад, корову), примата, тварину підзагону мавп (наприклад, нижчу вузьконосу мавпу або людиноподібну мавпу), нижчу вузьконосу мавпу (наприклад, мавпу, павіана), людиноподібну мавпу (наприклад, горилу, шимпанзе, орангутанга, гібона) або людину. В одному з варіантів реалізації суб'єкт являє собою людину, тобто, живу людину, включаючи живого зародка людини, живої дитини й живого дорослого. Компоненти Фармацевтичні композиції згідно з даним винаходом включають щонайменше наступні компоненти: (а) іHDAC, як визначено в даній заявці; і (б) один або більше з наступних додаткових інгредієнтів: циклодекстрин, аргінін і меглумін В одному з варіантів реалізації (б) являє собою циклодекстрин. В одному з варіантів реалізації (б) являє собою аргінін. В одному з варіантів реалізації (б) являє собою меглумін. В одному з варіантів реалізації (б) являє собою циклодекстрин й аргінін. В одному з варіантів реалізації (б) являє собою циклодекстрин і меглумін. В одному з варіантів реалізації (б) являє собою аргінін і меглумін. В одному з варіантів реалізації (б) являє собою циклодекстрин, аргінін, і меглумін. Кожний із цих компонентів обговорюється більш докладно нижче. В одному з варіантів реалізації фармацевтична композиція включає один або дещо інший додатковий інгредієнт (наприклад, фармацевтично прийнятний носій і т.п.). Інгібітор HDAC Фармацевтичні композиції згідно з даним винаходом включають інгібітор HDAC, що являє собою сполуки карбамінової кислоти, що містить сульфаніламідний зв'язок. Приклади таких інгібіторів HDAC представлені, наприклад, у роботі Watkins і співавторів (Watkins, C., et al., 2002, публікація міжнародної заявки на патент (PCT) номер WO 02/30879). 6 UA 99810 C2 5 В одному з варіантів реалізації інгібітор HDAC являє собою сполуки карбамінової кислоти, що включає сульфаніламідний зв'язок, як визначено в роботі Watkins і співавторів (Watkins, C., et al., 2002, публікація міжнародної заявки на патент (PCT) WO 02/30879). В одному з варіантів реалізації винаходу інгібітор HDAC вибирають із сполук наступної формули: O A 10 15 20 25 30 35 40 45 50 55 1 Q J 2 Q C N OH H де: А незалежно являє собою: C6-20карбоарил або C5-20гетероарил, і є не заміщеним або заміщеним; 1 Q незалежно являє собою: ковалентний зв'язок, C1- 7алкилен, C2- 7алкенилен, і є не заміщеним або заміщеним; J незалежно являє собою: N - NR -S(=O)2-, або N -S(=O)2-NR -; N R незалежно являє собою: -H, C1-7алкіл, C3-20гетероцикліл, C6-20карбоарил, C5-20гетероарил, C6-20карбоарил-C1-7алкіл або C5-20гетероарил-C1-7алкіл, і є не заміщеним або заміщеним; 2 Q незалежно являє собою: C6-20карбоарилен, C5-20гетероарилен, C6-20карбоарилен-C1- 7алкилен, C5-20гетероарилен-C1- 7алкилен, C6-20карбоарилен-C2- 7алкенилен, C5-20гетероарилен-C2- 7алкенилен, C1- 7алкилен C6-20карбоарилен, C1- 7алкилен C5-20гетероарилен, C2- 7алкенилен C6-20карбоарилен, C2- 7алкенилен C5-20гетероарилен, C1- 7алкилен C6-20карбоарилен-C1- 7алкилен, C1- 7алкилен C5-20гетероарилен-C1- 7алкилен, C2- 7алкенилен C6-20карбоарилен-C1- 7алкилен, C2- 7алкенилен C5-20гетероарилен-C1- 7алкилен, C1- 7алкилен C6-20карбоарилен C2- 7алкенилен, C1- 7алкилен- C5-20гетероарилен C2- 7алкенилен, C2- 7алкенилен- C6-20карбоарилен- C2- 7алкенилен або C2- 7алкенилен- C5-20гетероарилен-C2- 7алкенилен, і є не заміщеним або заміщеним; і його фармацевтично прийнятних солей, сольватів, амідів, складних ефірів, простих ефірів хімічно захищених форм і проліків. В одному з варіантів реалізації винаходу інгібітор HDAC також є інгібітором деацетилази гістонів. Фахівець у даній області без ускладнення зможе визначити, чи є припустимий інгібітор HDAC інгібітором HDAC чи ні. Способи аналізу, які можна застосовувати для оцінки інгібування HDAC, описані в роботі Watkins і співавторів (Watkins, C., et al., 2002), див. публікацію міжнародної заявки (PCT) WO 02/30879. 7 UA 99810 C2 5 10 15 20 25 У кращому варіанті реалізації група карбамінової кислоти, -C(=O)NHOH, не модифікована (наприклад, не є складним ефіром). 1 2 Не передбачається, що Q й Q напряму зв'язані один з одним. 1 N Не передбачається, що Q й R напряму зв'язано один з одним. 2 N Не передбачається, що Q й R напряму зв'язані один з одним. N Не передбачається, що A й R напряму зв'язано один з одним. 2 Не передбачається, що A й Q напряму зв'язані один з одним. Інгібітори HDAC: Група A Група А незалежно являє собою C6- 20карбоарил або C5-20гетероарил й є не заміщеною або заміщеною. В одному з варіантів реалізації A незалежно являє собою C 6- 10карбоарил або C5гетероарил й є не заміщеним або заміщеним. 10 В одному з варіантів реалізації А незалежно являє собою C 6-10карбоарил або C56гетероарил й є не заміщеним або заміщеним. В одному з варіантів реалізації А незалежно являє собою похідну: бензолу, нафталіну, карбазолу, піридину, піролу, фурану, тіофену або тіазолу; і є не заміщеним або заміщеним. Фраза «являє собою похідну» у даному контексті ставиться до сполук, які мають такі ж атоми кільця в такій же орієнтації/конфігурації, як і батьківська циклічна група, і в такий спосіб включає, наприклад, гідроване (наприклад, частково насичене, повністю насичене), карбонілзаміщений й інші заміщені похідні. Наприклад, і «піролідон» й «N-метилпірол» є похідними піролу. В одному з варіантів реалізації винаходу A незалежно являє собою: феніл, нафтил, карбазоліл, піридиніл, піроліл, фураніл, тіеніл або тіозоліл; і є не заміщеним або заміщеним. В одному з варіантів реалізації А незалежно являє собою феніл й є не заміщеним або заміщеним (наприклад, містить 1, 2, 3, 4 або 5 заступників). В одному з варіантів реалізації винаходу А незалежно являє собою: R 30 35 40 45 50 55 A n В одному з варіантів реалізації n являє собою 0, 1, 2, 3, 4 або 5. В одному з варіантів реалізації n являє собою 0, 1, 2, 3 або 4. В одному з варіантів реалізації n являє собою 0, 1, 2 або 3. В одному з варіантів реалізації n являє собою 0, 1 або 2. В одному з варіантів реалізації n являє собою 0 або 1. В одному з варіантів реалізації n являє собою 1, 2, 3, 4 або 5. В одному з варіантів реалізації n являє собою 1, 2, 3 або 4. В одному з варіантів реалізації n являє собою 1, 2 або 3. В одному з варіантів реалізації n являє собою 1 або 2. В одному з варіантів реалізації n являє собою 5. В одному з варіантів реалізації n являє собою 4. В одному з варіантів реалізації n являє собою 3. В одному з варіантів реалізації n являє собою 2. В одному з варіантів реалізації n являє собою 1. В одному з варіантів реалізації n являє собою 0. A В одному з варіантів реалізації винаходу кожний із заступників R , якщо є присутнім, незалежно має значення, визначене нижче під заголовком «інгібітори HDAC: Заступники». В одному з варіантів реалізації А є не заміщеним. 1 Інгібітор HDAC: Група Q 1 Група Q незалежно являє собою ковалентний зв'язок, C1- 7алкилен або C2- 7алкенилен й є не заміщеною або заміщеною. 1 В одному з варіантів реалізації, Q незалежно являє собою ковалентний зв'язок або C17алкилен є не заміщеним або заміщеним. Термін «алкилен» у даній заявці відноситься до бідентарної групи, отриманої шляхом видалення двох атомів водню, або перебування в одному атомі вуглецю, або по одному в кожного із двох різних атомів вуглецю, насичених вуглеводних сполук (сполук, що складаються з атомів вуглецю й атомів водню), що має від 1 до 20 атомів вуглецю (якщо не зазначено інше), що може бути аліфатичним (тобто лінійним або розгалуженим) або аліциклічним (тобто циклічним, але не ароматичною сполукою). 8 UA 99810 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін «алкенілен» при використанні в даній заявці ставиться до бідентатної групи, отриманої шляхом видалення двох атомів водню, які або обоє перебувають у того самого атома вуглецю або по одному в кожного із двох різних атомів вуглецю, вуглеводних сполук (сполук, що складається з атомів вуглецю й атомів водню), що має від 1 до 20 атомів вуглецю (якщо не зазначено інакше) і має щонайменше одна вуглець-вуглецева подвійна сполука, і яка може бути аліфатичною (тобто, лінійною або розгалуженою) або аліциклічною (тобто, циклічною, але не ароматичною сполукою). 1 В одному з варіантів реалізації винаходу Q незалежно являє собою C1- 7алкилен або C27алкенилен й є не заміщеним або заміщеним. 1 В одному з варіантів реалізації Q незалежно являє собою C1- 4алкилен або З2- 4алкенилен й є не заміщеним або заміщеним. 1 В одному з варіантів реалізації винаходу Q незалежно являє собою C1- 3алкилен або C23алкенилен й є не заміщеним або заміщеним. 1 В одному з варіантів реалізації винаходу Q незалежно являє собою C2- 7алкилен або C27алкенилен й є не заміщеним або заміщеним. 1 В одному з варіантів реалізації Q незалежно являє собою C2- 4алкилен або C2- 4алкенилен й є не заміщеним або заміщеним. 1 В одному з варіантів реалізації Q незалежно являє собою C2- 3алкилен або C2- 3алкенилен й є не заміщеним або заміщеним. 1 В одному з варіантів реалізації Q незалежно являє собою C2алкилен або C2алкенилен й є не заміщеним або заміщеним. 1 В одному з варіантів реалізації Q незалежно являє собою C1- 7алкилен й є не заміщеним або заміщеним. 1 В одному з варіантів реалізації Q незалежно являє собою C1- 4алкилен й є не заміщеним або заміщеним. 1 В одному з варіантів реалізації Q незалежно являє собою C1- 3алкилен й є не заміщеним або заміщеним. 1 В одному з варіантів реалізації Q незалежно являє собою C2- 7алкилен й є не заміщеним або заміщеним. 1 В одному з варіантів реалізації Q незалежно являє собою C2- 4алкилен й є не заміщеним або заміщеним. 1 В одному з варіантів реалізації Q незалежно являє собою C2- 3алкилен й є не заміщеним або заміщеним. 1 В одному з варіантів реалізації Q незалежно являє собою C2-3алкилен й є не заміщеним або заміщеним. 1 В одному з варіантів реалізації Q незалежно є аліфатичним. 1 В одному з варіантів реалізації Q незалежно є лінійним. 1 В одному з варіантів реалізації Q незалежно є розгалуженим. 1 В одному з варіантів реалізації Q незалежно є не заміщеним. Всі ймовірні комбінації варіантів реалізацій, описані вище, явно розкриті в даній заявці, так якби кожна комбінація була б описана окремо і явно. 1 В одному з варіантів реалізації Q незалежно являє собою: ковалентний зв'язок-CH2-, (CH2)2-, -(CH2)3-, -(CH2)4-, -CH=CH-, -CH=CHCH2-, -CH2CH=CHCH2-, -CH=CHCH=CH- або -CH2CH2CH=CH-. 1 В одному з варіантів реалізації Q незалежно являє собою: ковалентний зв'язок, -CH2-, CH2CH2- або -CH=CH-. 1 В одному з варіантів реалізації Q незалежно являє собою: ковалентний зв'язок, -CH2CH2або -CH=CH-. 1 В одному з варіантів реалізації Q незалежно являє собою: ковалентний зв'язок. 1 В одному з варіантів реалізації Q незалежно являє собою: -CH2CH2- або -CH=CH-. 1 В одному з варіантів реалізації Q незалежно являє собою: -CH2CH2Інгібітор HDAC: Група J N N Група J незалежно являє собою -NR -S(=O)2- або -S(=O)2-NR -. N В одному з варіантів реалізації J незалежно являє собою -NR -S(=O)2- («зворотній сульфаніламід»). N В одному з варіантів реалізації J незалежно являє собою -S(=O)2-NR - («прямий сульфаніламід»). N Інгібітор HDAC: Група R N Група R незалежно являє собою: -H, 9 UA 99810 C2 5 10 15 20 25 30 35 40 45 50 55 60 C1- 7алкіл, C3- 20гетероциклил, C6- 20карбоарил, C5-20гетероарил, C6- 20карбоарил- C1- 7алкіл або C5-20гетероарил- C1- 7алкіл, і є не заміщеною або заміщеною. N В одному з варіантів реалізації R незалежно являє собою: -H, C1- 7алкіл, C6- 20карбоарил або C6- 20карбоарил- C1- 7алкіл, і є не заміщеним або заміщеним. В одному з варіантів реалізації кожен C6- 20карбоарил являє собою C6- 10карбоарил. В одному з варіантів реалізації кожен C5- 20гетероарил являє собою C5- 10гетероарил. В одному з варіантів реалізації кожен C6- 20карбоарил являє собою C6карбоарил. В одному з варіантів реалізації певний або будь-який C5-20гетероарил являє собою C56гетероарил. В одному з варіантів реалізації C3- 20гетероциклил являє собою C3- 10гетероциклил. В одному з варіантів реалізації C3- 20гетероциклил являє собою C5- 7гетероциклил. В одному з варіантів реалізації кожен C1- 7алкіл являє собою C1- 4алкіл. В одному з варіантів реалізації кожен C1- 7алкіл являє собою C1- 3алкіл. В одному з варіантів реалізації кожен C1- 7алкіл являє собою C1- 2алкіл. В одному з варіантів реалізації кожен алкіл незалежно є аліфатичним. В одному з варіантів реалізації кожен алкіл незалежно є лінійним. В одному з варіантів реалізації кожен алкіл незалежно є розгалуженим. В одному з варіантів реалізації кожен алкіл незалежно є насиченим. В одному з варіантів реалізації кожен алкіл незалежно є частково насиченим. N В одному з варіантів реалізації, R незалежно є не заміщеним. Всі ймовірні комбінації варіантів реалізацій, описаних вище, явно розкриті в даній заявці, так якби кожна комбінація була б описана окремо і явно. N В одному з варіантів реалізації, R незалежно являє собою: -H або C1- 7алкіл й є не заміщеним або заміщеним. N В одному з варіантів реалізації R незалежно являє собою: -H або не заміщений C1-4алкіл. N В одному з варіантів реалізації R незалежно являє собою: -H або не заміщений насичений C1-4алкіл. N В одному з варіантів реалізації R незалежно являє собою: -H або не заміщений насичений аліфатичний C1-4алкіл. N В одному з варіантів реалізації R незалежно являє собою: -H, -Me, -Et, -nPr, -iPr, -nBu, sBu, -iBu, або -tBu. N В одному з варіантів реалізації, R незалежно являє собою: -H, -Me або -Et. N В одному з варіантів реалізації, R незалежно являє собою: -H або -Me. 2 Інгібітор HDAC: Група Q 2 Група Q незалежно являє собою: C6-20карбоарилен, C5-20гетероарилен, C6-20карбоарилен-C1-7алкилен, C5-20гетероарилен-C1-7алкилен, C6-20карбоарилен-C2-7алкенилен, C5-20гетероарилен-C2-7алкенилен, C1-7алкилен-C6-20карбоарилен, C1-7алкилен-C5-20гетероарилен, C2-7алкенилен-C6-20карбоарилен, C2-7алкенилен-C5-20гетероарилен, C1-7алкилен-C6-20карбоарилен-C1-7алкилен, C1-7алкилен-C5-20гетероарилен-C1-7алкилен, C2-7алкенилен-C6-20карбоарилен-C1-7алкилен, C2-7алкенилен-C5-20гетероарилен-C1-7алкилен, C1-7алкилен-C6-20карбоарилен- C2- 7алкенилен, C1-7алкилен-C5-20гетероарилен- C2- 7алкенилен, 10 UA 99810 C2 5 10 15 20 25 30 35 40 45 50 55 60 C2-7алкенилен-C6-20карбоарилен- C2- 7алкенилен, або C2-7алкенилен- C5- 20гетероарилен- C2- 7алкенилен, і є не заміщеним або заміщеним. 2 В одному з варіантів реалізації Q незалежно являє собою: C6-10карбоарилен, C5-10гетероарилен, C6-10карбоарилен-C1- 7алкилен, C5-10гетероарилен-C1- 7алкилен, C6-10карбоарилен-C2- 7алкенилен, C5-10гетероарилен-C2- 7алкенилен, C1- 7алкилен-C6-10карбоарилен, C1- 7алкилен-C5-10гетероарилен, C2- 7алкенилен-C6-10карбоарилен, C2- 7алкенилен C5-10гетероарилен, C1- 7алкилен- C6- 10карбоарилен- C1- 7алкилен, C1- 7алкилен- C5- 10гетероарилен- C1- 7алкилен, C2- 7алкенилен- C6- 10карбоарилен- C1- 7алкилен, C2- 7алкенилен- C5- 10гетероарилен- C1- 7алкилен, C1- 7алкилен- C6- 10карбоарилен- C2- 7алкенилен, C1- 7алкилен- C5- 10гетероарилен- C2- 7алкенилен, C2- 7алкенилен- C6- 10карбоарилен- C2- 7алкенилен або C2- 7алкенилен- C5- 10гетероарилен- C2- 7алкенилен, і є не заміщеним або заміщеним. 2 В одному з варіантів реалізації Q незалежно являє собою: C6карбоарилен, C5-6гетероарилен, C6карбоарилен-C1- 7алкилен, C5-6гетероарилен-C1- 7алкилен, C6карбоарилен-C2- 7алкенилен, C5-6гетероарилен-C2- 7алкенилен, C1- 7алкилен- C6карбоарилен, C1- 7алкилен- C5-6гетероарилен, C2- 7алкенилен- C6карбоарилен, C2- 7алкенилен- C5-6гетероарилен, C1- 7алкилен-C6карбоарилен- C1- 7алкилен, C1- 7алкилен- C5- 6гетероарилен- C1- 7алкилен, C2- 7алкенилен- C6карбоарилен- C1- 7алкилен, C2- 7алкенилен- C5-6гетероарилен- C1- 7алкилен, C1- 7алкилен- C6карбоарилен- C2- 7алкенилен, C1- 7алкилен- C5-6гетероарилен- C2- 7алкенилен, C2- 7алкенилен- C6карбоарилен- C2- 7алкенилен, або C2- 7алкенилен- C5-6гетероарилен- C2- 7алкенилен, і є не заміщеним або заміщеним. 2 В одному з варіантів реалізації Q незалежно являє собою: фенілен, фенілен-C1- 7алкилен, фенілен-C2- 7алкенилен, C1- 7алкилен фенілен, C2- 7алкенилен фенілен, C1- 7алкилен фенілен-C1- 7алкилен, C2- 7алкенилен фенілен-C1- 7алкилен, C1- 7алкилен фенілен-C2- 7алкенилен або C2- 7алкенилен фенілен-C2- 7алкенилен, і є не заміщеним або заміщеним. 2 В одному з варіантів реалізації Q незалежно являє собою: фенілен, фенілен-C1- 7алкилен або фенілен-C2- 7алкенилен, і є не заміщеним або заміщеним. 11 UA 99810 C2 5 10 15 20 В одному з варіантів реалізації кожен C1- 7алкилен являє собою C1- 4алкилен. В одному з варіантів реалізації кожен C1- 7алкилен являє собою C1- 3алкилен. В одному з варіантів реалізації кожен C1- 7алкилен являє собою C1- 2алкилен. В одному з варіантів реалізації кожен C1- 7алкилен являє собою C2алкилен В одному з варіантів реалізації кожен C1- 7алкилен являє собою C2- 4алкенилен. В одному з варіантів реалізації кожен C1- 7алкилен являє собою C2- 3алкенилен. В одному з варіантів реалізації кожен C1- 7алкилен являє собою C2алкенилен. В одному з варіантів реалізації приєднання до фенілену відбувається в мета- або параположенні. В одному з варіантів реалізації приєднання до фенілену відбувається в мета - положенні. В одному з варіантів реалізації приєднання до фенілену відбувається в пара -положенні. 2 В одному з варіантів реалізації Q незалежно являє собою орто-, мета- або пара-феніленетилен й є не заміщеним або заміщеним. 2 одному з варіантів реалізації Q незалежно являє собою орто-, мета - або пара -феніленетенилен і є не заміщеним або заміщеним. В одному з варіантів реалізації етенилен являє собою цис- або транс-етенилен. В одному з варіантів реалізації етенилен являє собою транс-етенилен. 2 В одному з варіантів реалізації Q незалежно являє собою мета-фенілен-етенилен й є не заміщеним або заміщеним. 2 В одному з варіантів реалізації Q є не заміщеним. Всі ймовірні комбінації варіантів реалізацій, описаних вище, явно розкриті в даній заявці, так якби кожна комбінація була б описана окремо і явно. 2 В одному з варіантів реалізації Q незалежно являє собою: 25 В одному з варіантів реалізації, Q2 незалежно являє собою: 30 35 40 45 50 Інгібітор HDAC: замісники 1 N 2 A В одному з варіантів реалізації кожен замісник (наприклад, в A, Q , R , Q ) (наприклад, R ), якщо є присутнім, незалежно обраний з: (1) карбонової кислоти; (2) складного ефіру; (3) амідо або тиоамідо; (4) ацила; (5) гало; (6) циано; (7) нітро; (8) гідрокси; (9) простого ефіру; (10) тиола; (11) тиоефиру; (12) ацилокси; (13) карбамату; (14) аміно; (15) ациламіно або тиоациламіно; (16) аміноациламіно або амінотиоациламіно; (17) сульфонаміно; (18) сульфоніла; (19) сульфоната; (20) сульфонамідо; (21) оксо; (22) іміно; (23) гідроксиииміно; (24) C 5-20арил-C1-7алкілу; (25) C5-20арила; (26) C3-20гетероциклила; (27) C1- 7алкіли; (28) бідентатної діоксигрупи. 1 N 2 В одному з варіантів реалізації кожний із замісників (наприклад, в A, Q , R , Q ) (наприклад, A R ), якщо є присутнім, незалежно обраний з: (1) -C(=O)OH; 1 1 (2) -C(=O)OR , де R незалежно має значення, визначене в (24), (25), (26) або (27); 2 3 2 3 2 3 (3) -C(=O)NR R або -C(=S)NR R , де кожний з R й R незалежно є -H; або має значення, 2 3 визначене в (24), (25), (26) або (27); або R й R разом з атомом азоту, до якого вони приєднані, утворять кільце, що має від 3 до 7 атомів кільця; 4 4 (4) -C(=O)R , де R незалежно є -H або має значення, визначене в (24), (25), (26) або (27); (5) -F, -Cl, -Br, -I; (6) -CN; (7) -NO2; (8) -OH; 5 5 (9) -OR , де R незалежно має значення, визначене в (24), (25), (26) або (27); (10) -SH; 12 UA 99810 C2 6 5 10 15 20 25 30 35 40 45 50 55 60 6 (11) -SR , де R незалежно має значення, визначене в (24), (25), (26) або (27); 7 7 (12) -OC(=O)R , де R незалежно є таким, як визначено в (24), (25), (26) або (27); 8 9 8 9 (13) -OC(=O)NR R , де кожний з R й R незалежно є -H; або має значення, визначене в 8 9 (24), (25), (26) або (27); або R й R разом з атомом азоту, якому вони приєднані, формують кільце, що має від 3 до 7 атомів кільця; 10 11 10 11 (14) -NR R , де кожний з R й R незалежно є -H; або таким, як визначено в (24), (25), 10 11 (26) або (27); або R й R разом з атомом азоту, до якого вони приєднані, формують кільце, що має від 3 до 7 атомів кільця; 12 13 12 13 12 (15) -NR C(=O)R або -NR C(=S)R , де R незалежно є -H; або має значення, визначене 13 в (24), (25), (26) або (27); і R незалежно є -H або має значення, визначене в (24), (25), (26) або (27); 14 15 16 14 15 16 14 (16) -NR C(=O)NR R або -NR C(=S)NR R , де R незалежно є -H; або має значення, 15 16 визначене в (24), (25), (26) або (27); і кожний з R й R незалежно є -H; або таким, як 15 16 визначено в (24), (25), (26) або (27); або R й R разом з атомом азоту, до якого вони приєднані, утворять кільце, що має від 3 до 7 атомів кільця; 17 18 17 (17) -NR SO2R , де R незалежно є -H; або має значення, визначене в (24), (25), (26) або 18 (27); і R незалежно є -H або має значення, визначене в (24), (25), (26) або (27); 19 19 (18) -SO2R , де R незалежно має значення, визначене в (24), (25), (26) або (27); 20 20 (19) -OSO2R і де R незалежно має значення, визначене в (24), (25), (26) або (27); 21 22 21 22 (20) -SO2NR R , де кожний з R й R незалежно є -H; або таким, як визначено в (24), (25), 21 22 (26) або (27); або R й R разом з атомом азоту, до якого вони приєднані, формують кільце, що має від 3 до 7 атомів кільця; (21) =O; 23 23 (22) =NR , де R незалежно є -H; або має значення, визначене в (24), (25), (26) або (27); 24 24 (23) =NOR , де R незалежно є -H; або має значення, визначене в (24), (25), (26) або (27); (24) C5-20арил-C1- 7алкіл, наприклад, де C5-20арил визначений в (25); не заміщеними або заміщений, наприклад, однієї або більше групами певними в (1) -(28); (25) C5-20арил, включаючи C6-20карбоарил й C5-20гетероарил; не заміщеними або заміщений, наприклад, однієї або більше групами, визначеними в (1) -(28); (26) C3- 20гетероциклил; не заміщеними або заміщений, наприклад, однієї або більше групами, певними в (1) -(28); (27) C1-7алкіл, C2-7алкенил, C2-7алкинил, C3-7циклоалкил, C3-7циклоалкенил, C37циклоалкинил, не заміщеними або заміщений, наприклад, однієї або більше групами, визначене в (1) -(26); і 25 25 (28) -O-R -O-, де R незалежно являє собою насичений C1-3алкіл і незалежно є не заміщеним або заміщеним одним або більше (наприклад, 1, 2, 3, 4) із заступників, певних в (5). Деякі приклади (27) включають наступне: гало-C1- 7алкіл; аміно-C1- 7алкіл (наприклад, -(CH2)w-аміно, w являє собою 1, 2, 3 або 4); амідо-C1- 7алкіл (наприклад, -(CH2)w-амідо, w являє собою 1, 2, 3 або 4); ациламідо-C1- 7алкіл (наприклад, -(CH2)w-ациламідо, w являє собою 1, 2, 3 або 4); карбокси-C1- 7алкіл (наприклад, -(CH2)w-COOH, w являє собою 1, 2, 3 або 4); ацил-C1- 7алкіл (наприклад, -(ацил CH2)w-, w являє собою 1, 2, 3 або 4); гидрокси-C1- 7алкіл (наприклад, -(CH2)w-ОР, w являє собою 1, 2, 3 або 4); C1- 7алкокси-C1- 7алкіл (наприклад, -(CH2)w-O-C1 7алкіл, w являє собою 1, 2, 3 або 4) 1 N 2 В одному з варіантів реалізації кожний із замісників (наприклад, в A, Q , R , Q ) (наприклад, A R ), якщо є присутнім, незалежно обраний з: ((1) -C(=O)OH; (2) -C(=O)OMe, -C(=O)OEt, -C(=O)O(iPr), -C(=O)O(tBu); -C(=O)O(cPr); -C(=O)OCH2CH2OH, -C(=O)OCH2CH2OMe, -C(=O)OCH2CH2OEt; -C(=O)OPh, -C(=O)OCH2Ph; (3) -(C=O)NH2, -(C=O)NMe2, -(C=O)NEt2, -(C=O)N(iPr)2, -(C=O)N(CH2CH2OH)2; -(C=O)- морфоліно, -(C=O)NHPh, -(C=O)NHCH2Ph; (4) -C(=O)H, -(C=O)Me, -(C=O)Et, -(C=O)(tBu), -(C=O)- cHex, -(C=O)Ph; -(C=O)CH2Ph; (5) -F, -Cl, -Br, -I; (6) -CN; (7) -NO2; (8) -OH; (9) -OMe, -OEt, -O(iPr), -O(tBu), -OPh, -OCH2Ph; -OCF3, -OCH2CF3; 13 UA 99810 C2 5 10 15 20 25 30 35 40 -OCH2CH2OH, -OCH2CH2OMe, -OCH2CH2OEt; -OCH2CH2NH2, -OCH2CH2NMe2, -OCH2CH2N(iPr)2; -OPh- Me, -OPh- OH, -OPh- OMe, -OPh- F, -OPh- Cl, -OPh- Br, -OPh- I; (10) -SH; (11) -SMe, -SEt, -SPh, -SCH2Ph; (12) -OC(=O)Me, -OC(=O)Et, -OC(=O)(iPr), -OC(=O)(tBu); -OC(=O)(cPr); -OC(=O)CH2CH2OH, -OC(=O)CH2CH2OMe, -OC(=O)CH2CH2OEt; -OC(=O)Ph, -OC(=O)CH2Ph; (13) -OC(=O)NH2, -OC(=O)NHMe, -OC(=O)NMe2, -OC(=O)NHEt, -OC(=O)NEt2, -OC(=O)NHPh, -OC(=O)NCH2Ph; (14) -NH2, -NHMe, -NHEt, -NH(iPr), -NMe2, -NEt2, -N(iPr)2, -N(CH2CH2OH)2; -NHPh, -NHCH2Ph; піперидино, піперазино, морфолино; (15) -NH(C=O)Me, -NH(C=O)Et, -NH(C=O)nPr, -NH(C=O)Ph, -NHC(=O)CH2Ph; -NMe(C=O)Me, -NMe(C=O)Et, -NMe(C=O)Ph, -NMe(=O)CH2Ph; (16) -NH(C=O)NH2, -NH(C=O)NHMe, -NH(C=O)NHEt, -NH(C=O)NPh, -NH(C=O)NHCH2Ph; -NH(C=S)NH2, -NH(C=S)NHMe, -NH(C=S)NHEt, -NH(C=S)NPh, -NH(C=S)NHCH2Ph; (17) -NHSO2Me, -NHSO2Et, -NHSO2Ph, -NHSO2PhMe, -NHSO2CH2Ph; -NMeSO2Me, -NMeSO2Et, -NMeSO2Ph, -NMeSO2PhMe, -NMeSO2CH2Ph; (18) -SO2Me, -SO2CF3, -SO2Et, -SO2Ph, -SO2PhMe, -SO2CH2Ph; (19) -OSO2Me, -OSO2CF3, -OSO2Et, -OSO2Ph, -OSO2PhMe, -OSO2CH2Ph; (20) -SO2NH2, -SO2NHMe, -SO2NHEt, -SO2NMe2, -SO2NEt2, -SO2- морфолино, -SO2NHPh, -SO2NHCH2Ph; (21) =O; (22) =NH, =NMe; =NEt; (23) =NOH, =NOMe, =NOEt, =NO(nPr), =NO(iPr), =NO(cPr), =NO(CH 2-cPr); (24) -CH2Ph, -CH2Ph- Me, -CH2Ph- OH, -CH2Ph- F, -CH2Ph- Cl; (25) -Ph, -Ph- Me, -Ph- OH, -Ph- OMe, -Ph-NH2, -Ph- F, -Ph- Cl, -Ph- Br, -Ph- I; піридил, піразиніл, піримидиніл, піридазиніл, фураніл, тиофеніл, піроліл, імідазоліл, піразоліл, оксазоліл, тиазоліл, тіадиазоліл; (26) піролідиніл, імідазолідиніл, піразолідиніл, піперидиніл, піперазиніл, азепиніл, тетрагідрофураніл, тетрагідропираніл, морфолиніл, азетидиніл; (27) -Me, -Et, -nPr, -iPr, -nBu, -iBu, -sBu, -tBu, -nPe; -cPr, -cHex; -CH=CH2, -CH2- CH=CH2; -CF3, -CHF2, -CH2F, -CCl3, -CBr3, -CH2CH2F, -CH2CHF2 й -CH2CF3; -CH2OH, -CH2OMe, -CH2OEt, -CH2NH2, -CH2NMe2; -CH2CH2OH, -CH2CH2OMe, -CH2CH2OEt, -CH2CH2CH2NH2, -CH2CH2NMe2; (28) -O- CH2- O- , -O- CH2- CH2- O- , -O- CH2- CH2- CH2- O- , -O- CF2- O- й -O- CF2- CF2- O- . інгібітор HDAC: Деякі кращі приклади Всі ймовірні комбінації варіантів реалізації, описаних вище, явно розкриті в даній заявці, так якби кожна комбінація була б описана окремо і явно. В одному кращому варіанті реалізації інгібітор HDAC вибирають із сполук наступної формули: O A 1 Q J 2 Q C N OH H 45 50 55 де: A незалежно являє собою: феніл, і є не заміщеним або заміщеним; 1 Q незалежно являє собою: ковалентний зв'язок, -CH2-, -CH2CH2-, -CH=CH-; J незалежно являє собою: N -NR -S(=O)2-, або N -S(=O)2-NR -; N R незалежно являє собою: 14 UA 99810 C2 5 10 15 -H або C1- 4алкіл, і є не заміщеним; 2 Q незалежно являє собою: фенілен-C1- 4алкилен, фенілен-C2- 4алкенилен, і є не заміщеним; і їх фармацевтично прийнятні солі, сольвати, аміди, складні ефіри, прості ефіри, хімічно захищені форми й попередники. В одному з варіантів реалізації інгібітор HDAC вибирають із сполук наступних формул й їхніх заміщених аналогів (наприклад, аналогів, у яких кінцева фенільна група або азот сульфаніламіду й т.п. несуть заміщення, наприклад, одним або більше із замісників, визначених вище під заголовком «інгібітор HDAC: Замісники») і їх фармацевтично прийнятних солей, сольватів, амідів, складних ефірів, простих ефірів, хімічно захищених форм і попередників: H N O 1 S N H C O O O 2 S N H O H N C S N H H N C O 4 N H O H N C N H S C O S N H O C N H S C O S O N H H N OH H N OH O O 8 OH O O 7 H N O O 6 OH O O 5 OH O O S OH O O 3 OH C O 15 H N OH UA 99810 C2 5 В одному з варіантів реалізації іHDAC вибирають із сполук наступної формули і їхніх заміщених аналогів (наприклад, аналогів, у яких кінцева фенільная група, азот сульфоніламіду й т.д. несуть заміщення, наприклад, одним або більше із замісників, описаних з у розділі «Інгібітор HDAC: Замісники») і їх фармацевтично прийнятних солей, сольватів, амідів, складних ефірів, простих ефірів, хімічно захищених форм і попередників: O N H 10 S C O H N OH PXD-101 O В одному з варіантів реалізації інгібітор HDAC вибирають із наступної сполуки і її фармацевтично прийнятних солей, сольватів, амідів, складних ефірів, простих ефірів, хімічно захищених форм і попередників: O N H S C O H N OH PXD-101 O 15 20 25 30 35 Інгібітор HDAC: Інші форми Деякі сполуки можуть існувати в одній або більше з конкретних геометричних, оптичних, енантіомерних, діастереомірних, епімірних, атропних, стереоізомірних, таутомірних, конформаційних або аномірних форм, включаючи, без обмеження, цис- і транс- форми; E- і Zформи; c-, t- і r- форми; ендо- і екзо- форми; R-, S- і мезо - форми; D- і L-форми; d- і l-форми; (+) і (-) форми; кето- , енольну- і енолятну форми; син- і анти-форми; синклінальну й антиклінальну форми; α- і β-форми; аксіальні й екваторіальні форми; конформації «ванна», «крісло», «твіст», «конверт» й «напівкрісло» й їхньої комбінації, які надалі в сукупності згадуються як «ізомери» (або «ізомерні форми»). Слід зазначити, що за винятком, як обговорюється нижче, таутомірних форм, у поняття терміна «ізомери», у даній заявці особливим образом не включені структурні (або конституціональні) ізомери (тобто ізомери, які відрізняються по характеру зв'язків між атомами, а не просто по положенню атомів у просторі). Наприклад, при згадуванні метоксигрупи, -OCH3, не мається на увазі її структурний ізомер, гідроксиметильна група, -CH2OH. Аналогічно, при згадуванні орто-хлорфенілу не мається на увазі його структурний ізомер, мета-хлорфеніл. Однак при згадуванні класу структур саме можуть ураховуватися структурні ізомери , що перебувають у межах цього класу (наприклад, C1- 7алкіл включає н-пропил і ізо-пропил; бутил включає н- , з-, втор- і трет- бутил; метоксифеніл включає орто-, мета- і пара-метоксифеніл. Вказане вище виключення не стосується таутомірних форм, наприклад, кето-, енольним- і енолятним формам, як, наприклад, в наступних таутомірних парах: кето/енол (представлені нижче), імін/енамін, амід/іміноспирт, амідин/амідин, нітрозо/оксим, тиокетон/ентиол, Nнітрозо/гідроксиазо й нітро/аци-нітро. 40 45 Слід зазначити, що особливим образом у поняття терміна «ізомери» включені сполуки з одним або більше ізотопічним заміщенням. Наприклад, H може перебувати в будь-якій 1 2 3 ізотопічній формі, включаючи H, H (D), і H (T); C може перебувати в будь-якій ізотопічній 12 13 14 16 формі, включаючи C, C й C; O може бути в будь-якій ізотопічній формі, включаючи O й 18 O і т.п. Якщо не зазначене інше, згадування конкретних сполук має на увазі всі такі ізомерні форми, включаючи (цілком або частково) рацемічні й іншої їхньої суміші. Способи одержання (наприклад, асиметричний синтез) і поділу (наприклад, фракційна кристалізація й 16 UA 99810 C2 5 10 15 20 25 30 35 40 45 50 55 60 хроматографічні способи) таких ізомерних форм або добре відомих в даній області або можуть бути легко отримані при модифікації відомих способів відомим способом. Якщо не зазначене інше, згадування конкретних сполук також має на увазі його іонну форму, сіль, сольват, захищену форму й попередники, наприклад, як розглядається нижче. Можуть виявитися доцільними або бажаними одержання, очищення й/або переробка відповідної солі активної сполуки, наприклад, фармацевтично прийнятної солі. Приклади фармацевтично прийнятних солей розглядаються в роботі Берджа й співавторів Berge et al., 1977, "Pharmaceutically Acceptable Salts," J. Pharm. Sci., Vol. 66, pp. 1-19. Наприклад, якщо сполуки є аніонними або мають функціональну групу, що може бути аніонною (наприклад, -COOH може бути -COO ), можна утворити сіль із підходящим катіоном. Приклади підходящих неорганічних катіонів включають, без обмеження, іони лужних металів, + + 2+ 2+ +3 такі як Na й K , катіони лужноземельных металів, такі як Ca й Mg ,і інші катіони, такі як Al . + Приклади підходящих органічних катіонів включають, без обмеження, іон амонію (тобто, NH4 ) і + + + + заміщені іони амонію (наприклад, NH3R , NH2R2 , NHR3 , NR4 ). Прикладами деяких підходящих заміщених іонів амонію є іони, отримані з: етиламіну, диетиламіну, дициклогексиламіну, триетиламіну, бутиламіну, етилендіаміну, етаноламіну, диетаноламіну, пиперазину, бензиламіну, фенілбензиламіну, холіну, меглуміну й трометаміну, а також амінокислот, таких як лізин й аргінін. Прикладом звичайного четверичного іона амонію є + N(CH3)4 . Якщо сполуки є катіонним або мають функціональну групу, що може бути катіонною + (наприклад, -NH2, що може переходити в -NH3 ), то можна утворити сіль із підходящим аніоном. Приклади підходящих неорганічних аніонів включають без обмеження аніони, отримані з наступних неорганічних кислот: соляний, бромистоводневий, іодистоводневий, сірчаної, сірчистої, азотної, азотистої, фосфорної й фосфористої. Приклади підходящих органічних аніонів включають, без обмеження, аніони, отримані з наступних органічних кислот: 2-ацетиоксибензойної, оцтової, аскорбінової, аспарагінової, бензойної, камфорсульфонової, коричної, лимонної, етилендиаминтетрауксусної, етандисульфонової, етансульфонової, фумарової, глюкогептонової, глюконової, глютамінової, гліколевої, гідроксималеінової, гідроксинафтален карбонової, изетинової, молочної, лактобіонової, лауринової, малеінової, яблучної, метансульфонової, муцинової, олеинової, щавлевої, пальмітинової, памоєвої, пантотенової, фенілуксусної, фенілсульфонової, пропіонової, піровиноградної, саліцилової, стеаринової, бурштинової, сульфанілової, виннока’мяної, толуолсульфонової, і валеріанової. Приклади підходящих полімерних органічних аніонів включають, без обмеження, аніони, отримані з наступних полімерних кислот: дубильної кислоти, карбоксиметилцелюлози. Можуть виявитися доцільними або бажаними одержання, очищення й/або переробка відповідного сольвату активної сполуки. Термін «сольват» використається в даному описі в загальноприйнятому значенні й позначає комплекс розчиненої речовини (наприклад, активної сполуки, солі активної сполуки) і розчинника. Якщо розчинник являє собою воду, сольват можна для зручності називати гідратом, наприклад, моногідратом, дигідратом, тригідратом і т.п. Можуть виявитися доцільними або бажаними одержання, очищення й/або переробка активної сполуки в хімічно захищеній формі. Термін «хімічно захищена форма» використовується в даному описі в загальноприйнятому в хімії значенні й ставиться до сполук, в яких одна або більше реакційно здатна функціональна група захищена від небажаних хімічних реакцій за певних умов (наприклад, pH, температура, радіація, розчинник і т.п.). Щоб оборотне зробити функціональну групу , що у противному випадку була б реакційно здатною, не здатної до реакції у певних умовах, на практиці застосовують добре відомі хімічні способи. У хімічно захищеній формі одна або більше їх реакційно здатних функціональних груп перебувають у формі захищеної або захисної групи (також відомої як екранована або група, що екранує, або блокована або група, що блокує). Захист реакційно здатної функціональної групи дозволяє здійснювати реакції за участю інших незахищених реакційно активної функціональних груп, не торкаючись захищеної групи; захисну групу можна буде видалити, звичайно в наступному етапі, без значного впливу на остиальну частину молекули. Див., наприклад, Protective Groups in Organic Synthesis (T. Green and P. Wuts; 3rd Edition; John Wiley and Sons, 1999). Велика розмаїтість таких способів «захисту», «блокування» або «екранування» широко поширене й гарно відомо в органічному синтезі. Можуть виявитися доцільними або бажаними одержання, очищення й/або переробка відповідної активної сполуки у формі про-інгібітору HDAC. Термін «про-інгібітор HDAC» у даній заявці відноситься до сполук, що при метаболізуванні (наприклад, in vivo) дає бажану активну 17 UA 99810 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполуку. Як правило, про-іHDAC є неактивним або менш активним, ніж активна сполука, але може мати корисні властивості, що проявляються при переробці, введенні або метаболізуванні. Наприклад, деякі попередники являють собою складні ефіри активної сполуки (наприклад, фізіологічно прийнятні легко метаболізовувані складні ефіри). У процесі метаболізму, складноефірний зв'язок (-C(=O)OR) гідролізується з утворенням активного інгібітору HDAC. Такі складні ефіри можуть бути отримані шляхом етерифікації, наприклад, будь-якої карбоксильної кислотної групи ( C(=O)OH) вихідної сполуки, при необхідності з попереднім захистом будь-якої іншої реакційно здатної групи вихідної сполуки, з наступним зняттям захисних груп якщо в цьому буде потреба. Циклодекстрин Термін «циклодекстрин» у даній заявці (наприклад, у зв'язку з компонентом (б)) відноситься до циклодекстрину як такому, а також до похідних циклодекстрину, у тому числі, наприклад, похідним циклодекстрину, описаним у даній заявці. Циклодекстрини, також відомі як циклоамілози, циклоглюкани й декстрини Шардингера, являють собою природні клатрати, одержувані, наприклад, при впливі амілази Bacillus macerans на крохмаль із формуванням однорідних циклічних сполук α-(1→4) зв'язками глюкопіранозних одиниць. α-, β- і γ- циклодекстрини утворені шістьома, сімома й вісьма одиницями, відповідно, і мають молекулярну масу 972,84, 1134,98 й 1297,12 г/моль, відповідно. Циклодекстрини мають гідрофобні порожнини й утворюють сполуку з органічною речовиною, солями й галогенами у твердому стані або у водяних розчинах. Їх застосовують у якості комплексоутворюючих речовин і при дослідженні дії ферментів. Дотепер циклодекстрини застосовували тільки в обмеженому числі препаратів невеликого обсягу для парентерального введення. Див., наприклад, Loftsson, T., 1998, "Cyclodextrins in Pharmaceutical Formulations," Report for Nordic Industrial Fund); і Strickley, R., 2004, “Solubilising Excipients in Oral and Injectable Formulations”, Pharm. Res., Vol. 21, No. 2, pp. 201-230. Відомий ряд похідних циклодекстринів, у яких , наприклад, одна або більше з первинних або вторинних бічних гідроксильних груп (-OH) беруть участь в утворенні похідних, з утворенням простих ефірних груп (наприклад, диметилового ефіру; гидроксиетилового ефіру; 2-гидроксипропилового ефіру; карбоксиметилового ефіру; карбоксиетилового ефіру; глюкозилового ефіру; мальтозилового ефіру; сульфобутилового ефіру). Звичайно ступінь молярного заміщення становить, наприклад, 0,6, 0,8 й 1,0 (наприклад, 0,5-1,0). В одному з варіантів реалізації, циклодекстрин вибирають із: α-циклодекстрину; β-циклодекстрину; γ-циклодекстрину; (C1-4алкіл)-α-циклодекстрину; (C1-4алкіл)-β-циклодекстрину; (C1-4алкіл)-γ-циклодекстрину; (гідрокси-C1-4алкіл)-α-циклодекстрину; (гідрокси-C1-4алкіл)-β-циклодекстрину; (гідрокси-C1(карбокси-C1-4алкіл)-α-циклодекстрину; (карбокси-C1-4алкіл)-β4алкіл)-γ-циклодекстрину; циклодекстрину; (карбокси-C1-4алкіл) -γ-циклодекстрину; сахаридні ефіри α-циклодекстрину; сахаридних ефірів β-циклодекстрину; сахаридних ефірів γ-циклодекстрину; і сульфобутилових ефірів α-циклодекстрину, β-циклодекстрину або γ-циклодекстрину. Приклади C1-4алкільних груп у цьому контексті включають -Me, -Et, -nPr, -iPr й -cPr. Приклади сахаридних ефірів у цьому контексті включають глюкозилові й мальтозилові ефіри. Особливо кращим циклодекстрином є: гідроксипропил-β-циклодекстрин. Переважно циклодекстрин має фармацевтичний ступінь чистоти або еквівалентну. Наступні циклодекстрини й похідні циклодекстринів можуть бути отримані в Wacker-Chemie Gmb, Munich, Germany: α-циклодекстрин (Cavamax® W6 pharma); γ-циклодекстрин (Cavamax® W6 pharma); Гідроксипропил- α-циклодекстрин (Cavasol® W6 HP TL); Гідроксипропил- β-циклодекстрин (Cavasol® W7 HP pharma); Гідроксипропил- γ-циклодекстрин (Cavasol® W7 HP pharma). Поза зв'язком з якою-небудь конкретною теорією автори винаходу думають, що кінцева фенільна група PXD-101 (або, можливо, заміщена кінцева фенільна група аналогів PXD-101) утворить комплекс із циклодекстрином, таким як, гідроксипропил-β-циклодекстрин. Аргінін Аргінін, також відомий як L-аргінін, 2-аміно-5-гуанідиновалеріанова кислота, і (S)-2-аміно-5[(аміноімінометил)-аміно]пентанова кислота, має молекулярну масу 174,20. Він розчинний у воді (насичений водяний розчин містить 15% мас./мас. при 21°C) і є лужним по природі (але 18 UA 99810 C2 менш лужним, чим меглумін). Він часто представлений у формі кислотно-адитивної солі, наприклад, гідрохлориду. Аргінін добре переноситься людиною в дозах до 30 г/кг, наприклад, у вигляді харчової добавки. 5 10 15 20 В одному з варіантів реалізації аргінін являє собою вільний аргінін або фармацевтично прийнятну сіль аргініну. Переважно, аргінін являє собою L-аргінін. В одному з варіантів реалізації аргінін являє собою вільний L-аргінін або фармацевтично прийнятну сіль L-аргініну. Переважно, аргінін має фармацевтичний ступінь чистоти або еквівалентну. L-аргінін для препаратів інгібіторів HDAC (відповідає як європейським стандартам, так і стандартам Сполучених Штатів) може бути отриманий, наприклад, від Ajinomoto, Kanagawa, Японія (Каталог № 2). Поза зв'язком з якою-небудь конкретною теорією автори винаходу думають, що акриламідні й/або сульфаніламідні групи PXD-101 (і його аналогів) беруть участь в in situ солеутворюванні з аргініном (і меглуміном, описаному нижче), і, таким чином, сприяють поліпшенню розчинності. Меглумін Меглумін, також відомий як N-метилглюкамін, 1-дезокси-1-(метиламіно)-D- глюцитол й Nметил-D-глюкамін, має молекулярну масу 195,21 г/моль і температуру плавлення близько 129131°C. Він розчинний у воді (~100 м в 100 мол при 25°C), є лужним по природі (і більше лужним, чим аргінін) (p ~10,5 для 1 % мас. водяного розчину). Він утворить солі з кислотами й комплекси з металами й застосовується в багатьох фармацевтичних препаратах. 25 30 35 40 45 В одному з варіантів реалізації меглумін являє собою вільний меглумін або фармацевтично прийнятну сіль меглуміну. Переважно меглумін має фармацевтичний ступінь чистоти або еквівалентну. Меглумін для препаратів інгібіторів HDAC (що відповідають як європейським стандартам, так і стандартам Сполучених Штатів) може бути отриманий, наприклад, в Merck Kga, Німеччина. Інші додаткові компоненти В одному з варіантів реалізації фармацевтична композиція додатково включає один або більше з інших додаткових фармацевтично прийнятних компонентів (наприклад, фармацевтично прийнятний носій, і т.п.). В одному з варіантів реалізації фармацевтична композиція додатково включає один або більше з інших фармацевтично прийнятних компонентів, добре відомих фахівцям у даній області, включаючи бнз обмеження, фармацевтично прийнятний носій, розріджувач, наповнювач, ад’ювант, буфер, модифікатор pH, консервант, антиоксидант, бактеріостатик, стабілізатор, суспендуючий засіб, солюбілізатор, поверхнево-активну речовину (наприклад, що змочує реагент), речовина що офарблює й ізотонуючні розчинені речовини (тобто речовини, які роблять склад ізотонічним крові або іншій відповідній рідині організму ймовірного реципієнта). Підходящі носії, розріджувач, наповнювачі й т.п. можна знайти в стандартних фармацевтичних посібниках. Див., наприклад, Handbook of Pharmaceutical Additives, 2nd Edition (eds. M. Ash and I. Ash), 2001 (Synapse Information Resources, Inc., Endicott, New York, USA), Remington's Pharmaceutical Sciences, 18th edition, Mack Publishing Company, Easton, Pa., 1990; і Handbook of Pharmaceutical Excipients, 2nd edition, 1994. 19 UA 99810 C2 5 10 15 20 25 30 35 40 45 50 55 Термін «фармацевтично прийнятний» у даній заявці відноситься до сполук, компонентів, речовин, композицій, лікарських форм і т.п., застосування яких, що включає контакт із тканинами суб’єкта, що розглядається (наприклад, людини) має логічне медичне обґрунтування й не пов'язане з підвищеною небажаною токсичністю, подразненням, алергійною реакцією або іншими проблемами або ускладненнями й відповідають розумному співвідношенню користь/ризик. Кожен носій, розріджувач, наповнювач і т.п. повинен також бути «прийнятним», у тому розумінні, що він повинен бути сумісним з іншими компонентами композиції. В одному з варіантів реалізації композиція додатково включає інші активні речовини, наприклад, інші терапевтичні або профілактичні агенти. Формат У даній заявці термін «склад» описує речовину, що існує у формі (наприклад, рідкій), готової для введення, тоді як термін «попередній склад» описує речовину (наприклад, ліофілат/ліофілізат, концентрат і т.п.), з якого може бути отриманий препарат (наприклад, шляхом регідратації, розведення й т.п..). В одному з варіантів реалізації композиція (наприклад, склад, попередній склад) є рідкою (наприклад, при кімнатній температурі, тобто 25°C, і стандартному атмосферному тиску, тобто 1,01325 бар). Рідка композиція (наприклад, склад, попередній склад), може являти собою розчин, суспензію, емульсію, і т.п., у яких розчинені, суспендовані або іншим способом представлені (наприклад, у вигляді липосом або інших мікрочастинок) інгібітор HDAC й інші компоненти (наприклад, циклодекстрин, аргінін, меглумін і т.п.) В одному з варіантів реалізації композиція (наприклад, склад, попередній склад) являє собою водяний розчин (наприклад, що включає щонайменше 30% мас./мас. води, наприклад, щонайменше 50% мас./мас. води, щонайменше 70% мас./мас. води). В одному з варіантів реалізації композиція (наприклад, склад, попередній склад) являє собою водний ізотонічний розчин (наприклад, ізотонічний крові). В одному з варіантів реалізації композиція (наприклад, склад, попередній склад), є стерильною й апирогенною (тобто, вільна від пирогенів). В одному з варіантів реалізації композиція (наприклад, попередній склад) являє собою рідкий концентрат, з якого можна одержати склад, наприклад, шляхом розведення. В одному з варіантів реалізації композиція (наприклад, попередній склад) твердою формою (наприклад, при кімнатній температурі, тобто, 25°C, і стандартному атмосферному тиску, тобто 1,01325 бар) (наприклад, порошком, гранулами, таблетками, ліофілатами/ліофілізатами й т.п.), з якої можна одержати препарат, наприклад, шляхом гідратації (або регідратації) , можливо, з наступним додатковим розведенням. Речовини, що підходять для розведення, гідратації й/або регідратації включають, наприклад, воду для ін'єкцій, водний сольовий розчин (наприклад, 0,9% мас./про. NaCl), водяний розчин глюкози, наприклад, 5% мас./про. фармакопейної глюкози), розчин для ін'єкції/інфузії, глюкозу для ін'єкції/інфузії, розчин Рінгера, розчин Рінгера з лактатом і т.п. Підходящий сольовий розчин («фізіологічний розчин для інфузії», 0,9% мас./про. Фрамакопійного хлорид натрію) може бути отриманий, наприклад, від Baxter Healthcare Ltd, Thetford, Norfolk, UK (код продукту FUE1322). Підходящий розчин глюкози («глюкоза для інфузії», 5% мас./про. фармакопейної глюкози ), може бути отриманий, наприклад, від Baxter Healthcare Ltd, Thetford, Norfolk, UK (код продукту FUE1322). Фармацевтичні композиції (наприклад, склади, попередні склади) можуть бути представлені в герметизованих контейнерах, розрахованих на одну або кілька доз, наприклад, в ампулах і флаконах. Фармацевтичний склад може бути отриманий, наприклад, з попереднього складу, екстемпорально, наприклад, безпосередньо перед застосуванням, наприклад, у мішку для внутрішньовенної (в.в.) інфузії. Один аспект даного винаходу відноситься до фармацевтичної композиції (наприклад, складу, попереднього складу), описаної в даній заявці, у підходящому контейнері (наприклад, флаконі, ампулі, мішку для внутрішньовенної (в.в.) інфузії. Один аспект даного винаходу відноситься до флакона або ампули, що містить фармацевтичну композицію (наприклад, склад, попередній склад), описану в даній заявці. Один аспект даного винаходу відноситься до флакона або ампули, що містить фармацевтичний попередній склад (наприклад, рідкий концентрат), описаної в даній заявці. 20 UA 99810 C2 5 10 15 20 25 30 35 40 45 50 55 60 Один аспект даного винаходу відноситься до мішка для внутрішньовенної (в.в.) інфузії, що містить фармацевтичну композицію (наприклад, склад), описану в даній заявці. Кількість інгібітору HDAC Фармацевтичний препарат включає терапевтично ефективну кількість інгібітору HDAC. Фармацевтична композиція містить таку кількість інгібітору HDAC, що при наступному одержанні фармацевтичного складу із зазначеної фармацевтичної композиції (наприклад, шляхом розведення, гідратації, регідратації й т.п.) зазначений фармацевтичний склад містить терапевтично ефективну кількість інгібітору HDAC. Фахівцеві в даній області очевидно, що відповідні дози інгібітору HDAC (і концентрація інгібітору HDAC у складах і композиціях) для різних суб'єктів можуть варіюватися. Визначення оптимальної дози звичайно включає врівноваження рівня терапевтичної корисності й будьякого ризику або негативних побічних ефектів. Обраний рівень дозування залежить від різноманітних факторів, що включають, без обмеження, активність конкретної сполуки, шлях введення, час введення, показник екскреції сполуки, тривалість лікування, інші інгібітори HDAC, сполуки й/або речовини, які використовуються в комбінації з інгібіторами HDAC, ступінь важкості стану, а також вид, стать, вік, вага, стан, загальний стан здоров'я й попередню історію хвороби об'єкта. Кількість іHDAC і шлях введення в остаточному підсумку знаходиться під розсудом лікаря, ветеринара або лікаря-консультанта, хоча звичайно дозування вибирають для досягнення локальної концентрації в місці дії, що забезпечувала б бажаний ефект, не викликаючи значних негативних або шкідливих побічних ефектів. Приклад кращого дозування - 150 моль/кг. Для інгібітору HDAC (наприклад, PXD-101) з молекулярною масою 318 г/моль вона становить ~47,7 мг/кг. Для суб'єкта масою 70 кг вона становить ~3.3 р. При розведенні мішку для внутрішньовенного введення обсягом 1,0 мол концентрація складу складає ~3,3 г/л (~3,3 мг/мол) або ~10 мм. Підходящий рідкий концентрат (наприклад, попередній склад) може мати концентрацію в 10-100 разів більше, ніж необхідний склад й, таким чином, його концентрація становить ~33-330 г/л (~33-330 мг/мол, наприклад, ~50 мг/мол) або ~0,1-1,0 M. В одному з варіантів реалізації концентрація інгібітору HDAC у композиції (наприклад, складі) становить щонайменше 0,01, 0,02, 0,05, 0,1, 0,2, 0,5, 1,0, 2,0 або 5,0 мг/мол. В одному з варіантів реалізації концентрація інгібітору HDAC у композиції (наприклад, складі) становить до 200, 100, 50, 20, 10, 5, 2, 1, 0,5 або 0,2 мг/мол, включно. В одному з варіантів реалізації концентрація інгібітору HDAC становить 0,1-10 мг/мол. В одному з варіантів реалізації концентрація інгібітору HDAC становить 0,5-10 мг/мол. В одному з варіантів реалізації концентрація інгібітору HDAC становить 1,0-10 мг/мол. В одному з варіантів реалізації концентрація інгібітору HDAC становить 0,1-5 мг/мол. В одному з варіантів реалізації концентрація інгібітору HDAC становить 0,5-5 мг/мол. В одному з варіантів реалізації концентрація інгібітору HDAC становить 1,0-5 мг/мол. В одному з варіантів реалізації концентрація інгібітору HDAC у композиції (наприклад, складі) становить щонайменше 0,01, 0,03, 0,05, 0,1, 0,3, 0,5, 1,0, 3,0, 5,0 або 10 мм. В одному з варіантів реалізації концентрація інгібітору HDAC у композиції (наприклад, складі) становить до 300, 200, 100, 50, 30, 20, 15, 10, 5, 3, 1, 0,5 або 0,3 мм, включно. В одному з варіантів реалізації концентрація інгібітору HDAC становить 0,3-30 мм. В одному з варіантів реалізації концентрація інгібітору HDAC становить 1,0-30 мм. В одному з варіантів реалізації концентрація інгібітору HDAC становить 2,0-30 мм. В одному з варіантів реалізації концентрація інгібітору HDAC становить 3,0-30 мм. В одному з варіантів реалізації концентрація інгібітору HDAC становить 0,3-15 мм. В одному з варіантів реалізації концентрація інгібітору HDAC становить 1,0-15 мм. В одному з варіантів реалізації концентрація інгібітору HDAC становить 2,0-15 мм. В одному з варіантів реалізації концентрація інгібітору HDAC становить 3,0-15 мм. Концентрація інгібітору HDAC у композиції (наприклад, у попередньому складі) може бути, наприклад, в 1-1000 разів вище, ніж концентрація інгібітору HDAC у відповідному складі. В одному з варіантів реалізації композиція (наприклад, попередній препарат) має концентрацію іHDAC щонайменше в 1, 2, 5, 10, 20, 50 або 100 разів вище. В одному з варіантів реалізації композиція (наприклад, попередній препарат) має концентрацію іHDAC до 1000, 500, 200, 100, 50, 20, 10, 5 або 2 разів, включно, вище. В одному з варіантів реалізації концентрація інгібітору HDAC в 10-500 разів вище. В одному з варіантів реалізації концентрація інгібітору HDAC в 10-200 разів вище. В одному з варіантів реалізації концентрація інгібітору HDAC в 10-100 разів вище. В одному з варіантів реалізації концентрація інгібітору HDAC в 10-50 разів вище. В одному з варіантів реалізації концентрація інгібітору HDAC в 10-20 разів вище. 21 UA 99810 C2 5 10 15 20 25 30 35 40 45 50 55 60 Наприклад, в одному з варіантів реалізації концентрація інгібітору HDAC у композиції (наприклад, попередньому складі) становить 30-600 мм (відповідно, в 10-20 разів вище, ніж 3,030 мм). В одному з варіантів реалізації концентрація інгібітору HDAC у композиції (наприклад, попередньому складі) становить щонайменше 0,1, 0,2, 0,5, 1,0, 2,0, 5,0, 10, 20, 30 або 50 мг/мол. В одному з варіантів реалізації концентрація інгібітору HDAC у композиції (наприклад, попередньому складі) становить до 1000, 500, 300, 200, 100, 50, 20, 10, 5 або 2 мг/мол, включно. В одному з варіантів реалізації концентрація інгібітору HDAC становить 5-500 мг/мол. В одному з варіантів реалізації концентрація інгібітору HDAC становить 10-500 мг/мол. В одному з варіантів реалізації концентрація інгібітору HDAC становить 20-500 мг/мол. В одному з варіантів реалізації концентрація інгібітору HDAC становить 30-500 мг/мол. В одному з варіантів реалізації концентрація інгібітору HDAC становить 5-300 мг/мол. В одному з варіантів реалізації концентрація інгібітору HDAC становить 10-300 мг/мол. В одному з варіантів реалізації концентрація інгібітору HDAC становить 20-300 мг/мол. В одному з варіантів реалізації концентрація інгібітору HDAC становить 30-300 мг/мол. В одному з варіантів реалізації концентрація інгібітору HDAC становить ~50 мг/мол. В одному з варіантів реалізації концентрація інгібітору HDAC у композиції (наприклад, попередньому складі) становить щонайменше 0,3, 0,5, 1,0, 1,5, 2,0, 3,0, 5,0, 10, 30, 50, 100 мм. В одному з варіантів реалізації концентрація інгібітору HDAC у композиції (наприклад, попередньому складі) становить до 3000, 1000, 500, 300, 100, 50, 30, 20, 15, 10, 5 або 3 мм, включно. В одному з варіантів реалізації концентрація інгібітору HDAC становить 10-1000 мм. В одному з варіантів реалізації концентрація інгібітору HDAC становить 30-1000 мм. В одному з варіантів реалізації концентрація інгібітору HDAC становить 50-1000 мм. В одному з варіантів реалізації концентрація інгібітору HDAC становить 100-1000 мм. В одному з варіантів реалізації концентрація інгібітору HDAC становить 10-500 мм. В одному з варіантів реалізації концентрація інгібітору HDAC становить 30-500 мм. В одному з варіантів реалізації концентрація інгібітору HDAC становить 50-500 мм. В одному з варіантів реалізації концентрація інгібітору HDAC становить 100-500 мм. У випадку якщо інгібітор HDAC представлений у формі солі, кількість розраховують на основі вихідної сполуки. Отже, зазначені вище значення (наприклад, 30-300 мг/мол, ~50 мг/мол) відповідають вихідній сполуці, а не, наприклад, його солі. Кількість циклодекстрину В одному з варіантів реалізації, якщо циклодекстрин є присутнім, то молярне відношення циклодекстрину до інгібітору HDAC становить щонайменше 0,5, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4 або 1,5. В одному з варіантів реалізації, якщо циклодекстрин є присутнім, то молярне відношення циклодекстрину до інгібітору HDAC становить до 5, 4, 3,5, 3, 2,5, 2,0, 1,9, 1,8, 1,7, 1,6 або 1,5, включно. В одному з варіантів реалізації молярне відношення становить 0,5-5. В одному з варіантів реалізації молярне відношення становить 0,8-4. В одному з варіантів реалізації молярне відношення становить 1-3. В одному з варіантів реалізації молярне відношення становить 1,2-2,5. В одному з варіантів реалізації молярне відношення становить 1,4-2. В одному з варіантів реалізації молярне відношення становить 1,5-1,9. Приклад кращої концентрації інгібітору HDAC для композиції (наприклад, попереднього складу, складу) становить ~10 мм. Якщо така композиція (наприклад, попередній склад, склад) повинна мати молярне відношення циклодекстрину до інгібітору HDAC ~1,5-1,9, то це відповідає концентрації циклодекстрину ~15-19 мм. Прикладом кращого інгібітору HDAC є PXD-101, що має молекулярну масу ~318 г/моль. βциклодекстрин має молекулярну масу ~1135 г/моль. Відношення молекулярних мас циклодекстрину до інгібітору HDAC становить ~1135/318 або ~3,57. Якщо композиція (наприклад, попередній склад, склад) повинна мати молярне відношення циклодекстрину до інгібітору HDAC ~1,5-1,9, це відповідає масовому відношенню циклодекстрину до інгібітору HDAC ~5,3-6,8 (тобто, 5,3-6,8 грам β-циклодекстрину на кожен грам PXD-101). Може бути кращим забезпечення загальної дози циклодекстрину менш 5000, 2000, 1000, 500, 400, 300, 200, 100 або 50 мг/кг. Кількість аргініну 22 UA 99810 C2 5 10 15 20 25 30 35 40 45 50 55 60 В одному з варіантів реалізації, якщо аргінін присутній, то молярне відношення аргініну до інгібітору HDAC становить щонайменше 0,5, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4 або 1,5. В одному з варіантів реалізації, якщо аргінін присутній, то молярне відношення аргініну до інгібітору HDAC становить до 5, 4, 3,5, 3, 2,5, 2,0, 1,9, 1,8, 1,7, 1,6 або 1,5, включно. В одному з варіантів реалізації молярне відношення становить 0,5-5. В одному з варіантів реалізації молярне відношення становить 0,8-4. В одному з варіантів реалізації молярне відношення становить 1-3. В одному з варіантів реалізації молярне відношення становить 1,2-2,5. В одному з варіантів реалізації молярне відношення становить 1,4-2. В одному з варіантів реалізації молярне відношення становить 1,5-1,9 Приклад кращої концентрації інгібітору HDAC для композиції (наприклад, складу) становить ~10 мм. Якщо ця композиція (наприклад, склад) повинна мати молярне відношення аргініну до інгібітору HDAC ~1,5-1,9, це відповідає концентрації аргініну ~15-19 мм. Прикладом кращого інгібітору HDAC є PXD-101, що має молекулярну масу ~318 г/моль. Вільний аргінін має молекулярну масу ~174 г/моль. Відношення молекулярних мас аргініну й інгібітору HDAC становить ~174/318 або ~0,547. Якщо композиція (наприклад, попередній склад, склад) повинна мати молярне відношення аргініну до інгібітору HDAC ~1.5-1.9, це відповідає масовому відношенню аргініну до інгібітору HDAC ~0,82-1,04 (тобто, 0,82-1,04 грам аргініну на кожен грам PXD-101). Може бути кращим забезпечення загальної дози аргініну менш 200, 100, 50, 30 або 20 г/кг. Кількість меглуміну В одному з варіантів реалізації, якщо меглумін є присутнім, то молярне відношення меглуміна до інгібітору HDAC становить щонайменше 0,5, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4 або 1,5. В одному з варіантів реалізації, якщо меглумін є присутнім, то молярне відношення меглуміну до інгібітору HDAC становить до 5, 4, 3,5, 3, 2,5, 2,0, 1,9, 1,8, 1,7, 1,6 або 1,5, включно. В одному з варіантів реалізації молярне відношення становить 0,5-5. В одному з варіантів реалізації молярне відношення становить 0,8-4. В одному з варіантів реалізації молярне відношення становить 1-3. В одному з варіантів реалізації молярне відношення становить 1,2-2,5. В одному з варіантів реалізації молярне відношення становить 1,4-2. В одному з варіантів реалізації молярне відношення становить 1,5-1,9. Приклад кращої концентрації інгібітору HDAC для композиції (наприклад, препарату) - ~10 мм. Якщо така композиція (наприклад, препарат) повинна мати молярне відношення меглуміну до інгібітору HDAC ~1,5-1,9, то це відповідає концентрації меглуміну ~15-19 мм. Прикладом кращого інгібітору HDAC є PXD-101, що має молекулярну масу ~318 г/моль. Вільний меглумін має молекулярну масу ~195 г/моль. Відношення молекулярних мас меглуміну й інгібітору HDAC становить ~195/318 або ~0,613. Якщо композиція (наприклад, попередній склад, склад) повинна мати молярне відношення меглуміну й інгібітору HDAC ~1,5 1,9, то це відповідає масовому відношенню меглуміну до інгібітору HDAC ~0,92-1,17 (тобто, 0,92-1,17 грама меглуміну на кожен грам PXD-101). Може бути кращим забезпечення загальної дози меглуміну менш 200, 100, 50, 30 або 20 г/кг. Одержання композицій Композиції (наприклад, попередній склади, склади) можуть бути отримані із застосуванням стандартних способів, добре відомих в області фармацевтики. Наприклад, способи, що використовують стандартну лабораторію або устаткування для фармацевтичного виробництва, добре відомі фахівцям в галузі фармацевтики. Один з аспектів даного винаходу відноситься до способу одержання композиції (наприклад, попереднього складу, складу) (як описано в даній заявці) шляхом об'єднання: (а) інгібітору HDAC, визначеного в даній заявці, і (а) одного або більше з наступних додаткових компонентів: циклодекстрину, аргініну й меглуміну; і, можливо, одного або більше їх інших додаткових фармацевтично прийнятних компонентів (описаних у даній заявці). Наприклад, відповідна кількість чистого, сухого інгібітору HDAC (наприклад, PXD-101), можна розчинити в розчині солеутворювача (наприклад, аргініну, меглуміну) або циклодекстрину у воді у відповідній концентрації, як описано в даній заявці. Розчинення можна здійснити протягом періоду від приблизно 1 хвилини до приблизно 1 години, шляхом помішування, наприклад, із застосуванням магнітної мішалки, лопатевої мішалки або турбінної мішалки, з підведенням тепла або без нього. Розчин, що утвориться, потім розбавляють до 23 UA 99810 C2 5 10 15 20 25 30 35 40 45 50 55 60 кінцевого обсягу, наприклад, водою відповідного класу, і додатково перемішують протягом деякого часу, поки розчин не стане гомогенним. Якщо буде потреба можна змінити pH розчину із застосуванням підходящої кислоти (наприклад, HCl) для досягнення pH рівного приблизно 8,5 або вище. Однак, при зміні рH може виникнути ризик преципітації інгібітору HDAC. Розчин пропускають через підходящий фільтр (наприклад, 0,2 мкм фільтр для стерилізації) і поміщують у підходящі контейнери (наприклад, флакони, ампули, і т.п.) у підходящому фармацевтичному виробничому середовищі й герметизують / запечатують. Ліофілізат можна приготувати, помістивши розчин у флакони, що мають призначені для ліофілізації пробки, і видаливши воду заморожуванням-висушуванням з одержанням порошку, придатного для відновлення / регідратації із застосуванням підходящої для регідратації середовища (наприклад, сольового розчину, глюкози й т.п.). Після заморожування висушування, флакони герметизують і запечатують. Один з аспектів даного винаходу відноситься до способу одержання складу (описаного в даній заявці) шляхом розведення, відновлення, гідратації, регідратації й т.п. попереднього складу (описаного в даній заявці). Один з аспектів даного винаходу відноситься до фармацевтичної композиції (наприклад, складу) (описаної в даній заявці), отриманої шляхом розведення, відновлення, гідратації, регідратації й т.п. попереднього складу (описаного в даній заявці). Один з аспектів даного винаходу відноситься до фармацевтичної композиції (наприклад, складу) (описаному в даній заявці), отриманої шляхом розведення, відновлення, гідратації, регідратації й т.п. попереднього складу (описаного в даній заявці). Наприклад, склади можуть бути отримані з попередніх складів, наприклад, екстемпорально, шляхом розведення, відновлення, гідратації, регідратації й т.п. із застосуванням відповідних рідин, наприклад, води (наприклад, води для ін'єкції), водного сольового розчину (наприклад, 0,9% мас./про. сольового розчину), водного розчину глюкози (наприклад, 5% мас./про. розчин глюкози) і т.п. Наприклад, відповідна кількість рідкої концентрованої композиції (наприклад, попереднього складу) (спочатку наданої у флаконі або ампулі) можна помістити в типовий 1 л мішок для внутрішньовенного введення із сольовим або глюкозним розчином, і отриманий склад застосовувати для введення шляхом внутрішньовенної інфузії. Наприклад, відповідна кількість ліофілату/ліофілізату композиції (наприклад, попереднього складу) можна відновити (або регідратувати) додаванням підходящого водного середовища (наприклад, води для ін'єкцій, 0,9% сольового розчину, 5% розчину глюкози, і т.п.), наприклад, у флакон, що містить ліофілат/ліофілізат, наприклад, за допомогою підходящого шприца й голки. Вміст флакона можна потім збовтати для розчинення ліофілізованого порошку. Отриману у результаті композицію можна потім застосовувати як склад і вводити суб'єктові, або можна застосовувати її як попередній склад і розбавляти до необхідної концентрації, наприклад, додаванням у підходящу для інфузії середовище, наприклад, у мішок для інфузії. Один з аспектів даного винаходу відноситься до способу одержання складу інгібітору HDAC (описаного в даній заявці), що включає стадію об'єднання зазначеного інгібітору HDAC з одним або більше з наступних додаткових компонентів: циклодекстрин, аргінін, і меглумін (описаних у даній заявці); і можливістю одним або більше з інших додаткових фармацевтично прийнятних компонентів (описанных у даній заявці). Один з аспектів даного винаходу відноситься до способу підвищення концентрації іHDAC (як описано в даній заявці) у фармацевтичній композиції, що включає стадію одержання препарату зазначеного іHDAC з одним або більше з наступних додаткових компонентів: циклодекстрин, аргінін, і меглумін (як описано в даній заявці); і можливо одного або більше іншого додаткового фармацевтично прийнятного компонента (як описано в даній заявці). Тверді форми Один з аспектів даного винаходу відноситься до фармацевтичної композиції, що включає інгібітор HDAC (наприклад, PXD-101) у твердій лікарській формі (наприклад, таблетка, капсула, желатинова таблетка й т.п.) (наприклад, желатинова капсула). Один з аспектів даного винаходу відноситься до твердої лікарської форми (наприклад, таблетці, капсулі, желатиновій таблетці й т.п.) (наприклад, желатиновій капсулі), що містить інгібітор HDAC, описаний у даній заявці. Один з аспектів даного винаходу відноситься до твердої лікарської форми (наприклад, таблетці, капсулі, желатиновій таблетці й т.п.) (наприклад, желатиновій капсулі), що містить фармацевтичну композицію (наприклад, склад), описану в даній заявці. Медичне застосування, способи лікування й т.п. 24 UA 99810 C2 5 10 15 20 25 30 35 40 45 50 55 60 Один з аспектів даного винаходу відноситься до компонентів фармацевтичної композиції, описаної в даній заявці (наприклад, інгібітору HDAC; одному або більше із циклодекстрину, аргініну й меглуміна; і т.п.) для застосування в способі лікування людини або тварини за допомогою терапії. Один з аспектів даного винаходу відноситься до фармацевтичної композиції (наприклад, попередньому складу, складу), описаної в даній заявці, для застосування в способі лікування організму людини або тварини за допомогою терапії. Один з аспектів даного винаходу відноситься до застосування компонентів фармацевтичної композиції, описаної в даній заявці (наприклад, інгібіторів HDAC; одного або більше із циклодекстрину, аргініну й меглуміна й т.п.) у виробництві лікарського препарату для лікування патологічного стану, описаного в даній заявці. Один з аспектів даного винаходу відноситься до застосування фармацевтичної композиції (наприклад, попереднього складу), описаного в даній заявці, у виробництві лікарського препарату для лікування патологічного стану, описаного в даній заявці. Один з аспектів даного винаходу відноситься до способу лікування, що включає введення суб'єктові, що потребує лікуванні, фармацевтичній композиції (наприклад, складу), описаної в даній заявці. Один з аспектів даного винаходу відноситься до способу (а) регуляції (наприклад, інгібування) проліферації клітин; (б) інгібування ходу клітинного циклу; (в) стимуляції апоптозу; або (г) комбінації одного або більше з перерахованого, in vitro або in vivo, включаючи контакт клітини з фармацевтичною композицією (наприклад, препаратом), як описано в даній заявці. Лікуванню можуть піддаватися будь-які типи клітин, що включають, без обмеження, клітини легені, шлунково-кишкового тракту (включаючи, наприклад, кишку, товсту кишку, ободову й пряму кишку), груди (молочної залози), яєчника, простати, печінки (печіночні), бруньки (брунькові), сечового міхура, підшлункової залози, мозку й шкіри. Один з аспектів даного винаходу відноситься до способу введення інгібітору HDAC, визначеного в даній заявці, суб'єктові, що включає введення зазначеному суб'єктові фармацевтичної композиції (наприклад, складу), описаної в даній заявці. Лікування Термін «лікування» у даній заявці стосовно до лікування патологічного стану відноситься, як правило, до лікування й терапії людини, або тварини (наприклад, при застосуванні у ветеринарії), при якому досягається деякий бажаний терапевтичний ефект, наприклад, інгібування прогресування патологічного стану, і включає зниження ступеня прогресування, зупинку прогресування, зниження ступеня вираженості патологічного стану й лікування патологічного стану. Цей термін також охоплює лікування як профілактичну міру (тобто, профілактика). Наприклад, застосування відносно суб'єктів, у яких ще не розвився патологічний стан, але з підвищеним ризиком розвитку такого патологічного стану також входить у поняття терміна «лікування». Термін «терапевтично ефективна кількість» у даній заявці відповідає такій кількості інгібітору HDAC, що ефективне для одержання деякого бажаного терапевтичного ефекту, пов'язане із прийнятним співвідношенням користь/ризик при введенні відповідно до необхідного режиму лікування. Термін «лікування» включає комбіновані способи лікування й терапії, у яких два або більше способи лікування або терапії поєднують, наприклад, послідовно або одночасно. Наприклад, сполуки, описані в даній заявці, можна також використовувати у комбінованих способах терапії, наприклад, разом з іншими агентами, наприклад, цитотоксичними агентами й т.п.. Приклади способів лікування й терапії включають, без обмеження, хіміотерапію (введення активних агентів, включаючи, наприклад, інгібітор HDAC, антитіла (наприклад, при імунотерапії), попередники (наприклад, при фотодинамічній терапії, пролікарської гено-направленої терапії (GDEPT), антитіло-направленої пролікарської терапії ферментами (ADEPT), і т.п.); хірурги; радіаційної терапії; і генотерапії. Патологічні стани В одному з варіантів реалізації лікування являє собою лікування проліферативного патологічного стану. Терміни «проліферативний патологічний стан», «проліферативне порушення» або «проліферативне захворювання» використовуються в даній заявці рівнозначно й ставляться до небажаної або неконтрольованої клітинної проліферації надлишкових або аномальних клітин, що є небажаними, наприклад, неопластичному або гіперпластичному росту. В одному з варіантів реалізації лікування являє собою лікування проліферативного патологічного стану, що характеризується доброякісною, передзлоякісною або злоякісною 25 UA 99810 C2 5 10 15 20 25 30 35 40 45 50 55 60 проліферацією клітин, включаючи, без обмеження, неоплазми, гіперплазії й пухлини (наприклад, гистиоцитому, гліому, астроцитому, остеому), рак (див. нижче), псоріаз, хвороби кісток, фібропроліферативні порушення (наприклад, сполучних тканин), фіброз легенів, атеросклероз, проліферацію клітин гладких м'язів у кровоносних судинах, наприклад, стеноз або рестеноз після ангиопластики. В одному з варіантів реалізації лікування являє собою лікування раку. В одному з варіантів реалізації лікування являє собою лікування раку легенів, дрібноклітинного раку легенів, раку шлунково-кишкового тракту, раку товстої кишки, раку прямої кишки, колоректального раку, раку грудей, раку яєчників, раку простати, раку яєчок, раку печінки, раку нирок, раку сечового міхура, раку підшлункової залози, раку мозку, саркоми, остеосаркоми, саркоми Капоши, меланоми, злоякісної меланоми, базально-клітинного раку або лейкемії. В одному з варіантів реалізації лікування представляє лікування патологічного стану, опосередковуваного HDAC. Термін «патологічний стан, опосередковуваний HDAC» у даній заявці відноситься до патологічного стану, при якому HDAC й/або дія HDAC є важливою або необхідною, наприклад, для виникнення, прогресування, прояву й т.п. цього патологічного стану або патологічного стану, що, як відомо, лікують інгібіторами HDAC (такими як, наприклад, трихостатин A). Фахівець у даній області легко може визначити, лікує чи ні можливий інгібітор HDAC патологічний стан, опосередковуваний HDAC, у будь-якому конкретному типі клітин. Наприклад, можна застосовувати стандартні способи аналізу для оцінки активності конкретної сполуки, описані в роботі Watkins et al., 2002(публікація міжнародної заявки WO 02/30879). Приклади таких патологічних станів включають, без обмеження, наступні: Рак (див., наприклад, Vigushin et al., 2001, Clin. Cancer Res., Vol. 7, No. 4, pp. 971-976). Псоріаз (див., наприклад, Iavarone et al., 1999, Mol. Cell Biol., Vol. 19, No. 1, pp. 916-922). Фібропроліферативні порушення (e.g., фіброз печінки) (див., наприклад, Niki et al., 1999, Hepatology, Vol. 29, No. 3, pp. 858- 867; Corneil et al., 1998, опублікована заявка на японський патент JP 10114681 A2). Проліферативні порушення гладких м'язів мускулатури (наприклад, атеросклероз, рестеноз) (див., наприклад, Kimura et al., 1994, Biol. Pharm. Bull., Vol. 17, No. 3, pp. 399-402). Нейродегенеративні захворювання (наприклад, хвороба Альцгеймера, хвороба Паркінсона, хорея Хантингтона, аміотропний латеральний склероз, дегенерація спинного мозку й мозочка) (див., наприклад, Kuusisto et al., 2001, Biochem. Biophys. Res. Commun., Vol. 280, No. 1, pp. 223228; Stefan, J., et al., 2002, публікація міжнародного патенту (PCT) номер WO 02/090534). Запальні захворювання (наприклад, остеоартрит, ревматоїдний артрит) (див., наприклад, Dangond et al., 1998, Biochem. Biophys. Res. Commun., Vol. 242, No. 3, pp. 648- 652; Takahashi, I., et al, 1996, J. Antibiot. (Tokyo), Vol. 49, No. 5, pp. 453-457). Хвороби, пов'язані з ангиогенезом (наприклад, рак, ревматоїдний артрит, псоріаз, діабетична ретинопатія) (див., наприклад, Kim et al., 2001, Nature Medicine, Vol. 7, No. 4, pp. 437- 443). Гематопоетичні захворювання (наприклад, анемія, серповидно-клітинна анемія, таласемія) (див., наприклад, McCaffrey et al., 1997, Blood, Vol. 90, No. 5, pp. 2075- 2083). Викликані грибами інфекції (див., наприклад, Bernstein et al., 2000, Proc. Natl. Acad. Sci. USA, Vol. 97, No. 25, pp. 13708- 13713; Tsuji et al., 1976, J. Antibiot. (Tokyo), Vol. 29, No. 1, pp. 16). Паразитарні інфекції (наприклад, малярія, трипаносомоз, гельмінтоз, протозойна інфекція (див., наприклад, Andrews et al., 2000, Int. J. Parasitol., Vol. 30, No. 6, pp. 761-768). Бактеріальні інфекції (див., наприклад, Onishi et al., 1996, Science, Vol. 274, pp. 939-940). Вірусні інфекції (див., наприклад, Chang et al., 2000, Nucleic Acids Res., Vol. 28, No. 20, pp. 3918-3925). Патологічні стани, які піддаються лікуванню імуномодуляцією (наприклад, неуважний склероз, аутоіммунний діабет, волчанка, атопічний дерматит, алергія, астма, алергійний риніт, запальна хвороба кишечнику; і для поліпшення приживлення трансплантата) (див., наприклад, Dangond et al., 1998, Biochem. Biophys. Res. Commun., Vol. 242, No. 3, pp. 648- 652; Takahashi et al., 1996, J. Antibiot. (Tokyo), Vol. 49, No. 5, pp. 453-457). Дозування Введення можна здійснювати у вигляді однієї дози, безупинно або із проміжками, (наприклад, частинами дози з відповідними інтервалами) протягом усього курсу лікування. Способи визначення найбільш ефективного способу й дози введення добре відомі фахівцям у даній області й залежать від конкретного складу, застосовуваного для терапії, мети терапії, 26 UA 99810 C2 5 10 15 20 25 30 35 40 45 50 55 60 клітини (клітин) мішеней, на які спрямоване лікування, і суб'єкта, що піддається лікуванню. Однократне або багаторазове введення можна бути здійснити із застосуванням рівня дози й схеми, обраної лікарем, лікарем-консультантом або ветеринаром. В одному з варіантів реалізації об'єкт одержує інгібітор HDAC внутрішньовенно або 2 підшкірно в кількостях, достатніх для доставки близько 3-1500 мг/м у день, наприклад, близько 2 3, 30, 60, 90, 180, 300, 600, 900, 1000, 1200 або 1500 мг/м у день. Такі кількості можна вводити за допомогою ряду підходящих способів, наприклад, більші обсяги інгібітору HDAC у низької концентрації протягом одного тривалого періоду часу або кілька разів на день. Необхідну кількість можна вводити протягом одного або більше послідовних днів, через день, з перервами або із застосуванням комбінації перерахованого протягом тижня (7-денний строк). Крім того, можна вводити невеликі обсяги інгібітору HDAC у високій концентрації протягом короткого періоду часу, наприклад, один раз у день протягом одного або більше днів або послідовно, через день, з перервами або із застосуванням комбінації перерахованого протягом 2 тижня (7-денний строк). Наприклад, можна вводити дозу 300 мг/м у день протягом 5 2 послідовних днів, у цілому 1500 мг/м за період лікування. При іншому режимі дозування число послідовних днів може також становити 5, при цьому лікування продовжують протягом 2 або 3 2 2 послідовних тижнів до досягнення загальної кількості 3000 мг/м й 4500 мг/м за період лікування. Як правило, можна приготувати склад для внутрішньовенного введення, що містить інгібітор HDAC у концентрації від приблизно 1,0 мг/мол до приблизно 10 мг/мол, наприклад, 1,0 мг/мол, 2,0 мг/мол, 3,0 мг/мол, 4,0 мг/мол, 5,0 мг/мол, 6,0 мг/мол, 7,0 мг/мол, 8,0 мг/мол, 9,0 мг/мол й 10 мг/мол, і вводити в кількості, необхідної для досягнення описаних вище доз. В одному прикладі суб'єктові можна ввести достатній обсяг препарату для внутрішньовенного введення в день, таким чином, щоб загальна денна доза склала від приблизно 300 до 2 приблизно 1200 мг/м . 2 У конкретному варіанті реалізації кожні 24 години внутрішньовенно вводять 900 мг/м PXD101 протягом щонайменше п'яти послідовних днів. В іншому конкретному варіанті реалізації 2 кожні 24 години внутрішньовенно вводять 100 мг/м PXD-101 протягом щонайменше п'яти послідовних днів. В іншому варіанті реалізації дози інгібітору HDAC для перорального введення при застосуванні його для лікування бажаного патологічного стану може змінюватися від приблизно 2 мг до приблизно 2000 мг у день, наприклад, від приблизно 20 мг до приблизно 2000 мг у день, наприклад, від приблизно 200 мг до приблизно 2000 мг у день. Наприклад, доза для перорального введення може становити приблизно 2, приблизно 20, приблизно 200, приблизно 400, приблизно 800, приблизно 1200, приблизно 1600 або приблизно 2000 мг у день. Очевидно, що загальну щоденну кількість можна вводити у вигляді однієї дози або можна вводити у вигляді множинних доз, наприклад, два, три або чотири рази в день. Наприклад, суб'єкт може одержати від приблизно 2 мг/день до приблизно 2000 мг/день, наприклад, від приблизно 20 мг/день до приблизно 2000 мг/день, наприклад, від приблизно 200 мг/день до приблизно 2000 мг/день, наприклад, від приблизно 400 мг/день до приблизно 1200 мг/день. Таким чином, лікарський препарат, приготовлений відповідним чином, і призначений для введення один раз у день, може містити від приблизно 2 мг до приблизно 2000 мг, наприклад, від приблизно 20 мг до приблизно 2000 мг, наприклад, від приблизно 200 мг до приблизно 1200 мг, наприклад, від приблизно 400 мг/день до приблизно 1200 мг/день. Інгібітори HDAC можна вводити у вигляді однієї дози або частинами загальної дози два, три або чотири рази в день. Для введення два рази в день відповідним чином приготовлений лікарський препарат повинен, отже, містити половину необхідної щоденної дози. Набори Один з аспектів даного винаходу відноситься до набору (або набору компонентів), що включає: (a) фармацевтичну композицію (наприклад, попередній склад, склад), описану в даній заявці, переважно надану в підходящому контейнері й/або з підходящим упакуванням, і (б) інструкції із застосування, наприклад, письмову інструкцію із введення препарату, і т.п. Один з аспектів даного винаходу відноситься до набору (або набору компонентів), що включає: (a) фармацевтичну композицію (наприклад, попередній склад), як описану в даній заявці, переважно надану в підходящому контейнері й/або з підходящим упакуванням, і (б) інструкції із застосування, наприклад, письмові інструкції з приготування відповідного фармацевтичного складу з композиції (наприклад, попереднього складу й наступному введенню препарату, і т.п. Набір може включати додаткові компоненти, що включають, наприклад, відповідні розчини для розведення (наприклад, фізіологічний сольовий розчин, розчин глюкози й т.п.), реагенти 27 UA 99810 C2 5 10 (наприклад, для зміни pH) і пристрою (наприклад, мішки, пробірки, шприці, голки, пристрої для переносу) для зборки й застосування (наприклад, при готуванні складів і наступному введенні). Письмові інструкції можуть також включати перелік показань, при яких склад (наприклад, що містить інгібітор HDAC) є підходящим лікуванням. Дослідження препаратів Ці дослідження демонструють значне збільшення розчинності інгібітору HDAC (у порядку 500-кратного збільшення для PXD-101) при застосуванні одного або більше з: циклодекстрину, аргініну й меглуміна. Композиції, що утворяться, стабільні й можуть бути розведені до необхідної заданої концентрації без ризику преципітації. Крім того, композиції мають pH, котрий хоча і вище ідеального, але є прийнятним для застосування. O N H 15 20 25 S C O H N PXD-101 OH O Поглинання УФ 1 Значення коефіцієнта поглинання світла ультрафіолетової області (УФ) E 1 для PXD-101 визначали шляхом побудови каліброваної кривої в залежності від концентрації PXD-101 в 1 50:50 метанол/вода при λmax для речовини 269 нм. Визначене даним методом значення E 1 склало 715,7. У дослідженнях розчинності суміш метанол/вода, а не чистий метанол (або інший органічний розчинник), була обрана як середовище для послідовних розведень для того, щоб зменшити ризик преципітації циклодекстрину. Розчинність у демінерализованій воді Встановили, що розчинність PXD-101 для демінералізованої води склала 0,14 мг/мол. Поліпшення розчинності за допомогою циклодекстринів Одержували насичені зразки PXD-101 у водяних розчинах двох природних циклодекстринів (α-CD й γ-CD) і гідроксипропилових похідних α, β і γ циклодекстринів (HP-α-CD, HP-β-D й HP-γCD).Всі експерименти завершували при концентрації циклодекстрину 250 мг/мол, за винятком α-циклодекстрину, розчинність якого була недостатньою для досягнення цієї концентрації. Дані підсумовані в наступній таблиці. HP-β-CD забезпечує найкраще збільшення розчинності PXD101. 30 Таблиця 1 Збільшення розчинності циклодекстринів Циклодекстрин α-CD HP-α-CD HP-β-CD γ-CD HP-γ-CD 35 40 Концентрація циклодекстрину (мг/мол) 100 250 250 250 250 Концентрація Інгібітору HDAC (мг/мол) 0,65 2,32 11,76 1,44 7,00 Збільшення розчинності 5 17 84 10 50 Визначення фазової розчинності HP-β-CD Діаграмауфазової розчинності для HP-β-CD одержали при концентраціях циклодекстрину від 50 до 500 мг/мол (5-50% мас./про). Була побудована залежність розрахункових значень розчинності інгібітору HDAC у комплексі від концентрації циклодекстрину. Див. Фігуру 1. Як показує графік, існує приблизно лінійна залежність між концентраціями циклодекстрину й інгібітору HDAC при молярному відношенні приблизно 4:1. Такий тип діаграми фазової розчинності для циклодекстринів називають графіком фазової розчинності типу А. На графіку видно незначне позитивне відхилення відношення інгібітору HDAC до циклодекстрину. Це відхилення може бути наслідком експериментальної помилки, пов'язаної з рішенням використати масу замість обсягу для дозування більше концентрованих зразків циклодекстрину внаслідок їхньої в'язкості. Крім того, можливо, що існує незначне відхилення від лінійного характеру фазової розчинності типу А. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical formulations of histone deacetylase inhibitors
Автори англійськоюBastin, Richard, J., Hughes, Nicholas, J.
Назва патенту російськоюФармацевтические составы, которые содержат ингибиторы деацетилазы гистонов
Автори російськоюБастин Ричард Джей, Хьюз Николас Джей
МПК / Мітки
МПК: A61P 35/00, A61K 47/26, A61K 47/18, A61K 47/40, A61K 31/18
Мітки: інгібітори, деацетилази, складі, фармацевтичні, гістонів, містять
Код посилання
<a href="https://ua.patents.su/45-99810-farmacevtichni-skladi-shho-mistyat-ingibitori-deacetilazi-gistoniv.html" target="_blank" rel="follow" title="База патентів України">Фармацевтичні склади, що містять інгібітори деацетилази гістонів</a>
Попередній патент: Спосіб очищення теплообмінного обладнання
Наступний патент: Спосіб і пристрій для очищення води, що передбачають утворення біполярного шару
Випадковий патент: Спосіб отримання біологічно активного жиру з печінки хрящових риб












