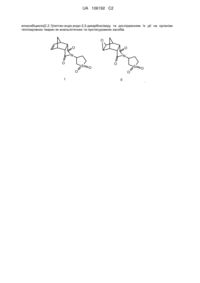
N-(1,1-діоксотетрагідротіофен-3-іл)біцикло[2.2.1]гепт-5-ен-ендо,ендо-2,3-дикарбоксімід та n-(1,1-діоксотетрагідротіофен-3-іл)-екзо-5,6-епоксибіцикло[2.2.1]гептан-ендо,ендо-2,3-дикарбоксімід, які виявляють аналь
Номер патенту: 106192
Опубліковано: 11.08.2014
Автори: Касьян Андрій Олегович, Тарабара Ігор Миколайович, Кас'ян Лілія Іванівна, Зленко Олена Тимофіївна, Пальчиков Віталій Олександрович, Стефаник Михайло Іванович, Дульнєв Петро Георгійович, Мамчур Віталій Йосипович, Прядка Маргарита Олександрівна
Формула / Реферат
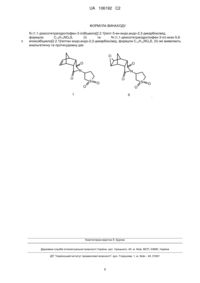
N-(1,1-Діоксотетрагідротіофен-3-іл)біцикло[2.2.1]гепт-5-ен-ендо,ендо-2,3-дикарбоксімід, формули C13H15NO4S, (I) та N-(1,1-діоксотетрагідротіофен-3-іл)-екзо-5,6-епоксибіцикло[2.2.1]гептан-ендо,ендо-2,3-дикарбоксімід, формули C13H15NO5S, (II) які виявляють анальгетичну та протисудомну дію.

Текст
Реферат: N-(1,1-діоксотетрагідротіофен-3-іл)біцикло[2.2.1]гепт-5-ен-ендо,ендо-2,3-дикарбоксімід та N(1,1-діоксотетрагідротіофен-3-іл)-екзо-5,6-епоксибіцикло-[2.2.1]гептан-ендо,ендо-2,3дикарбоксімід, які виявляють анальгетичну та протисудомну дію. Винахід стосується способу синтезу N-(1,1-діоксотетрагідротіофен-3-іл)біцикло[2.2.1]гепт-5-енендо,ендо-2,3-дикарбоксіміду та N-(1,1-діоксотетрагідротіофен-3-іл)-екзо-5,6епоксибіцикло[2.2.1]гептан-ендо,ендо-2,3-дикарбоксіміду, які виявляють анальгетичну та протисудомну дію. Задачею винаходу є синтез нових біологічно активних сполук та дослідження спектра їх фармакологічних властивостей. Поставлена задача вирішується синтезом N-(1,1-діоксотетрагідротіофен-3-іл)біцикло[2.2.1]гепт5-ен-ендо,ендо-2,3-дикарбоксіміду та N-(1,1-діоксотетрагідротіофен-3-іл)-екзо-5,6 UA 106192 C2 (12) UA 106192 C2 епоксибіцикло[2.2.1]гептан-ендо,ендо-2,3-дикарбоксіміду та дослідженням їх дії на організм теплокровних тварин як анальгетичних та протисудомних засобів. O O O N N O S O I O S O O II O . UA 106192 C2 5 10 15 Винахід стосується двох нових хімічних сполук - похідних ангідриду біцикло[2.2.1]гепт-5-енендо, eндо-2,3-дикарбонової кислоти (І, ендикового ангідриду) [1], які містять сульфолановий (тіоландіоксидний) фрагмент. Заявлені сполуки (II, III) виявляють анальгетичну та протисудомну дію, що передбачає можливість застосування їх в медичній практиці як лікарських препаратів. Шляхи пошуку ефективних засобів боротьби з болем залишаються важливим напрямком сучасної медицини. Біль, що є сигналом загрози, при тривалому впливі перетворюється в небезпечний патологічний фактор. Анальгетики є активними захисними засобами від больового стресу, але сучасним болезаспокійливим препаратам притаманні численні побічні ефекти. Наркотичні анальгетики, поряд з гальмуванням ноцицептивних реакцій, підвищують судомну активність [2]. Тому набуває суттєвого значення пошук біологічно активних сполук, які мають як анальгетичні, так і протисудомні якості. Ефект заявлених сполук (II, III) порівнювали з широко відомим класичним анальгетиком помірної болезаспокійливої дії - анальгіном (аналог) у загальноприйнятому дозуванні 100 мг/кг. 2,6-ендо Як прототип, вибрано N-(n-толуолсульфоніл)-N'-(3,5-діоксо-4-азатрицикло[5.2.1.0 ]дец-8-ен4-іл)карбамід (IV) [3], який також виявляє анальгетичну та протисудомну активність і має близьку за хімічною природою структуру. Задачею винаходу є розробка нових біологічно активних засобів, що мають виражену болезаспокійливу дію разом із протисудомним ефектом. O O O O 25 30 O O NH NHSO2 CH3 O III VI 7 H2N 1 1 2 3 5 4 O O + кип'ятіння, 12 годин, 67,6 % O S 2 6 конц. CH3COOH 3 5 O 4 O O O O II I 45 O O Ця задача вирішується синтезом оригінальних, не описаних в літературі імідів (II, III). Речовина (II) - N-(1,1-діоксотетрагідротіофен-3-іл)біцикло-[2.2.1]гепт-5-ен-ендо, ендо-2,3дикарбоксімід, формули C13H15NO4S, і його епоксидне похідне (III) - N-(1,1діоксотетрагідротіофен-3-іл)-екзо-5,6-епоксибіцикло[2.2.1]гептан-ендо, ендо-2,3-дикарбоксімід, C13H15NO5S. Іміди на основі ангідриду (І), ендо- та екзо-стереоізомери та їх похідні мають досить широкий спектр застосування. Їм притаманна фармакологічна активність: психотропна [4], антидепресантна дія [5], вони використовуються для лікування центральної нервової системи [6], системи кровообігу [7], зокрема як протиаритмічні препарати [8], як засоби, що мають жарознижуючу та анальгетичну активність [9], седативні засоби [10], протизапальні засоби [11]. Для синтезу сполуки (II) запропоновано спосіб, що полягає у взаємодії промислово доступного ангідриду (І) [1] з 3-аміно-1,1-діоксотетрагідротіофеном. 6 40 S O II 7 35 N O S I 20 N O O O O N S O Приклад 1 До 3,28 г (0,02 моль) ендикового ангідриду (І) в 50 мл льодяної оцтової кислоти додали 2,70 г (0,02 моль) 3-аміно-1,1-діоксотетрагідротіофену і кип'ятили отриману суміш протягом 12 годин (дані тонкошарової хроматографії). Оцтову кислоту випарували у вакуумі, до залишку додали 50 мл води. Кристали відфільтрували, промивали на фільтрі водою до нейтральної реакції на лакмус і висушили на повітрі. Продукт додатково очистили перекристалізацією із суміші ізопропілового спирту з водою (5:1 за об'ємом). Вихід іміду (II) 3,80 г (67.6 %), Тпл. 180,5-182 °C, Rf 0 (діетиловий етер, Silufol UV-254), 0 (2пропанол, Silufol UV-254). Сполука (II) синтезована вперше, раніше не описана. Склад та структура заявленої 1 13 речовини доведена елементним аналізом, а також даними ІЧ-спектра та спектрів ЯМР Н і С. Знайдено, %: С - 55,48; Н - 5,39; N-5,01. C13H15NO4S. Обчислено, %: С - 55,52; Н - 5,34; N-4,98. -1 ІЧ-спектр (КВr), см : 3070, 3010, 1758, 1685, 1380, 1315, 1218, 1150, 1055, 732. 1 UA 106192 C2 1 5 5,6 Спектр ЯМР Н (400 МГц, ДМСО-d6), δ, м. ч.: 6,07 м (2Н, Н ), 4,62 м (1Н, Нцикл), 3,20-3,40 1 4 2 3 (4Н, Нцикл), 3,37 м (1Н, Н ), 3,34 м (1Н, Н ), 3,31 м (1Н, Н ), 3,24 м (1Н, Н ), 2,37 м (1Н, Нцикл), 2,16 7s 2 7а м (1Н, Нцикл), 1,52 д (1Н, H , J7s, 7a 7,2 Гц), 1,50 д (1Н, Н ). 13 5,6 Спектр ЯМР С (100,6 МГц, ДМСО-d6), δ, м. ч.: 178,9 (С=О), 178,8 (С=О), 135,9 (С ), 52,9 7 2,3 4 1 (Сцикл), 52,4 (Сцикл), 51,4 (Сцикл), 51,4 (С ), 46,3 (С ), 46,0 (С ), 45,9 (С ), 26,9(Сцикл). Епоксиімід (III) одержували окисленням іміду (II) надлишком пероксимурашиної кислоти (ПМК) in situ. 7 7 1 5 ПМК, 40 оС 2 6 3 4 доби, 94,6 % O 4 O 1 6 2 3 4 5 N N O O S O O O II 10 15 20 25 30 35 40 O S O III Приклад 2 До 5,62 г (0,02 моль) іміду (II) в 40 мл 98 %-ної мурашиної кислоти додали по краплях при перемішуванні 0,05 моль 50 %-ного розчину пероксиду водню і продовжували перемішувати при температурі 40 °C до закінчення реакції, на що треба 4 доби. Мурашину кислоту випарували у вакуумі, до залишку додали 50 мл води. Кристали відфільтрували, промивали на фільтрі водою до нейтральної реакції на лакмус і висушили на повітрі. Продукт додатково очистили перекристалізацією із ізопропілового спирту. Вихід епоксиіміду (III) 5,62 г (94,6 %), Тпл. 217219 °C, Rf 0 (діетиловий етер, Silufol UV-254), 0 (2-пропанол, Silufol UV-254). Сполука (III) синтезована вперше, раніше не описана. Склад та структура заявленої 1 речовини доведена елементним аналізом, а також даними ІЧ-спектра та спектра ЯМР Н. Знайдено, %: С - 52,44; Н - 5,11; N-4,73. C13H15NO5S. Обчислено, %: С - 52,53; Н - 5,05; N-4,71. -1 ІЧ-спектр (КВr), см : 3030, 1775, 1710, 1405, 1335, 1160, 860. 1 Спектр ЯМР Н (400 МГц, ДМСО-d6), δ, м. ч.: 4,75 м (1Н, Нцикл), 3,37 м (4Н, Нцикл), 3,23 м (2Н, 5,6 2,3 1,4 7s 2 Н ), 3,16 м (2Н, Н ), 2,88 м (2Н, Н ), 2,30 м (2Н, Нцикл), 1,35 д (1Н, H , J7s, 7a 10,2 Гц), 1,05 д 7а (1Н, Н ). Біологічні властивості заявлених речовин (II, III) вивчали в експериментах на дорослих безпорідних білих мишах масою 20-30 г. У першій серії визначалася гостра токсичність нових сполук (II, III) за методом Litchfield, Wilcoxon (1949) в модифікації В.Б. Прозоровського (1962) [12]. Досліджувані речовини вводилися внутрішньоочеревинно в рідкій лікарській формі з застосуванням солюбілізатора ТВІН-40. Досліди показали, що середня смертельна доза для сполуки (II) становить 1282±28 мг/кг, а для сполуки (III) 1536±16 мг/кг, тобто вони належать до речовин IV класу небезпеки, до малотоксичних речовин [13]. В подальших серіях сполуки, що 1 вивчались, як і найближчий аналог, вводилися в дозі 10 ЛД50, тобто 128,2 та 153,6 мг/кг відповідно. У другій серії експериментів вивчалася болезаспокійлива дія досліджуваних сполук (II, III) за методом термічного подразнення на гарячій пластинці (метод "hot plate") при температурі 55 °C. Больовий поріг визначали по латентному періоду больової реакції, перші ознаки якої проявлялися вилизуванням задніх лапок. За 30 хвилин до тестування піддослідні миші отримували внутрішньоочеревинно досліджувані сполуки. Спостереження показали, що вже через півгодини після ін'єкції сполуки (II) відмічалося підвищення величини латентного періоду больової реакції на 128,18 % по відношенню до вихідного стану (табл. 1). 2 UA 106192 C2 Таблиця 1 Анальгетична дія сульфоланвмісних похідних (II, III) ряду норборнену на моделі "hot plate" Час після введення препарату 30 хвилин 60 хвилин 90 хвилин 28,66*±3,6 33,15*±2,8 24,15*±2,4 +128,18 +163,93 +92,03 +120,12 +196,51 +90,90 Препарат Статистичні показники Вихідний стан Заявлена речовина (II) М±m % від ВС % від контролю 12,56±1,2 Контроль до речовини (II) М±m 10,66±0,6 13,02±0,7 11,18±1,09 12,64±1,5 Заявлена речовина (III) M±m % від ВС % від контролю 10,06±0,46 18,18*±3,32 +10,84 +95,4* 39,06*±4,69 +288,65 +311,2* 32,86*±5,7 +226,96 +265,1* Контроль до речовини (III) М±m 8,5±1,5 9,3±0,8 9,5±0,4 9,0±0,9 13,3*±1,8 +132,90 20,8*±1,8 +128,20 18,4*±4,2 +223,50 15,3*±0,7 +72,8 Прототип (IV) Анальгін М±m % від ВС % від контролю М±m % від ВС % від контролю 5,7±0,6 8,9±0,9 Примітки: знак * - відповідає вірогідній відмінності Р0,05; знак «+» означає підвищення величини у порівнянні з контролем. 5 10 15 20 При зіставленні результату дослідної серії з показниками контрольної групи анальгетична дія має близький показник (120,12 %). Незначне підвищення порога больової чутливості у контрольних тварин можна пояснити активацією власної опіатної антиноцицептивної системи. Пік протибольової активності нової сполуки (II) припадає на 60 хвилину тестування. Тривалість латентного періоду в дослідній серії значно зросла та досягла 33,15±2,8 с, в той час як у контрольних мишей показник зменшився до 11,18±0,9 с, тобто, по відношенню до вихідного стану латентний період больового реагування при дії іміду (II) збільшився до 163,93 %, а в співставленні з контролем - до 196,51 %, що на 59,57 % менше ніж ефект прототипу (IV), але на 91,13 % перевищує дію анальгіну в загально прийнятному дозуванні (100 мг/кг). На 90 хвилині експерименту анальгетична дія сполуки (II) почала зменшуватись. Через півтори години після введення досліджуваної речовини його болезаспокійливий ефект складав 92,03 % у порівнянні з вихідним станом, або 90,90 % по відношенню до даних контрольної групи тварин (табл. 1). Дані табл. 1 свідчать про значну перевагу заявленої сполуки (III) в аспекті анальгетичної дії як у порівнянні з анальгіном та прототипом (IV), так і у порівнянні з даними, отриманими для заявленої речовини (II). Дія епоксиіміду (III) досягає максимуму на 60 хвилині після введення та перевершує ефект прототипу (IV) на 65,15 %, іміду (II) - на 124,72 %, а найбільше анальгіну - на 215,85 %. При проведенні подальших досліджень було встановлено протисудомну дію заявлених речовин (II, III). Застосовувалася модель коразолових (100 мг/кг) судом. Відмічалася тривалість життя піддослідних мишей, що отримували внутрішньоочеревинно за 30 хвилин до початку 1 тестування /10 ЛД50 заявленого препарату. В контрольній серії робили ін'єкції ізотонічного розчину натрію хлориду в тому ж об'ємі. До обох розчинів додавали ТВІН-40 (табл. 2). 25 3 UA 106192 C2 Таблиця 2 Вплив заявлених сполук (II, III) на судомну дію коразолу № п/п 1. 2. 3. 4. 5. 6. Препарат Заявлена сполука (II) Заявлена сполука (III) Прототип (IV) Контроль до препарату (II) Контроль до препарату (III) Контроль до препарату (IV) Тривалість життя (хвилини) М±m 18,16±1,4 5,6±0,5 6,8±0,7 8,83±1,19 4,1±0,5 4,3±0,6 Протисудомна дія, % + 105,66* + 36,60* + 58,10* Примітки аналогічні табл. 1. 5 10 Дослідження показали, що введення сполук (II, III) суттєво підвищує тривалість життя тварин, що свідчить про опірність до судомного впливу. Як показують дані аналізу, ефект заявленої сполуки (II) значно перевищував ступінь протисудомної дії не тільки іміду (III) на 69,06 %, але й дії прототипу (IV) на 47,56 %. У четвертій серії дослідів вивчалася дія оригінальних сполук (II, III) на центральну нервову систему, а саме виявлення балансу процесів збудження і гальмування на білих мишах. Використовували метод впливу досліджуваних речовин на тривалість наркотичного (гексеналового) сну. Гексенал вводили внутрішньоочеревинно в дозі 60 мг/кг. За 30 хвилин до введення гексеналу піддослідні тварини одержували внутрішньоочеревинно ін'єкцію 1 досліджуваної сполуки у дозі /10 ЛД50. Контрольним мишам вводили ізотонічний розчин натрію хлориду у тому ж об'ємі. До обох розчинів додавали ТВІН-40 (табл. 3). Таблиця 3 Вплив заявлених імідів (II, III) на тривалість гексеналового сну № п/п Препарат 1. 2. 3. 4. 5. 6. Заявлена сполука (II) Контроль до сполуки (II) Заявлена сполука (III) Контроль до сполуки (III) Прототип (IV) Контроль до прототипу (IV) Тривалість сну (хвилини) Транквілізуюча активність, % (по М±m відношенню до контролю) 27,00*±1,2 +56,97* 17,8±1,06 23,6±1,1 +24,2* 19,0±1,8 21,6*±1,4 +66,2* 13,0±0,3 Примітки аналогічні табл. 1. 15 20 Дані експерименту свідчать про безумовну наявність синергізму вивчаємих сполук (II, III) з гексеналом, що доводить їх гальмівну, гіпно-седативну, транквілізуючу дію на головний мозок, але ефект заявлених сполук (II, III) на 9,23 % та 42 % відповідно менше дії прототипу (IV). Дослідження показали, що речовини (II, III) мають протисудомні і транквілізуючі властивості, що свідчить про перевагу гальмівних процесів у ЦНС. Такі прояви можуть призвести до підвищення резистентності до дефіциту кисню. Тому в наступній, п'ятій серії дослідів ми вивчали антигіпоксичну дію оригінальних сполук (II, III) по визначенню тривалості життя піддослідних тварин у замкнутому просторі, на моделі нормобаричної артеріально-гіпоксичної гіпоксії (О.Н. Єлізарова, 1971). 25 4 UA 106192 C2 Таблиця 4 Антигіпоксична активність сполук (II, III) № п/п Препарат 1. 2. 3. 4. 5. 6. Заявлена сполука (II) Контроль до сполуки (II) Заявлена сполука (III) Контроль до сполуки (III) Прототип (IV) Контроль до прототипу (IV) Тривалість життя (хвилини) М±m 14,0*±1,0 10,3±0,3 15,5±0,31 13,0±2,36 14,2*±0,4 8,0±0,3 Антигіпоксична активність, % (по відношенню до контролю) +35,7* + 19,2 +77,5* Примітки аналогічні табл. 1. 5 10 15 20 25 30 35 40 Спостереження показали (табл. 4), що заявлені сполуки (II, III) мають антигіпоксичну активність і призводять до збільшення тривалості життя мишей в умовах гіпоксії, але рівень вказаної дії значно (на 41,6 % і 58,3 % відповідно) нижчий, ніж для прототипу (IV). Таким чином, заявлені речовини (II, III) виявляють значну анальгетичну та протисудомну дію, яка переважає властивості прототипу (IV), а також мають слабкий транквілізуючий та антигіпоксичний ефекти. Джерела інформації: 1. Fringuelli F., Taticchi A. The Diels-Alder Reaction: Selected Practical Methods. - John Wiley & Sons, Ltd.-2002.-340 p. 2. Лекарственная анальгезия в условиях измененного функционального состояния мозга / Опрышко В.И., Мамчур В.Й., Зленко Е.Т. // II Российский национальный конгресс "Человек и лекарство": Тез. докл. - М.: 1995. - С.17. 3. Пат. 20676 Україна, МПК С07С 13/00, С07С 311/16. N-(n-толуолсульфоніл)-Н'-(3,5-діоксо2,6-ендо 4-азатрицикло[5.2.1.0 ]дец-8-ен-4-іл)карбамід, який виявляє анальгетичну, проти судомну, транквілізуючу та антигіпоксичну дію / Зленко О.Т., Кас'ян Л.І., Мамчур В.Й., Тарабара І.М., Бондаренко Я.С., Опришко В.І. - № u200606452; Заявл. 09.06.2006; Опубл. 15.02.2007. – 4 с. 4 4. Заявка 63-132887 Япония, МКИ C07D 417/112. Новые имидные производные / Фудзио А., Маюми Й., Икутаро С. - № 62-271410; Заявл. 26.09.1986; Опубл. 04.06.1988 // РЖХим. - 1990. - 7 О 108П. 5 5. Пат. 5011841 США, МКИ А61К31/50; 31/495. Treatment of depression / К.А. Scappaticci. №436405; Заявл. 14.11.1989; Опубл. 30.04.1991; НКИ 514/253 // РЖХим. - 1992. - 9 О 245П. 6. Correlation of a structure and neurotropic action in a series of original norbornene derivatives / nd Zlenko H., Kasyan L., Mamchur V. et al. // 2 Europ. Congr. of Pharmacology. Budapest. Hungary. Fund. Clin. Pharm. - 1999. -Vol. 13, № l. -P. 377. 7. Пат. 3850922 США, МКИ C07D87/42. 5-endo-benzoyloxy-N[amino(lower)alkyl]bicyclo[2.2.1]heptane-2,3-dieno-carboxylic acid imides / M. Иширо, О. Садао. - № 3850922; Заявл. 13.09.1973; Опубл. 26.11.1974 // РЖХим. - 1975. - 22 О 43 П. 8. Пат. 3850921 США, МКИ C07D27/50. Derivatives of 2,3-norbornanedicarboxamide / М. Ichiro, О. Sadao. - №3850921; Заявл. 20.09.1972; Опубл. 26.11.1974 // РЖХим. - 1975. - 18 О 19 П. 4 9. Пат. 4585 Япония, МКИ 16Е33. Способ получения 1-(о-хлорфенил)-3,6-эндометилен-Δ тетрагидрофталимида / Т. Седзи, X. Сукэюки. - №4585; Заявл. 04.12.1964; Опубл. 24.02.1967 // РЖХим. - 1968. - 10 Н 351 П. 10. Thalidomid-Analoga, 3. Mitt / H. Koch, J. Kotlan, E. Farkouh, M. Lindner // Monatsh. Chem.1971.-Bd. 102. -№2. - S. 609-621. 11. Заявка 54-103864 Япония, МКИ C07D 209/56. Производные N-(п-замещенный фенил)5 4,7-эндометилен-Δ -гидроизоиндолинов / Масахиро Т., Макошо С, Хисаюки Т., Кодзи К. - №538479; Заявл. 26.01.1978; Опубл. 15.08.1979 // РЖХим. - 1980. - 13 О 109 П. 12. Прозоровский В.Б. Использование метода наименьших квадратов для пробит-анализа кривых летальности // Фармакология и токсикология. - 1962. - Т. 25. - № 1. - С. 115-119. 13. Експериментальне вивчення токсичної дії потенційних лікарських засобів / В.М. Коваленко, О.В. Стефанов, Ю.М. Максимов, І.М. Трахтенберг // Доклінічні дослідження лікарських засобів. - Київ. - 2001. - 74с. 45 5 UA 106192 C2 ФОРМУЛА ВИНАХОДУ 5 N-(1,1-діоксотетрагідротіофен-3-іл)біцикло[2.2.1]гепт-5-ен-ендо,ендо-2,3-дикарбоксімід, формули C13H15NO4S, (I) та N-(1,1-діоксотетрагідротіофен-3-іл)-екзо-5,6епоксибіцикло[2.2.1]гептан-ендо,ендо-2,3-дикарбоксімід, формули C13H15NO5S, (II) які виявляють анальгетичну та протисудомну дію O O O N N O S O O S O O I II O . Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
Автори англійськоюZlenko Olena Tymofiivna, Mamchur Vitalii Yosypovych, Kasian Lilia Ivanivna, Palchikov Vitalii Oleksandrovych, Kasian Andrii Olegovych, Dulniev Petro Heorhiiovych, Tarabara Ihor Mykolaiovych, Stefanyk Mykhailo Ivanovych, Priadka Margaryta Oleksandrivna
Автори російськоюЗленко Елена Тимофеевна, Мамчур Виталий Иосифович, Касьян Лилия Ивановна, Пальчиков Виталий Александрович, Касьян Андрей Олегович, Дульнев Петр Георгиевич, Тарабара Игорь Николаевич, Стефаник Михаил Иванович, Прядка Маргарита Александровна
МПК / Мітки
МПК: A61P 29/00, C07D 409/04, A61K 31/403, C07D 209/52
Мітки: аналь, n-(1,1-діоксотетрагідротіофен-3-іл)біцикло[2.2.1]гепт-5-ен-ендо,ендо-2,3-дикарбоксімід, виявляють, n-(1,1-діоксотетрагідротіофен-3-іл)-екзо-5,6-епоксибіцикло[2.2.1]гептан-ендо,ендо-2,3-дикарбоксімід
Код посилання
<a href="https://ua.patents.su/8-106192-n-11-dioksotetragidrotiofen-3-ilbiciklo221gept-5-en-endoendo-23-dikarboksimid-ta-n-11-dioksotetragidrotiofen-3-il-ekzo-56-epoksibiciklo221geptan-endoendo-23-dikarboksimid-yaki-viya.html" target="_blank" rel="follow" title="База патентів України">N-(1,1-діоксотетрагідротіофен-3-іл)біцикло[2.2.1]гепт-5-ен-ендо,ендо-2,3-дикарбоксімід та n-(1,1-діоксотетрагідротіофен-3-іл)-екзо-5,6-епоксибіцикло[2.2.1]гептан-ендо,ендо-2,3-дикарбоксімід, які виявляють аналь</a>
Попередній патент: Спосіб одержання транс-1-((1r,3s)-6-хлор-3-феніліндан-1-іл)-3,3-диметилпіперазину
Наступний патент: Гомологічна рекомбінація, опосередкована нуклеазами з цинковими пальцями
Випадковий патент: Скеровуючий пристрій для розпилювання матеріалу