Спосіб одержання соматичного хітинвмісного матеріалу вищих базидіальних грибів
Номер патенту: 25350
Опубліковано: 30.10.1998
Автори: Вассер Соломон Павлович, Даниляк Микола Ілліч, Решетніков Сергій Васильович, Янчевський Віктор Казимирович
Текст
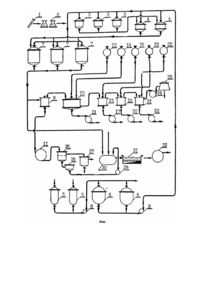
Изобретение относится к биотехнологии получения природных полимеров из соматических хи тинсодержащих структур высших базидиальных грибов. Хитинсодержащий полимер и его производные нашли применение в целом ряде отраслей промышленности, сельском хозяйстве, медицине, в частности: в сельском хозяйстве для создания высокопродуктивных экологически чистых препаратов для защиты растений; в медицине в качестве носителя для лекарственных препаратов пролонгированного действия, для изготовления просыпочных материалов; в целлюлозно-бумажной промышленности для изготовления бумаги, картона и специальных изделий; в текстильной - для изготовления нитей, пряжи и нетканных материалов; в химической - в качестве сорбента ионов тяжелых металлов, для микрофильтрации и диализа, в качестве основы для иммобилизации ферментов и при приготовлении катализаторов, для очистки сточных вод; в те хнике в качестве теплоизоляционного и химически стойкого материала и ряде других о траслей промышленности. Хитинсодержащий полимер значительно превосходит целлюлозу и другие натуральные волокна по химической стойкости к кислотам, щелочам и органическим растворителям, а также по механической прочности. Известны аналоги получения хитинсодержащих материалов из панцирей ракообразных, содержание хитина а которых составляет 10 - 15%. Описаны технологические схемы получения хитинсодержащих материалов из панцирей ракообразных [1], которые включают в себя конкретные технологические этапы реализации способа, в частности: дробление исходного продукта панцирей, сепарацию или фракционирование, депротеинизацию, обезвоживание, противоточную промывку, деминерализацию, фильтрацию, деацитилирование, промывку кислотой, сушк у, измельчение и, наконец, упаковку. Такой технологической схемой способа предусмотрено также осуществление процесса химической и физической регенерации протеина. При практической реализации этих способов большие технические трудности представляет получение хитинсодержащих растворов. Для решения этой задачи предложен ряд способов получения растворимых солей хитина, ксантогенирования алкилированного хитина, использования в качестве растворителя 1,2-хлоралкогопя в кислоте, ди- и трихлоруксусной кислоты, хлоральдегида и метиленхлорида с хлористым литием, смеси трихлоруксусной кислоты и различных галогенсодержащих углеводородов, а также путем ацилирования волокон из N-деацетилированного и этерифицированного хитина [1]. Вторым недостатком способов получения хитинсодержащих материалов из панцирей ракообразных является технологическая сложность удаления из исходного сырья сопутствующи х белково-углеводных компонентов, сопряженная с расходом большого количества кислот, щелочей и воды, что приводит к значительному удорожанию готового продукта. В целях устранения этих недостатков в качестве источников хитина предложено использовать биомассу плесневых грибов - зигомицетов и дейтеромицетов, содержание хитина в клеточных стенках которых достигает 20 65% [2 - 6]. Плесневые грибы в качестве источника хитина выгодно отличаются от ракообразных тем, что практически не содержат карбоната кальция, а поэтому при реализации способов в промышленных условиях требуется значительно меньше химических реагентов и воды [7]. Описаны способы получения хитинсодержащего материала из культур дейтеромицетальных грибов, который состоит из хитина и глюканов, путем обработки мицелия гидроокисью натрия или калия при высокой температуре. При этом удаляют белковые соединения, омыляют жиры последующей обработкой 30 - 50% натриевой или калиевой щелочью для перевода хитина в алкальхитин. Последний измельчают или переводят в мелкодисперсное состояние и обрабатывают сероводородом в течение 4 - 5 часов в закрытом сосуде. Полученный таким образом продукт помещают в раствор 7% щелочи, в результате чего получают раствор ксантогената хитина [5]. Особенности строения вегетативного мицелия мукоральных грибов характеризуются большим диаметром гиф (10 - 20мкм) при малой толщине стенки (0,1 - 0,2мкм) и отсутствием внутренних поперечных перегородок. При таком соотношении диаметра полого волокна мицелия и толщины его стенки, при отсутствии вн утри каналов поперечных перегородок, гифы не могут со хранять присущую им тр убчатую форму и при незначительном механическом воздействии коллапсируют. Повышенная хрупкость таких волокон, полученных из культур дейтеромицетом, обусловлена также химическими свойствами клеточных стенок, в частности, высоким содержанием глюкуроновой кислоты и полифосфатов. Исходя из этого, хи тинсодержащий материал дейтеромицетов обладает низкими показателями прочности и не может представлять интереса в качестве волокнистого материала для получения бумагоподобных изделий. Основным недостатком приведенных аналогов является также многоступенчатость процесса. В связи со сложностью таких технологических реакций и высокой стоимостью сырья и вспомогательных материалов-реагентов упомянутые технологии не нашли широкого применения. Наиболее близким по научно-технической сущности к заявляемому изобретению является способ получения хитинсодержащего волокнистого материала [8] из культур высши х базидиальных грибов (прототип). Задача изобретения-прототипа - повышение эластичности и выхода целевого продукта за счет того, что мицелиальную массу базидиальных грибов обрабатывают раствором щелочи, промывают водой и проводят последовательную обработку смешивающимися с водой органическими растворителями в порядке степени понижения их точек кипения с последующей сушкой целевого продукта. Для конкретной реализации способа, т.е. получения хи тинсодержащего материала используют плодовые тела высших базидиомицетов Inonotus dryophillus (Berk.) Mur., Fomes fomentarius (L.: Fr.), произрастающих на живых деревьях. При отделении волокнистой массы срезают верхний корковый слой плодового тела толщиной 3 - 5мм, удаляют трубчатый гименофор и ядро, расположенное вблизи точки прикрепления плодового тела к стволу дерева. Волокнистую массу, представляющую пучки гиф, разрывают вдоль волокон на небольшие фрагменты. Воздушносухую мицелиальную массу, подготовленную таким образом, заливают горячей водой. После достаточного увлажнения с помощью мешалки при 3,0×103об/мин производят ее гомогенизацию. Полученную суспензию фильтруют через капроновый фильтр, отфильтрованный материал заливают 3% раствором NaOH. Обработку ведут при 60°C и интенсивном перемешивании. Затем раствор щелочи отфильтровывают вакуумным насосом. Далее, волокнистую суспензию заливают водой, перемешивают и нейтрализуют остаток щелочи соляной кислотой, после чего волокнистую массу трижды промывают дистиллированной водой при интенсивном перемешивании. После фильтрации и физического отжатия суспендированный хитинсодержащий материал запивают этиловым спиртом на непродолжительное время. Спирт отфильтровывают, а волокнистую массу заливают на несколько минут ацетоном. После отделения ацетона, последний заливают этиловым эфиром и оставляют также на несколько минут. Эфир удаляют под вакуумом, остаток подвергают сушке. Полученный таким образом продукт представляет собой хитин-глюкан-меланиновый продукт, который состоит из волокон длиной 3 - 40мм и диаметром 1,5 - 4,0мкм. Высшие базидиальные грибы отличаются высоким содержанием хитина, отсутствием или наличием незначительного количества глюкуроновой кислоты и зольных элементов в клеточной стенке гиф. Химический комплекс хитина в соединении с другими биополимерами придает такому материалу уникальные сорбционные свойства, а меланины способствуют повышению его химической и радиационной стойкости. Кроме того, культуральный мицелий высших базидиомицетов, в частности, Panus tigrinus (Fr.) Sing, имеет прочные поперечные перегородки внутри просвета гифы, что обеспечивает сохранение трубчатой формы волокна. Малый диаметр волокон и особенности химического состава их клеточных стенок позволяют получать эластичные и прочные волокна. Однако указанный способ использования высших базидиальных грибов по прототипу не позволяет максимально использовать потенциальные биологические особенности культур высши х базидиальных грибов. Организация производства хитинсодержащих волокнистых материалов в этом случае не дает возможности создать крупномасштабное безотходное производство. Сбор природных плодовых тел грибов в течение вегетативного цикла развития базидиомицетов приводит к получению различной по физико-химическому составу исходной формы биомассы, что нарушает ведение нормального технологического процесса, который в этом случае сопряжен с корректировкой регламента, приводящей к постоянному изменению технологического процесса. При таком непостоянном качестве исходных материалов приходится вести процесс наугад, что приводит к высокому расходу реагентов и неизбежным потерям хитинсодержащего материала. Такое производство предопределяет его сезонность, что также приводит к большим издержкам содержания основных производственных фондов. Далее, использование высших базидиальных грибов в культуре, как это предлагается по технологической схеме прототипа, не предполагает использование физиологически активных соединений, содержащихся в культуральной жидкости, а также связано с громадными вторичными водными сбросами, величина которых составляет 950 - 990%. При указанной технологии в процессе культивирования и последующего использования волокнистого хитинсодержащего материала фильтраты культуральной жидкости становятся бросовыми отходами, тогда как их потребительская стоимость чрезвычайно высокая, поскольку в ней содержатся высокоактивные гидролитические, протеолитические и окислительные ферменты системы, стоимость концентратов или гомогенатов которых значительно превосходит коммерческую стоимость хитина. В основу изобретения поставлена задача расширить технологические возможности, повысить экологическую чистоту биотехнологического процесса и получить наряду с хитинсодержащим материалом ферментного концентрата и белково-витаминную кормовую добавку. В глубинной культуре высшего базидиального гриба отделяют мицелиальную массу, культуральную жидкость подвергают мембранной фильтрации с отводом ферментного концентрата, а фильтрат мембранного разделения смешивают с растительным субстратом, стерилизуют, о хлаждают, засевают мицелием глубинной культуры и осуществляют процесс твердофазной ферментации для получения белково-витаминного продукта кормового назначения. Реализация предложенного способа осуществляется следующим образом и характеризуется такими примерами. Пример 1. Получение хитинсодержащего волокнистого материала. Исходный штамм культуры высшего базидиального гриба Fomes fomen. tarius (Fr.) Gill., ИБК-355 (8) пересевают на агаризованную питательную среду в пробирки (см. фиг.) (1), культивируют при оптимальной температуре 27 28°C продолжительностью 10 - 15 суток. Маточной культурой с косяков засевают жидкую питательную среду (табл.1) в колбах емкостью 0,75л из расчета 1 - 5% посевного материала и выращивают на качалке в течение 6 - 7 суток с частотой качания 100об/мин. Приготовленную таким способом маточную культур у пересевают в лабораторные ферментеры 3 на заранее приготовленную стерильную питательную среду. Отсюда, на стадии физиологической зрелости в конце логарифмической фазы роста биомассы, посевную культур у переливают в малые ферментеры 4 на заранее приготовленную стерильную питательную среду. Процесс приготовления питательных сред осуществляется в реакторах питательной среды 5 с последующей стерилизацией при 125 - 130°C в автоклавах 6 и перекачиванием насосами 8 в ферментеры различного технологического назначения 3, 4, 7. Питательная среда характеризуется показателями, приведенными в табл.1. После 4 - 5 суток культивирования готовую культур у, которая характеризуется физико-химическими показателями, приведенными в табл.2, направляют на линию получения хитинсодержащего волокнистого материала на фильтрационную центрифугу 9. Для разделения биомассы и культуральной жидкости используют центрифуги с непрерывным удалением биомассы с одним или несколькими шнеками, вращающимися в том же направлении, что и барабан, с несколько меньшей скоростью, что позволяет снизить величину максимальной центробежной силы. Примененные для этих целей центрифуги разделяют суспензию культуральной жидкости с содержанием твердой фазы 8 - 15% с большим интервалом значений дисперсности, способны выдавать менее влажный осадок, поскольку он удаляется из ротора после осаждения биомассы и выделения его из жидкости. При прохождении биомассы через зону обезвоживания сюда подают воду по специальным соплам для ее промывки. При такой технологии фильтрации промывка создает положительный эффект в широком диапазоне размеров волокон мицелиальной биомассы-5 - 10мкм. Мицелиальную массу из центрифуги 9 после промывки горячей водой направляют в реактор 10, а фугат культуральной жидкости через изотермический сборник 11 на мембранную фильтрацию. Мицелиальная масса в реакторе подвергается щелочной обработке 1% раствором едкого натра из сборника 12 при 60°C и интенсивном перемешивании. После разделения - декантации в реакторе волокнистого материала и щелочи, последнюю направляют в сборник щелочи 13, а волокнистый материал далее нейтрализуют 1% соляной кислотой из сборника 14. Затем нейтрализованный продукт промывают дистиллированной водой и после промывки направляют на центрифугу 15. После удаления воды методом центрифугирования хитинсодержащий материал смачивают этиловым спиртом из сборника 16, выдерживают в таком состоянии 20 - 30 минут, после чего остатки этилового спирта удаляют также методом центрифугирования и направляют в сборник 17. Из технологического этапа промывки и обработки этиловым спиртом хитинсодержащий материал направляют в центрифугу ацетоновой обработки 18. Далее, волокнистую массу заливают для смачивания на такое же время ацетоном из сборника 19. После удаления ацетона центрифугированием остатки ацетона направляют в сборник 20, а сгущенный остаток направляют на центрифугу 21 следующего те хнологического этапа обработки этиловым эфиром из сборника 22, где осуществляют такую же обработку, как и на предыдущем этапе. Остатки этилового эфира направляют в сборник 23. Далее хитинсодержащий волокнистый материал направляют в сборник готового продукта 24, а отсюда на вакуумную сушку 25. Готовый и полученный по предлагаемому способу хи тинсодержащий волокнистый материал характеризуется показателями, приведенными в табл.3. Пример 2. Получение концентрата ферментных препаратов. Способ предусматривает концентрацию и выделение ферментных препаратов с помощью мембран, заключающийся в возможности осуществления процесса безфазового перехода или межфазового перехода, поскольку выделенный и концентрируемый ферментный препарат постоянно находится в водном окружении. Для этих целей используют полиамидные или синтетические мембраны на нетканевой подложке с удельной производительностью по дистиллированной воде при температуре 10 ± 3°C и давлением 0,15 - 0,20МПа - 1,0 1,5м 3/м 2час, с белковой селективностью. Определяющим условием технологического процесса мембранной технологии получения концентрированных ферментных препаратов по предложенному способу является первостепенная очистка культуральной жидкости от дисперсных частиц питательной среды. Такой технологический прием решается путем центрифугирования исходной культуральной жидкости от дисперсных частиц питательной среды на центрифуга х с высокой разделяющей способностью, позволяющей получать прозрачные растворы, не содержащие мицелиальные массы и балластных веществ питательной среды. Этот те хнологический этап осуществляют в следующей последовательности. Первичный фильтрат культуральной жидкости после отделения мицелиальной массы на разделительной центрифуге 9 из изотермического сборника 11 под гидравлическим давлением или инертного газа направляют в собственно аппарат мембранной фильтрации 26. После мембранного фильтра надосадочный раствор концентрированного препарата направляется в приемник концентрата 27, а фильтрат в приемник фильтрата 28 и, далее, через приемник 29 на смеситель 30, где осуществляют смачивание растительного стерильного субстрата фильтратом мембранного разделений для последующего осуществления процесса твердофазной ферментации и получения белково-витаминного продукта кормового назначения в камерах твердофазной ферментации 31. Продукты мембранной фильтрации характеризуются показателями приведенными в табл.4. Пример 3. Получение белково-витаминного продукта кормового назначения методом твердофазной ферментации. Сыпучие или гранулированные вторичные углеводные субстраты: подсолнечная лузга, виноградные выжимки, солома, жом или другие полиозы ковшевым элеватором направляют в бункер-запасник, предназначенный для хранения 3 - 5 дневного запаса, откуда подаются на автовесы и, наконец, в смеситель субстрата твердофазной ферментации 30. Смеситель перед загрузкой тщательно промывают и проверяют на исправность всей имеющейся на нем арматуры, после чего в его загрузочные люки подают необходимое количество субстрата влажностью 12 14%. Загруженный в смеситель субстрат смачивают фильтратом культуральной жидкости мембранного разделения из сборника 29 до влажности 60 - 75%, через форсунки, имеющиеся внутри стерилизатора. Фильтрат культуральной жидкости подается в смеситель самотеком при непрерывной работе мешалки, а после подачи фильтрата культуральной жидкости мешалка должна работать еще 10 - 12 минут. Для более надежной стерилизации в смесителе субстрата в фильтрат культуральной жидкости добавляют 0,1 - 0,3% формалина по весу субстрата. Прогрев до 100°C производят при неплотно закрытой задвижке, при непрерывной работе мешалки и постоянном наблюдении за температурой. При достижении по всей массе субстрата температуры 100°C закрывают плотно вытяжную задвижку и постепенно поднимают давление до 1,7атм (115°C). При указанном давлении субстрат стерилизуют в течение 1 часа при периодическом перемешивании а течение 1 - 2 минут через каждые 12 - 15 минут. После чего среду охлаждают до 27 - 30°C водой, пропускаемой через "водяную р убашку". После охлаждения простерилизованного субстрата его тщательно перемешивают с посевным материалом в виде глубинной культуры из ферментера 7. Необходимость постадийного приготовления посевного материала (1 - 4,7) вызвана тем, что расход его при засеве субстрата для твердофазной ферментации составляет значительную величину. Таким образом, число стадий определяется только объемом производства и нормой расхода посевного материала для данного продуцента и целей последующего использования культуральной жидкости. Расход посевного материала зависит от физиологических активностей продуцента и составляет 5 - 10% от массы субстрата. Засеянный питательный субстрат направляют в растительную камеру 31, где осуществляется ферментация при непрерывной продувке воздуха, с влажностью до 90 - 95%, продуваемым вентилятором через камеру кондиционирования и калорифер. Камера твердофазной ферментации представляет собой бетонный туннель с сетчатым днищем, на которое укладывается субстрат, засеянный посевным мицелием слоем толщиной 0,6 - 0,8см. Под ситом на глубине 0,5 0,7м находится основное дно туннеля. Пространство между ситом и дном является воздухораспределительным каналом, куда нагнетается воздух. Нижнее подситовое пространство разделено бетонными стенками соответственно верхним отделениям. Регулируемая шибером струя воздуха из общего воздухораспределительного канала передается в каждое отделение сита снизу. Регулирование температуры подаваемого воздуха осуществляют непосредственной эжекцией в воздуховод водяного пара, что позволяет одновременно поддерживать его высокую влажность на уровне 96 - 98% во избежание пересыхания субстрата. После полной загрузки камеры засеянным субстратом ее закрывают и осуществляют процесс твердофазной ферментации течение 7 - 10 суток. В течение этого времени постоянно контролируют температур у в толще субстрата, не допуская его разогрева выше 30°C. Оптимальные условия для развития мицелия гриба - 25 - 27°C регулируют температурой подаваемого воздуха , при этом учитывается, что максимальный разогрев массы субстрата дереворазрушающими базидиомицетами наблюдается в первые трое суток колонизации субстрата, в последующем процесс тепловыделения стабилизируется на постоянном уровне. После окончания процесса роста гриба продукт твердофазной ферментации передают на ленточный транспортер и, далее, на сушку барабанного типа, где осуществляют подсушивание горячим воздухом до 10 - 12% влажности. Готовый продукт твердофазной ферментации характеризуется показателями, приведенными в табл.5. Таким образом, приведенные примеры экспериментальной проверки предлагаемого изобретения подтвержают выполнение поставленной задачи. Предлагаемый способ получения соматических хитинсодержащих структур высших базидиальных грибов является безотходной, экологически чистой технологией, позволяющей высокоэффективно использовать вторичные ресурсы. Анализ сравнительных показателей готовых продуктов способа получения соматических хи тинсодержащих структур высши х базидиальных грибов позволяет утверждать, что предложенный способ существенно отличается от известных ранее технологических приемов получения соматических хитинсодержащих стр уктур высши х базидиальных грибов и соответствует критерию "новизна". При изучении других известных решений в данной области биотехнологии признаки, отличающие заявляемое изобретение от прототипа, не были выявлены и поэтому они обеспечивают заявляемому биотехнологическому решению соответствие критерию "существенные отличия".
ДивитисяДодаткова інформація
Автори англійськоюDanyliak Mykola Illich, Yanchevskyi Viktor Kazymyrovych
Автори російськоюДаниляк Николай Ильич, Янчевский Виктор Казимирович
МПК / Мітки
МПК: C08B 37/08, C08L 5/00
Мітки: вищих, матеріалу, соматичного, хітинвмісного, одержання, грибів, базидіальних, спосіб
Код посилання
<a href="https://ua.patents.su/8-25350-sposib-oderzhannya-somatichnogo-khitinvmisnogo-materialu-vishhikh-bazidialnikh-gribiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання соматичного хітинвмісного матеріалу вищих базидіальних грибів</a>
Попередній патент: Спосіб лікування гострого деструктивного панкреатиту
Наступний патент: Каталізатор одержання метил-трет-бутилового ефіру
Випадковий патент: Спосіб визначення межі здорового бронху у хворих туберкульозом легень