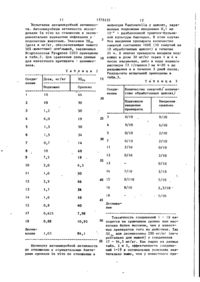
Спосіб одержання макролідних сполучень
Формула / Реферат
Формула изобретения
Способ получения макролидных соединений общей формулы
ACH2CH2R,
где А -
R - октагидроазоцин-1-ил, 4-фенил-пиперидин-1-ил, гексагидроазепин-1-ил, 1-азаспиро(4,5)дец-1-ил, 1,2,3,4-тетрагидрохинолин-1-ил, 1,2,3,4-тетрагидроизохинолин-2-ил, 1,2,3,6-тетрагидропиридин-1-ил, пирролидин-1-ил, азациклотридецин-1-ил, 3-азабицикло(3,2,2)-нон-3-ил, 1,3,3-триметил-6-азабицикло [3,2,1]окт-6-ил; цис- и транс-3,5-диметилпиперидин-1-ил;
R1 – водород, гидроксил или микарозилокси
R2 -
отличающийся тем, что осуществляют восстановление альдегида формулы
АСН2СН = О,
где А имеет указанные значения, боргидридом натрия или цианборгидридом натрия в присутствии амина общей формулы
RH,
где R имеет указанные значения, в среде С1-С4 - алканоила при комнатной температуре.
Текст
Изобретение касается замещенных лактонов, в частности получения соединений общей формулы A-CH 2 CH 2 R ( где R - октагидроазоцин-1-ил; 4-фенилпиперидин-1-ил; гексагидроаэепин-1-ил\ 1-азаспнро(4,5)дец~]-ил;1 1,2,3,4-тетрагидрокинолин-1-ил; 1,2,3,4~тетра~ гидроизохинолин-2-ил; I,2,3,4-тетрагидропиридин-1-ил; пирролидин-1-ил; азациклотридецин-1-ил; 3-азабицикло > (2,3,2)нон-3-ил; 1,3,З-триметил-6аэабицикло Г3,2,1]окт-6-ил*г цис- и транс-3,5-диметщіпиперидин-1-ил; 0 P . - H, ОН или формулы микроэилоксигруппа -О; ° j~ группа формулы о или 'нонч)-окоторые обладают антимикробной активностью , Цель изобретения - создание более активных веществ указанного класса. Их синтез ведут восстановлением альдегида АСН ? СН ~ О боргидридом или цианборгидрндом натрия в присутствии амина RH (в которых А и R указаны выше) в среде С 1 - 4 - алканола при комнатной температуре. Новые макролидные вещества в сравнении с десмикоэином имеют токсичность в 2 раза выше (200 и 94,5 мг/кг) , но это компенсируется лучшей антимикробной активностью в отношении Stuphococcos pyogihes и Pasteurella у цмплят; эффективная доза до 6,3 мг/кг (орально) против 84,1 мг/кг для десмикозина. 3 табл. СО со ел СП t 1375135 Изобретение относится к способу получения макролидных соединений общей формулы ACHfCHR, где А 10 R-rCH 15 R^- октагидроазоцин-1-ил, 4-фенилпиперидин-І-ил, гексагидроазепин-1-ил, 1-аэаспиро (4,5)дец-1-ил, I,2,3,4-тетрагидрохинолин-!-ил, 1,2,3,4-тетра20 гидроизохинолин-2-ил, I,2,3f6-тетра гидропиридин-1-ил, пирролидин-1-ил, азациклотридецин-1-ил, 3-аэабицикло(3,2|2)-нон-3-ил, 1,3,3-триметил-баэабицикло(3,2,1)окт-6-ил, цис,- и 25 транс-3,5-диметилпиперидин-1-ил, R, - водород, гидроксил или микароэилокси ОН OH н о Ч У о - или н о - ( У о сн3о осн3 но ОСН-І 30 35 обладающих антимикробной активностью. Целью изобретения является разработка способа получения новых макролидных соединений с повышенной антимикробной активностью. П р и м е р 1. 20-ДН-ДО-20-(Гексагидроазепин-1-ил)десмикозин 2045 ДН-ДО-20 - здесь и далее обозначает 20 - дигидро-20-деэокси-; десмнкозинАСИхСНО, где R, - микарозилокси R t - b, Десмикозин (10 г, 13 ммоль), растворенный в безводном метаноле 100 мл 50 быстро добавляют к раствору цианбор-ї гидрида натрия (3,3 г, 52 ммоль) и гексаметиленимина (6,5 г, 7,5 мл, 65 ммоль) в безводном метаноле (50 мл] в атмосфере азота» Реакционную смесь 55 перемешивают в атмосфере азота при комнатной температуре в течение приблизительно 3 ч, а затем выпаривают при пониженном давлении. Полученный остаток растворяют в метиленхлориде ровно с таким количеством этилацетата, чтобы растворить остаток и этот раствор экстрагируют насыщенным раствором бикарбоната натрия. Органический слой отделяют, сушат над сульфатом натрия, выпаривают при пониженном давлении и получают светло-желтую пену. Эту пену очищают методом хроматографии на силикагеле, элюнруют сначала метиленхлоридом (1 л ) , затем ступенчато 500-мл порциями смеси метиленхлорид/метанол в соотношениях: 98:2; 96:4; 94: 6; 92: 8 и 9: 1 ив завершение, смесями метиленхлорид (метанол) гидроксид аммония в соотношениях: 90:10:0,5(500 мл) и 75: :25:0,5 М (2 л ) . Фракции, содержащие требуемый продукт, идентифицируют методом TGX, соединяют и выпаривают досуха. Получают 6,035 г (7,07 ммоль) 2О-ДН-ДО-20 (гексагидроазепин-1-ил) десмикозина в виде белой пены. Другие фракции, которые содержат нечистый продукт соединяют, повторно растворяют в метиленхлориде, снова экстрагируют насыщенным раствором бикарбоната натрия и очищают, как ранее с применением силикагельной колонки с насадкой метиленхлорид/метанол (9:1) и элюированием метиленхлорид/метанол/ гидроксид аммония в следующих соотношениях: 90:10:0,5 (500 мл) и 80:20; :0,5 (1 л ) . Получают дополнительно 1,372 г (1,61 ммоль) продукта. Общий выход 20-ДН-ДО-20 - (гексагидроазепин-1-ил) десмикозина 7,407 г (8,68 ммоль, 67%). П р и м е р 2. 20-ДН-ДО-4-(4-Фенилпиперидин-1-ил) десмикозин. Десмикозин (1,5 г, 2 ммоль) растворяют в абсолютном метаноле /60 мл^ и обрабатывают 4-фенилпиперидином (640 мг, 4 ммоль) в присутствии молярного сита Linde 4A. Через 30 мин добавляют NaBHjCN (500 мл, 8 ммоль) и смесь перемешивают в течение 2,5 ч при комнатной температуре. Смесь выливают в насыщенный раствор бикарбоната натрия (200 мл) и эктрагируют метиленхлоридом (3x200 мл). Соединенные экстракты сушат над сульфатом натрия, фильтруют и выпаривают при пониженном давлении. Остаток (3,6 г) очищают методом экслреесхроматографии на силикагеле, элюируя градиентом от 1 л метиленхлорида до 1 л ме З 13751 35 танола/метиленхлорид (5:95), затем 1 л метанол/метиленхлорид (5:95). Фракции, содержащие требуемый про-, дукт, идентифицируют при помощи ТСХ, _ соединяют и выпаривают досуха, получают 680 мг 20-ДН-ДО-20- 4-фенилпиперидин-1-ил десмикозина. П р и м е р 3. 20-ДН-ДО-20-(Гексагидроазепин -1~ил)~4 -дезоксидесми- jg КОЗИН. Раствор 4-дезоксидесмикозина (565 мг, 0,75 ммоль) в метаноле (15 мл) в атмосфере аргона'перемешивают с активированным молекулярным J5 ситом Linde ЗА 2,2 г в течение 30 мин, затем добавляют гексаметиленимин (0,25 мл, 2,25 ммоль). Через 1 ч к реакционной смеси добавляют : цианборгидрид натрия (141 мг, ^о 2,25 ммоль). Через 45 мин реакционную смесь выливают в насыщенный раствор бикарбоната натрия и экстрагируют этилацетатом. Соединенные органичес-г кие экстракты встряхивают с насыщен- 25 ным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют, выпаривают и получают 600 мл сырого продукта. Этот продукт очищают методом препаративной тонкослойной хро— эл матографии на силикагеле, элюнруют смесью дихлорметан (метанол) концент" рированный гидроксид аммония (90:15:. :2) и получают 150 мл (выход 24% I 20-ДН-ДО-20 - (гексагидроазепнн-135 ил)-4, -дезоксидесмикозина. П р и м е р 4. 20-ДН-ДО-20 - (Октагидроазоцин-1-ил)десмикозин. Десмикозин (4,0 г, 5,2 ммоль) растворяют в абсолютном метаноле ,Q (30 мл) и обрабатывают гептаметиленимином (1,2 г, 1,3 мл, 10,4 ммоль) в присутствии молекулярного сита ЗА. После окончания реакции смесь перемешивают в течение 1 ч при комнатной ,< температуре, затем быстро пипеткой приливают раствор боргидрида натрия (60 мг, 1,6 ммоль) в абсолютном метаноле (10 м л ) . Реакционную смесь перемешивают в течение 1,5 ч при ком50 натной температуре, затем добавляют еще 30 мг боргидрида натрия (одну порцию в виде твердого вещества). Реакционную смесь перемешивают еще в течение 75 мин и затем фильтруют. 55 Фильтрат выпаривают при пониженном давлении. Остаток растворяют в этилацетате (150 мл) и этот раствор экстрагируют водой (150 мл) и насыщен 4 • ным раствором бикарбоната натрия (100 мл). Потом этилацетатный раст-* вор экстрагируют 0,5 М буферным раствором (І50 мл) NaH a PO 4 с рН 6,5. Буферный экстракт выпаривают в вакууме для удаления оставшегося этилацетата и затем быстро перемешивают при медленном добавлении 5 н.едкого натра, получают густой белый осадок, Белое твердое вещество удаляют фильтрованием, сушат и получают 3,55 г 20-ДН-ДО-20 - (октагидроазопин-1-ил) десмикозина. П р и м е р 5. 20-ДН-ДО-2О - (1Азаспиро)4,5-(декан-1-ил)десмикозин, Десмикозин (5,0 г, 6,5 ммоль) растворяют в абсолютном метаноле \50мл) и обрабатывают 1-азаспиро(4,5)дека-, ном 31,36 г, 9,8 ммоль в присутствии молекулярного сита ЗА, Через 15 мин добавляют NaBH n CN (620 мл.9,8ммоль) и смесь перемешивают в течение 17 ч при комнатной температуре. Реакционную смесь фильтруют и фильтрат выпаривают при пониженном давлении. Остаток растворяют в этилацетате (300 мл) и экстрагируют водой (300 мл и 100 м л ) . Затем продукт экстрагируют из этилацетагного раствора с буфером 0,5 М NaH 2 PO 4 с рН 6,5 (300 и 100 мл). Фосфатные буферные экстракты соединяют и выпаривают в вакууме для удаления оставшегося этилацетата. Затем фосфатный буферный раствор быстро перемешивают при медленном добавлении 5 н. едкого натра и получают густой белый осадок. Белое твердое вещество отделяют фильтрованием, промывают водой, сушат и получают 2О-ДН-ДО-20 - (1-аэаспиро) 4,5-(декан-Ї-ил)десмикозин (3,52 г ) . П р и м е р 6. 20-ДН-ДО-20-(1,2, 3,4-Тетрагидрохинолин-1-ил)десмикозин. Десмикозин (11,6 г, 15 ммоль) растворяют в сухом метаноле (100 мл) и добавляют 1,2,3,4-тетрагидрохинолин (3,8 мл, 30 ммоль). Смесь перемешивают при комнатной температуре в течение 30 мин, а затем добавляют цианборгидрид натрия (1,25 г, 20 ммоль). Смесь перемешивают в течение ночи, после чего выпаривают при пониженном давлении. Остаток распределяют между этилацетатом и водой (по 100 мл каждого). Органический слой экстрагируют последовательно вод«ым фосфатным буфером с рН 6,5 (100 мл) и водным фос 5 13751 35 6 гидроксида натрия» Выпавший осадок собирают, сушат на воздухе и получают 5,6 г указанного в заглавии соединения. П р и м е р 8. 20-ДН-ДО-20 - (I, 2,3,6 - Тетрагидропиридин-1-ил)десмикозин. — Десмикозин (11,6 г, 15 ммоль) растворяют в безводном метаноле (!00 мл) и добавляют 1,2,3,6 - тетрагидропиридин (2,8 мл, 30 ммоль). После перемешивания в смеси в течение 30 мин при комнатной температуре добавляют цианборгидрид натрия (1,25 f, 20 ммоль). Смесь перемешивают в течение ночи, затем выпаривают при пониженном давлении. Остаток растворяют в этилзцетате (150 мл). Этот раствор экстрагируют водой (150 м л ) , потом водным фосфатным буфером с рН 6,5 (2x100 мл). Буферные растворы выпаривают отдельно при пониженном давлении для удаления этилацетата, затем доводят рН до 10 путем добавления 5 н.гидроксида натрия. Образовавшиеся осадки собирают фильтрованием, сушат на воздухе и получают 5,4 г (первый экстракт) и 3,2 г (второй экстракт) указанного в заглавии соединения . Другие соединенияполучены аналогичным образом. Значения заместителей R - R 2 и физико-химические свойства полученных соединений представлены . в табл,I, фатным буфером с рН 4,5 (100 м л ) . Этилацетатный слой сушат над сульфатом натрия, фильтруют и выпаривают, остаток (А,6 г) отделяют методом хроматографии на силикагеле. Колонку элюируют при линейном градиенте дихлорметана (4 л) и 5% метанола плюс 0,5% концентрированного гидроксида аммония в дихлорметзне (4 л)» Фракции, содер~ю жащие требуемый продукт, идентифицируют методом ТСХ, собирают, выпаривают досуха и получают 3,4 г указанного в заглавии соединения. П р и м е р 7. 2О-ДН-ДО-20 - (1, 1 5 2,3,4 - Тетрагидроиэохинолин-2-ил) десмикозин. Десмикозин (11,6 г, 15 ммоль) растворяют в сухом метаноле (100 мл) и добавляют 1,2,3,4 - тетрагидроизохи- 20 нолин (3,8 мл, 30 ммоль). После перемешивания смеси в течение 30 мин при комнатной температуре добавляют цианоборгидрид натрия (1,25 г, 20ммоль). Смесь перемешивают в течение ночи, а 25 затем выпаривают при пониженном давлении. Остаток распределяют между этилацетатом и водой (по 150 мл каждого). Потом органический слой экстрагируют последовательно фосфатным зо буфером с рН 6,5 (100 мл) и фосфатным буфером с рН 4,5 (100 м л ) . Экстракт фосфатного буфера с рН 4,5 выпаривают при пониженном давлении для удаления этилацетата, после чего рН доводят до 10 путем добавления 5 н. Т а б л и ц а Соединения Заместители Массспектр (исходный ион) R УФ-спектр Титруемые группы I II 7,9 £ нм 9,5 1 Октагидроазоцин-ї-ил Микароэилокси а 1013 282 22000 2 3-Аэадицикло
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61P 31/04, A61K 31/7042, C07H 17/08, A61K 31/70, A23K 1/17, A61K 31/7048
Мітки: одержання, сполучень, макролідних, спосіб
Код посилання
<a href="https://ua.patents.su/8-6045-sposib-oderzhannya-makrolidnikh-spoluchen.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання макролідних сполучень</a>
Попередній патент: Спосіб одержання похідних хлорамбуціла /його варіанти/
Наступний патент: Затримуючий пристрій гірської машини
Випадковий патент: Вітроколесо з регулятором