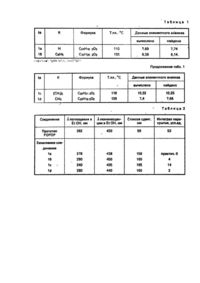
Похідні 1,2-біс-(5-фенілоксазоліл-2)бензолу, як органічний люмінофор синього свічення
Формула / Реферат
Производные 1, 2 - бис - 5 - фенилоксазолил - 2 бензола общей формулы:
где R=Н, С6Н5, N(СН3)2, СН3 в качестве органического люминофора синего свечения.
Текст
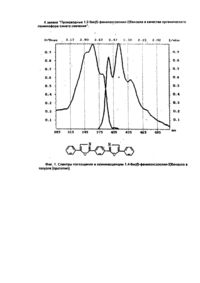
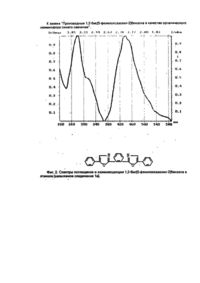
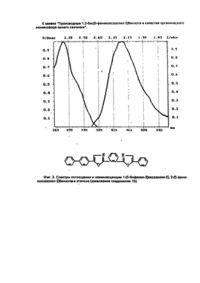
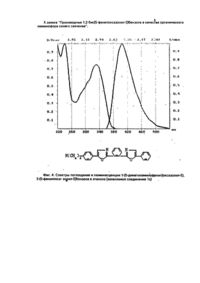
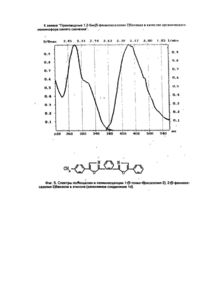
Изобретение относится к новым химическим соединениям, конкретно к производным 1,2-бис/5фенолоксазолил-2-/бензола формулы 1 1,2-Бис/5-фенилоксазолил-2/бензол проявляет свойства органического люминофора синего свечения с аномально большим стоксовым сдвигом, у которого спектр люминесценции практически не перекрывается со спектром поглощения. Поэтому в его спектрах практически отсутствует реабсорбция, снижающая прозрачность полученных из него полимерных материалов к собственному излучению. Наличие указанных свойств позволяет эффективно использовать соединения формулы I в сцинтилляционных системах, имеющих большую протяженность Среди люминофоров наиболее близким по полосе испускания света к заявляемому соединению является 1,3,5-трифенил-2-пиразолин (II) / l max поглощения 390 нм, l max люминесценции 450 нм/ [1]. Это соединение широко используется в качестве оптического отбеливателя, активирующей добавки в жидких и пластмассовых сцинтилляторах, 1,2,3-трифенил-2-пиразолин является одним из лучших активаторов для жидких сцинтилляторов. Сцинтилляторы на его основе обладают высокой сцинтилляционной эффективностью и устойчивостью к излучению. Кроме того, он относительно доступен и дешев в производстве. Недостатком 1,2,3-трифенил-2-пиразолина является его небольшой стоксов сдвиг (60 нм) и значительное перекрывание спектров поглощения и испускания, что приводит к снижению прозрачности в сцинтилляторах большой протяженности ограничивает его применение. Наиболее близким по структуре к заявляемым химическим соединениям является 1,4-бис/5фенилоксазолил-2/бензол /III/, известный под торговым названием /РОРОР/, выпускаемый промышленностью и широко применяемый как добавка в пластмассовых сцинтилляторах. РОРОР является эффективным люминофором синего свечения /l max поглощения 362 нм, lmax люминесценции 420 нм, стоксов сдвиг 58 нм/. РОРОР получают конденсацией дихлорангидрида терефталевой кислоты с ω-аминоацетофеноном гидрохлоридом с последующей циклодегидратацией полученного соединения в серной кислоте [2]. РОРОР обладает теми же недостатками, что и 2,3-трифенил-2-пиразолин, это небольшой (58 нм) стоксов сдвиг и также значительное покрытие спектров люминесценции и поглощения, а так как доля теряемого флуоресцентным красителем света пропорциональна числу актов перепоглощения, то в его спектрах наблюдается реабсорбция, отрицательно сказывающаяся на прозрачности окрашенных им полимерных материалов к свету собственного излучения. Для эффективного использования люминофора в полимере его спектры люминесценции и поглощения должны быть достаточно разнесены (иметь большой стоксов сдвиг) и минимальный интеграл перекрытия. Это особенно важно при создании сцинтилляционных полимерных систем, где прозрачность материала к собственному излучению красителя играет основную роль. В основу изобретения поставлена задача получить новые химические соединения в ряду структурных аналогов общей формулы III, которые обладали бы большим стоксовым сдвигом и меньшим перекрытием спектров поглощения и люминесценции. Решение поставленной задачи достигается новой химической структурой, выраженной формулой Неожиданным для данной структуры является тот факт, что, например, в соединении 1(а) положение полосы флуоресценции практически совпадает с положением полосы флуоресценции РОРОР, а полоса поглощения соединения 1(а) в сравнении с РОРОР значительно смещена в коротковолновую область. Причем она является даже более коротковолновой, чем полоса поглощения 2,5-дифенил-оксазола /РРО/. Это связано с тем, что в невозбужденном состоянии молекула соединения 1 испытывает значительные стерические затруднения. В результате взаимного отталкивания фенилоксазольных фрагментов плоское строение нарушается, что приводит к потере сопряжения между фрагментами молекулу. При возбуждении молекула упрощается и сопряжение восстанавливается. Таким образом, поглощают свет отдельные несопряженные фрагменты, n-электронная система которых значительно отличается от n-электронной системы РОРОР, этим объясняется большая разница в их спектрах поглощения. В то же время в возбужденном состоянии n-электронная система уплощенной молекулы соединения 1 аналогична n-электронной системе изначально плоской молекулы РОРОР, поэтому их полосы испускания практически совпадают. Введение заместителей в пара-положение концевого фенильного кольца вызывает общее изменение положения полос поглощения люминесценции и поглощения соединений 1/a-d/, но стоксов сдвиг при этом практически не меняется (около 160 нм). Соединения 1/a-d/ получают конденсацией хлорангидрида 2-/5-фенилоксазолил-2/ бензойной кислоты с соответствующим w -аминоацетофеноном гидрохлоридом и последующей циклодегидратацией полученного соединения в серной кислоте. В свою очередь, 2-/5-фенолоксазолил-2/бензойную кислоту синтезируют из фенациламида фталевой кислоты, полученного взаимодействием w -аминоацетофенона гидрохлорида с фталевым ангидридом, циклодегидратацией в серной кислоте. Изобретение поясняется следующим примером. Пример. Получение 1,2-бис/5-фенилоксазолил-2/бензола. В круглодонной колбе, емкостью 400 мл, снабженной обратным холодильником, кипятят 26,9 (0.1 м) г 2-/5фенилоксазолил-2/-бензойной кислоты в 300 мл хлористого тионила в течение 2 часов. Затем отгоняют избыток хлористого тионила (до объема 60-80 мл), добавляют 100 мл бензола, отгоняют азеотроп бензола и хлористого тионила. Добавление бензола и отгонку азеотропа повторяют еще дважды. Затем в колбу добавляют 100 мл бензола. Образующийся бензольный раствор хлорангидрида используют в следующей стадии синтеза. В круглодонной колбе емкостью 400 мл, снабженной механической мешалкой, растворяют в минимуме воды 17,1 г ω-аминоацетофенона гидрохлорида. Затем при комнатной температуре в интенсивном перемешивании в один прием добавляют весь бензольный раствор хлорангидрида и приливают небольшими порциями насыщенный раствор соды до рН = 8. После этого раствор при той же температуре выдерживают 2 часа. Выпавший осадок отфильтровывают, промывают водой и сушат. Затем в круглодонной колбе, емкостью 500 мл, высушенный продукт растворяют при интенсивном перемешивании и комнатной температуре в концентрированной серной кислоте. Перемешивают раствор в течение 2 часов при этой же температуре. Образовавшийся темно-коричневый раствор выливают на лед. Выпавший осадок отфильтровывают, промывают водой и сушат. Выход - 23,8 г /64%/. Очищают полученный 1,2-бис/5-фенилоксазолил-2/бензол на хроматографической колонке непрерывного действия/сорбент - силохром, элюент - гексан/. Т. пл. = 110°С. Остальные соединения получают аналогично. Температуры плавления и данные элементного анализа приведены в таблице 1. Строение полученных соединений подтверждено данными ИК-спектроскопии. На спектрограммах, записанных в твердой фазе (таблетки КВr), проявляется большое число полос, связанных с наличием оксазольного (770-780 и 1530-1600 см-1) и бензольного (600-650, 800-840, 1000-1030 и 1600-1620 см-1) циклов. Испытания производных 1,2-бис/5-фенилоксазолил-2/бензола в качестве органического люминофора: были измерены спектры поглощения и люминесценции, и определен стоксов сдвиг заявляемых химических соединений и для сравнения - прототипа (фиг. 1-5). Спектры поглощения измеряли на спектрофотометре "Specord M-40"; спектры люминесценции - на установке, состоящей из зеркального монохроматора ЗМР-3, приемника оптического излучения ФЭУ-18, микроамперметра М-95. Фотолюминесценция возбуждалась лампой СВДШ-500, из спектра которой кварцевым монохроматором ДМР-4 выделяли свет с длиной волны 313 нм. Величину стоксова сдвига определяли как разницу максимумов полос люминесценции и поглощения. Интеграл перекрытия вычисляли как площадь перекрытия спектров поглощения и люминесценции. Данные испытаний приведены в таблице 2. Как видно из таблицы, заявляемые химические соединения имеют существенные преимущества перед прототипом. Так, стоксов сдвиг его в эталоне примерно в 3 раза превышает стоксов сдвиг ранее известного соединения аналогичного строения (прототипа). Интеграл перекрытия его спектров поглощения и люминесценции значительно меньше (примерно в 5-10 раз) соединения аналогичного строения (прототипа). Указанные преимущества заявляемых соединений позволят их эффективно использовать в сцинтилляционной технике. Изготовление крупногабаритных блоков на их основе позволит значительно увеличить светопередачу, и тем самым увеличить их эффективность. Использование указанных соединений даст возможность значительно повысить качество выпускаемых люминесцентных материалов. · ι чф»'»» *. ^gitftr /и^,
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 1,2-bis-5-phenyloxazolyl-2 benzol as blue-emitting organic phosphor
Автори англійськоюShershukov Viktor Mykhailovych, Shylo Oleh Pavlovych
Назва патенту російськоюПроизводные 1,2-бис-( фенилоксазолил-2)бензола как органический люминофор синего свечения
Автори російськоюШершуков Виктор Михайлович, Шило Олег Павлович
МПК / Мітки
МПК: C07D 413/10, C07D 261/08, C09K 11/06
Мітки: свічення, похідні, люмінофор, синього, 1,2-біс-(5-фенілоксазоліл-2)бензолу, органічний
Код посилання
<a href="https://ua.patents.su/8-7639-pokhidni-12-bis-5-feniloksazolil-2benzolu-yak-organichnijj-lyuminofor-sinogo-svichennya.html" target="_blank" rel="follow" title="База патентів України">Похідні 1,2-біс-(5-фенілоксазоліл-2)бензолу, як органічний люмінофор синього свічення</a>
Попередній патент: Спосіб отримання похідних птерідіна
Наступний патент: Пристрій для видалення рідини з твердого кавалкового матеріалу
Випадковий патент: Спосіб очистки стічних вод