N-гідроксигомоазаадамантанон та його комплекс з діоксомолібденом
Номер патенту: 86566
Опубліковано: 10.01.2014
Автори: Ільницька Олена Людвигівна, Пехньо Василь Іванович, Коваль Людмила Іванівна, Дзюба Валерій Іванович
Формула / Реферат
1. Сполука формули І:
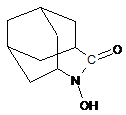 I
I
або її сольвати, комплексні сполуки, або солі.
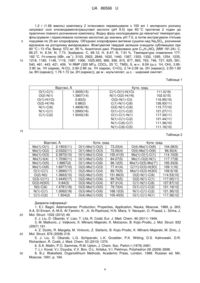
Текст
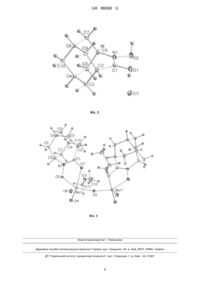
Реферат: 1. Сполука формули І: C O N OH I або її сольвати, комплексні сполуки, або солі. UA 86566 U (12) UA 86566 U UA 86566 U 5 10 15 20 25 30 35 40 45 50 55 Корисна модель належить до координаційної хімії. У корисній моделі, що заявляється, 3,8 описано сполуку N-гідроксигомоазаадамантанону (4-азатрицикло[4.3.1.1 ] ундекан-5-он-4-олу) (1) - проліганду нового типу - гетероциклічної, каркасної гідроксамової кислоти, а також її хелатного комплексу з діоксомолібденом (VI) - μ-оксо-біс[(N-оксигомоазаадамантанонато)діоксомолібден(VІ)-етанол (1/1)]у (2) як проміжної сполуки при синтезі Nгідроксигомоазаадамантанону (Фіг. 1). N-гідроксигомоазаадамантанон має специфічну будову, зокрема об'єднує в собі такі суттєві структурні особливості, як каркасність, гетероциклічність, жорстко фіксована цис-орієнтація кисневих атомів гідроксаматного фрагмента молекули, і тому може проявляти унікальні властивості на відміну від відомих гідроксамових кислот (біолігандів). Технічний результат полягає в можливості застосування цієї сполуки в біохімії та фармакології (потенційнопротивірусні препарати, біоциди). Інтерес до адамантанвмісних сполук пов'язаний з тим, що вони, як відомо з рівня техніки, проявляють високу противірусну та антибактеріальну активність і широко застосовуються в хіміотерапії [1]. Введення адамантильного фрагмента в сполуки, що є діючими речовинами медикаментів різноманітного призначення, істотно підвищує терапевтичний індекс похідних сполук у порівнянні з вихідними [2]. У переважній більшості згаданих структур аліцикл зв'язується в молекулі через вузлове положення вуглеводневого каркаса, як це показано в роботі [3]. Набагато рідше зустрічаються структури, де адамантильний фрагмент пов'язаний в молекулі через місткове положення трициклічного каркаса [4]. Поліпшення лікарських властивостей відомих сполук - основна мотивація синтезу адамантанвмісних сполук, наприклад, модифікація адамантаном біолігандів, таких як гідроксамові кислоти [5]. У зазначеному контексті, сполуки з вбудованою в жорсткий трициклічний скелет гідроксаматною групою могли б представляти особливий інтерес для досліджень. Найближчим аналогом заявленої сполуки є N-гідрокси-ε-капролактам, який одержували виходячи з капролактаму способом, що описаний в роботі [6]. Суть способу полягає в окисненні триметилсилільованих вторинних амідів до гідроксаматних комплексів MoO2 (VI) з подальшим виділенням N-гідрокси похідних. Використання апротонних окиснювачів на основі перекисів Мо (V) дозволяє синтезувати з помірним виходом аліциклічні гідроксамові кислоти, зокрема Nгідрокси-ε-капролактам. Проміжний силіламід не виділяють при використанні як силілюючого реагенту 1,1,1,3,3,3-гексаметилдисилазану, надлишок якого відганяють. Недоліком найближчого аналога є відсутність трициклічної каркасної будови, сполуки з якою мають потенційну противірусну активність. Дана корисна модель направлена на синтез гідроксамової кислоти нового типу - Nгідроксигомоазаадамантанону, який, за рахунок специфічної будови, може проявляти біологічну активність і представляти інтерес для біохімії та фармакології. Суть корисної моделі: одержання і дослідження N-гідроксигомоазаадамантанону, згідно з корисною моделлю, об'єднує в собі такі суттєві структурні особливості, як каркасність, гетероциклічність, жорстко фіксована цис-орієнтація кисневих атомів гідроксаматного фрагмента молекули. N-гідроксигомоазаадамантанон (І) синтезували, виходячи з гомоазаадамантанону методом, що описаний вище для N-гідрокси-ε-капролактаму [6]. Несподівано було знайдено, що реакція окиснення триметилсилільованого гомоазаадамантанону (N, N-диметилформамідо)-оксодипероксомолібденом(VІ) відрізняється від подібної реакції окиснення капролактаму тим, що утворюється не моноядерний, а біядерний комплекс 2, ймовірно внаслідок стеричного фактора. Продукт реакції окиснення очищали дворазовою перекристалізацією з етанолу з виділенням придатних для РСА кристалів проміжного комплексу 2 (фіг. 1). Триметилсилільні похідні дуже чутливі до води та протонних розчинників, внаслідок сольволізу до вихідних амідів [6]. Тому хлористий метилен, що використовували як розчинник для синтезу патентованих сполук, ретельно осушували над молекулярними ситами 0,4 нм за методикою, аналогічною описаній раніше для диметилформаміду [7]. Техніка експерименту, яка використовується в синтезі літійорганічних сполук [8] добре підходить для методу хелатуючого окиснення силільованих лактамів. N-гідроксигомоазаадамантанон (І) одержували шляхом обмінної реакції комплексоутворення молібденілу (МоО2) з натрієвою сіллю етилендіамінтетраоцтової кислоти (Na4(EDTA)). При цьому комплекс 2 розчиняли в 1 М розчині Na4(EDTA) (pH 9,5). Далі доводили рН реакційної суміші до значення 7,5 і екстрагували гідроксамову кислоту декількома порціями дихлорметану. Розчинник випаровували, продукт очищували сублімацією. Наявність координованого етанолу в молекулі комплексу 2 не заважає виділенню сполуки 1 з високим виходом. 1 UA 86566 U 5 10 15 20 25 30 35 40 45 50 55 60 ІЧ спектр N-гідроксигомоазаадамантанону (І) містить характеристичну для гідроксамових -1 -1 кислот смугу валентних коливань карбонільної групи при 1632 см , зміщену на 34 см в високочастотну область у порівнянні з такою у спектрі вихідного комплексу 2. 1 Н ЯМР спектр розчину в CDCl3 сполуки 1 містить (м.ч.): розширений (внаслідок обмінних процесів) сигнал одного протона ОН групи при 8,09; вузький слаборозділений мультиплет в межах 3,95-3,90, що відповідає резонансу протона вузлового положення вуглеводневого каркаса, суміжного з атомом азоту гетероциклу; в межах 2,90-2,86 знаходиться відносно вузький, слаборозділений мультиплет протона при вузловому атомі вуглецю суміжного з карбонільним. Три групи слаборозділених мультиплетів в межах 2,14-2,08 від двох протонів, 2,00-1,82 від восьми протонів, а також 1,78-1,72 від двох протонів відповідають резонансним 1 1 сигналам Н вуглеводневого каркаса. Таким чином, дані ІЧ- та Н ЯМР-спектроскопії підтверджують наведену хімічну будову гідроксамової кислоти 1 (фіг. 1). Слід зазначити, що вона поступово розкладається при зберіганні при кімнатній температурі (близько 10 % на місяць). При підкисленні насиченого спиртового розчину сполуки 1 надлишком 10 % соляної кислоти при кімнатній температурі з подальшим охолодженням до 5 °C виділили гідрохлорид Nгідроксигомоазаадамантанону у вигляді монокристалів. Останній є вкрай нестійкими на повітрі при кімнатній температурі, однак при 100 К виявився цілком придатними для проведення тривалої процедури РСА. Молекулярна структура гідрохлориду N-гідроксигомоазаадамантанону представлена на фіг. 2, геометричні характеристики в таблиці 1. За даними РСА молекула хлориду водню є донором протона для карбонільної групи, так само як це було показано методом FTIR для ацетогідроксамової кислоти [9]. У порівнянні з вихідним лактамом гомоазаадамантаноном [10] зміни геометричних характеристик незначні і стосуються лише угруповання N-C=O. А саме, спостерігається зменшення довжини зв'язку N(1)-C(1) (1.2993 (16) Å, в лактамі - 1.331 Å) і величини кута N(1)C (1)0(1) (117.30(11)°, в лактамі - 120.6°). Гідроксамова група практично плоска, атоми С6, С2, N1, С1 лежать в одній площині. Молекули гідрохлориду сполуки 1 об'єднуються в димери і формують кристали за рахунок водневих зв'язків О-Н···Сl, а також більш слабких взаємодій СН···Сl і СН···О. Сполука 2 досить стійка в насиченому етанольному розчині, однак швидко розкладається на повітрі, втрачаючи координовані молекули спирту. ІЧ спектр комплексу містить сильні смуги -1 поглинання при 930 і 896 см , які відповідають симетричним і асиметричним Мо=О коливанням -1 [МоО2] груп, а також сильну смугу поглинання при 759 см , що обумовлена коливаннями μоксогрупи. Наведені значення добре узгоджуються з такими, що знайдені для діоксо-μ-оксо сполук молібдену з монодентатними [11], бідентатними [12], тридентатними [13] лігандами. У -1 спектрі міститься також сильна смуга поглинання при 789 см , яку можна віднести до коливань зв'язку Мо-O координованої молекули етанолу. Характеристичні коливання пов'язаної з -1 металом С-O групи (1598 см ) помітно зміщені в високочастотний спектральний діапазон в порівнянні зі смугами коливання в спектрах біс-гідроксаматів молібденілу [14]. Це можна пояснити впливом жорсткого вуглеводневого каркаса, в який вбудована гідроксаматна група. -1 Сильна широка смуга поглинання при 3371 см підтверджує наявність координованого етанолу в молекулі біядерного комплексу молібдену (VI). 1 Н ЯМР спектр розчину в CDCl3 комплексу 2 містить вузький слаборозділений мультиплет в межах 4,10-4,05 м. ч., що відповідає резонансу протона вузлового положення вуглеводневого каркаса, суміжного з атомом азоту гетероциклу; при 3,72 м. ч. спостерігається характерний 3 квадруплет ( JH-H=6,9 Гц) від метиленових протонів координованого етанолу; в межах 2,92-2,84 м.ч. знаходиться відносно вузький слабо розділений мультиплет протона при вузловому атомі вуглецю суміжного з карбонільним вуглецем; три групи слабо розділених мультиплетів в межах (м.ч.) 2,19-2,05 від п'яти протонів, 1,95-1,82 від шести протонів, а також 1,78-1,70 від двох протонів віднесені до резонансних ліній вуглеводневого каркаса; при 1,25 м.ч. спостерігається 3 1 характерний триплет ( JH-H=6,9 Гц) метилових протонів координованого спирту. Дані ІЧ- та Н ЯМР спектроскопії підтверджують наведену хімічну будову μ-оксо-біс[Nоксигомоазаадамантанонато)-діоксо-молібден(VІ)-етанол (1/1)]у (фіг. 1). За даними РСА комплекс являє собою біядерну сполуку, в якій два ідентичні, кристалографічно незалежні, молібденвмісні фрагменти (C10H15NO2MoO2C2H5OH) пов'язані між собою містковим атомом кисню (μ-оксогрупа) (фіг. 3), відстань Мо…Мо складає 3.7427(9) Å. Крім μ-оксогрупи, в хімічне оточення кожного атома молібдену входять пара термінальних оксоліганда в цис-позиції, депротонований фрагмент гідроксамової кислоти і молекула етилового спирту. Координаційний поліедр кожного фрагмента [МоО 6] має геометрію викривленого октаедра, подібно будові біс-гідроксаматних, а також інших комплексів діоксомолібдену (VI). Значення валентних кутів наступні: O(1)Мо(1)O(2) (в хелатному циклі) 2 UA 86566 U 5 10 15 20 25 30 35 40 45 50 55 73.23(4)°, О(3)Мо(1)О(5) - 79.73(4)°, О(4)Мо(1)О(6) - 104.28(5)° (таблиця 2). Значення довжин зв'язків Мо(1)-О(4) і Мо(1)-О(6) складають близько 1,70 Å, що відповідає подвійному зв'язку Мо=О. Значення довжин зв'язків С(1)-О(1) і C(1)-N(1) свідчать про делокалізацію електронної густини між атомами С(1), O(1) і N(1) [15]. Металлоцикл Mo(1)-O(1)-C(1)-N(1)-O(2) плоский. Довжини зв'язків Мо-O в хелатному кільці нееквівалентні, подібно до того, як це має місце в споріднених біс-гідроксаматних структурах [16], внаслідок сильного транс-впливу груп Мо=О. Зв'язок Мо(1)-О(5) значно коротший за Мо(1)-О(3), що, ймовірно, також пов'язане з трансвпливом оксогруп. Довжина зв'язку Мо(1)-О(5) складає 1.8867 (2) Å, що кореспондується з даними для інших μ-оксомісткових комплексів молібденілу (VI). Значення кута Мо(1)0(5)Мо(1*) становить 165.33 (9)°. За літературними даними значення кутів місткового зв'язку для біядерних комплексів діоксо-молібдену (VI) змінюються в широких межах: 143.5° для Mo2O4(μ-O)Cl2(di-t-Bubipy)2 (де di-t-Bu-bipy-4,4'-ди-трет-бутил-2,2'-біпіридин) [17], ~ 151° для Мо2О4(μ-О)Сl2(рzН)4 (де pzH - піразол) [11], ~ 175° для Mo2O4(μ-O)Cl2(DMF)4 (де DMF - диметилформамід) [18], а також близько 156° і 180° для конформерів Мо2О4(μ-О)Сl2(РzРу)2 (де PzPy похідне 2-(3піразоліл)піридину) [19]. Такий розкид значень обумовлений можливими внутрішньомолекулярними контактами типу π-π взаємодії між ароматичними лігандами [12], а також просторовими характеристиками лігандів. Молекули етанолу, що займають транспозицію щодо μ-оксогрупи сполуки 2, стабілізують біядерну структуру, як вже зазначалося вище, за рахунок сильного внутрішньомолекулярного водневого зв'язку з карбонільним атомом кисню. Суть корисної моделі пояснюється кресленням і конкретними прикладами. На фіг. 1 наведено схему синтезу N-гідроксигомоазаадамантанону (І), проміжного комплексу μ-оксо-біс[N-оксигомоазаадамантанонато)-діоксомолібден(VІ)-етанол (1/1)]у (2), а також проміжного продукту - триметилсилільного похідного гомоазаадамантанону. На фіг. 2 зображено молекулярну структуру гідрохлориду N-гідроксигомоазаадамантанону, одержану з рентгеноструктурних даних. На фіг. 3 зображено молекулярну структуру μ-оксо-біс[(N-оксигомоазаадамантанонато)діоксомолібден(VІ)-етанол (1/1)]у (2), одержану з рентгеноструктурних даних. В таблиці 1 наведено величини основних відстаней та кутів в молекулі гідрохлориду Nгідроксигомоазаадамантанону. В таблиці 2 наведено величини основних відстаней та кутів в молекулі μ-оксо-біс[Nоксигомоазаадамантанонато)-діоксомолібден(VІ)-етанол (1/1)]у (2). Всі хімічні речовини, що використовувалися для синтезу були кваліфікації „ч". Розчинники очищали перегонкою. Диметилформамід (DMF) фірми MERCK очищали, як було описано в [7]. Для якісного аналізу використовували пластини 25 TCL Silica gel 60 F254 фірми MERCK. Елементний аналіз був проведений на аналізаторі CARLO ERBA 1106. -1 Інфрачервоні спектри (ІЧ) поглинання в діапазоні частот 400-4000 см записані в таблетках КВr на спектрофотометрі SPECORD М 80, оснащеному ІВМ-сумісною операційною системою. 1 Н ЯМР спектри реєстрували на спектрометрі Varian VXR-300 (300 МГц) в CDCl3 (внутрішній стандарт ТМС). Ренгено-структурні дані отримані на дифрактометрі BRUKER SMART APEX II (Mo Кα випромінювання, λ = 0.71073 Å, графітовий монохроматор) при 100 К. μ-Оксо-біс[(N-оксигомоазаадамантанонато)-діоксомолібден(VІ)-етанол (1/1)/ (2). 2.00 г (12.1 ммоль) гомоазаадамантанону і кілька крапель триметилхлорсилану кип'ятили зі зворотним холодильником, із захистом від вологи повітря, в 60 мл гексаметилдисилазану протягом 7 годин. Надлишок силілюючого реагента відганяли. Після охолодження в струмі аргону до кімнатної температури залишок розчиняли в 30 мл сухого дихлорметану і змішували з розчином 1.51г (6.05 ммольl) (N, N-диметилформамід)-оксодипероксомолібдену (VI) в 50 мл сухого дихлорметану. Гомогенну реакційну масу помаранчевого кольору перемішували протягом 30 годин з захистом від вологи повітря. Залишок світло-коричневого кольору, після видалення розчинника, кристалізували два рази з етанолу і одержували блідо-жовті пластинчаті кристали комплексу 2, придатні для РСА. Вихід: 1.22 г, 28 %. Аналітичні дані. Розраховано для C24H38N2O11Mo2 (MW 722.45): С, 39.90; Н, 5.30; N, 3.88. Знайдено: С, 40.12; Н, 5.51; N, 3.75 %. ІЧ -1 спектр (КВr, см ): 3371, 2970, 2917, 2867,2846, 1598, 1472, 1432, 1392, 1369, 1351, 1320, 1313, 1295, 1244, 1221, 1184, 1173, 1094, 1070, 1041, 999, 930, 896, 876, 866, 789, 759, 649, 584, 538, 1 494, 415. Н ЯМР (300 МГц, CDCl3, 25 °C, TMS), δ, м.ч.: 4.10-4.05 (м, 1Н (каркас, N-O)), 3.72 (к, 3 JH-H-6.9 Гц, 2Н, СН2), 2.92-2.84 (м, 1Н (каркас, С=О)), 2.19-2.05 (м, 5Н (каркас)), 1.95-1.82 (м, 6Н 3 (каркас)), 1.78-1.70 (м, 2Н (каркас)), 1.25 (т, JH-H=6.9 Hz, 3Н, СН3), де м - мультиплет, т триплет, к -квадруплет. N-гідрокси-гомоазаадамантанон (1) 3 UA 86566 U 5 10 1.2 г (1.66 ммоль) комплексу 2 інтенсивно перемішували з 100 мл 1 молярного розчину натрієвої солі етилендіамінтетраоцтової кислоти (рН 9.5) при 60 °C протягом 2 годин до практично повного розчинення комплексу. Водну фазу охолоджували до кімнатної температури, фільтрували і підкислювали соляною кислотою до значень рН 7.5, а потім екстрагували п'ятьма порціями по 25 мл хлороформу. Об'єднані хлороформні витяжки сушили над Na2SO4, розчинник відганяли на роторному випаровувачі. Жовтуватий твердий залишок очищали сублімацією при 80 °C і 13 гПа. Вихід: 572 мг, 95 %. Аналітичні дані. Розраховано для C10H15NO2 (MW 181.24): С, 66.27; Н, 8.34; N, 7.73. Знайдено: С, 66.12; Н, 8.47; N, 7.91 %. Температура плавлення 177-1 182 °C. ІЧ-спектр (КВr, см ): 3103, 2922, 2846, 1632, 1440, 1367, 1353, 1332, 1295, 1254, 1235, 1218, 1180, 1148, 1116, 1087, 1066, 1025,993, 966, 936, 915, 877, 863, 763, 746, 727, 625, 561, 1 540, 461, 443, 421, 409. Н ЯМР (300 МГц, CDCl3, 25 °C, TMS), δ, м.ч.: 8.09 (ш.с, 1Н, ОН), 3.953.90 (м, 1Н (каркас, N-O)), 2.90-2.86 (м, 1Н (каркас, С=О)), 2.14-2.08 (м, 2Н (каркас)), 2.00-1.82 (м, 8Н (каркас)), 1.78-1.72 (м, 2Н (каркас)), де м - мультиплет, ш.с. - широкий синглет. Таблиця 1 Відстані, Å О(1)-С(1) O(2)-N(1) О(1)-H(1O) O(2)-H(1N) N(1)-C(6) N(1)-C(1) C(1)-C(2) Кути, град. С(1)-О(1)-Н(1O) N(1)-O(2)-H(1N) O(2)-N(1)-C(l) C(1)-N(1)-C(6) O(2)-N(1)-C(6) O(1)-C(1)-C(2) O(1)-C(1)-N(1) N(1)-C(1)-C(2) N(1)-C(6)-C(7) N(1)-C(6)-C(5) 1.3005(15) 1.3907(14) 0.83(3) 0.88(2) 1.4909(16) 1.2993(16) 1.5043(18) 111.0(19) 102.0(15) 116.95(10) 126.93(11) 115.77(10) 121.27(11) 117.30(11) 121.44(11) 111.36(10) 111.16(10) 15 Таблиця 2 Відстані, Å Мо(1)-О(1) 2.1903(11) Мо(1)-О(2) 2.0322(11) Мо(1)-О(3) 2.3972(10) Мо(1)-0(4) 1.7036(11) Мо(1)-О(5) 1.8867(2) Мо(1)-О(6) 1.6977(10) O(1)-С(1) 1.2890(17) O(2)-N(l) 1.3663(15) O(3)-С(11) 1.4445(17) О(3)-Н(3О) 0.84(3) N(l)-C(6) 1.4781(18) N(1)-C(1) 1.3062(18) C(1)-C(2) 1.504(2) 20 25 30 Кути, град. О(1)-Мо(1)-О(2) 73.23(4) О(1)-Мо(1)-О(3) 72.00(4) О(1)-Мо(1)-O(4) 155.41(5) О(1)-Мо(1)-O(5) 84.27(5) О(1)-Мо(1)-O(6) 96.12(5) О(2)-Мо(1)-O(3) 77.41(4) О(2)-Мо(1)-O(4) 89.70(5) О(2)-Мо(1)-O(5) 151.86(5) О(2)-Мо(1)-O(6) 99.70(5) O(3)-Мо(1)-O(4) 87.31(4) О(3)-Мо(1)-О(5) 79.73(4) О(3)-Мо(1)-O(6) 168.12(5) О(4)-Мо(1)-O(5) 105.45(5) Кути, град. О(4)-Мо(1)-О(6) 104.28(5) О(5)-Мо(1)-О(6) 99.30(4) Мо(1)-О(1)-С(1) 114.10(9) Mo(1)-O(2)-N(1) 117.17(8) Мо(1)-О(5)-Мо(1*) 165.33(9) С(11)-О(3)-Н(3О) 109.1(16) Мо(1)-О(3)-Н(3О) 109.5(18) O(2)-N(1)-C(6) 114.53(10) O(2)-N(1)-C(1) 117.00(11) C(1)-N(1)-C(6) 127.87(12) O(1)-C(1)-C(2) 121.19(12) N(1)-C(1)-C(2) 121.36(12) O(1)-C(1)-N(1) 117.36(12) Джерела інформації: 1. E.I. Bagrii, Adamantanes: Production, Properties, Application, Nauka, Moscow, 1989, p. 263; A.A. El-Emam, A.-M.S. Al-Tamimi, K…A. Al-Rashood, H.N. Misra, V. Narayan, O. Prasad, L. Sinha, J. Моl. Struct. 1022 (2012) 49. 2. J. Liu, D. Obando, V. Liao, T. Lifa, R. Codd, Eur. J. Med. Chem. 46 (2011) 1949. 3. M. Matkovic, J. Veljkovic, K. Mlinaric-Majerski, K. Molcanov, B. Kojic-Prodic, J. Моl. Struct. 832 (2007) 191. 4. Z. Dzolic, R. Margeta, M. Vinkovic, Z. Stefanic, B. Kojic-Prodic, K. Mlinaric-Majerski, M. Zinic, J. Моl. Struct. 876 (2008) 218. 5. J. Liu, D. Obando, L.G. Schipanski, L.K. Groebler, P.K. Witting, D.S. Kalinowski. D.R. Richardson, R. Codd, J. Med. Chem. 53 (2010) 1370. 6. S.A. Maltin, P.O. Sammes, R.M. Upton, J. Chem. Soc. Perkin I (1979) 2481. 7. L.I. Koval, V.I. Dzyuba, V.V. Bon, O.L. Ilnitska, V.I. Pekhnyo, Polyhedron 28 (2009) 2698. 8. B.J. Wakefield, Organolithium Methods, Academic Press, London, 1988. Russian ed. Mir, Moscow, 1991, p. 184. 4 UA 86566 U 5 10 15 9. M. Saldyka, Z. Mielke, J. Моl. Struct. 692 (2004) 163. 10. J. Symersky, P. Kalal, K. Blaha, V. Langer, Acta Cryst. C42 (1986) 76. 11. C.C.L. Pereira, S.S. Balula, F.A. A. Paz, A.A. Valente, M. Pillinger, J. Klinowski, I.S. Goncalves, Inorg. Chem. 46 (2007) 8508. 12. S. Gupta, S. Pal, A.K. Barik, S. Roy, A. Hazra, T.N. Mandal, R.J. Butcher, S.K. Kar, Polyhedron 28 (2009) 711. 13. J.A. Brito, N. Saffon, M. Gomez, B. Royo, Curr. Inorg. Chem. 1 (2011) 131. 14. V.I. Dzyuba, L.I. Koval, V.V. Bon, V.I. Pekhnyo, Polyhedron 29 (2010) 2900. 15. Kh.T. Sharipov, N.K. Makhmudova, T.S. Khodashova, N.A. Parpiev, M.A. Porai-Koshits, Koord. Khim. (Russ.) (Coord. Chem.) 8 (1982) 117. 16. D.A. Brown, H. Bogge, R. Coogan, D. Doocey, T.J. Kemp, A. Muller, B. Neumann, Inorg. Chem. 35 (1996) 1674. 17. A.C. Gomes, J.A. Fernandes, C.A. Gamelas, I.S. Goncalves, F.A. A. Paz, Acta Cryst. E67 (2011) 1738. 18. S. Gago, P. Neves, B. Monteiro, M. Pessego, A.D. Lopes, A.A. Valente, F.A.A. Paz, M. Pillinger, J. Moreira, C.M. Silva, I.S. Goncalves, Eur. J. Inorg. Chem (2009) 4528. 19. A.C. Coelho, M. Nolasco, S.S. Balula, M.M. Antunes, C.C.L. Pereira, F.A.A. Paz, A.A. Valente, M. Pillinger, P. Ribeiro-Claro, J. Klinowski, I.S. Goncalves, Inorg. Chem. 50 (2011) 525. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 20 1. Сполука формули І: C O N OH I або її сольвати, комплексні сполуки, або солі. 25 5 UA 86566 U Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
Автори англійськоюDziuba Valerii Ivanovych, Koval Liudmyla Ivanivna, Ilnytska Olena Liudvyhivna, Pekhnio Vasyl Ivanovych
Автори російськоюДзюба Валерий Иванович, Коваль ЛюдмилаИвановна, Ильницкая Елена Людвиговна, Пехньо Василий Иванович
МПК / Мітки
МПК: C07C 13/615, C07D 201/00, C07D 295/00, C07D 259/00
Мітки: n-гідроксигомоазаадамантанон, комплекс, діоксомолібденом
Код посилання
<a href="https://ua.patents.su/8-86566-n-gidroksigomoazaadamantanon-ta-jjogo-kompleks-z-dioksomolibdenom.html" target="_blank" rel="follow" title="База патентів України">N-гідроксигомоазаадамантанон та його комплекс з діоксомолібденом</a>
Попередній патент: Спосіб лікування розповсюдженного раку яєчника
Наступний патент: Спосіб азотування в тліючому розряді з автономними параметрами
Випадковий патент: Прямоточний циліндричний клапан