Спосіб культивування одноклітинної зеленої водорості haematococcus pluvialis для одержання астаксантину
Номер патенту: 87245
Опубліковано: 25.06.2009
Автори: Дробецька Ірина Вікторівна, Чубчикова Ірина Миколаївна, Мінюк Галина Семенівна, Терент'єва Наталя Вікторівна
Формула / Реферат
Спосіб культивування одноклітинної зеленої водорості Haematococcus pluvialis для одержання астаксантину, що передбачає індукцію біосинтезу астаксантину в монадних вегетативних клітинах, який відрізняється тим, що культуру, яку виростили на поживному середовищі МОНМ-1, у стані субстратного насичення клітин по біогенних елементах (інокулят) вносять у кількості 0,3-0,35.107 кл.л-1 у поживне середовище МОНМ-2, що відрізняється від середовища МОНМ-1 30-кратно зниженим вмістом азоту (0,2 мМ.л-1) і фосфору (0,12 мМ.л-1), однократно вносять 15 мМ ацетату натрію і подальше вирощування протягом 20 діб здійснюють в напівпроточному режимі (0,1-0,3 доб-1), підтримуючи в середовищі МОНМ-2 заданий рівень азоту і фосфору, при цілодобовому освітленні люмінесцентними лампами денного світла з інтенсивністю світлового потоку 120 mЕ.м-2.с-1, безперервній продувці повітрям (0,3 л.хв.-1) і температурі 22-26 °С, а модифіковане середовище МОНМ-1 має такий склад, мг.л-1:
KNO3
615
СаСl2.2Н2O
55,45
Fе6Н5O7.5Н2O
2,62
MgSO4.7Н2O
246,5
Na2HPO4
45,0
MnSO4.H2O
0,85
ZnSO4.7H2O
0,07
CuSO4.5H2O
0,012
Na2Mo4.2H2O
0,12
СоСl2.6Н2O
0,011
KCr(SO4)2.12H2O
0,499
Nа2Se3
0,008
Біотин
0,025
Вітамін В1
0,0175
Вітамін В12
0,015.
Текст
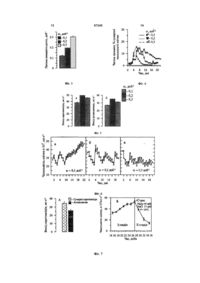
Спосіб культивування одноклітинної зеленої водорості Haematococcus pluvialis для одержання астаксантину, що передбачає індукцію біосинтезу астаксантину в монадних вегетативних клітинах, який відрізняється тим, що культуру, яку вирос C2 2 (11) 1 3 87245 4 ковину й альгенан. Ці обставини вимагають застотемах in vivo АО-активність b-каротину й aсування комбінацій спеціальних енергоємних метокоферолу на порядок. Найбільш перспективним тодів дезінтеграції клітин (здрібнювання біомаси промисловим джерелом природного астаксантину до часток розміром менш 5-8мкм) і приводять до є зелена мікроводорість Haematococcus pluvialis, у використання коштовного й енергоємного устаткуклітинах якої вміст пігменту може досягати 2-3% вання (кульові млини, ультразвукові дезінтегратосухої речовини (СР). При цьому АО-активність ри, преси й т.п.). астаксантину, що продукується водорістю, істотно 2. Індукція утворення апланоспор і накопиченвище активності синтетичного аналога, завдяки ня в них астаксантину за допомогою методів перевазі в складі ізомерів природної форми стрес-впливу на культури, що використовуються у 3S,3'S-ізомера. теперішній час, викликає значні втрати біомаси, Двостадійні промислові технології одержання отриманої на І етапі, через масову загибель вегеастаксантину з Н. pluvialis, які використовують у тативних клітин (до 40-60%), що приводить до нетеперішній час, передбачають такий спосіб кульпродуктивних витрат на мінеральні солі, електротивування водорості, при якому процеси росту й енергію й технічне обслуговування культиваторів. біосинтезу вторинних каротиноїдів пристосовані 3. Ще одним недоліком, що вимагає додаткодо різних стадій клітинного циклу (вегетативної й вих капіталовкладень, є агрегація пальмелоїдних спорогенезу) [див. Boussiba S. Carotenogenesis in клітин на початковому етапі другої стадії й осіданthe green alga Haematococcus pluvialis: Cellular ня їх на стінках культиваторів, що приводить до physiology and stress response // Physiol. Plant. зниження інтенсивності світлового потоку, що про2000. - 108. - P. 111-11]. На першій («зеленій») никає у внутрішній шар культури. Це явище вимастадії технологічного процесу водорість вирощугає використання ерліфтів або потужних мембранють у контрольованих умовах, що забезпечують них насосів для збільшення швидкості максимальну швидкість ділення вегетативних клітурбулентного потоку в культиваторах, а також тин. На другій («червоній») стадії, що починається обов'язкового чищення культиваторів перед кожз моменту досягнення культурами стаціонарної ним технологічним циклом (обробкою гарячою фази росту, отриману біомасу переносять в умови, парою під високим тиском). що ініціюють утворення апланоспор і накопичення Відомий спосіб одностадийного культивування в них астаксантину. Трансформацію вегетативних Н. pluvialis, при якому ділення клітин і накопичуклітин в апланоспори й індукцію в останніх втовання в них астаксантину відбуваються на одній ринного каротиногенезу викликають різними вида(вегетативній) стадії клітинного циклу [див. Del Rio ми стрес-впливу на культури: збільшенням освітΕ., Acien F.G., Garcia-Malea M.C., Rivas J., Molinaленості й температури, дефіцитом біогенних Grima E., Guerrero M.G. Efficient one-step production елементів або додаванням у середовище різних of astaxanthin by the microalga хімічних сполук - активаторів вільно-радикального Haematococcuspluvialis in continuous culture // окислювання [див. WO 97/28274, WO 2005/116238, Biotechnol. Bioeng. - 2005. - 91, №7. - P. 808-815]. ЕР 1760157, JP 3163127, ЕР 1724357]. У результаПеревага способу полягає в тому, що вегетативні ті стрес-впливу монадні еліпсоїдні клітини здобумонадні клітини, збагачені астаксантином, не мавають спочатку пальмелоїдну структуру (втрачають міцної альгенанової оболонки, завдяки чому ють джгутики, округляються й збільшуються в підвищується біодоступность каротиноїду, знижурозмірах), а потім утворюють апланоспори, оточеються витрати на здрібнювання біомаси й збільні багатошаровою, стійкою до хімічного впливу шується вихід астаксантину при його одержанні в (лужного й кислотного гідролізу) оболонкою, яка чистому виді. Водорість вирощують автотрофно утворена целюлозою й біополімером альгенаном, методом безперервної культури на поживному аналогічним за структурою спорополленіну, і тому середовищі зі зниженим вмістом азоту (1,7мМ) при важко руйнується механічними методами. Дозріштучному освітленні люмінесцентними лампами з вання апланоспор супроводжується інтенсивним інтенсивністю світлового потоку в 1220mЕ·м-2·с-1 і накопиченням моно- і діефірів астаксантину в ліпідних включеннях цитоплазми. Тривалість другої швидкості протоку середовища (w), що дорівнює стадії культивування, вихід астаксантину з літра 0,9·доб-1. Одержувана таким чином біомаса на культури і його вміст у біомасі варіюють залежно 95% складається з монадних і пальмелоїдних вевід методів індукції вторинного каротиногенезу. гетативних клітин і на 5% - із апланоспор. НайВідомі двостадійні технології культивування Н. більш раціональним методом збирання біомаси в pluvialis характеризуються рядом недоліків, що цьому випадку є центрифугування. Вміст сухої визначають високу собівартість одержання астакречовини в літрі культури становить 0,7г, вміст сантину з Н. pluvialis й обмежують безпосереднє астаксантину в біомасі - 0,8% СР. застосування одержуваної біомаси для виробницЗазначена робота має принципове значення, тва БАД, продуктів харчування й кормових добатому що підтверджує можливість одержання біовок. Найбільш істотні з них полягають у наступномаси Н. pluvialis, що складається з вегетативних му: клітин, збагачених астаксантином. Однак запропо1. Наявність у апланоспор міцних оболонок існований режим культивування має істотні обметотно утрудняє екстракцію астаксантину з біомаси ження для використання в промислових масштапри його одержанні в чистому виді і обумовлює бах. Найбільш важливими з них є: низьку біодоступність каротиноїду для людини й а) високі витрати електроенергії на створення ссавців при безпосередньому уживанні біомаси в світлового потоку інтенсивністю. 1220mЕ·м-2·с-1 і їжу через відсутність у їхньому шлунковощоденне збирання біомаси за допомогою центрикишковому тракті ферментів, що гідролізують клітфугування (90% всього об'єму культури); 5 87245 6 б) суттєво більш низький вміст астаксантину в Спільним для прототипу й способу, що заявсухій речовині (0,7% СР), у порівнянні з варіантами ляється, є індукція біосинтезу астаксантину в модвостадійного методу культивування водорості, надних клітинах. На відміну від прототипу, в якому що використовуються в теперішній час (2-2,5% індукція біосинтезу астаксантину здійснюється СВ); зниженням концентрації у середовищі тільки азоту Крім того, у роботі відсутні відомості про тридо 1,7мМ·л-1 й різким збільшенням освітленості до валість стаціонарної фази росту культур (тобто 1220mЕ·м-2·с-1, у способі, що заявляється, провотривалості технологічного циклу) і всі дані, що хадиться одночасно різке зниження концентрації рактеризують продуктивність культур по біомасі й азоту і фосфору до 0,2мМ N·л-1 і 0,01мМ Р·л-1 у астаксантину, наведеш для 5 доби культивування. поєднанні з однократним додаванням ацетату наВідсутні також і відомості про співвідношення мотрію (для збільшенням молярного співвідношення надних і пальмелоїдних клітин в одержуваній біоC/N до 150) без суттєвого збільшення освітленості. масі, що мають важливе значення для оцінки її Крім того, в прототипі використовується метод біодоступності, тому що оболонки пальмел, так безперервної культури зі швидкістю протоку 0,1само як й оболонки апланоспор, містять альгенан. 0,3сут-1. В основу винаходу Спосіб культивування одПередбачуваний винахід пояснюється ілюстноклітинної зеленої водорості Haematococcus раціями. Фіг.1 - Динаміка вмісту сумарних каротиpluvialis поставлено задачу підвищити ефективноїдів й астаксантину в культурах і клітинах Н. ність одностадійного способу культивування Н. pluvialis залежно від швидкості протоку поживного pluvialis шляхом зниження витрат на виробництво середовища. Фіг.2 - Вміст каротиноїдів (а) і астакбіомаси й підвищення її біологічної цінності (біодосантину (б, в) у сухій біомасі залежно від швидкоступності й вмісту астаксантину). сті протоку поживного середовища. Фіг.3 - СередСпосіб культивування одноклітинної зеленої ня питома швидкість росту культур при різній водорості Haematococcus pluvialis для одержання швидкості протоку середовища. Фіг.4 - Динаміка астаксантину заснований на методі індукції біосинчисельності пальмелоїдних клітин у культурах при тезу астаксантину в монадних вегетативних клітирізній швидкості протоку середовища. Фіг.5 - Вихід нах, а його модифікація й підбор умов культивусумарних каротиноїдів (а) і астаксантину (б) з літра вання, що виключають утворення апланоспор і культури за 20-денний технологічний цикл в умозабезпечують перевагу в культурах рухливих клівах одностадійної напівпроточної культури. Фіг.6 тин над пальмелоїдними (більше 80%) протягом Динаміка біомаси в культурах Н. pluvialis (штам 20-ти денного технологічного циклу й накопичення IBSS-18) при різній швидкості протоку середовив них астаксантину до рівня його звичайного вмісща. Фіг.7 - Вихід сумарних каротиноїдів й астаксату в апланоспорах (не менш 2% СР), були виконантину з літра культури в умовах двостадійної кульні авторами в лабораторних експериментах. тури. Поставлене завдання досягається тим, що Спосіб культивування одноклітинної зеленої культуру, що було вирощено на поживному сереводорості Haematococcus pluvialis реалізується в довищі МОНМ-1, у стані субстратного насичення таким чином: клітин по біогенних елементах вносять у кількості Для культивування може бути використаний 0,3-0,35·107кл·л-1 в поживне середовище МОНМ-2, будь-який штам Haematococcus pluvialis, наприщо відрізняється від середовища МОНМ-1 30клад CALU-79, САLU 333, CAUP G1002, ССАР кратно зниженим вмістом азоту (0,2мМ·л-1) і фос34/1D, ССАР 213/4, SAG 34-1d, SAG 213-4, UTEX фору (0,12мМ·л-1). До середовища однократно 113, IBSS-18 при перевазі крупноклітинних штамів. додають 15мМ ацетату натрію. Вирощування проЇх колекційне зберігання здійснюють на агаризоватягом 20 діб здійснюють у натвпроточному режимі ному (1,5%) базовому середовищі OHM (табл. 1) (0,1-0,3сут-1), підтримуючи в середовищі МОНМ-2 при освітленості 1000-1500Лк, і температурі 15заданий рівень азоту й фосфору, при цілодобово18°С із пересіванням кожні 1,5-2 місяця. му освітленні люмінесцентними лампами денного Склад поживних середовищ для різних стадій світла с інтенсивністю світлового потоку 120mЕ·мкультивування Н. pluvialis 2 -1 ·с , безперервній продувні повітрям (0,3л·хв.-1) і температурі 22-26°С. 7 87245 8 Таблиця 1 Компонент середовища OHM** KNO3 CaCl2·2Н2О Fe6H5O7·5H2O MgSO4·7Η2Ο Na2HPO4 MnSO4·H2O ZnSO4·7H2O CuSO4·5H2O Na2Mo4·2H2O CoCl2·6H2O Сr2О3 KCr(SO4)2·12H2O Se2 Na2Se3 Біотин Вітамін B1 Вітамін В12 410 110,9 2,62 246,5 30 0,85 0,012 0,12 0,011 0,076 0,005 0,025 0,0175 0,015 Вміст, мг·л-1 Модифікації середовища OHM OHM базова (для зберігання МОНМ-1 (для II МОНМ-2 (для напівштамів й І стадії одержання іно- стадії одержання проточного культивукуляту) інокуляту) вання) 410 615 20,2 110,9 55,45 55,45 2,62 2,62 2,62 246,5 246,5 246,5 30 45 1,42 0,85 0,85 0,85 0,07 0,07 0,07 0,012 0,012 0,012 0,12 0,12 0,12 0,011 0,011 0,011 0,499 0,499 0,499 0,008 0,08 0,008 0,025 0,025 0,025 0,0175 0,0175 0,0175 0,015 0,015 0,015 Примітка: ** - [див. Fabregas J., Dominguez Α., Regueiro Μ., Maseda., Otero A. Optimization of culture medium for the continuous cultivation of the microalga Haematococcuspluvialis // Appl. Microbiol. Biotechnol. 2000. - 53. - P. 530-535] Одержання інокуляту. Для одержання інокуляту водорість із агаризованих косяків переносять у рідке стерильне базове середовище OHM і 5-7 днів вирощують методом накопичувальної культури при розсіяному природному світлі. Потім культуру переносять у середовище МОНМ-1 (див. табл. 1) і продовжують культивувати при штучному освітленні люмінесцентними лампами денного світла (50-60mЕ·м-2·с-1 16год світло: 8год темрява) в накопичувальному режимі при безперервному барботажі повітрям зі швидкістю 0,1-0,2л·хв.-1. Для засіву культиваторів використовують культуру, клітини якої мають монадну структуру, при залишковому вмісті азоту і фосфору у середовищі МОНМ-1 не нижче 40% вихідного рівня. Суспензію клітин концентрують и вносять до культиваторів із такого розрахунку, щоб початкова чисельність клітин становила 3-3,5·108кл·л-1 або 0,3-0,4г·л-1 сухої речовини. Процес культивування. Поживним середовищем для запропонованого способу культивування є середовище МОНМ-2, у яке однократно відразу після засіву культиваторів додають ацетат натрію до концентрації 15мМ·л-1. Вирощування водорості здійснюють при безперервному освітленні інтенсивністю 120mЕ·м-2·с-1, швидкості продувки повітрям 0,2-0,3л·хв.-1 і температурі поживного середовища 22-26°С. З інтервалом в 24 години із культиваторів відбирають 10-30% об'єму культури, замінюючи його рівноцінним об'ємом свіжого середовища та відновлюючи при цьому початковий рівень азоту (0,2мМ·л-1) і фосфору (0,01мМ·л-1). Створення різкого негативного градієнта концентрацій азоту й фосфору (не менш чим 10 кратного) у поєднанні зі збільшенням молярного співвідношення C/N у середовищі до 150 приводить до індукції біосинтезу астаксантину у вегетативних клітинах Н. pluvialis при освітленості, яка на порядок нижче, чим у прототипі (Фіг.1). Вміст астаксантину в сухій біомасі в процесі культивування збільшується до 2,2-2,8% сухої речовини (Фіг.2б), тобто до рівня, що звичайно реєструють в біомасі агоіаноспор при двостадійному культивуванні H. pluvialis - 2-3% СР. Його частка в сумарних каротиноїдах, починаючи з 10-ї доби, становить 70-80% (Фіг.2в). Щоденне відновлення початкового рівня нітратів і фосфатів забезпечує підтримку клітин у культурах у вегетативному стані. Середня за 20 діб питома швидкість росту астаксантинпродукуючих культур становить 0,12-0,3доб-1 (Фіг.3), що практично не відрізняється від швидкості росту автотрофних накопичувальних культур на першій («зеленій») стадії 2-х стадійної технології культивування (0,1-0,35доб-1). При цьому 80-90% клітин, які містять астаксантин, протягом періоду не менш 20-ти діб зберігають монадну структуру, а апланоспори в культурах відсутні (Фіг.4). У пропонованому способі культивування величина швидкості протоку (w) перебуває в діапазоні 0,1-0,3доб-1, але найкращою є швидкість 0,2доб-1 (щоденний 20% обмін середовища). У цьому випадку загальний вихід каротиноїдів й астаксантину з літра культури за 20 діб культивування вище, ніж у всіх апробованих авторами варіантах, і становить 50мг·л-1 и 35мг·л-1, відповідно (Фіг.5 и 7). 8 Приклад. 9 87245 10 Для культивування використали штам IBSSколбах становив 0,7л, початкова чисельність клі18, виділений авторами у районі м. Адлер в 2003р. тин - 3-3,5·108кл·л-1. Відразу після засіву колб іноШтам характеризується великими розмірами клікулятом у культури внесли по 5,3мл 2Μ стерильтин (середня довжина монад становить 33-34мкм) ного розчину ацетату натрію. З інтервалом у 24 і більш високою швидкістю накопичення астаксангодини із колб відбирали 10, 20 и 30% об'єму культину, у порівнянні з колекційними штамами IPPAS тури (w=0,1-0,3сут-1) і заміняли його рівноцінним Н-239 й CALU-79. об'ємом свіжого середовища, відновлюючи при Для одержання інокуляту штам протягом тижцьому початкову концентрацію азоту (0,2мМ·л-1) і ня вирощували методом накопичувальної культуфосфору (0,01мМ·л-1). Появу астаксантину в кліри в скляних колбах об'ємом 50мл при природному тинах було зареєстровано вже через добу після світлі (30-35mЕ·м-2·с-1) на базовому середовищі внесення інокуляту в середовище МОНМ-2 і, поOHM. Потім культуру концентрували за допомогою чинаючи з 10-ої доби культивування, його вміст у центрифугування (800об·хв.-1, 2хв.), переносили розрахунку на клітину стабілізувався й, в залежнодо колб більшого об'єму (500мл), які містили сті від швидкості протоку, становив: а) 27-31пг·кл-1 300мл середовища МОНМ-1, и продовжували випри w=0,1доб-1; б) 36-40пг·кл-1 при w=0,2доб-1; в) рощувати протягом 4-х діб при освітленні люміне30-35пг·кл-1 w=0,3доб-1 (Фіг.2). Астаксантинпродусцентними лампами «Feron» DL 20W Т4 6400К (50куючі монадні клітини активно ділились протягом 60mЕ·м-2·с-1 с фотоперіодом 16год світло:8год темусього періоду культивування (Фіг.6). Азот и фосрява) при безперервному барботажі стерильним фор, які щодня вносили до середовища під час повітрям зі швидкістю 0,2л·хв.-1 и температурі 22обміну, повністю утилізувались культурами протя23°С. На 5-ту добу (на логарифмічній фазі росту), гом доби, що було необхідною умовою накопичуколи усі клітини в культурі мали монадну структування астаксантину в клітинах і, одночасно з цим, ру, а залишковий вміст азоту и фосфору в середозапобігало непродуктивним витратам мінеральних вищі становив 52,14 и 4,64мг·л-1, відповідно, сусолей. Загальний вихід біомаси як сировини для спензію клітин концентрували за допомогою одержання астаксантину при напівпроточному центрифугування (800об·хв.-1, 2хв.) і використовукультивуванні складався з щоденних 10-30% відвали у якості інокуляту. борів, а також біомаси, що збирали по закінченні Культивування Н. pluvialis для одержання астехнологічного циклу. Дані, що характеризують таксантину проводили в трьох варіантах наїгівпровихід каротиноїдів і астаксантину протягом 20-ти точного режиму в 1-літрових конічних колбах на добового циклу культивування, вміст каротиноїдів поживному середовищі МОНМ-2 при цілодобовому у біомасі на заключній стадії й діапазони чисельбічному освітленні з інтенсивністю світлового поності монадних клітин у культурах при різних варітоку 120mЕ·м-2·с-1, швидкості продувки повітрям антах протоку середовища представлені в табл. 2. 0,3л·хв.-1 і температурі 22-24°С. Об'єм культури в Таблиця 2 Продукційні й морфологічні характеристики культур в умовах напівпроточного культивування Швидкість про- Вихід каротиноїдів, мг·л11 Вміст каротиноїдів у біомасі, % СР Частка монад- Вміст аптоки середови- сумарні кароних клітин у ланоспор, сумарні каротиастаксантин астаксантин ща, доб-1 культурах, % % тиноїди ноїди 0,1 38,14±0,45 27,13±0,30 2,69±0,11 2,3±0,11 82,8-98,2 0 0,2 49,72±0,11 35,25±0,14 3,09±0,18 2,7±0,21 87,7-98,6 0 0,3 45,62±0,44 31,30±0,36 3,51±0,15 2,5±0,27 89,3-99,7 0 В умовах двостадійного культивування штаму IBSS-18 при індукції біосинтезу астаксантину стрес-комплексом СН3СОONа (45мМ)+NaCl (17мМ)+температура 30°С його вміст у зрілих апланоспорах штаму IBSS-18 (розраховуючи на клітину) істотно вище (120-200пг·кл-1), ніж у монадних клітинах, що одержують при реалізації одностадійного способу культивування, що пропонується. Однак при двостадійному культивуванні максимальний вихід астаксантину з літру культури (з такою ж початковою чисельністю клітин і тривалістю технологічного циклу) у даного штаму у серії експериментів не перевищував 27,5±1,4мг·л-1 через масову загибель клітин у постстресорний період (див. Фіг.7). Пропонований спосіб має ряд переваг у порівнянні із прототипом. По-перше, 10-кратна економія електроенергії, що витрачається на освітлення культиваторів, по-друге, 3-9-кратна (залежно від величини щоденного обміну) економія електроенергії, що витрачається на збирання біомаси, потретє, відсутність непродуктивних витрат нітратів і фосфатів у процесі напівпроточного культивування, і, нарешті, вміст астаксантину в біомасі за прототипом - 0,8% сухої речовини, а в пропонованому способі - 2,2-2,8% сухої речовини. Розроблено економічний й ефективний спосіб, що може бути покладений в основу промислового культивування одноклітинної зеленої водорості Haematococcus pluvialis, як сировини для одержання природного астаксантину в чистому виді й БАД з підвищеною біодоступністю каротиноїду. Спосіб виключає трансформацію вегетативних клітин в апланоспори, забезпечує перевагу в культурах клітин монадної структури (>80%) протягом не менш 20 діб і вміст астаксантину в біомасі не менш 2% сухої речовини. 11 87245 12 13 87245 14 15 Комп’ютерна верстка О. Гапоненко 87245 Підписне 16 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for cultivating unicellular green algae haematococcus pluvialis for producing astaxanthin
Автори англійськоюMiniuk Halyna Semenivna, Terentieva Natalia Viktorivna, Drobetska Iryna Viktorivna, Chubchykova Iryna Mykolaivna
Назва патенту російськоюСпособ культивирования одноклеточной зеленой водоросли haematococcus pluvialis для получения астаксантина
Автори російськоюМинюк Галина Семеновна, Терентьева Наталья Викторовна, Дробецкая Ирина Викторовна, Чубчикова Ирина Николаевна
МПК / Мітки
МПК: C12R 1/89, C12N 1/12, A01G 33/00
Мітки: pluvialis, haematococcus, зеленої, культивування, водорості, одержання, астаксантину, одноклітинної, спосіб
Код посилання
<a href="https://ua.patents.su/8-87245-sposib-kultivuvannya-odnoklitinno-zeleno-vodorosti-haematococcus-pluvialis-dlya-oderzhannya-astaksantinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб культивування одноклітинної зеленої водорості haematococcus pluvialis для одержання астаксантину</a>
Попередній патент: Спосіб лікування надлишкової ваги за ганною модло
Наступний патент: Сталева деталь з покриттям, спосіб її виготовлення та застосування
Випадковий патент: Спосіб плоского торцевого шліфування