Сполуки 2,6-хінолінілу та їх застосування як лікарського засобу
Формула / Реферат
1. Сполука, яка описується формулою І, її енантіомери, діастереоізомери або фармацевтично прийнятна сіль,
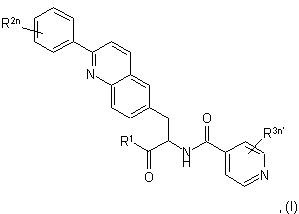
де
R1 є водень, гідроксил або С1-6алкіл;
R2 є водень або галоген;
n приймає значення від 0 до 5;
R3 є водень або галоген;
n' приймає значення від 0 до 4.
2. Сполука за п. 1, де
R1 є гідроксил або метокси;
R2 є атом хлору;
n є 2;
R3 є атом хлору;
n' є 2.
3. Сполука за пп. 1 або 2, де асиметричний атом вуглецю є у S-конфігурації.
4. Сполука за п. 1, вибрана серед метил-(2S)-2-[(3,5-дихлорізонікотиноїл)аміно]-3-[2-(2,6-дихлорфеніл)-6-хінолініл]пропаноату і (2S)-2-[(3,5-дихлорізонікотиноїл)аміно]-3-[2-(2,6-дихлорфеніл)-6-хінолініл]пропанової кислоти.
5. Сполука (2S)-2-[(3,5-дихлорізонікотиноїл)аміно]-3-[2-(2,6-дихлорфеніл)-6-хінолініл]пропанова кислота.
6. Фармацевтичний склад, який містить як активний інгредієнт терапевтично ефективну кількість сполуки за будь-яким із пп. 1-5 і фармацевтично прийнятний ад'ювант, розріджувач або носій.
7. Сполука за будь-яким із пп. 1-5 для застосування в медицині.
8. Застосування сполуки за будь-яким із пп. 1-5 у виготовленні лікарського засобу.
9. Застосування сполуки за будь-яким із пп. 1-5 у виготовленні лікарського засобу для лікування асоційованих з α4β1 і/або α4β7 запальних або медичних станів.
10. Застосування за п. 8 або 9 у виготовленні лікарського засобу для лікування астми, алергічного риніту, синуситу, кон'юнктивіту, харчової алергії, запальних розладів шкіри, включаючи дерматит, псоріаз, кропивницю, свербіж та екзему, ревматоїдного артриту, запальних хвороб кишечнику, включаючи хворобу Крона і виразковий коліт, множинного склерозу та інших автоімунних розладів, гострого мієлолейкозу, трансплантації й атеросклерозу.
11. Застосування за п. 8 або 9 у виготовленні лікарського засобу для лікування α4-асоційованих ракових хвороб.
Текст
1. Сполука, яка описується формулою І, її енантіомери, діастереоізомери або фармацевтично прийнятна сіль, C2 2 (19) 1 3 Даний винахід стосується сполук 2,6хінолінілу, процесів їх виготовлення, фармацевтичних складів, що їх містять, та їх застосування в медикаментах. Інтегрин 4 1 (відомий також під назвою VLA4 або "дуже пізнього антигена-4" (Very Late Antigen-4) і під позначеннями CD49d/CD29) експресується, головним чином, на еозинофілах, лімфоцитах, моноцитах і базофілах. Він зв'язується в першу чергу з адгезивною молекулою VCAM-1 на поверхні судинних клітин, яка експресується на ендотелії у відповідь на запальні цитокіни (TNF- , IL-1 та селективним чином на IL-4 і IL-13) і на зовнішньоклітинний фібронектин матриксного білка. Оскільки 4 1 не експресується на нейтрофілах кровообігу, котрі є першим захистом від інфекції, він є мішенню для фармакологічної регуляції запальних хвороб. Кількома дослідженнями in vitro та in vivo була показана важливість ролі 4 1 в опосередкованих адгезією запальних патологіях та ефективність блокування його функції. До числа таких патологій належать астма, множинний склероз (MS), ревматоїдний артрит (RA), запальні хвороби кишечнику тощо. Інтегрин 4 1 експресується також на лейкозних клітинах, які демонструють підвищену виживаність внаслідок зв'язування з фібронектином, експресованим на стромальних клітинах кісткового мозку. Блокування цієї взаємодії під час хіміотерапії дозволяє ефективно запобігати рецидивам гострого мієлолейкозу. Інтегрин 4 1 і молекула VCAM-1 були також ідентифіковані в клітинах гладких м'язів із інтимального атеросклеротичного стовщення зрілої аорти. Блокування цієї взаємодії дозволяє ефективно запобігати диференціації гладких м'язів та атеросклерозу. Було також показано, що взаємодія інтегрину 4 1 на запальних клітинах з фібронектином збільшує імовірність хронічного відторгнення алотрансплантата. Блокування цієї взаємодії дозволяє ефективно підтримувати життєздатність трансплантата. Інтегрин 4 7 (відомий також під скороченою назвою LPAM-1) експресується на деяких субпопуляціях Т- і В-лімфоцитів та на еозинофілах. Подібно 4 1, інтегрин 4 7 зв'язує VCAM-1 і фібронектин. Крім того, 4 7 зв'язується з адгезивною молекулою MAdCAM-1 поверхні клітини, яка експресується переважно у шлунково-кишковому тракті і, як вважається, є залученою до хомінгу лейкоцитів у шлунково-кишкову слизувату оболонку. Взаємодія між 4 7 і MAdCAM-1 може також являтися важливими місцями запалення зовні слизуватої тканини. У декількох дослідженнях було показано, що 4 7 залучається до запальних хвороб кишечнику і що блокування його функції можна ефективно використовувати в лікуванні таких хвороб. У міжнародній патентній заявці WO 00/15612 описані сполуки, які мають таку загальну формулу: 90319 4 де R виражає собою замісників - водень, СООН, -СОО-алкіл. У заявці вказано на те, що ці речовини можуть використовуватися як проміжні матеріали в готуванні фармацевтичних сполук, але не згадується про їх фармацевтичне застосування. У міжнародній патентній заявці WO 03/093237 описані сполуки 2,6-хінолінілу і 2,6-нафтилу та їх застосування як фармацевтичних засобів у лікуванні асоційованих з VLA-4 запальних хвороб. Авторами даного винаходу були знайдені деякі аналоги цих 2,6-хінолінілових сполук, що є потужними, селективними інгібіторами 4-інтегринів і, зокрема, інтегринів 4 1 і/або 4 7, які демонструють поліпшену оральну біодоступність, низький коефіцієнт виведення ліків із крові і високе поглинання. Ці сполуки не чинять або чинять мінімальну інгібіторну дію на -інтегрини інших підгруп. Таким чином, в одному з варіантів здійснення даного винаходу пропонується сполука, яка має формулу І де R1 є водень, гідроксил або С1-6 алкіл, R2 є водень або галоген, n приймає значення від 0 до 5, R3 є водень або галоген, n' приймає значення від 0 до 4, її енантіомери, діастереоізомери та фармацевтично прийнятна сіль. Використовуваний тут термін "алкіл" означає насичений, одновалентний вуглеводневий радикал, який має прямолінійну або розгалужену частини чи їх комбінації і містить 1-6 атомів вуглецю, у кращому варіанті - 1-2 атомів вуглецю, або один із метиленів (-СН2-) якого може бути заміщений атомом кисню; кращою алкільною групою є група метокси. Використовуваний тут термін "гідроксил" означає групу -ОН. 5 Використовуваний тут термін "галоген" означає атом хлору, брому, фтору або йоду. Кращим для цілей даного винаходу галогеном є хлор. R1 зазвичай є водень, гідроксил або С1-6 алкіл. 1 Кращими варіантами R є гідроксил і метокси. 1 Найкращим варіантом R є гідроксил. R2 зазвичай є водень або галоген. Кращим варіантом R2 є галоген. Кращим галогеном R2 є хлорид. У найкращому варіанті R2 є хлорид у положеннях 2 і 6 фенільного кільця. Число n зазвичай приймає значення від 0 до 5. Кращими значеннями n є 1, 2 і 3, а ще кращим n є 2. R3 зазвичай є водень або галоген. Кращим R3 є галоген, а особливо кращим R3 є хлорид. Найкращим R3 є хлорид у положеннях 3 i 5 піридинового кільця. Число n' зазвичай приймає значення від 0 до 4. Кращими значеннями n' є 1, 2 і 3, а ще кращим n' є 2. R2 зазвичай є атом хлору в положенні 2 або 4 фенільного кільця. У кращому варіанті R2 є принаймні один атом хлору в положенні 2 або 4 фенільного кільця. У ще кращому варіанті R2 є один атом хлору в положенні 2 і 4 фенільного кільця. R3 зазвичай є атом хлору в положенні 3 або 5 піридинового кільця. У кращому варіанті R3 є принаймні один атом хлору в положенні 3 або 5 піридинового кільця. У ще кращому варіанті R3 є один атом хлору в положенні 3 і 5 піридинового кільця. Кращими сполуками згідно з даним винаходом є метил-(2S)-2-[(3,5-дихлорізонікотиноїл)аміно]-3[2-(2,6-дихлорфеніл)-6-хінолініл]пропаноат і (2S)-2[(3,5-дихлорізонікотиноїл)аміно]-3-[2-(2,6дихлорфеніл)-6-хінолініл]пропанова кислота та її фармацевтично прийнятні солі. Найкращою сполукою згідно з даним винаходом є (2S)-2-[(3,5-дихлорізонікотиноїл)аміно]-3-(2(2,6-дихлорфеніл)-6-хінолініл]пропанова кислота та її фармацевтично прийнятні солі. Сполуки за формулою І та деякі проміжні продукти процесу їх одержання мають структури принаймні з одним стереогенним центром. Цей стереогенний центр може бути наявним в R або S конфігурації. Позначення R і S конфігурацій використовуються тут відповідно до правил, описаних у публікації [Pure Appl. Chem. (1976), 45, 11-30]. В усіх перелічених вище випадках асиметричний атом вуглецю в кращому варіанті є в "S"конфігурації. Вираз "фармацевтично прийнятні солі" в контексті даного опису означає терапевтично активні, нетоксичні основні та кислі сольові форми, котрі можуть утворюватися сполуками згідно з формулою І. Сіль приєднання кислоти сполуки за формулою І, яка може утворюватися в її вільній формі як основа, може отримуватися шляхом реакції вільної основи з відповідною неорганічною кислотою, наприклад, соляною або бромистоводневою, сірчаною, азотною, фосфорною і т.п., або органічною кислотою, наприклад, оцтовою, гідроксіоцтовою, пропановою, молочною, піровиноградною, малоновою, бурштиновою, малеїновою, фумаровою, яблучною, винною, лимонною, метансульфоно 90319 6 вою, етансульфоновою, бензолсульфоновою, ртолуолсульфоновою, цикламіновою, саліциловою, р-аміносаліциловою, памоїновою і т.п. (Handbook of Pharmaceutical Salts, P. Heinrich Stahl & Camille G. Wermuth (Eds), Verlag Helvetica Chimica Acta Zurich, 2002, 329-345). Сполуки за формулою І, які містять кислі протони, можуть бути перетворені на їхні терапевтично активні, нетоксичні сольові форми додавання основ, наприклад, солі металів або амінів, за допомогою реакцій з відповідними органічними і неорганічними основами. Підходящими основними солями такого роду є, наприклад, солі амонію, солі лужних і лужноземельних металів, наприклад, літію, натрію, калію, магнію, кальцію і т.п., солі органічних основ, наприклад, N-метил-D-глюкаміну, гідрабаміну, та солі амінокислот, наприклад, аргініну, лізину і т.п. (Handbook of Pharmaceutical Salts, P. Heinrich Stahl & Camille G. Wermuth (Eds), Verlag Helvetica Chimica Acta - Zurich, 2002, 329-345). З іншого боку, зазначені сольові форми можуть бути перетворені на їхні вільні форми за допомогою реакцій з відповідними основами або кислотами. Сполуки за формулою І та їхні солі можуть використовуватися у формі сольватів, котрі також охоплюються об'ємом даного винаходу. До числа таких сольватів належать, наприклад, гідрати, алкоголяти тощо. Даний винахід стосується також усіх стереоізомерних форм, наприклад, енантіомерів і діастереоізомерів сполук за формулою І або їхніх сумішей (включаючи всі можливі суміші стереоізомерів). Деякі сполуки за формулою І можуть існувати також у таутомерних формах. Хоча такі форми не показані наочно в наведеній вище формулі, наявність їх припускається, і вони також охоплюються об'ємом даного винаходу. При будь-якому посиланні в даному описі на сполуку або сполуки згідно з даним винаходом без вказування конкретної ізомерної форми на увазі мається, що цим охоплюються всі можливі ізомерні форми даної сполуки та їхні суміші. Сполуки згідно з даним винаходом можуть існувати в різних поліморфних формах. Хоча такі форми не показані наочно в наведеній вище формулі, наявність їх припускається, і вони також охоплюються об'ємом даного винаходу. Даний винахід стосується в тому числі процесів виготовлення сполук, які мають формулу І. Для фахівця в галузі хімії органічного синтезу повинно бути цілком зрозуміло, що сполуки за формулою І згідно з даним винаходом можуть виготовлятися за аналогією з відомими процесами, описаними, наприклад, у заявці WO 03/093237. У тих випадках, коли сполука за формулою І має один стереогенний центр, а в її синтезі використовуються процеси, що не є стереоселективними, тоді розділяння суміші стереоізомерів може здійснюватися за одну або декілька стадій і в загальному випадку залучати послідовне розділяння сумішей діастереомерів на рацемати, що їх складають, у кращому варіанті методами хроматографії на ахіральній або хіральній фазі у зворотному 7 або, що краще, у прямому режимі з наступною принаймні однією завершальною стадією розділяння кожного рацемату на його енантіомери в найкращому варіанті за допомогою хроматографії на хіральній фазі у зворотному або, що краще, у прямому режимі. Альтернативним чином, коли використовуються частково стереоселективні процеси синтезу, завершальною стадією може бути розділяння діастереомерів за допомогою хроматографії на ахіральній або хіральній фазі у зворотному або, що краще, у прямому режимі. Було знайдено, що сполуки за формулою І та їхні фармацевтично прийнятні солі можуть використовуватися у широкому діапазоні фармацевтичних показань. Так, сполуки згідно з винаходом можуть використовуватися в лікуванні астми, алергічного риніту, синуситу, кон'юнктивіту, харчової алергії, запальних розладів шкіри, включаючи дерматит, псоріаз, кропивницю, свербіж та екзему, ревматоїдного артриту, запальних хвороб кишечнику, включаючи хворобу Крона та виразковий коліт, множинного склерозу та інших автоімунних розладів, гострого мієлолейкозу, трансплантації й атеросклерозу. Таким чином, іншим своїм аспектом даний винахід торкається застосування сполуки за формулою 1 або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування розладів, наприклад, таких як зазначені вище. Зокрема, даний винахід торкається застосування сполуки за формулою і або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування асоційованих з 4 1 і/або 4 7 запальних або медичних станів і зокрема, наприклад, астми, алергічного риніту, синуситу, кон'юнктивіту, харчової алергії, запальних розладів шкіри, включаючи дерматит, псоріаз, кропивницю, свербіж та екзему, ревматоїдного артриту, запальних хвороб кишечнику, включаючи хворобу Крона і виразковий коліт, множинного склерозу та інших автоімунних розладів, гострого мієлолейкозу, трансплантації та атеросклерозу. Сполуки згідно з даним винаходом можуть використовуватися в лікуванні станів, опосередкованих механізмами адгезії. До числа таких станів належать, у першу чергу, астма, алергічний риніт, синусит, кон'юнктивіт, харчова алергія, запальні розлади шкіри, включаючи дерматит, псоріаз, кропивницю, свербіж та екзему, ревматоїдний артрит, запальні хвороби кишечнику, включаючи хворобу Крона і виразковий коліт, множинний склероз та інші автоімунні розлади, гострий мієлолейкоз, трансплантація й атеросклероз. Лікування пацієнтів, що страждають на асоційовані з 4 1 і/або 4 7 запальні або медичні стани, тобто в першу чергу на астму, алергічний риніт, синусит, кон'юнктивіт, харчову алергію, запальні розлади шкіри, включаючи дерматит, псоріаз, кропивницю, свербіж та екзему, ревматоїдний артрит, запальні хвороби кишечнику, включаючи хворобу Крона і виразковий коліт, множинний склероз та інші автоімунні розлади, гострий мієлолейкоз, трансплантацію й атеросклероз, може здійснюватися шляхом уведення пацієнту ефе 90319 8 ктивної кількості однієї чи більше із вищезазначених сполук або їхніх фармацевтично прийнятних похідних чи солей у фармацевтично прийнятному носію чи розріджувачу з метою зменшення утворення кисневих радикалів. Активні речовини при цьому можуть уводитися будь-яким підходящим шляхом і зокрема, наприклад, перорально, парентерально, внутрішньовенно, інтрадермально, підшкірно, внутрішньом'язовим шляхом або місцевим шляхом в рідкій формі, у формі крему, гелю або в твердій формі, через щоку або за допомогою носового спрею чи аерозолю. Крім того, даний винахід торкається застосування сполук за формулою І у виготовленні медикаменту для терапевтичних цілей. Зокрема, винахід торкається застосування сполук за формулою І у виготовленні медикаменту для лікування станів, в котрих з очевидністю є наявним компонент, асоційований з 4 1 і/або 4 7 інтегринами. Даний винахід торкається, в тому числі, застосування сполук за формулою І у виготовленні медикаменту для лікування астми, алергічного риніту, синуситу, кон'юнктивіту, харчової алергії, запальних розладів шкіри, включаючи дерматит, псоріаз, кропивницю, свербіж та екзему, ревматоїдний артрит, запальні хвороби кишечнику, включаючи хворобу Крона і виразковий коліт, множинний склероз та інші автоімунні розлади, гострий мієлолейкоз, трансплантацію й атеросклероз. Крім того, винахід торкається застосування сполук за формулою І в медикаментах. Зокрема даний винахід торкається застосування сполук за формулою І в медикаментах для лікування астми, алергічного риніту, синуситу, кон'юнктивіту, харчової алергії, запальних розладів шкіри, включаючи дерматит, псоріаз, кропивницю, свербіж та екзему, ревматоїдного артриту, запальних хвороб кишечнику, включаючи хворобу Крона і виразковий коліт, множинного склерозу та інших автоімунних розладів, гострого мієлолейкозу, трансплантації й атеросклерозу. Активність і властивості активних сполук, їхня оральна доступність і стабільність in vitro та in vivo можуть значно відрізнятися поміж оптичних ізомерів описаних тут сполук. В одному з кращих варіантів здійснення винаходу активну сполуку вводять в енантіомерно збагаченій формі, тобто практично у формі одного ізомеру. Даний винахід стосується також процесу лікування асоційованих з 4 1 і/або 4 7 запальних або медичних станів (у першу чергу астми, алергічного риніту, синуситу, кон'юнктивіту, харчової алергії, запальних розладів шкіри, включаючи дерматит, псоріаз, кропивницю, свербіж та екзему, ревматоїдного артриту, запальних хвороб кишечнику, включаючи хворобу Крона і виразковий коліт, множинного склерозу та інших автоімунних розладів, гострого мієлолейкозу, трансплантації й атеросклерозу) у ссавця, що потребує такого лікування, який (процес) включає у себе введення пацієнту терапевтичної дози принаймні однієї сполуки за формулою І або її фармацевтично прийнятної солі. 9 Процеси згідно з винаходом включають у себе введення ссавцю (переважно людині), що страждає на той чи інший із вищеперелічених станів або розладів, сполуки згідно з даним винаходом у кількості, достатній для полегшення або відвертання даного розладу або стану. При цьому сполуку вводять у будь-якій дозованій лікарській формі, включаючи, наприклад, таку, що містить від 0,01 до 2000мг, а краще - від 0,05 до 500мг активного інгредієнта на однодозову лікарську форму. Використовуваний тут термін "лікування" охоплює своїм значенням як цілюще лікування, так і профілактичне лікування. Використовуваний тут термін "практично" стосується складу, що містить більше 95% одного ізомеру, а в кращому варіанті 98%. Під терміном "цілюще лікування" тут мається на увазі ефективність лікування наявного симптоматичного епізоду того чи іншого розладу або стану. Під терміном "профілактичне лікування" тут мається на увазі запобігання виникненню або рецидиву того чи іншого розладу або стану. Запропоновані сполуки можуть використовуватися в керуванні клітинною адгезією і, зокрема, у профілактиці та лікуванні хвороб або розладів, у котрих певну роль відіграє транссудація лейкоцитів. Отже даний винахід поширюється в тому числі на таке застосування, а також на застосування запропонованих сполук у виготовленні медикаменту для лікування таких хвороб або розладів. До числа хвороб або розладів цього типу входять запальний артрит і, зокрема, ревматоїдний артрит, васкуліт або полідерматоміозит, множинний склероз, трансплантація, діабет, запальний дерматоз, наприклад псоріаз або дерматит, астма і запальні хвороби кишечнику. До одного із аспектів даного винаходу входять процеси лікування а4-асоційованих ракових хвороб (включаючи як тверді, так і гематопоетичні злоякісні утворення). Такими видами ракових хвороб є, наприклад, недрібноклітинний рак легенів, рак підшлункової залози, рак простати, рак нирок, цервікальний рак, рак яєчників, колоректальний рак, рак молочної залози, ендометріальний рак, рак сечового міхура, злоякісна меланома, семіноми, рак щитовидної залози, гострий мієлолейкоз і рак шлунку. Результати, отримані при застосуванні сполук за формулою І, свідчать про їхній сильний фармакологічний ефект. Для лікування хвороб сполуки за формулою І або їхні фармацевтично прийнятні солі можуть вживатися в ефективних щоденних дозах і вводитися у формі фармацевтичного складу. Таким чином, один із варіантів здійснення даного винаходу стосується фармацевтичного складу, який містить ефективну кількість сполуки за формулою І або її фармацевтично прийнятної солі в комбінації з фармацевтично прийнятним розріджувачем або носієм. Фармацевтичний склад згідно з даним винаходом готують шляхом ретельного змішування однієї чи більше сполук за формулою І або їхніх фарма 90319 10 цевтично прийнятних солей з фармацевтичним розріджувачем або носієм за допомогою звичайних фармацевтичних технологій, добре відомих фахівцям у даній галузі. Підходящі розріджувачі та носії можуть приймати найрізноманітніші форми залежно від вибраного шляху введення ліків, тобто, наприклад, перорального, ректального або парентерального. Фармацевтичні склади, що містять сполуки згідно з даним винаходом, можуть уводитися, наприклад, перорально або парентерально, тобто, внутрішньовенним, внутрішньом'язовим, підшкірним або внутрішньооболонковим шляхами. Підходящі для введення фармацевтичні склади можуть мати тверду або рідку форму, а саме, наприклад, форму таблеток, пілюль, драже, желатинових капсул, розчинів, сиропів і т.п. Для їх готування активний інгредієнт може змішуватися, наприклад, з інертним розріджувачем або нетоксичним, фармацевтично прийнятним носієм, котрим може бути, наприклад, крохмаль або лактоза. У разі потреби такі фармацевтичні склади можуть також містити: сполучне, котрим може служити мікрокристалічна целюлоза, трагакантова камедь або желатин; дезінтегратор, котрим може служити альгінова кислота; мастило, котрим може бути стеарат магнію; засіб для полегшення ковтання, наприклад колоїдний двоокис кремнію; підсолоджувач, наприклад сахарозу або сахарин; барвники та ароматизатори, наприклад перцева м'ята або метилсаліцилат. Винаходом охоплюються також склади, що є здатними вивільняти активну речовину регульованим чином. Фармацевтичні склади, які можуть використовуватися у парентеральному введенні, мають звичайну форму, наприклад, водних або олійних розчинів чи суспензій, які зазвичай поміщаються в ампули, разові шприци, скляні або пластмасові пляшечки чи в контейнери для вливання. Окрім активного інгредієнта, ці розчини або суспензії в разі потреби можуть також містити стерильний розріджувач, наприклад, воду для ін'єкцій, фізіологічний розчин, олію, поліетиленгліколь, гліцерин, пропіленгліколь або інші синтетичні розчинники, антибактеріальні засоби, такі як бензиловий спирт, антиоксиданти, такі як аскорбінова кислота або бісульфіт натрію, хелатні добавки, такі як етилендіамін-тетраоцтова кислота, буфери, наприклад ацетати, цитрати або фосфати, та засоби регулювання осмолярності, наприклад хлорид натрію або декстрозу. Такі фармацевтичні форми готують за допомогою звичайних процесів, що є добре відомими в галузі фармацевтики. Кількість активного інгредієнта у фармацевтичних складах може лежати в широкому діапазоні концентрацій і залежить від низки різноманітних чинників, серед яких стать, вік, маса тіла і медичний стан пацієнта, а також спосіб уведення. Отже кількість сполуки за формулою І у складах для перорального введення становить принаймні 0,5%(мас.) і може досягати 80%(мас.) відносно загальної маси складу. 11 90319 12 Для пероральних складів денна доза у кращому варіанті становить від 0,01 до 2000 міліграмів (мг) сполуки за формулою І. У складів для парентерального введення кількість сполуки за формулою І становить принаймні 0,5%(мас.) і може досягати 33%(мас.) відносно загальної маси складу. У кращих варіантах парентеральних складів величина одиничної дози сполуки за формулою І лежить в інтервалі від 0,01мг до 2000мг. Денна доза сполук за формулою І може варіювати в широких межах і в загальному випадку лежить в інтервалі від 0,01 до 2000мг. Але цілком зрозуміло, що конкретні дози в кожному випадку будуть залежати від індивідуальних особливостей пацієнта і визначатися лікарем-куратором. Нижче наведені приклади, метою котрих є лише ілюстрація даного винаходу і котрі не повинні розглядатися як такі, що будь-яким чином його обмежують. Для фахівця в даній галузі повинно бути цілком зрозуміло, що в ці приклади можуть вноситися зміни і модифікації, які, тим не менше, не будуть виходити за рамки ідеї та об'єму винаходу. Згадані у прикладах найменування сполук, дані Міжнародним союзом з чистої та прикладної хімії (IUPAC), були створені ACD version 6.00. Якщо в даних прикладах не зазначено іншого, то аналіз властивостей сполук здійснювався за допомогою таких методів та приладів: ЯМР спектри записували на спектрометрах Bruker AV-300 і DRX-400 з робочими частотами 300,13МГц і 400,13МГц для протонів, використовуючи програмний пакет Bruker XWINNMR. Усі спектри, за винятком деяких, зазначених окремо, були отримані при кімнатній температурі. Значення хімічного зсуву подані в мільйонних частинах (млн. ч.) відносно внутрішнього TMS стандарту або сигналу залишкового розчинника. HPLC-хроматографічний аналіз (методом рідинної хроматографії з високою розрізнювальною спроможністю) проводили за допомогою одного із таких приладів: HP 1100 (діодна решітка), підключеного до мас-спектрометра Finnigan LC-Q Mass Spectrometer, режим електророзпорошування (ESI) з позитивною/негативною іонізацією, довжина хвилі детектора DAD 200-400нм, обладнаного аналітичною колонкою LUNA С18(2), DP 5мкм, 100X4,6мм. Градієнтний хід від розчинника А(вода+0,08% мурашина кислота) до розчинника В (ацетонітрил+0,08% мурашина кислота) за 6,5хв. з утримуванням при 95% В упродовж 9,7хв. і при 5% В упродовж 11,82хв. Витрата елюенту була встановлена на рівень 3мл/хв. Хроматографію проводили при температурі 35°С. У наведених нижче прикладах використовуються такі скорочення: TFA Трифтороцтова кислота TEA Триетиламін DCM Дихлорметан NaOH Гідроксид натрію НСІ Соляна кислота NaHCO3 Гідрогенкарбонат натрію MgSO4 Сульфат магнію THF Тетрагідрофуран МgСІ Н2О Моногідрат хлориду магнію NaCI Хлорид натрію Н2О2 Перекис водню МеОН Метанол ЕtOН Етанол EtAc Етилацетат СаСІ2 Хлорид кальцію KСІ Хлорид калію МnСІ2 Хлорид марганцю NaH2PO4 2H2O Одноосновний дигідрат фосфату натрію ТМВ Тетраметилбензидин PBS Фосфат-забуферений фізіологічний розчин TBS Трис-забуферений фізіологічний розчин ADP Аденозин-5'-дифосфат BSA Альбумін бичачої сироватки FCS Фетальна теляча сироватка RT Кімнатна температура W Маса V Об'єм Приклад 1. Синтез метил-(2S)-2-[(3,5дихлорізонікотиноїл)аміно]-3-(2-(2,6-дихлорфеніл)6-хінолініл]пропаноату. (1) Метил-(2S)-2-[(трет-бутоксикарбоніл)аміно]-3[2-(2,6-дихлорфеніл)-6-хінолініл]пропаноат (сполуку №26, Міжнародна патентна заявка WO 03/093237) (500мг, 1,05ммоль) розчинили в DCM (5мл) і до розчину по краплях протягом 10 хвилин добавили розчин TFA (0,8мл, 10,5ммоль) у DCM (2мл). По завершенні додавання реакційну суміш перемішували при кімнатній температурі до наступного дня. Після цього суміш охолодили до 0°С і до неї по краплях протягом 10 хвилин добавили розчин TEA (2,1мл, 15,8ммоль) у DCM (2мл). Далі реакційну суміш охолодили до -10°С і до неї по краплях протягом 10 хвилин добавили 3,5дихлорізонікотиноїлхлорид (Bioorg. Med. Chem. 13 Lett 2002, 12, 1591-1594) (663мг, 3,0ммоль), після чого суміш залишили відігріватися до кімнатної температури. За 1 годину реакційну суміш промили водним розчином НСІ (1н., 10мл), а потім водним розчином NaHCO3 (насиченим, 10мл). Шар DCM просушили над MgSO4, профільтрували, і розчинник видалили у вакуумі, отримавши тверду речовину не цілком білого кольору. Цю речовину очистили за допомогою флеш-хроматографії (елюент EtAc) і в результаті отримали зазначену в заголовку сполуку у вигляді білого порошку (432мг, 75%) LCMS М+1 (552, 550, 548), час утримування 3,82хв, 1Н ЯМР, 300МГц, d6-DMSO - 9,50(1 Η, d), 8,63 (2H, s), 8,42 (1H, d), 7,98 (1H, d), 7,94 (1H, d), 7,78 (1H, dd), 7,65 (2H, d), 7,55 (2H, m), 4,95 (1H, m), 3,74 (3H, s), 3,45 (1H, dd), 3.20 (1H, dd). Приклад 2. Синтез (2S)-2-[(3,5дихлорізонікотиноїл)аміно]-3-[2-(2,6-дихлорфеніл)6-хінолініл]пропанової кислоти. (2) Метил-(2S)-2-[(3,5-дихлорізонікотиноїл)аміно]3-[2-(2,6-дихлорфеніл)-6-хінолініл]пропаноат (410мг, 0,75ммоль) розчинили в THF (2мл) і по краплях протягом 3 годин додали до перемішуваного водного розчину NaOH (2Μ, 2,5мл). По завершенні додавання утворену реакційну суміш перемішували при кімнатній температурі впродовж 1год., після чого з неї під вакуумом видалили THF. Утворену в результаті суспензію розбавили водою (6мл) і підкислили до рН 4 соляною кислотою (12М). Речовину, що випала в осад, зібрали шляхом фільтрації, промили водою (15мл) і сушили до наступного дня під вакуумом (40°С). У результаті отримали цільовий продукт у вигляді білого порошку (274мг, 68%). Аналіз методом рідинної хроматографії з мас-спектроскопією: LCMS М+1 (535, 537), М-1 (534, 536), час витримування 3,39хв., 1Н ЯМР, 300МГц, d6-DMSO - 13,00 (1Н, brs), 9,40 (1Н, d), 8,65 (2Н, s), 8,42 (1Н, d), 7,98 (1Н, d), 7,94 (1Н, d), 7,78 (1Н, dd), 7,65 (2Н, d), 7,54 (2Н, m), 4,90 (1Н, m), 3,45 (1Н, brs), 3,20 (1Н, dd). Хіральна HPLCхроматографія: ее (енантіомерний надлишок) 97%, час витримування 6,29хв. (Колонка: CHIRALPAK AD 250* 4,6мм, 10мкм; розчинник А 1: пропанол+0,1% TFA; розчинник В: ізогексан; ізократичний 20% А: 80% В; температура 40°С; період вимивання 15хв.; детектування на 280нм). Приклад 3 У даному прикладі описані клітинні випробування, що демонструють потужність і селективність сполук згідно з даним винаходом. В усіх цих дослідах визначали величину ІС50 відповідних випробуваних сполук, яка виражає собою концентрацію сполуки, потрібну для досягнення 50% інгібування клітинної адгезії, де за 100% приймається адгезія, виміряна при відсутності випробуваної сполуки, а за 0% - поглинання в лунках без клітин. 4 1-Інтегрин-залежна адгезія клітин Джеркета (Jurkat) з VCAM-lg Планшети NUNC на 96 лунок покривали F(аb)2-фрагментним IgG Fcv-специфічним антитілом кози проти людини (Jackson Immuno Research 109-006-098: 100мкл в концентрації 2мкг/мл у 0,1Μ NaHCO3, pH 8,4) і витримували протягом ночі при 4°С. Після цього планшети промивали (3х) у PBS і блокували протягом 1год. у PBS/1% BSA при кім 90319 14 натній температурі на коливному стенді. Після промивання (3х у PBS) на планшети додавали 9нг/мл очищеного 2d VCAM-lg, розбавленого у PBS/1% BSA, і планшети витримували на коливному стенді впродовж 60 хвилин при кімнатній температурі. Після цього планшети знов промивали (3х у PBS) і на них проводили випробування при температурі 37°С упродовж 30хв. у загальному об'ємі 200мкл, в якому містилося 2,5x105 клітини Джеркета (Jurkat) при наявності або за відсутності титрованих сполук, що піддавалися випробуванням. Кожний планшет промивали (2х) живильним середовищем, і зчеплені клітини фіксували шляхом обробки їх 100мкл МеОН протягом 10 хвилин, а потім ще раз промивали. Далі у планшети протягом 5 хвилин при кімнатній температурі додавали 100мкл 0,25%. чайної китайської рози (Sigma R4507) у PBS, і планшети промивали (3х) у PBS. Після цього додавали 100мкл 50%(об.) EtOH у PBS, планшети витримували в цьому розчині впродовж 60хв., а після цього вимірювали поглинання (570нм). 4 7-Iнтегрин-залежна адгезія JY-клітин з MAdCAM-lg Ці випробування проводили згідно з методикою, аналогічною описаній вище для 4 1випробувань, за винятком того, що замість 2d VCAM-lg використовували MAdCAM-lg (150нг/мл), а замість клітин Джеркета (Jurkat) використовували сублінію -лімфобластоїдної клітинної лінії JY. Величини ІС50 випробуваних сполук визначали так, як описано для випробувань на 4 1-інтегрині. Випробування на 4-інтегрин-залежне зв'язування з VCAM цілісної крові До FACS-пробірок (клітинного сортера зі збудженням флуоресценції) помістили такі реагенти: 3мкл 100мМ МnСІ2 (у концентрації, 100-кратно вищій за потрібну), 1мкл 1мг/мл стрептавідин-FITC (постачальник: фірма Pierce, у концентрації, 100кратно вищій за потрібну), 2мкл 500мкг/мл біотинільованої hVCAM-1-mFc (у концентрації, 50-кратно вищій за потрібну) і 2мкл послідовно розбавленої випробуваної сполуки у концентрації, 50-кратно вищій за бажану кінцеву концентрацію. Після цього в кожну FACS-пробірку додали 100мкл гепаринізованої крові людини від здорових донорів, пробірки герметично закрили і коливали впродовж 30 хвилин при кімнатній температурі. Далі до пробірок упродовж 5 хвилин при кімнатній температурі додали по 2мл лізисного розчину "FACS Lysing Solution" (BD Biosciences), пробірки центрифугували зі швидкістю 1200об./хв., двічі промили в 3мл TBS, а кінцеву суспензію - в 100мкл TBS. Після цього проводили проточну цитометрію на приладі Becton Dickinson FACScan, визначивши таким чином відсоток клітин у лімфоцитному вікні, здатних зв'язувати VCAM-молекули. 5 1-Iнтегрин-залежна адгезія K562-клітин з фібронектином 96-Лункові планшети для культивування тканин покривали фібронектином людської плазми (Sigma F0895) в концентрації 5мг/мл у PBS і витримували протягом 2год. при 37°С. Планшети промивали (3х у PBS) і блокували впродовж 1год. 15 90319 у 100мкл PBS/1% BSA при кімнатній температурі на коливному стенді. Блоковані планшети промивали (3х у PBS), і після цього проводили випробування при 37°С у загальному об'ємі 200мкл, що 5 містив 2,5x10 K562-клітин, форбол-12-міристат13-ацетат в концентрації 10нг/мл і титровані випробувані сполуки (або без них). Період інкубування становив 30 хвилин. Після цього кожний планшет фіксували і забарвлювали аналогічно описаному вище для 4 1-випробувань. m 2-Залежна адгезія поліморфно-ядерних нейтрофілів людини з пластмасою 96-Лункові планшети для культивування тканин покривали середовищем RPMI 1640/10% FCS і витримували протягом 2год. при температурі 37°С. До лунок додавали 2x105 свіжо відокремлених венозних поліморфно-ядерних нейтрофілів (ΡΜΝ) людини у загальному об'ємі 200мкл при наявності 10нг/мл форбол-12-міристат-13-ацетату і при наявності або за відсутності випробуваних сполук, та інкубували протягом 20хв. при температурі 37°С, а потім протягом 30хв. при кімнатній температурі. Після цього планшети промивали у живильному середовищі і до кожної лунки додавали 100мкл 0,1%(мас./об.) гексадецилтриметиламонійброміду (Sigma H5882) у 0,05Μ калійфосфатному буфері, рН 6,0. Далі планшети витримували на коливальному стенді при кімнатній температурі впродовж 60хв. Потім за допомогою ТМВ оцінювали активність ендогенної пероксидази, для чого зразки PMN-лізату змішували з 0,22% Н2О2 (Sigma) і 50мкг/мл ТМВ (Boehringer Mannheim) у 0,1Μ натрій-ацетат/цитратному буфері, рН 6,0, і вимірювали поглинання на 630нм. IIb/ 3-Залежна агрегація тромбоцитів людини Агрегацію тромбоцитів людини оцінювали шляхом вимірювання імпедансу агрегації на хронологічному люмінесцентному агрегометрі суцільної крові "Chronolog Whole Blood Lumiaggregometer". Збагачену на тромбоцити плазму (PRP: platelet-rich plasma) людини готували Комп’ютерна верстка О. Гапоненко 16 шляхом центрифугування свіжої венозної крові людини, підданої антикоагуляційній обробці 0,38% (об.) тринатрійцитратом при 220 г упродовж 10хв. і розбавленої до густини клітин 6 108/мл в автологічній плазмі. Кювети містили однакові об'єми PRP і профільтрованого буферу Тирода (Tyrode) (г/літр: NaCI 8,0; MgCI2-H2O 0,427; СаСІ2 0,2; KСІ 0,2; Dглюкозу 1,0; NaHCO3 1,0; NaH2PO4.2H2O 0,065). Моніторинг агрегації проводили після додавання 2,5мкМ ADP (Sigma) при наявності або за відсутності інгібіторів. v 3-інтегрин-залежна адгезія JY-клітин з вітронектином 96-Лункові NUNC планшети покривали вітронектином людини (Promega) у концентрації 2,5мкг/мл у PBS і витримували протягом 2 годин при температурі 37°С. Планшети промивали (2х у PBS), а потім блокували впродовж 1год. у 100мкл PBS/1%BSA при кімнатній температурі на коливному стенді. Блоковані планшети промивали (2х у PBS), після чого на них проводили випробування при 37°С у загальному об'ємі 200мкл, що містив 2x105 JY-клітин, форбол-12-міристат-13-ацетат в концентрації 10нг/мл за відсутності або при наявності титрованої випробуваної сполуки. JY-клітини попередньо інкубували впродовж 15 хвилин з 5мкг/мл моноклонального антитіла проти 2інтегринів під назвою 6,5Е для запобігання 2залежному неспецифічному зв'язуванню. Кожний планшет фіксували і забарвлювали так, як описано вище для 4 1-випробувань. В описаних вище випробуваннях сполуки згідно з винаходом у загальному випадку мали величини IC50 не більше 1мкМ як для інгібування 4 1, так і для інгібування 4 1. В інших випробуваннях, що стосувалися -інтегринів інших підгруп, ті самі сполуки мали величини ІС50>50мкМ і вище, демонструючи, таким чином, потужність і селективність їхньої дії щодо 4-інтегринів. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською2,6 quinolinyl derivatives, processes for preparing them and their use as medicament
Автори англійськоюPerry Benjamin
Назва патенту російськоюСоединения 2,6-хинолинила и их применение как лекарственного средства
Автори російськоюПерри Бенджамин
МПК / Мітки
МПК: A61K 31/4709, A61P 29/00, C07D 401/12
Мітки: сполуки, лікарського, засобу, 2,6-хінолінілу, застосування
Код посилання
<a href="https://ua.patents.su/8-90319-spoluki-26-khinolinilu-ta-kh-zastosuvannya-yak-likarskogo-zasobu.html" target="_blank" rel="follow" title="База патентів України">Сполуки 2,6-хінолінілу та їх застосування як лікарського засобу</a>
Попередній патент: Вагон метрополітену з вентиляційним обладнанням пасажирського салону
Наступний патент: Пристрій для розділення радіоімпульсних сигналів за несучою частотою
Випадковий патент: Система навісних вентильованих фасадів сиал












