Дигідроптеридинони, спосіб їх одержання та їх застосування як лікарського засобу
Номер патенту: 80743
Опубліковано: 25.10.2007
Автори: Штеегмайер Мартін, Шнапп Гізела, Брайтфельдер Штеффен, Брандль Тріксі, Квант Йенс Юрген, Айкмайер Крістіан, Кольбатцкі Флоріан, Баум Анке, Хоффманн Маттіас, Грауерт Маттіас, Золька Флавіо
Формула / Реферат
1. Сполуки загальної формули (І)
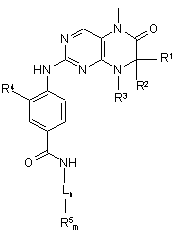 , (І)
, (І)
у якій
R1 та R2 мають ідентичні або різні значення й означають водень або необов'язково заміщений С1-С6алкіл, або
R1 та R2 спільно утворюють 2-5-членний алкільний місток, що може містити 1-2 гетероатоми,
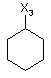
R3 являє собою водень або залишок, що вибраний із групи, яка включає необов'язково заміщений С1-С12алкіл, С2-С12алкеніл, С2-С12алкініл та С6-С14арил, або
залишок, що вибраний із групи, яка включає необов'язково заміщений і/або з'єднаний місточковим зв'язком С3-С12циклоалкіл, С3-С12циклоалкеніл, С7-С12поліциклоалкіл, С7-С12поліциклоалкеніл, С5-С22спіроциклоалкіл, С3-С12гетероциклоалкіл, що містить 1-2 гетероатоми, та С3-С12гетероциклоалкеніл, що містить 1-2 гетероатоми, або
R1 та R3 або R2 та R3 спільно утворюють насичений або ненасичений С3-С4алкільний місток, що може містити 1 гетероатом,
R4 являє собою залишок, що вибраний із групи, яка включає водень, -CN, гідроксигрупу, -NR6R7 та галоген, або
залишок, що вибраний із групи, яка включає необов'язково заміщений С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С1-С5алкілоксигрупу, С2-С5алкенілоксигрупу, С2-С5алкінілоксигрупу, С1-С6алкілтіогрупу, С1-С6алкілсульфоксогрупу та С1-С6алкілсульфоніл,
L являє собою лінкер, що вибраний з групи, яка включає необов'язково заміщений С2-С10алкіл, С2-С10алкеніл, С6-С14арил, -С2-С4алкіл-С6-С14арил, -С6-С14арил-С1-С4алкіл, необов'язково з'єднаний місточковим зв'язком С3-С12циклоалкіл та гетероцикліл, що містить 1 або 2 атоми азоту,
n означає 0 або 1,
m означає 1 або 2,
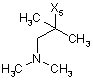
R5 являє собою залишок, що вибраний із групи, яка включає необов'язково заміщений морфолініл, піперидиніл, піперазиніл, піперазинілкарбоніл, піролідиніл, тропеніл, R8-дикетометилпіперазиніл, сульфоксоморфолініл, сульфонілморфолініл, тіоморфолініл, -NR8R9 та азациклогептил,
R6 та R7 мають ідентичні або різні значення й означають водень або С1-С4алкіл, а
R8 та R9 являють собою незаміщені азотні замісники при R5, мають ідентичні або різні значення й означають або водень, або залишок, що вибраний із групи, яка включає С1-С6алкіл, -С1-С4алкіл-С3-С10циклоалкіл, С3-С10циклоалкіл, С6-С14арил, -С1-С4алкіл-С6-С14арил, піраніл, піридиніл, піримідиніл, С1-С4алкілоксикарбоніл, С6-С14арилкарбоніл-, С1-С4алкілкарбоніл-, С6-С14арилметилоксикарбоніл-, С6-С14арилсульфоніл-, С1-С4алкілсульфоніл- та С6-С14арил-С1-С4алкілсульфоніл-,
необов'язково у вигляді їх таутомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей.
2. Сполуки за п. 1, у яких
R1-R4, R6 та R7 мають зазначені вище значення, а
L являє собою лінкер, що вибраний із групи, яка включає необов'язково заміщений С2-С10алкіл, С2-С10алкеніл, С6-С14арил, -С2-C4алкіл-С6-С14арил, -С6-С14арил-С1-C4алкіл, необов'язково з'єднаний місточковим зв'язком С3-С12циклоалкіл та гетероцикліл, що містить 1 або 2 атоми азоту,
n означає 1,
m означає 1 або 2,
R5 являє собою зв'язаний з L через атом азоту залишок, що вибраний із групи, яка включає необов'язково заміщений морфолініл, піперидиніл, R8-піперазиніл, піролідиніл, тропеніл, R8-дикетометилпіперазиніл, сульфоксоморфолініл, сульфонілморфолініл, тіоморфолініл, -NR8R9 та азациклогептил,
R8 та R9 являють собою незаміщені азотні замісники при R5, мають ідентичні або різні значення й означають водень або залишок, що вибраний із групи, яка включає С1-С6алкіл, -С1-С4алкіл-С3-С10циклоалкіл, С3-С10циклоалкіл, С6-С14арил, -С1-С4алкіл-С6-С14арил, піраніл, піридиніл, піримідиніл, С1-С4алкілоксикарбоніл, С6-С14арилкарбоніл-, С1-С4алкілкарбоніл-, С6-С14арилметилоксикарбоніл-, С6-С14арилсульфоніл-, С1-С4алкілсульфоніл- та С6-С14арил-С1-С4алкілсульфоніл-,
необов'язково у вигляді їх таутомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей.
3. Сполуки за п. 1, у яких
R1-R4, R6 та R7 мають зазначені вище значення, а
L являє собою лінкер, що вибраний із групи, яка включає необов'язково заміщений С2-С10алкіл, С2-С10алкеніл, С6-С14арил, -С2-C4алкіл-С6-С14арил, -С6-С14арил-С1-C4алкіл, необов'язково з'єднаний місточковим зв'язком С3-С12циклоалкіл та гетероцикліл, що містить 1 або 2 атоми азоту,
n означає 0 або 1,
m означає 1 або 2,
R5 являє собою зв'язаний з L через атом вуглецю залишок, що вибраний із групи, яка включає R8-піперидиніл-, R8R9-піперазиніл-, R8-піролідиніл, R8-піперазинілкарбоніл-, R8-тропеніл, R8-морфолініл та R8-азациклогептил, а
R8 та R9 являють собою незаміщені азотні замісники при R5, мають ідентичні або різні значення й означають водень або залишок, що вибраний із групи, яка включає С1-С6алкіл, -С1-С4алкіл-С3-С10циклоалкіл, С3-С10циклоалкіл, С6-С14арил, -С1-С4алкіл-С6-С14арил, піраніл, піридиніл, піримідиніл, С1-С4алкілоксикарбоніл, С6-С14арилкарбоніл-, С1-С4алкілкарбоніл-, С6-С14арилметилоксикарбоніл-, С6-С14арилсульфоніл-, С1-С4алкілсульфоніл- та С6-С14арил-С1-С4алкілсульфоніл-,
необов'язково у вигляді їх таутомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей.
4. Сполуки за будь-яким з пп. 1-3, у яких
L, m, n та R3-R9 мають зазначені вище значення, а
R1 та R2 мають ідентичні або різні значення й означають залишок, що вибраний з групи, яка включає водень, Me, Et, Pr, або
R1 та R2 спільно утворюють С2-С4алкільний місток,
необов'язково у вигляді їх таутомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей.
5. Сполуки за будь-яким з пп. 1-4, у яких
R1, R2, m, n та R5-R8 мають зазначені вище значення, а
R3 являє собою залишок, що вибраний з групи, яка включає необов'язково заміщений С1-С10алкіл, С3-С7циклоалкіл, С3-С6гетероциклоалкіл та С6-С14арил, або
R1 та R3 або R2 та R3 спільно утворюють насичений або ненасичений С3-С4алкільний місток, що може містити 1-2 гетероатоми,
R4 являє собою залишок, що вибраний з групи, яка включає водень, ОМе, ОН, Me, Et, Pr, OEt, NHMe, NH2, F, Cl, Br, O-пропаргіл, O-бутиніл, CN, SMe, NМe2, CONH2, етиніл, пропініл, бутиніл та аліл, та
L являє собою лінкер, що вибраний з групи, яка включає необов'язково заміщений феніл, фенілметил, циклогексил і розгалужений С1-С6алкіл,
необов'язково у вигляді їх таутомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей.
6. Сполука формули (І) за будь-яким з пп. 1-5 для застосування як лікарський засіб.
7. Сполука формули (І) за будь-яким з пп. 1-5 для застосування як лікарський засіб, що має антипроліферативну дію.
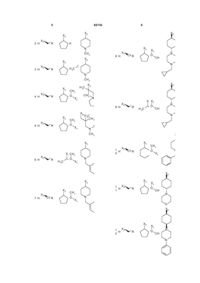
8. Сполуки загальної формули (І) за п. 1, у якій замісники для кожної конкретної сполуки мають значення, наведені у одному рядку таблиці:
R1
R2
Конфіг. R1 aбo R2
R3
R4
Ln-R5m
1
H
![]()
R
![]()
2
H
![]()
R
![]()
H
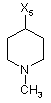
3
H
![]()
R
![]()
![]()

4
H
![]()
R
![]()
![]()
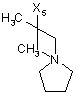
5
H
![]()
R
![]()
![]()
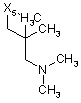
6
H
![]()
R
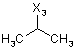
![]()
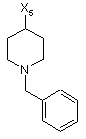
7
H
![]()
R
![]()
![]()

8
H
![]()
R
![]()
![]()
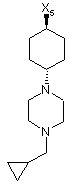
9
H
![]()
R
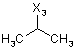
![]()

10
H
![]()
R
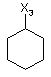
![]()
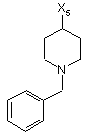
11
H
![]()
R
![]()
![]()

12
H
![]()
R
![]()
![]()
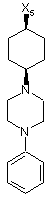
13
H
![]()
R
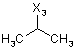
![]()
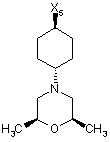
14
H
![]()
R
![]()
 ,
,
де символи Х1, Х2, Х3, Х4 та Х5, що наведені в цій таблиці, означають положення, у якому відповідний залишок R1, R2, R3, R4 та L-R5 приєднаний до іншої частини молекули загальної формули (І).
9. Фармацевтична композиція, що містить як діючу речовину одну або декілька сполук загальної формули (І) за будь-яким з пп. 1-4 або її (їх) фізіологічно прийнятні солі, при необхідності разом зі звичайними допоміжними речовинами і/або носіями.
10. Спосіб одержання сполуки загальної формули (І)
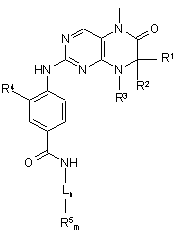 , (І)
, (І)
у якій R1-R5, m, n та L мають значення, що зазначені в пп. 1-5, який відрізняється тим, що сполуку загальної формули (II)
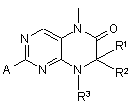 , (II)
, (II)
у якій R1-R3 мають значення, що зазначені в пп. 1-4, а А означає відхідну групу, яка вибрана з O-метилу, -SCN, хлору, брому, йоду, метансульфонілу, трифторметансульфонілу або n-толуолсульфонілу, піддають взаємодії з необов'язково заміщеною сполукою загальної формули (III)
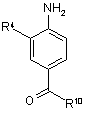 , (III)
, (III)
у якій R4 має значення, що зазначені в пп. 1-5, a R10 являє собою групу ОН, NH-L- R5, -O-метил або -O-етил, і потім за певних умов продукт загальної формули (IV)
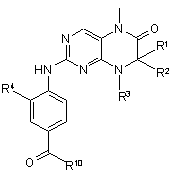 , (IV)
, (IV)
у якій R1-R4 мають значення, що зазначені в пп. 1-5, а R10 являє собою групу ОН, -NH-L-R5, -O-метил або -O-етил, при необхідності після попереднього гідролізу складноефірної групи -COR10, піддають взаємодії з аміном загальної формули (V)
NH2-L-R5m (V),
у якій R5 має значення, що зазначені в пп. 1-5.
11. Сполука формули (II)
 , (II)
, (II)
у якій R1-R3 мають значення, що зазначені в пп. 1-5, а А означає відхідну групу, яка вибрана з O-метилу, -SCN, хлору, брому, йоду, метансульфонілу, трифторметансульфонілу або n-толуолсульфонілу.
12. Сполука, яка є проміжною для одержання сполуки загальної формули І за будь-яким з пп. 1-5, у якій
L являє собою циклогексил,
n означає 1,
m означає 1, та
R5 являє собою 4-циклопропілметилпіперазиніл,
причому зазначена проміжна сполука являє собою цис- або транс-4-(4-циклопропілметилпіперазин-1-іл)-циклогексиламін
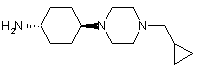
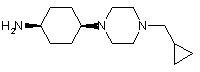 .
.
Текст
1. Сполуки загальної формули (І) C2 2 (19) 1 3 80743 С14арилкарбоніл-, С1-С4алкілкарбоніл-, С6С14арилметилоксикарбоніл-, С6-С14арилсульфоніл, С1-С4алкілсульфонілта С6-С14арил-С 1С4алкілсульфоніл-, необов'язково у вигляді їх таутомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей. 2. Сполуки за п. 1, у яких R1-R4, R6 та R7 мають зазначені вище значення, а L являє собою лінкер, що вибраний із групи, яка включає необов'язково заміщений С 2-С10алкіл, С2С10алкеніл, С6-С14арил, -С2-C4алкіл-С 6-С14арил, С6-С14арил-С 1-C4алкіл, необов'язково з'єднаний місточковим зв'язком С3-С12циклоалкіл та гетероцикліл, що містить 1 або 2 атоми азоту, n означає 1, m означає 1 або 2, R5 являє собою зв'язаний з L через атом азоту залишок, що вибраний із групи, яка включає необов'язково заміщений морфолініл, піперидиніл, R8-піперазиніл, піролідиніл, тропеніл, R8дикетометилпіперазиніл, сульфоксоморфолініл, сульфонілморфолініл, тіоморфолініл, -NR8R9 та азациклогептил, R8 та R9 являють собою незаміщені азотні замісники при R5, мають ідентичні або різні значення й означають водень або залишок, що вибраний із групи, яка включає С1-С6алкіл, -С1С4алкіл-С3-С10циклоалкіл, С3-С10циклоалкіл, С6С14арил, -С1-С4алкіл-С 6-С14арил, піраніл, піридиніл, піримідиніл, С1-С4алкілоксикарбоніл, С6С14арилкарбоніл-, С1-С4алкілкарбоніл-, С6С14арилметилоксикарбоніл-, С6-С14арилсульфоніл, С1-С4алкілсульфонілта С6-С14арил-С 1С4алкілсульфоніл-, необов'язково у вигляді їх таутомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей. 3. Сполуки за п. 1, у яких R1-R4, R6 та R7 мають зазначені вище значення, а L являє собою лінкер, що вибраний із групи, яка включає необов'язково заміщений С 2-С10алкіл, С2С10алкеніл, С6-С14арил, -С2-C4алкіл-С 6-С14арил, С6-С14арил-С 1-C4алкіл, необов'язково з'єднаний місточковим зв'язком С3-С12циклоалкіл та гетероцикліл, що містить 1 або 2 атоми азоту, n означає 0 або 1, m означає 1 або 2, R5 являє собою зв'язаний з L через атом вуглецю залишок, що вибраний із групи, яка включає R8піперидиніл-, R8R9-піперазиніл-, R8-піролідиніл, R8піперазинілкарбоніл-, R8-тропеніл, R8-морфолініл та R8-азациклогептил, а R8 та R9 являють собою незаміщені азотні замісники при R5, мають ідентичні або різні значення й означають водень або залишок, що вибраний із групи, яка включає С1-С6алкіл, -С1С4алкіл-С3-С10циклоалкіл, С3-С10циклоалкіл, С6С14арил, -С1-С4алкіл-С 6-С14арил, піраніл, піридиніл, піримідиніл, С1-С4алкілоксикарбоніл, С6С14арилкарбоніл-, С1-С4алкілкарбоніл-, С6 4 С14арилметилоксикарбоніл-, С6-С14арилсульфоніл, С1-С4алкілсульфонілта С6-С14арил-С 1С4алкілсульфоніл-, необов'язково у вигляді їх таутомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей. 4. Сполуки за будь-яким з пп. 1-3, у яких L, m, n та R3-R9 мають зазначені вище значення, а R1 та R2 мають ідентичні або різні значення й означають залишок, що вибраний з групи, яка включає водень, Me, Et, Pr, або R1 та R2 спільно утворюють С 2-С4алкільний місток, необов'язково у вигляді їх таутомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей. 5. Сполуки за будь-яким з пп. 1-4, у яких R1, R2, m, n та R5-R8 мають зазначені вище значення, а R3 являє собою залишок, що вибраний з групи, яка включає необов'язково заміщений С 1-С10алкіл, С3С7циклоалкіл, С3-С6гетероциклоалкіл та С6С14арил, або R1 та R3 або R2 та R3 спільно утворюють насичений або ненасичений С 3-С4алкільний місток, що може містити 1-2 гетероатоми, R4 являє собою залишок, що вибраний з групи, яка включає водень, ОМе, ОН, Me, Et, Pr, OEt, NHMe, NH2, F, Cl, Br, O-пропаргіл, O-бутиніл, CN, SMe, NМe2, CONH 2 , етиніл, пропініл, бутиніл та аліл, та L являє собою лінкер, що вибраний з групи, яка включає необов'язково заміщений феніл, фенілметил, циклогексил і розгалужений С 1С6алкіл, необов'язково у вигляді їх таутомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей. 6. Сполука формули (І) за будь-яким з пп. 1-5 для застосування як лікарський засіб. 7. Сполука формули (І) за будь-яким з пп. 1-5 для застосування як лікарський засіб, що має антипроліферативну дію. 8. Сполуки загальної формули (І) за п. 1, у якій замісники для кожної конкретної сполуки мають значення, наведені у одному рядку таблиці: Кон фіг. R 2 3 R4 Ln-R5m 1 R R1 R aбo R2 X5 1 H X2 X 3 X4 R H 3C O CH N O 5 80743 X2 R X5 X5 X3 2 H 6 H X3 N CH 3 X5 X3 3 H X2 H 3C R 8 H X2 X4 O CHR N CH N O N CH 3 X3 4 H X2 CH 3 O R H 3C CH 3 X4 X5 X5 N 9 H X5 X3 5 H X2 CH 3 O R X2 X 3 X4 R H 3C O N CH N H 3C CH 3 X4 N C CH 3 X X3 X5 6 H X2 1 H 0 X 3 CH 3 R H 3C O X4 X2 CHR CH 3 O N X4 N X5 X3 X5 X3 7 H X2 CHR X2 1 H 1 CH 3 O X4 X4 O R CH N N O X5 X3 X2 1 H 2 R X4 O N CH N 7 80743 X5 X1 1 H 3 X 3 X4 R H 3C O 8 необов'язково формули (III) NH 2 заміщеною сполукою загальної R4 CH N H 3C O O R 10 , (III) у якій R має значення, що зазначені в пп. 1-5, a R10 являє собою групу ОН, NH-L- R5, -O-метил або -O-етил, і потім за певних умов продукт загальної формули (IV) 4 X3 X1 1 H 4 CH 3 O CHR X4 H 3C H 3C N X5 CH , де символи Х1, Х2 , Х3 , Х4 та Х5 , що наведені в цій таблиці, означають положення, у якому відповідний залишок R1, R2, R3, R4 та L-R5 приєднаний до іншої частини молекули загальної формули (І). 9. Фармацевтична композиція, що містить як діючу речовину одну або декілька сполук загальної формули (І) за будь-яким з пп. 1-4 або її (їх) фізіологічно прийнятні солі, при необхідності разом зі звичайними допоміжними речовинами і/або носіями. 10. Спосіб одержання сполуки загальної формули (І) N N HN N R4 O R1 N R3 HN , (І) у якій R1-R5, m, n та L мають значення, що зазначені в пп. 1-5, який відрізняється тим, що сполуку загальної формули (II) N A N N O R1 R2 R3 , (II) у якій R -R мають значення, що зазначені в пп. 14, а А означає відхідну груп у, яка вибрана з Oметилу, -SCN, хлору, брому, йоду, метансульфонілу, трифторметансульфонілу або n-толуолсульфонілу, піддають взаємодії з 1 3 R2 , (IV) у якій R -R мають значення, що зазначені в пп. 15, а R10 являє собою групу ОН, -NH-L-R 5, -O-метил або -O-етил, при необхідності після попереднього гідролізу складноефірної групи -COR10, піддають взаємодії з аміном загальної формули (V) NH2-L-R5m (V), у якій R5 має значення, що зазначені в пп. 1-5. 11. Сполука формули (II) 4 N N O R1 N N R2 R3 R5 m N R10 1 , (II) у якій R -R мають значення, що зазначені в пп. 15, а А означає відхідну груп у, яка вибрана з Oметилу, -SCN, хлору, брому, йоду, метансульфонілу, трифторметансульфонілу або n-толуолсульфонілу. 12. Сполука, яка є проміжною для одержання сполуки загальної формули І за будь-яким з пп. 15, у якій L являє собою циклогексил, n означає 1, m означає 1, та R5 являє собою 4-циклопропілметилпіперазиніл, причому зазначена проміжна сполука являє собою цис- або транс-4-(4-циклопропілметилпіперазин-1іл)-циклогексиламін 1 Ln O R1 R3 O R2 NH N N R4 A O N N 3 9 H 2N N 80743 10 H 2N N N N . Даний винахід стосується дигідроптеридинонів загальної формули (І) нових (I) (I) у якій залишки L, R1, R2, R3, R4 та R5 мають зазначені у формулі винаходу та в описі значення, їх ізомерів, способу одержання цих дигідроптеридинонів, а також їх застосування як лікарські засоби. Похідні птеридинонів відомі з рівня техніки як діючі речовини, що мають антипроліферативну дію. Так, зокрема, [у заявці WO 01/019825] описується застосування похідних птеридинонів для лікування онкологічних та вірусних захворювань. Стійкість багатьох видів пухлин обумовлює необхідність розробки та створення нових високоефективних протипухлинних лікарських засобів. Виходячи з вищевикладеного, в основу даного винаходу було покладено завдання одержати нові сполуки, що мають протизапальну та антипроліферативну дію. При створенні винаходу було встановлено, що сполуки загальної формули (І), у якій залишки L та R1-R5 мають зазначені нижче значення, несподівано проявляють ефективність як інгібітори особливих кіназ, що беруть участь у регуляції клітинного циклу. Завдяки цьому пропоновані у винаході сполуки можуть застосовуватися, наприклад, для лікування захворювань, які так чи інакше пов'язані з активністю специфічних кіназ, що беруть участь у регуляції клітинного циклу, і при яких характерна надлишкова або аномальна проліферація клітин. Відповідно до цього даний винахід стосується сполук загальної формули (І) у якій R1 та R2 мають ідентичні або різні значення й означають водень або необов'язково заміщений С1-C6алкіл або R1 та R2 спільно утворюють 2-5-членний алкільний місток, що може містити 1-2 гетероатоми, R3 являє собою водень або залишок, що вибраний із групи, яка включає необов'язково заміщений С1-С12алкіл, С2-С12алкеніл, С2С12алкініл та С 6-С14арил, або залишок, що вибраний із групи, яка включає необов'язково заміщений і/або з'єднаний містковим зв'язком С3-С12циклоалкіл, С3С12циклоалкеніл, С7-С12поліциклоалкіл, С7С12поліциклоалкеніл, С5-С12спіроциклоалкіл, С3С12гетероциклоалкіл, що містить 1-2 гетероатоми, та С3-С12гетероциклоалкеніл, що містить 1-2 гетероатоми, або R1 та R3 або R2 та R3 спільно утворюють насичений або ненасичений С 3-С4алкільний місток, що може містити 1 гетероатом, R4 являє собою залишок, що вибраний із групи, яка включає водень, -CN, гідроксигрупу, NR6R7 та галоген, або залишок, що вибраний із групи, яка включає необов'язково заміщений С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С1-С5алкілоксигрупу, С2С5алкенілоксигрупу, С2-С5алкінілоксигрупу, С1C6алкілтіогрупу, С1-C6алкілсульфоксогрупу та С 1C6алкілсульфоніл, L являє собою лінкер, що вибраний із групи, яка включає необов'язково заміщений С 2-С10алкіл, С2-С10алкеніл, С6-С14арил, -С2-С4алкіл-С 6-С14арил, -С6-С14арил-С 1-С4алкіл, необов'язково з'єднаний містковим зв'язком С3-С12циклоалкіл та гетероарил, що містить 1 або 2 атоми азоту, n означає 0 або 1, m означає 1 або 2, R5 являє собою залишок, що вибраний із групи, яка включає необов'язково заміщений морфолініл, піперидиніл, піперазиніл, 11 80743 піперазинілкарбоніл, піролідиніл, тропеніл, R8дикетометилпіперазиніл, сульфоксоморфолініл, сульфонілморфолініл, тіоморфолініл, -NR8R9 та азациклогептил, R6 та R7 мають ідентичні або різні значення й означають водень або С1-С4алкіл, та R8 та R9 являють собою незаміщені азотні замісники при R5, мають ідентичні або різні значення й означають або водень, або залишок, що вибраний із групи, яка включає С 1-С6алкіл, -С1С4алкіл-С3-С10циклоалкіл, С3-С10циклоалкіл, С6С14арил, -С1-С4алкіл-С 6-С14арил, піраніл, піридиніл, піримідиніл, С1-С4алкілоксикарбоніл, С6С14арилкарбоніл-, С1-С4алкілкарбоніл-, С6С14арилметилоксикарбоніл-, С6-С14арилсульфоніл, С1-С4алкілсульфонілта С6-С14арил-С 1С4алкілсульфоніл-, необов'язково у вигляді їх та утомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей. Кращими є ті сполуки формули (І), де R1-R4, R6 та R7 мають зазначені вище значення, а L являє собою лінкер, що вибраний із групи, яка включає необов'язково заміщений С 2-С10алкіл, С2-С10алкеніл, С6-С14арил, -С2-С4алкіл-С 6-С14арил, -С6-С14арил-С 1-С4алкіл, необов'язково з'єднаний містковим зв'язком С3-С12циклоалкіл та гетероарил, що містить 1 або 2 атоми азоту, n означає 1, m означає 1 або 2, R5 являє собою пов'язаний з L через атом азоту залишок, що вибраний із групи, яка включає необов'язково заміщений морфолініл, піперидиніл, R8-піперазиніл, піролідиніл, тропеніл, R8дикетометилпіперазиніл, сульфоксоморфолініл, сульфонілморфолініл, тіоморфолініл, -NR8R9 та азациклогептил, R8 та R9 являють собою незаміщені азотні замісники при R5, мають ідентичні або різні значення й означають водень або залишок, що вибраний із групи, яка включає С1-С6алкіл, -С1С4алкіл-С3-С10циклоалкіл, С3-С10циклоалкіл, С6С14арил, С1-С4алкіл-С 6-С14арил, піраніл, піридиніл, піримідиніл, С1-С4алкілоксикарбоніл, С6С14арилкарбоніл-, С1-С4алкілкарбоніл-, С6С14арилметилоксикарбоніл-, С6-С14арилсульфоніл, С1-С4алкілсульфонілта С6-С14арил-С 1С4алкілсульфоніл-, необов'язково у вигляді їх та утомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей. Кращі далі ті сполуки формули (І), де R1-R4, R6 та R7 мають зазначені вище значення, а L являє собою лінкер, що вибраний із групи, яка включає необов'язково заміщений С 2-С10алкіл, С2-С10алкеніл, С6-С14арил, -С2-С4алкіл-С 6-С14арил, -С6-С14арил-С 1-С4алкіл, необов'язково з'єднаний містковим зв'язком С3-С12циклоалкіл та гетероарил, що містить 1 або 2 атоми азоту, n означає 0 або 1, m означає 1 або 2, 12 R5 являє собою пов'язаний з L через атом вуглецю залишок, що вибраний із групи, яка включає R8-піперидиніл-, R8R9-піперазиніл-, R8піролідиніл, R8- піперазинілкарбоніл -, R8-тропеніл, R8-мopфoлiнiл та R8-азабіциклогептил, a R8 та R9 являють собою незаміщені азотні замісники при R5, мають ідентичні або різні значення та означають водень або залишок, що вибраний із групи, яка включає С1-С6алкіл, -С1С4алкіл-С 3-С10циклоалкіл, С3-С10циклоалкіл, С6С14арил, -С1-С4алкіл-С 6-С14арил, піраніл, піридиніл, піримідиніл, С1-С4алкілоксикарбоніл, С6С14арилкарбоніл-, С1-С4алкілкарбоніл-, С6С14арилметилоксикарбоніл-, С6-С14арилсульфоніл, С1-С4алкілсульфонілта С6-С14арил-С 1С4алкілсульфоніл-, необов'язково у вигляді їх та утомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей. До особливо кращих відносяться ті сполуки формули (І), де L, m, n та R3-R9 мають зазначені вище значення, а R1 та R2 мають ідентичні або різні значення й означають залишок, що вибраний із групи, яка включає водень, Me, Et, Pr або R1 та R2 спільно утворюють С 2-С4алкільний місток, необов'язково у вигляді їх та утомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей. Найбільш кращими є ті сполуки формули (І), де R1, R2, m, n та R5-R8 мають зазначені вище значення, а R3 являє собою залишок, що вибраний із групи, яка включає необов'язково заміщений С 1С10алкіл, С3-С7циклоалкіл, С3-С6гетероциклоалкіл та С6-С14арил, або R1 та R3 або R2 та R3 спільно утворюють насичений або ненасичений С 3-С4алкільний місток, що може містити 1-2 гетероатоми, R4 являє собою залишок, що вибраний із групи, яка включає водень, ОМе, ОН, Me, Et, Pr, OEt, NHMe, NH 2, F, Cl, Br, О-пропаргіл, O-бутиніл, CN, SMe, NMe 2, CONH2, етиніл, пропініл, бутиніл і аліл, та L являє собою лінкер, що вибраний із групи, яка включає необов'язково заміщений феніл, фенілметил, циклогексил і розгалужений С 1С6алкіл, необов'язково у вигляді їх таутомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей. Ще одним об'єктом винаходу є сполуки формули (І) для їх застосування як лікарські засоби. Особливе значення відповідно до винаходу надається сполукам формули (І) для їх застосування як лікарські засоби з антипроліферативною дією. 13 80743 Ще одним об'єктом винаходу є застосування сполуки формули (І) для одержання лікарського засобу, призначеного для лікування і/або попередження раку, інфекційних, запальних та аутоімунних захворювань. Ще одним об'єктом винаходу є спосіб лікування і/або попередження раку, інфекційних, запальних та аутоімунних захворювань, який відрізняється тим, що пацієнтові вводять ефективну кількість сполуки формули (І). Ще одним об'єктом винаходу є фармацевтичні композиції, що містять як діючу речовину одну або декілька сполук загальної формули (І) або її (їх) фізіологічно сумісної солі, при необхідності в сполученні зі звичайними допоміжними речовинами і/або носіями. Ще одним об'єктом винаходу є спосіб одержання сполуки загальної формули (І) (I) у якій R1-R5, m, n та L мають зазначені вище значення, які відрізняється тим, що сполука загальної формули (II) (II) у якій R1-R3 мають зазначені вище значення, а А означає групу, що відходить, піддають взаємодії з необов'язково заміщеною сполукою загальної формули (III) (III) у якій R4 має зазначені вище значення, a R10 являє собою групу ОН, NH-L-R 5,- О-метил, -Оетил, і потім за певних умов продукт загальної формули (IV) (VI) R 10 у якій R1-R4 мають зазначені вище значення, a являє собою групу ОН, -NH-L-R 5, -О-метил або 14 -О-етил, при необхідності після попереднього гідролізу складноефірної групи -COR10, піддають взаємодії з аміном загальної формули (V) (V) у якій R5 має зазначені вище значення. Ще одним об'єктом винаходу є сполука формули (II) (II) у якій R1-R3 мають зазначені вище значення, а А означає груп у, що відходить. Під алкільними групами індивідуально і як фрагменти інших залишків маються на увазі розгалужені та нерозгалужені алкільні групи, що містять від 1 до 12 атомів вуглецю, краще 1-6, особливо краще 1-4 атоми вуглецю, наприклад, метил, етил, пропіл, бутил, пентил, гексил, гептил, октил, ноніл, децил і додецил. Під згаданими вище залишками, до яких відносяться пропіл, бутил, пентил, гексил, гептил, октил, ноніл, децил і додецил, маються на увазі також, якщо не зазначено інше, всі їх можливі ізомерні форми. Так, наприклад, поняття "пропіл" включає обидва ізомерних залишки н-пропіл та ізопропіл, поняття "бутил" включає я-бутил, ізобутил, втор-бутип та трет-бутил, поняття "пентил" включає ізопентил, неопентил і т.д. У вищезгаданих алкільних групах один або декілька атомів водню за певних умов можуть бути заміщені на інші залишки. Так, наприклад, ці алкільні групи можуть бути заміщені атомами фтор у. За певних умов можлива також заміна всіх атомів водню алкільної групи. Поняття "алкільний місток" означає, якщо не зазначено інше, розгалужені або нерозгалужені алкільні групи, що містять 1-5 атомів вуглецю, наприклад, метиленові, етиленові, пропіленові, ізопропіленові, н-бутиленові, ізобутильні, вторбутильні, трет-бутильні й тому подібні містки. Особливо кращими є метиленові, етиленові, пропіленові та бутиленові містки. У названих алкільних містках 1-2 С-атоми за певних умов можуть бути заміщені на один або декілька гетероатомів, вибраних із групи, що включає кисень, азот і сірку. Під алкенільними групами (включаючи й ті випадки, коли ці групи є компонентами інших залишків) маються на увазі розгалужені або нерозгалужені алкенільні групи, що містять від 2 до 10 атомів вуглецю, краще від 2 до 6, особливо краще 2-3 атоми вуглецю, за умови, що вони мають щонайменше один подвійний зв'язок. Як приклад можна назвати етеніл, пропеніл, бутеніл, пентеніл і т.п. Якщо не зазначено інше, то із числа вищезгаданих понять пропеніл, бутеніл і т.п. включають всі можливі ізомерні форми. Так, наприклад, поняття "бутеніл" включає 1-бутеніл, 2бутеніл, 3-бутеніл, 1-метил-1-пропеніл, 1-метил-2пропеніл, 2-метил-1-пропеніл, 2-метил-2-пропеніл та 1-етил-1-етеніл. 15 80743 У вищезгаданих алкенільних групах, якщо не зазначено інше, один або декілька атомів водню за певних умов можуть бути заміщені на інші залишки. Так, наприклад, ці алкенільні групи можуть бути заміщені атомами галогену фтору. За певних умов можлива також заміна всіх атомів водню алкенільної групи. Під алкінільними групами (включаючи й ті випадки, коли ці групи є компонентами інших залишків) маються на увазі розгалужені або нерозгалужені алкінільні групи, що містять від 2 до 10 атомів вуглецю, за умови, що вони мають щонайменше один потрійний зв'язок, як приклад можна назвати етиніл, пропініл, бутиніл, пентиніл, гексиніл і т.п., кращі з них етиніл і пропініл. У вищезгаданих алкінільних групах, якщо не зазначено інше, один або декілька атомів водню за певних умов можуть бути заміщені на інші залишки. Так, наприклад, ці алкінільні групи можуть бути заміщені атомами фтору. За певних умов можлива також заміна всіх атомів водню алкінільної групи. Поняття "арил" означає ароматичну циклічну систему, що містить від 6 до 14 атомів вуглецю, краще 6 або 10 атомів вуглецю, краще феніл, який, якщо не зазначено інше, може нести, наприклад, один або декілька наступних замісників: груп у ОН, NO 2, CN, -OCHF 2, -OCF 3, NH2, галоген, краще фтор або хлор, С1-С10алкіл, краще С1-С5алкіл, більш краще С 1-С3алкіл, особливо краще метил або етил, -О- С1-С3алкіл, краще -О-метил або -О-етил, гр упу -СООН, -СООС1-С4алкіл, краще -О-метил або -О-етил, груп у CONH2. Як гетероарильні залишки, у яких аж до двох С-атомів можуть бути заміщені на один або два атоми азоту, можна назвати, наприклад, пірол, піразол, імідазол, тіазол, піридин і піримідин, при цьому кожний з вищезгаданих гетероарильних циклів може бути в свою чергу за певних умов анельований з бензольним кільцем, краще з бензімідазолом, і, крім того, ці гетероцикли, якщо не зазначено інше, можуть нести, наприклад, один або декілька наступних замісників: F, СІ, Вr, ОН, ОМе, метил, етил, CN, CONH 2, NH2, необов'язково заміщений феніл, необов'язково заміщений гетероарил, краще необов'язково заміщений піридил. Під циклоалкільними залишками маються на увазі циклоалкільні залишки, що містять від 3 до 12 атомів вуглецю, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил або циклооктил, краще циклопропіл, циклопентил або циклогексил, при цьому кожний з вищезгаданих циклоалкільних залишків у свою чергу може нести за певних умов один або декілька замісників, наприклад, групу ОН, NO 2, CN, ОМе, -OCHF2, -OCF3, -NH2 або галоген, краще фтор або хлор, С1-С10алкіл, краще С1-С5алкіл, більш краще С 1-С3алкіл, особливо краще метил або етил, -О-С1-С3алкіл, краще -О-метил або -Оетил, -СООН, -СОО-С 1-С4алкіл, краще -СООметил або -СОО-етил, або -CONH2. Особливо кращими замісниками циклоалкільних залишків є =О, гр упа ОН, NH2, метил або F. 16 Під циклоалкенільними залишками маються на увазі циклоалкільні залишки, що містять від 3 до 12 атомів вуглецю й мають щонайменше один подвійний зв'язок, наприклад, циклопропеніл, циклобутеніл, циклопентеніл, циклогексеніл або циклогептеніл, краще циклопропеніл, циклопентеніл або циклогексеніл, при цьому кожний з вищезгаданих циклоалкенільних залишків у свою чергу може нести за певних умов один або декілька замісників. "=О" означає приєднаний через подвійний зв'язок атом кисню. Під гетероциклоалкільними залишками маються на увазі, якщо не зазначено інше, 5-, 6або 7-членні насичені або ненасичені гетероцикли, які можуть містити як гетероатоми азот, кисень або сірку, наприклад, тетрагідрофуран, тетрагідрофуранон, g-бутиролактон, α-піран, gпіран, діоксолан, тетрагідропіран, діоксан, дигідротіофен, тіолан, дитіолан, піролін, піролідин, піразолін, піразолідин, імідазолін, імідазолідин, тетразол, піперидин, піридазин, піримідин, піразин, піперазин, триазин, тетразин, морфолін, тіоморфолін, діазепан, оксазин, тетрагідрооксазиніл, ізотіазол і піразолідин, краще морфолін, піролідин, піперидин або піперазин, при цьому такий гетероцикл у свою чергу може нести за певних умов замісники, наприклад, С1-С4алкіл, краще метил, етил або пропіл. Під поліциклоалкільними залишками маються на увазі необов'язково заміщені бі-, три-, тетраабо пентациклічні циклоалкільні залишки, наприклад, пінан, 2,2,2-октан, 2,2,1-гептан або адамантан. Під поліциклоалкенільними залишками маються на увазі необов'язково з'єднані містковим зв'язком і/або заміщені 8-членні бі-, три-, тетраабо пентациклічні циклоалкенільні залишки, краще біциклоалкенільні або трициклоалкенільні залишки, за умови, що вони мають щонайменше один подвійний зв'язок, наприклад, норборнен. Під спіроалкільними залишками маються на увазі необов'язково заміщені спіроциклічні С 5С12алкільні залишки. Поняття "галоген" означає, як правило, фтор, хлор, бром або йод, краще фтор, хлор або бром, особливо краще хлор. Під групою А, що відходить, яка має ідентичні або різні значення, мається на увазі така група, що відходить, як, наприклад-, О-метил-, SCN, хлор, бром, йод, метансульфоніл, трифторметансульфоніл або п-толуолсульфоніл, краще хлор. Пропоновані у винаході сполуки можуть бути представлені у вигляді окремих оптичних ізомерів, сумішей окремих енантіомерів, діастереомерів або рацематів, у вигляді та утомерів, а також у вигляді вільних основ або відповідних кислотно-адитивних солей, утворених з фармакологічно прийнятними кислотами, наприклад, кислотно-адитивних солей з галогеноводневими кислотами, такими як хлористо- або бромистоводнева кислота, або з органічними кислотами, такими як щавлева, фумарова, дигліколева або метансульфонова кислота. 17 80743 Замісник R1 може являти собою водень або залишок із групи, що включає необов'язково заміщений і/або розгалужений С 1-С6алкіл, краще метил або етил. Замісник R2 може являти собою водень або залишок із групи, що включає необов'язково заміщений і/або розгалужений С 1-С6алкіл, краще метил або етил. R1 та R2 можуть спільно утворювати 2-5членний алкільний місток, краще етиленовий, пропіленовий або бутиленовий місток, що може містити 1-2 гетероатоми, краще кисень або азот, особливо кращі з названих етиленовий і пропіленовий містки. Замісник R3 може являти собою водень або залишок, що вибраний із групи, яка включає необов'язково заміщений С 1-С12алкіл, краще етил, пропіл, бутил, пентил або гексил, особливо краще пропіл, бутил, пентил або гексил, С2-С12алкеніл, краще С5-С7алкеніл, С2-С12алкініл, краще С5С7алкініл, і С6-С14арил, краще феніл, або може являти собою залишок, що вибраний із групи, яка включає необов'язково заміщений і/або з'єднаний містковим зв'язком С3-С12циклоалкіл, краще циклопентил або циклогексил, С3-С12циклоалкеніл, краще С5-С7циклоалкеніл, С7-С12поліциклоалкіл, С7-С12поліциклоалкеніл, С5-С12спіроциклоалкіл, С3С12гетероциклоалкіл, краще піраніл або піпериніл, піролідиніл, піразиніл або морфолініл, що містить 1-2 гетероатоми, краще кисень або азот, та С3С12гетероциклоалкеніл, що містить 1-2 гетероатоми, краще кисень або азот. Найбільш кращими як замісник R3 є ізопропіл, ізобутил, ізопентил, циклопентил, феніл або циклогексил. R1 та R3 або R2 та R3 можуть спільно утворювати насичений або ненасичений С 3С4алкільний місток, що може містити 1 гетероатом, краще кисень або азот. Замісник R4 може являти собою залишок, що вибраний із групи, яка включає водень, -CN, гідроксигрупу, -NR 6R7 і галоген, краще хлор або фтор, особливо краще хлор, або являти собою залишок, що вибраний із групи, яка включає необов'язково заміщений С1-С6алкіл, краще метил, етил або пропіл, С2-С6алкеніл, краще етиніл або пропеніл, С2-С6алкініл, краще етиніл, пропініл або бутиніл, С1-С5алкілоксигрупу, краще метокси-, етокси-або пропаргілоксигрупу, С2С5алкенілоксигрупу, С2-С5алкінілоксигрупу, С1С6алкілтіогрупу, С1-С6алкілсульфоксогрупу та С 1С6алкілсульфоніл. Найбільш кращими як замісник R4 є метоксигрупа, метил, етоксигрупа, етил, пропаргілоксигрупа або хлор. L може являти собою лінкер, що вибраний із групи, яка включає необов'язково заміщений С 2С10алкіл, краще етил, пропіл, бутил або пентил, С2-С10алкеніл, С6-С14арил, краще феніл, -С2С4алкіл-С6-С14арил, -С6-С14арил-С 1-С4алкіл, краще -фенілметил, необов'язково з'єднаний містковим зв'язком С3-С12циклоалкіл, краще циклогексил, та гетероарил, що містить 1-2 атоми азоту. n означає 0 або 1. m означає 1 або 2, краще 1. R5 може являти собою залишок, що вибраний із групи, яка включає необов'язково заміщений 18 морфолініл, піперидиніл, піперазиніл, піперазинілкарбоніл, піролідиніл, тропеніл, R8диметоксиметилпіперазиніл, сульфоксоморфолініл, сульфонілморфолініл, тіоморфолініл, -NR8R9 та азациклогептил, краще піперидиніл, морфолініл, піролідиніл, сульфоксоморфолініл, піперазиніл, тіоморфолініл або тропеніл. Залишки R6 та R7 можуть бути ідентичними або різними і являти собою водень або С гС4алкіл, краще метил або етил. Залишки R8 та R9 можуть являти собою незаміщені азотні замісники при R5, мати ідентичні або різні значення й означати або водень, або залишок, що вибраний із групи, яка включає С1С6алкіл, краще метил, етил або пропіл, -С1С4алкіл-С 3-С10циклоалкіл, краще -СН2циклопропіл, С3-С10циклоалкіл, С6-С14арил, краще феніл, - С1С4алкіл-С 6-С14арил, краще бензил, піраніл, піридиніл, піримідиніл, піраніл, С1С4алкілоксикарбоніл, С6-С14арилкарбоніл-, С1С4алкілкарбоніл-, С6-С14арилметилоксикарбоніл-, С6-С14арилсульфоніл-, С1-С4алкілсульфоніл- та С6-С14арил-С 1-С4алкілсульфоніл-. Найбільш кращі як замісник R8 метил, етил або пропіл. Найбільш кращі як замісник R9 метил, етил або пропіл. R10 може являти собою замісник, що вибраний із групи, яка включає групу ОН, NH2-LR5, -О-метил та -О-етил, краще групу ОН, LR5, -О-метил або -Оетил. Всі залишки, що зазначені при розкритті значень R'-R10, за певних умов можуть бути розгалуженими і/або можуть бути заміщені. Пропоновані у винаході сполуки можна синтезувати за допомогою описаного нижче способу А, при цьому замісники в загальних формулах (А1)-(А9) мають зазначені вище значення. Представлений спосіб призначений лише для більш докладного пояснення винаходу, не обмежуючи при цьому його об'єм. Спосіб А Стадія 1А Сполуку формули (А1) взаємодією з сполукою формули (А2) перетворюють у сполуку формули (A3) (схема 1А). Дану реакцію можна проводити [згідно з WO 00/43369 або WO 00/43372]. Сполука (А1) є комерційно доступним продуктом і поставляється, зокрема, фірмою City Chemical LLC, що розташована за адресою: 139 Allings Crossing Road, West Haven, CT, 06516, USA. Сполуку (А2) можна одержувати за відомою з літератури методикою: [a) F. Effenberger, U. Burkhart, J. Willfahrt, Liebigs Ann. Chem. 1986, cc. 314-333; б) T. Fukuyama, C.-K. Jow, M. Cheung, Tetrahedron Lett. 1995, 36, cc.6373-6374; в) R.K. Olsen, J. Org. Chem. 1970, 35, cc.1912-1915; r) F.E. Dutton, B.H. Byung, Tetrahedron Lett. 1998, 30, cc.5313-5316; д) J.M. Ranajuhi, M.M. Joullie, Synth. Commun. 1996, 26, cc.1379-1384]. Схема 1А 19 80743 На стадії 1Α 1 еквівалент сполуки (A1) та 1-1,5 еквівалента, краще 1,1 еквівалента, відповідної основи, краще карбонату калію, гідрокарбонату калію, карбонату натрію або гідрокарбонату натрію, карбонату кальцію, особливо краще карбонату калію, перемішують у розріджувачі, необов'язково з водою, наприклад, в ацетоні, тетрагідрофурані, діетиловому ефірі, циклогексані, петролейному ефірі або діоксані, краще в циклогексані або діетиловому ефірі. Далі при температурі в інтервалі від 0 до 15°С, краще від 5 до 10°С, по краплях додають 1 еквівалент амінокислоти формули (А2), розчинений в органічному розчиннику, наприклад, в ацетоні, тетрагідрофурані, діетиловому ефірі, циклогексані або діоксані. Реакційну суміш нагрівають при перемішуванні до температури в інтервалі від 18 до 30°С, краще до приблизно 22°С, і потім продовжують перемішування впродовж наступних 10-24год., краще приблизно впродовж 12год. Після цього розріджувач відганяють, залишок змішують із водою та суміш двічі або тричі екстрагують за допомогою органічного розчинника, наприклад, діетилового ефіру або етилацетату. Об'єднані органічні екстракти суша ть, а розчинник відганяють. Залишок (сполука (A3)) можна без попереднього очищення використовувати на стадії 2. Стадія 2А Одержану на стадії 1 А сполук у (A3) відновлюють за нітрогрупою та циклізують з утворенням сполуки (А4) (схема 2А) Схема 2А На стадії 2А 1 еквівалент нітросполуки (A3) розчиняють у відповідній кислоті, краще в льодяній оцтовій кислоті, мурашиній кислоті або водній соляній кислоті, насамперед у льодяній оцтовій кислоті, і нагрівають до 50-70°С, краще до приблизно 60°С. Потім аж до завершення екзотермічної реакції додають відновник, наприклад, цинк, олово або залізо, краще залізний порошок, і впродовж 0,2-2год., краще впродовж 0,5год., перемішують при температурі в інтервалі від 100 до 125°С, краще при температурі приблизно 117°С. Після охолодження до кімнатної температури сіль заліза відфільтровують, а розчинник відганяють. Залишок розчиняють у відповідному розчиннику або в суміші розчинників, наприклад, в етилацетаті або в суміші 20 дихлорметану/метанолу, взятих у співвідношенні 9:1, і напівнасиченого розчину NaCl, та фільтрують, наприклад, через кізельгур. Органічну фазу суша ть і концентрують. Залишок (сполука (А4)) можна очищати за допомогою хроматографії або шляхом кристалізації або використовувати його як сирий продукт на стадії 3А синтезу. Стадія 3А Одержану на стадії 2А сполуку (А4) можна шляхом електрофільного заміщення відповідно до схеми 3А перетворювати в сполук у формули (А5) На стадії 3А 1 еквівалент аміду формули (А4) розчиняють у відповідному органічному розчиннику, наприклад, у диметилформаміді або диметилацетаміді, краще в диметилацетаміді, і охолоджують до температури в інтервалі від приблизно -5 до +5°С, краще до 0°С. Потім додають 0,9-1,3 еквіваленти гідриду натрію та 0,91,3 еквіваленти метилуючого агента, наприклад, метилйодиду. Реакційну суміш впродовж 0,1-3год., краще впродовж приблизно 1год., перемішують при 0-10°С, краще при температурі приблизно 5°С, після чого в разі потреби її можна витримувати в зазначеному інтервалі температур впродовж наступних 12год. Потім реакційну суміш зливають на суміш води та льоду й осад виділяють. Залишок (сполука (А5)) можна очищати за допомогою хроматографії, краще на силікагелі, або шляхом кристалізації або використовувати як сирий продукт на стадії 4А синтезу. Стадія 4А Амінування одержаної на стадії 3А сполуки (А5) з одержанням сполуки формули (А9) (схема 4А) можна здійснювати за відомими з літератури методами, а саме, у відповідності з наступними варіантами: [4.1А (a) M.P.V. Boarland, J.F.W. McOmie, J. Chem. Soc. 1951, cc.1218-1221; б) F.H.S. Curd, F.C. Rose, J. Chem. Soc. 1946, cc.343348, 4.2A (a) Banks, J. Am. Chem. Soc. 1944, 66, cc.1131; б) Ghosh and Dolly, J. Indian Chem. Soc. 1981, 58, cc.512-513; в) N.P. Reddy та Μ. Tanaka, Tetrahedron Lett. 1997, 38, cc.4807-4810]. Схема 4А 21 80743 22 Потім реакційну суміш очищають, наприклад, на силікагелі, і продукт (А8) виділяють із розчину, одержують його шляхом відповідної кристалізації. Продукт (А8) розчиняють у відповідному розчиннику, такому як діоксан, і додають разом з кислотою, наприклад, напівконцентрованою соляною кислотою, наприклад, у співвідношенні розчинник/кислота 3:1. Потім впродовж 1-48год., наприклад, впродовж 12год., нагрівають зі зворотним холодильником та осад, що випав, виділяють. При необхідності продукт (А9) очищають шляхом кристалізації. Схема 5А Наприклад, відповідно до варіанта 4.1Α 1 еквівалент сполуки (А5) та 1-3 еквіваленти, краще 2 еквіваленти, сполуки (А6) без використання розчинника або у відповідному органічному розчиннику, такому, наприклад, як сульфолан, диметилформамід, диметилацетамід, толуол, Νметилпіролідон, диметилсульфоксид або діоксан, краще в суль фолані, нагрівають до 100-220°С, краще до приблизно 160°С, витримуючи при цій температурі впродовж 0,1-4год., краще впродовж 1год. Після охолодження додаванням органічних розчинників або сумішей розчинників, наприклад, діетилового ефіру/метанолу, етилацетату, метиленхлориду або діетилового ефіру, краще суміші діетилового ефіру/метанолу в співвідношенні 9:1, продукт (А9) кристалізують або очищають його за допомогою хроматографії. Відповідно до варіанта 4.2А 1 еквівалент сполуки (А5) та 1-3 еквіваленти сполуки (А6) перемішують зі зворотним холодильником впродовж 1-48год., краще впродовж приблизно 5год., разом з відповідною кислотою, наприклад, з 1-10 еквівалентами 10-38%-ої соляної кислоти, і/або з відповідним спиртом, наприклад, етанолом, пропанолом, бутанолом, краще з етанолом. Продукт, що випав в осад (А9) відфільтровують, при необхідності промивають водою, сушать і кристалізують з відповідного органічного розчинника. Відповідно до варіанта 4.3 А 1 еквівалент сполуки (А5) та 1-3 еквіваленти сполуки (А7) розчиняють у відповідному розчиннику, наприклад, толуолі або діоксані, змішують з відповідним фосфіновим лігандом, наприклад, 2,2'біс(дифенілфосфіно)-1,1'-бінафтилом, та паладієвим каталізатором, таким як трис(дибензиліденацетон)дипаладій(0), і відповідною основою, наприклад, карбонатом цезію, та впродовж 1-24год., краще впродовж 17год., кип'ятять зі зворотним холодильником. Варіант 5.1Α Відповідно до даного варіанта, наприклад, 1 еквівалент сполуки (А9) разом з 1 еквівалентом активуючого реагенту, такого, наприклад, як тетрафторборат О-бензотриазоліл-N,N,N',N'тетраметилуронія (ТБТУ), і приблизно 1,5 еквівалента відповідної основи, такої як диізопропілетиламін (ДІПЕА), розчиняють у відповідному органічному розчиннику, наприклад, дихлорметані, тетрагідрофурані, диметилформаміді, N-метилпіролідоні або диметилацетаміді, краще дихлорметані або диметилформаміді. Після додавання 1 еквівалента аміну (А10) реакційну суміш впродовж 0,1-24год., краще впродовж приблизно 2год., перемішують при температурі в інтервалі від 20 до 100°С. У результаті, наприклад, кристалізації або хроматографічного очищення одержують продукт формули (A11). Нові сполуки загальної формули (І) можна синтезувати аналогічно представленим нижче прикладам. Ці приклади призначені лише для більш докладного пояснення винаходу, не обмежуючи при цьому його об'єм. Нижче описується також одержання деяких проміжних сполук, що використовуються для синтезу сполук формули (І) у прикладах. Одержання кислот Для синтезу сполук у прикладах 94 та 95 спочатку одержують описаним нижче шляхом проміжну сполуку Z1 (Z1) 23 80743 50,0г (0,48моль) метилового ефіру Dаланіну·НСI та 49,1г (0,50моль) циклогексанону попередньо поміщали в 300мл дихлорметану, після чого змішували з 41,0г (0,50моль) ацетату натрію та 159,0г (0,75моль) триацетоксиборогідриду натрію. Суміш впродовж ночі перемішували та потім додавали 300мл 10%го розчину гідрокарбонату натрію. Водну фазу екстрагували дихлорметаном. Об'єднані органічні фази промивали 10%-им розчином гідрокарбонату натрію, сушили над Na2SO4 і концентрували. Вихід: 72,5г сполуки Z1a (прозора рідина). 72,5г сполуки Z1a попередньо поміщали в 500мл води та додавали 76,6г (0,39моль) 2,4дихлор-5-нітропіримідину в 500мл діетилового ефіру. При температурі -5°С по краплях додавали 100мл 10%-го розчину гідрокарбонату калію. Спочатку впродовж 3год. перемішували при -5°С, а потім впродовж 12год. при кімнатній температурі. Органічну фазу відокремлювали й сушили над Na2SO4. При концентруванні продукт випадав у вигляді кристалів. Вихід: 48,0г сполуки Z1b (кристали жовтого кольору). 48,0г сполуки Z1b розчиняли в 350мл льодяної оцтової кислоти й нагрівали до 60°С. Потім порціями додавали 47,5г залізного порошку, при цьому температура підвищувалася до 105°С. Реакційну суміш впродовж 3год. перемішували при 80°С, потім у гарячому стані фільтрували через целюлозу та концентрували. Залишок розділяли шляхом перемішування у воді й етиловому ефірі оцтової кислоти, відокремлювали вакуумфільтрацією та світло-сірий осад, що утворився, промивали етиловим ефіром оцтової кислоти. Фільтрат промивали розведеним аміаком та водою, органічну фазу сушили над Na2SO4, фільтрували через активоване вугілля й концентрували. У результаті одержували ще деяку кількість твердої речовини світло-сірого кольору. Вихід: 29,5г сполуки Z1c (кристали світлосірого кольору). 32,1г сполуки Z1c попередньо поміщали в 300мл диметилацетаміду й змішували з 13мл (0,2моль) метилйодиду. Потім при -5°С порціями додавали 6,4г (0,16моль) гідриду натрію у вигляді 60%-ої дисперсії в мінеральному маслі. Через 2год. реакційну суміш зливали на 800мл суміші води та льоду. Осад, що випав, відокремлювали вакуум-фільтрацією та промивали петролейним ефіром. Вихід: 33,0г сполуки Z1d (кристали бежевих кольорів). 4,0г сполуки Z1d та 2,3г (15ммоль) 4-аміно-3метилбензойної кислоти суспендували в 50мл етанолу та 120мл води, змішували з 2мл концентрованої соляної кислоти та впродовж 48год. кип'ятили зі зворотним холодильником. Осад, що випав при охолодженні, відокремлювали вакуум-фільтрацією та промивали водою, етанолом і діетиловим ефіром. Вихід: 2,9г сполуки Z1 (безбарвні кристали). Для синтезу сполук у прикладах 188 та 203 спочатку одержують описаним нижче шляхом проміжну сполуку Z2 24 (Z2) Розчин 128,2г (0,83моль) етилового ефіру Dаланіну·НСI та 71,5г (0,85моль) циклопентанону в 1500мл дихлорметану змішували з 70,1г (0,85моль) ацетату натрію та 265,6г (1,25моль) триацетоксиборогідриду натрію. Реакційну суміш перемішували впродовж 12год. і потім зливали в 1,5л 10%-го розчину гідрокарбонату натрію. Водну фазу екстрагували дихлорметаном. Об'єднані органічні фази сушили над Na2SO4 і концентрували. Вихід: 143,4г сполуки Z2a (безбарвне масло). 66,0г сполуки Z2a попередньо поміщали в 500мл води й змішували з 85,0г (0,44моль) 2,4дихлор-5-нітропіримідину в 500мл діетилового ефіру. При температурі -5°С по краплях додавали 100мл 10%-го розчину гідрокарбонату калію й реакційну суміш впродовж 48год. перемішували при кімнатній температурі. Водну фазу екстрагували діетиловим ефіром, об'єднані органічні фази сушили над Na2SO4 і концентрували. Тверду речовину темно-червоного кольору розділяли шляхом перемішування з петролейним ефіром і відокремлювали вакуумфільтрацією. Вихід: 88,0г сполуки Z2b (кристали жовтого кольору). 88,0г сполуки Z2b розчиняли в 1000мл льодяної оцтової кислоти та при 60°С змішували порціями з 85г залізного порошку, при цьому температура піднімалася до 110°С. Суміш впродовж 1год. перемішували при 60°С, потім у гарячому стані відокремлювали вакуумфільтрацією через целюлозу й концентрували. Тверду речовину коричневого кольору розділяли шляхом перемішування з 700мл води й відокремлювали вакуум-фільтрацією. Вихід: 53,3г сполуки Z2c (кристали, злегка забарвлені в коричневий колір). 53,3г сполуки Z2c розчиняли в 300мл диметилацетаміду й змішували з 13мл (0,21моль) метилйодиду. Потім при -5°С додавали порціями 5,0г (0,21моль) гідриду натрію у вигляді 60%-ої дисперсії в мінеральному маслі. Через 12год. реакційну суміш зливали на 1000мл суміші води та льоду й осад, що утворився, відокремлювали вакуум-фільтрацією. Вихід: 40,0г сполуки Z2d (безбарвні кристали). 4,0г сполуки Z2d та 2,8г (16ммоль) 4-аміно-3метилбензойної кислоти суспендували в 25мл етанолу та 60мл води, змішували з 3мл концентрованої соляної кислоти й впродовж 43год. кип'ятили зі зворотним холодильником. Осад, що випав при охолодженні, відокремлювали вакуумфільтрацією та промивали водою, етанолом і діетиловим ефіром. 25 80743 Вихід: 0,9г сполуки Z2 (безбарвні кристали). Для синтезу сполук у прикладах 19, 21, 22, 23, 45, 55, 58, 116, 128, 131, 133, 134, 136, 138, 177, 217, 231, 239, 46, 184, 166 та 187 спочатку одержують описаним нижче шляхом проміжну сполуку Z3 (Z3) 54,0г (0,52моль) D-2-аміномасляної кислоти суспендували в 540мл метанолу та при охолодженні льодом повільно змішували з 132г (1,1моль) тіонілхлориду. Впродовж 1,5год. суміш кип'ятили зі зворотним холодильником і потім концентрували. Одержане масло змішували з 540мл mpem-бутилметилового ефіру й кристали, що утворилися, відокремлювали вакуумфільтрацією. Вихід: 78,8г сполуки Z3a (безбарвні кристали). 74,2г сполуки Z3a та 43,5мл (0,49моль) циклопентанону розчиняли в 800мл дихлорметану. Після додавання при 0°С 40,0г (0,49моль) ацетату натрію та 150,0г (0,71моль) триацетоксиборогідриду натрію перемішували впродовж 12год. при кімнатній температурі та потім додавали 500мл 20%-го розчину гідрокарбонату натрію. Водну фазу екстрагували дихлорметаном. Об'єднані органічні фази промивали водою, сушили над MgSO4 і концентрували. Вихід: 85,8г сполуки Z3b (масло, злегка забарвлене в жовтий колір). 40,0г сполуки Z3b та 30,0г (0,22моль) карбонату калію суспендували в 600мл ацетону та при охолодженні льодом змішували з 45,0г (0,23моль) 2,4-дихлор-5-нітропіримідином в 200мл ацетону. Через 12год. додавали ще 5,0г 2,4дихлор-5-нітропіримідину та перемішували впродовж 3год. Потім реакційну суміш концентрували, розчиняли в 800мл етилового ефіру оцтової кислоти й 600мл води й водну фазу екстрагували етиловим ефіром оцтової кислоти. Об'єднані органічні фази промивали водою, сушили над MgSO 4 і концентрували. Вихід: 75,0г сполуки Z3c (масло коричневого кольору). 100г сполуки Z3c розчиняли в 650мл льодяної оцтової кислоти та при 70°С змішували порціями з 20г залізного порошку. Далі спочатку впродовж 1год. перемішували при 70°С, а потім впродовж 1,5год. при 100°С, після чого відфільтровували в гарячому стані через кізельгур. Реакційну суміш концентрували, розчиняли в суміші метанолу та дихлорметану, наносили на силікагель й очищали екстракцією за Сокслетом за допомогою етилового ефіру оцтової кислоти. Розчинник видаляли й залишок розділяли шляхом перемішування з метанолом. 26 Вихід: 30,0г сполуки Z3d (кристали світлокоричневого кольору). 25,0г сполуки Z3d та 6,5мл (0,1моль) метилйодиду попередньо поміщали в 250мл диметилацетаміду та при -10°С змішували з 3,8г (0,95моль) гідриду натрію у вигляді 60%-ої дисперсії в мінеральному маслі. Далі перемішували спочатку впродовж 20хв. при 0°С, а потім впродовж 30хв. при кімнатній температурі й на завершення додавали лід. Реакційну суміш концентрували та змішували з 300мл води. Осад, що утворився, відокремлювали вакуумфільтрацією та промивали петролейним ефіром. Вихід: 23,0г сполуки Z3e (безбарвна тверда речовина). 6,0г сполуки Z3e та 5,1г (31ммоль) 4-аміно-3метоксибензойної кислоти суспендували в 90мл етанолу та 350мл води, змішували з 3,5мл концентрованої соляної кислоти й впродовж 48год. кип'ятили зі зворотним холодильником. Потім реакційну суміш концентрували, залишок розділяли шляхом перемішування із сумішшю метанолу й діетилового ефіру й осад, що утворився, відокремлювали вакуум-фільтрацією. Вихід: 6,3г сполуки Z3 (кристали світлобежевого кольору). Для синтезу сполук у прикладах 81, 82, 93 та 137 спочатку одержують описаним нижче шляхом проміжну сполуку Z4 (Z4) 25.0г (0,19моль) етилового ефіру 1аміноциклопропан-1-карбонової кислоти·НСI та 16,8г (0,20моль) циклопентанону розчиняли в 300мл дихлорметану й змішували з 16,4г (0,20моль) ацетату натрію та 61,7г (0,29моль) триацетоксиборогідриду натрію. Далі перемішували впродовж ночі, після чого реакційну суміш зливали на 400мл 10%-го розчину гідрокарбонату натрію. Водну фазу екстрагували дихлорметаном. Об'єднані органічні фази сушили над Na2SO4 і концентрували. Вихід: 34,5г сполуки Z4a (безбарвне масло). До суміші 34,5г сполуки Z4a в 350мл води додавали 42,5г (0,22моль) 2,4-дихлор-5нітропіримідину в 350мл діетилового ефіру. Потім при -5°С змішували з 80мл 10%-го розчину гідрокарбонату калію й впродовж ночі перемішували при кімнатній температурі. Водну фазу екстрагували діетиловим ефіром. Об'єднані органічні фази сушили над Na2SO4 і концентрували. Вихід: 53,8г сполуки Z4b (масло коричневого кольору). 20.1г сполуки Z4b розчиняли в 200мл льодяної оцтової кислоти та при 60°С змішували порціями з 19,1г залізного порошку, при цьому температура 27 80743 піднімалася до 100°С. Далі впродовж 3год. перемішували при 60°С, потім відокремлювали вакуум-фільтрацією через целюлозу й концентрували. Залишок розділяли шляхом перемішування у воді й етиловому ефірі оцтової кислоти та осад, що випав, жовтого кольору відокремлювали вакуум-фільтрацією. Фільтрат промивали розведеним аміаком і водою, органічну фазу сушили над Na2SO4 і концентрували. Після додавання діетилового ефіру кристалізувався подальший продукт. Вихід: 4,0г сполуки Z4c (кристали жовтого кольору). 7,8г сполуки Z4c та 2,6мл (0,04моль) метилйодиду розчиняли в 100мл диметилацетаміду та при -5°С змішували порціями з 1,5г (0,04моль) гідриду натрію у вигляді 60%-ої дисперсії в мінеральному маслі. Через 2год. реакційну суміш зливали на суміш води та льоду й осад, що утворився, відокремлювали вакуумфільтрацією. Вихід: 7,5г сполуки Z4d (кристали, злегка забарвлені в коричневі кольори.) 3,0г сполуки Z4d та 1,9г (11ммоль) 4-аміно-3метоксибензойної кислоти суспендували в 40мл етанолу та 80мл води, змішували з 2мл концентрованої соляної кислоти й впродовж 20год. кип'ятили зі зворотним холодильником. Потім додавали ще 0,5г 4-аміно-3-метоксибензойної кислоти й впродовж 48год. продовжували кип'ятити зі зворотним холодильником. Осад, що випав при охолодженні, відокремлювали вакуумфільтрацією та промивали водою, етанолом і діетиловим ефіром. Вихід: 2,1г сполуки Z4 (безбарвні кристали), tпл 222-223°C. Для синтезу сполук у прикладах 162, 43, 53, 161, 202, 211, 215 та 212 спочатку одержують описаним нижче шляхом проміжну сполуку Z5 28 Розчинений в етиловому ефірі оцтової кислоти залишок промивали водою й органічну фазу сушили над MgSO 4 і концентрували. Вихід: 102,7г сполуки Z5b (масло коричневого кольору). 22,7г сполуки Z5b розчиняли в 350мл льодяної оцтової кислоти та при 60°С змішували порціями з 17,4г залізного порошку. Після додавання зазначеного компонента впродовж 0,5год. кип'ятили зі зворотним холодильником, відфільтровували в гарячому стані й концентрували. Залишок розчиняли в 200мл суміші дихлорметану й метанолу (у співвідношенні 9:1) і промивали розчином хлориду натрію. Органічну фазу відокремлювали вакуумфільтрацією через кізельгур, сушили над MgSO4, концентрували й очищали колоночною хроматографією (елюент: етиловий ефір оцтової кислоти/циклогексан у співвідношенні 1:1). Вихід: 1,9г сполуки Z5c (безбарвні кристали). 1,9г сполуки Z5c розчиняли в 32мл диметилацетаміду та при охолодженні льодом змішували з 0,3г (7ммоль) гідриду натрію у вигляді 60%-ої дисперсії в мінеральному маслі. Через 10хв. додавали 0,5мл (7ммоль) метилйодиду та перемішували впродовж 3год. при кімнатній температурі. Потім реакційну суміш концентрували та змішували з водою. Осад, що утворився, відокремлювали вакуум-фільтрацією та промивали петролейним ефіром. Вихід: 1,6г сполуки Z5d (безбарвні кристали). 14,0г сполуки Z5d та 10,0г (0,06моль) 4-аміно3-метоксибензойної кислоти суспендували в 200мл діоксану та 80мл води, змішували з 10мл концентрованої соляної кислоти й кип'ятили впродовж 40год. зі зворотним холодильником. Осад, що випав при охолодженні, відокремлювали вакуум-фільтрацією та промивали водою, діоксаном і діетиловим ефіром. Вихід: 13,9г сполуки Z5 (безбарвні кристали). Для синтезу сполук у прикладах 88, 194, 229 та 89 спочатку одержують описаним нижче шляхом проміжну сполука Z6 (Z5) (Z6) Суміш із 73,4мл (0,5моль) етилового ефіру 2бромізомасляної кислоти, 87,1мл (0,75моль) 3метил-1-бутиламіну, 82,5г (0,6моль) йодиду натрію та 76,0г (0,6моль) карбонату калію в 1000мл етилового ефіру оцтової кислоти кип'ятили впродовж 3 днів зі зворотним холодильником. Потім присутні солі відфільтровували й фільтрат концентрували. Вихід: 97,0г сполуки Z5a (масло червоного кольору). 49,0г (0,25моль) 2,4-дихлор-5-нітропіримідину та 38,3г (0,28моль) карбонату калію суспендували в 500мл ацетону та при 0°С змішували з 93,0г сполуки Z5a в 375мл ацетону. Потім реакційну суміш перемішували впродовж ночі при кімнатній температурі, фільтрували й концентрували. 6,0г (0,06моль) L-2-аміномасляної кислоти попередньо поміщали в 80мл 0,5-молярної сірчаної кислоти та при 0°С змішували з 5,5г (0,08моль) нітриту натрію в 15мл води. Реакційну суміш перемішували впродовж 22год. при 0°С, змішували з сульфатом амонію та фільтрували. Фільтрат екстрагували діетиловим ефіром й об'єднані органічні фази сушили над MgSO4 і концентрували. Вихід: 6,0г сполуки Z6a (масло жовтого кольору). 29 80743 200мл метанолу при охолодженні льодом послідовно змішували з 65,0мл (0,89моль) тіонілхлориду та 76,0г сполуки Z6a в 50мл метанолу. С уміш впродовж 1год. перемішували при 0°С та впродовж 2год. при кімнатній температурі і потім метанол і залишковий тіонілхлорид видаляли при 0°С у вакуумі. Вихід: 40,0г сполуки Z6b (масло жовтого кольору). 30,0мл (0,17моль) ангідриду трифторметансульфонової кислоти попередньо поміщали в 150мл дихлорметану та при охолодженні льодом змішували впродовж 1год. із розчином 20,0г сполуки Z6b та 14,0мл (0,17моль) піридину в 50мл дихлорметану. Суміш впродовж 2год. перемішували при кімнатній температурі, солі, що утворилися відокремлювали вакуумфільтрацією та потім промивали 100мл води. Органічну фазу сушили над MgSO 4 і концентрували. Вихід: 42,0г сполуки Z6c (масло світло-жовтого кольору). До розчину 15,5мл (0,17моль) аніліну та 24,0мл (0,17моль) триетиламіну в 400мл дихлорметану при охолодженні льодом по краплях додавали впродовж 1год. 42,0г сполуки Z6c в 200мл дихлорметану. Розчин впродовж 1год. перемішували при кімнатній температурі й ще впродовж 2год. при 35°С. Реакційну суміш промивали водою, сушили над MgSO4 і концентрували. Залишок, що утворився, очищали шляхом перегонки (95-100°С, 1-10-3мбар). Вихід: 14,0г сполуки Z6d (безбарвне масло). 14,0г сполуки Z6d та 16,0г (0,1моль) карбонату калію суспендували в 100мл ацетону та при 10°С змішували з 16,0г (0,08моль) 2,4-дихлор-5нітропіримідину. Потім суміш впродовж 4год. перемішували при 40°С, солі, що утворилися відокремлювали вакуум-фільтрацією й фільтрат концентрували. Залишок розчиняли в 300мл етилового ефіру оцтової кислоти та промивали водою. Органічну фазу сушили над MgSO4 і концентрували. Вихід: 31,0г сполуки Z6e (масло коричневого кольору). 31,0г сполуки Z6e розчиняли в 200мл льодяної оцтової кислоти та при 60°С змішували порціями з 10г залізного порошку, при цьому температура піднімалася до 85°С. Перемішування продовжували ще впродовж 1год. при 60°С, потім фільтрували через кізельгур і концентрували. Залишок розділяли шляхом перемішування з метанолом. Вихід: 4,5г сполуки Z6f (кристали коричневого кольору). До суміші 4,5г сполуки Z6f та 1,0мл (16ммоль) метилйодиду в 100мл диметилацетаміду при 20°С додавали порціями 0,6г (16ммоль) гідриду натрію у вигляді 60%-ої дисперсії в мінеральному маслі. Через 1год. реакційну суміш змішували з 50мл води й концентрували. Залишок розмішували з 200мл води й осад, що випав, відокремлювали вакуум-фільтрацією та промивали петролейним ефіром. Вихід: 4,5г сполуки Z6g (безбарвні кристали). 30 Суспензію 1,5г сполуки Z6g та 1,4г (8ммоль) метилового ефіру 4-аміно-3-метоксибензойної кислоти в 30мл толуолу змішували з 0,4г (0,6ммоль) 2,2'-біс(дифенілфосфіно)-1,1'бінафтилу, 0,23г (0,3ммоль) трис(дибензиліденацетон)дипаладію(0) та 7,0г (21ммоль) карбонату цезію й кип'ятили впродовж 17год. зі зворотним холодильником. Потім реакційну суміш наносили на силікагель й очищали хроматографією на колонці (елюент: дихлорметан/метанол у співвідношенні 9:1). Вихід: 1,7г сполуки Z6h (кристали жовтого кольору). 1,7г сполуки Z6h розчиняли в 50мл діоксану, змішували з 15мл напівконцентрованої соляної кислоти та кип'ятили впродовж 12год. зі зворотним холодильником. Після охолодження осад, що утворився, відокремлювали вакуум-фільтрацією. Вихід: 1,1г сполуки Z6 (безбарвна тверда речовина). Для синтезу сполук у прикладах 26, 20, 32, 56, 101, 112 та 209 спочатку одержують описаним нижче шляхом проміжну сполуку Z7 (Z7) 50,0г (0,36моль) метилового ефіру Оаланіну·НСI суспендували в 500мл дихлорметану й 35мл ацетону та змішували з 30,0г (0,37моль) ацетату натрію й 80,0г (0,38моль) триацетоксиборогідриду натрію. Потім перемішували впродовж 12год., після чого зливали на 400мл 10%-го розчину гідрокарбонату натрію. Органічну фазу сушили над Na2SO4 і концентрували. Вихід: 51,0г сполуки Z7a (масло жовтого кольору). Суспензію 51,0г сполуки Z7a в 450мл води змішували з 80,0г (0,41моль) 2,4-дихлор-5нітропіридину в 400мл діетилового ефіру. При -5°С по краплях додавали 100мл 10%-го розчину гідрокарбонату калію. Реакційну суміш перемішували впродовж 3год., органічну фазу сушили над Na2SO4 і концентрували. Вихід: 74г сполуки Z7b (масло жовтого кольору). 18,6г сполуки Z7b розчиняли в 200мл льодяної оцтової кислоти та при 60°С змішували порціями з 20,0г залізного порошку. Суміш впродовж 2год. перемішували при 60°С і потім проводили вакуумфільтрацію через целюлозу. Залишок розчиняли в етиловому ефірі оцтової кислоти та промивали водою та концентрованим аміаком. Органічну фазу сушили над Na2SO4 і концентрували. Залишок кристалізували з діетилового ефіру. Вихід: 9,8г сполуки Z7c (безбарвні кристали). 17,0г сполуки Z7c та 7мл (0,1моль) метилйодиду розчиняли в 200мл 31 80743 диметилацетаміду та при -5°С змішували з 4,0г (0,1моль) гідриду натрію у вигляді 60%-ої дисперсії в мінеральному маслі. Реакційну суміш перемішували впродовж 30хв. і потім зливали на 300мл суміші води та льоду. Осад, що утворився, відокремлювали вакуум-фільтрацією та виділяли шляхом розмішування з петролейним ефіром. Вихід: 14,8г сполуки Z7d (кристали бежевих кольорів). 0,9г сполуки Z7d та 1,5г (9ммоль) 4-аміно-3метоксибензойної кислоти нагрівали до 210°С з витримуванням при цій температурі впродовж 30хв. Після охолодження залишок розділяли шляхом перемішування з етиловим ефіром оцтової кислоти й осад, що утворився, відокремлювали вакуум-фільтрацією. Вихід: 1,2г сполуки Z7 (кристали сірого кольору). Аналогічно описаним вище варіантам синтезу одержували серед інших наступні кислоти: 32 8,7мл морфоліну та 9,3мл 2-нітропропану попередньо поміщали спільно в реакційну посудину при охолодженні льодом, а потім повільно додавали по краплях 7,5мл формальдегіду (37%) і 4мл 0,5-молярного розчину NaOH (
ДивитисяДодаткова інформація
Назва патенту англійськоюDihydropteridinones, method for the production and use thereof in the form of drugs
Автори англійськоюHoffmann Matthias, Grauert Matthias, Breitfelder Steffen, Eickmeier Christian, Steegmaier Martin, Schnapp Gisela, Baum Anke, Quant Jens Juergen, Solca Flavio, Colbatzky Florian
Назва патенту російськоюДигидроптеридиноны, способ их получения и их применение в качестве лекарственного средства
Автори російськоюХоффманн Маттиас, Грауэрт Маттиас, Брайтфельдер Штеффен, Айкмайер Кристиан, Штеегмайер Мартин, Шнапп Гизела, Баум Анке, Квант Йенс Юрген, Золька Флавио, Кольбатцкі Флориан
МПК / Мітки
МПК: A61K 31/519, C07D 295/033, A61P 35/00, C07D 475/00
Мітки: лікарського, спосіб, одержання, дигідроптеридинони, застосування, засобу
Код посилання
<a href="https://ua.patents.su/31-80743-digidropteridinoni-sposib-kh-oderzhannya-ta-kh-zastosuvannya-yak-likarskogo-zasobu.html" target="_blank" rel="follow" title="База патентів України">Дигідроптеридинони, спосіб їх одержання та їх застосування як лікарського засобу</a>
Попередній патент: Противірусний лікарський засіб
Наступний патент: Спосіб захисту нержавіючої сталі від корозії в сірчаній кислоті
Випадковий патент: Гідроелектрична установка