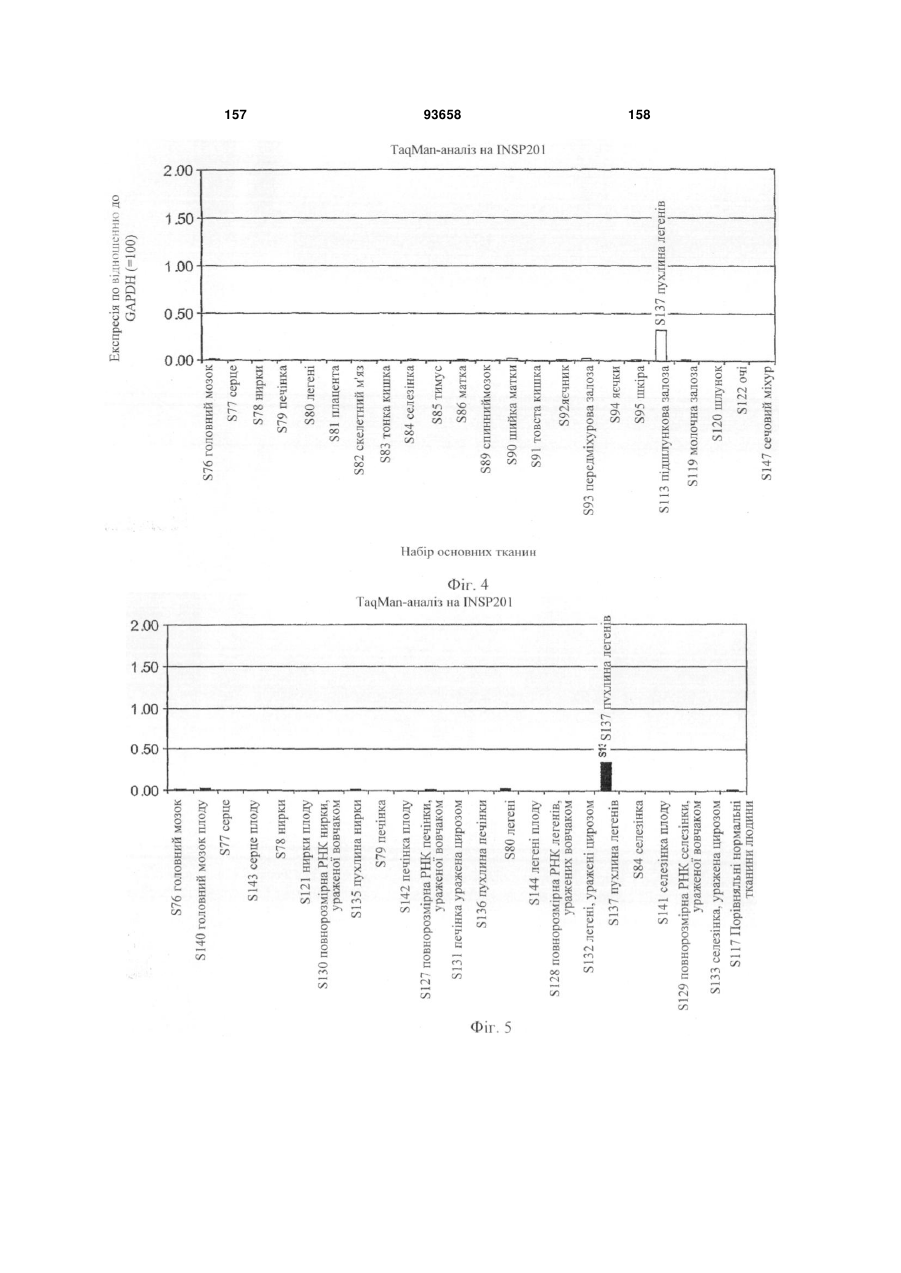
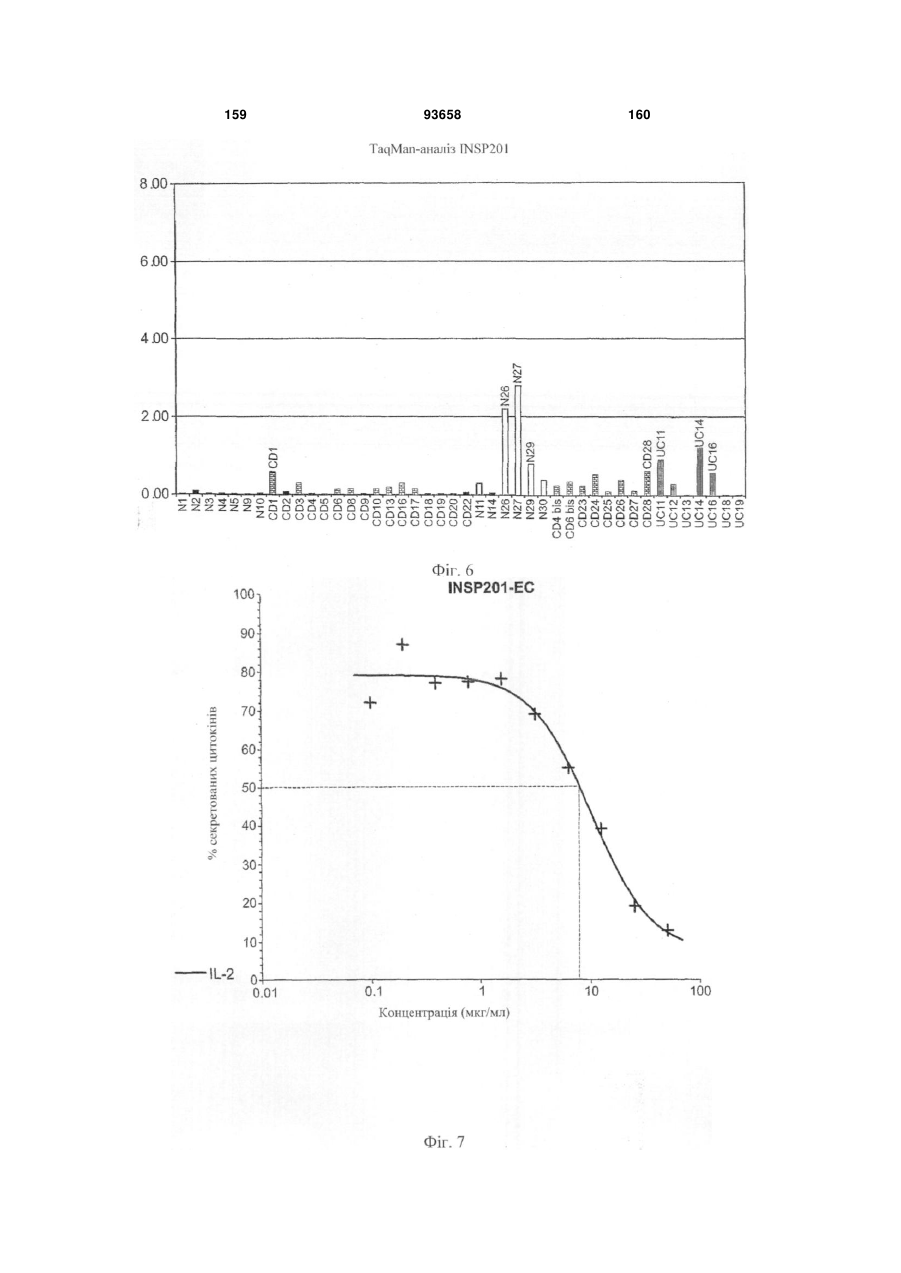
Глікопротеїн клітинної поверхні
Номер патенту: 93658
Опубліковано: 10.03.2011
Автори: Бенковска Ядвіга, Фаган Річард, Йорке-Сміт Мелані, Пауер Крістін, Фітцджералд Стефен
Формула / Реферат
1. Поліпептид, який
(i) містить амінокислотну послідовність, представлену в SEQ ID NО:2; SEQ ID NО:4, SEQ ID NО:6, SEQ ID NО:8, SEQ ID NО:10, SEQ ID NО:12, SEQ ID NО:14, SEQ ID NО:16, SEQ ID NО:18, SEQ ID NО:20, SEQ ID NО:22, SEQ ID NО:24, SEQ ID NО:26, SEQ ID NО:28 і/або SEQ ID NО:30; або
(ii) являє собою функціональний еквівалент (і), ідентичність якого амінокислотній послідовності, вказаної в підпункті (і), більше 80 % і який є представником сімейства глікопротеїнів клітинної поверхні.
2. Поліпептид за п. 1, який містить амінокислотну послідовність, представлену в SEQ ID NО:8, SEQ ID NО:12, SEQ ID NО:24, SEQ ID NО:30, SEQ ID NО:2, SEQ ID NО:10, SEQ ID NО:14, SEQ ID NО:18, SEQ ID NО:20, SEQ ID NО:22, SEQ ID NО:26 і/або SEQ ID NО:28.
3. Поліпептид за п. 1 або 2, який складається з амінокислотної послідовності, представленої в SEQ ID NО:2, SEQ ID NО:4, SEQ ID NО:6, SEQ ID NО:8, SEQ ID NО:10, SEQ ID NО:12, SEQ ID NО:14, SEQ ID NО:16, SEQ ID NО:18, SEQ ID NО:20, SEQ ID NО:22, SEQ ID NО:24, SEQ ID NО:26, SEQ ID NО:28, і/або SEQ ID NО:30.
4. Поліпептид за п. 1, причому функціональний еквівалент ідентичний амінокислотній послідовності SEQ ID NО:2; SEQ ID NО:4, SEQ ID NО:6, SEQ ID NО:8, SEQ ID NО:10, SEQ ID NО:12, SEQ ID NО:14, SEQ ID NО:16 або SEQ ID NО:18 більше ніж на 85 %, 90 %, 95 %, 98 % або 99 %.
5. Поліпептид за будь-яким з пп. 1-4 для терапії або діагностики захворювання.
6. Очищена молекула нуклеїнової кислоти, яка кодує поліпептид за будь-яким з попередніх пунктів.
7. Молекула нуклеїнової кислоти за п. 6 для терапії або діагностики захворювання.
8. Вектор, який містить молекулу нуклеїнової кислоти за п. 6.
9. Вектор за п. 8 для терапії або діагностики захворювання.
10. Клітина-хазяїн, трансформована вектором за п. 8.
11. Антитіло, яке специфічно зв'язується з глікопротеїном клітинної поверхні за будь-яким з пп.1-4.
12. Антитіло за п. 11 для терапії або діагностики захворювання.
13. Гібридний поліпептид, який містить поліпептид за будь-яким з пп. 1-4, злитий з гетерологічною амінокислотною послідовністю.
14. Гібридний поліпептид за п. 13, де вказаною гетерологічною амінокислотною послідовністю є константний домен IgG або його фрагмент або домен hCG або його фрагмент.
15. Гібридний поліпептид за п. 13 або п. 14 для терапії або діагностики захворювання.
16. Спосіб діагностики захворювання у пацієнта, який включає оцінку рівня експресії природного гена, що кодує поліпептид за будь-яким з пп. 1-4, або оцінку активності поліпептиду за будь-яким з пп. 1-4 у тканині вказаного пацієнта, і порівняння вказаного рівня експресії або активності з контрольним рівнем, де рівень, що відрізняється від вказаного контрольного рівня, є ознакою наявності захворювання.
17. Спосіб за п. 16, який включає в себе стадії
а) контактування зразка тканини, взятої у пацієнта, з нуклеїновокислотним зондом у жорстких умовах, що сприяють утворенню гібридного комплексу між молекулою нуклеїнової кислоти за п. 6 і вказаним зондом;
b) контактування контрольного зразка з вказаним зондом в умовах, аналогічних умовам стадії (а); і
с) детектування присутності гібридних комплексів у вказаних образах, де детектування рівнів вказаного гібридного комплексу у зразку, взятому у даного пацієнта, які відрізняються від рівнів гібридного комплексу в контрольному зразку, вказує на наявність захворювання.
18. Застосування поліпептиду за будь-яким з пп. 1-4 як глікопротеїну клітинної поверхні.
19. Фармацевтична композиція, яка містить поліпептид за будь-яким з пп.1-4.
20. Вакцинна композиція, яка містить поліпептид за будь-яким з пп. 1-4 або молекулу нуклеїнової кислоти за п. 6.
21. Набір, який використовується для діагностики захворювання і який включає в себе перший контейнер, що містить нуклеїновокислотний зонд, який гібридизується в жорстких умовах з молекулою нуклеїнової кислоти за п. 6; другий контейнер, що містить праймери, які підходять для ампліфікації вказаної молекули нуклеїнової кислоти; і інструкції з використання зонда і праймерів для полегшення діагностики захворювання.
Текст
1. Поліпептид, який (i) містить амінокислотну послідовність, представлену в SEQ ID NО:2; SEQ ID NО:4, SEQ ID NО:6, SEQ ID NО:8, SEQ ID NО:10, SEQ ID NО:12, SEQ ID NО:14, SEQ ID NО:16, SEQ ID NО:18, SEQ ID NО:20, SEQ ID NО:22, SEQ ID NО:24, SEQ ID NО:26, SEQ ID NО:28 і/або SEQ ID NО:30; або (ii) являє собою функціональний еквівалент (і), ідентичність якого амінокислотній послідовності, вказаної в підпункті (і), більше 80 % і який є представником сімейства глікопротеїнів клітинної поверхні. 2. Поліпептид за п. 1, який містить амінокислотну послідовність, представлену в SEQ ID NО:8, SEQ ID NО:12, SEQ ID NО:24, SEQ ID NО:30, SEQ ID NО:2, SEQ ID NО:10, SEQ ID NО:14, SEQ ID NО:18, SEQ ID NО:20, SEQ ID NО:22, SEQ ID NО:26 і/або SEQ ID NО:28. 3. Поліпептид за п. 1 або 2, який складається з амінокислотної послідовності, представленої в SEQ ID NО:2, SEQ ID NО:4, SEQ ID NО:6, SEQ ID NО:8, SEQ ID NО:10, SEQ ID NО:12, SEQ ID NО:14, SEQ ID NО:16, SEQ ID NО:18, SEQ ID NО:20, SEQ ID NО:22, SEQ ID NО:24, SEQ ID NО:26, SEQ ID NО:28, і/або SEQ ID NО:30. 4. Поліпептид за п. 1, причому функціональний еквівалент ідентичний амінокислотній послідовності SEQ ID NО:2; SEQ ID NО:4, SEQ ID NО:6, 2 (19) 1 3 93658 4 го гібридного комплексу у зразку, взятому у даного пацієнта, які відрізняються від рівнів гібридного комплексу в контрольному зразку, вказує на наявність захворювання. 18. Застосування поліпептиду за будь-яким з пп. 14 як глікопротеїну клітинної поверхні. 19. Фармацевтична композиція, яка містить поліпептид за будь-яким з пп.1-4. 20. Вакцинна композиція, яка містить поліпептид за будь-яким з пп. 1-4 або молекулу нуклеїнової кислоти за п. 6. 21. Набір, який використовується для діагностики захворювання і який включає в себе перший контейнер, що містить нуклеїновокислотний зонд, який гібридизується в жорстких умовах з молекулою нуклеїнової кислоти за п. 6; другий контейнер, що містить праймери, які підходять для ампліфікації вказаної молекули нуклеїнової кислоти; і інструкції з використання зонда і праймерів для полегшення діагностики захворювання. Даний винахід стосується нового білка, що позначається INSP201 та ідентифікований у даній заявці як глікопротеїн клітинної поверхні, і застосування цього білка і послідовностей нуклеїнової кислоти, яка містить гени, що кодують вказаний білок, з метою діагностики, попередження і лікування захворювань. Всі цитовані тут публікації, патенти і патентні заявки у всій своїй повноті вводяться у даний опис за допомогою посилання. Попередній рівень техніки У наш час, у галузі розробки лікарських засобів відбувся крутий перелом, який поклав початок новій ері функціональної геноміки, що прийшла на зміну старим методам. Термін "функціональна геноміка" застосовується до способів використання засобів біоінформатики для приписування функцій послідовностям білків, що представляють інтерес для фахівців. Такі засоби стають все більш необхідними, і це пов'язано з тим, що оснащення науково-дослідних лабораторій, які займаються визначенням функцій послідовностей цих білків, поки не дає можливості швидко обробляти все наростаючий потік даних про послідовності цих білків. Оскільки ефективність і точність методів біоінформатики зростає, ці методи швидко витісняють стандартні методи біохімічної характеризації. Дійсно, сучасні засоби біоінформатики, що використовуються для ідентифікації білків відповідно до винаходу, дозволяють одержувати остаточні результати з достатньою високим ступенем достовірності. Різні інститути і комерційні організації займаються обробкою даних, що безперервно надходять, про послідовності, і на основі одержаних результатів вони приходять до важливих відкриттів. Однак, необхідність в ідентифікації та характеризації інших генів і поліпептидів, що кодуються цими генами, з метою їх подальшого дослідження і пошуку нових лікарських засобів, все ще залишається актуальною. Вступ Білки, що секретуються Здатність клітин продукувати і секретувати позаклітинні білки є головним фактором у багатьох біологічних процесах. Ферменти, фактори росту, білки позаклітинного матриксу і молекули, що передають сигнали, секретуються клітинами. Це відбувається внаслідок злиття секреторної везикули з плазматичною мембраною. У більшості випадків, але не завжди, білки транспортуються в ендоплазматичний ретикулум і у секреторні везикули за допомогою сигнального пептиду. Сигнальні пептиди являють собою цис-активні послідовності, які впливають на транспорт поліпептидних ланцюгів з цитоплазми у мембрано-зв'язаний компартмент, такий як секреторна везикула. Поліпептиди, які доставляються у секреторні везикули, або секретуються у позаклітинний матрикс, або утримуються у плазматичній мембрані. Поліпептиди, які утримуються у плазматичній мембрані, мають один або декілька трансмембранних доменів. Прикладами сигнального пептиду, який грає головну роль у функціонуванні клітин, є цитокіни, гормони, білки позаклітинного матриксу (адгезивні молекули), протеази і фактори росту і диференціювання. Опис винаходу Даний винахід базується на виявленні того факту, що поліпептид INSP201 являє собою глікопротеїн клітинної поверхні. В одному з варіантів свого першого аспекту даний винахід стосується поліпептиду, який: (і) містить амінокислотну послідовність, представлену у SEQ ID NO:2; SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10, SEQ ID NO:12, SEQ ID NO:14, SEQ ID NO:16 і/або SEQ ID NO:18; (ii) являє собою її фрагмент, який є членом сімейства глікопротеїнів клітинної поверхні або має спільну антигенну детермінанту з поліпептидами (і), або (ііі) являє собою функціональний еквівалент (і) або (іі). Переважно, поліпептид відповідно до першого аспекту винаходу містить амінокислотну послідовність, представлену у SEQ ID NO:12. Такий переважний білок містить амінокислотну послідовність, представлену у SEQ ID NO:8. Відповідно до другого варіанту свого першого аспекту даний винахід стосується поліпептиду, що складається з амінокислотних послідовностей, представлених у SEQ ID NO:2; SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10, SEQ ID NO:12, SEQ ID NO:14, SEQ ID NO:16 і/або SEQ ID NO:18. Переважно, фрагментом, виключеним з об'єму даного винаходу, є фрагмент, що складається з перших 79 амінокислот SEQ ID NO:8. Цей фрагмент описаний у GenPept NCBI реєстр. № АХ884746 і у наведених нижче патентних докумен 5 тах під назвою Genset: US20050106595, US6822072, JP2001269182, JP2002511259, ЕР1033401, WO9953051 і US6783961. Поліпептид, що має послідовність, представлену у SEQ ID NO:2, буде далі називатися "поліпептидом екзону 1 INSP201". Поліпептид, що має послідовність, представлену SEQ ID NO:4, буде далі називатися "поліпептидом екзону 2 INSP201". Поліпептид, що має послідовність, представлену SEQ ID NO:6, буде далі називатися "поліпептидом екзону 3 INSP201". Поліпептид, що має послідовність, представлену SEQ ID NO:8, буде далі називатися "повнорозмірним поліпептидом INSP201". Не претендуючи на яку-небудь теорію, заявники лише припускають, що перші 21 амінокислота поліпептиду INSP201 утворюють сигнальний пептид. Поліпептид екзону 1 INSP201, що не містить цієї передбачуваної сигнальної послідовності, представлений у SEQ ID NO:10. Повнорозмірна послідовність поліпептиду INSP201, що не містить цієї передбачуваної сигнальної послідовності, представлена у SEQ ID NO:12. Поліпептид, що має послідовність, представлену SEQ ID NO:10, буде далі називатися "зрілим поліпептидом екзону 1 INSP201". Поліпептид, що має послідовність, представлену SEQ ID NO:12, буде далі називатися "зрілим поліпептидом INSP201". У даній заявці висловлюється припущення, що поліпептид INSP201 містить визначене число можливих сайтів N-глікозилування. Відповідно до цього, глікопротеїни, що містять (або що складаються з) поліпептид(у) INSP201, модифікований(ого) за допомогою N-глікозилування в одному, двох, трьох, чотирьох, п'яти, шести або семи положеннях, які відповідають Asn124, Asn156, Asn188, Asn204, Asn220, Asn250 і Asn268 SEQ ID NO:8, є аспектами даного винаходу. У даній заявці висловлюється припущення, що поліпептид INSP201 містить трансмембранну область, локалізовану між залишками 406-427, включно, послідовності SEQ ID NO:8. Відповідно до цього, позаклітинні варіанти поліпептиду INSP201 є аспектами даного винаходу. Переважно, щоб такі варіанти включали позаклітинні форми, що містять, або такі, що складаються з них, амінокислотні залишки 1-405 SEQ ID NO:8, або залишки 22405, включно, послідовності SEQ ID NO:8, в їх апоі N-глікозилованих формах, описаних вище. Поліпептид, що має послідовність, представлену у SEQ ID NO:14, буде далі називатися "позаклітинним поліпептидом INSP201". Поліпептид, що має послідовність, представлену у SEQ ID NO:18, буде далі називатися "зрілим позаклітинним поліпептидом INSP201", і цей поліпептид не включає амінокислоти, які, можливо, утворюють сигнальну послідовність поліпептиду INSP201. Поліпептидні варіанти такого типу можуть бути, зокрема, використані у скринінг-аналізах на ліганди, такі як ліганди, що секретуються, які зв'язуються з поліпептидом INSP201 і з іншими білками вказаного типу. Такі варіанти можуть бути також використані для кількісної оцінки вказаних лігандів, наприклад, для діагностики захворювань, 93658 6 у патогенезі яких ці ліганди і вказаний поліпептид відіграють визначену роль. Аспектом даного винаходу також є внутрішньоклітинний варіант поліпептиду INSP201. Таким варіантом є поліпептид, що складається з амінокислотних залишків 428-518, включно, послідовності SEQ ID NO:8. Поліпептид, що має послідовність, представлену у SEQ ID NO:16, буде далі називатися "внутрішньоклітинним поліпептидом INSP201". Використовуваний тут термін "поліпептиди INSP201" включає поліпептиди, що містять поліпептид екзону 1 INSP201, поліпептид екзону 2 INSP201, поліпептид екзону 3 INSP201, повнорозмірний поліпептид INSP201, зрілий поліпептид екзону 1 INSP201, зрілий поліпептид INSP201, позаклітинний поліпептид INSP201, зрілий позаклітинний поліпептид INSP201 і внутрішньоклітинний поліпептид INSP201. Все ці поліпептиди є аспектами даного винаходу. Відповідно до зазначених вище варіантів першого аспекту даного винаходу, переважно, щоб такий поліпептид функціонував як білок, що секретується, зокрема, як член сімейства глікопротеїнів клітинної поверхні. Глікопротеїни клітинної поверхні представляють значний інтерес для фахівця у галузі біології людини, а значить, і фізіології людини, а також у галузі охорони здоров'я. Очевидно, що зовнішня поверхня клітинної мембрани грає важливу роль в утворенні тканин і у збереженні їх цілісності. Зовнішні поверхні таких, що розвиваються, і диференційованих клітин містять рецепторні молекули, що розпізнають системні сигнали, ліганди або гормони. Зв'язування або дисоціація лігандів регулює деякі з різних функцій клітин, і приводить їх у відповідність до вимог всієї системи організму. Зовнішня поверхня клітин також покрита глікопротеїнами і протеогліканами. Такі великі комплекси білка і полісахаридів утворюють тканиноспецифічний матрикс, в якому клітини, що мають аналогічну функцію, можуть діяти спільно як єдина тканина. При ембріогенезі, сортування і об'єднання клітин, що мають спільну функцію, полегшується, і, ймовірно, регулюється, завдяки молекулярній специфічності глікопротеїнових і протеогліканових поверхонь даних клітин. Вуглеводні ланцюги являють собою глікопротеїни, що зв'язані N- і О-глікозидними зв'язками і утворюють складні структури. Фактично, N- і Огліканові ланцюги формуються в ендоплазматичному ретикулумі і в апараті Гольджі внаслідок регульованого каскаду глікотрансферазних і глікозидазних реакцій процесингу під впливом подій специфічної регуляції (наприклад, на рівні експресії гена або локалізації ферменту). Така комплексна регуляція приводить до утворення сотень структур, деякі з яких варіюються, в залежності від типу клітин/тканини або стадії їх розвитку/диференціювання. У наш час спостерігається все зростаючий інтерес до захворювань, які викликаються порушенням глікозилування, і до терапевтичних глікопротеїнів, що продукуються методами рекомбінантних ДНК. Зокрема, патологічні клітини можуть містити 7 відносні кількості вказаних структур, які, у більшості випадків, відрізняються від нормальних клітин за своїми властивостями, і можуть бути використані з метою визначення стадії захворювання і з метою діагностики. Інформація про структури глікопротеїнів, що асоційовані з даним захворюванням, і про їх функції, може бути використана у терапії, наприклад, в імунотерапії, для блокування клітинної адгезії або запобігання іншим процесам зв'язування або іншим біологічним процесам (Brockhausen I. et al., Acta Anat. 1998; 161(1-4):36-78; Bhatia P.K. & Mukhopadhyay Α., Adv. Biochem. Eng. Biotechnol. 1999; 64:155-201). Так, наприклад, був досліджений взаємозв'язок між характером глікозилування/експресії глікопротеїнів і прогресуванням раку/розвитком злоякісних захворювань (Dennis J.W. et al., Biocheim. Biophys. Acta. 1999 Dec. 6; 1473(1):21-34) або спадкових захворювань (Dennis J.W. et al., Bioassays. 1999 May; 21(5):412-21). З врахуванням того, що глікопротеїни звичайно експресуються у вигляді сумішей глікоформ, були розроблені різні методи одержання гомогенних глікопептидних і глікопротеїнових матеріалів для їх використання в експериментах, що проводяться з метою біологічного дослідження глікопротеїнів. (Grogan MJ. et al., Annu.Rev.Biochem. 2002; 71:593-634). Багато глікопротеїнів клітинної поверхні піддаються обмеженому протеолізу під дією клітинних протеаз. Такий механізм "злущування" сприяє секреції позаклітинних доменів, які можуть впливати на активність зв'язування інших циркулюючих білків, розпізнаваних цими позаклітинними доменами. Фактично, таке "злущування" позаклітинних доменів внаслідок зміни клітинних відповідей на екзогенні подразники, приводить до розвитку ряду патофізіологічних процесів, таких як запалення, дегенерація і апоптоз клітин, а також онкогенез, як було показано внаслідок інтенсивного дослідження систем "цитокін/рецептор цитокіну" (Mullberg J. et al., Eur. Cytokine Netw. 2000 Mar; 11(1):27-38; Arribas J. & Merlos-Suarez A. Curr. Top. Dev. Biol. 2003; 54:125-44; Dello Sbarba P. & Rovida E; Biol. Chem. 2002 Jan; 383(1):69-83). Поліпептиди відповідно до першого аспекту даного винаходу можуть додатково містити гістидинову мітку. Така гістидинова мітка, переважно, присутня біляС-кінця даного поліпептиду. Переважно, така гістидинова мітка містить 1-10 гістидинових залишків (наприклад, 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10 залишків). Більш переважно, вказана гістидинова мітка містить 6 гістидинових залишків. "Антигенна детермінанта" відповідно до винаходу може являти собою частину поліпептиду відповідно до винаходу, яка зв'язується з антигензв'язувальним сайтом антитіла або з Т-клітинним рецептором (TCR). Альтернативно, "антигенна детермінанта" може являти собою сайт на поверхні поліпептиду відповідно до винаходу, з яким зв'язується одна молекула антитіла. Взагалі, антиген має декілька або множину різних антигенних детермінант і реагує з антитілами, що володіють множиною різних специфічностей. Таке антитіло переважно є імуноспецифічним до поліпептиду 93658 8 відповідно до винаходу. Переважно, вказане антитіло є імуноспецифічним до поліпептиду відповідно до винаходу, який не становить частину гібридного білка. Переважно, вказане антитіло є імуноспецифічним до INSP201 або до його фрагмента. Антигенні детермінанти звичайно складаються з хімічно активних поверхневих груп молекул, таких як бічні ланцюги амінокислот або цукрів, і можуть мати специфічні тривимірні структури, а також визначений заряд. Переважно, термін "антигенна детермінанта" означає конкретну хімічну групу на поліпептиді відповідно до винаходу, яка є антигенною, тобто виробляє специфічну імунну відповідь. У другому своєму аспекті даний винахід стосується очищеної молекули нуклеїнової кислоти, що кодує поліпептид відповідно до першого аспекту винаходу. Термін "очищена молекула нуклеїнової кислоти" переважно означає молекулу нуклеїнової кислоти відповідно до винаходу, яка: (1) відділена, щонайменше приблизно від 50% білків, ліпідів, вуглеводів або інших сполук, з якими асоціюється природна повнорозмірна нуклеїнова кислота при її виділенні з клітин-джерел; (2) не зв'язана з усіма полінуклеотидами або з їх частиною, з якими вказана "очищена молекула нуклеїнової кислоти" асоціюється у природі, (3) функціонально приєднана до полінуклеотиду, з яким вона не асоціюється у природі; або (4) не зустрічається у природі як частина більш великої полінуклеотидної послідовності. Переважно, виділена молекула нуклеїнової кислоти відповідно до винаходу, по суті, не містить будь-якої(их) іншої(их) домішкової(их) молекули(молекул) нуклеїнової кислоти або інших домішок, які присутні в її природному оточенні і можуть перешкоджати використанню цієї нуклеїнової кислоти для продукування поліпептидів або її терапевтичному, діагностичному або профілактичному застосуванню або застосуванню з метою дослідження. Переважний варіант винаходу, зокрема, стосується молекул геномних ДНК, які не входять в об'єм даного винаходу. Переважно, геномна ДНК, зокрема, що має розмір більш ніж 10 т.п.н. (тисяч пар нуклеотидів), 50 т.п.н., 100 т.п.н., 150 т.п.н., 200 т.п.н., 250 т.п.н. або 300 т.п.н., не входить в об'єм винаходу. При цьому переважно, якщо така "очищена молекула нуклеїнової кислоти" складається тільки з кДНК. Переважно, очищена молекула нуклеїнової кислоти містить послідовність нуклеїнової кислоти, представлену у SEQ ID NO:1 (що кодує поліпептид екзону 1 INSP201), SEQ ID NO:3 (що кодує поліпептид екзону 2 INSP201), SEQ ID NO:5 (що кодує поліпептид екзону 3 INSP201), SEQ ID NO:7 (що кодує поліпептид INSP201), SEQ ID NO:9 (що кодує зрілий поліпептид екзону 1 INSP201), SEQ ID NO:11 (що кодує зрілий поліпептид INSP201), SEQ ID NO:13 (що кодує позаклітинний поліпептид INSP201), SEQ ID NO:15 (що кодує внутрішньоклітинний поліпептид INSP201) або SEQ ID NO:17 (що кодує зрілий позаклітинний поліпептид INSP201), або являє собою надмірний еквівалент або фрагмент будь-якої з вказаних послідовностей. 9 Даний винахід також стосується очищеної молекули нуклеїнової кислоти, що складається з послідовності нуклеїнової кислоти, представленої у SEQ ID NO:1 (що кодує поліпептид екзону 1 INSP201), SEQ ID NO:3 (що кодує поліпептид екзону 2 INSP201), SEQ ID NO:5 (що кодує поліпептид екзону 3 INSP201), SEQ ID NO:7 (що кодує поліпептид INSP201), SEQ ID NO:9 (що кодує зрілий поліпептид екзону 1 INSP201), SEQ ID NO:11 (що кодує зрілий поліпептид INSP201), SEQ ID NO:13 (що кодує позаклітинний поліпептид INSP201), SEQ ID NO:15 (що кодує внутрішньоклітинний поліпептид INSP201) або SEQ ID NO:17 (що кодує зрілий позаклітинний поліпептид INSP201), або що являє собою надмірний еквівалент або фрагмент будь-якої з вказаних послідовностей. У своєму третьому аспекті даний винахід стосується очищеної молекули нуклеїнової кислоти, яка гібридизується в умовах високої жорсткості з молекулою нуклеїнової кислоти другого аспекту даного винаходу. Умови гібридизації високої жорсткості визначають як умови інкубування протягом ночі при 42°С у розчині, що містить 50% формамід, 5XSSC (150 мМ NaCl, 15 мМ тринатрійцитрат), 50 мМ фосфат натрію (рН 7,6), 5х розчин Денхардта, 10% сульфат декстрану і 20 мікрограмів/мл денатурованої фрагментованої ДНК сперми лосося, з подальшим промиванням фільтрів в 0,1 X SSC приблизно при 65°С. Використовуваний тут термін "функціональний еквівалент" означає молекулу білка або нуклеїнової кислоти, що володіє функціональними або структурними властивостями, в основному аналогічними властивостям молекули поліпептиду або нуклеїнової кислоти відповідно до винаходу. Функціональний еквівалент білка може містити модифікації, якщо такі модифікації необхідні для здійснення конкретної функції. Термін "функціональний еквівалент" включає фрагменти, мутанти, гібриди, варіанти, аналоги або хімічні похідні молекули. Переважно "функціональним еквівалентом" може бути молекула білка або нуклеїнової кислоти, що володіє будь-якою однією або декількома функціональними активностями поліпептидів відповідно до винаходу. Переважно "функціональним еквівалентом" може бути молекула білка або нуклеїнової кислоти, що володіє активністю, яка, по суті, аналогічна активності INSP201 або його фрагмента, виміряній у відповідному аналізі на біологічну активність або функцію. Переважно "функціональним еквівалентом" може бути молекула білка або нуклеїнової кислоти, що володіє активністю, яка ідентична активності або перевищує активність INSP201 або його фрагмента, виміряну у відповідному аналізі на біологічну активність або функцію. Переважно "функціональним еквівалентом" може бути молекула білка або нуклеїнової кислоти, що володіє активністю, яка становить 50%, 60%, 70%, 80%, 90%, 95%, 98%, 99%, 100% або більше від активності INSP201 або його фрагментів, виміряної у відповідному аналізі на біологічну активність або функцію. 93658 10 Переважно "функціональним еквівалентом" може бути білок або поліпептид, що володіє in vivo або in vitro активністю, яка по суті аналогічна активності поліпептидів відповідно до винаходу. Переважно, "функціональним еквівалентом" може бути білок або поліпептид, здатний взаємодіяти з іншими клітинними або позаклітинними молекулами по механізму, який, по суті, аналогічний механізму взаємодії відповідної частини поліпептидів відповідно до винаходу. Так, наприклад, в імуноаналізі, "функціональний еквівалент" може сприяти зниженню здатності до зв'язування антитіла з відповідним пептидом (тобто, пептидом, що має модифіковану амінокислотну послідовність, а тому є "функціональним еквівалентом") поліпептиду відповідно до винаходу, або з самим поліпептидом відповідно до винаходу, де вказане антитіло виробляється проти відповідного пептиду поліпептиду відповідно до винаходу. Еквімолярна концентрація вказаного функціонального еквівалента буде знижувати рівень зазначеного вище зв'язування відповідного пептиду щонайменше приблизно на 5%, переважно, приблизно на 5-10%, більш переважно, приблизно на 10-25%, ще більш переважно, приблизно на 25-30%, і найбільш переважно, приблизно на 40-50%. Так, наприклад, функціональні еквіваленти можуть бути повністю функціональними, або у них може бути відсутня одна або декілька активностей. Таким чином, відповідно до даного винаходу, модифікації можуть впливати на функцію, наприклад, на активності поліпептиду, які підтверджують їх ідентифікацію як глікопротеїну клітинної поверхні. У своєму четвертому аспекті даний винахід стосується вектора, такого як експресуючий вектор, який містить молекулу нуклеїнової кислоти другого або третього аспекту даного винаходу. У своєму п'ятому аспекті даний винахід стосується клітини-хазяїна, трансформованого вектором четвертого аспекту даного винаходу. У своєму шостому аспекті даний винахід стосується ліганду, який специфічно зв'язується з членами сімейства глікопротеїнів клітинної поверхні відповідно до першого аспекту винаходу. Переважно, такий ліганд інгібує функцію поліпептиду відповідно до першого аспекту винаходу, який є членом сімейства глікопротеїнів клітинної поверхні. Ліганди для поліпептидів відповідно до винаходу можуть мати різні форми, включаючи природні або модифіковані субстрати, ферменти, рецептори, невеликі органічні молекули, такі як невеликі природні або синтетичні органічні молекули розміром 2000 Да, а переважно, 800 Да або менше, пептидоміметики, неорганічні молекули, пептиди, поліпептиди, антитіла, і їх структурні або функціональні міметики. У своєму сьомому аспекті даний винахід стосується сполуки, яка є ефективною з точки зору зміни експресії природного гена, що кодує поліпептид відповідно до першого аспекту винаходу, або з точки зору регуляції активності поліпептиду відповідно до першого аспекту винаходу. Такі сполуки можуть бути ідентифіковані із застосуванням описаних тут методів аналізу і скринінгу. 11 Сполука відповідно до сьомого аспекту винаходу може або підвищувати (служити агоністом), або знижувати (служити антагоністом) рівень експресії гена або активності поліпептиду. Важливо зазначити, що ідентифікація функції поліпептиду INSP201 дає можливість розробити способи скринінгу, що дозволяють ідентифікувати сполуки, ефективні для лікування і/або діагностики захворювань. Позаклітинні і внутрішньоклітинні форми поліпептиду INSP201, можливо, є особливо придатними для їх застосування у способах скринінгу їх джерел. Ліганди і сполуки відповідно до шостого і сьомого аспектів винаходу можуть бути ідентифіковані з використанням таких способів. Ці способи також є аспектами даного винаходу. В іншому своєму аспекті даний винахід стосується застосування гена або поліпептиду INSP201 як мішені для скринінгу кандидатів на лікарські засоби-модулятори, а зокрема, лікарських засобівкандидатів, що володіють активністю, направленою проти розладів, асоційованих з глікопротеїном клітинної поверхні. В іншому своєму аспекті даний винахід стосується способів скринінгу сполук на можливість їх застосування для лікування розладів, асоційованих з глікопротеїном клітинної поверхні, де вказані способи включають в себе виявлення здатності вказаної сполуки зв'язуватися з геном або поліпептидом INSP201 або з їх фрагментами. У ще одному своєму аспекті даний винахід стосується способів скринінгу сполук на можливість їх застосування для лікування розладів, асоційованих з глікопротеїном клітинної поверхні, де вказані способи включають в себе аналіз на модуляцію активності гена або поліпептиду INSP201 або їх фрагментів. У своєму восьмому аспекті даний винахід стосується поліпептиду відповідно до першого аспекту даного винаходу або молекули нуклеїнової кислоти відповідно до другого або третього аспектів даного винаходу, або вектора відповідно до четвертого аспекту даного винаходу, або клітинихазяїна відповідно до п'ятого аспекту даного винаходу, або ліганду відповідно до шостого аспекту даного винаходу, або сполуки відповідно до сьомого аспекту даного винаходу, які можуть бути використані для лікування або діагностики захворювань, у патогенезі яких беруть участь члени сімейства глікопротеїнів клітинної поверхні. Такими захворюваннями можуть бути клітиннопроліферативні розлади, включаючи новоутворення, меланому, пухлини легенів, ободової кишки, молочної залози, підшлункової залози, голови і шиї та інші солідні пухлини; мієлопроліферативні розлади, такі як лейкоз, не-ходжкінська лімфома, лейкопенія, тромбоцитопенія, порушення ангіогенезу, саркома Капоші; аутоімунні/запальні захворювання, включаючи алергію, запальні захворювання кишечнику, артрит, псоріаз, запалення дихальних шляхів, астму і відторгнення трансплантованих органів; серцево-судинні захворювання, включаючи гіпертензію, набряки, стенокардію, атеросклероз, тромбоз, сепсис, інсульт, реперфузійне ураження та ішемію; неврологічні розлади, включаючи розлади центральної нервової систе 93658 12 ми, хворобу Альцгеймера, ушкодження головного мозку, аміотрофічний бічний склероз і болі; захворювання дихальних шляхів, включаючи хронічну обструктивну хворобу легенів і кістозний фіброз; порушення розвитку; метаболічні розлади, включаючи цукровий діабет, остеопороз і ожиріння; СНІД і ниркові захворювання; інфекції, включаючи вірусні інфекції, бактеріальні інфекції, грибкові інфекції і паразитарні інфекції, та інші патологічні стани. Такими захворюваннями, переважно, є захворювання, у патогенезі яких беруть участь глікопротеїни клітинної поверхні. Ці молекули можуть бути також використані з метою приготування лікарського засобу для лікування вказаних захворювань. Такі молекули можуть бути також використані для контрацепції або для лікування репродуктивних розладів, включаючи безпліддя. Молекули відповідно до винаходу (тобто поліпептиди відповідно до першого аспекту винаходу, молекула нуклеїнової кислоти відповідно до другого або третього аспектів винаходу, вектор відповідно до четвертого аспекту винаходу, клітинахазяїн відповідно до п'ятого аспекту винаходу, ліганд відповідно до шостого аспекту винаходу або сполука відповідно до сьомого аспекту винаходу) можуть бути, зокрема, використані для лікування або діагностики розладів/захворювань (у даному описі винаходу ці два терміни є взаємозамінними), включаючи запалення, дегенерацію і апоптоз клітин і онкогенез. У своєму дев'ятому аспекті даний винахід стосується способу діагностики захворювань у пацієнта, який включає в себе оцінку рівня експресії природного гена, що кодує поліпептид відповідно до першого аспекту винаходу, або оцінку активності поліпептиду відповідно до першого аспекту винаходу у тканині вказаного пацієнта і порівняння вказаного рівня експресії або активності з контрольним рівнем, де рівень, який відрізняється від вказаного контрольного рівня, є показником захворювання. Такий спосіб переважно здійснюють in vitro. Аналогічні способи можуть бути використані для моніторингу терапевтичного лікування захворювання у пацієнта, де зміна рівня експресії або активності молекули поліпептиду або нуклеїнової кислоти протягом визначеного періоду часу у порівнянні з контрольним рівнем служить показником рецидиву захворювання. Переважний спосіб детектування поліпептидів відповідно до першого аспекту винаходу включає в себе стадії: (а) контактування ліганду відповідно до шостого аспекту винаходу, такого як антитіло, з біологічним зразком в умовах, придатних для утворення комплексу ліганд-поліпептид; і (b) детектування вказаного комплексу. Що стосується дев'ятого аспекту винаходу, потрібно зазначити, що для детектування аномальних рівнів білка існують різні методи, відомі фахівцеві, такі як методи гібридизації нуклеїнової кислоти з короткими зондами, методи аналізу на точкову мутацію, метод ампліфікації за допомогою полімеразної ланцюгової реакції (ПЦР) і методи з використанням антитіл. Подібні методи можуть бути використані у короткий або тривалий період часу, що дозволяє проводити моніторинг терапев 13 тичного лікування захворювання у пацієнта. Даний винахід стосується також наборів, які можуть бути використані у вказаних методах діагностики захворювання. У своєму десятому аспекті даний винахід стосується використання поліпептиду відповідно до першого аспекту винаходу як глікопротеїну клітинної поверхні. Придатним застосуванням поліпептидів відповідно до винаходу як глікопротеїнів клітинної поверхні є їх використання як регулятора клітинного росту, метаболізму або диференціювання клітин; як частини пари рецептор/ліганд і як діагностичного маркера для детектування фізіологічного або патологічного стану. У своєму одинадцятому аспекті даний винахід стосується фармацевтичної композиції, що містить поліпептид відповідно до першого аспекту винаходу або молекулу нуклеїнової кислоти відповідно до другого або третього аспектів винаходу, або вектор відповідно до четвертого аспекту винаходу, або клітину-хазяїна відповідно до п'ятого аспекту винаходу, або ліганд відповідно до шостого аспекту винаходу, або сполуку відповідно до сьомого аспекту даного винаходу, у комбінації з фармацевтично прийнятним носієм. У своєму дванадцятому аспекті даний винахід стосується поліпептиду відповідно до першого аспекту винаходу або молекули нуклеїнової кислоти відповідно до другого або третього аспектів винаходу, або вектора відповідно до четвертого аспекту винаходу, або клітини-хазяїна відповідно до п'ятого аспекту винаходу, або ліганду відповідно до шостого аспекту винаходу, або сполуки відповідно до сьомого аспекту винаходу, які можуть бути використані з метою приготування лікарського засобу для діагностики або лікування захворювань, включаючи, але не обмежуючись ними, мієлопроліферативні розлади, такі як лейкоз, лімфома, мієлодиспластичні синдроми і карцинома, новоутворення, меланома, пухлини легенів, ободової кишки, молочної залози, підшлункової залози, голови і шиї, та інші солідні пухлин, гематологічні розлади, такі як макроглобулінемія, аутоімунні захворювання і запальні розлади, включаючи алергію, запальне захворювання кишечнику, артрит, псоріаз, розсіяний склероз, запалення дихальних шляхів, астму і відторгнення трансплантованих органів, В-клітинні розлади, серцевосудинні розлади, неврологічні розлади, порушення розвитку, безпліддя, порушення метаболізму, СНІД, ниркове захворювання, інфекції та інші патологічні стани. У своєму тринадцятому аспекті даний винахід стосується способу лікування захворювання у пацієнта, що передбачає введення вказаному пацієнту поліпептиду відповідно до першого аспекту винаходу, або молекули нуклеїнової кислоти відповідно до другого або третього аспектів винаходу, або вектора відповідно до четвертого аспекту винаходу, або клітини-хазяїна відповідно до п'ятого аспекту винаходу, або ліганду відповідно до шостого аспекту винаходу, або сполуки відповідно до сьомого аспекту винаходу. У тому випадку, якщо захворювання, при яких у даного пацієнта рівень експресії природного ге 93658 14 на, що кодує поліпептид відповідно до першого аспекту винаходу, або рівень активності поліпептиду відповідно до першого аспекту винаходу нижче, ніж відповідний рівень експресії або активності у здорового пацієнта, то поліпептид, молекула нуклеїнової кислоти, ліганд або сполука, що вводяться вказаному пацієнту, повинні володіти агоністичними властивостями. І навпаки, у випадку, якщо захворювання, при яких у даного пацієнта рівень експресії природного гена, що кодує поліпептид відповідно до першого аспекту винаходу, або рівень активності поліпептиду відповідно до першого аспекту винаходу вище, ніж відповідний рівень експресії або активності у здорового пацієнта, то поліпептид, молекула нуклеїнової кислоти, ліганд або сполука, що вводяться вказаному пацієнту, повинні володіти антагоністичними властивостями. Прикладами таких антагоністів є молекули антисмислової нуклеїнової кислоти, рибозими і ліганди, такі як антитіла. Поліпептиди INSP201 являють собою глікопротеїни клітинної поверхні, а тому вони грають визначену роль у розвитку багатьох патологічних станів. Антагоністи поліпептидів INSP201 представляють особливий інтерес, оскільки вони дозволяють сприятливо впливати на динаміку патологічних станів. У своєму чотирнадцятому аспекті даний винахід стосується трансгенних тварин або тварин, які є дефіцитними по поліпептиду першого аспекту даного винаходу і не є людиною, і які були трансформовані так, що вони експресують більш високі або більш низькі рівні вказаного поліпептиду або взагалі не експресують такого поліпептиду. Вказані трансгенні тварини є найбільш придатними моделями для дослідження захворювань, і можуть бути також використані у способах скринінгу з метою ідентифікації сполук, які є ефективними для лікування або діагностики даного захворювання. Різні стандартні методи і процедури, які можуть застосовуватися для здійснення винаходу, систематизовані нижче. При цьому потрібно зазначити, що даний винахід не обмежується описаними конкретними методами, протоколами, клітинними лініями, векторами і реагентами. Потрібно також зазначити, що використовувана тут термінологія застосовується тільки для опису конкретних варіантів винаходу, і ця термінологія не повинна розглядатися як обмеження об'єму даного винаходу. Об'єм винаходу обмежений тільки доданою формулою винаходу. У даному описі використовуються стандартні скорочення, прийняті для позначення нуклеотидів і амінокислот. Якщо це не обумовлено особливо, то для здійснення даного винаходу використовуються стандартні методи молекулярної біології і мікробіології, методи рекомбінантних ДНК і методи імунології, які добре відомі фахівцям у даній галузі. Більш повний опис вказаних методів можна знайти у літературі. Так, наприклад, найбільш придатні описи, які можуть бути використані як консультація, наводяться у наступних роботах: Sambrook, Molecular Cloning: A Laboratory Manual, Second Edition (1989); DNA Cloning, Volumes I and 15 II (D.N. Glover ed. 1985); Oligonucleotide Synthesis (M.J. Gait ed. 1984); Nucleic Acid Hybridization (B.D. Hames & S.J. Higgins eds. 1984); Transcription and Translation (B.D. Hames & S.J. Higgins eds. 1984); Animal Cell Culture (R.I. Freshney ed. 1986); Immobilized Cells and Enzymes (IRL Press, 1986); B. Perbal, A. Practical Guide to Molecular Cloning (1984); the Methods in Enzymology series (Academic Press, Inc.), especially volumes 154 & 155; Gene Transfer Vectors for Mammalian Cells (J.H. Miller and M.P. Calos eds. 1987, Cold Spring Harbor Laboratory); Immunochemical Methods in Cell and Molecular Biology (Mayer and Walker, eds. 1987, Academic Press, London); Scopes (1987) Protein Purification: Principles and Practice, Second Edition (Springer Verlag, N.Y.); і Handbook of Experimental Immunology, Volumes I-IV (D.M. Weir and C.C. Blackwell eds. 1986). Використовуваний тут термін "поліпептид" включає будь-який пептид або білок, що містить дві або більше амінокислот, зв'язаних одна з одною пептидними зв'язками або модифікованими пептидними зв'язками, тобто пептидними ізостерами. Цей термін стосується як коротких ланцюгів (пептидів або поліпептидів), так і більш довгих ланцюгів (білків). Поліпептид даного винаходу може бути присутнім у формі зрілого білка, або він може бути присутнім у вигляді пре-, про- або препро-білка, який може бути активований шляхом відщеплення пре-, про- або препро-частини цього білка з продукуванням активного зрілого поліпептиду. У таких поліпептидах, пре-, про- або препро-послідовність може являти собою лідерну або секреторну послідовність, або вона може являти собою послідовність, що використовується для очищення зрілої поліпептидної послідовності. Поліпептид відповідно до першого аспекту винаходу може утворювати частину гібридного білка. Так, наприклад, часто виявляється переважним, щоб даний поліпептид включав одну або декілька додаткових амінокислотних послідовностей, які можуть містити секреторну або лідерну послідовності, про-послідовності, послідовності, що полегшують очищення, або послідовності, що надають білку більш високу стабільність, наприклад, під час рекомбінантного продукування. Альтернативно або додатково, зрілий поліпептид може бути приєднаний до іншої сполуки, такої як сполука, що збільшує час напівжиття вказаного поліпептиду (наприклад, до поліетиленгліколю). Гібридний білок поліпептиду відповідно до першого аспекту винаходу може, наприклад, містити імуноглобуліновий гібрид, тобто, гібридний білок, що містить весь позаклітинний INSP201 (наприклад, INSP201-EC) або його фрагмент, злитий з повнорозмірним імуноглобуліном або його частиною. Методи одержання гібридних білків імуноглобуліну добре відомі фахівцям і описані, наприклад, у WO 01/03737. Фахівцям у даній галузі відомо, що одержаний гібридний білок відповідно до винаходу, по суті, зберігає біологічну активність поліпептиду відповідно до першого аспекту винаходу, таку, наприклад, як інгібування IL-2, яке може бути визначене в in vitro аналізах, описаних у 93658 16 прикладі 6, або в аналізі на рак, описаному у прикладі 7, або з використанням тварин-модєлей запального кишкового захворювання, описаних у прикладі 8. Вказаний гібрид може бути одержаний шляхом прямого приєднання компонентів або шляхом їх приєднання за допомогою короткого лінкерного пептиду, довжина якого може складати щонайменше 1-3 амінокислотних залишки або більше, наприклад, 5, 7, 9, 11 або 13 амінокислотних залишків. Вказаним лінкером може бути, наприклад, трипептид з послідовністю E-F-M (GluPhe-Met) або лінкерна послідовність, що складається з 13 амінокислот і містить послідовність GluPhe-Gly-Ala-Gly-Leu-Val-Leu-Gly-Gly-Gln-Phe-Met, вбудовану між поліпептидом відповідно до першого аспекту винаходу і послідовністю імуноглобуліну. Одержаний гібридний білок володіє поліпшеними властивостями, такими як більш тривалий час його присутності у фізіологічних рідинах (час напівжиття), підвищена питома активність, підвищений рівень експресії, або здатність вказаного гібридного білка легко піддаватися очищенню. У переважному варіанті винаходу поліпептид відповідно до першого аспекту винаходу приєднують до константної області молекули Ig, наприклад, до Fc-частини імуноглобуліну. Переважно, такий поліпептид приєднують до областей важкого ланцюга, таких як домени СН2 і СН3, наприклад, але необов'язково, разом з шарнірною областю людського IgG1. Fc-частина може бути, наприклад, мутована для попередження небажаних активностей, таких як зв'язування з комплементом, зв'язування з Fc-рецепторами або т.п. Одержання специфічних гібридних білків, що містять поліпептид відповідно до першого аспекту винаходу і частину імуноглобуліну, описане, наприклад, у прикладі 11 заявки WO99/09063. Для одержання гібридних білків відповідно до винаходу можуть бути також використані й інші ізоформи Ig, такі як ізоформи IgG2 або IgG4, та ізоформи інших класів Ig, таких, наприклад, як IgM або IgA. Гібридні білки можуть бути мономерними або мультимерними, а також гетеро- або гомомультимерними. Інші гібридні білки поліпептиду відповідно до першого аспекту винаходу можуть бути одержані шляхом приєднання доменів, виділених з інших білків, з утворенням димерів, тримерів і т.п. Прикладами послідовностей білків, які можуть утворювати мультимери поліпептидів відповідно до винаходу, є домени, виділені з таких білків, як hCG (WO 97/30161), колаген X (WO 04/33486), С4ВР (WO 04/20639), білки Erb (WO 98/02540) або суперспіралізовані пептиди (WO 01/00814). Поліпептиди можуть містити амінокислоти, які відрізняються від 20 амінокислот, що кодуються генами, і які є модифікованими або внаслідок природних процесів, таких як посттрансляційний процесинг, або внаслідок застосування хімічних методів модифікації, добре відомих фахівцям. Прикладами відомих модифікацій, які можуть бути здійснені у поліпептидах даного винаходу, є глікозилування, приєднання ліпіду, сульфування, гаммакарбоксилювання, наприклад, залишків глутамінової кислоти, гідроксилювання і ADPрибозилування. Іншими можливими модифікація 17 ми є ацетилування, ацилювання, амідування, ковалентне приєднання флавіну, ковалентне приєднання молекули гема, ковалентне приєднання нуклеотиду або нуклеотидного похідного, ковалентне приєднання ліпідного похідного, ковалентне приєднання фосфатидилінозиту, перехресне зв'язування, циклізація, утворення дисульфідного зв'язку, деметилування, утворення ковалентних перехресних зв'язків, утворення цистеїну, утворення піроглутамату, формілування, утворення GPI-якоря, йодування, метилування, міристоїлування, окиснення, протеолітичний процесинг, фосфорилування, пренілування, рацемізація, селеноїлування, приєднання амінокислот до білків, що опосередковується перенесенням РНК, таке як аргінілування, і убіхітинізація. Модифікації можуть бути присутніми у будьякій області поліпептиду, включаючи пептидний кістяк, амінокислотні бічні ланцюги і аміно- або карбокси-кінці. Дійсно, блокування аміно- або карбокси-кінця у поліпептиді, або того і іншого, за допомогою ковалентної модифікації є звичайним процесом, що відбувається у природних і синтетичних поліпептидах, і такі модифікації можуть бути присутніми у поліпептидах даного винаходу. Модифікації, які присутні у поліпептиді, у більшості випадків, будуть залежати від способу одержання даного поліпептиду. Для поліпептидів, одержаних рекомбінантним методом, природа і ступінь модифікації, здебільшого, буде визначатися здатністю до посттрансляційної модифікації конкретної клітини-хазяїна і присутністю сигналів модифікації в амінокислотній послідовності поліпептиду, що розглядається. Так, наприклад, характер глікозилування може варіюватися у клітинхазяїнів різного типу. Поліпептиди даного винаходу можуть бути одержані будь-яким придатним способом. Такими поліпептидами є виділені природні поліпептиди (наприклад, виділені з клітинної культури), поліпептиди, продуковані рекомбінантним методом (включаючи гібридні білки), синтетичні поліпептиди або поліпептиди, продуковані з використанням комбінації цих методів (див., наприклад, Bray 2003, Nat. Rev. Drag. Discov. 2(7):587-93; Casi & Hilvert 2003, Curr. Opin. Struct. Biol, 13(5):589-94). Функціонально еквівалентні поліпептиди першого аспекту даного винаходу можуть являти собою поліпептиди, гомологічні поліпептиду INSP201. Два поліпептиди можуть бути визначені використовуваним тут терміном "гомологічні", якщо послідовність одного з цих поліпептидів має досить високий ступінь ідентичності або подібності до послідовності іншого поліпептиду. Термін "ідентичність" означає, що у будь-якому конкретному положенні порівнюваних послідовностей, ці дві послідовності мають ідентичні амінокислотні залишки. Термін "подібність" означає, що у будьякому конкретному положенні порівнюваних послідовностей, ці дві послідовності мають амінокислотні залишки аналогічного типу. Ступінь ідентичності і подібності може бути легко обчислений (Computational Molecular Biology, Lesk A.M., ed., Oxford University Press, New York, 1988; Biocomputing Informatics and Genome Projects, 93658 18 Smith D.W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part 1, Griffin A.M. & Griffin H.G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G. Academic Press, 1987; і Sequence Analysis Primer, Gribskov M. & Devereux J., eds., M. Stockton Press, New York, 1991). Тому, гомологічними поліпептидами є природні біологічні варіанти (наприклад, алельні варіанти або варіанти поліпептидів, що утворилися внаслідок географічних змін видів, від яких ці поліпептиди походять), і мутанти (такі як мутанти, що містять амінокислотні заміни, інсерції або делеції) поліпептиду INSP201. Такими мутантами можуть бути поліпептиди, в яких один або декілька амінокислотних залишків замінені консервативним або неконсервативним амінокислотним залишком (переважно, консервативним амінокислотним залишком), і такий замінений амінокислотний залишок може бути, а може і не бути, залишком, що кодується генетичним кодом. Звичайно такі заміни відбуваються між Ala, Val, Leu та llе; між Ser і Thr; між кислотними залишками Asp і Glu; між Asn і Gln; між основними залишками Lys і Arg; або між ароматичними залишками Phe і Туr. Особливо переважними є варіанти, в яких декілька, тобто від 5 до 10, від 1 до 5, від 1 до 3, від 1 до 2 амінокислот або тільки одна амінокислота, є заміненими, делетованими або доданими у будь-якій комбінації. Особливо переважними є такі, що "мовчать", заміни, додатки і делеції, які не впливають на властивості і активність вказаного білка. Також переважними є консервативні заміни. Такими мутантами також є поліпептиди, в яких один або декілька амінокислотних залишків мають групу-замісник. Відповідно до даного винаходу будь-яка заміна повинна бути, переважно, "консервативною" або "допустимою" заміною, яку звичайно визначають як заміну, що вводить амінокислоти, які мають аналогічні хімічні властивості (наприклад, основна, позитивно заряджена амінокислота повинна бути замінена іншою основною, позитивно зарядженою амінокислотою), що є достатніми для збереження структури і біологічної функції даної молекули. У літературі описана множина моделей, за допомогою яких може бути здійснений відбір консервативних амінокислотних замін, виходячи зі статистичних і фізико-хімічних досліджень послідовності і/або структури білків (Rogov S.I. і Nekrasov A.N., 2001). Експерименти з конструювання білків показали, що використання специфічних підпослідовностей амінокислот дозволяє продукувати білки з відповідним укладанням і активні білки, і класифікувати амінокислотні "синонімічні" заміни, які можуть легко пристосовуватися до білкової структури і які можуть бути використані для детектування функціональних і структурних гомологів і паралогів (Murphy L.R. et al., 2000). Групи синонімічних амінокислот і групи більш переважних синонімічних амінокислот представлені у таблиці 1. У поліпептиди відповідно до винаходу також можуть бути також введені для різних цілей специфічні неконсервативні мутації. Мутації, що знижують афінність глікопротеїну клітинної поверхні, допускають можливість повторного використання 19 цих поліпептидів, а також їх застосування для інших цілей, що потенційно підвищує їх терапевтичну ефективність. (Robinson C.R., 2002). Імуногенні епітопи, фактично присутні у поліпептидах відповідно до винаходу, можуть бути використані для розробки вакцин (Stevanovic S., 2002), або вони можуть бути видалені шляхом модифікації їх послідовності відомими методами відбору мутацій, що підвищують стабільність білка, і їх корекції (van den Burg В. & Eijsink V., 2002; WO 02/05146, WO 00/34317 і WO 98/52976). Переважною альтернативою синонімічним групам для амінокислотних похідних, включених у пептидоміметики, є групи, визначені у таблиці 2. Невичерпний список амінокислотних похідних також включає аміноізомасляну кислоту (Aib), гідроксипролін (Hyp), 1,2,3,4-тетрагідроізохінолін-3СООН, індолін-2-карбонову кислоту, 4дифторпролін, L-тіазолідин-4-карбонову кислоту, L-гомопролін, 3,4-дегідропролін, 3,4дигідроксифенілаланін, циклогексилгліцин і фенілгліцин. Термін "амінокислотне похідне" означає амінокислоту, що не входить у 20 природних амінокислот, що кодуються генетичним кодом, або хімічну молекулу, подібну до такої амінокислоти. Зокрема, таке амінокислотне похідне може містити заміщені або незаміщені молекули, молекули з прямим ланцюгом, молекули з розгалуженим ланцюгом або циклоалкільні молекули, а також може включати один або декілька гетероатомів. Вказані амінокислотні похідні можуть бути одержані de novo, або вони можуть бути взяті з комерційно доступних джерел (Calbiochem-Novabiochem A.G., Switzerland; Bachem, USA). Різні методи включення неприродних амінокислотних похідних у білки з використанням in vitro та in vivo систем трансляції для зондування і/або поліпшення структури і функції білків описані у літературі (Dougherty D.A., 2000). Методи синтезу і одержання пептидоміметиків, а також непептидоміметиків добре відомі фахівцям (Golebiowski A. et al., 2001; Hruby V.J. & Balse P.M., 2000; Sawyer Т.K., "Structure Based Drag Design", edited by Veerapandian P., Marcel Dekker Inc., pg. 557-663, 1997). Звичайно, вважається, що два поліпептиди, які мають більш ніж 30%-ну ідентичність, є функціонально еквівалентними. Переважно, щоб послідовності функціонально еквівалентних поліпептидів відповідно до першого аспекту винаходу були більш ніж на 80% ідентичні послідовності поліпептиду INSP201 або його активних фрагментів. Більш переважними є поліпептиди, що мають ступінь ідентичності більш ніж 85%, 90%, 95%, 98% або 99%, відповідно. Функціонально еквівалентними поліпептидами відповідно до першого аспекту винаходу можуть бути також поліпептиди, які були ідентифіковані із застосуванням одного або декількох методів структурного порівняння первинних послідовностей шляхом їх вирівнювання. Так, наприклад, технологія інформаційної обробки потоку геномних даних (Inpharmatica Genome Threader), яка складає один з аспектів способу пошуку, що використову 93658 20 ються для генерування бази даних пошуку Biopendium, може бути застосована (див. заявку РСТ WO 01/69507) для ідентифікації поліпептидів з невідомими функціями, відносно яких, незважаючи на їх низький ступінь ідентичності у порівнянні з поліпептидом INSP201, висловлюється припущення, що вони являють собою члени сімейства глікопротеїнів клітинної поверхні, де вказане припущення базується на їх значній структурній гомології з послідовністю поліпептиду INSP201. Термін "значна структурна гомологія" означає, що технологія Inpharmatica Genome Threader дозволяє передбачити структурну гомологію двох білків з достовірністю, принаймні, 10% і вище. Поліпептид відповідно до першого аспекту винаходу також включає фрагменти поліпептиду INSP201 і фрагменти функціональних еквівалентів поліпептиду INSP201, за умови, що ці фрагменти є членами сімейства глікопротеїнів клітинної поверхні або мають спільну антигенну детермінанту з поліпептидом INSP201. Використовуваний тут термін "фрагмент" означає поліпептид, що має амінокислотну послідовність, яка є ідентичною частині, але не всій, амінокислотної послідовності поліпептиду INSP201, або одному з його функціональних еквівалентів. Ці фрагменти повинні містити, принаймні, η суміжних амінокислот даної послідовності, і в залежності від конкретної послідовності, вказане число п, переважно, дорівнює 7 або більше (наприклад, 8, 10, 12, 14, 16, 18, 20 або більше). Невеликі фрагменти можуть утворювати антигенну детермінанту. Переважно, мінімальна довжина фрагмента відповідно до винаходу становить 6, 10, 25, 50, 100, 150, 200, 250, 300, 350, 400, 450 або 500 амінокислот. Переважно, максимальна довжина фрагмента відповідно до винаходу становить 517, 515, 510, 500, 475, 450, 400, 350, 300, 250, 200, 150, 100 або 50 амінокислот. Переважно, мінімальна довжина молекули нуклеїнової кислоти, що кодує фрагмент відповідно до винаходу, становить 18, 30, 75, 150, 300, 450, 600, 750, 900, 1050, 1200, 1350 або 1500 нуклеотидів. Переважно, максимальна довжина молекули нуклеїнової кислоти, що кодує фрагмент відповідно до винаходу, становить 1551, 1545, 1530, 1500, 1425, 1350, 1200, 1050, 900, 750, 600, 450, 300 або 150 нуклеотидів. Переважно, максимальна довжина поліпептиду відповідно до винаходу становить 518, 520, 550, 600, 650, 700, 800, 900, 1000, 1250, 1500, 2000, 2500, 3000, 3500, 4000, 4500 або 5000 амінокислот. Переважно, максимальна довжина молекули нуклеїнової кислоти, що кодує поліпептид відповідно до винаходу, становить 1554, 1560, 1750, 1800, 1950, 2100, 2400, 2700, 3000, 5000, 7500, 10000, 20000, 30000, 50000, 75000 або 100000 нуклеотидів. Фрагменти повнорозмірного поліпептиду INSP201 можуть складатися з комбінацій 2 або 21 всіх трьох 3 послідовностей суміжних екзонів у послідовностях поліпептидів INSP201, відповідно. Вказані фрагменти можуть бути присутніми у "вільній формі", тобто вони можуть не бути частиною іншого поліпептиду або не бути приєднаними до інших амінокислот або поліпептидів, або вони можуть входити до складу більш великого поліпептиду, частину або область якого вони утворюють. Якщо фрагмент даного винаходу входить до складу більш великого поліпептиду, то, найбільш переважно, щоб такий фрагмент утворював одну безперервну область. Так, наприклад, деякі переважні варіанти даного винаходу стосуються фрагмента, що має пре- і/або про-поліпептидну область, приєднану до аміно-кінця вказаного фрагмента, і/або додаткову область, приєднану до карбоксильного кінця цього фрагмента. Однак, до складу одного більш великого поліпептиду можуть входити декілька фрагментів. Поліпептиди даного винаходу або їх імуногенні фрагменти (що містять, принаймні, одну антигенну детермінанту) можуть бути використані для генерування лігандів, таких як поліклональні або моноклональні антитіла, які володіють імуноспецифічністю до таких поліпептидів. Вказані антитіла можуть бути використані для виділення або для ідентифікації клонів, які експресують поліпептиди даного винаходу, або для очищення даних поліпептидів афінною хроматографією. Як абсолютно очевидно для будь-якого читача-фахівця, такі антитіла, крім інших застосувань, можуть бути також використані як діагностичні або терапевтичні засоби. Термін "імуноспецифічний" означає, що дані антитіла мають, в основному, більш високу афінність до поліпептидів даного винаходу, ніж до інших споріднених поліпептидів, описаних раніше. Використовуваний тут термін "антитіло" означає інтактні молекули, а також їх фрагменти, такі як Fab, F(ab')2 і Fv, які здатні зв'язуватися з антигенною детермінантою, що розглядається. Такі антитіла зв'язуються з поліпептидами першого аспекту даного винаходу. Під поняттям "значно більш висока афінність" автори мають на увазі помітно більш високу афінність до поліпептиду відповідно до винаходу у порівнянні з афінністю відомих білків, що секретуються. При цьому переважно, щоб афінність по відношенню до поліпептиду відповідно до винаходу щонайменше в 1,5, 2, 5, 10, 100, 103, 104, 105, 106 разів або більше перевищувала афінність по відношенню до відомих білків, що секретуються, таких як члени сімейства глікопротеїнів клітинної поверхні. При цьому переважно, щоб афінність по відношенню до поліпептиду відповідно до винаходу значно перевищувала афінність по відношенню до відомих глікопротеїнів клітинної поверхні. Якщо переважними є поліклональні антитіла, то вибраний ссавець, такий як миша, кролик, коза або кінь, може бути імунізований поліпептидом відповідно до першого аспекту винаходу. Поліпептид, що використовується для імунізації тварини, може бути одержаний методами рекомбінантних 93658 22 ДНК, або він може бути синтезований методом хімічного синтезу. Якщо необхідно, то даний поліпептид може бути кон'югований з білком-носієм. Звичайно використовуваними носіями, до яких можуть бути хімічно приєднані дані поліпептиди, є альбумін бичачої сироватки, тироглобулін і гемоціанін лімфи равлика. Такий зв'язаний поліпептид може бути потім використаний для імунізації тварини. Сироватку, взяту у імунізованої тварини, збирають і обробляють відомими методами, наприклад, імуноафінною хроматографією. Моноклональні антитіла проти поліпептидів відповідно до першого аспекту винаходу можуть бути легко одержані фахівцем у даній галузі. Загальна методика одержання моноклональних антитіл з використанням гібридомної технології добре відома фахівцям (див. наприклад, Kohler G. & Milstein C, Nature 256:495-497 (1975); Kozbor et al., Immunology Today 4:72(1983); Cole et al., 77-96, Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc. (1985)). Панелі моноклональних антитіл, продукованих проти поліпептидів відповідно до першого аспекту винаходу, можуть бути скриновані на різні властивості, тобто на ізотип, епітоп, афінність і т.п. Моноклональні антитіла є особливо придатними для очищення окремих поліпептидів, проти яких вони направлені. Альтернативно, гени, що кодують потрібні моноклональні антитіла, можуть бути виділені з гібридом, наприклад, методами ПЛР, відомими фахівцям, а також вони можуть бути клоновані і експресовані у відповідних векторах. Можуть бути також використані і химерні антитіла, в яких не-людські варіабельні області з'єднані або ліговані з людськими константними областями (див. наприклад, Liu et al., Proc. Natl. Acad. Sci. USA, 84, 3439 (1987)). Ці антитіла можуть бути модифіковані так, щоб вони були менш імуногенними для індивідуума, наприклад, шляхом їх "гуманізації" (див., Jones et al., Nature, 321, 522 (1986); Verhoeyen et al., Science, 239, 1534 (1988); Kabat et al., J. Immunol., 147, 1709 (1991); Queen et al., Proc. Natl. Acad. Sci., USA, 86, 10029 (1989); Gorman et al., Proc. Natl. Acad. Sci., USA, 88, 34181 (1991) і Hodgson et al., Bio/Technology, 9, 421 (1991)). Використовуваний тут термін "гуманізоване антитіло" означає молекули антитіла, в яких амінокислоти CDR та інші вибрані амінокислоти у варіабельних доменах важкого і/або легкого ланцюгів нелюдського донорного антитіла були замінені еквівалентними амінокислотами людського антитіла. Таким чином, гуманізоване антитіло має близьку подібність до людського антитіла, але, при цьому, воно володіє здатністю зв'язуватися з донорним антитілом. В іншому альтернативному варіанті винаходу, таким антитілом може бути "біспецифічне" антитіло, тобто антитіло, що має два різних антигензв'язувальних домени, кожний з яких володіє специфічністю до різних епітопів. Для відбору генів, що кодують антитіла, які володіють здатністю зв'язуватися з поліпептидами відповідно до винаходу, або з набору ПЛРампліфікованих V-генів лімфоцитів людини, скринованих на здатність виробляти відповідні антиті 23 ла, або з бібліотеки "ненавчених" лімфоцитів, може бути використана техніка фагового представлення (McCafferty J. et al. (1990), Nature 348, 552554; Marks J. et al., (1992) Biotechnology 10, 779783). Афінність цих антитіл може бути також підвищена шляхом перестановки ланцюгів (Clackson Т. et al., (1991) Nature 352, 624-628). Антитіла, генеровані описаними вище методами, незалежно від того, є вони поліклональними або моноклональними, володіють й іншими цінними властивостями, тобто вони можуть бути використані як реагенти в імуноаналізах, радіоімуноаналізах (РІА) або твердофазових імуноферментних аналізах (ELISA). Для використання для даних цілей антитіла можуть бути помічені реагентом, що аналітично детектується, таким як радіоізотоп, флуоресцентна молекула або фермент. Поліклональні антитіла, направлені проти поліпептиду відповідно до винаходу, звичайно виробляються у тварин (наприклад, у кроликів або мишей) за допомогою декількох підшкірних або внутрішньочеревинних ін'єкцій поліпептиду INSP201 і ад'юванту. Може виявитися бажаним використовувати кон'югат поліпептиду відповідно до винаходу з білком-носієм, який є імуногенним у тварини, яку імунізують, таким як гемоціанін лімфи равлика, сироватковий альбумін, бичачий тироглобулін або інгібітор соєвого трипсину. Крім того, для посилення імунної відповіді використовують агрегувальні агенти, такі як галуни. Після імунізації, у тварин беруть кров, і сироватку аналізують на титр антитіла проти INSP201. Моноклональні антитіла, направлені проти поліпептиду відповідно до винаходу, продукують будь-яким методом, який дозволяє виробляти молекули антитіла шляхом культивування безперервної клітинної культури. Прикладами придатних методів одержання моноклональних антитіл є гібридомні методи і метод одержання людської Вклітинної гібридоми. Даний винахід також стосується гібридомних клітинних ліній, які продукують моноклональні антитіла, що реагують з поліпептидом INSP201. Моноклональні антитіла відповідно до винаходу можуть бути модифіковані для їх застосування як терапевтичних засобів. Одним з варіантів є "химерне антитіло", в якому частина важкого (Н) і/або легкого (L) ланцюга ідентична або гомологічна відповідній послідовності антитіл, що походять від конкретного виду або належать до конкретного класу або підкласу, а інший(і) ланцюг(и) ідентичний(і) або гомологічний(і) відповідній послідовності антитіл, що походять від іншого виду або належать до іншого класу або підкласу. Даний винахід також стосується фрагментів таких антитіл, за умови, що вони володіють потрібною біологічною активністю. В іншому своєму варіанті моноклональне антитіло відповідно до винаходу є "гуманізованим" антитілом. Взагалі, гуманізоване антитіло має один або декілька амінокислотних залишків, введених у це антитіло з джерела, що не належить до людини. Гуманізація може бути здійснена, наприклад, методами, відомими фахівцям, шляхом за 93658 24 міни щонайменше однієї частини гіперваріабельної області гризунів відповідними областями людського антитіла. Термін "антитіло" або "імуноглобулін" охоплює як поліклональне, так і моноклональне антитіло. Переважним антитілом є моноклональне антитіло, що реагує з антигеном. Термін "антитіло" також включає суміші більш ніж одного антитіла, що реагує з антигеном (наприклад, суміш моноклональних антитіл різних типів, що реагують з антигеном). Термін "антитіло" також включає повнорозмірні антитіла, їх біологічно функціональні фрагменти, одноланцюжкові антитіла і генетично модифіковані антитіла, такі як химерні антитіла, що містять частини антитіл більш ніж одного виду, біфункціональні антитіла, кон'югати антитіл, гуманізовані і людські антитіла. Біологічно функціональними фрагментами антитіл, які також можуть бути використані, є пептидні фрагменти антитіла, достатні для зв'язування з антигеном. Використовуваний тут термін "антитіло" включає повнорозмірне антитіло, а також будь-які його фрагменти (наприклад, F(ab')2, Fab', Fab, Fv), здатні зв'язуватися з епітопами, антигенами або антигенними фрагментами, що представляють інтерес. Термін "очищене антитіло" означає антитіло, яке, в основному, не містить інших білків, вуглеводів і ліпідів, з якими воно звичайно асоціюється у природі. Таке антитіло "переважно зв'язується" з поліпептидами INSP201 відповідно до винаходу (або з його антигенним фрагментом), тобто, в основному, не розпізнає і не зв'язується з іншими антигенно не-спорідненими молекулами. Очищене антитіло відповідно до винаходу є, переважно, імунореактивним з INSP201 конкретного виду і володіє імунною специфічністю до INSP201 конкретного виду, а більш переважно, є імуноспецифічним до нативного людського INSP201. Термін "специфічно зв'язується" означає, що дане антитіло зв'язується зі специфічним поліпептидом, тобто INSP201, з високою авідністю і/або високою афінністю. Зв'язування антитіла зі своїм епітопом на цьому специфічному поліпептиді, переважно, є більш сильним, ніж зв'язування того ж самого антитіла з будь-яким іншим епітопом. Антитіла, які специфічно зв'язуються з INSP201, можуть зв'язуватися і з іншими поліпептидами на більш низькому рівні, але такому, що ще детектується (наприклад, на рівні, що становить 10% або менше від рівня зв'язування, що спостерігається для поліпептиду, що представляє інтерес). Таке слабке зв'язування або фонове зв'язування можна легко диференціювати від специфічного зв'язування антитіла зі сполукою або поліпептидом, що представляє інтерес, наприклад, з використанням відповідного контролю. Переважно афінність антитіла по відношенню до поліпептиду відповідно до винаходу щонайменше в 1,5, 2, 5, 10, 100, 103, 104, 105, 106 або більше разів перевищує афінність по відношенню до інших відомих членів сімейства INSP201. Термін "генетично модифіковані антитіла" означає антитіла, амінокислотна послідовність яких відрізняється від послідовності нативного антитіла. Завдяки релевантності методів рекомбі 25 нантних ДНК відповідно до винаходу, немає необхідності обмежуватися послідовностями амінокислот, що виявляються у природних антитілах, тобто антитіла можуть бути реконструйовані для надання їм бажаних властивостей. Можливими змінами є множина замін, які варіюються у межах від заміни тільки однієї або декількох амінокислот до повної реконструкції, наприклад, варіабельної або константної області. Взагалі, для поліпшення або зміни інших властивостей, таких як фіксація комплементу, взаємодія з мембранами або інші ефекторні функції, можуть бути зроблені модифікації у константній області. Для поліпшення антигензв'язу вальних властивостей можуть бути зроблені модифікації у варіабельній області. Термін "гуманізоване антитіло" або "гуманізований імуноглобулін" означає імуноглобулін, що містить людську каркасну область, і щонайменше одну, а переважно, всі гіперваріабельні області (CDR), що походять від не-людського антитіла, де будь-яка присутня в імуноглобуліні константна область, по суті, щонайменше приблизно на 8590%, а переважно, щонайменше на 95%, ідентична константній області людського імуноглобуліну. Отже, всі частини гуманізованого імуноглобуліну, можливо, за винятком CDR, по суті ідентичні відповідним частинам однієї або декількох нативних послідовностей людського імуноглобуліну. Див., наприклад, Queen et al., патенти США №№ 55301101; 5585089; 5693762 і 6180370 (кожний з яких у всій своїй повноті вводиться у даний опис за допомогою посилання). "Повністю гуманізовані антитіла" являють собою молекули, що містять варіабельну і константну область людського імуноглобуліну. Повністю гуманізовані антитіла можуть бути використані у терапії, де їх повторне введення необхідне для лікування хронічних і рецидивних захворювань, таких як аутоімунні захворювання. Один з методів одержання повністю людських антитіл полягає у "гуманізації" мишачої гуморальної імунної системи, тобто у продукуванні мишачих штамів, здатних виробляти людський Ig (Xenomice), шляхом введення локусів людського імуноглобуліну (Ig) миші, у якої були інактивовані ендогенні гени Ig. Області Ig є виключно складними за своєю фізичною структурою, і для кінцевого продукування імунної відповіді широкого ряду необхідне здійснення процесів реаранжування і експресії генів. Різноманітність антитіл, головним чином, генерується шляхом комбінаторного реаранжування різних генів V, D і J, присутніх у локусах Ig. Такі локуси також містять регуляторні елементи, що чергуються, які здійснюють регуляцію експресії антитіл, алельне виключення, перемикання класів і дозрівання афінності. Введення неаранжованих трансгенів людських Ig-трансгенів мишам продемонструвало, що мишачий механізм рекомбінації сумісний з механізмом рекомбінації людських генів. Крім того, гібридоми, що секретують антигенспецифічні людські mAb різних ізотипів, можуть бути одержані шляхом імунізації мишей Xenomice антигеном. Повністю гуманізовані антитіла і методи їх одержання відомі фахівцям (Mendez et al., Nature 93658 26 Genetics 15:146-156 (1997); Buggemann et al., Eur. J. Immunol. 21:1323-1326 (1991); Tomizuka et al., Proc. Natl. Acad. Sci. USA, 97:722-727 (2000), заявка на патент WO 98/24893). Термін "химерне антитіло" означає антитіло, в якому константна область походить від антитіла одного виду (звичайно людського антитіла), а варіабельна область походить від антитіла іншого виду (звичайно антитіла гризуна). Отже, химерні антитіла являють собою молекули, різні частини яких походять від тварин різних видів, таких як молекули, що мають варіабельну область, що походить від мишачого Mab, і константну область людського імуноглобуліну. Так, наприклад, при використанні мишачих Mab, досягаються більш високі виходи з гібридом, але, при цьому, спостерігається більш висока імуногенність у людини, а тому, для зниження імуногенності і для збільшення виходу продукту, головним чином, використовуються химерні антитіла, такі як людські/мишачі химерні Mab. Химерні антитіла і методи їх одержання відомі фахівцям (Cabilly et al., Proc. Natl. Acad. Sci. USA, 81:3273-3277 (1984); Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984); Boulianne et al., Nature 312:643-646 (1984); Cabilly et al. Європейська патентна заявка 125023 (опублікована 14 листопада, 1984); Neuberger et al. Nature 314:268-270 (1985); Taniguchi et al. Європейська патентна заявка 171496 (опублікована 19 лютого, 1985); Morrison et al. Європейська патентна заявка 173494 (опублікована 5 березня, 1986); Neuberger et al., заявка РСТ WO 8601533 (опублікована 13 березня, 1986); Kudo et al. Європейська патентна заявка 184187 (опублікована 11 червня, 1986); Sahagan et al., J. immunol. 137:1066-1074 (1986); Robinson et al. Міжнародна патентна заявка № WO 8702671 (опублікована 7 травня, 1987); Liu et al., Proc. Natl. Acad. Sci, USA, 84:3439-3443 (1987); Sun et al., Proc. Natl. Acad. Sci, USA, 84:214-218 (1987); Better et al. Science 240:10411043 (1988); Riechmarm et al., Nature 332:323-327; і Harlow & Lane, ANTIBODIES: A LABORATORY MANUAL, див. вище). Ці публікації у всій своїй повноті вводяться у даний опис за допомогою посилання. Використовуваний тут термін "фрагмент антитіла" означає молекулу, що містить частину антитіла, здатного специфічно зв'язуватися з антигеном, антигенною детермінантою або епітопом. Потрібно зазначити, що Fab і F(ab)2 та інші фрагменти використовуваних у даному винаході антитіл можуть бути використані для детектування і кількісної оцінки їх антигенів методами, описаними тут для молекул інтактних антитіл. Такі фрагменти звичайно одержують шляхом протеолітичного розщеплення з використанням ферментів, таких як папаїн (для одержання Fab-фрагментів) або пепсин (для одержання F(аb')2-фрагментів). Що стосується згаданих тут антитіл, то термін "моноклональне антитіло" включає моноклональні антитіла, химерні антитіла, повністю гуманізовані антитіла, антитіла проти антиідіотипічних антитіл (анти-анти-Id антитіла), які можуть бути помічені у розчинній або зв'язаній формі, а також їх фрагменти, одержані будь-якими відомими методами, та 27 кими як, але без обмеження ними, ферментативне розщеплення, пептидний синтез або методи рекомбінантних ДНК. Моноклональні антитіла являють собою, по суті, гомогенну популяцію антитіл, специфічних до антигенів, де вказані популяції містять, в основному, аналогічні епітоп-зв'язувальні сайти. Mab можуть бути одержані методами, відомими фахівцям. Див., наприклад, роботи Kohler G. & Milstein C, Nature 256:495-497 (1975); патент США № 4376110; Ausubel et al., eds., Harlow & Lane, ANTIBODIES: A LABORATORY MANUAL, Cold Spring Harbor Laboratory, (1988); і Colligan et al., eds., Current Protocols in Immunology, Greene Publisching Assoc. and Wiley Interscience, N.Y. (1992-1996), зміст яких у всій своїй повноті вводиться у даний опис за допомогою посилання. Такі антитіла можуть належати до імуноглобулінів будь-якого класу, включаючи IgG, IgM, IgE, IgA, GILD і будь-якого підкласу. Гібридома, що продукує mAb відповідно до винаходу, може бути культивована in vitro, in situ або in vivo. Завдяки продукуванню високих титрів Mab in vivo або in situ, цей метод одержання є переважним. Термін "моноклональне антитіло" також означає інтактні молекули, а також їх фрагменти, такі, наприклад, як Fab і F(ab')2, здатні зв'язуватися з антигеном. Fab і F(аb')2-фрагменти не містять Fc-фрагмента інтактного антитіла, більш швидко виводяться з кровотоку і можуть володіти здатністю до менш неспецифічного зв'язування з тканинами, ніж інтактне антитіло (Wahl et al., J. Nucl. Med. 24:316-325 (1983)). Вважається, що моноклональне антитіло "здатне зв'язуватися" з молекулою, якщо воно здатне специфічно реагувати з вказаною молекулою, і якщо така реакція приводить до зв'язування даної молекули з антитілом. "Антиген" являє собою молекулу або частину молекули, здатну зв'язуватися з антитілом, де вказаний антиген, крім того, володіє здатністю індукувати у тварини вироблення антитіла, здатного зв'язуватися з епітопом такого антигену. Антиген може мати один або декілька епітопів. Згаданий вище термін "специфічна реакція" означає, що вказане антитіло реагує з високим ступенем селективності з епітопом на відповідному антигені, але не з множиною інших антигенів, що індукують вироблення інших антитіл. Ці антитіла, включаючи фрагменти антитіл, що використовуються у даному винаході, можуть бути застосовані для кількісної або якісної оцінки їх антигенів у зразку, або для детектування присутності клітин, що експресують свої антигени. Така оцінка може бути здійснена імунофлуоресцентними методами з використанням флуоресцентно міченого антитіла (див. нижче) у комбінації з флуоресцентною мікроскопією, протоковою цитометрією або флуориметричного детектування. Антитіла (або їх фрагменти), що використовуються у даному винаході, можуть бути застосовані для гістологічного аналізу, а також в імунофлуоресцентній або імуноелектронній мікроскопії, для in situ детектування їх антигенів. Детектування in situ може бути здійснене шляхом забору гістологічного зразка у пацієнта, і обробки такого зразка міченим 93658 28 антитілом відповідно до винаходу. Це антитіло (або фрагмент), переважно, додають до біологічного зразка, або на цей біологічний зразок наносять мічене антитіло (або його фрагмент). Шляхом здійснення такої процедури може бути визначена не тільки присутність даних антигенів, але також і їх розподіл у тканині, що розглядається. Для середнього фахівця абсолютно очевидно, що для здійснення in situ детектування за допомогою даного винаходу можуть бути застосовані будь-які модифіковані методи гістологічних аналізів (таких як процедури забарвлювання) широкого ряду. Такі аналізи на присутність антигенів звичайно включають інкубування біологічного зразка, такого як біологічні рідини, тканинні екстракти, свіжозібрані клітини, такі як лімфоцити або лейкоцити, або клітини, які були інкубовані у тканинній культурі у присутності міченого антитіла, здатного ідентифікувати антигени, і детектування антитіла будьякими методами, добре відомими фахівцям. Біологічний зразок може бути іммобілізований на твердофазовій основі або на носії, такому як нітроцелюлоза, або на іншій твердофазовій основі або на іншому носії, здатному іммобілізувати клітини, клітинні частинки або розчинні білки. Потім така основа або носій можуть бути промиті придатними буферами, а потім оброблені міченим антитілом відповідно до винаходу, як було згадано вище. Потім твердофазова основа або носій можуть бути промиті буфером другий раз для видалення незв'язаного антитіла. Кількість незв'язаної мітки на вказаній твердій основі або на носії може бути потім оцінена стандартними методами. Молекула антитіла відповідно до винаходу може бути адаптована для використання в імунометричному аналізі, також відомому як "двохсайтовий" або "сендвіч"-аналіз. У типовому імунометричному аналізі, визначену кількість неміченого антитіла (або фрагмента антитіла) іммобілізують на твердій основі або на твердому носії і додають визначену кількість міченого розчинного антитіла, що детектується, що дозволяє детектувати і/або кількісно оцінювати трьохкомпонентний комплекс, утворений антитілом, іммобілізованим на твердофазовому носії, антигеном і міченим антитілом. Антитіла відповідно до винаходу можуть бути використані у комбінації з методами імуноафінної хроматографії. Більш конкретно, такі антитіла можуть бути вміщені на поверхню матеріалу у хроматографічній колонці. Потім, композиція, що очищається, може бути пропущена через вказану колонку. Якщо зразок, що очищається, включає будь-які поліпептиди INSP201, які зв'язуються з антитілами, то такі поліпептиди INSP201 можуть бути видалені зі зразка, а потім очищені. Отже, загалом, методи діагностики можуть бути здійснені in vitro з використанням клітинного зразка (наприклад, проби крові, біоптату лімфовузлів або тканини), виділеного у ссавця, або вони можуть бути здійснені шляхом in vivo візуалізації. Композиції, що містять антитіла відповідно до винаходу, можуть бути використані для детектування присутності INSP201, наприклад, за допомогою радіоімуноаналізу, ELISA, FACS і т.п. Одна або декілька молекул-міток можуть бути приєднані 29 до гуманізованого імуноглобуліну. Прикладами молекул-міток є барвники, непроникні для рентгенівських променів, рентгеноконтрастна речовина, флуоресцентні молекули, спін-мічені молекули, ферменти та інші молекули-мітки, що використовуються у діагностиці, а зокрема, у радіологічних методах або у методах візуалізації за допомогою магнітного резонансу. Препарати антитіл IgG відповідно до винаходу можуть бути переважно виділені з антисироватки відповідно до винаходу шляхом афінного очищення, переважно, за допомогою G-білокімунопреципітації. Антисироватка, одержана від імунізованої тварини, може бути використана для детектування з оптимальною чутливістю за допомогою вестерн-імуноблот-аналізу, їмунопреципітації і ELISA-аналізу поліпептидів INSP201. У загальних рисах, очищене антитіло або фрагмент антитіла відповідно до винаходу, здатне(ий) специфічно зв'язуватися з антигеном-мішенню, звичайно є оптимальними з точки зору репродукованості, стандартизації або точності детектування у порівнянні з неочищеним препаратом відповідно до винаходу. Для середнього фахівця у даній галузі очевидно, що вказане антитіло або фрагмент, що має афінність, яка визначається константою дисоціації, що складає до 10-12 для когнатного антигену, можуть бути одержані стандартними методами. Як було описано вище, вказаний препарат може переважно містити антитіло або фрагмент антитіла, приєднані до молекули, що детектується, будь-якого типу. Фрагмент антитіла має ту перевагу, що його розмір менше, ніж розмір батьківського антитіла, від якого він походить, але, при цьому, він зберігає, по суті, таку ж специфічність зв'язування з антигеном-мішенню, або таку ж специфічність і афінність зв'язування, як батьківське антитіло. Таким чином, завдяки тому, що фрагмент антитіла має менший розмір, ніж батьківське антитіло, він буде, в основному, мати набагато кращий біологічний розподіл у тканині і кращі дифузні властивості (наприклад, у системі in vivo або у виділених тканинах), ніж батьківське антитіло. Фрагмент антитіла, в якому, по суті, відсутня Fc-область, такий як одноланцюжковий Fv-, Fab'-, Fab- і F(аb')2фрагмент або CDR, є переважним для використання з метою обробки даного препарату молекулою, здатною специфічно зв'язуватися з такою Fcобластю, і у тих випадках коли таке зв'язування є небажаним. Звичайно, такими випадками є небажане зв'язування Fc-області з когнатним Fcрецептором, або зв'язування Fc-області з компонентом комплементу (наприклад, з компонентом C1q комплементу, присутнього у сироватці). Fcрецептори присутні на поверхні імунних клітин багатьох типів, включаючи спеціалізовані АПК, такі як дендритні клітини; В-лімфоцити; і гранулоцити, такі як нейтрофіли, базофіли, еозинофіли, моноцити, макрофаги і тучні клітини. Таким чином, відсутність Fc-області у фрагменті антитіла може бути особливо переважною для запобігання небажаній активації імунних клітин, що опосередковується Fc-рецептором, або небажаному каскаду 93658 30 реакцій активації комплементу, що опосередковуються компонентом комплементу, а зокрема, при введенні вказаного препарату індивідууму in vivo. F(ab')2 являє собою фрагмент молекули антитіла, що містить двовалентну антигензв'язувальну частину молекули антитіла. F(ab')2-препарат відповідно до винаходу може бути відповідним чином одержаний стандартними методами шляхом обробки вказаного препарату антитіла, такого як антисироватка відповідно до винаходу, ферментом пепсином. Одержаний F(аb')2-продукт являє собою частинку 5S. Fab- або Fab' являє собою фрагмент молекули антитіла, що містить одновалентну антигензв'язувальну частину молекули антитіла. CDR може бути генерована, як описано в ЕР0585939 або як описано у Strandberg et al. (Protein Eng. 2001 Jan; 14(l):67-74). CDR відповідно до винаходу може являти собою модифіковану CDR, яка здійснює значний вплив на модуляцію поліпептиду INSP201. Методи модифікації активних пептидів описані, наприклад, Sawa et al. 1999 (J. Med. Chem. 42, 3289-3299). Fab'-препарат відповідно до винаходу може бути легко одержаний стандартними методами шляхом обробки препарату, що містить антитіло, відповідно до винаходу ферментом пепсином з подальшим, проведенням реакції відновлення з одержанням F(ab')2. Таке відновлення може бути здійснене з використанням тіолового відновника, і з використанням, але необов'язково, групи, що блокує сульфгідрильні групи, одержані внаслідок розщеплення дисульфідних зв'язків. Внаслідок такої обробки одержують два моновалентних 3,5S Fab-фрагменти і Fc-фрагменти. Fab-препарат може бути легко одержаний стандартними методами шляхом обробки препарату, що містить антитіло, відповідно до винаходу, такого як антисироватка відповідно до винаходу, ферментом папаїном з одержанням інтактного легкого ланцюга і частини важкого ланцюга, що складається з варіабельного домену і СН1-домену. Повний опис генерування фрагмента антитіла шляхом ферментативної обробки антитіла є у спеціальній літературі (див. наприклад, Goldenberg, патенти США №№ 4036945 і 4331647; Porter R.R, 1959. Biochem J. 73:119-126). Одноланцюжковий Fv-фрагмент (що також позначається у літературі scFv) являє собою одноланцюжкову молекулу, що включає варіабельну область легкого ланцюга і варіабельну область важкого ланцюга, з'єднані придатним поліпептидним лінкером. F(ab')2-, Fab'-, Fab-, scFv- або CDR-препарат відповідно до винаходу може бути одержаний методами рекомбінантних ДНК. Рекомбінантний фрагмент антитіла одержують шляхом виділення мРНК з В-лімфоцитів тварин, імунізованих антигеном-мішенню; продукування кДНК з мРНК за допомогою ЗТ-ПЛР; і використання вказаної кДНК для конструювання бібліотеки фагового представлення фрагментів антитіла. Влімфоцити можуть бути відповідним чином виділені з селезінки або, альтернативно, з крові, кістко 31 вого мозку або лімфатичних вузлів імунізованої тварини. При цьому потрібно зазначити, що описана вище методика може бути застосована для одержання препарату, що містить фрагмент моноклонального антитіла відповідно до винаходу, що володіє, по суті, будь-якою бажаною афінністю і/або специфічністю зв'язування з антигеном-мішенню. Такий препарат може бути використаний для різних цілей, при яких переважно використовувати реагент, здатний зв'язуватися з антигеноммішенню з визначеними параметрами зв'язування. Оскільки Fab' має структуру, по суті аналогічну структурі Fab, то препарат даного винаходу, що містить Fab', може бути використаний, в основному, для таких же цілей, як препарат, що містить Fab, де вказані Fab'- і Fab-фрагменти містять по суті аналогічні варіабельні області важкого і легкого ланцюга. У цьому випадку, в залежності від конкретного застосування, препарат відповідно до винаходу, що містить фрагмент антитіла, здатний зв'язуватися з антигеном-мішенню з максимальною афінністю, тобто F(ab)2-препарат відповідно до винаходу може володіти значно більшою перевагою у порівнянні з Fab-, Fab'- або scFvпрепаратами відповідно до винаходу, оскільки, на відміну від одновалентного зв'язування вказаного одновалентного фрагмента антитіла, F(ab)2препарат володіє двовалентним зв'язуванням з антигеном-мішенню. Як було згадано вище, в залежності від застосування і мети цього застосування, препарат, що містить антитіло або його фрагмент, може бути одержаний від ссавця будь-якого виду. Препарат, що містить антитіло або його фрагмент відповідно до винаходу, що походять від ссавця потрібного виду, може бути виділений з сироватки тварини такого виду, імунізованої антигеноммішенню. Препарат відповідно до винаходу, що містить людське або гуманізоване антитіло або його фрагмент, може бути переважним для його застосування, що передбачає введення препарату індивідууму. Так, наприклад, людське або гуманізоване антитіло або його фрагмент звичайно мають оптимальну імунологічну переносимість, а тому вони мають оптимальний час напівжиття in vivo у людини, і тим самим володіють оптимальною ефективністю. Додатковий опис одержання і застосування людських або гуманізованих антитіл наводиться нижче. Даний препарат може бути використаний per se, або він може бути одержаний у вигляді активного інгредієнта, що входить до складу фармацевтичної композиції. Таким чином, даний винахід стосується фармацевтичної композиції, що містить фармацевтично прийнятний носій і, як активний інгредієнт, антитіло або фрагмент антитіла відповідно до винаходу. Способи одержання фармацевтичної композиції, що містить антитіло або його фрагмент відповідно до винаходу як активний інгредієнт, і способи застосування такої фармацевтичної композиції описані нижче. 93658 32 Доставку антитіла або його фрагмента, переважно, здійснюють шляхом введення фармацевтичної композиції відповідно до винаходу, що містить антитіло або його фрагмент відповідно до винаходу як активний інгредієнт. Вказане антитіло або його фрагмент, переважно, вводять з метою досягнення рівня фрагмента антитіла, зв'язаного з антигеном-мішенню, достатнього для досягнення бажаної регуляції біохімічної активності. Середній фахівець у даній галузі, такий як лікуючий лікар, а більш переважно, лікар-фахівець з даного захворювання, може самостійно провести необхідне обстеження з метою визначення придатної схеми терапії, включаючи придатний спосіб введення і придатну дозу антитіла або його фрагмента, ефективну для лікування захворювання відповідно до даного винаходу. Як було описано вище, антиген-мішень (тобто, INSP201), що являє собою поліпептид, може бути одержаний різними способами. Переважно, такий антиген-мішень одержують стандартним методом хімічного синтезу. Вказаний антиген-мішень може бути хімічно синтезований, наприклад, стандартними методами твердофазового синтезу. Такими методами є винятковий твердофазовий синтез, частковий твердофазовий синтез, фракціонована конденсація і класичний синтез у розчині. Процедури твердофазового поліпептидного синтезу добре відомі фахівцям [див., наприклад, Stewart et al., "Solid Phase Peptide Synthesis", 2nd ed., Pierce Chemical Company, (1984)]. Синтезований поліпептид може бути очищений за допомогою препаративної високоефективної рідинної хроматографії, описаної Creighton T. [Protein, structures and molecular principles, W.H. Freeman and Co. N.Y. (1983)], а його амінокислотна послідовність може бути підтверджена стандартними методами секвенування амінокислот. Як було описано вище, вказаний препарат, переважно, одержують шляхом імунізації ссавця вказаним антигеном-мішенню. Одержання препарату in vivo може бути переважно здійснене шляхом повторної ін'єкції ссавцеві антигену-мішені у присутності ад'юванту відповідно до схеми введення, що передбачає бустерстимуляцію продукування антитіл у сироватці. У випадку, якщо даний антиген-мішень дуже малий для вироблення адекватної імуногенної відповіді (що називається у літературі "гаптеном"), то такий гаптен може бути приєднаний до антигенно нейтрального носія, такого як гемоціанін лімфи равлика (KLH) або сироватковий альбумін [наприклад, альбумін бичачої сироватки (BSA)] (див., наприклад, патенти США №№ 5189178 і 5239078). Приєднання гаптену до носія може бути здійснене різними методами, добре відомими фахівцям, так, наприклад, може бути здійснене пряме приєднання до аміногруп, з подальшим, але необов'язковим, відновленням утворюваного іміно-зв'язку. Альтернативно, даний носій може бути приєднаний з використанням конденсуючих агентів, таких як дициклогексилкарбодіімід або інші карбодіімідні дегідратуючі агенти. Для такого приєднання мо 33 жуть бути також використані лінкерні сполуки, а саме можуть бути використані гомобіфункціональні та гетеробіфункціональні лінкери, що постачаються фірмою Pierce Chemical Company, Rockford, III. Одержаний імуногенний комплекс може бути потім ін'єктований придатним ссавцям, таким як корови, вівці, миші, кролики і т.п. Після вироблення антитіла in vivo, його титр у сироватці ссавцяхазяїна може бути легко визначений відповідно до процедур імуноаналізів, добре відомих фахівцям у даній галузі. Як було описано вище, вказаний препарат може переважно містити гуманізоване антитіло або його фрагмент. Гуманізовані антитіла або їх фрагменти являють собою генетично сконструйовані химерні антитіла або їх фрагменти, що мають, переважно мінімальні, частини, що походять від не-людських антитіл. Гуманізованими антитілами є антитіла, в яких гіперваріабельні області людського антитіла (антитіла-реципієнта) замінені залишками гіперваріабельної області не-людського антитіла (донорного антитіла), такого як мишачого, щурячого або кролячого антитіла, що володіє потрібними функціональними властивостями. У деяких випадках, каркасні залишки Fv людського антитіла замінені відповідними нелюдськими залишками. Гуманізовані антитіла можуть також містити залишки, не присутні у послідовностях антитіла-реципієнта, в "імпортній" гіперваріабельній області або у каркасній області. У загальних рисах, гуманізоване антитіло може містити, по суті, всі або щонайменше один, а звичайно два варіабельних домени, в яких всі, або в основному всі, гіперваріабельні області відповідають областям нелюдського антитіла, а всі, або майже всі, каркасні області відповідають областям релевантної людської консенсусної послідовності. В оптимальному випадку, гуманізованні антитіла також включають щонайменше частину константної області антитіла, такої як Fc-область, що звичайно походить від людського антитіла (див., наприклад, див., Jones et al., Nature, 321, 522 (1986); Riechmann et al., Nature 332:323-329 і Presta, 1992, Curr. Op. Struct. Biol. 2:593-596). Методи гуманізації нелюдських антитіл або їх фрагментів добре відомі фахівцям. У загальних рисах, гуманізоване антитіло має один або декілька амінокислотних залишків, введених у нього з джерела, яке не є людиною. Такі не-людські амінокислотні залишки часто називають "імпортними" залишками, що звичайно походять від "імпортного" варіабельного домену. Гуманізація може бути здійснена, по суті, як описано у літературі (див., наприклад, Jones et al., Nature 321, 522 (1986); Riechmann et al., 1988. Nature, 332:323-327, Verhoeyen et al., Science, 239:1534-1536; патент США № 4816567) шляхом заміни людських гіперваріабельних областей відповідними гіперваріабельними областями гризунів. Відповідно до цього, такими гуманізованими антитілами є химерні антитіла, де варіабельний домен, який, по суті, менше варіабельного домену інтанктного людського антитіла, замінений відповідною послідовністю, що походить від не-людського антитіла. Практично, гуманізованими антитілами, в основному, 93658 34 можуть бути людські антитіла, в яких деякі залишки гіперваріабельної області, а можливо і деякі залишки каркасної області замінені залишками, що походять від аналогічних сайтів антитіл гризунів. Людські антитіла або їх фрагменти можуть бути також одержані різними методами, відомими фахівцям, включаючи конструювання бібліотек фагового представлення [див. наприклад, Hoogenboom & Winter, 1991. J. Mol. Biol. 227:381; Marks et al., 1991. J. Mol. Biol. 222:581; Cole et al., "Monoclonal Antibodies and Cancer Therapy", Alan R. Liss, pp. 77 (1985); Boerner et al. 1991. J. Immunol., 147:86-95). Гуманізовані антитіла можуть бути також одержані шляхом введення послідовностей, що кодують області людського імуноглобуліну, трансгенним тваринам, наприклад, мишам, у яких ендогенні гени імуноглобуліну були частково або повністю інактивовані. Після антигенної стимуляції продукування людського антитіла спостерігалося у таких тварин, які у всіх відношеннях мали подібність до людини, включаючи реаранжування генів, збирання ланцюгів і репертуар антитіл. Повне керівництво зі здійснення такої технології наводиться у літературі (див., наприклад, патенти США №№ 5545807, 5545806, 5569825, 5625126, 5633425 і 5661016; Marks et al., 1992. Bio/Technology 10:779783; Lonberg et al., 1994. Nature 368:856-859; Morrison, 1994. Nature 368:812-13; Fishwild et al., 1996. Nature Biotechnology, 14:845-51; Neuberger 1996. Nature Biotechnology, 14:826; Lonberg & Huszar, 1995. Intern. Rev. Immunol. 13:65-93). Антитіла-антагоністи проти мембранозв'язаного INSP201 можуть бути використані для лікування запальних і/або аутоімунних розладів. Антитіла-агоністи проти мембрано-зв'язаного INSP201 можуть бути використані для лікування раку, ВІЛ- і/або EBV-інфекцій і гепатиту В. Активність антитіл проти INSP201 може бути продемонстрована в аналізах і/або на тваринахмоделях, як описано у прикладах6-8. Переважними молекулами нуклеїнової кислоти відповідно до другого і третього аспектів винаходу є молекули, які кодують поліпептидні послідовності, представлені у SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10, SEQ ID NO:12, SEQ ID NO:14 і/або SEQ ID NO:16, або SEQ ID NO:18, і функціонально еквівалентні поліпептиди. Ці молекули нуклеїнової кислоти можуть бути використані у способах і для цілей, описаних у даній заявці. Молекули нуклеїнової кислоти відповідно до винаходу, переважно, містять принаймні η суміжних нуклеотидів в описаних тут послідовностях, де п, в залежності від конкретної послідовності, переважно, дорівнює 10 або більше (наприклад, 12, 14, 15, 18, 20, 25, 30, 35, 40 або більше). Молекулами нуклеїнової кислоти відповідно до винаходу також є послідовності, комплементарні послідовностям молекул нуклеїнової кислоти, описаних вище (наприклад, для використання як антисмислових послідовностей або як зондів). Молекули нуклеїнової кислоти відповідно до винаходу можуть бути присутніми у формі РНК, такої як мРНК, або у формі ДНК, включаючи, наприклад, кДНК, синтетичну ДНК або геномну ДНК. 35 Такі молекули нуклеїнової кислоти можуть бути одержані методами клонування, хімічного синтезу або їх комбінацією. Молекули нуклеїнової кислоти можуть бути одержані, наприклад, методом хімічного синтезу, таким як твердофазовий фосфорамідитний хімічний синтез, виділення з геномних або кДНК-бібліотек або виділення з відповідного організму. РНК-молекули можуть бути, в основному, генеровані шляхом in vitro- або in vivoтранскрипції ДНК-послідовностей. Молекули нуклеїнової кислоти можуть бути двохланцюжковими або одноланцюжковими. Одноланцюжковою ДНК може бути кодуючий ланцюг, також відомий як смисловий ланцюг, або некодуючий ланцюг, який також називають антисмисловим ланцюгом. Термін "молекула нуклеїнової кислоти" також охоплює аналоги ДНК і РНК, такі як аналоги, що містять модифіковані кістяки і зв'язані з пептидом нуклеїнові кислоти (PNA). Використовуваний тут термін "PNA" означає антисмислову молекулу або антиген, який містить олігонуклеотид, що складається, принаймні, з п'яти нуклеотидів і приєднаний до пептидного кістяка з амінокислотних залишків, які переважно закінчуються лізином. Цей кінцевий лізин надає даній композиції розчинність. PNA можуть бути ПЕГільовані для продовження їх часу життя у клітині, де вони переважно, зв'язуються з комплементарною одноланцюжковою ДНК і РНК і припиняють елонгацію транскрипту (Nielsen P.E. et al. (1993) Anticancer Drug Des. 8:53-63). Молекула нуклеїнової кислоти, що кодує поліпептид відповідно до винаходу, може бути ідентична кодуючій послідовності однієї або декількох описаних тут молекул нуклеїнової кислоти. Ці молекули можуть також мати різні послідовності, які, внаслідок виродженості генетичного коду, кодують поліпептид, представлений у будьякій з послідовностей SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10, SEQ ID NO:12, SEQ ID NO:14 і/або SEQ ID NO:16 або SEQ ID NO:18. Такими молекулами нуклеїнової кислоти можуть бути, але не обмежуються ними, послідовність, що кодує тільки зрілий поліпептид; послідовність, що кодує зрілий поліпептид, і додаткові кодуючі послідовності, такі як послідовності, що кодують лідерну або секреторну послідовність, таку як про-, пре- або препро-поліпептидну послідовність; послідовність, що кодує зрілий поліпептид із зазначеними вище додатковими кодуючими послідовностями або без них, або разом з іншими додатковими некодуючими послідовностями, включаючи некодуючі 5'- і 3'-послідовності, такі як транскрибовані нетрансльовані послідовності, які грають визначену роль у транскрипції (включаючи сигнали термінації), у зв'язуванні з рибосомою і у забезпеченні стабільності мРНК. Молекулами нуклеїнової кислоти можуть бути також допоміжні послідовності, що кодують додаткові амінокислоти, такі як амінокислоти, що володіють додатковими функціональними властивостями. Молекули нуклеїнової кислоти відповідно до другого і третього аспектів винаходу можуть також кодувати фрагменти або функціональні еквіваленти поліпептидів і фрагментів відповідно до першо 93658 36 го аспекту винаходу. Вказана молекула нуклеїнової кислоти може являти собою природний варіант, такий як природний алельний варіант, або така молекула може являти собою варіант, що не зустрічається у природі. Вказані неприродні варіанти молекули нуклеїнової кислоти можуть бути одержані методами мутагенезу, включаючи методи, що застосовуються до молекул нуклеїнової кислоти, до клітин або до цілих організмів. Серед варіантів, що розглядаються, є варіанти, які відрізняються від зазначених вище молекул нуклеїнової кислоти тим, що вони мають нуклеотидні заміни, делеції або інсерції. Такі заміни, делеції або інсерції можуть бути зроблені в одному або декількох нуклеотидах. Вказані варіанти можуть бути модифіковані у кодуючій або у некодуючій області або у тій й іншій областях. Альтерації у кодуючих областях можуть приводити до консервативних або неконсервативних амінокислотних замін, делецій або інсерцій. Молекули нуклеїнової кислоти відповідно до винаходу можуть бути також сконструйовані методами, в основному, відомими фахівцям, включаючи, в залежності від цілей застосування, модифікацію клонування, процесинг і/або експресію генного продукту (поліпептиду). Перестановка ДНК шляхом рандомізованої фрагментації і повторного збирання генних фрагментів і синтетичних олігонуклеотидів за допомогою ПЛР являє собою технологію, яка може бути використана для конструювання нуклеотидних послідовностей. Сайтнаправлений мутагенез може бути використаний для введення нових рестрикційних сайтів, зміни характеру глікозилування, зміни переваги кодонів, продукування варіантів сплайсингу, введення мутацій і т.п. Молекули нуклеїнової кислоти, які кодують поліпептид відповідно до першого аспекту винаходу, можуть бути ліговані з гетерологічною послідовністю так, щоб одержана комбінована молекула нуклеїнової кислоти кодувала гібридний білок. Такі комбіновані молекули нуклеїнової кислоти входять у другий або третій аспекти даного винаходу. Так, наприклад, для скринінгу пептидних бібліотек на інгібітори активності вказаного поліпептиду з використанням такої комбінованої молекули нуклеїнової кислоти може виявитися корисним здійснення експресії гібридного білка, який може розпізнаватися комерційно доступним антитілом. Гібридний білок може бути також сконструйований так, щоб він містив сайт розщеплення, локалізований між послідовністю поліпептиду відповідно до винаходу і послідовністю гетерологічного білка, і щоб такий поліпептид міг бути відщеплений і виділений з вказаного гетерологічного білка. Молекулами нуклеїнової кислоти відповідно до винаходу можуть бути також антисмислові молекули, які є частково комплементарними молекулам нуклеїнової кислоти, що кодують поліпептиди відповідно до винаходу, а тому, вони гібридизуються з кодуючими молекулами нуклеїнової кислоти (гібридизація). Відповідно до методів, відомих середньому фахівцеві у даній галузі, такі антисмислові молекули, наприклад, олігонуклеотиди, можуть бути сконструйовані так, щоб вони розпізнавали 37 потрібну нуклеїнову кислоту, що кодує поліпептид відповідно до винаходу, специфічно зв'язувалися з цією нуклеїновою кислотою і, тим самим, запобігали її транскрипції (див. наприклад, Cohen J.S., Trends in Pharm. Sci., 10, 435 (1989), Okano, J. Neurochem. 56, 560 (1991); O'Connor, J. Neurochem 56, 560 (1991); Lee et al., Nucleic Acids Res 6, 3073 (1979); Cooney et al., Science 241, 456 (1988); Dervan et al., Science 251, 1360 (1991)). Використовуваний тут термін "гібридизація" означає приєднання двох молекул нуклеїнової кислоти одна до одної за допомогою водневих зв'язків. Звичайно, одна молекула може бути фіксована на твердому носії, а інша молекула може знаходитися у розчині у вільному стані. Потім ці дві молекули можуть бути піддані контакту одна з одною в умовах, що сприяють утворенню водневого зв'язку. Факторами, що впливають на утворення таких зв'язків, є: тип і об'єм розчинника; температура реакції; час гібридизації; перемішування; присутність агентів, що блокують неспецифічне зв'язування молекули у рідкій фазі з твердим носієм (реагент Денхардта або BLOTTO); концентрація молекул; використання сполук, що підвищують швидкість асоціації молекул (сульфату декстрану або поліетиленгліколю); і жорсткість умов промивання після гібридизації (Sambrook et al., [див. вище]). Інгібування гібридизації повністю комплементарної молекули з молекулою-мішенню може бути оцінене з використанням гібридизаційного аналізу, відомого фахівцям (Sambrook et al. [див. вище]). У високій мірі гомологічна молекула буде потім конкурувати з повністю гомологічною молекулою за зв'язування з молекулою-мішенню та інгібувати це зв'язування у різних умовах жорсткості, як описано у Wahl G.M. і S.L. Berger (1987; Methods Enzymol. 152:399-407) і Kimmel A.R. (1987; Methods Enzymol. 152:507-511). Термін "жорсткість" означає умови реакції гібридизації, які сприяють асоціації молекул з великою подібністю, але не сприяють асоціації молекул, що відрізняються. Умови гібридизації високої жорсткості визначають як умови інкубування протягом ночі при 42°С у розчині, що містить 50% формамід, 5XSSC (150 мМ NaCl, 15 мМ тринатрійцитрат), 50 мМ фосфат натрію (рН 7,6), 5х розчин Денхардта, 10% сульфат декстрану і 20 мікрограмів/мл денатурованої фрагментованої ДНК сперми лосося, з подальшим промиванням фільтрів в 0,1 X SSC приблизно при 65°С. Умови низької жорсткості передбачають реакцію гібридизації, що здійснюється при 35°С (Sambrook et al. [див. вище]). Переважними умовами гібридизації є умови гібридизації високої жорсткості. У переважних варіантах цього аспекту, даний винахід стосується молекул нуклеїнової кислоти, які, по всій своїй довжині, принаймні, на 70% ідентичні молекулі нуклеїнової кислоти, що кодує поліпептид INSP201, і молекул нуклеїнової кислоти, які, в основному, комплементарні вказаним молекулам нуклеїнової кислоти. Відповідно до цього аспекту даного винаходу, переважно, щоб молекула нуклеїнової кислоти містила область, яка по всій своїй довжині щонайменше на 80% ідентична 93658 38 такій кодуючій послідовності, або, щоб молекула нуклеїнової кислоти була комплементарна вказаній молекулі. При цьому особливо переважно, щоб молекули нуклеїнової кислоти по всій своїй довжині були щонайменше на 90%, більш переважно, щонайменше на 95%, а особливо переважно, щонайменше на 98%, 99% або більше ідентичні вказаним послідовностям. Переважними варіантами цього аспекту є молекули нуклеїнової кислоти, що кодують поліпептиди, які володіють, в основному, такою ж біологічною функцією або активністю, як і поліпептид INSP201. Даний винахід стосується способу детектування молекули нуклеїнової кислоти відповідно до винаходу, що включає стадії: (а) контактування нуклеїнового зонда відповідно до винаходу з біологічним зразком в умовах гібридизації, що сприяють утворенню дуплексів; і (b) детектування будьякого з таких утворених дуплексів. Як буде додатково обговорюватися нижче у зв'язку з аналізами, які можуть бути використані відповідно до даного винаходу, молекула нуклеїнової кислоти, описана вище, може бути використана як гібридизаційний зонд для РНК, кДНК або геномної ДНК з метою виділення повнорозмірних кДНК і геномних клонів, що кодують поліпептид INSP201, і з метою виділення кДНК і геномних клонів гомологічних і ортологічних генів, що мають високий ступінь подібності до генів, що кодують цей поліпептид. У зв'язку з цим, нарівні з іншими відомими методами, можуть бути використані методи, що описані і обговорюються нижче як ілюстрація. Методи секвенування і аналізу ДНК добре відомі і, в основному, доступні фахівцям, і можуть бути реально використані для здійснення багатьох варіантів відповідно до винаходу, що обговорюються у даний заявці. У вказаних методах можуть використовуватися ферменти, такі як фрагмент Кленова ДНКполімерази І, секвеназа (US Biochemical Corp., Cleveland, OH), полімераза Taq (Perkin Elmer), термостабільна полімераза T7 (Amersham, Chicago, IL), або комбінація таких полімераз і коригувальні екзонуклеази, такі як екзонуклеази, що присутні в ELONGASE Amplification System, і постачаються Gibco/BRL (Gaithersburg, MD). Спосіб секвенування може бути, переважно, автоматизований з використанням пристроїв, таких як апарат Hamilton Micro Lab 2200 (Hamilton, Reno, NV), термокомірка Peltier Thermal Cycler (PTC200; MJ Research, Watertown, MA), каталізатор АВІ і ДНКсеквенатори 373 і 377 DNA Sequencers (Perkin Elmer). Одним з методів виділення молекули нуклеїнової кислоти, що кодує поліпептид з функцією, еквівалентною функції поліпептиду INSP201, є зондування бібліотеки геномних ДНК або кДНК природним або штучно сконструйованим зондом відповідно до стандартних процедур, відомих фахівцям (див., наприклад, "Current Protocols in Molecular Biology", Ausubel et al. (eds). Greene Publisching Associates and Wiley Interscience, New York, 1989, 1992). Особливо придатними є зонди, які містять щонайменше 15, переважно, щонайменше 30, а більш переважно, щонайменше 50 ос 39 нов, що безперервно йдуть одна за одною, які відповідають або комплементарні послідовностям нуклеїнової кислоти, що походить від відповідного кодуючого гена (SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9, SEQ ID NO:11, SEQ ID NO:13, SEQ ID NO:15 і SEQ ID NO:17). Для полегшення ідентифікації такі зонди можуть бути помічені реагентом, що аналітично детектується. Придатними реагентами є, але не обмежуються ними, радіоізотоп, флуоресцентні барвники і ферменти, здатні каталізувати утворення продукту, що детектується. З використанням цих зондів середній фахівець у даній галузі може самостійно виділити комплементарні копії полінуклеотидів геномної ДНК, кДНК або РНК, що кодують білки, які представляють інтерес, що походять від різних джерел, наприклад, людини, ссавця або інших тварин, і скринувати ці джерела на присутність споріднених послідовностей, наприклад, окремих членів сімейства, типу і/або підтипу. У багатьох випадках виділені кДНКпослідовності будуть неповними, тобто у цих послідовностях область, що кодує поліпептид, буде сильно обрізана, звичайно біля 5'-кінця. Для одержання повнорозмірних кДНК або для подовження коротких кДНК існує декілька методів. Такі послідовності можна подовжити з використанням неповної нуклеотидної послідовності та із застосуванням різних відомих методів детектування вище розташованих послідовностей, таких як промотори і регуляторні елементи. Так, наприклад, одним з методів, який може бути використаний у цьому випадку, є метод швидкої ампліфікації кДНК-кінців (RACE; див., наприклад, Frohman et al., PNAS USA 85, 8998-9002, 1998). Нещодавно розроблені модифікації цієї технології, проілюстровані Marathon T.M. (Clontech Laboratories Inc.), значно спростили пошук більш довгих кДНК. Для пошуку невідомої послідовності нуклеїнової кислоти, яка є суміжною з відомим локусом, може бути використаний злегка модифікований метод, який називається "сайтрестрикційною" ПЛР і передбачає використання універсальних праймерів (Sarkar G. (1993) PCR Methods Applic. 2:318-322). Для ампліфікації або для подовження послідовностей з використанням різних праймерів, одержаних на основі відомої області, може бути також використана зворотна ПЛР (Triglia Т. et al. (1988) Nucleic Acids Res. 16:8186). Іншим методом, який може бути використаний у цьому випадку, є ПЛР "із захопленням", яка являє собою ПЛР-ампліфікацію ДНКфрагментів, суміжних з відомою послідовністю у штучній хромосомній ДНК людини і дріжджів (Lagerstrom Μ. et al., (1991) PCR Methods Applic. 1, 111-119). Іншим методом, який може бути використаний для пошуку невідомих послідовностей, є метод Parker J.D. et al. (1991) Nucleic Acids Res. 19:3055-3060). Крім того, можна використовувати ПЛР, "гніздові" праймери і бібліотеки PromoterFinderTM для "прогулянки" по геномній ДНК (Clontech, Palo Alto, CA). Цей спосіб дозволяє уникнути необхідності скринінгу бібліотек і може бути використаний для виявлення ділянок стику інтрон/екзон. 93658 40 При скринінгу на повнорозмірні ДНК переважно використовувати бібліотеки, які були відібрані за розмірами і містять більш великі кДНК. Переважними також є бібліотеки рандомізованих праймерів, які можуть включати додаткові послідовності, що містять 5'-області генів. Використання бібліотеки рандомізованих праймерів може виявитися особливо переважним у тому випадку, якщо бібліотека oligo-d(T) не дає повнорозмірної кДНК. Геномні бібліотеки можуть бути використані для подовження послідовності з одержанням 5'нетранскрибованих регуляторних областей. В одному з варіантів здійснення винаходу молекули нуклеїнової кислоти відповідно до винаходу можуть бути використані для визначення локалізації у хромосомі. У цьому методі молекула нуклеїнової кислоти може бути націлена на конкретну ділянку, або вона може бути гібридизована з конкретною ділянкою на окремій хромосомі людини. Відповідно до даного винаходу, картування релевантних послідовностей у хромосомах є важливою стадією у підтвердженні кореляції цих послідовностей з геноасоційованим захворюванням. Після картування послідовності з визначенням її точної локалізації, фізичне положення послідовності на хромосомі може бути порівняне з даними генетичної карти. Ці дані можна знайти, наприклад, у роботі V. McKusick, Mendelian Inheritance in Man (наявній у наш час у бібліотеці Уельського медичного університету Джона Хопкінса) (John Hopkins University Welch Medical Library). Взаємозв'язок між генами, які можуть бути картовані на одній і тій же області хромосоми, і захворюваннями, асоційованими з ними, потім ідентифікують за допомогою аналізу на зчеплення генів (спільне успадковування фізично суміжних генів). Це дозволяє дослідникам одержати цінну інформацію, яка може бути використана для пошуку генів, асоційованих з даним захворюванням, із застосуванням методу позиційного клонування або інших методів виявлення генів. Після попереднього визначення локалізації генів, асоційованих з даним захворюванням або синдромом, шляхом аналізу на зчеплення генів з конкретною областю геному, будь-яке картування послідовностей на даній ділянці може дати інформацію про асоційовані або регуляторні гени, яка може бути використана для подальших досліджень. Молекула нуклеїнової кислоти може бути також використана для детектування відмінностей у хромосомній локалізації, обумовлених транслокацією, інверсією і т.п., у нормальних індивідуумів, індивідуумів-носіїв та у індивідуумів, які страждають захворюванням. Молекули нуклеїнової кислоти відповідно до винаходу також є цінним матеріалом для визначення локалізації у тканинах. Такі методи дозволяють визначати характер експресії поліпептиду у тканинах шляхом детектування мРНК, яка їх кодує. Такими методами є методи гібридизації in situ і методи ампліфікації нуклеотидів, такі як ПЛР. Результати цих досліджень дозволяють одержати певні відомості відносно нормальних функцій даного поліпептиду в організмі. Крім того, у цих дослідженнях, порівняння нормального характеру експресії мРНК з експресією мРНК, що кодується 41 мутантним геном, дозволяє одержати важливу інформацію про роль мутантних поліпептидів у даному захворюванні. Така аномальна експресія може мати короткочасну, просторову або кількісну природу. Для інгібування ендогенної експресії гена, що кодує поліпептид відповідно до винаходу, можуть бути також використані методи "відключення" гена. Одним з методів, який може бути використаний для "відключення" послідовність-специфічного посттрансляційного гена, є інтерференція РНК (RNAi) (Elbashir S.M. et al., Nature 2001, 411, 494498). Короткі дцРНК-олігонуклеотиди синтезують in vitro і вводять у клітину. Послідовністьспецифічне зв'язування цих дцРНКолігонуклеотидів запускає процес деградації мРНК-мішені, що приводить до зниження рівня або до скасування експресії білка-мішені. Ефективність методів "відключення" гена, описаних вище, може бути оцінена шляхом визначення рівня експресії поліпептидів (наприклад, за допомогою Вестерн-блотингу), а на РНК-рівні, вона може бути оцінена за допомогою методики, що базується на TaqMan. Вектори відповідно до винаходу містять молекули нуклеїнової кислоти відповідно до винаходу і можуть являти собою клонуючі або експресуючі вектори. Клітини-хазяїни відповідно до винаходу, які можуть бути трансформовані, трансфіковані або трансдуковані векторами відповідно до винаходу, можуть являти собою прокаріотичні або еукаріотичні клітини-хазяїни. Поліпептиди відповідно до винаходу можуть бути одержані у рекомбінантній формі за допомогою експресії молекул нуклеїнової кислоти, що кодують ці поліпептиди, у векторах, які містяться у клітині-хазяїні. Такі методи експресії добре відомі фахівцям, і багато з них детально описані у Sambrook et al. (див. вище) і Fernandez & Hoeffler (1998, eds. "Gene expression systems. Using nature for the art of expression". Academic Press, San Diego, London, Boston, New York, Sydney, Tokyo, Toronto). Для продукування поліпептиду у потрібному хазяїні можуть бути використані, в основному, будь-які системи або будь-які вектори, придатні для підтримки, ампліфікації або експресії молекул нуклеїнової кислоти. Придатна нуклеотидна послідовність може бути вбудована в експресійну систему будь-яким з добре відомих і рутинних методів, таких як методи, описані у Sambrook et al. (див. вище). У загальних рисах, кодуючий ген може бути вміщений під контроль регуляторного елемента, такого як промотор, сайт зв'язування з рибосомою (для експресії у бактеріях), і необов'язково, оператор, так, щоб ДНК-послідовність, що кодує потрібний поліпептид, транскрибувалася у РНК у трансформованій клітині-хазяїні. Прикладами придатних систем експресії є, наприклад, хромосомна, епісомна і вірусна системи, включаючи, наприклад, вектори, що походять від бактеріальних плазмід, бактеріофагу, транспозонів, дріжджових епісом, інсерційних елементів, дріжджових хромосомних елементів, вірусів, таких як бакуловірус, паповавірсуси, такі як SV40, віруси 93658 42 коров'ячої віспи, аденовіруси, віруси віспи домашньої птиці, віруси псевдосказу і ретровіруси, або їх комбінації, а також вектори, що походять від плазмідних і бактеріофагових генетичних елементів, включаючи косміди і фагміди. Для доставки більш великих фрагментів ДНК, ніж ті, які можуть міститися і експресуватися у плазміді, можуть бути також використані штучні людські хромосоми (НАС). Переважними прикладами векторів, які можуть бути використані відповідно до аспектів даного винаходу, що належать до INSP201, є вектори pCR4-TOPO, pCR4-TOPO-INSP201, pENTR, pENTR_INSP201EC-6HIS, pEAK12d-PAC, pDEST12.2, pEAK12d-PAC_INSP201EC-6HIS і pDEST12.2_INSP201EC-6HIS. Особливо придатними експресійними системами є мікроорганізми, такі як бактерії, трансформовані рекомбінантним бактеріофагом, плазмідними або космідними ДНК-експресуючими векторами; дріжджі, трансформовані векторами для експресії у дріжджах; клітинні системи комах, інфіковані вірусними експресуючими векторами (наприклад, бакуловірусом); клітинні системи рослин, трансформовані вірусними експресуючими векторами (наприклад, вірусом мозаїки цвітної капусти, CaMV; вірусом мозаїки тютюну, TMV) або векторами для експресії у бактеріях (наприклад, плазмідами Ті або pBR322); або клітинні системи тварин. Для продукування поліпептидів відповідно до винаходу можуть бути також використані безклітинні системи трансляції. Введення молекул нуклеїнової кислоти, що кодують поліпептид відповідно до винаходу, у клітини-хазяїни, може бути здійснено методами, описаними у багатьох відомих лабораторних керівництвах, таких як керівництво Davis et al., Basic Methods in Molecular Biology (1986) і Sambrook et al. [див. вище]. Особливо придатними методами є трансфекція з використанням фосфату кальцію; трансфекція, опосередкована DEAE-декстраном; трасвекція; мікроінжекція; трансфекція, опосередкована катіонним ліпідом; електропорація; трансдукція; завантаження шляхом зскрібка; введення методом біобалістики або інфікування (див., Sambrook et al., 1989, [див. вище], Ausubel et al., 1991 [див. вище], Spector, Goldman & Leinwald, 1998). В еукаріотичних клітинах експресійні системи, в залежності від цілей їх використання, можуть бути або тимчасовими (наприклад, епісомними), або перманентними (хромосомна інтеграція). Кодуюча молекула нуклеїнової кислоти може включати, а може і не включати, послідовність, що кодує регуляторну послідовність, таку як сигнальний пептид або лідерна послідовність, якщо це необхідно, наприклад, для секреції поліпептиду, що транслюється, у просвіт ендоплазматичного ретикулуму, у периплазматичний простір або у позаклітинний простір. Ці сигнали можуть бути ендогенними по відношенню до поліпептиду або вони можуть бути гетерологічними. Лідерні послідовності можуть бути видалені бактеріальним хазяїном при посттрансляційному процесингу. Крім регуляторних послідовностей може виявитися бажаним введення регуляторних послідовностей, які забезпечують регуляцію експресії по 43 ліпептиду в залежності від росту клітини-хазяїна. Прикладами регуляторних послідовностей є послідовності, які забезпечують збільшення або зниження рівня експресії гена у відповідь на хімічну або фізичну стимуляцію, включаючи присутність регуляторної сполуки, або у відповідь на різні температурні або метаболічні умови. Регуляторними послідовностями є нетрансльовані області вектора, такі як енхансери, промотори і 5'- і 3'нетрансльовані області. Ці послідовності взаємодіють з клітинними білками хазяїна, внаслідок чого здійснюється транскрипція і трансляція. Такі регуляторні послідовності можуть варіюватися за своєю довжиною і специфічністю. В залежності від вибраної векторної системи і вибраного хазяїна можуть бути використані будь-які придатні транскрипційні і трансляційні елементи, включаючи конститутивні та індуцибельні промотори. Так, наприклад, для клонування у бактеріальних системах можуть бути використані індуцибельні промотори, такі як гібридний промотор lacZ фагміди BlueScript (Stratagene, LaJolla, СА) або плазміди pSportl (Gibco BRL) і т.п. У клітинах комах може використовуватися бакуловірусний промотор поліедрину. Промотори або енхансери, що походять від геномів рослинних клітин (наприклад, гена білка теплового шоку, RUBISCO і гена запасних білків) або від вірусів рослин (наприклад, вірусних промоторів або лідерних послідовностей), можуть бути клоновані у вказаний вектор. У клітинних системах ссавців переважними є промотори, що походять від генів ссавців або від вірусів ссавців. Якщо необхідно генерувати клітинну лінію, що містить множину копій даної послідовності, то можуть бути використані вектори на основі SV40 або EBV з відповідним селективним маркером. Експресуючий вектор конструюють так, щоб конкретна кодуюча послідовність нуклеїнової кислоти була присутньою у векторі разом з відповідними регуляторними послідовностями і щоб положення і орієнтація кодуючої послідовності по відношенню до регуляторних послідовностей дозволяли такій кодуючій послідовності транскрибуватися під "контролем" регуляторних послідовностей, тобто так, щоб РНК-полімераза, яка зв'язується з ДНК-молекулою біля регуляторних послідовностей, здійснювала транскрипцію кодуючої послідовності. У деяких випадках може виявитися необхідним модифікувати вказану послідовність так, щоб вона могла приєднуватися до регуляторних послідовностей у відповідній орієнтації, тобто зі збереженням рамки зчитування. Вказані регуляторні послідовності та інші регуляторні послідовності можуть бути ліговані з кодуючою послідовністю нуклеїнової кислоти перед вбудовуванням у вектор. Альтернативно, така кодуюча послідовність може бути клонована безпосередньо в експресуючий вектор, який вже містить регуляторні послідовності і відповідний рестрикційний сайт. Для тривалого високоефективного продукування рекомбінантного поліпептиду переважною є стабільна експресія. Так, наприклад, клітинні лінії, які стабільно експресують потрібний поліпептид, можуть бути трансформовані з використанням 93658 44 експресуючих векторів, які можуть містити вірусні сайти ініціації реплікації і/або ендогенні експресійні елементи і вибраний маркерний ген, присутній на тому ж самому або на окремому векторі. Після введення цього вектора клітини можна залишити на 1-2 дні для росту у збагаченому середовищі, яке потім замінюють селективним середовищем. Селективний маркер необхідний для надання резистентності, що використовується з метою відбору, і його присутність дозволяє культивувати і виділяти клітини, які успішно експресують введені послідовності. Резистентні клони стабільно трансформованих клітин можуть бути піддані проліферації методами культивування тканини, придатними для клітин такого типу. Клітинні лінії ссавців, придатні як хазяїни для експресії, добре відомі фахівцям, і такими клітинними лініями є багато іморталізованих клітинних ліній, наявних в Американській колекції типових культур (АТСС), включаючи, але не обмежуючись ними, клітини яєчника китайського хом'ячка (СНО), клітини HeLa, клітини нирок дитинчат хом'ячка (ВНК), клітини нирок мавпи (COS), клітини С127, клітини 3T3, клітини ВНК, клітини НЕК 293, клітини меланоми Боуеса, клітини гепатоцелюлярної карциноми людини (наприклад, Hep G2) і ряд інших клітинних ліній. У бакуловірусній системі матеріали для одержання експресійних систем бакуловірус/клітина комахи є комерційно доступними і постачаються у наборах, inter alia, від Invitrogen, San Diego CA (набір "МахВас"). У загальних рисах, ці методи відомі фахівцям і детально описані у Summers & Smith, Texas Agricultural Experiment Station Bulletin № 1555 (1987). Клітинами-хазяїнами, особливо придатними для використання у даній системі, є клітини комах, такі як клітини Drosophila S2 і клітини Spodoptera Sf9. Фахівцям відома множина систем експресії генів у клітинних культурах рослин і у цілих рослинах. Прикладами придатних систем експресії генів у клітинах рослин є системи, описані у патентах США 5693506, 5659122 і 5608143. Інші приклади експресії генів у клітинних культурах рослин описані Zenk, Phytochemistry 30, 3861-3863 (1991). Зокрема, можна використовувати будь-які рослини, з яких можуть бути виділені і культивовані протопласти з подальшим продукуванням з них цілих регенерованих рослин, які містять перенесений ген. Зокрема, з клітин або тканин, що культивуються, можуть бути регенеровані всі рослини, включаючи, але не обмежуючись ними, всі основні види цукрової тростини, цукрового буряка, бавовнику, плодових та інших дерев, бобових, а також овочевих рослин. Прикладами особливо переважних бактеріальних клітин-хазяїнів є клітини стрептококів, стафілококів, Е.coli, Streptomyces і Bacillus subtilis. Прикладами особливо придатних клітинхазяїнів для експресії у грибах є дріжджові клітини (наприклад, S. cerevisiae) і клітини Aspergillus. Будь-які системи відбору, які можуть бути використані для виділення трансформованих клітинних ліній, відомі фахівцям. Прикладами є гени тимідинкінази (Wigler Μ. et al. (1977) Cell 11:223-32) і 45 аденін-фосфорибозилтрансферази вірусу простого герпесу (Lowy I. et al. (1980) Cell 22:817-23), які можуть бути використані в tk- або aprt± -клітинах, відповідно. Крім того, як основа для відбору можуть бути використані гени резистентності до антиметаболіту, антибіотику або до гербіциду, наприклад, ген дигідрофолат-редуктази (DHFR), який надає резистентність до метотрексату (Wigler Μ. et al. (1980) Proc. Natl. Acad. Sci. 77:3567-70); ген npt, який надає резистентність до аміноглікозидів, неоміцину і до G-418 (Colbere-Garapin F. et al (1981) J. Mol. Biol. 150:1-14), і гени als або pat, які надають резистентність до хлорсульфурон- і фосфінотрипинацетилтрансферази, відповідно. Були описані й інші селективні гени, приклади яких добре відомі фахівцям. Хоча присутність або відсутність експресії маркерного гена дозволяє припустити, що присутній також і потрібний ген, однак, його присутність і експресія ще потребують підтвердження. Так, наприклад, якщо відповідна послідовність була вбудована у послідовність маркерного гена, то трансформовані клітини, що містять відповідні послідовності, можуть бути ідентифіковані за відсутністю функції маркерного гена. Альтернативно, маркерний ген може знаходитися у тандемі з послідовністю, що кодує поліпептид відповідно до винаходу, який знаходиться під контролем одного промотору. Експресія маркерного гена у відповідь на індукування або відбір звичайно вказує також на експресію тандемного гена. Альтернативно, клітини-хазяїни, які містять послідовність нуклеїнової кислоти, що кодує поліпептид відповідно до винаходу, і які експресують вказаний поліпептид, можуть бути ідентифіковані різними методами, відомими фахівцям. Такими методами є, але не обмежуються ними, ДНК-ДНК або ДНК-РНК-гібридизація і біоаналізи на присутність білка, наприклад, сортування клітин за інтенсивністю флуоресценції (FACS) або імуноаналізи (такі як твердофазовий імуноферментний аналіз [ELISA] і радіоімуноаналіз [РІА]), які передбачають використання мембран, розчинів або чіпів для детектування і/або кількісної оцінки нуклеїнової кислоти або білка (див. Hampton R. et al. (1990) Serological Methods, a Laboratory Manual, APS Press, St Paul, MN і Maddox D.E. et al., (1983) J. Exp. Med., 158, 1211-1216). Існує великий ряд методів мічення і кон'югації, відомих фахівцям, і ці методи можуть бути використані у різних аналізах на присутність нуклеїнових кислот і амінокислот. Методами, що використовуються з метою продукування мічених зондів для гібридизації або ПЛР-зондів для детектування послідовностей, споріднених з молекулами нуклеїнової кислоти, які кодують поліпептиди відповідно до винаходу, є мічення олігонуклеотидами, ніктрансляція, мічення по кінцях або ПЛРампліфікація з використанням міченого полінуклеотиду. Альтернативно, послідовності, що кодують поліпептид відповідно до винаходу, можуть бути клоновані у вектор для продукування мРНК-зонду. Такі вектори відомі фахівцям, є комерційно доступними і можуть бути використані для синтезу РНК 93658 46 зондів in vitro шляхом додання відповідної РНКполімерази, такої як Т7, Т3 або SP6, і мічених нуклеотидів. Ці процедури можуть бути проведені з використанням різних комерційно доступних наборів (Pharmacia & Upjohn (Kalamazoo, MI); Promega (Madison WI) і U.S. Biochemical Corp., Cleveland, OH). Придатними репортерними молекулами або мітками, які можуть бути використані для полегшення детектування, є радіонукліди, ферменти і флуоресцентні, хемілюмінесцентні або хромогенні агенти, а також субстрати, кофактори, інгібітори, магнітні частинки і т.п. Молекули нуклеїнової кислоти відповідно до винаходу можуть бути також використані для генерування трансгенних тварин, а зокрема, гризунів. Такі трансгенні тварини входять у додатковий аспект відповідно до винаходу. Це генерування може бути здійснене шляхом локальної модифікації соматичних клітин або маніпуляцій із зародковими лініями для введення успадковуваних модифікацій. Такі трансгенні тварини можуть бути, зокрема, використані для генерування тваринмоделей з метою пошуку молекул лікарських засобів, які є ефективними як модулятори поліпептидів відповідно до винаходу. Поліпептид може бути виділений і очищений з рекомбінантних клітинних культур добре відомими методами, включаючи преципітацію сульфатом амонію або етанолом, екстракцію кислотою, аніонообмінну або катіонообмінну хроматографію, хроматографію на фосфоцелюлозі, гідрофобну хроматографію, афінну хроматографію, хроматографію на гідроксіапатитах і хроматографію на лектині. Для очищення найбільш придатною є високоефективна рідинна хроматографія. У випадку, якщо даний поліпептид був денатурований у процесі виділення і/або очищення, то для відновлення активної конформації може бути використана добре відома техніка рефолдингу білків. Якщо необхідно, то для полегшення очищення білків можуть бути також використані спеціальні векторні конструкції, одержані шляхом приєднання послідовностей, що кодують поліпептиди відповідно до винаходу, до нуклеотидної послідовності, що кодує поліпептидний домен, який полегшує очищення розчинних білків. Прикладами таких доменів, що полегшують очищення білків, є пептиди, які утворюють хелатні комплекси з металами, такі як: гістидин-триптофанові модулі, які дозволяють проводити очищення на іммобілізованих металах; домени білка А, які дозволяють проводити очищення на іммобілізованому імуноглобуліні; і домен, що використовується у системі подовження/очищення FLAGS (Immunex Corp., Seattle, WA). Для полегшення очищення між доменом для очищення і поліпептидом відповідно до винаходу можуть бути включені лінкерні послідовності, що розщеплюються, такі як послідовності, специфічні до фактора ХА або ентерокінази (Invitrogen, San Diego, СА). Один з таких експресуючих векторів забезпечує експресію гібридного білка, що містить поліпептид відповідно до винаходу, приєднаний до декількох гістидинових залишків, за якими йдуть тіоредоксин або рестрикційний сайт ентерокінази. 47 Гістидинові залишки полегшують проведення очищення за допомогою ІМАС (афінної хроматографії на іммобілізованому іоні металу, описаної Porath J. et al. (1992), Prot. Exp. Purif. 3:263-281), тоді як тіоредоксин або рестрикційний сайт ентерокінази дозволяють виділяти поліпептид з гібридного білка. Обговорення векторів, що містять гібридні білки, можна знайти у Kroll D.J. et al. (1993; DNA Cell Biol. 12:441-453). Якщо поліпептид, що експресується, використовується в аналітичному скринінгу, то звичайно переважно, щоб він був продукований на поверхні клітини-хазяїна, в якій він експресується. У цьому випадку, клітини-хазяїни можуть бути зібрані до їх використання у скринінг-аналізі, наприклад, таким методом, як сортування клітин зі збудженням флуоресценції (FACS) або імуноафінним методом. Якщо поліпептид секретується у середовище, то таке середовище може бути відновлене для виділення і очищення експресованого поліпептиду. Якщо поліпептид продукується всередині клітини, то, перед виділенням поліпептиду, ці клітини повинні бути спочатку піддані лізису. Як вказувалося вище, даний винахід також стосується нових мішеней і способів скринінгу на лікарські засоби-кандидати або інші потрібні речовини. Такі методи скринінгу включають аналізи на зв'язування і/або функціональні аналізи і можуть бути здійснені in vitro, у клітинних системах та in vivo в організмі тварини. У зв'язку з цим, конкретною метою даного винаходу є застосування поліпептиду INSP201 як мішені для скринінгу на лікарські засобикандидати, які можуть бути використані для лікування або попередження розладів, асоційованих з глікопротеїном клітинної поверхні. Іншою метою даного винаходу є розробка способів відбору біологічно активних сполук, де вказані способи включають контактування сполукикандидату з геном або поліпептидом INSP201 і відбір сполук, які зв'язуються з вказаним геном або поліпептидом. Іншою метою даного винаходу є розробка способів відбору біологічно активних сполук, де вказані способи включають контактування сполукикандидату з рекомбінантною клітиною-хазяїном, що експресує поліпептид INSP201, і відбір сполук, які зв'язуються з вказаним поліпептидом INSP201 на поверхні вказаних клітин, і/або які модулюють активність поліпептиду INSP201. Термін "біологічно активна сполука" означає будь-яку сполуку, що володіє біологічною активністю у індивідуума, переважно, терапевтичною активністю; більш переважно, сполука, що володіє активністю глікопротеїну клітинної поверхні, а ще більш переважно, сполука, яка може бути використана для лікування INSP201-асоційованих розладів або як засіб для розробки лікарських препаратів, призначених для лікування розладів, асоційованих з глікопротеїном клітинної поверхні. "Біологічно активною сполукою", переважно, є сполука, що модулює активність INSP201. Описані вище способи можуть бути здійснені in vitro із застосуванням різних пристроїв і різних умов, включаючи використання іммобілізованих 93658 48 реагентів, і ці способи можуть також включати додаткову стадію аналізу активності вибраних сполук у моделі, такій як тварина-модель з розладом, асоційованим з глікопротеїном клітинної поверхні. Переважними вибраними сполуками є агоністи INSP201, тобто сполуки, які можуть зв'язуватися з INSP201 та імітувати активність його ендогенного ліганду. Іншою метою даного винаходу є розробка способу відбору біологічно активних сполук, де вказаний спосіб включає контактування in vitro сполуки, що тестується, з поліпептидом INSP201 відповідно до винаходу і визначення здатності вказаної сполуки, що тестується, модулювати активність вказаного поліпептиду INSP201. Іншою метою даного винаходу є розробка способу відбору біологічно активних сполук, де вказаний спосіб включає контактування in vitro сполуки, що тестується, з геном INSP201 відповідно до винаходу і визначення здатності вказаної сполуки, що тестується, модулювати експресію вказаного гена INSP201, а переважно, стимулювати його експресію. В іншому своєму варіанті даний винахід стосується способу скринінгу, відбору або ідентифікації активних сполук, а зокрема, сполук, що володіють активністю, направленою на придушення запалення, дегенерацію клітин, апоптоз і онкогенез, де вказаний спосіб включає контактування сполуки, що тестується, з рекомбінантною клітиноюхазяїном, що містить репортерну конструкцію, де вказана конструкція містить репортерний ген, що знаходиться під контролем промотору гена INSP201, і відбір сполук, що тестуються, які модулюють (наприклад, стимулюють або знижують, а переважно, стимулюють) експресію вказаного репортерного гена. Поліпептид відповідно до винаходу може бути використаний для скринінгу бібліотек сполук у будь-якому з відомих методів, що застосовуються для пошуку лікарських засобів. Такі сполуки можуть стимулювати (служити агоністами) або інгібувати (служити антагоністами) експресію гена або активність поліпептиду відповідно до винаходу, а тому вони складають додатковий аспект даного винаходу. Переважними сполуками є сполуки, здатні впливати на експресію природного гена, що кодує поліпептид відповідно до першого аспекту винаходу, або регулювати активність поліпептиду відповідно до першого аспекту винаходу. Сполуки-агоністи або сполуки-антагоністи можуть бути виділені, наприклад, з клітин, безклітинних препаратів, хімічних бібліотек або сумішей природних продуктів. Такими агоністами або антагоністами можуть бути природні або модифіковані субстрати, ліганди, ферменти, рецептори, або структурні або функціональні міметики. Придатний опис таких методів скринінгу можна знайти у роботі Coligan et al., Current Protocols in Immunology 1(2):Chapter 5 (1991). Зв'язування з геном або з поліпептидоммішенню служить показником здатності вказаної сполуки модулювати активність вказаної мішені, і, тим самим, впливати на шлях, що приводить до розвитку у індивідуума розладу, асоційованого з 49 глікопротеїном клітинної поверхні. Детектування зв'язування може бути здійснене різними методами, такими як мічення сполуки-кандидата, aналіз на конкурентне зв'язування з відомим міченим лігандом і т.п. Для проведення аналізів на зв'язування in vitro, вказані поліпептиди можуть бути використані, в основному. у чистій формі, у вигляді суспензії, у формі, іммобілізованій на носії, або у формі, що експресується у мембрані (у формі інтактної клітини, мембранного препарату, ліпосоми і т.п.). Модуляція активності включає, але не обмежується ними, стимуляцію поверхневої експресії рецептора INSP201, модуляцію мультимеризації вказаного рецептора (наприклад, утворення мультимерних комплексів з іншими субодинииями) і т.п. Клітинами, що використовуються у таких аналізах, можуть бути будь-які рекомбінантні клітини (тобто, будь-які клітини, що містять рекомбїнантну нуклеїнову кислоту, що кодує поліпептид INSP201) або будь-які клітини, що експресують ендогенний поліпептид INSP201. Прикладами таких клітин є, але не обмежуються ними, прокаріотичні клітини (такі як бактерії) і еукаріотичні клітини (такі як клітини дріжджів, клітини ссавців, клітини комах, клітини рослин і т.п.). Конкретними прикладами є клітини E.coli. Pichia pastoris. Hansenula polymorpha, Shizosaccharomyces pombe, дріжджові клітини Kluyveromyces або Saccharomyces. клітинні лінії ссавців (наприклад, клітини Vero, клітини СНО, клітини 3T3, клітини COS і т.п.), а також первинні і стабілізовані клітинні культури ссавців (наприклад, культури фібробластів, ембріональних клітин, епітеліальних клітин, нервових клітин, адипоцитів і т.п.). Сполуки, які можуть розглядатися як найбільш ймовірні кандидати на хороші антагоністи, являють собою молекули, які зв'язуються з поліпептидом відповідно до винаходу, але не індукують яких-небудь біологічних ефектів поліпептиду після зв'язування з ним. Потенційними антагоністами є невеликі органічні молекули, пептиди, поліпептиди і антитіла, які зв'язуються з поліпептидом відповідно до винаходу і, тим самим, інгібують або придушують його активність. Таким чином, зв'язування поліпептиду з нормальними клітинними молекулами, що зв'язуються, може бути піддане інгібуванню, що буде приводити до придушення нормальної біологічної активності такого поліпептиду. Поліпептид відповідно до винаходу, який використовується у такому методі скринінгу, може знаходитися у розчині у вільному стані, може бути іммобілізований на твердому носії або може бути присутнім на клітинній поверхні, або він може бути локалізований всередині клітини. Взагалі, у таких процедурах скринінгу можуть бути використані відповідні клітини або клітинні мембрани, що експресують поліпептид, який контактує зі сполукою, що тестується, що приводить до зв'язування, або до стимуляції або інгібування функціональної відповіді. Потім, функціональну відповідь клітин, що контактують зі сполукою, що тестується, порівнюють з відповіддю контрольних клітин, які не контактували зі сполукою, що тестується. Такий аналіз, що проводиться за допомогою придатної системи 93658 50 детектування, дозволяє визначити, чи може сполука, що тестується, давати сигнал, що генерується активацією вказаного поліпептиду. Інгібітори активації звичайно аналізують у присутності відомого агоніста, i оцінюють вплив цього агоніста на активацію у присутності сполуки, що тестується. Переважний спосіб ідентифікації сполуки, що є агоністом або антагоністом поліпептиду відповідно до винаходу, включає в себе: (а) контактування клітини, що експресує (необов'язково, на своїй поверхні) поліпептид відповідно до першого аспекту винаходу, де вказаний поліпептид асоційований з другим компонентом, здатним давати сигнал, що детектується, у відповідь на зв'язування сполуки з вказаним поліпептидом, де вказану сполуку скринують в умовах, що стимулюють зв'язування з вказаним поліпептидом; і (b) визначення події зв'язування вказаної сполуки з вказаним поліпептидом, або її активації або інгібування шляхом вимірювання рівня сигналу, що генерується внаслідок взаємодії вказаної сполуки з вказаним поліпептидом. Методи генерування сигналів, що детектуються, в аналізах описаного тут типу добре відомі фахівцям. Конкретним прикладом є спільне введення конструкції, що експресує поліпептид відповідно до винаходу або його фрагмент, такий як LBD, присутній у вигляді гібриду з ДНК-зв'язувальним доменом GAL4, у клітину разом з репортеркою плазмідою, такою, наприклад, як pFR-Luc iStratagene Europe, Amsterdam. The Netherlands). Ця конкретна плазміда містить синтетичний промотор з п'ятьма тандемними повторами GAL4зв'язувальних сайтів, що регулюють експресію гена люциферази. При введенні потенційного ліганду у клітини, він буде зв'язуватися з гібридом "GAL4-поліпептид", та індукувати транскрипцію гена люциферази. Моніторинг рівня експресії гена люциферази може бути проведений шляхом детектування його активності на пристрої для зчитування інтенсивності люмінесценції (див. наприклад, Lehman et al., JBC 270, 12953. 1995; Pawar et al., JBC. 277, 39243, 2002). Ще більш переважний спосіб ідентифікації агоніста або антагоніста поліпептиду відповідно до винаходу включає в себе: (a) контактування міченої або неміченої сполуки з поліпептидом, іммобілізованим на будь-якому твердому носії (наприклад, на сферах, пластинах, матричному носії, чіпі) і детектування вказаної сполуки шляхом визначення присутності мітки або самої сполуки: (b) контактування клітини, що експресує на своїй поверхні поліпептид, шляхом його штучного заякорювання на клітинній мембрані, або шляхом конструювання химерного рецептора, асоційованого з другим компонентом, здатним давати сигнал, що детектується, у відповідь на зв'язування сполуки з вказаним поліпептидом, де вказану сполуку скринують в умовах, що стимулюють зв'язування з вказаним поліпептидом; і (с) визначення події зв'язування вказаної сполуки з вказаним поліпептидом, або її активації або інгібування шляхом порівняння рівня сигналу, що 51 генерується внаслідок взаємодії вказаної сполуки з вказаним поліпептидом, з рівнем сигналу, що виробляється за відсутності даної сполуки. Так, наприклад, може бути застосований такий спосіб, як FRET-детектування ліганду, зв'язаного з поліпептидом у присутності пептидних коактиваторів (Norris et al., Science 285. 744, 1999). Інший переважний спосіб ідентифікації агоніста або антагоніста поліпептиду відповідно до винаходу включає в себе. (a) контактування клітини, що експресує (необов'язково, на своїй поверхні) поліпептид, асоційований з другим компонентом, здатним давати сигнал, що детектується, у відповідь на зв'язування сполуки з вказаним поліпептидом, де вказану сполуку скринують в умовах, що стимулюють зв'язування з вказаним поліпептидом; і (b) визначення події зв'язування вказаної сполуки з вказаним поліпептидом, або її активації або інгібування шляхом порівняння рівня сигналу, що генерується внаслідок взаємодії вказаної сполуки з вказаним поліпептидом, з рівнем сигналу, що виробляється за відсутності даної сполуки. В інших переважних варіантах винаходу загальні методи, описані вище, можуть, крім того, включати здійснення ідентифікації агоніста або антагоніста у присутності міченого або немїченого ліганду для поліпептиду. В іншому варіанті винаходу, спосіб ідентифікації агоніста або антагоніста поліпептиду відповідно до винаходу включає в себе: визначення факту інгібування зв'язування ліганду з клітинами, які експресують поліпептид відповідно до винаходу (і які, але необов'язково, містять на своїй поверхні поліпептид відповідно до винаходу), або з клітинними мембранами, що містять такий поліпептид, у присутності сполукикандидата в умовах, що стимулюють зв'язування з вказаним поліпептидом, і визначення кількості ліганду, зв'язаного з вказаним поліпептидом. Вважається, що сполука, яка сприяє зниженню рівня зв'язування з лігандом, є агоністом або антагоністом. При цьому, переважно, щоб вказаний ліганд був міченим. Більш конкретно, спосіб скринінгу на сполуку, що є агоністом або антагоністом поліпептиду, включає в себе стадії: (a) інкубування міченого ліганду з цілою клітиною, що експресує на своїй поверхні поліпептид відповідно до винаходу, або з клітинною мембраною, що містить поліпептид відповідно до винаходу; (b) вимірювання кількості міченого ліганду, зв'язаного з цілою клітиною або з клітинною мембраною: (c) додання сполуки-кандидата до суміші міченого ліганду і цілої клітини або клітинної мембрани стадії (а) і доведення цієї суміші до стану рівноваги: (d) вимірювання кількості міченого ліганду, зв'язаного з цілою клітиною або з клітинною мембраною, після проведення стадії (с); і (e) порівняння відмінності у кількостях зв'язаного міченого ліганду стадій (b) і id), де сполука, 93658 52 що викликає зниження рівня зв'язування у стадії id), вважається агоністом або антагоністом. Аналогічним чином, даний винахід стосується способу скринінгу на сполуку, яка є агоністом або антагоністом поліпептиду, що включає в себе стадії: (a) інкубування міченого ліганду з поліпептидом відповідно до винаходу, іммобілізованим на будь-якому твердому носії або на клітинній поверхні, або з клітинною мембраною, що містить поліпептид відповідно до винаходу; (b) вимірювання кількості міченого ліганду, зв'язаного з поліпептидом відповідно до винаходу, іммобілізованим на будь-якому твердому носії, або з цілою клітиною або з клітинною мембраною; (c) додання сполуки-кандидата до суміші міченого ліганду і поліпептиду, іммобілізованого на твердому носії, цілої клітини або клітинної мембрани стадії (а), і доведення цієї суміші до стану рівноваги: (d) вимірювання кількості міченого ліганду, зв'язаного з іммобілізованим поліпептидом, з цілою клітиною або з клітинною мембраною, після проведення стадії (с); і (e) порівняння відмінності у кількостях зв'язаного міченого ліганду стадій (b) і id), де сполука, що викликає зниження рівня зв'язування у стадії (d). вважається агоністом або антагоністом. Поліпептид INSP201 відповідно до винаходу може модулювати ріст і диференціювання клітин. Таким чином, біологічна активність поліпептиду INSP201 може бути оцінена у системах, які дозволяють проводити дослідження росту і диференціювання клітин, таких як системи для аналізу у культурі органу або системи для аналізу колоній клітин в агарозній культурі. Стимуляція або інгібування проліферації клітин можуть бути виміряні за допомогою різних аналізів. Так, наприклад, для оцінки інгібування росту клітин може бути використане тверде або рідке середовище. У твердому середовищі, клітини, ріст яких піддається інгібуванню, можуть бути відібрані з групи клітин індивідуума шляхом порівняння розмірів колоній, що утворюються ними. У рідкому середовищі, інгібування росту може бути скриноване шляхом вимірювання каламутності культурального середовища або включення міченого тимідину у ДНК. Звичайно, включення нуклеозидного аналога у щойно синтезовану ДНК може служити основою для вимірювання проліферації клітин (тобто, активного росту клітин) у даній популяції. Так, наприклад, як реагент для мічення ДНК може бути використаний бромдезоксіуридин (BrdU), а як детектуючий реагент можуть бути використані мишачі моноклональні антитіла проти BrdU. Це антитіло зв'язується тільки з клітинами, що містять ДНК. в яку був включений бромдезоксіуридин. У комбінації з цим аналізом можуть бути використані різні методи детектування, включаючи імунофлуоресцентні, імуногістохімічні. ELISA- і колориметричні методи. Набори, що включають бромдезоксіуридин (BrdU) і мишаче моноклональне антитіло проти BrdU, є комерційно доступними і постачаються фірмою Boehnnger Mannheim (Indianapolis, IN). 53 Вплив поліпептиду INSP201 на диференціювання клітин може бути оцінений за допомогою контактування стовбурових клітин або ембріональних клітин з різними кількостями поліпептиду INSP201 і оцінки такого впливу на диференціювання стовбурових клітин або ембріональних клітин. Для ідентифікації одержаних клітин можуть бути використані тканиноспецифічні антитіла і методи мікроскопії. Було виявлено, що поліпептид INSP201 може також модулювати дозозалежну проліферацію і диференціювання клітин імунної і/або нервової системи в описаних вище аналізах. Таким чином, термін "функціональні еквіваленти" поліпептиду INSP201 включає поліпептиди, які володіють будьякою з вказаних активностей дозозалежної регуляції росту і диференціювання клітин в описаних вище аналізах. Хоча ступінь дозозалежної активності необов'язково повинен бути ідентичний активності поліпептиду INSP201, однак, переважно, шоб вказані "функціональні еквіваленти" володіли, по суті, аналогічною дозозалежною активністю, виміряною у даному аналізі, у порівнянні з активністю поліпептиду INSP201. У деяких описаних вище варіантах даного винаходу можуть бути використані прості аналізи на зв'язування, в яких адгезію сполуки, що тестується, до поверхні, яка несе даний поліпептид, детектують за допомогою мітки, безпосередньо або опосередковано асоційованої зі сполукою, що тестується, або аналізи на конкуренцію з міченою сполукою-конкурентом. В іншому варіанті здійснення винаходу можуть бути використані конкурентні аналізи на скринінг лікарських засобів, в яких нейтралізуючі антитіла, здатні зв'язуватися з даним поліпептидом, специфічно конкурують за зв'язування зі сполукою, що тестується. Таким чином, вказані антитіла можуть бути використані для детектування на присутність будь-якої сполуки, що тестується, яка володіє специфічною афінністю зв'язування з вказаним поліпептидом. Можуть бути також розроблені аналізи для детектування впливу доданих сполук, що тестуються, на продукування мРНК, що кодує вказаний поліпептид, у клітинах. Так, наприклад, може бути розроблений такий аналіз ELISA, який дозволяє вимірювати секретовані або клітинно-асоційовані рівні поліпептиду з використанням моноклональних або поліклональних антитіл стандартними методами, відомими фахівцям, і такий аналіз може бути використаний для пошуку сполук, які можуть інгібувати або посилювати продукування поліпептиду з відповідним чином модифікованих клітин або тканин. Потім може бути визначений рівень утворення зв'язувальних комплексів між поліпептидом і сполукою, що тестується. Інший метод, який може бути використаний для скринінгу лікарських засобів, дозволяє здійснювати високоефективний скринінг сполук, що володіють відповідною афінністю зв'язування з поліпептидом, що представляє інтерес (див. Міжнародну патентну заявку WO 84/03564). У цьому методі велике число різних невеликих сполук, що тестуються, синтезують на твердому субстраті, який потім може бути підданий реакції з поліпеп 93658 54 тидом відповідно до винаходу і промиванню. Одним зі способів іммобілізації поліпептиду є використання не-нейтралізуючих антитіл. Зв'язаний поліпептид може бути потім детектований методами, добре відомими фахівцям. Очищений поліпептид також може бути безпосередньо нанесений на планшети для подальшого використання у зазначених вище способах скринінгу на лікарські засоби. Фахівцям відомі й інші методи такого типу. Див., наприклад, Adessi С. & Soto С. Curr. Med. Chem. 2002, 9(9):963-78; Strand F.L. Prog. Drug. Res., 2003 61:1-37; Hruby V.J. Nat. Rev. Drug. Discov. 2002, 1(11):847-58. Поліпептид відповідно до винаходу може бути використаний для ідентифікації мембранозв'язаних або розчинних рецепторів за допомогою стандартної техніки зв'язування з рецептором, відомої фахівцям, такої як аналізи на зв'язування і перехресне зв'язування з лігандом, в яких даний поліпептид мітять радіоактивним ізотопом, хімічно модифікують або приєднують до пептидної послідовності, яка полегшує його детектування або очищення, та інкубують з джерелом передбачуваного рецептора (наприклад, з композицією клітин, клітинними мембранами, клітинними супернатантами. тканинними екстрактами або з фізіологічними рідинами). Ефективність зв'язування може бути визначена біофізичними методами, такими як поверхневий плазмонний резонанс і спектроскопія. Аналізи на зв'язування можуть бути використані для очищення і клонування рецептора, але вони можуть бути також використані для ідентифікації агоністів і антагоністів вказаного поліпептиду, які конкурують з вказаним поліпептидом за зв'язування з рецептором Стандартні методи проведення скринінг-аналІзів добре відомі фахівцям. В іншому своєму варіанті даний винахід стосується застосування поліпептиду JNSP20I або його фрагмента, де вказаним фрагментом, переважно, с фрагмент, специфічний до гена TNSP201, з метою виділення або генерування агоніста або стимулятора поліпептиду INSP201 для лікування імуноасоційованого розладу, де вказаний агоніст або стимулятор вибраний з групи, що складається з: 1. специфічного антитіла або його фрагмента, включаючи: а) химерне, b) гуманізоване або с) повністю людське антитіло, а також 2 біспепифічного або мультиспецифічного антитіла, 3. одноланцюжкового антитіла (наприклад, scFv), або 4. однодоменного антитіла, або 5. пептидо- або не-пептидоміметика, що походить від вказаних антитіл, або 6. антитіло-міметика, такого як (а) антикалін або (b) зв'язувальна молекула на основі фібронектину (наприклад, тринектин або аднектин). Одержання пептидо- або не-пептидоміметиків з антитіл відоме фахівцям (Saragovi et al., 1991 і Saragovi et al., 1992). Антикаліни також відомі фахівцям (Vogt et al., 2004). Зв'язувальні молекули на основі фібронек 55 тину описані у патенті США № 6818418 і в WO 2004029224. Крім того, сполуками, що тестуються, можуть бути сполуки різного походження, природи і складу, такі як будь-які невеликі молекули, нуклеїнові кислоти, ліпіди, пептиди, поліпептиди, включаючи антитіла, такі як химерне, гуманізоване або повністю людське антитіло або його фрагмент, пептидоабо не-пептидоміметики, що походять від них, а також біспецифічні або мультиспецифічні антитіла, одноланцюжкові антитіла (наприклад, scFv), однодоменні антитіла, антитіла-міметики, такі як антикалін або зв'язувальна молекула на основі фібронектину (наприклад, тринектин або аднектин) і т.п., в ізольованій формі або у вигляді їх суміші або комбінацій. Даний винахід також стосується набору для скринінгу, що використовується у методах ідентифікації агоністів, антагоністів, лігандів, рецепторів, субстратів і ферментів, описаних вище. Даний винахід також стосується агоністів, aнтагоністів, лігандів, рецепторів, субстратів, ферментів та інших сполук, що модулюють активність або антигенність поліпептиду відповідно до винаходу згідно з описаними вище механізмами. Як вказувалося вище, припускається, що різні молекули відповідно до винаходу (тобто, поліпептиди відповідно до першого аспекту даного винаходу, молекула нуклеїнової кислоти відповідно до другого або третього аспектів даного винаходу, вектор відповідно до четвертого аспекту даного винаходу, клітина-хазяїн відповідно до п'ятого аспекту даного винаходу, ліганд відповідно до шостого аспекту даного винаходу, і сполука відповідно до сьомого аспекту даного винаходу можуть бути використані для лікування або діагностики захворювань. З метою оцінки ефективності вказаних молекул відповідно до винаходу для лікування або діагностики захворювання можуть бути проведені один або декілька з описаних нижче аналізів. Потрібно зазначити, що хоча деякі з наведених нижче аналізів описані для сполук, що тестуються, які є білком/поліпептидом, однак, фахівець у даній галузі може легко модифікувати ці аналізи для їх застосування до інших молекул відповідно до винаходу, які також можуть бути використані як "сполуки, що тестуються". Даний винахід також стосується фармацевтичних композицій, що містять поліпептид, нуклеїнову кислоту, ліганд або сполуку відповідно до винаходу у комбінації з придатним фармацевтичним носієм. Ці композиції можуть бути використані як терапевтичні або діагностичні реагенти, як вакцини або як інші імуногенні композиції, детально описані нижче. Відповідно до використовуваної тут термінології, композиція, що містить поліпептид, нуклеїнову кислоту, ліганд або сполуку [X], вважається такою, що "в основному не містить" домішок [тут, Y]. якщо, принаймні, 85 мас.% від всієї кількості X+Y у даній композиції складає X. Переважно, X складає, принаймні, приблизно, 90%, а більш переважно, принаймні, приблизно, 95%, 98% або навіть 99% мас. за загальною масою X+Y у даній композиції. 93658 56 Переважно, фармацевтичні композиції повинні містити терапевтично ефективну кількість поліпептиду, молекули нуклеїнової кислоти, ліганду або сполуки відповідно до винаходу. Використовуваний тут термін "терапевтично ефективна кількість" означає кількість терапевтичного агента, необхідного для лікування, ослаблення або попередження захворювання або стану, що розглядається, або для досягнення терапевтичного або профілактичного ефекту, що детектується. Для кожної сполуки терапевтично ефективна доза може бути спочатку оцінена або в аналізі клітинної культури, наприклад, пухлинних клітин, або на тваринах-моделях. звичайно на мишах, кроликах, собаках або свинях. З використанням тварини-моделі може бути також визначений відповідний інтервал концентрацій і їх спосіб введення Одержана інформація може бути потім використана для визначення придатних доз і способів їх введення людині. Точна ефективна кількість сполуки для введення індивідууму буде залежати від тяжкості патологічного стану, загального стану здоров'я індивідуума, його віку ваги, статi і режиму харчування, від часу і частоти введення лікарського засобу, від комбінаиії(й) лікарських засобів, а також від реактивної чутливості з толерантності/сприйнятливості даного індивідуума до терапії, що проводиться. Така кількість може бути визначена шляхом рутинного експериментування і може бути встановлена лікарем-клініцистом. У загальних рисах, ефективна доза може складати від 0,01 мг/кг до 50 мг/кг, а переважно, від 0,05 мг/кг до 10 мг/кг. Композиції можуть бути введені пацієнту або окремо, або у комбінації з іншими агентами, лікарськими засобами або гормонами. Фармацевтична композиція може також містити фармацевтично прийнятний носій, придатний для введення терапевтичного агента. Такими носіями є антитіла та інші поліпептиди, гени та інші терапевтичні агенти, такі як ліпосоми, за умови, що даний носій сам по собі не індукує вироблення антитіл, які здійснюють негативний вплив на індивідуума, якому вводять вказану композицію, і не є надмірно токсичним. Придатними носіями можуть бути великі макромолекули з уповільненим метаболізмом, такі як білки, полісахариди, полімолочні кислоти, полігліколеві кислоти, полімерні амінокислоти, співполімери амінокислот і неактивні вірусні частинки. Використовуваними тут фармацевтично прийнятними солями можуть бути, наприклад, солі мінеральних кислот, такі як гідрохлориди. гідроброміди. фосфати, сульфати і т.п., і солі органічних кислот, такі як ацетати, пропіонати. малонати. бензоати і т.п. Докладне обговорення фармацевтично прийнятних носіїв можна знайти у Remington's Pharmaceutical Sciences (Mack Pub. Co., N.J. 1991). Фармацевтично прийнятні носії у терапевтичних композиціях можуть, крім того, містити рідини, такі як вода, фізіологічний розчин, гліцерин і етанол. Крім того, у вказаних композиціях можуть бути присутніми і допоміжні речовини, такі як змочувальні або емульгувальні агенти, рН-забуферюючі речовини і т.п. За допомогою таких носіїв можуть бути одержані фармацевтичні композиції у вигляді 57 таблеток, пілюль, драже, капсул, рідин, гелів, сиропів, зависей, суспензій і т.п. для перорального прийому пацієнтом. Композиції відповідно до винаходу, після їх приготування, можуть бути безпосередньо введені індивідууму. Індивідуумами, які піддаються лікуванню, можуть бути тварини, а зокрема, людина. Фармацевтичні композиції, що використовуються у даному винаході, можуть бути введені різними способами, включаючи, але не обмежуючись ними, пероральне, внутрішньовенне, внутрішньом'язове, внутрішньоартеріальне, інтрамедулярне, інтратекальне, інтравентрикулярне, трансдермальне або черезшкірне введення (див., наприклад, WO 98/20734), a також підшкірне, внутрішньочеревинне, інтраназальне, внутрішньокишкове, місцеве, під'язикове, інтравагінальне або ректальне введення. Для введення фармацевтичних композицій відповідно до винаходу можуть бути також використані апарати для "вистрілювання" генів або безголкові шприци. В основному, терапевтичні композиції можуть бути приготовані у вигляді розчинів для ін'єкцій, або рідких розчинів, або суспензій, або вони можуть бути одержані у вигляді твердих форм, придатних для одержання розчинів або суспензій у рідких носіях перед їх ін'єкцією. Вказані композиції можуть бути безпосередньо доставлені, в основному, шляхом підшкірної. внутрішньочеревинної, внутрішньовенної або внутрішньом'язової ін'єкції, або вони можуть бути доставлені в інтерстиціальний простір тканини. Ці композиції можуть бути також введені в уражену ділянку. При цьому, лікування може бути проведене за схемою введення разової дози або дробних доз. Якщо активність поліпептиду відповідно до винаходу перевищує активність, необхідну для лікування конкретного патологічного стану, то у цьому випадку може бути розглянуто декілька підходів. Один з таких підходів передбачає введення індивідууму описаної вище сполуки-інгібітору (антагоніста) разом з фармацевтично прийнятним носієм, де вказаний інгібітор вводять у кількості, ефективній для інгібування функції поліпептиду, наприклад, блокування зв'язування з лігандами, субстратами, ферментами або рецепторами, або для інгібування повторного сигналу, і. тим самим, ефективній для ослаблення симптомів аномального стану. Такими антагоністами, переважно, є антитіла. Для мінімізації імуногенності антитіл, описаних вище, найбільш переважно, шоб такі антитіла були химерними і/або гуманізованими. Відповідно до іншого підходу можуть бути введені розчинні форми поліпептидів, які зберігають афінність зв'язування з лігандом, субстратом, ферментом або рецептором, що розглядаються. В основному, такий поліпептид може бути введений у вигляді фрагментів, в яких зберігаються релевантні частини. В альтернативному підході, експресія гена, що кодує даний поліпептид, може бути інгібована методами блокування експресії, такими як використання молекул антисмислової нуклеїнової кислоти (описаних вище), які можуть бути генеровані ендо 93658 58 генно або введені окремо. Модифікації експресії генів можуть бути одержані шляхом конструювання комплементарних послідовностей або антисмислових молекул (ДНК, РНК або PNA) для здійснення регуляції, 5'-областейабо регуляторних областей (сигнальної послідовності, промоторів, енхансерів та інтронів; гена, що кодує даний поліпептид. Аналогічним чином, таке інгібування може бути здійснене з використанням методики спарювання основ з утворенням "потрійної спіралі". Спарювання з утворенням потрійної спіралі використовується тому, що воно приводить до порушення здатності подвійної спіралі розкриватися так, щоб це виявилося достатнім для зв'язування з полімеразами, факторами транскрипції або регуляторними молекулами. Успіхи у клінічній терапії, досягнуті останнім часом завдяки використанню ДНКтриплексу, були описані у літературі (Gee J.E. et al. (1994): Huber B.E. & В.І, Carr. Molecular and Immunologic Approaches. Futura Publishing Co., Mt. Kisco, NY). Комплементарна послідовність або антисмислова молекула можуть бути також сконструйовані з метою блокування трансляції мРНК за допомогою запобігання зв'язуванню транскрипту з рибосомами. Такі олігонуклеотиди можуть бути введені або генеровані in situ внаслідок експресії in vivo. Крім того, експресії поліпептиду відповідно до винаходу можна запобігти з використанням рибозимів, специфічних до мРНК-послідовності, що кодує цей поліпептид. Рибозими являють собою каталітично активні РНК, які можуть бути природними або синтетичними (див. наприклад, Usman N. et al., Curr. Opin. Struct. Biol. (1996) 6(4), 527-33). Синтетичні рибозими можуть бути сконструйовані так, щоб вони специфічно розщеплювали мРНК у вибраних положеннях і, тим самим, запобігали трансляції мРНК у функціональний поліпептид. Рибозими можуть бути синтезовані з використанням природного рибозофосфатного кістяка і природних основ, звичайно присутніх у РНКмолекулах. Альтернативно, рибозими можуть бути синтезовані з використанням неприродних кістяків, наприклад, 2'-О-метил-РНК, з метою захисту від розщеплення рибонуклеазою, і ці рибозими можуть містити модифіковані основи. Молекули РНК можуть бути модифіковані з метою збільшення внутрішньоклітинної стабільності і часу напівжиття. Можливими модифікаціями є, але не обмежуються ними, приєднання фланкуючих послідовностей біля 5'- і/або біля 3'-кінців даної молекули або використання у вказаному кістяку молекули фосфортіоату або 2'-О-метилу замість фосфодіестеразних зв'язків. Ця концепція може розглядатися і при продукуванні PNA і може бути застосована до всіх вказаних молекул за допомогою включення нетрадиційних основ, таких як інозин, квеозин і бутозин, а також ацетил-, метил-, тіо- і аналогічні модифіковані форми аденіну, цитидину, гуаніну, тиміну і уридину, які не можуть легко розпізнаватися ендогенними ендонуклеазами. Для лікування аномальних станів, асоційованих з недостатньою експресією поліпептиду відповідно до винаходу і його активністю, є декілька 59 способів. Один з таких способів передбачає введення індивідууму терапевтично ефективної кількості сполуки, яка активує вказаний поліпептид, тобто, сполуки-агоніста, описаної вище, з метою ослаблення симптомів патологічного стану. Альтернативно, терапевтична кількість вказаного поліпептиду у комбінації з придатним фармацевтичним носієм може бути введена з метою збереження відповідної фізіологічної рівноваги даного поліпептиду. Для здійснення ендогенного продукування даного поліпептиду відповідними клітинами індивідуума може бути застосована генотерапія. Генотерапію використовують для перманентного лікування захворювань, пов'язаних з аномальним продукуванням даного поліпептиду, шляхом заміни дефектного гена "правильним" терапевтичним геном. Генотерапія відповідно до винаходу може бути здійснена in vivo або ex vivo. Для генотерапії ex vivo потрібне виділення і очищення клітин, взятих у пацієнта, введення терапевтичного гена і введення генетично модифікованих клітин назад пацієнту. На противагу цьому, генотерапія in vivo не потребує виділення і очищення клітин пацієнтів. Для введення пацієнту звичайно використовують "упакований" терапевтичний ген. Носії для доставки генів можуть бути невірусними, такими як ліпосоми, або вони можуть являти собою дефектні за реплікацією віруси, такі як аденовірус, описаний Berkner K.L., Curr. Top. Microbiol. Immunol., 158, 3966 (1992), або вектори на основі аденоасоційованого вірусу (AAV), описані Muzyczka N. Curr. Top. Microbiol. Immunol., 158, 97-129 (1992) і у патенті США № 5252479. Так, наприклад, молекула нуклеїнової кислоти, що кодує поліпептид відповідно до винаходу, може бути сконструйована для експресії у дефектному за реплікацією ретровірусному векторі. Потім ця експресійна конструкція може бути виділена і введена у клітину, що упаковує, трансдуковану ретровірусним плазмідним вектором, що містить РНК, яка кодує вказаний поліпептид, так, шоб вказана клітина, що упаковує, продукувала інфекційні вірусні частинки, що містять потрібний ген. Ці клітини-продуценти можуть бути введені індивідууму для конструювання клітин in vivo та експресії поліпептиду in vivo (див. Chapter 20 Gene Therapy and other Molecular Genetic-based Therapeutic Approaches (і посилання, що цитуються там), Human Molecular Genetics (1996), Т. Strachan & A.P.Read. BIOS Scientific Publishers Ltd). Іншим способом є введення "оголеної ДНК", де терапевтичний ген безпосередньо Ін*єктують у кровотік або у м'язову тканину. У випадку, коли поліпептидами або молекулами нуклеїнової кислоти відповідно до винаходу є агенти, що викликають захворювання, даний винахід стосується способу їх використання з метою одержання вакцин для вироблення антитіл проти вказаного агента, що викликає захворювання. Вакцини відповідно до винаходу можуть бути або профілактичними (тобто, призначеними для попередження інфекції), або терапевтичними (тобто, призначеними для лікування захворювань піс 93658 60 ля інфікування). Такі вакцини містять імунізуючий(і) антиген(и), імуноген(и), поліпептид(и), білок(ки) або нуклеїнову кислоту, звичайно у комбінації з описаними вище фармацевтично прийнятними носіями, де вказаним носієм може бути будь-який носій, який сам по собі не індукує вироблення антитіл, що здійснюють негативний вплив на індивідуума, якому вводять вказану композицію. Крім того, ці носії можуть діяти як імуностимулятори ("ад'юванти"). Більш того, антиген або імуноген може бути кон'югований з бактеріальним токсоїдом, таким як токсоїд дифтерії, правця, холери, Н. pylori та інші патогени. Оскільки поліпептиди можуть розкладатися у шлунку, то вакцини, що містять поліпептиди, переважно, вводять парентерально (наприклад, шляхом підшкірної, внутрішньом'язової, внутрішньовенної або черезшкірної ін'єкції). Композиціями, придатними для парентерального введення, є водні і безводні стерильні розчини для ін'єкцій, які можуть містити антиоксиданти, буфери, бактеріостати і розчинені речовини, які надають даній композиції ізотонічність з кров'ю реципієнта, а також водні і безводні стерильні суспензії, які можуть містити суспендуючі агенти або загусники. Вакцинні композиції відповідно до винаходу можуть бути вмішені у ємності для разових лікарських форм або для дробних лікарських форм. Так, наприклад, ці лікарські форми можуть бути вміщені у запаяні ампули і посудини і можуть зберігатися у замороженому вигляді, в які, безпосередньо перед їх використанням, необхідно додати лише стерильний рідкий носій. Конкретна доза буде залежати від питомої активності даної вакцини і може бути легко визначена шляхом рутинного експериментування. Генетична доставка антитіл, що зв'язуються з поліпептидами відповідно до винаходу, може бути здійснена, наприклад, як описано у Міжнародній патентній заявці WO 98/55607. Для одержання вакцинних композицій може бути також використана технологія безголкового упорскування (див., наприклад, www.powderject.com). Ряд придатних методів вакцинації і систем для доставки вакцин описані у Міжнародній патентній заявці W0 00/29428. Даний винахід також стосується використання молекул нуклеїнової кислоти відповідно до винаходу як діагностичних реагентів. Детектування мутованої форми гена, що являє собою молекули нуклеїнової кислоти відповідно до винаходу, які асоціюються з дисфункцією, застосовується як діагностичний засіб, який може полегшувати встановлення діагнозу захворювання або сприйнятливості до захворювання, що виникає внаслідок зниженої експресії, надекспресії або зміненої просторової або часової експресії даного гена. Індивідууми, які несуть мутації у даному гені, можуть бути ідентифіковані на ДНК-рівні різними методами. Молекули нуклеїнової кислоти, що використовуються для діагностики, можуть бути одержані з клітин даного індивідуума, таких як клітини крові, сечовини, слини, біоптату тканини або матеріалу,
ДивитисяДодаткова інформація
Назва патенту англійськоюCell surface glycoprotein
Автори англійськоюFitzgerald Stephen, Fagan Richard, Bienkowska Jadwiga, Power Christine, Yorke-Smith Melanie
Назва патенту російськоюГликопротеин клеточной поверхности
Автори російськоюФитцджералд Стефен, Фаган Ричард, Бенковска Ядвига, Пауэр Кристин, Йорке-Смит Мелани
МПК / Мітки
МПК: C07K 14/435
Мітки: поверхні, клітинної, глікопротеїн
Код посилання
<a href="https://ua.patents.su/81-93658-glikoproten-klitinno-poverkhni.html" target="_blank" rel="follow" title="База патентів України">Глікопротеїн клітинної поверхні</a>
Попередній патент: Кодовий замок денисова-пухового
Наступний патент: Харчовий продукт, який містить свіжі плоди
Випадковий патент: Відновлення оксиду заліза до металевого заліза з застосуванням природного газу