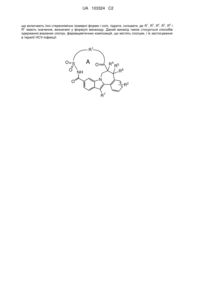
Макроциклічні похідні індолу, придатні як інгібітори вірусу гепатиту с
Номер патенту: 103324
Опубліковано: 10.10.2013
Автори: Лін Це-І, Рабуассон П'єр Жан-Марі Бернар, Вендевілль Сандрін Марі Елен, Тахрі Абделла, Амссомс Кеті Інгрід Едуард
Формула / Реферат
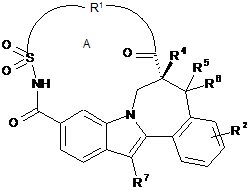
1. Сполука формули (І)
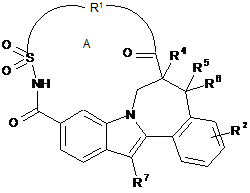 , (I)
, (I)
включаючи її стереохімічно ізомерні форми і N-оксиди, солі, гідрати й сольвати, де:
R1 означає двовалентний ланцюг, вибраний з:
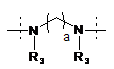 ,
,
 ,
,
 ,
,
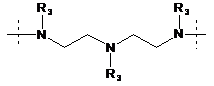 ,
,
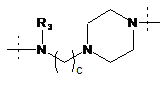 ,
,
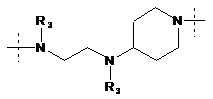 ,
,
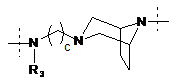
i
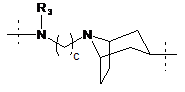 ;
;
кожна група R3 незалежно вибрана з групи, що складається з водню, С1-4алкілу й С3-5циклоалкілу;
а дорівнює 3, 4, 5 або 6;
кожен b незалежно дорівнює 1 або 2;
с дорівнює 1 або 2;
макроцикл А містить від 14 до 18 атомів у циклі, зокрема макроцикл А має 17 або 18 атомів у циклі;
кожна група R2 незалежно означає водень, галоген або С1-4алкокси;
групи R4 і R5 означають водень, або R4 і R5 разом утворюють подвійний зв'язок або метиленову групу з утворенням конденсованого циклопропілу;
R6 є воднем або метилом; і
R7 означає С3-7циклоалкіл, необов'язково заміщений галогеном.
2. Сполука за п. 1, де
R1 вибирають з -N(R3)-(CH2)4-N(R3)-, ![]() ,
,
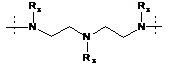 та
та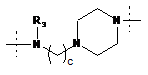 ,
,
кожна група R3 незалежно вибрана з водню й метилу.
3. Сполука за будь-яким з пп. 1 або 2, де R2 розташований в пара-положенні бензольної групи відносно зв'язку, який сполучає вказаний бензол з індольною групою.
4. Сполука за будь-яким з пунктів від 1 до 3, де R2 вибирають з фтору й метокси.
5. Сполука за будь-яким з пунктів від 1 до 4, де R7 вибирають з циклогексилу й 2-фторциклогексилу.
6. Сполука за будь-яким з пунктів від 1 до 5, де R4 і R5 разом утворюють подвійний зв'язок.
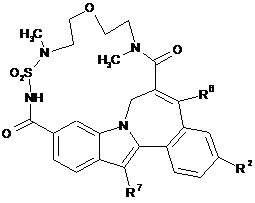
7. Сполука за будь-яким з пунктів від 1 до 5, де сполука формули (І) має стереохімічну конфігурацію, як представлено формулою (ІА)
 (ІА).
(ІА).
8. Сполука за будь-яким з пунктів від 1 до 3, що вибрана з групи сполук структурних формул ІІ-1, II-2, ІІ-3, III-1, ІII-2, ІІІ-3, ІII-4, IV-1, IV-2 або IV-3
 (II-1),
(II-1), 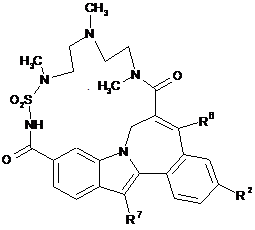 (II-2),
(II-2),
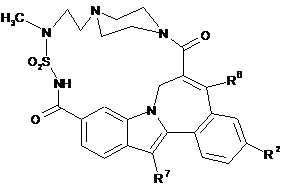 (II-3),
(II-3), 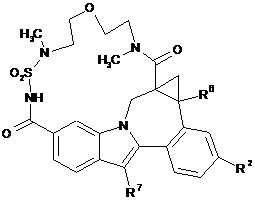 (III-1),
(III-1),
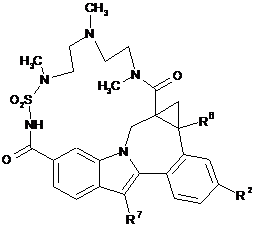 (III-2),
(III-2), 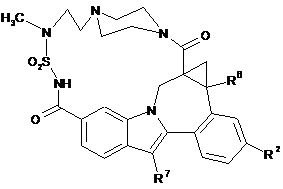 (III-3),
(III-3),
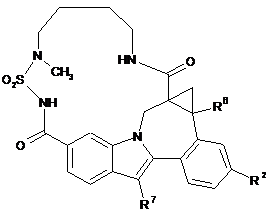 (III-4),
(III-4), 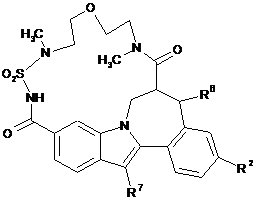 (IV-1),
(IV-1),
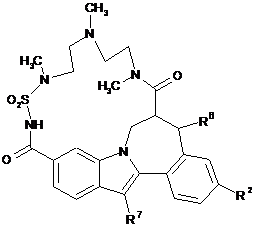 (IV-2),
(IV-2), 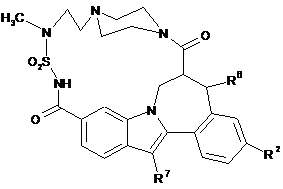 (IV-3).
(IV-3).
9. Фармацевтична композиція, що містить носій і, як активний інгредієнт, сполуку, як заявлено в будь-якому з пунктів від 1 до 8, в ефективній проти вірусу кількості.
10. Фармацевтична композиція за п. 9, що також містить щонайменше одну іншу сполуку, яка виявляє ефективність проти HCV.
11. Фармацевтична композиція за п. 9 або 10, що також містить щонайменше одну сполуку, яка виявляє ефективність проти HCV.
12. Сполука за будь-яким з пунктів від 1 до 8 або фармацевтична композиція за будь-яким з пунктів від 9 до 11 для використання як лікарського засобу.
13. Сполука за будь-яким з пунктів від 1 до 8 або фармацевтична композиція за будь-яким з пунктів від 9 до 11 для інгібування реплікації HCV.
14. Застосування сполуки за будь-яким з пунктів від 1 до 8 для виробництва лікарського засобу для інгібування реплікації HCV.
Текст
Реферат: Даний винахід стосується інгібіторів реплікації HCV формули (І) R1 O O O A S O R NH 4 R 5 R 6 N R R 2 7 , (I) UA 103324 C2 (12) UA 103324 C2 1 2 4 5 6 що включають їхні стереохімічно ізомерні форми і солі, гідрати, сольвати, де R , R , R , R , R і 7 R мають значення, визначені у формулі винаходу. Даний винахід також стосується способів одержання вказаних сполук, фармацевтичних композицій, що містять сполуки, і їх застосування в терапії HCV-інфекції. R1 O S O NH O A R4 R5 O R6 N R2 R7 UA 103324 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь винаходу Даний винахід стосується макроциклічних похідних індолу, що чинять інгібіторну дію на реплікацію вірусу гепатиту С (HCV). Винахід також стосується композицій, що містять вказані сполуки як активні інгредієнти, а також способів одержання вказаних сполук і композицій. Попередній рівень техніки в даній галузі Вірус гепатиту С є основною причиною хронічного захворювання печінки, поширеного по всьому світу, й стає центром уваги більшості медичних досліджень. HCV є членом сімейства вірусів Flaviviridae роду hepacivirus і тісно пов'язаний з родом flavivirus, який включає ряд вірусів, причетних до хвороби людини, таких як вірус денге і вірус жовтої лихоманки, і з сімейством вірусів тварин pestivirus, яке включає вірус діареї великої рогатої худоби (BVDV). Геном вірусу HCV представлений позитивно-смисловою одноланцюговою лінійною РНК, що містить близько 9600 основ. Геном включає як 5'-, так і 3'- нетрансльовані області, які приймають вторинні структури РНК, і центральну відкриту рамку зчитування, яка несе інформацію про єдиний поліпротеїн, розміром близько 3010-3030 амінокислотних залишків. Поліпротеїн розділяється на десять генних продуктів, які утворюються з поліпротеїну-попередника за допомогою організованої серії співі посттрансляційних ендопротеолітичних розщеплювань, опосередкованих як хазяйськими, так і вірусними протеазами. Структурні білки вірусів включають ядерний нуклеокапсидний білок і два глікопротеїни вірусної оболонки Е1 і Е2. Ділянки РНК HCV, що кодують неструктурні (NS) білки з декількома істотними для вірусу ферментативними функціями (хеліказа, полімераза, протеаза), також кодують білки з невідомою функцією. Реплікація вірусного геному опосередковується РНК-залежною РНКполімеразою, інформацію про яку несе ділянка неструктурного білка РНК 5b (NS5B). На додаток до полімерази, функції хелікази й протеази, обумовлені біфункціональним білком, кодованим ділянкою NS3, як показано, є істотними для реплікації РНК вірусу HCV. Окрім серинової протеази, кодованої ділянкою NS3, HCV також кодує металопротеїназу в області NS2. Реплікація HCV переважно відбувається в гепатоцитах, але не є безпосередньо цитопатичною, приводячи до стабільної інфекції. Зокрема, виявилося, що брак сильної відповідної реакції Т-лімфоцитів і велика схильність вірусу до мутації стимулюють високу частоту хронічної інфекції. Існує 6 основних генотипів HCV і більше 50 підтипів, які географічно розподілені різним чином. HCV типу 1 є домінуючим генотипом у США і Європі. Наприклад, HCV типу 1 налічує від 70 до 75 відсотків усіх HCV інфекцій у Сполучених Штатах. Велика генетична гетерогенність HCV має важливі діагностичні й клінічні наслідки, можливо, пояснюючи труднощі в розробці вакцин і недостатню відповідну реакцію на лікування. Як оцінюється, 170 мільйонів осіб у всьому світі інфіковано вірусом гепатиту С (HCV). Після появи первинної гострої інфекції, в більшості інфікованих індивідуумів розвивається хронічний гепатит, який може перейти у фіброз печінки, що призводить до цирозу, кінцевої стадії захворювання печінки, і HCC (гепатоклітинна карцинома) (National Institutes of Health Consensus Development Conference Statement: Management of Hepatitis C. Hepatology, 36, 5 Suppl. S3-S20, 2002). Цироз печінки, що виникає унаслідок інфекції HCV, призводить приблизно до 10000 смертей на рік лише в США і є основною причиною для трансплантації печінки. Передача HCV може відбуватися за рахунок контакту із зараженою кров'ю і продуктами крові, наприклад після переливання крові або внутрішньовенного введення лікарських засобів. Включення діагностичних тестів, використовуваних при скринінгу крові, привело до зниження випадків поширення інфекції HCV після переливання крові. Проте, зважаючи на повільне прогресування захворювання печінки до кінцевої стадії захворювання, існуючі інфекції продовжуватимуть ще протягом десятиліть бути серйозною медичною й економічною проблемою (Kim, W.R. Hepatology, 36, 5 Suppl. S30-S34, 2002). Терапія, що існує в даний час, заснована на (пегільованому) інтерфероні-альфа (IFN- (α) у комбінації з рибавірином. Така комбінована терапія приводить до стійкої вірологічної відповіді більш ніж у 40 % хворих, інфікованих вірусами генотипу 1, і приблизно у 80 % хворих, інфікованих генотипами 2 і 3. Окрім обмеженої дії на HCV типу 1, комбінована терапія має значні побічні дії й погано переноситься більшістю пацієнтів. Наприклад, у зареєстрованих дослідженнях з використанням пегільованого інтерферону й рибавірину, помітні побічні дії приводили до призупинення лікування в приблизно 10-14 % хворих. Основні побічні ефекти комбінованої терапії включають симптоми подібного до грипу захворювання, гематологічні порушення й нейропсихіатричні симптоми. Розробка ефективнішого, зручнішого й легшого до перенесення лікування є головним завданням суспільної охорони здоров'я. Таким чином, лікування такого хронічного захворювання є незадоволеною клінічною потребою, оскільки існуюча терапія лише частково ефективна й обмежена небажаними побічними ефектами. Однією ділянкою особливого інтересу був пошук інгібіторів NS5b РНК-залежної для РНК 1 UA 103324 C2 5 10 15 20 25 полімерази (RdRp). Близькі структурні гомологи даної полімерази не існують в неінфікованій клітині хазяїна, й виявлення інгібіторів вказаної вище полімерази представить більш специфічний тип дії. Інгібітори, які розглядаються в даний час, можуть бути класифіковані або як нуклеозидні інгібітори (NI), або як ненуклеозидні інгібітори (NNI). NI безпосередньо конкурують з нуклеотидними субстратами за зв'язування з високо консервативними активними ділянками. Більшої специфічності можна досягти інгібіторами NNI, які можуть взаємодіяти зовні високо консервативної активної ділянки біля унікальної алостеричної ділянки, властивої лише структурно родинним полімеразам. Похідні індолу були описані відносно інгібіторної активності проти HCV. Міжнародна публікація WO 2007/092000 описує тетрациклічні похідні індолу як інгібітори HCV NS5B для лікування і/або запобігання інфікуванню вірусом HCV. Патент США 2008/0146537 описує конденсовані з циклопропілом індолобензазепінові інгібітори HCV NS5B. Міжнародна публікація WO 2008/075103 описує макроциклічні похідні індолу, придатні для лікування або запобігання інфекції вірусом гепатиту С. В даний час, попередні клінічні випробування зазнали багато невдач, тим самим, висуваючи на перший план необхідність продовжити пошук нових інгібіторів NS5b. Досі існує висока медична потреба в безпечній і ефективній терапії, спрямованій проти вірусу HCV. Такі інгібітори HCV можуть подолати недоліки існуючої терапії інфекції HCV, такі як побічні ефекти, обмежена ефективність, поява стійкості й порушення дотримання режиму терапії, а також поліпшити стійку вірусологічну відповідь. Зокрема, у випадках, де терапевтичні сполуки мають відповідну біодоступність і сприятливий фармакокінетичний і метаболічний профіль. Сутність винаходу Було виявлено, що деякі макроциклічні похідні індолу проявляють противірусну активність у суб'єктів, інфікованих вірусом HCV, з придатними властивостями відносно одного або більше наступних параметрів: противірусна ефективність, сприятливий мутантний профіль, відсутність токсичності, сприятливий фармакокінетичний і метаболічний профіль і легкість приготування й уведення. Отже, вказані сполуки придатні в лікуванні або боротьбі з інфекціями HCV. Даний винахід відноситься до інгібіторів реплікації HCV, які можуть бути представлені формулою (I): 30 R1 O S O NH A R4 R5 O R6 N O R2 R7 , (I) включаючи їхні стереохімічні ізомерні форми і N-оксиди, солі, гідрати й сольвати, де: 1 - R означає двовалентний ланцюг, вибраний з N 35 a N 3 R3 R , R3 N N b b R3 , R3 N 3 O 3 R N N R3 R N , R3 N , 2 UA 103324 C2 R3 N N N c , R3 N N N R3 , N N c N R3 , та R3 N N c 5 N - кожна група R3 незалежно вибрана з групи, що складається з водню, C 1-4алкілу і С3 5циклоалкілу; 10 15 20 25 30 35 40 - а дорівнює 3, 4, 5 або 6; - кожен b незалежно дорівнює 1 або 2; - с дорівнює 1 або 2; - макроцикл А містить від 14 до 18 атомів у циклі; 2 - кожна група R незалежно означає водень, галоген або С1-4алкокси; 4 5 4 5 - групи R і R означають водень, або R і R разом утворюють подвійний зв'язок або метиленову групу з утворенням конденсованого циклопропілу; 6 - R означає водень або метил; і 7 - R означає С3-7циклоалкіл, необов'язково заміщений галогеном. Винахід також відноситься до способів одержання сполук формули (I), включаючи їхні стереохімічні ізомерні форми і N-оксиди, четвертинні аміни, комплекси з металами, солі, гідрати й сольвати, їхні проміжні сполуки й застосування проміжних сполук у одержанні сполук формули (I). Винахід відноситься до сполук формули (I) як таких, включаючи їхні стереохімічні ізомерні форми і N-оксиди, четвертинні аміни, комплекси з металами, солі, гідрати або сольвати, для їх використання як ліків. Винахід відноситься до сполук формули (I) як таких, включаючи їхні стереохімічні ізомерні форми і N-оксиди, четвертинні аміни, комплекси з металами, солі, гідрати або сольвати, для лікування гепатиту С. Винахід також відноситься до фармацевтичних композицій, що містять носій і ефективну проти вірусів кількість сполуки формули (I), як указано в описі. Фармацевтичні композиції можуть містити комбінації згаданих вище сполук з іншими засобами, направленими проти вірусу HCV. Фармацевтичні композиції можуть містити комбінації згаданих вище сполук із засобами проти вірусу HCV. Винахід також відноситься до вказаних вище фармацевтичних композицій для введення суб'єктові, що страждає на інфекцію HCV. Винахід також відноситься до застосування сполуки формули (I), включаючи її стереохімічні ізомерні форми й N-оксиди, четвертинні аміни, комплекси з металами, солі, гідрати або сольвати, для виробництва лікарського засобу з метою інгібування реплікації HCV. Винахід також відноситься до застосування сполуки формули (I), включаючи її стереохімічні ізомерні форми й N-оксиди, четвертинні аміни, комплекси з металами, солі, гідрати або сольвати, для виробництва лікарського засобу з метою запобігання або лікування станів, асоційованих з HCV. Винахід також відноситься до способу інгібування реплікації вірусу HCV у теплокровних тварин, указаний спосіб включає введення ефективної кількості сполуки формули (I), включаючи її стереохімічні ізомерні форми й N-оксиди, четвертинні аміни, комплекси з металами, солі, гідрати або сольвати. Винахід також відноситься до способу запобігання або лікування станів, що асоціюються з HCV, у теплокровних тварин, вказаний спосіб включає введення ефективної кількості сполуки формули (I), включаючи її стереохімічні ізомерні форми і N-оксиди, четвертинні аміни, комплекси з металами, солі, гідрати або сольвати. Детальний опис винаходу 3 UA 103324 C2 5 10 15 20 25 30 35 40 45 50 55 Далі буде описано даний винахід. У наступних параграфах, різні аспекти або варіанти здійснення винаходу визначені в деталях. Кожен аспект або варіант здійснення винаходу, визначений таким чином, може бути об'єднаний з будь-яким іншим аспектом(ами) або варіантом(ами) здійснення винаходу, якщо чітко не зазначене інше. Зокрема, будь-яка властивість, вказана як переважна або сприятлива, може бути комбінована з будь-якою іншою властивістю або властивостями, зазначеними як переважні або сприятливі, для розробки окремого випадку здійснення винаходу. Як вживають в описі вище й нижче, наступні визначення використовують, якщо не вказане інше. В описі даного винаходу терміни "суб'єкт" або "інфікований суб'єкт" або "хворий" стосуються індивідуума, інфікованого вірусом HCV, за необхідності лікування. Термін "галоїд" або "галоген" є узагальненим для фтору, хлору, брому і йоду. Як застосовують в описі, "С1-4алкіл" як група або частина групи означає насичені вуглеводневі радикали з прямим або розгалуженим ланцюгом, що містять від 1 до 4 атомів вуглецю, такі як, наприклад, метил, етил, проп-1-іл, проп-2-іл, бут-1-ил, бут-2-ил, ізобутил, 2метилпроп-1-іл; "С1-3алкіл" як група або частина групи означає насичені вуглеводневі радикали з прямим або розгалуженим ланцюгом, що містять від 1 до 3 атомів вуглецю, такі як, наприклад, метил, етил, проп-1-іл, проп-2-іл. Термін "С1-6алкілен" як група або частина групи стосується С 1-6алкільних груп, які є двовалентними, тобто з двома простими ланцюгами для приєднання до двох інших груп. Необмежуючі приклади алкіленових груп включають метилен, етилен, метилметилен, пропілен, етилетилен, 1-метилетилен і 1,2-диметилетилен. Термін "С3-7циклоалкіл" є узагальненим для циклопропілу, циклобутилу, циклопентилу, циклогексилу й циклогептилу. Термін "С 3-5циклоалкіл" може охоплювати циклопропіл, циклобутил і циклопентил. Термін "С1-4алкокси" або "С1-4алкілокси" як група або частина групи відноситься до радикала a a формули –OR , де R є С1-4алкілом, як визначено вище. Необмежуючі приклади відповідної С 14алкоксигрупи включають метокси, етокси, пропокси, ізопропокси, бутокси, ізобутокси, секбутокси і трет-бутокси. Слід зазначити, що положення радикала на будь-якому фрагменті молекули, використовуваному у визначеннях, можуть бути де-небудь на такому фрагменті, оскільки він є хімічно стійким. Радикали, використовувані у визначеннях змінних, включають усі можливі ізомери, якщо не вказане інше. Наприклад, піперидиніл включає піперидин-1-іл, піперидин-2-іл, піперидин-3-іл і піперидин-4-іл; пентил включає пент-1-ил, пент-2-ил і пент-3-ил. У разі, коли будь-яка змінна зустрічається більше одного разу в будь-якій складовій частині, кожне визначення є незалежним. Будь-якого разу, коли використовується термін "сполуки формули (I)” або "сполуки згідно з даним винаходом" або подібні терміни, він може включати сполуки формули (I), що включають їхні стереохімічні ізомерні форми та їхні N-оксиди, четвертинні аміни, комплекси з металами, солі, гідрати й сольвати. Один варіант здійснення винаходу включає сполуки формули (I) або будь-яку їхню підгрупу, визначену в описі, включаючи їхні можливі стереохімічні ізомерні форми, а також N-оксиди, солі, гідрати й сольвати. Інший варіант здійснення винаходу включає сполуки формули (I) або будь-які їхні підгрупи, визначені в описі, включаючи їхні можливі стереохімічні ізомерні форми, а також N-оксиди, солі, гідрати й сольвати. Будь-якого разу, коли використовується термін "необов'язково заміщений", він має включати незаміщений, а також заміщений щонайменше одним з певних замісних радикалів. Наприклад, "С1-4алкіл, необов'язково заміщений хлором", може включати незаміщений С1-4-алкіл, а також С1-4алкіл, заміщений хлором. Сполуки формули (I) можуть мати один або більше центрів хіральності й можуть існувати у вигляді стереохімічно ізомерних форм. Термін "стереохімічно ізомерні форми", як він використаний в описі, означає всі можливі сполуки, побудовані з однакових атомів, зв'язаних однаковою послідовністю зв'язків, але що мають різні тривимірні структури, що їх можуть мати сполуки формули (I). Згідно з прикладами, де (R) або (S) використовують на позначення абсолютної конфігурації хірального атома в заміснику, позначення наведене, зважаючи на сполуки цілком, а не окремий замісник. У одному аспекті даний винахід пропонує сполуки формули (I): 4 UA 103324 C2 R1 A O S O NH R4 R5 O R6 N O R2 R7 (I) 1 5 2 4 включаючи їхні стереохімічно ізомерні форми і N-оксиди, солі, гідрати й сольвати, де R , R , R , 5 6 7 R , R , R і А мають таке саме значення, як визначено в описі. Варіанти здійснення даного винаходу стосуються сполук формули (I) або будь-якої їх підгрупи, як визначено в описі, де одне 1 2 4 5 6 7 або більше визначень для R , R , R , R , R і R , передбачених у варіантах здійснення винаходу нижче, використовують: Окремі підгрупи сполук формули (I) є сполуками формули (II), (III) або (IV): 10 R1 R1 O A O2S A O2S R6 O R6 NH NH N O N O R2 R2 7 R7 (III), (II), R R1 O A O2S R6 NH N O R2 (IV), R7 1 2 4 5 6 7 де R , R , R , R , R , R і А мають такі самі значення, що й визначені в описі. 1 В одному варіанті здійснення винаходу, R є двовалентним ланцюгом, вибраним з R3 N a N N R3 R3 N b b R3 , , R3 R3 N 15 N N c R3 N R3 N O N R3 , N c , N c N R3 N R3 R3 N , N N N R3 N N . 1 У окремому варіанті здійснення винаходу, R вибирають з 5 , та R3 N , UA 103324 C2 N R3 a N R3 R3 N , R3 N O R3 N N R3 , R3 R3 N N , та N N c , де а і с є такими, як визначено в описі вище, або де а рівне 4 або 5, і с рівне 1 або 2. В 1 іншому окремому варіанті здійснення винаходу, R вибирають з R3 3 N 3 -N(R )-(CH2)4-N(R )-, R3 N O R3 N R3 N N R3 , R3 N N c N , та . 5 R3 1 N N c N 1 Коли R є , зрозуміло, що група R може бути орієнтована у двох напрямах, тобто піперазинільний фрагмент може бути сполучений з сульфонамідною групою, тоді як аліфатичний амін сполучений з карбонільною групою, або піперазинільний фрагмент сполучений з карбонільною групою, й аліфатичний амін сполучений з сульфонамідною групою. R3 10 N N c N 1 Переважно, коли R є , тоді піперазинільний фрагмент сполучений з карбонільною групою, й аліфатичний амін сполучений з сульфонамідною групою. 1 В окремому варіанті здійснення винаходу, R вибирають з N CH3 CH3 N CH3 CH3 N O N , N N N N , та CH3 . CH3 1 Альтернативно, R вибирають з CH3 N O N N N 15 CH3 CH3 CH3 N N H , CH3 , , N N N та CH3 CH3 CH3 N 1 У переважному варіанті здійснення винаходу, R є N O . CH3 N N H 1 У іншому варіанті здійснення винаходу, R є . CH3 N N 1 У іншому варіанті здійснення винаходу, R є CH3 . N N N 20 25 1 CH3 У іншому переважному варіанті здійснення винаходу, R є . 3 Кожну групу R незалежно вибирають з групи, що складається з водню, С 1-4алкілу й С33 5циклоалкілу. В окремому варіанті здійснення винаходу, R незалежно вибирають з групи, що складається з водню, метилу, етилу, ізопропілу й циклопропілу. В більш специфічному варіанті 3 здійснення винаходу, кожну групу R незалежно вибирають з групи, що складається з водню й 3 метилу; або R означає метил. Макроцикл А містить від 14 до 18 атомів у циклі. В окремому варіанті здійснення винаходу макроцикл А містить 16, 17 або 18 атомів у циклі. В більш специфічному варіанті здійснення 6 UA 103324 C2 5 10 15 20 25 винаходу А містить 17 атомів у циклі. 2 Групу R вибирають з групи, що складається з водню, галогену або С 1-4алкокси. В окремому 2 варіанті здійснення винаходу, R вибирають з групи, що складається з водню, хлору, фтору або 2 метокси. В більш специфічному варіанті здійснення винаходу, R означає водень або метокси 2 або хлор; або, альтернативно, R означає фтор або метокси; або, в переважному варіанті 2 2 здійснення винаходу, R означає метокси. В іншому варіанті здійснення винаходу, група R розташована в мета- або пара-положенні бензольного кільця по відношенню до зв'язку, що 2 зв'язує бензол з індольною групою. В переважному варіанті здійснення винаходу, група R розташована в пара-положенні бензолового кільця по відношенню до зв'язку, що зв'язує даний бензол з індольною групою. 4 5 4 5 Групи R і R означають водень, або R і R разом утворюють подвійний зв'язок або метиленову групу з утворенням конденсованого циклопропілу. В окремому варіанті здійснення 4 5 4 5 винаходу, R і R означають водень, або R і R разом утворюють метиленову групу з 4 утворенням конденсованого циклопропілу. В іншому окремому варіанті здійснення винаходу, R 5 6 і R разом утворюють подвійний зв'язок. У іншому варіанті здійснення винаходу, групу R 6 вибирають з водню й метилу. В окремому варіанті здійснення винаходу, R означає водень, коли сполука формули (I) є сполукою формули (III) або (IV). В іншому окремому варіанті 6 здійснення винаходу, R означає метил, коли сполукою формули (I) є сполука формули (II). 7 Група R означає С3-7циклоалкіл, необов'язково заміщений галогеном. У окремому варіанті 7 здійснення винаходу, R вибирають з циклопентилу, циклогексилу й фторциклогексилу 7 (зокрема, 2-фторциклогексилу). В переважному варіанті здійснення винаходу, R означає циклогексил. 4 5 Окрема підгрупа сполук формули (I) представлена сполуками формули (I), де R і R разом 1 2 6 утворюють подвійний зв'язок, і де використовують одне або більше визначень для R , R , R і 7 R , відповідно до варіантів здійснення винаходу. Більш специфічною підгрупою сполук формули 1 2 4 5 6 7 (I) є сполуки формули (II), де R , R , R , R , R , R і А мають таке саме значення, як визначено в описі. Більш специфічними є такі сполуки, представлені наступними структурними формулами 2 6 7 (II-1), (II-2) і (II-3), де R , R і R мають таке саме значення, як визначено в описі для сполук формули (I) або їх підгруп. CH3 O N H3C N N O H3C H3C O2S N N R6 R6 O2S NH O H3C NH N O N O R2 R2 (II-1), R7 30 R7 (II-2), та N H3C N N O R6 O2S NH O N R2 R7 35 40 (II-3). У окремому варіанті здійснення винаходу винахід пропонує сполуки, незалежно, формули 6 6 (II), (II-1), (II-2) і (II-3), де R означає водень або метил, переважніше, де R означає метил. У іншому варіанті здійснення винаходу, винахід пропонує сполуки формули (II) або їх 7 підгрупи, де R означає циклогексил або 2-фторциклогексил. У іншому варіанті здійснення винаходу, винахід пропонує сполуки формули (II) або їх 2 підгрупи, де R означає водень, метокси або хлор. Альтернативно, винахід пропонує сполуки 2 формули (II) або їх підгрупи, де R означає фтор або метокси. 1 2 4 5 6 7 Окремою підгрупою сполук формули (I) є сполуки формули (III), де R , R , R , R , R , R і А мають таке ж значення, як визначено в описі. Більш специфічними є такі сполуки, представлені 2 6 7 наступними структурними формулами (III-1), (III-2), (III-3) і (III-4), де R , R і R мають таке ж 7 UA 103324 C2 значення, як визначено в описі для сполук формули (I). CH3 O N H3C O N N H3C H3C R6 O2S O N N H3C R6 O2S NH NH N O N O R2 R7 R2 (III-1), (III-2), R7 N H3C O N N R6 O2S CH3 O2S NH O HN N R6 NH N O N O R2 R2 R7 (III-3), (III-4) R Зокрема, винахід пропонує сполуки, незалежно, формули (III), (III-1), (III-2), (III-3) і (III-4), де 6 R означає водень. У іншому варіанті здійснення винаходу, винахід пропонує сполуки формули (III) або їх 7 підгрупи, де R означає циклогексил або 2-фторциклогексил. У іншому варіанті здійснення винаходу, винахід пропонує сполуки формули (III) або їх 2 підгрупи, де R означає водень, метокси або хлор. 1 2 4 Окрема підгрупа сполук формули (I) представлена сполуками формули (IV), де R , R , R , 5 6 7 R , R , R і А мають таке ж значення, як визначено в описі. Більш специфічними є такі сполуки, 2 6 7 представлені наступними структурними формулами (IV-1), (IV-2) і (IV-3), де R , R і R мають таке саме значення, як визначено в описі для сполук формули (I). 7 5 10 CH3 O N H3C H3C O N N N N H3C R6 O2S R6 O2S NH O H3C NH N O N O R2 R7 R2 R7 (IV-1) (IV-2) N H3C N N O R6 O2S NH O N R2 15 (IV-3) R7 В іншому варіанті здійснення винаходу, винахід пропонує сполуки формули (IV) або їх 7 підгрупи, де R означає циклогексил або 2-фторциклогексил. У іншому варіанті здійснення винаходу, винахід пропонує сполуки формули (IV) або їх 2 підгрупи, де R означає водень, метокси або хлор. 8 UA 103324 C2 5 У окремому варіанті здійснення винаходу, даний винахід пропонує сполуки формули (II-1), (III-1) і (IV-1). Інший варіант даного винаходу стосується сполук формули (II-2), (III-2) і (IV-2). Інший варіант даного винаходу стосується сполук формули (II-3), (III-3) і (IV-3). У окремому варіанті здійснення винаходу, винахід пропонує сполуки формули (I), вибрані з групи, що складається з N O S O O N O NH N O S O N O O N NH N O O N N O N S N O , N O N O NH O N O O O N O N O S N O O O O NH N O O S N N O O N S O , N O NH O O O O NH N S NH O O O S O O N O O NH N O O N N O NH O N O , S O N O N N O NH O N S O O , S O N O , O , N O NH O N N O , N O O N O NH O NH O S O O N O , S N O N O O N NH , N 10 N O O NH O S N O O , O , N N O N N , N O NH N O NH O , S S N O O O N N , O N O O , N N O S NH O O N N N O S NH O O O O , N O NH N O , 9 N O , UA 103324 C2 N O S N O N N O S O NH O N N N O O NH N O O O та . Особливо, даний винахід пропонує сполуки формули (I), вибрані з N O S O N N O O O NH N O S O O N N O NH O N O N O N N N O S NH O O O N O N O O N O N N O NH N O . N NH N O O O O S O , S , O O N N , N N NH O , N N O S NH O O N O O O 5 S O O S N O N N O NH O N O , S N N O O NH N O O O O та , . Альтернативно, даний винахід пропонує сполуки формули (I), вибрані з 10 N O S O O N O N NH O N O S N O N NH O O NH O N N NH N O O , N O S NH O O O O O O H N S H N O N N O S NH O O N , N , N O S NH O O O N O , 10 N O N O O , O , UA 103324 C2 N N O S NH O O O N N O S NH O O N O O N O S NH O O N N O O S NH O O O N N O O N O N N O S NH O O N O O N O , H N O HN N Cl HN S , O S NH O O , O F N F N N , O S NH O O N O O , N N O , O HN O S NH O O N N O N O O Cl , H N N O S NH O O , N O S O HN O N , NH O N O S NH O O N O N O N O O Cl або , . 5 Особливо, даний винахід пропонує сполуки формули (I), вибрані з N O S O O N N O O S NH O O NH N O N O N O S NH O O O N O N O S NH O O O N O , N O S NH O O N O N O N F F та . 10 11 O N O O , N UA 103324 C2 5 10 15 20 25 30 35 40 Якщо не згадано або не вказано інше, хімічне позначення сполуки охоплює суміш деяких або всіх можливих стереохімічно ізомерних форм, які вказана сполука може мати. Вказана вище суміш може містити утримувати всі діастереомери й/або енантіомери основної молекулярної структури вказаної сполуки. Всі стереохімічно ізомерні форми сполуки згідно з даним винаходом, в чистому вигляді виді або у вигляді суміші з із будь-якою іншою формою, мають бути включені в обсяг даного винаходу. Чисті стереоізомерні форми сполук і проміжних сполук, як відмічено в даному описі, визначені як ізомери, що по суті не містять утримують інших енантіомерних або діастереомерних форм тієї ж основної молекулярної структури вказаних сполук або проміжних сполук. Зокрема, термін "стереоізомерно чистий" відноситься до сполук або проміжних сполук , що мають надлишок стереоізомера, щонайменше 80 % (тобто, мінімум 90 % одного ізомеру й максимум 10 % інших можливих ізомерів), аж до надлишку стереоізомера 100 % (тобто, 100 % одного ізомеру і відсутність інших), конкретніше, до сполук або проміжних сполук , що мають надлишок стереоізомера від 90 до 100 %, ще конкретніше, що має надлишок стереоізомера від 94 до 100 %, і найконкретніше, що має надлишок стереоізомера від 97 до 100 %. Терміни "енантіомерно чистий" і "діастереомерно чистий" слід розуміти аналогічним чином, але та що має відношення до надлишку енантіомера й надлишку діатереомера, відповідно, в даних сумішах. Чисті стереоізомерні форми сполук і проміжних сполук згідно з згідно даним винаходом можуть бути отримані одержувати з використанням відомих у даній галузі способів. Наприклад, енантіомери можуть бути відокремлені один від одного шляхом селективної кристалізації їхніх діастереомерних солей соль, утворених з із оптично активними кислотами або основами. Прикладами зразками є винна кислота, дибензоїлвинна кислота, дитолуоїлвинна кислота й камфорсульфонова кислота. Альтернативно, енантіомери можуть бути розділені хроматографічними методами з використанням хіральних стаціонарних фаз. Вказані чисті стереохімічно ізомерні форми можуть бути отримані одержувати з із відповідних чистих стереохімічно ізомерних форм відповідних придатних вихідних початкових речовин, за умови, що при умові, що реакція протікає стереоспецифічно. Переважно, якщо бажаний певний стереоізомер, зазначену сполуку синтезують стереоспецифічно способами одержання. В даних способах переважно будуть використані енантіомерно чисті вихідні початкові речовини. Діастереомерні рацемати сполук формули (1) або будь-якої їх підгрупи можуть бути отримані традиційними способами. Відповідні фізичні способи розділення, які переважно можна використовувати, є, наприклад, селективною кристалізацією й хроматографією, наприклад колонковою хроматографією. Для деяких зі сполук формули (1), їхніх N-оксидів, солей, гідратів, сольватів, четвертинних амінів, або комплексів з металами й проміжних сполук, використовуваних для їх отримання, абсолютна стереохімічна конфігурація не була визначена експериментально. Фахівець у даній галузі здатний визначити абсолютну конфігурацію таких сполук з використанням способів, відомих у даній галузі, наприклад таких, як дифракція рентгенівських променів. У варіанті здійснення винаходу, даний винахід відноситься до сполук формули (IIIA), (IIIB), (IVA) і (IVB) R1 A O2S R1 O R6 O A O2S R6 NH NH N O N O R2 R2 (IIIA) R7 R1 R1 O A O2S R6 O A O2S R6 NH NH N O N O R2 R2 R7 45 1 (IIIB) R7 2 6 (IVA) 7 R 7 (IVB) де R , R , R , R і А мають таке саме значення, як визначено в описі. 12 UA 103324 C2 У більш специфічному варіанті здійснення винаходу, даний винахід відноситься до сполук формули (IIIA-1), (IIIA-2), (IIIA-3), (IIIA-4), (IIIB-1), (IIIB-2), (IIIB-3), (IIIB-4), (IVA-1), (IVA-2), (IVA-3), (IVB-1), (IVB-2) і (IVB-3). CH3 O N H3C H3C O N N H3C R6 O2S O N N H3C R6 O2S NH NH N O N O R2 5 R2 (IIIA-1) R7 R N H3C (IIIA-2) 7 O HN N N O N CH3 R6 O2S R6 O2S NH NH N O N O R2 R2 (IIIA-3) 7 R (IIIA-4) R7 CH3 O N H3C H3C O N N H3C R6 O2 S O N N H3C R6 O2S NH NH N O N O R2 R2 (IIIB-1) R7 N H3C (IIIB-2) R7 O HN N N O N CH3 O2S R6 O2S R6 NH NH N O N O R2 R2 (IIIB-3) 7 R (IIIB-4) R7 CH3 O N H3C N N H3C O H3C R6 O2S O H3C R6 O2S NH O N N NH N N O R2 R7 R2 (IVA-1) R7 13 (IVA-2) UA 103324 C2 O N H3C N N H3C O N N R6 O2S O H3C R6 O2S NH NH N O N O R2 R2 R7 (IVA-3) R7 (IVB-1) CH3 N H3C N N N O H3C H3C R6 O2S N N R6 O2S NH NH N O O N R2 R 5 6 R2 (IVB-2) 7 2 O R7 (IVB-3) 7 де R , R і R мають таке ж значення, як визначено в описі. В іншому варіанті здійснення винаходу, за необхідністю, сполуки формули (I) або їх підгрупи мають стереохімічну конфігурацію, ілюстровану формулою (IA). R1 A O S O O R4 R5 O R6 NH N R2 R7 10 15 20 25 30 (IA) Даний винахід призначений включити всі ізотопи атомів, що існують у даних сполуках. Ізотопи включають ті атоми, які мають той самий атомний номер, але різні масові числа. Як загальний приклад і без обмеження, ізотопи водню включають тритій і дейтерій. Ізотопи вуглецю включають C-13 і C-14. Що стосується терапевтичного використання, солі сполук формули (I) представлені такими солями, в яких протиіон є фармацевтично прийнятним. Проте солі кислот і основ, які не є фармацевтично прийнятними, також можуть знайти вживання, наприклад, в одержанні або очищенні фармацевтично прийнятної сполуки. Всі солі, фармацевтично прийнятні вони чи ні, включені в обсяг даного винаходу. Фармацевтично прийнятні солі кислоти або основи, як відмічено в описі вище, призначені включити терапевтично активні нетоксичні адитивні солі кислоти й основи, які сполуки формули (I) можуть утворювати. Фармацевтично прийнятні адитивні солі кислоти можна отримати звичайним способом шляхом обробки основи такою прийнятною кислотою. Прийнятні кислоти включають, наприклад, неорганічні кислоти, такі як галогенводневі кислоти, наприклад хлористоводнева або бромистоводнева кислота, сірчана, азотна, фосфорна й подібні кислоти; або органічні кислоти, такі як, наприклад, оцтова, пропанова, гідроксіоцтова, молочна, піровиноградна, щавлева (тобто, етандіова), малонова, янтарна (тобто, бутандіова), малеїнова, фумарова, яблучна (тобто, гідроксибутандіова кислота), винна, лимонна, метансульфонова, етансульфонова, бензолсульфонова, р-толуол-сульфонова, цикламова, саліцилова, раміносаліцилова, памова й подібні кислоти. У свою чергу, вказані сольові форми можуть бути перетворені при обробці відповідною основою на форму вільної основи. Сполуки формули (I) або будь-яка їх підгрупа, що містять кислий протон, також можуть бути перетворені на їхні нетоксичні адитивні солі металів або амінів шляхом обробки відповідними 14 UA 103324 C2 5 10 15 20 25 30 35 40 45 50 органічними й неорганічними основами. Прийнятні форми основних солей включають, наприклад, солі амонію, солі лужних і лужноземельних металів, наприклад літію, натрію, калію, магнію, солі кальцію й подібні, солі з органічними основами, наприклад бензатином, N-метил-Dглюкаміном, солі гідрабаміну й солі з амінокислотами, такими як, наприклад, аргінін, лізин і тому подібне. Термін "четвертинний амін", як він використаний раніше в даному описі, відноситься до визначення четвертинних амонієвих солей, які сполуки формули (I) або будь-яка їх підгрупа здатні утворювати при реакції між основним азотом сполуки формули (I) або будь-якої її підгрупи і придатним засобом кватернізації, таким як, наприклад, необов'язково заміщений алкілгалогенід, арилгалогенід і арилалкілгалогенід, наприклад метилйодид або бензилйодид. Інші реагенти з придатними відхідними групами також можна використовувати, такі як алкілтрифторметансульфонати, алкілметансульфонати і алкіл-р-толуолсульфонати. Четвертинний амін містить позитивно заряджений азот. Фармацевтично прийнятні протиіони включають хлор, бром, йод, трифторацетат і ацетат. Вибраний протиіон може бути введений з використанням іонообмінних смол. Мається на увазі, що N-оксидні форми даних сполук включають сполуки формули (I) або будь-яку їх підгрупу, де один або декілька атомів азоту окислені до так званого N-оксиду. Слід розуміти, що сполуки формули (I) або будь-яка їх підгрупа можуть мати металзв'язуючі, хелатуючі, комплексотвірні властивості й отже, можуть існувати у вигляді металокомплексів і хелатів металів. Передбачається, що такі металопохідні сполук формули (I) або будь-якої їх підгрупи включені в обсяг даного винаходу. Деякі зі сполук формули (I) або будь-яка їх підгрупа й проміжні сполуки також можуть існувати в одній або більше таутомерних формах. Мається на увазі, що такі форми, хоча й не вказані детально в наведеній вище формулі, включені в обсяг даного винаходу. Таким чином, сполуки й проміжні сполуки можуть існувати у вигляді суміші таутомерів або у вигляді індивідуального таутомера. У винаході особлива перевага надається сполукам формули I або будь-якій їх підгрупі, які в описаному нижче аналізі інгібування мали величину інгібування меншу за 100 мкМ, переважно меншу за 50 мкМ, переважніше меншу за 10 мкМ, переважно меншу за 5 мкМ, ще переважніше меншу за 1 мкМ, переважно меншу за 100 нМ і, особливо, меншу за 10 нМ, як визначено відповідним аналізом, таким як аналізи, використовувані в прикладах нижче. Зрозуміло, що визначені вище підгрупи сполук формули (I), а також будь-яка інша підгрупа, вказана в описі, призначені включити стереохімічно ізомерні форми і будь-які N-оксиди, солі, четвертинні аміни, гідрати, сольвати й металокомплекси таких сполук. Одержання сполук формули (I) Загальні схеми синтезу Сполуки формули (I) можуть бути синтезовані наступними різними способами А, В, С, D, E, F і G, описаними нижче, з похідних індолу А-1. O O R4 Rb Ra R5 O R6 N O R2 R7 (A-1) 7 де R , R , R , R і R є такими, як визначено для сполук формули (I) або їх підгруп, і Ra вибирають з метилу і трет-бутилу, і Rb вибирають з метилу. Сполуки формули (А-1) є або відомими сполуками в даній галузі, або можуть бути отримані, як описано в патенті США US20070270406A1, міжнародних публікаціях WO2007/054741 і WO2007/092000. Спосіб А Схематичне представлення синтезу сполук формули (I) подане на схемі 1. Спосіб починається зі сполуки формули А-1. Сполуки формули А-2 можуть бути отримані за допомогою регіоселективного гідролізу складного ефіру, що містить Rb-групу, в лужних умовах, використовуючи гідроксид, такий як LіOH або NаOH, в полярних розчинниках, таких як вода, спирт, такий як метанол або етанол, тетрагідрофуран (ТГФ) або їх суміші. Даний спосіб може бути використаний у разі, якщо Rb є метильною групою, і Ra є трет-бутильною групою, або Ra є метильною групою. 1 1 1 Монозахищений біфункціональний R -похідний реагент формули PG-R -H, де група R є 2 4 5 6 15 UA 103324 C2 5 10 15 20 25 30 35 такою, як визначено для сполук формули (I) або їх підгруп, може бути сполучений з карбоновою кислотою сполук А-2 з утворенням амідного зв'язку, приводячи до сполук А-3. "PG ”, як визначено в описі, є відповідною захисною групою для аміну, вибраною із захисних груп, відомих у даній галузі. Переважно, PG є трет-бутоксикарбонільною (Вос) захисною групою або 4-нітробензолсульфонільною (нозильною) групою. Утворення амідних зв'язків може бути здійснене стандартними методиками, такими, які використовують для скріплення амінокислот у пептидному синтезі. Пептидний синтез включає взаємодію карбонової кислоти однієї речовини з аміногрупою іншої речовини з утворенням зв'язуючого амідного зв'язку з супровідною дегідратацією. Утворення амідного зв'язку можна здійснювати шляхом взаємодії вихідних речовин у присутності сполучного реагенту або шляхом перетворення карбоксильної функціональності на активну форму, таку як активний складний ефір, змішаний ангідрид або хлорангідрид або бромангідрид карбонової кислоти. Загальні описи таких реакцій скріплення і використовуваних у них речовин можна знайти в керівництві з хімії пептидів, наприклад, M. Bodanszky, "Peptide Chemistry ", 2nd rev. ed., Springer-Verlag, Berlin, Germany (1993). Схема 1 Приклади реакцій зв'язування з утворенням амідного зв'язку включають азидний метод, метод змішаних ангідридів карбонової кислоти і карбоксильної групи (ізобутилхлорформіат), карбодиімідний (дициклогексилкарбодиімід (DCC), діізопропілкарбодиімід (DIC) або водорозчинний карбодиімід, такий як N-етил-N' -[3- (диметиламіно)пропіл]карбодиімід (EDC)) метод, метод активованих ефірів (наприклад, р-нітрофеніл, р-хлорфеніл, трихлорфеніл, пентахлорфеніл, пентафторфеніл, N-гідроксисукцинімідоефір і подібні складні ефіри), метод з К-реагентом Вудворда, метод з 1,1-карбонілдіімідазолом (CDI або N, N'-карбонілдіімідазол), метод із застосуванням фосфорумісних реагентів і методи із застосуванням реакцій окисленнявідновлення. Деякі з указаних вище методів можуть бути покращувані шляхом додавання придатних каталізаторів, наприклад, у карбодиімідному методі при додаванні 1гідроксибензотриазолу або 4-диметиламінопіридину (4-DMAP). Також сполучними засобами є (бензотриазол-1-ілокси)-трис- (диметиламіно)фосфонію гексафторфосфат, або як такий, або у присутності 1-гідроксибензотриазолу або 4-DMAP; або 2- (1Н-бензотриазол-1-іл)-N, N,N',N'тетраметилуронію тетрафторборат або О-(7-азабензотриазол-1-іл)-N, N,N',N'-тетраметилуронію гексафторфосфат. Вказані реакції зв'язування можуть бути здійснені або в розчині (рідка фаза), або у твердій фазі. Реакції зв'язування переважно проводять у інертному розчиннику, як-от галогеновані вуглеводні, наприклад дихлорметан (DCM), хлороформ, диполярні апротонні розчинники, як-от ацетонітрил, диметилформамід (ДМФ), диметилацетамід, ДМСО, НМРТ, прості ефіри, такі як тетрагідрофуран (ТГФ). У багатьох прикладах, реакції зв'язування здійснені у присутності придатної основи, такої як 16 UA 103324 C2 5 10 15 20 25 30 третинний амін, наприклад триетиламін, діізопропілетиламін (DIPEA), N-метилморфолін, Nметилпіролідин, 4-DMAP або 1,8-діазабіцикло [5.4.0]ундец-7-ен (DBU). Температура реакції може варіюватися між 0ºС і 50ºС, і час реакції може бути в інтервалі між 15 хв і 24 год. Видалення захисної групи способами, відомими в даній галузі, може привести до одержання сполук А-4. Вказані способи включають взаємодію сполук А-3 з трифтороцтовою кислотою (ТФО) у відповідному розчиннику, такому як DCM, коли PG є Вос-захисна група, або взаємодія сполук А-3 з тіолумісною меркаптооцтовою кислотою або тіофенолом, у розчині або в твердій фазі, у присутності основи, як-от карбонат цезію або LіOH, у придатному розчиннику, такому як ДМФ, ТГФ, коли PG являє собою нозил. У разі, коли Ra означає трет-бутилову групу, і PG є Восзахисна група, видалення PG, як описано вище, може привести до сполуки А-4 з Ra, що означає ОН. Потім сполуки А-4 піддають взаємодії з сульфамідом у придатному розчиннику, наприклад діоксані, в умовах нагрівання, тобто 100ºС. Дана реакція може протікати при мікрохвильовому випромінюванні й приводити до сполук А-5. Інший спосіб уведення сульфамідного фрагмента може складатися із взаємодії сполуки А-4 з аміносульфонілхлоридом у присутності придатної основи, як-от триетиламін, DIPEA або піридин, у відповідному розчиннику, такому як хлорумісний розчинник, подібний DCM, або в ДМФ, ТГФ. Складноефірна функція сполук А-5, тобто -СО-О-Ra, потім може бути гідролізована, використовуючи умови, відомі в даній галузі, і включаючи обмилення в основному середовищі, як описано вище, з утворенням сполук А-6. Нагрівання може бути потрібне для завершення даної реакції. Кислі умови також можуть бути використані для гідролізу складноефірної функції сполук А-5, наприклад, ТФО у відповідному розчиннику, подібному DCM, коли Ra є третбутильною групою. Сполуки (I) можуть бути отримані макроциклізацією шляхом утворення внутрішньомолекулярного ацилсульфамідного зв'язку у присутності сполучних засобів, таких як CDI, який перетворює карбоксильну групу на активний ацилімідазол при нагріванні. Потім отриманий ацилімідазол може бути очищений до додавання придатної основи, як-от DBU, для здійснення замикання кільця, яке може відбуватися в умовах нагрівання. Розчинники, використовувані для вказаних реакцій, можуть включати ацетонітрил або ТГФ. Інші сполучні засоби, такі як засоби, відомі в даній галузі, також можуть бути використані для досягнення замикання кільця. Спосіб В 17 UA 103324 C2 Схема 2 5 10 15 20 25 30 Альтернативний спосіб, що приводить до сполук А-4, ілюстрований на схемі 2, може полягати в утворенні амідного зв'язку між сполуками А-2 і реагентом, представленим 1 симетричним двовалентним ланцюгом R , використовуваним у надлишку в порівнянні зі сполуками А-2. Вказаний амідний зв'язок може бути утворений, як описано вище, зокрема, з використанням сполучного засобу, такого як [диметиламіно- ([1,2,3]триазоло [4,5-b ]піридин-3ілокси)метилен]диметиламонію гексафторфосфат (HATU), в присутності основи, як-от DIPEA, і у придатному розчиннику, подібному DCM, ДМФ, або переважніше ТГФ. Далі сполуки А-4 можуть взаємодіяти, як описано вище в способі А, з одержанням сполук (I). Спосіб С Схема 3 Сполуки можуть бути безпосередньо отримані зі сполук А-2 способом, подібним до описаного вище способу синтезу сполук А-3, але використовуючи реагент, представлений 1 двовалентним ланцюгом R , що включає один сульфамідний фрагмент замість захисної групи. 1 1 Такий сульфамідний фрагмент може бути введений у ланцюг R на H-R -H при нагріванні 1 реагенту формули H-R -H, який може бути або монозахищеним придатною захисною групою 1 (тобто PG-R -H), або незахищеним, якщо реагент представлений симетричним ланцюгом, з сульфамідом у придатному розчиннику, такому як діоксан, в умовах мікрохвильового випромінювання. Далі, захисна група може бути видалена способами, відомими в даній галузі, наприклад, реакцією з ТФО в дихлорметані, коли захисною групою є Вос-захисна група, що 1 приводить до дериватизованого R -ланцюга, що включає моносульфамід. Спосіб D Сполуки формули А-3 або А-4 можуть піддаватися модифікації функціональної групи, такий як алкілування або відновне амінування, до видалення PG у сполук А-3 і реакції, що приводить до сульфаміду А-4. Спосіб Е 18 UA 103324 C2 Схема 4 5 10 15 20 25 Складний ефір, що несе Ra-групу, сполук А-1 (Ra є, наприклад, трет-бутиловою групою, і Rb є метильною групою) може бути гідролізований, як описано вище, в кислих умовах, використовуючи, наприклад, ТФО у придатному розчиннику, подібному DCM, із одержанням похідної карбонової кислоти Е-2. Взаємодія сполук Е-2 з сульфамідним фрагментом, уведеним у монозахисний двовалентний 1 ланцюг R , може привести до ацилсульфамідних сполук Е-3 в умовах, описаних для останньої стадії способу А. Переважно, сполучним засобом, використовуваним для активації карбоксильної групи, може бути CDI, у придатному розчиннику, подібному до ацетонітрилу або ТГФ, в умовах нагрівання. Додавання сульфамідного ланцюга в присутності основи, як-от DBU, в результаті може привести до сполук Е-3. PG є придатною захисною групою для аміну, вибраною з груп, відомих у даній галузі. Переважно, в способі Е, PG є Вос-захисна група. Видалення захисної групи PG у сполук Е-3 способами, відомими в даній галузі, може привести до сполук Е-4. Вказані способи включають взаємодію сполук Е-3 з ТФО у придатному розчиннику, такому як DCM, коли PG є Вос-захисна група. Далі, складноефірна функція сполук Е-4 (Rb означає метильну групу) може бути гідролізована в умовах, відомих у даній галузі, і що включають обмилення в основному середовищі, як описано вище, приводячи до сполук Е-5. Альтернативно, сполуки Е-3 можуть піддаватися реакції обмилення в основному середовищі для гідролізу складного ефіру, що містить Rb-групу, до видалення захисної групи в аміну в умовах, описаних вище, і що наводять до сполук Е-5. Сполуки (I) можуть бути отримані макроциклізацією сполук Е-5 шляхом утворення внутрішньомолекулярного амідного зв'язку у присутності сполучних засобів, як описано в способі А. Переважно, вказана стадія утворення амідного зв'язку може бути здійснена в умовах сильного розведення. Спосіб F 30 19 UA 103324 C2 Схема 5 5 10 Сполуки F-3 можуть бути отримані реакцією утворення аміду, виходячи зі сполук А-2 і алкіленаміну, як описано для другої стадії способу А. Подальший гідроліз складного ефіру в основних або кислих умовах, як описано раніше, може привести до сполук F-4. Далі, ацилсульфамідний зв'язок може бути утворений способом, описаним для останньої стадії способу А, використовуючи алкіленсульфамідну сполуку й отримуючи сполуки F-5. Альтернативно, ацилсульфамідна група може бути введена в сполуки формули Е-2 до гідролізу складного ефіру, що включає Rb-групу, і зв'язування отриманої карбонової кислоти з алкенаміном, як описано вище, приводячи до сполуки F-5. Утворення макроциклу, тобто, сполуки формули F-6, яка є сполукою формули (I), що містить R3 N b R3 наступний двовалентний ланцюг, як R : може бути здійснено реакцією метатези олефінів у присутності придатного металукаталізатора, такого як, наприклад, Ru-оснований каталізатор, як описано Miller, S.J., Blackwell, H.E., Grubbs, R.H. J. Am. Chem. Soc. 118, (1996), 9606-9614; Kingsbury, J. с., Harrity, J. P. A., Bonitatebus, P. J., Hoveyda, A. H., J. Am. Chem. Soc. 121, (1999), 791-799; і Huang et al, J. Am. Chem. Soc. 121, (1999), 2674-2678; наприклад каталізатор Hoveyda-Grubbs. Стійкі на повітрі рутенієві каталізатори, такі як біс(трициклогексилфосфін)-3-феніл-1H-інден® 1-іліденрутенію хлорид (Neolyst M1 ) або біс(трициклогексилфосфін)[(фенілтіо)метилен]рутенію(IV) дихлорид, можуть бути використані. Іншими каталізаторами, які можуть бути використані, є каталізатори Граббса першого і другого покоління, тобто, бензиліден-біс(трициклогексилфосфін)дихлоррутеній і (1,3-біс(2,4,6триметилфеніл)-2-імідазолідиніліден)дихлор (фенілметилен)(трициклогексилфосфін)рутеній, відповідно. Особливий інтерес становлять каталізатори Hoveyda-Grubbs першого й другого покоління, якими є дихлор (о-ізопропоксифенілметилен)(трициклогексилфосфін)рутеній(II) і 1,3біс- (2,4,6-триметилфеніл)-2-імідазолідиніліден)дихлор (о-ізопропоксифенілметилен) рутеній, відповідно. Також інші каталізатори, що містять інші перехідні метали, такі як Мо, можуть бути використані для даної реакції. Реакції метатезису можуть бути здійснені в придатному розчиннику, такому як, наприклад, прості ефіри, наприклад ТГФ, діоксан; галогеновані вуглеводні, наприклад дихлорметан, CHCl 3, 1,2-дихлоретан тощо, вуглеводні, наприклад толуол. Зазначені реакції здійснюють при підвищених температурах в атмосфері азоту. Сполуки формули (I) або будь-яка їх підгрупа або будь-які їх підгрупи можуть бути перетворені одне на одне за допомогою реакцій трансформації функціональної групи, відомих у даній галузі. Наприклад, аміногрупи можуть бути N-алкіловані, нітрогрупи можуть бути відновлені до аміногруп, атом галогену може бути обмінений на інший галоген. Сполуки формули F-6 можуть бути піддані каталітичному гідруванню з використанням, наприклад, Pd/C як каталізатор, у придатному розчиннику, такому як метанол, етанол, ТГФ, 1 15 20 25 30 35 40 N b 20 UA 103324 C2 5 оцтова кислота або їх суміш, з отриманням сполук формули F-7, де алкен двовалентного 1 ланцюга R відновлений до відповідного алкана. Сполуки формули F-6, що належать до групи сполук формули (II), можуть бути перетворені на сполуки F-7, що мають структуру сполук формули (IV), після вказаної стадії гідрування. Загалом, сполуки формули (II) можуть бути перетворені на сполуки формули (IV) шляхом каталітичного гідрування, як показано нижче. Схема 6 10 15 20 25 30 35 40 Сполуки формули (I) можуть бути перетворені на відповідні форми N-оксидів відомими в даній галузі способами, призначеними для перетворення тривалентного азоту на його Nоксидну форму. Вказана реакція N-окислення може бути в основному здійснена шляхом взаємодії вихідної речовини формули (I) з відповідним органічним або неорганічним перекисом. Відповідні неорганічні перекиси включають, наприклад, перекис водню, перекиси лужного металу або лужноземельного металу, наприклад перекис натрію, перекис калію; відповідні органічні перекиси можуть включати пероксикислоти, такі як, наприклад, бензолкарбопероксикислота або галогензаміщена бензолкарбопероксикислота, наприклад 3хлорбензолкарбопероксикислота, пероксіалканові кислоти, наприклад пероксіоцтова кислота, алкілгідроперекиси, наприклад трет-бутилгідроперекис. Відповідними розчинниками є, наприклад, вода, нижчі спирти, наприклад етанол і тому подібне, вуглеводні, наприклад толуол, кетон, наприклад 2-бутанон, галогеновані вуглеводні, наприклад дихлорметан, і суміші вказаних розчинників. Чисті стереохімічні ізомерні форми сполук формули (I) можуть одержуватися способами, відомими в даній галузі. Діастереомери можуть бути розділені фізичними методами, такими як селективна кристалізація й хроматографічні методи, наприклад противоточне розподілення, рідинна хроматографія й подібні. Сполуки формули (I) можуть одержуватися у вигляді рацемічних сумішей енантіомерів, які можуть бути відділені один від одного способами розділення, відомими в даній галузі. Рацемічні сполуки формули (I), які є в міру основними або кислотними, можуть бути перетворені на відповідні діастереомерні сольові форми шляхом взаємодії з придатною хіральною кислотою, відповідно хіральною основою. Далі, зазначені діастереомерні сольові форми розділяють, наприклад, селективною або фракційною кристалізацією, й енантіомери виділяються звідси за допомогою лугу або кислоти. Альтернативний спосіб розділення енантіомерних форм сполук формули (I) включає рідинну хроматографію, зокрема рідинну хроматографію з використанням хіральної стаціонарної фази. Зазначені чисті стереохімічні ізомерні форми також можуть бути вироблені з відповідних чистих стереохімічно ізомерних форм відповідних вихідних речовин, за умови, що реакція відбувається стереоспецифічно. Переважно, якщо специфічний стереоізомер є бажаним, тоді зазначена сполука може бути синтезована стереоспецифічними методами одержання. В зазначених методах переважно можуть бути використані енантіомерно чисті вихідні речовини. Спосіб G описує синтез енантіомерно чистих вихідних речовин А-2, що належать до груп сполук (III) і (IV). Спосіб G 45 21 UA 103324 C2 Схема 7 5 10 15 20 25 30 35 Рацемічна суміш А-2 може бути піддана взаємодії з хіральним допоміжним компонентом, таким як (S)-4-бензил-2-оксазолідинон, після перетворення її на ацилхлорид способами, відомими в даній галузі, такими як взаємодія А-2 з оксалілхлоридом у відповідному розчиннику, подібному ТГФ, у присутності каталітичної кількості ДМФ. Потім, хлорангідрид може взаємодіяти з аніоном (S)-4-бензил-2-оксазолідинону, утвореним реакцією з сильною основою, як-от бутиллітій, у відповідному розчиннику, такому як ТГФ, при низьких температурах, зазвичай при 78ºС, і в інертній атмосфері, з отриманням діастереоізомерів G1 і G2, які можуть бути виділені способами, відомими в даній галузі, такими як хроматографія на силікагелі. Далі, видалення хірального допоміжного компоненту з кожного з діастереоізомерів G1 і G2 може бути здійснене обробкою основою, такою як NaOH, у придатному розчиннику, такому як метанол, вода, ТГФ, з отриманням енантіомерно чистих сполук А-2" та А-2''. Використовуючи зазначені енантіомерно чисті вихідні речовини, можна одержувати енантіомерно чисті сполуки формули (I), що містять один стереоцентр, такі як сполуки формули (IIIA), (IIIB). Чисті стереохімічно ізомерні форми сполук формули (I) або будь-яких їх підгруп можуть бути отримані способами, відомими в даній галузі. Діастереомери можуть бути розділені фізичними способами, такими як селективна кристалізація й хроматографічні методи, наприклад противоточне розподілення, рідинна хроматографія й тому подібне. Сполуки формули (I) або будь-які їх підгрупи можуть бути одержані у вигляді рацемічних сумішей енантіомерів, які можуть бути розділені одне від одного методами розділення, відомими в даній галузі. Рацемічні сполуки формули (I) або будь-які їх підгрупи, що є в міру основними або кислотними, можуть бути перетворені на відповідні діастереомірні сольові форми шляхом взаємодії з придатною хіральною кислотою, відповідно хіральною основою. Далі, зазначені діастереомірні сольові форми розділяють, наприклад, селективною або фракційною кристалізацією, й енантіомери виділяються звідси за допомогою лугу або кислоти. Альтернативний спосіб розділення енантіомірних форм сполук формули (I) або будь-яких їх підгруп включає рідинну хроматографію, зокрема рідинну хроматографію з використанням хіральної стаціонарної фази. Зазначені чисті стереохімічно ізомерні форми також можуть бути вироблені з відповідних чистих стереохімічно ізомерних форм відповідних вихідних речовин, за умови, що реакція відбувається стереоспецифічно. Переважно, якщо специфічний стереоізомер є бажаним, тоді зазначена сполука може бути синтезована стереоспецифічними методами одержання. В зазначених методах переважно можуть бути використані енантіомерно чисті вихідні речовини. 22 UA 103324 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому аспекті, даний винахід стосується фармацевтичної композиції, що включає терапевтично ефективну кількість сполуки формули (I) або будь-яких її підгруп, як визначено в описі, й фармацевтично прийнятний носій. Терапевтично ефективна кількість у даному контексті означає кількість, достатню для профілактичної дії, стабілізації або зменшення вірусної інфекції та, зокрема, вірусної інфекції HCV, в інфікованих суб'єктів або суб'єктів, що піддаються ризику інфікування. В іншому аспекті, даний винахід відноситься до способу приготування фармацевтичної композиції, як зазначено в описі, який включає рівномірне змішування фармацевтично прийнятного носія з терапевтично ефективною кількістю сполуки формули (I) або будь-яких її підгруп, як зазначено в описі. У зв'язку з цим, згідно з варіантом здійснення даного винаходу, сполуки формули (I) або будь-яка їх підгрупа можуть бути приготовані в різних фармацевтичних формах для введення. Зрозуміло, що всі композиції, зазвичай використовувані для системного введення лікарських засобів, включені як придатні композиції. Для приготування фармацевтичних композицій згідно з даним винаходом, ефективну кількість окремої сполуки, необов'язково в сольовій формі або у вигляді металокомплексу, як активний інгредієнт змішують у вигляді однорідної суміші з фармацевтично прийнятним носієм, де носій може мати різні форми залежно від форми препарату, бажаної для введення. Вказані фармацевтичні композиції бажано отримати в стандартній лікарській формі, особливо, для введення перорально, ректально, черезшкірно або шляхом парентеральної ін'єкції. Наприклад, при приготуванні композицій у пероральній дозованій формі, будь-які зі звичайних фармацевтичних середовищ можуть бути використані, такі як, наприклад, вода, гліколі, масла, спирти й тому подібні в разі пероральних рідких препаратів, таких як суспензії, сиропи, еліксири, емульсії й розчини; або тверді носії, такі як крохмалі, цукри, каолін, змащувальні засоби, сполучні речовини, дезінтегруючі засоби й тому подібні в разі порошків, пілюль, капсул і пігулок. Завдяки легкості їх уведення, пігулки й капсули являють собою найбільш сприятливі пероральні стандартні лікарські форми, в разі яких з очевидністю використовують тверді фармацевтичні носії. Для парентеральних композицій, носій, як правило, включатиме стерилізовану воду, щонайменше, в значній мірі, хоча інші інгредієнти, наприклад ті, які сприяють розчинності, можуть бути включені у склад. Наприклад, можуть бути приготовані розчини для ін'єкцій, у яких носій включає фізіологічний розчин, розчин глюкози або суміш фізіологічного розчину й розчину глюкози. Суспензії для ін'єкцій також можуть бути приготовані, в разі яких можна використовувати придатні рідкі носії, суспендуючі засоби й тому подібне. Також включені препарати в твердому вигляді, які призначені для перетворення, незадовго до вживання, на рідкі препарати. В композиціях, придатних для черезшкірного введення, носій необов'язково включає засіб, що підсилює проникність і/або відповідний змочуючий засіб, необов'язково в поєднанні з придатними допоміжними добавками будь-якої природи в невеликих долях, де вказані добавки не чинять істотної шкідливої дії на шкіру. Сполуки згідно з даним винаходом можуть бути введені шляхом інгаляції або вдування в ротову порожнину за допомогою способів і препаратів, використовуваних у даній галузі для введення таким шляхом. Таким чином, у цілому, сполуки згідно з даним винаходом можуть бути введені в легені у вигляді розчину, суспензії або сухого порошку, розчин є переважним. Будьяка система, розроблена для доставки розчинів, суспензій або сухих порошків за допомогою інгаляції або вдування в ротову порожнину, є придатною для введення даних сполук. Таким чином, даний винахід також відноситься до фармацевтичної композиції, пристосованої для введення шляхом інгаляції або вдування через рот, що включає сполуки формули (I) або будь-які її підгрупи й фармацевтично прийнятний носій. Переважно, сполуки згідно з даним винаходом уводять шляхом інгаляції розчину в дозах, розпилюваних за допомогою небулайзера або аерозольного балона. Найпереважніше готувати описані вище фармацевтичні композиції в стандартній лікарській формі для легкості введення й однорідності дозування. Стандартна лікарська форма, використовувана у винаході, належить до фізично дискретних одиниць, придатних у вигляді однократних дозувань, де кожна одиниця містить зумовлену кількість активного інгредієнта, розраховану для надання бажаного терапевтичного ефекту, в поєднанні з необхідним фармацевтичним носієм. Прикладами таких стандартних лікарських форм є пігулки (що включають пігулки з насічкою або покриті оболонкою), капсули, супозиторії, пакетики з порошками, облатки, розчини або суспензії для ін'єкцій й тому подібне, й окрема їх множина. Сполуки формули (I) і будь-яка їх підгрупа виявляють противірусні властивості. Вірусні інфекції й пов'язані з ними захворювання, що піддаються лікуванню при використанні сполук і способів згідно з даним винаходом, включають такі інфекції, викликані HCV та іншими патогенними флавівірусами, такими як жовта лихоманка, лихоманка денге (типи 1-4), енцефаліт 23 UA 103324 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сент-Луїса, японський енцефаліт, енцефаліт долини Муррея, вірус Західного Ніла і вірус Кунжін. Захворювання, пов'язані з HCV, включають прогресуючий фіброз печінки, запалення й некроз, що наводять до цирозу, кінцевої стадії захворювання печінки, й НСС, а для інших патогенних флавівірусів, стани включають жовту лихоманку, лихоманку денге, геморагічну лихоманку й енцефаліт. Проте сполуки згідно з винаходом також можуть привернути увагу завдяки тому факту, що вони не виявляють активність проти інших вірусів, зокрема проти HIV. HIV-інфіковані хворі часто страждають на супутні інфекції, такі як HCV. Лікування таких хворих інгібітором HCV, який також інгібує HIV, може привести до появи стійкий штамів HIV. Завдяки їхнім противірусним властивостям, особливо їхній дії проти вірусу HCV, сполуки формули (I) або будь-яка їх підгрупа, включаючи їхні стереохімічно ізомерні форми та їхні Nоксиди, четвертинні аміни, металокомплекси, солі, гідрати й сольвати, є придатними в лікуванні індивідуумів, що страждають на вірусну інфекцію, особливо інфекцію HCV, і для профілактики таких інфекцій. У цілому, сполуки згідно з даним винаходом можуть бути придатні в лікуванні теплокровних тварин, заражених вірусами, зокрема, флавівірусами, такими як HCV. Отже, сполуки згідно з даним винаходом або будь-яка їх підгрупа можуть бути використані як лікарські засоби. Вказане використання як лікарський засіб або спосіб лікування включає системне введення інфікованим вірусом суб'єктам або суб'єктам, чутливим до вірусних інфекцій, ефективної кількості для лікування станів, пов'язаних з вірусною інфекцією, зокрема інфекцією HCV. Даний винахід також відноситься до застосування даних сполук або будь-якої їх підгрупи у виробництві лікарського засобу для лікування або запобігання вірусним інфекціям, особливо інфекції HCV. Крім того, даний винахід відноситься до способу лікування теплокровної тварини, зараженої вірусом, або підданої ризику зараження вірусом, зокрема вірусом HCV, де зазначений спосіб включає введення ефективної проти вірусу кількості сполуки формули (I) або будь-яких її підгруп, як визначено в описі. Даний винахід також стосується комбінації сполуки формули (I) або будь-якої її підгрупи, як визначено в описі, з іншими засобами проти HCV. У варіанті здійснення винаходу, винахід стосується комбінації сполуки формули (I) або будь-якої її підгрупи, щонайменше, з одним засобом проти HCV. У окремому варіанті здійснення винаходу, винахід стосується комбінації сполуки формули (I) або будь-якої її підгрупи, щонайменше, з двома засобами проти HCV. У окремому варіанті здійснення винаходу винахід стосується комбінації сполуки формули (I) або будь-якої її підгрупи, щонайменше, з трьома засобами проти HCV. У окремому варіанті здійснення винаходу винахід стосується комбінації сполуки формули (I) або будь-якої її підгрупи, щонайменше, з чотирма засобами проти HCV. Комбінація раніше відомої сполуки проти HCV, такої як інтерферон-α (IFN- α), пегільований інтерферон- α, рибавірин або їх комбінація і сполуки формули (I) або будь-якої її підгрупи може бути використана як лікарський засіб у комбінованій терапії. У варіанті здійснення винаходу, "комбінована терапія" відноситься до продукту, що містить обов'язково (а) сполуку формули (I) і (b) щонайменше одну іншу сполуку проти вірусу HCV, як комбінований препарат для одночасного, окремого або послідовного використання в лікуванні інфекцій HCV, зокрема, в лікуванні інфекцій вірусом HCV. Сполуки проти вірусу HCV охоплюють засоби, вибрані з інгібіторів полімерази HCV, R-7128, MK-0608, VCH759, PF-868554, GS9190, NM283, валопіцитабіну, PSI-6130, XTL-2125, NM-107, R7128 (R4048), GSK625433, R803, R-1626, BILB-1941, HCV-796, JTK-109 і JTK-003, ANA-598, IDX-184, MK-3281, MK-1220, похідних бензимідазолу, похідних бензо-1,2,4-тіадіазину, похідних фенілаланіну, A-831 і A-689; інгібіторів протеаз HCV (NS2-NS3 і NS3-NS4A), сполук, описаних у міжнародній публікації WO02/18369 (див., наприклад, стор.273, рядки 9-22 і стор. 274, рядок 4 – стор. 276, рядок 11), BI-1335, TMC435350, MK7009, ITMN-191, BILN-2061, VX-950, BILN-2065, BMS-605339, VX-500, SCH 503034; інгібіторів інших мішеней у життєвому циклі HCV, що включають інгібітори хелікази й металопротеїнази, ISIS-14803; імуномодуляторів, таких як α-, βі γ-інтерферони, такі як rIFN-α 2b, rIFN- α 2ba, консенсус IFN-α (інферген), ферон, реаферон, інтермакс α, rIFN-β, інферген + актимун, IFN-омега з DUROS, албуферон, локтерон, ребіф, пероральний IFN-α, IFN-α 2b XL, AVI-005, пегільований-інферген, пегільовані похідні сполуки інтерферону-α, такі як пегільований rIFN-α 2b, пегільований rIFN-α 2a, пегільований IFN-β, сполуки, які стимулюють синтез інтерферону в клітинах, інтерлейкіни, агоністи Толл-подібних рецепторів (TLR), сполуки, які підсилюють розвиток відповіді Т-хелперів 1 типу, і тимозин; інших противірусних засобів, таких як рибавірин, аналоги рибавірину, такі як ребетол, копегус і вірамідин (тарибавірин), амантадин і телбівудин, інгібіторів внутрішньої посадки рибосоми, 24 UA 103324 C2 5 10 15 20 25 30 35 40 45 50 55 60 інгібіторів альфа-глюкозидази 1, таких як MX-3253 (целгосивір) і UT-231B, гепатопротекторів, таких як IDN-6556, ME-3738, LB-84451 і MITOQ, інгібіторів вірусів широкого спектру, таких як інгібітори IMPDH (наприклад, сполуки патентів США US5807876, US6498178, US6344465, US6054472, міжнародних публікацій WO97/40028, WO98/40381, WOOO/56331, мікофенолова кислота та її похідні, і що включають, але не обмежуються ними, VX-497, VX-148, і/або VX-944); та інших лікарських засобів для лікування HCV, таких як задаксин, нітазоксадин, BIVN-401 (віростат), PYN-17 (алтирекс), KPE02003002, актилон (CPG-10101), KRN-7000, civacir, GI-5005, ANA-975, XTL-6865, ANA-971, NOV-205, tarvacin, EHC-18, NIM811, DEBIO-025, VGX-410C, EMZ702, AVI 4065, бавітуксимаб і оглуфанід; або комбінацій будь-яких з описаних вище сполук. Таким чином, для боротьби з інфекціями HCV або для лікування інфекцій HCV, сполуки формули (I) або будь-які їх підгрупи можуть бути введені спільно в комбінації, наприклад, з інтерфероном-α (IFN-α), пегільованим інтерфероном- α, рибавірином або з їх комбінацією, а також терапевтичними засобами, заснованими на антитілах, таргетованих проти епітопів HCV, короткої інтерферуючої РНК (si RNA), рибозимів, ДНКзимів, антисмислової РНК, низькомолекулярних антагоністів, наприклад протеази NS3, хелікази NS3 і полімерази NS5B. Комбінації згідно з даним винаходом можуть бути використані як лікарські засоби. У зв'язку з цим даний винахід відноситься до використання сполуки формули (I) або будь-якої її підгрупи, як визначено вище, для виробництва лікарського засобу, придатного для інгібування активності HCV у ссавця, інфікованого вірусами HCV, де вказаний лікарський засіб використовують у комбінованій терапії, вказана комбінована терапія, переважно, включає сполуку формули (I) і щонайменше одну іншу сполуку, що інгібує HCV, наприклад IFN-α , пегільований IFN- α, рибавірин або їх комбінацію. Крім того, відомо, що великий відсоток хворих, інфікованих вірусом 1 імунодефіциту людини (HIV), також інфіковані HCV, тобто вони є співінфікованими вірусами HCV/HIV. Інфекція HIV, певно, несприятливо впливає на всі стадії зараження HCV, приводячи до підвищеної персистенції вірусу й прискореного розвитку пов'язаного з HCV захворювання печінки. У свою чергу, інфекція HCV може впливати на лікування інфекції HIV, збільшуючи випадки печінкової токсичності, викликаної противірусними лікарськими засобами. Крім того, даний винахід стосується комбінацій сполуки формули (I) або будь-якої її підгрупи із засобами проти вірусу HCV. Також, комбінація однієї або більше додаткових сполук проти вірусу HCV і сполуки формули (I) або будь-яких її підгруп може бути використана як лікарський засіб. Зокрема, вказана комбінація може бути використана для інгібування реплікації HCV і HIV. Термін "комбінована терапія" також охоплює продукт, що містить (а) сполуку формули (I) або будь-яку її підгрупу і (b) щонайменше одну сполуку проти вірусу HCV і (с) необов'язково щонайменше одну іншу сполуку проти HCV, як комбінований препарат для одночасного, окремого або послідовного використання в лікуванні інфекцій HCV і HIV, зокрема, в лікуванні інфекцій HCV і HIV, або для попередження або лікування станів, пов'язаних з вірусами HCV і HIV. Таким чином, даний винахід стосується продукту, що містить (а) сполуку формули (I) або будь-яку її підгрупу і (b) одну або більше додаткових сполук, що виявляють активність проти вірусу HCV, як комбінований препарат для одночасного, окремого або послідовного використання в лікуванні інфекцій HCV і HIV. Різні лікарські засоби можуть бути комбіновані в одному препараті разом з фармацевтично прийнятний носіями. Вказані сполуки, що виявляють активність проти HIV, можуть бути будь-якими відомими антиретровірусними сполуками, такими як сурамін, пентамідин, тимопентин, кастаноспермін, декстран (сульфат декстрану), фоскарнет натрію (тринатрію фосфоноформіат); нуклеозидні інгібітори зворотної транскриптази (NRTIs), наприклад зидовудин (AZT), диданозин (ddl), залцитабін (ddC), ламівудин (3TC), ставудин (d4T), емтрицитабін (FTC), абакавір (ABC), амдоксовір (DAPD), елвуцитабін (ACH-126443), AVX 754 (()-dOTC), фозивудину дитоксил (FZT), фосфазид, HDP-990003, KP-1461, MIV-210, рацивір (PSI5004), UC-781 і тому подібне; ненуклеозидні інгібітори зворотної транскриптази (NNRTIs), такі як делавірдин (DLV), ефавіренз (EFV), невірапін (NVP), дапівірин (TMC 120), етравірин (TMC 125), рилпівірин (TMC278), DPC-082, (+)-каланолід A, BILR-355 і тому подібне; нуклеотидні інгібітори зворотної транскриптази (NtRTIs), наприклад терофовір ((R)-PMPA) і тенофовір дисопроксил фумарат (TDF) і тому подібне; конкуруючі з нуклеотидом інгібітори зворотної транскриптази (NcRTIs), наприклад NсRTI-I і тому подібне; інгібітори транс-діючих білків, такі як TAT-інгібітори, наприклад, RO-5-3335, BI-201 і тому подібне; інгібітори REV; інгібітори протеаз, наприклад ритонавір (RTV), саквінавір (SQV), лопінавір (ABT-378 або LPV), індинавір (IDV), ампренавір (VX-478), TMC 126, нелфінавір (AG-1343), атазанавір (BMS 232,632), дирунавір (TMCl 14), фосампренавір (GW433908 або VX-175), бреканавір (GW-640385, VX-385), P-1946, PL-337, PL100, типранавір (PNU-140690), AG-1859, AG-1776, Ro-0334649 і тому подібне; інгібітори входу, 25 UA 103324 C2 5 10 15 20 25 30 35 40 45 50 55 60 які включають злиті інгібітори (наприклад, енфувірдит (T-20)), інгібітори приєднання й інгібітори співрецепторів, останні включають антагоністи CCR5 (наприклад, анкривірок, CCR5mAb004, маравірок (UK-427,857), PRO-140, TAK-220, TAK-652, вікривірок (SCH-D, SCH-417,690)) і антагонізм CXR4 (наприклад, AMD-070, KRH-27315),, прикладами інгібіторів входу є PRO-542, TNX-355, BMS-488043, BlockAide/CR(ТМ), FP 21399, hNMO1, нонакін, VGV-I; інгібітором дозрівання є, наприклад, PA-457; інгібітори вірусної інтегрази, наприклад ралтегравір (MK-0518), елвітегравір (JTK-303, GS-9137), BMS-538158; рибозими; імуномодулятори; моноклональні антитіла; генна терапія; вакцини; siРНК; антисмислові РНК; бактерициди; інгібітори цинкових пальців. Отже, HCV-інфіковані хворі, що також страждають на стани, зв'язані з HIV або навіть іншими патогенними ретровірусами, такими як AIDS, AIDS-споріднений комплекс (ARC), прогресуючою генералізованою лімфаденопатією (PGL), а також хронічними захворюваннями CNS, викликаними ретровірусами, такими як, наприклад, опосередкована HIV деменція і розсіяний склероз, можуть успішно піддаватися лікуванню даними сполуками. Композиції можуть бути приготовані у відповідних фармацевтичних дозованих формах, таких як дозовані форми, описані вище. Будь-який з активних інгредієнтів може бути приготований окремо, і препарати можуть бути введені спільно, або може бути запропонований один препарат, що містить, до того ж, якщо бажано, інші активні інгредієнти. Як використовують у описі, термін "композиція" має охоплювати продукт, що містить певні інгредієнти, а також будь-який продукт, отриманий, прямо або не прямо, шляхом комбінування певних інгредієнтів. Термін "терапевтично ефективна кількість", як він використаний у описі, означає таку кількість активної сполуки або компонента або фармацевтичного засобу, яка викликає біологічну або медичну відповідь у тканині, системі, в тварини або людини, якої домагається, у світлі даного винаходу, дослідник, ветеринар, практикуючий лікар або інший клініцист, що включає послаблення симптомів захворювання, підданого лікуванню. Оскільки даний винахід також стосується комбінацій, що містять два або більше засобів, "терапевтично ефективна кількість" у контексті комбінацій також означає таку кількість засобів, разом узятих, комбінована дія яких викликає бажану біологічну або медичну відповідь. Наприклад, терапевтично ефективна кількість композиції, що містить (а) сполуку формули (I) і (b) інший засіб, що виявляє активність проти HCV, має бути кількістю сполуки формули (I) і кількістю іншого засобу, що виявляє активність проти HCV, які, коли взяті разом, мають комбіновану дію, що є терапевтично ефективною. У цілому, мається на увазі, що противірусна ефективна добова кількість складатиме від 0,01мг/кг до 500 мг/кг ваги тіла, більш переважно від 0,1 мг/кг до 50 мг/кг ваги тіла. Може виявитися зручним уводити потрібну дозу у вигляді двох, трьох, чотирьох або більше субдоз з придатними інтервалами протягом дня. Вказані субдози можуть бути приготовані у вигляді стандартних лікарських форм, наприклад, що містять від 1 до 1000 мг і, зокрема, від 5 до 200 мг активного інгредієнта на стандартну лікарську форму. Точне дозування й частота введення залежать від конкретної використовуваної сполуки формули (I), конкретного стану, підданого лікуванню, важкості стану, підданого лікуванню, віку, ваги, статі, ступеню порушення й загального фізичного стану окремого хворого, а також іншого лікарського засобу, який може приймати індивідуум, що добре відоме фахівцям у даній галузі. Крім того, вочевидь, що вказана ефективна добова кількість може бути знижена або підвищена залежно від відповідної реакції суб'єкта, підданого лікуванню, й/або залежно від оцінки лікаря, що прописує сполуки згідно з даним винаходом. Відмічені вище діапазони ефективної добової кількості, отже, є лише керівними вказівками. В одному варіанті здійснення даного винаходу, винахід пропонує виріб, що містить композицію, яка виявляє ефективність у лікуванні інфекції HCV або в інгібуванні полімерази NS5B вірусу HCV; і пакувальний матеріал, що включає етикетку, на якій вказано, що композиція може бути використана для лікування інфікування вірусом гепатиту С, де композиція містить сполуку формули (I) або будь-яку її підгрупу або комбінацію, описану вище. Інший варіант здійснення даного винаходу стосується набору або контейнеру, що містить сполуку формули (I) або будь-яку її підгрупу в кількості, ефективній для використання як стандарту або засобу в тесті або аналізі для визначення здатності можливих фармацевтичних препаратів інгібувати полімеразу NS5B вірусу HCV, зростання HCV або і те й інше. Даний аспект винаходу може знайти своє застосування в фармацевтичних дослідницьких програмах. Сполуки й комбінації згідно з даним винаходом можуть бути використані у високопродуктивних аналізах мішень, таких як дослідження, спрямовані на вимірювання ефективності вказаної комбінації в лікуванні інфекції HCV. 26 UA 103324 C2 5 Приклади Наступні приклади призначені ілюструвати даний винахід і не обмежувати його. Якщо не вказане інше, очищення синтезованих сполук колонковою хроматографією або флешхроматографією здійснювали на колонці з силікагелем. Приклад 1 – синтез сполуки 1 N N O O S NH O O O N O Стадія 1 O HO O O O O NaOH N O N O O O 1a 10 15 1b Розчин NаOH (6,38 г) у 25 мл води додавали до перемішуваного розчину 1a (10-трет-бутил 6-метил 13-циклогексил-3-метокси-7H-індоло [2,1-а ][2]бензазепін-6,10-дикарбоксилату, синтезованого, як описано в патенті США 2007270406 Al,) у ТГФ (100 мл) і MеOH (150 мл). Через 1 годину реакційну суміш концентрували при зниженому тиску, потім розбавляли охолодженою льодом водою (150 мл). рН отриманого розчину доводили до рН 6 оцтовою кислотою (AсOH). Осад збирали фільтруванням, промивали водою й сушили у вакуумі з + отриманням 1,90 г (98 %) 1b у вигляді жовтуватого порошку: m/z=488 (M+Н) Стадія 2 H2N HO O N O O O HN N O + O O O NH HATU O N O DIPEA, THF 1b 20 25 1c HATU (1,17 г, 3,08 ммоль) додавали в атмосфері азоту до перемішуваного розчину 1b (1,00 г, 2,05 ммоль), DIPEA (1,07 мл, 6,15 ммоль) і 2,2'-оксибіс (N-метилетанаміну) (1,08 г, 8,20 ммоль) у 30 мл сухого ТГФ. Через 1 год., реакцію гасили водою (100 мл), і реакційну суміш екстрагували етилацетатом (EtOAc). Органічний шар послідовно сушили (Na 2SO4), фільтрували й упарювали. Залишок розтирали у воді, фільтрували й сушили з отриманням 1,15 г (93 %) кінцевої сполуки + 1c у вигляді жовтуватого порошку: m/z=602 (M+H) 27 UA 103324 C2 Стадія 3 O O S N H2N HN N O O O S NH2 H2N O O O O N O N O N O O O 1c 5 1d Розчин 1c (1,15 г, 1,91 ммоль) і сульфаміду (1,84 г, 19,1 ммоль) у діоксані (10 мл) нагрівали при 100 в НВЧ-печі протягом 20 хвил. Реакційну суміш охолоджували до кімнатної температури, потім упарювали у вакуумі. Залишок розтирали у воді, фільтрували й промивали водою. Порошок реконструювали в EtOAc, сушили (Na2SO4) і упарювали з отриманням 1,15 г + (88 %) бажаного продукту 1d у вигляді жовтуватого порошку: m/z=681 (M+H) Стадія 4 O O S N H2N N O O F O O F O O S N H2N F O O OH OH N O N N O O O 1d 1e 10 ТФО (3,0 г, 26,3 ммоль) додавали до розчину 1d (1,15 г, 1,70 ммоль) у дихлорметані (3 мл). Через 1 год. реакційну суміш концентрували у вакуумі. Залишок розтирали в ефірі, фільтрували й промивали ефіром, потім очищали хроматографією (градієнт від EtOAc до EtOAc/EtOH, 9:1) з + отриманням 802 мг (76 %) бажаного продукту 1e: m/z=625 (M+H) 15 Стадія 5 O O S N H2N N O O O S N H2N O O N OH N N O O N N O O N O 1e 20 N N O N 1f Карбонілдіімідазол (389 мг, 2,40 ммоль) додавали до перемішуваного розчину 1e (500 мг, 0,80 ммоль) в сухому ТГФ (3 мл). Реакційну суміш перемішували при кімнатній температурі протягом 1 год.: спостерігали повне перетворення на проміжну сполуку 1f. Отриманий розчин упарювали, потім залишок очищали флеш-хроматографією (градієнт від EtOAc до CH3CN від 1:0 до 0:1) з отриманням 550 мг кінцевого продукту 1f, який використовували як такий на + наступній стадії: m/z=675 (M+H) 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMacrocyclic indole derivatives useful as hepatitis c virus inhibitors
Автори англійськоюVendeville, Sandrine, Marie, Helene, Raboisson Pierre Jean-Marie Bernard, Lin, Tse-I, Tahri, Abdellah, Amssoms, Katie, Ingrid, Eduard
Автори російськоюРабуассон Пьер Жан-Мари Бернар
МПК / Мітки
МПК: A61P 31/14, C07D 513/18, A61K 31/55, C07D 515/00
Мітки: вірусу, інгібітори, макроциклічні, індолу, придатні, похідні, гепатиту
Код посилання
<a href="https://ua.patents.su/83-103324-makrociklichni-pokhidni-indolu-pridatni-yak-ingibitori-virusu-gepatitu-s.html" target="_blank" rel="follow" title="База патентів України">Макроциклічні похідні індолу, придатні як інгібітори вірусу гепатиту с</a>
Попередній патент: Спосіб одержання арилкарбоксамідів
Наступний патент: Упаковка для харчових продуктів, яка дозволяє повторне закривання та забезпечує подовжений строк зберігання вмісту
Випадковий патент: Спосіб захисту від механічного стиснення проксимального кінця системи для шунтування шлуночків головного мозку лікворошунтуючими системами типу лшс 2 та лшс 3