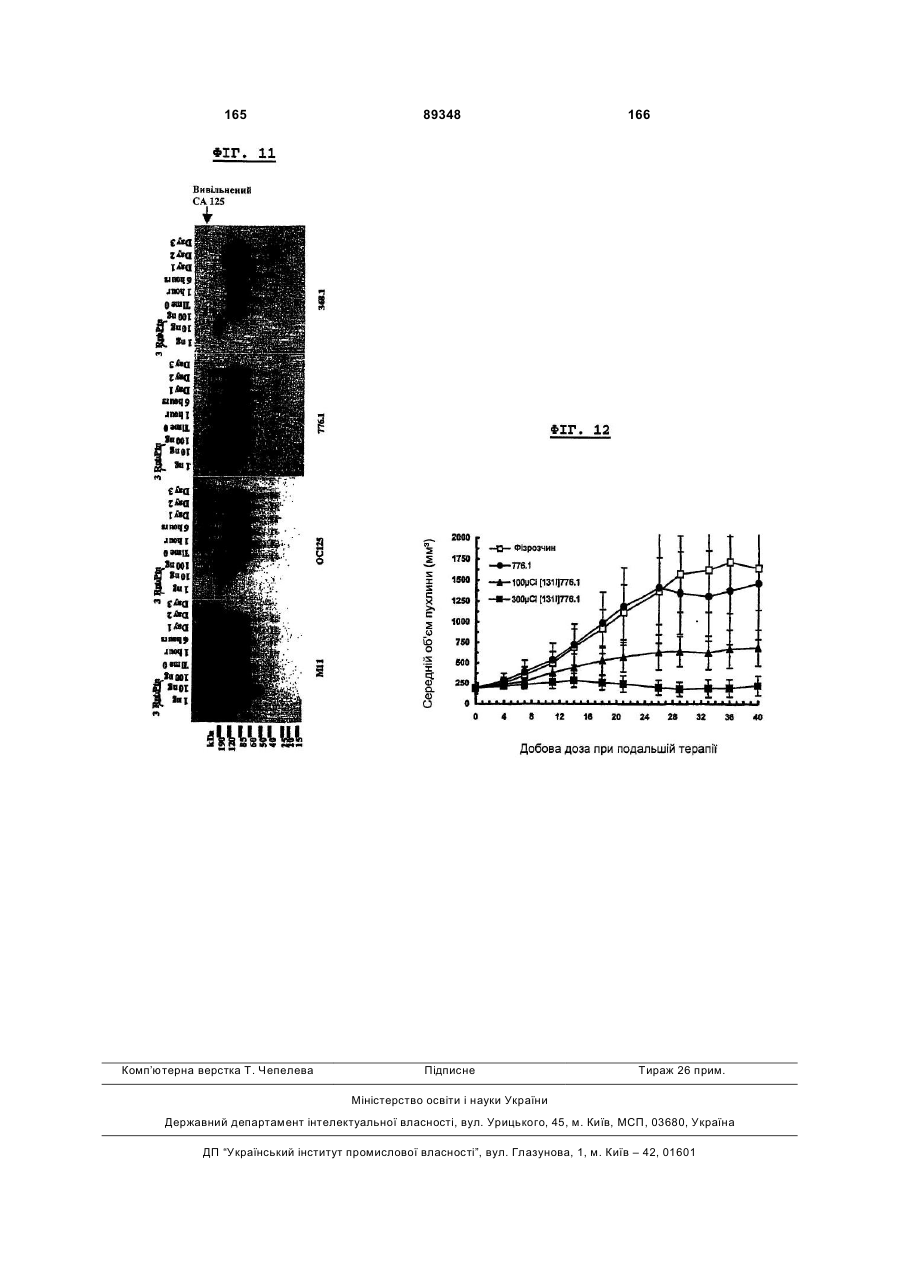
Ізольоване моноклональне антитіло, що зв’язує клітинно-асоційований поліпептид са 125/о772р
Формула / Реферат
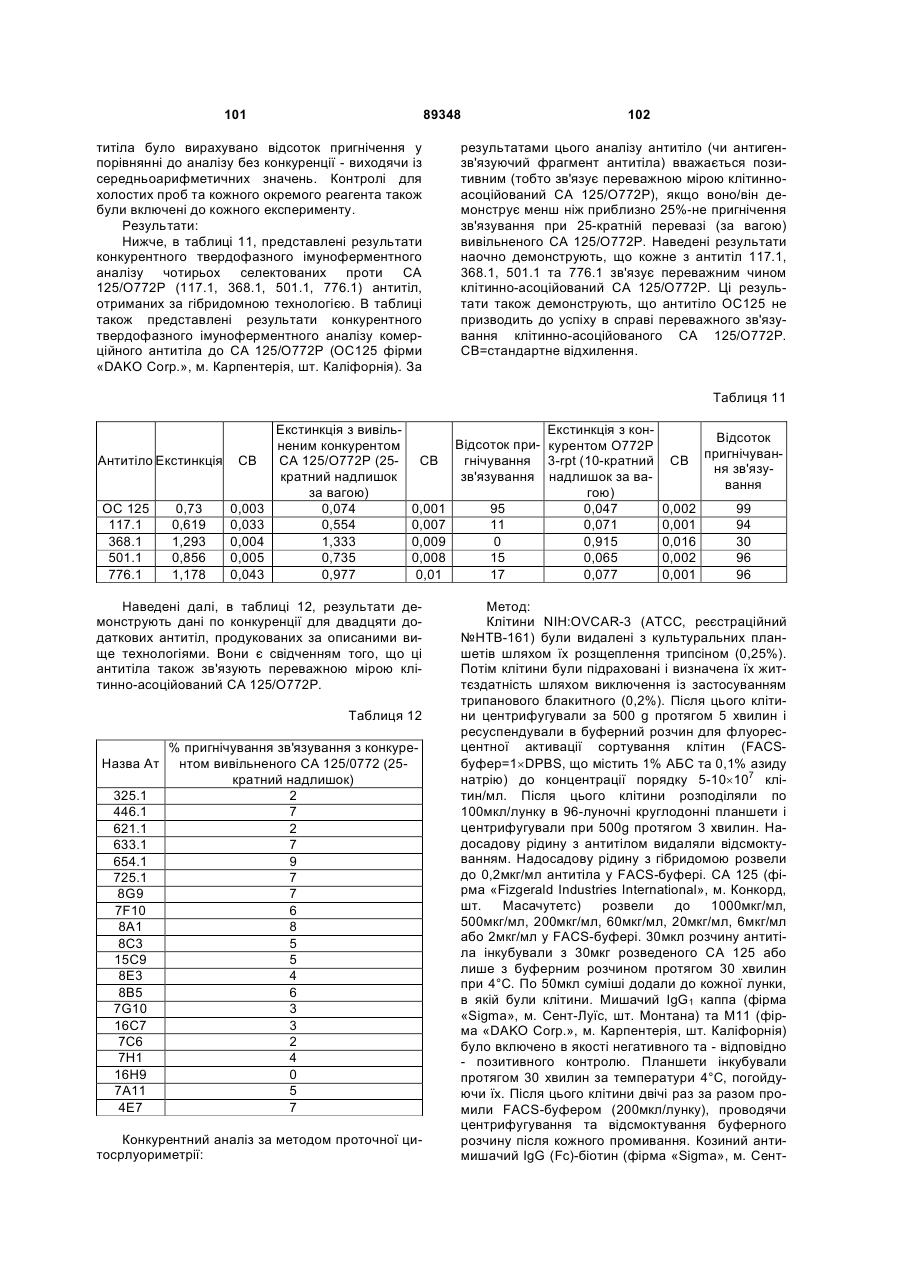
1. Ізольоване моноклональне антитіло або антигензв'язувальний фрагмент антитіла, що зв'язує переважним чином клітинно-асоційований поліпептид СА 125/О772Р, споріднений із вивільненим поліпептидом СА 125/О772Р, де антитіло або антигензв'язувальний фрагмент антитіла зв'язує повторювану ділянку згаданого поліпептиду, представленого амінокислотами 14-452 SEQ ID NO: 1.
2. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або фрагмент антитіла за результатами конкурентного твердофазного імуноферментного аналізу демонструє менше 25 %, менше 20 %, менше 15 %, менше 10 % або менше 5 % пригнічування зв’язування згаданої повторюваної ділянки 1 в присутності 25-кратного (за вагою) надлишку вивільненого СА 125/О772Р над клітинно-асоційованим СА 125/О772Р.
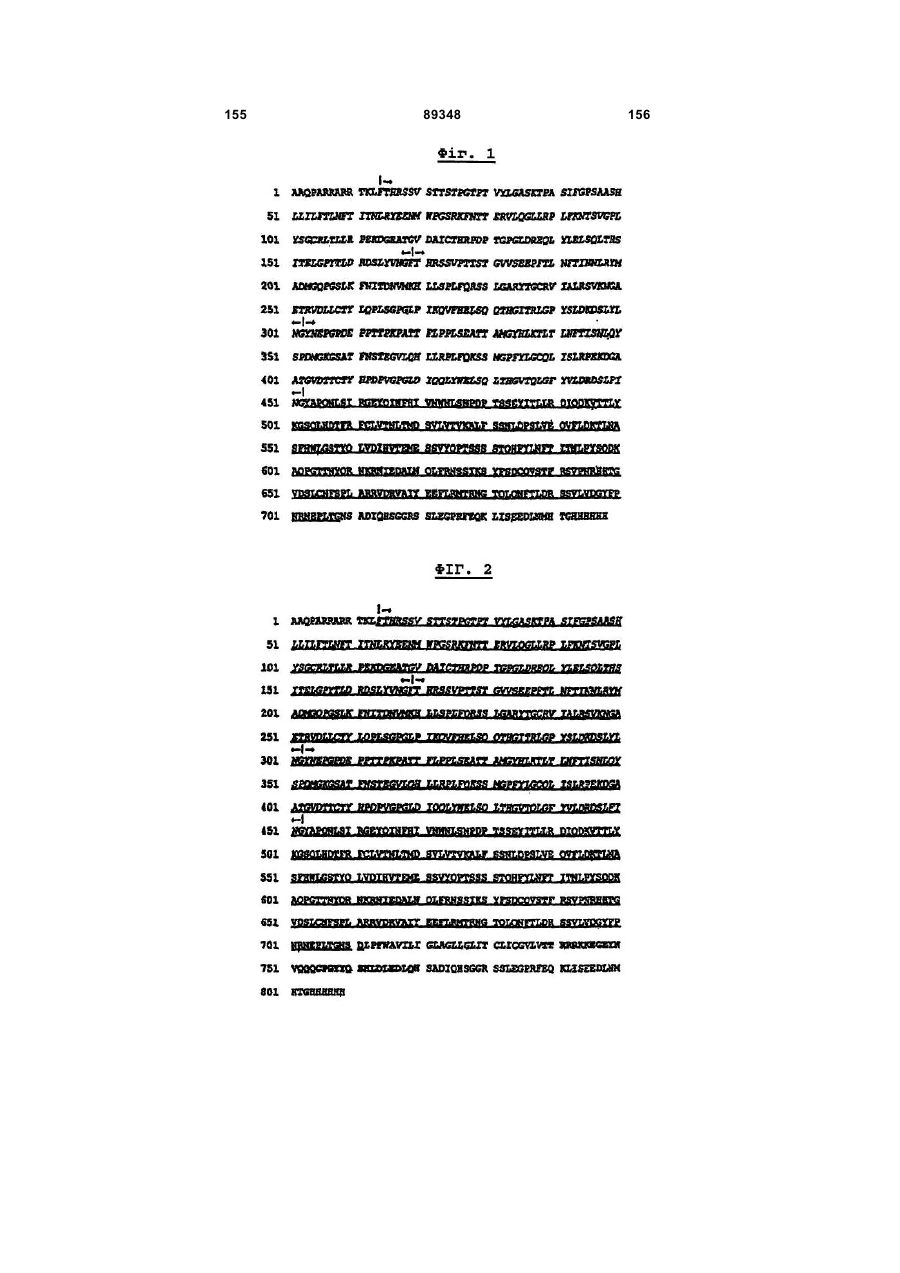
3. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або фрагмент антитіла за результатами аналізу за методом проточної цитофлуориметрії демонструє визначене за відсотком позитивних клітин значення IC50, яке становить щонайменше 0,05 мг/мл, щонайменше 0,25 мг/мл, щонайменше 0,5 мг/мл, щонайменше 0,75 мг/мл або ж щонайменше 1,0 мг/мл вивільненого СА 125/О772Р.
4. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або фрагмент антитіла зв'язує пептид SEQ ID NO: 1, але не зв'язує вивільнений СА 125/О772Р у виявлюваних кількостях.
5. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло є антитілом класу IgG, переважною ізотипом IgG1.
6. Ізольоване антитіло згідно з пунктом 1, в якому антитіло є химерним моноклональним антитілом.
7. Ізольоване антитіло згідно з пунктом 6, в якому химерне моноклональне антитіло включає в себе константну ділянку Cγ1 або константну ділянку Cγ4.
8. Ізольоване антитіло згідно з пунктом 1, в якому антитіло є гуманізованим моноклональним антитілом.
9. Ізольоване антитіло згідно з пунктом 1, в якому антитіло є людським моноклональним антитілом.
10. Ізольоване антитіло згідно з пунктом 1, в якому антитіло є біспецифічним або мультиспецифічним антитілом.
11. Ізольоване антитіло згідно з пунктом 1, в якому антитіло є химерним антитілом.
12. Ізольоване антитіло згідно з пунктом 1, в якому антитіло є одноланцюговим антитілом, Fvs з дисульфідним зв’язком, одноланцюговим Fvs або антиідіотипним антитілом.
13. Антигензв'язувальний фрагмент антитіла згідно з пунктом 1, в якому антигензв'язувальний фрагмент антитіла є Fab-фрагментом, F(ab')2-фрагментом, фрагментом, що включає в себе легколанцюговий (VL) чи важколанцюговий (VH) поліпептид, або ж фрагментом з ділянкою визначення комплементарності (CDR).
14. Моноклональне антитіло згідно з пунктом 1, продуковане гібридомою, що вибирають з групи 4E7 (ATCC®, реєстраційний № PTA-5109), 7A11 (ATCC®, реєстраційний № PTA-5110), 7C6 (ATCC®, реєстраційний № PTA-5111), 7F10 (ATCC®, реєстраційний № PTA-5112), 7G10 (ATCC®, реєстраційний № PTA-5245), 7H1 (ATCC®, реєстраційний № PTA-5114), 8A1 (ATCC®, реєстраційний № PTA-5115), 8B5 (ATCC®, реєстраційний № PTA-5116), 8C3 (ATCC®, реєстраційний № PTA-5246), 8E3 (ATCC®, реєстраційний № PTA-5118), 8G9 (ATCC®, реєстраційний № PTA-5119), 15C9 (ATCC®, реєстраційний № PTA-5106), 16C7 (ATCC®, реєстраційний № PTA-5107), 16H9 (ATCC®, реєстраційний № PTA-5108), 117.1 (ATCC®, реєстраційний № PTA-4567), 325.1 (ATCC®, реєстраційний № PTA-5120), 368.1 (ATCC®, реєстраційний № PTA-4568), 446.1 (ATCC®, реєстраційний № PTA-5549), 501.1 (ATCC®, реєстраційний № PTA-4569), 621.1 (ATCC®, реєстраційний № PTA-5121), 633.1 (ATCC®, реєстраційний № PTA-5122), 654.1 (ATCC®, реєстраційний № PTA-5247), 725.1 (ATCC®, реєстраційний № PTA-5124), або 776.1 (ATCC®, реєстраційний № PTA-4570).
15. Гібридома, що депонована як гібридома, яку вибирають з групи 4E7 (ATCC®, реєстраційний № PTA-5109), 7A11 (ATCC®, реєстраційний № PTA-5110), 7C6 (ATCC®, реєстраційний № PTA-5111), 7F10 (ATCC®, реєстраційний № PTA-5112), 7G10 (ATCC®, реєстраційний № PTA-5245), 7H1 (ATCC®, реєстраційний № PTA-5114), 8A1 (ATCC®, реєстраційний № PTA-5115), 8B5 (ATCC®, реєстраційний № PTA-5116), 8C3 (ATCC®, реєстраційний № PTA-5246), 8E3 (ATCC®, реєстраційний № PTA-5118), 8G9 (ATCC®, реєстраційний № PTA-5119), 15C9 (ATCC®, реєстраційний № PTA-5106), 16C7 (ATCC®, реєстраційний № PTA-5107), 16H9 (ATCC®, реєстраційний № PTA-5108), 117.1 (ATCC®, реєстраційний № PTA-4567), 325.1 (ATCC®, реєстраційний № PTA-5120), 368.1 (ATCC®, реєстраційний № PTA-4568), 446.1 (ATCC®, реєстраційний № PTA-5549), 501.1 (ATCC®, реєстраційний № PTA-4569), 621.1 (ATCC®, реєстраційний № PTA-5121), 633.1 (ATCC®, реєстраційний № PTA-5122), 654.1 (ATCC®, реєстраційний № PTA-5247), 725.1 (ATCC®, реєстраційний № PTA-5124), або 776.1 (ATCC®, реєстраційний № PTA-4570), і продукує антитіло згідно з пунктом 1.
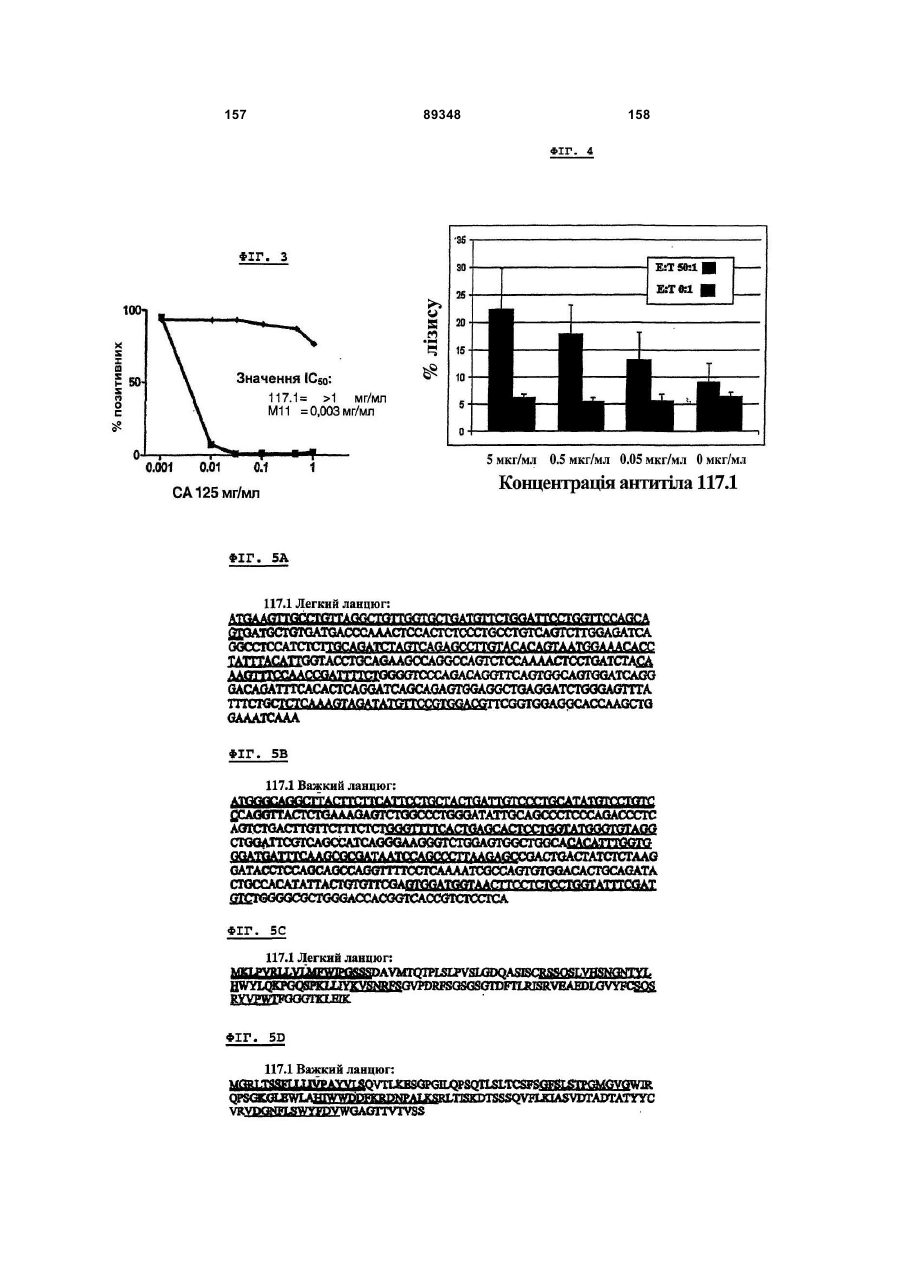
16. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або антигензв'язувальний фрагмент антитіла включає в себе легколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:27, SEQ ID NO:29, SEQ ID NO:31, SEQ ID NO:33, SEQ ID NO:54 або SEQ ID NO:56.
17. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або антигензв'язувальний фрагмент антитіла включає в себе важколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:32, SEQ ID NO:34, SEQ ID NO:53 або SEQ ID NO:55.
18. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з будь-яким з пунктів 16-17, в якому антитіло або антигензв'язувальний фрагмент антитіла включає в себе легколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:27, та важколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:28.
19. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з будь-яким з пунктів 16-17, в якому антитіло або антигензв'язувальний фрагмент антитіла включає в себе легколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:29, та важколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:30.
20. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з будь-яким з пунктів 16-17, в якому антитіло або антигензв'язувальний фрагмент антитіла включає в себе легколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:31, та важколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:32.
21. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з будь-яким з пунктів 16-17, в якому антитіло або антигензв’язувальний фрагмент антитіла включає в себе легколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:33, та важколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:34.
22. Ізольоване антитіло або антигензв’язувальний фрагмент антитіла згідно з будь-яким з пунктів 16-17, в якому антитіло або антигензв’язувальний фрагмент антитіла включає в себе легколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:54, та важколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:53.
23. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з будь-яким з пунктів 16-17, в якому антитіло або антигензв’язувальний фрагмент антитіла включає в себе легколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:56, та важколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:55.
24. Ізольована молекула нуклеїнової кислоти, котра включає в себе нуклеотидну послідовність, в якій закодована варіабельна ланцюгова ділянка антитіла або антигензв'язувального фрагмента антитіла згідно з будь-яким із пунктів 16 або 17.
25. Молекула нуклеїнової кислоти згідно з пунктом 24, в якій молекула нуклеїнової кислоти включає в себе нуклеотидну послідовність SEQ ID NO:35, 36, 37, 38 ,39, 40, 41, 42, 52, 57, 58 або 59.
26. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або антигензв'язувальний фрагмент антитіла зв'язує пептид SEQ ID NO: 1 із Kd, що менше 100 нМ, менше 10 нМ, менше 1 нМ, менше 100 пМ або менше 10 пМ - за результатами визначення афінності за методикою BIAcore.
27. Антитіло або антигензв'язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або антигензв'язувальний фрагмент антитіла модифіковано шляхом амінокислотної заміни, вставки, делеції або їх комбінації та має таку ж саму або підвищену афінність до клітинно-асоційованого СА 125/O772P порівняно з афінністю відповідного не модифікованого антитіла чи антигензв'язувального фрагмента антитіла.
28. Ізольоване антитіло або антигензв’язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або антигензв’язувальний фрагмент антитіла модифіковано шляхом амінокислотної заміни, вставки, делеції або їх комбінації та в якому антитіло або антигензв’язувальний фрагмент антитіла демонструє такий же самий або більший період напіввиведення з сироватки порівняно з відповідним не модифікованим антитілом або антигензв’язувальним фрагментом антитіла.
29. Ізольоване антитіло або антигензв’язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або фрагмент антитіла сприяє лізису СА 125/О772Р-позитивної пухлинної клітини в аналізі на антитілозалежну клітинно-опосередковану цитотоксичність.
30. Ізольоване антитіло або антигензв’язувальний фрагмент антитіла згідно з пунктом 29, в якому антитіло або антигензв’язувальний фрагмент антитіла сприяє лізису щонайменше 10 % СА 125/О772Р-позитивної пухлинної клітини в аналізі на антитілозалежну клітинно-опосередковану цитотоксичність при співвідношенні ефектор:мішень 50:1, при співвідношенні ефектор:мішень 25:1 або при співвідношенні ефектор:мішень 12,5:1 та концентрації в 5,0 мкг антитіла або його антигензв’язувального фрагмента на 1 мл.
31. Ізольоване антитіло або антигензв’язувальний фрагмент антитіла згідно з пунктом 29, в якому антитіло або фрагмент антитіла сприяє лізису щонайменше 10% СА 125/О772Р-позитивної пухлинної клітини в аналізі на антитілозалежну клітинно-опосередковану цитотоксичність при співвідношенні ефектор:мішень 12,5:1 та концентрації в 50 нг антитіла або його антигензв’язувального фрагмента на 1 мл.
32. Ізольоване антитіло або антигензв’язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або фрагмент антитіла сприяє лізису СА 125/О772Р-позитивної пухлинної клітини в аналізі на комплементзалежну цитотоксичність.
33. Ізольоване антитіло або антигензв’язувальний фрагмент антитіла згідно з пунктом 34, в якому антитіло або фрагмент антитіла сприяє лізису від щонайменше 15 % при 5 мкг/мл антитіла чи антигензв’язувального фрагмента антитіла до 95 % при 0,1 мкг/мл антитіла чи антигензв’язувального фрагмента антитіла.
34. Ізольоване антитіло або антигензв’язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або фрагмент антитіла пригнічує ріст СА 125/О772Р-позитивної пухлини.
35. Фармацевтична композиція, до складу якої входить моноклональне антитіло або антигензв’язувальний фрагмент моноклонального антитіла згідно з пунктом 1 та фармацевтично прийнятний носій.
36. Промисловий виріб, що включає в себе пакувальний матеріал та фармацевтичну композицію згідно з пунктом 35, яка знаходиться всередині пакувального матеріалу, причому згадана фармацевтична композиція знаходиться у формі, придатній для введення в організм суб’єкта.
37. Злитий поліпептид, до складу якого входить антитіло або антигензв’язувальний фрагмент антитіла згідно з пунктом 1, оперативно зв’язаний з гетерологічним агентом.
38. Спосіб сприяння розпізнаванню моноклонального антитіла або антигензв'язувального фрагмента антитіла згідно з пунктом 1, який полягає у:
(a) інкубуванні антитіла чи антигензв’язувального фрагмента антитіла з пептидом, до складу якого входить клітинно-асоційований СА 125/О772Р, у присутності вивільненого СА 125/О772Р за умов, що уможливлюють зв’язування антитіла або антигензв’язувального фрагмента антитіла з вказаним пептидом, до складу якого входить клітинно-асоційований СА 125/О772Р, або з вивільненим СА 125/О772Р;
(b) видаленні вивільненого СА 125/О772Р та антитіла або антигензв’язувального фрагмента антитіла, що залишилися незв’язаними з вказаним пептидом, до складу якого входить клітинно-асоційований СА 125/О772Р;
(c) вимірюванні кількості антитіла або антигензв’язувального фрагмента антитіла, що зв’язалися з вказаним пептидом, до складу якого входить клітинно-асоційований СА 125/О772Р; а також
(d) порівнянні кількості, визначеної в підпункті (с), із кількістю антитіла або антигензв’язувального фрагмента антитіла, що зв’язалися з вказаним пептидом, до складу якого входить клітинно-асоційований СА 125/О772Р, за відсутності вивільненого СА 125/О772Р.
39. Спосіб згідно з пунктом 38, у якому пептид, до складу якого входить клітинно-асоційований СА 125/О772Р, іммобілізований на твердій поверхні.
40. Спосіб згідно з пунктом 39, у якому спосіб реалізовується у форматі твердофазного імуноферментного аналізу.
41. Спосіб згідно з пунктом 38, у якому вивільнений СА 125/О772Р та пептид, що включає в себе клітинно-асоційований СА 125/О772Р, наявні у співвідношенні 25:1 (за вагою) вивільненого СА 125/О772Р у порівнянні з пептидом, до складу якого входить клітинно-асоційований СА 125/О772Р.
42. Спосіб сприяння розпізнаванню моноклонального антитіла або антигензв’язувального фрагмента антитіла згідно з пунктом 1, який полягає у:
(a) контактуванні антитіла чи антигензв’язувального фрагмента антитіла з пептидом, до складу якого входить клітинно-асоційований СА 125/О772Р, у присутності вивільненого СА 125/О772Р за умов, що уможливлюють зв’язування пептиду, що включає в себе клітинно-асоційований СА 125/О772Р, з антитілом або антигензв’язувальним фрагментом антитіла;
(b) видаленні пептиду, що залишився незв’язаним, до складу якого входить клітинно-асоційований СА 125/О772Р;
(c) вимірюванні кількості пептиду, до складу якого входить клітинно-асоційований СА 125/О772Р, що зв’язався з антитілом або антигензв’язувальним фрагментом антитіла, а також
(d) порівнянні кількості, визначеної в підпункті (с), із кількістю антитіла пептиду, до складу якого входить клітинно-асоційований СА 125/О772Р, антитіла або антигензв’язувального фрагмента антитіла, що зв’язалися за відсутності вивільненого СА 125/О772Р.
43. Спосіб згідно з пунктом 42, у якому вивільненого СА 125/О772Р у 25 разів (за вагою) більше.
44. Спосіб згідно з пунктом 42, у якому антитіло або антигензв’язувальний фрагмент антитіла іммобілізовано на твердій поверхні.
45. Спосіб згідно з пунктом 44, у якому спосіб реалізовується у форматі твердофазного імуноферментного аналізу.
46. Спосіб сприяння розпізнаванню моноклонального антитіла або антигензв’язувального фрагмента антитіла згідно з пунктом 1, який полягає у:
(a) контактуванні антитіла чи антигензв’язувального фрагмента антитіла з клітиною, що експресує СА 125/О772Р, у присутності певної кількості вивільненого СА 125/О772Р за умов, що уможливлюють зв’язування СА 125/О772Р з антитілом або антигензв’язувальним фрагментом антитіла;
(b) видаленні клітин, що залишилися не зв’язаними;
(c) визначенні кількості СА 125/О772Р-експресуючих клітин, що зв’язалися з антитілом або його антигензв’язувальним фрагментом, а також
(d) порівнянні кількості, визначеної в підпункті (с), із кількістю СА 125/О772Р-експресуючих клітин, що зв’язують антитіло або антигензв’язувальний фрагмент антитіла за відсутності вказаної кількості вивільненого СА 125/О772Р.
47. Спосіб згідно з пунктом 46, у якому кількість вивільненого СА 125/О772Р складає щонайменше 0,5 мг/мл.
48. Спосіб згідно з пунктом 46, у якому визначення виконують за методом проточної цитофлуориметрії або методом флуоресцентно активованого сортування клітин.
49. Гібридома, яка здатна секретувати антитіло згідно з пунктом 1.
50. Ізольоване антитіло або його антигензв’язувальний фрагмент згідно з пунктом 1 у вигляді кон’югата з цитотоксичним агентом.
51. Ізольоване антитіло або його антигензв’язувальний фрагмент згідно з пунктом 50, в якому цитотоксичний агент є радіоізотопом.
52. Ізольоване антитіло або його антигензв’язувальний фрагмент згідно з пунктом 51, в якому радіоізотоп вибирають із групи, до якої входять 125I, 131I, 111In, 99mTc та 90Y.
53. Моноклональне антитіло згідно з пунктом 14 або 15 у вигляді кон’югата з цитотоксичним агентом.
54. Моноклональне антитіло згідно з пунктом 53, в якому цитотоксичний агент є радіоізотопом.
55. Моноклональне антитіло згідно з пунктом 54, в якому радіоізотоп вибирають із групи, до якої входять 125I, 131I, 111In, 99mTc та 90Y.
56. Фармацевтична композиція згідно з пунктом 35, в якій антитіло або його антигензв’язувальний фрагмент знаходяться у вигляді кон’югата з цитотоксичним агентом.
57. Фармацевтична композиція згідно з пунктом 56, в якій цитотоксичний агент є радіоізотопом.
58. Фармацевтична композиція згідно з пунктом 57, в якій радіоізотоп вибирають із групи, до якої входять 125I, 131I, 111In, 99mTc та 90Y.
59. Моноклональне антитіло згідно з пунктом 1, вибране з групи, до складу якої входять 325.1 (ATCC®, реєстраційний № PTA-5120), 621.1 (ATCC®, реєстраційний № PTA-5121), 633.1 (ATCC®, реєстраційний № PTA-5122), 654.1 (ATCC®, реєстраційний № PTA-5247), 725.1 (ATCC®, реєстраційний № PTA-5124), 8G9 (ATCC®, реєстраційний № PTA-5119), 7F10 (ATCC®, реєстраційний № PTA-5112), 8A1 (ATCC®, реєстраційний № PTA-5115), 8C3 (ATCC®, реєстраційний № PTA-5246), 15C9 (ATCC®, реєстраційний № PTA-5106), 8E3 (ATCC®, реєстраційний № PTA-5246), 8B5 (ATCC®, реєстраційний № PTA-5116), 7G10 (ATCC®, реєстраційний № PTA-5145), 16C7 (ATCC®, реєстраційний № PTA-5107), 7C6 (ATCC®, реєстраційний № PTA-5111), 7H1 (ATCC®, реєстраційний № PTA-5114), 16H9 (ATCC®, реєстраційний № PTA-5108), 7A11 (ATCC®, реєстраційний № PTA-5110), 4E7 (ATCC®, реєстраційний № PTA-5109), 117.1 (ATCC®, реєстраційний № PTA-4567), 368.1 (ATCC®, реєстраційний № PTA-4568), 446.1 (ATCC®, реєстраційний № PTA-5540), 501.1 (ATCC®, реєстраційний № PTA-4509) та 776.1 (ATCC®, реєстраційний № PTA-4570), або його антигензв’язувальний фрагмент.
60. Фармацевтична композиція, до складу якої входять моноклональне антитіло згідно з пунктом 59 або його антигензв’язувальний фрагмент і фармацевтично прийнятний носій.
61. Застосування моноклонального антитіла або антигензв’язувального фрагмента антитіла згідно з пунктом 1 для виготовлення лікувального засобу для лікування СА 125/О772Р-асоційованого розладу.
62. Застосування згідно з пунктом 61, в якому СА 125/О772Р-асоційований розлад є розладом проліферації клітин.
63. Застосування згідно з пунктом 61, в якому антитіло вибирають з групи, до складу якої входять 325.1 (ATCC®, реєстраційний № PTA-5120), 621.1 (ATCC®, реєстраційний № PTA-5121), 633.1 (ATCC®, реєстраційний № PTA-5122), 654.1 (ATCC®, реєстраційний № PTA-5247), 725.1 (ATCC®, реєстраційний № PTA-5124), 8G9 (ATCC®, реєстраційний № PTA-5119), 7F10 (ATCC®, реєстраційний № PTA-5112), 8A1 (ATCC®, реєстраційний № PTA-5115), 8C3 (ATCC®, реєстраційний № PTA-5246), 15C9 (ATCC®, реєстраційний № PTA-5106), 8E3 (ATCC®, реєстраційний № PTA-5246), 8B5 (ATCC®, реєстраційний № PTA-5116), 7G10 (ATCC®, реєстраційний № PTA-5145), 16C7 (ATCC®, реєстраційний № PTA-5107), 7C6 (ATCC®, реєстраційний № PTA-5111), 7H1 (ATCC®, реєстраційний № PTA-5114), 16H9 (ATCC®, реєстраційний № PTA-5108), 7A11 (ATCC®, реєстраційний № PTA-5110), 4E7 (ATCC®, реєстраційний № PTA-5109), 117.1 (ATCC®, реєстраційний № PTA-4567), 368.1 (ATCC®, реєстраційний № PTA-4568), 446.1 (ATCC®, реєстраційний № PTA-5540), 501.1 (ATCC®, реєстраційний № PTA-4509) та 776.1 (ATCC®, реєстраційний № PTA-4570).
64. Застосування згідно з будь-яким з пунктів 61-63, в якому антитіло чи його антигензв’язувальний фрагмент кон’юговано з цитотоксичним агентом.
Текст
1. Ізольоване моноклональне антитіло або антигензв'язувальний фрагмент антитіла, що зв'язує переважним чином клітинно-асоційований поліпептид СА 125/О772Р, споріднений із вивільненим поліпептидом СА 125/О772Р, де антитіло або антигензв'язувальний фрагмент антитіла зв'язує повторювану ділянку згаданого поліпептиду, представленого амінокислотами 14-452 SEQ ID NO: 1. 2 (19) 1 3 11. Ізольоване антитіло згідно з пунктом 1, в якому антитіло є химерним антитілом. 12. Ізольоване антитіло згідно з пунктом 1, в якому антитіло є одноланцюговим антитілом, Fvs з дисульфідним зв’язком, одноланцюговим Fvs або антиідіотипним антитілом. 13. Антигензв'язувальний фрагмент антитіла згідно з пунктом 1, в якому антигензв'язувальний фрагмент антитіла є Fab-фрагментом, F(ab')2фрагментом, фрагментом, що включає в себе легколанцюговий (VL) чи важколанцюговий (VH) поліпептид, або ж фрагментом з ділянкою визначення комплементарності (CDR). 14. Моноклональне антитіло згідно з пунктом 1, продуковане гібридомою, що вибирають з групи 4E7 (ATCC®, реєстраційний № PTA-5109), 7A11 (ATCC®, реєстраційний № PTA-5110), 7C6 (ATCC®, реєстраційний № PTA-5111), 7F10 (ATCC®, реєстраційний № PTA-5112), 7G10 (ATCC®, реєстраційний № PTA-5245), 7H1 (ATCC®, реєстраційний № PTA-5114), 8A1 (ATCC®, реєстраційний № PTA5115), 8B5 (ATCC®, реєстраційний № PTA-5116), 8C3 (ATCC®, реєстраційний № PTA-5246), 8E3 (ATCC®, реєстраційний № PTA-5118), 8G9 (ATCC®, реєстраційний № PTA-5119), 15C9 (ATCC®, реєстраційний № PTA-5106), 16C7 (ATCC®, реєстраційний № PTA-5107), 16H9 (ATCC®, реєстраційний № PTA-5108), 117.1 (ATCC®, реєстраційний № PTA4567), 325.1 (ATCC®, реєстраційний № PTA-5120), 368.1 (ATCC®, реєстраційний № PTA-4568), 446.1 (ATCC®, реєстраційний № PTA-5549), 501.1 (ATCC®, реєстраційний № PTA-4569), 621.1 (ATCC®, реєстраційний № PTA-5121), 633.1 (ATCC®, реєстраційний № PTA-5122), 654.1 (ATCC®, реєстраційний № PTA-5247), 725.1 (ATCC®, реєстраційний № PTA-5124), або 776.1 (ATCC®, реєстраційний № PTA-4570). 15. Гібридома, що депонована як гібридома, яку вибирають з групи 4E7 (ATCC®, реєстраційний № PTA-5109), 7A11 (ATCC®, реєстраційний № PTA5110), 7C6 (ATCC®, реєстраційний № PTA-5111), 7F10 (ATCC®, реєстраційний № PTA-5112), 7G10 (ATCC®, реєстраційний № PTA-5245), 7H1 (ATCC®, реєстраційний № PTA-5114), 8A1 (ATCC®, реєстраційний № PTA-5115), 8B5 (ATCC®, реєстраційний № PTA-5116), 8C3 (ATCC®, реєстраційний № PTA-5246), 8E3 (ATCC®, реєстраційний № PTA5118), 8G9 (ATCC®, реєстраційний № PTA-5119), 15C9 (ATCC®, реєстраційний № PTA-5106), 16C7 (ATCC®, реєстраційний № PTA-5107), 16H9 (ATCC®, реєстраційний № PTA-5108), 117.1 (ATCC®, реєстраційний № PTA-4567), 325.1 (ATCC®, реєстраційний № PTA-5120), 368.1 (ATCC®, реєстраційний № PTA-4568), 446.1 (ATCC®, реєстраційний № PTA-5549), 501.1 (ATCC®, реєстраційний № PTA-4569), 621.1 (ATCC®, реєстраційний № PTA-5121), 633.1 (ATCC®, реєстраційний № PTA-5122), 654.1 (ATCC®, реєстраційний № PTA-5247), 725.1 (ATCC®, реєстраційний № PTA-5124), або 776.1 (ATCC®, реєстраційний № PTA-4570), і продукує антитіло згідно з пунктом 1. 16. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або антигензв'язувальний фрагмент антиті 89348 4 ла включає в себе легколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:27, SEQ ID NO:29, SEQ ID NO:31, SEQ ID NO:33, SEQ ID NO:54 або SEQ ID NO:56. 17. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або антигензв'язувальний фрагмент антитіла включає в себе важколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:32, SEQ ID NO:34, SEQ ID NO:53 або SEQ ID NO:55. 18. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з будь-яким з пунктів 1617, в якому антитіло або антигензв'язувальний фрагмент антитіла включає в себе легколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:27, та важколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:28. 19. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з будь-яким з пунктів 1617, в якому антитіло або антигензв'язувальний фрагмент антитіла включає в себе легколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:29, та важколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:30. 20. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з будь-яким з пунктів 1617, в якому антитіло або антигензв'язувальний фрагмент антитіла включає в себе легколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:31, та важколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:32. 21. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з будь-яким з пунктів 1617, в якому антитіло або антигензв’язувальний фрагмент антитіла включає в себе легколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:33, та важколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:34. 22. Ізольоване антитіло або антигензв’язувальний фрагмент антитіла згідно з будь-яким з пунктів 1617, в якому антитіло або антигензв’язувальний фрагмент антитіла включає в себе легколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:54, та важколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:53. 23. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з будь-яким з пунктів 1617, в якому антитіло або антигензв’язувальний фрагмент антитіла включає в себе легколанцюгову варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:56, та важколанцюгову варіабельну ділянку, до 5 складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:55. 24. Ізольована молекула нуклеїнової кислоти, котра включає в себе нуклеотидну послідовність, в якій закодована варіабельна ланцюгова ділянка антитіла або антигензв'язувального фрагмента антитіла згідно з будь-яким із пунктів 16 або 17. 25. Молекула нуклеїнової кислоти згідно з пунктом 24, в якій молекула нуклеїнової кислоти включає в себе нуклеотидну послідовність SEQ ID NO:35, 36, 37, 38 ,39, 40, 41, 42, 52, 57, 58 або 59. 26. Ізольоване антитіло або антигензв'язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або антигензв'язувальний фрагмент антитіла зв'язує пептид SEQ ID NO: 1 із Kd, що менше 100 нМ, менше 10 нМ, менше 1 нМ, менше 100 пМ або менше 10 пМ - за результатами визначення афінності за методикою BIAcore. 27. Антитіло або антигензв'язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або антигензв'язувальний фрагмент антитіла модифіковано шляхом амінокислотної заміни, вставки, делеції або їх комбінації та має таку ж саму або підвищену афінність до клітинно-асоційованого СА 125/O772P порівняно з афінністю відповідного не модифікованого антитіла чи антигензв'язувального фрагмента антитіла. 28. Ізольоване антитіло або антигензв’язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або антигензв’язувальний фрагмент антитіла модифіковано шляхом амінокислотної заміни, вставки, делеції або їх комбінації та в якому антитіло або антигензв’язувальний фрагмент антитіла демонструє такий же самий або більший період напіввиведення з сироватки порівняно з відповідним не модифікованим антитілом або антигензв’язувальним фрагментом антитіла. 29. Ізольоване антитіло або антигензв’язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або фрагмент антитіла сприяє лізису СА 125/О772Р-позитивної пухлинної клітини в аналізі на антитілозалежну клітинно-опосередковану цитотоксичність. 30. Ізольоване антитіло або антигензв’язувальний фрагмент антитіла згідно з пунктом 29, в якому антитіло або антигензв’язувальний фрагмент антитіла сприяє лізису щонайменше 10 % СА 125/О772Р-позитивної пухлинної клітини в аналізі на антитілозалежну клітинно-опосередковану цитотоксичність при співвідношенні ефектор:мішень 50:1, при співвідношенні ефектор:мішень 25:1 або при співвідношенні ефектор:мішень 12,5:1 та концентрації в 5,0 мкг антитіла або його антигензв’язувального фрагмента на 1 мл. 31. Ізольоване антитіло або антигензв’язувальний фрагмент антитіла згідно з пунктом 29, в якому антитіло або фрагмент антитіла сприяє лізису щонайменше 10% СА 125/О772Р-позитивної пухлинної клітини в аналізі на антитілозалежну клітинноопосередковану цитотоксичність при співвідношенні ефектор:мішень 12,5:1 та концентрації в 50 нг антитіла або його антигензв’язувального фрагмента на 1 мл. 32. Ізольоване антитіло або антигензв’язувальний фрагмент антитіла згідно з пунктом 1, в якому ан 89348 6 титіло або фрагмент антитіла сприяє лізису СА 125/О772Р-позитивної пухлинної клітини в аналізі на комплементзалежну цитотоксичність. 33. Ізольоване антитіло або антигензв’язувальний фрагмент антитіла згідно з пунктом 34, в якому антитіло або фрагмент антитіла сприяє лізису від щонайменше 15 % при 5 мкг/мл антитіла чи антигензв’язувального фрагмента антитіла до 95 % при 0,1 мкг/мл антитіла чи антигензв’язувального фрагмента антитіла. 34. Ізольоване антитіло або антигензв’язувальний фрагмент антитіла згідно з пунктом 1, в якому антитіло або фрагмент антитіла пригнічує ріст СА 125/О772Р-позитивної пухлини. 35. Фармацевтична композиція, до складу якої входить моноклональне антитіло або антигензв’язувальний фрагмент моноклонального антитіла згідно з пунктом 1 та фармацевтично прийнятний носій. 36. Промисловий виріб, що включає в себе пакувальний матеріал та фармацевтичну композицію згідно з пунктом 35, яка знаходиться всередині пакувального матеріалу, причому згадана фармацевтична композиція знаходиться у формі, придатній для введення в організм суб’єкта. 37. Злитий поліпептид, до складу якого входить антитіло або антигензв’язувальний фрагмент антитіла згідно з пунктом 1, оперативно зв’язаний з гетерологічним агентом. 38. Спосіб сприяння розпізнаванню моноклонального антитіла або антигензв'язувального фрагмента антитіла згідно з пунктом 1, який полягає у: (a) інкубуванні антитіла чи антигензв’язувального фрагмента антитіла з пептидом, до складу якого входить клітинно-асоційований СА 125/О772Р, у присутності вивільненого СА 125/О772Р за умов, що уможливлюють зв’язування антитіла або антигензв’язувального фрагмента антитіла з вказаним пептидом, до складу якого входить клітинноасоційований СА 125/О772Р, або з вивільненим СА 125/О772Р; (b) видаленні вивільненого СА 125/О772Р та антитіла або антигензв’язувального фрагмента антитіла, що залишилися незв’язаними з вказаним пептидом, до складу якого входить клітинноасоційований СА 125/О772Р; (c) вимірюванні кількості антитіла або антигензв’язувального фрагмента антитіла, що зв’язалися з вказаним пептидом, до складу якого входить клітинно-асоційований СА 125/О772Р; а також (d) порівнянні кількості, визначеної в підпункті (с), із кількістю антитіла або антигензв’язувального фрагмента антитіла, що зв’язалися з вказаним пептидом, до складу якого входить клітинноасоційований СА 125/О772Р, за відсутності вивільненого СА 125/О772Р. 39. Спосіб згідно з пунктом 38, у якому пептид, до складу якого входить клітинно-асоційований СА 125/О772Р, іммобілізований на твердій поверхні. 40. Спосіб згідно з пунктом 39, у якому спосіб реалізовується у форматі твердофазного імуноферментного аналізу. 41. Спосіб згідно з пунктом 38, у якому вивільнений СА 125/О772Р та пептид, що включає в себе 7 клітинно-асоційований СА 125/О772Р, наявні у співвідношенні 25:1 (за вагою) вивільненого СА 125/О772Р у порівнянні з пептидом, до складу якого входить клітинно-асоційований СА 125/О772Р. 42. Спосіб сприяння розпізнаванню моноклонального антитіла або антигензв’язувального фрагмента антитіла згідно з пунктом 1, який полягає у: (a) контактуванні антитіла чи антигензв’язувального фрагмента антитіла з пептидом, до складу якого входить клітинно-асоційований СА 125/О772Р, у присутності вивільненого СА 125/О772Р за умов, що уможливлюють зв’язування пептиду, що включає в себе клітинноасоційований СА 125/О772Р, з антитілом або антигензв’язувальним фрагментом антитіла; (b) видаленні пептиду, що залишився незв’язаним, до складу якого входить клітинно-асоційований СА 125/О772Р; (c) вимірюванні кількості пептиду, до складу якого входить клітинно-асоційований СА 125/О772Р, що зв’язався з антитілом або антигензв’язувальним фрагментом антитіла, а також (d) порівнянні кількості, визначеної в підпункті (с), із кількістю антитіла пептиду, до складу якого входить клітинно-асоційований СА 125/О772Р, антитіла або антигензв’язувального фрагмента антитіла, що зв’язалися за відсутності вивільненого СА 125/О772Р. 43. Спосіб згідно з пунктом 42, у якому вивільненого СА 125/О772Р у 25 разів (за вагою) більше. 44. Спосіб згідно з пунктом 42, у якому антитіло або антигензв’язувальний фрагмент антитіла іммобілізовано на твердій поверхні. 45. Спосіб згідно з пунктом 44, у якому спосіб реалізовується у форматі твердофазного імуноферментного аналізу. 46. Спосіб сприяння розпізнаванню моноклонального антитіла або антигензв’язувального фрагмента антитіла згідно з пунктом 1, який полягає у: (a) контактуванні антитіла чи антигензв’язувального фрагмента антитіла з клітиною, що експресує СА 125/О772Р, у присутності певної кількості вивільненого СА 125/О772Р за умов, що уможливлюють зв’язування СА 125/О772Р з антитілом або антигензв’язувальним фрагментом антитіла; (b) видаленні клітин, що залишилися не зв’язаними; (c) визначенні кількості СА 125/О772Рекспресуючих клітин, що зв’язалися з антитілом або його антигензв’язувальним фрагментом, а також (d) порівнянні кількості, визначеної в підпункті (с), із кількістю СА 125/О772Р-експресуючих клітин, що зв’язують антитіло або антигензв’язувальний фрагмент антитіла за відсутності вказаної кількості вивільненого СА 125/О772Р. 47. Спосіб згідно з пунктом 46, у якому кількість вивільненого СА 125/О772Р складає щонайменше 0,5 мг/мл. 48. Спосіб згідно з пунктом 46, у якому визначення виконують за методом проточної цитофлуориметрії або методом флуоресцентно активованого сортування клітин. 89348 8 49. Гібридома, яка здатна секретувати антитіло згідно з пунктом 1. 50. Ізольоване антитіло або його антигензв’язувальний фрагмент згідно з пунктом 1 у вигляді кон’югата з цитотоксичним агентом. 51. Ізольоване антитіло або його антигензв’язувальний фрагмент згідно з пунктом 50, в якому цитотоксичний агент є радіоізотопом. 52. Ізольоване антитіло або його антигензв’язувальний фрагмент згідно з пунктом 51, в якому радіоізотоп вибирають із групи, до якої входять 125I, 131I, 111In, 99m Tc та 90Y. 53. Моноклональне антитіло згідно з пунктом 14 або 15 у вигляді кон’югата з цитотоксичним агентом. 54. Моноклональне антитіло згідно з пунктом 53, в якому цитотоксичний агент є радіоізотопом. 55. Моноклональне антитіло згідно з пунктом 54, в якому радіоізотоп вибирають із групи, до якої входять 125I, 131I, 111In, 99m Tc та 90Y. 56. Фармацевтична композиція згідно з пунктом 35, в якій антитіло або його антигензв’язувальний фрагмент знаходяться у вигляді кон’югата з цитотоксичним агентом. 57. Фармацевтична композиція згідно з пунктом 56, в якій цитотоксичний агент є радіоізотопом. 58. Фармацевтична композиція згідно з пунктом 57, в якій радіоізотоп вибирають із групи, до якої входять 125I, 131I, 111In, 99m Tc та 90Y. 59. Моноклональне антитіло згідно з пунктом 1, вибране з групи, до складу якої входять 325.1 (ATCC®, реєстраційний № PTA-5120), 621.1 (ATCC®, реєстраційний № PTA-5121), 633.1 (ATCC®, реєстраційний № PTA-5122), 654.1 (ATCC®, реєстраційний № PTA-5247), 725.1 (ATCC®, реєстраційний № PTA-5124), 8G9 (ATCC®, реєстраційний № PTA-5119), 7F10 (ATCC®, реєстраційний № PTA-5112), 8A1 (ATCC®, реєстраційний № PTA-5115), 8C3 (ATCC®, реєстраційний № PTA-5246), 15C9 (ATCC®, реєстраційний № PTA5106), 8E3 (ATCC®, реєстраційний № PTA-5246), 8B5 (ATCC®, реєстраційний № PTA-5116), 7G10 (ATCC®, реєстраційний № PTA-5145), 16C7 (ATCC®, реєстраційний № PTA-5107), 7C6 (ATCC®, реєстраційний № PTA-5111), 7H1 (ATCC®, реєстраційний № PTA-5114), 16H9 (ATCC®, реєстраційний № PTA-5108), 7A11 (ATCC®, реєстраційний № PTA-5110), 4E7 (ATCC®, реєстраційний № PTA5109), 117.1 (ATCC®, реєстраційний № PTA-4567), 368.1 (ATCC®, реєстраційний № PTA-4568), 446.1 (ATCC®, реєстраційний № PTA-5540), 501.1 (ATCC®, реєстраційний № PTA-4509) та 776.1 (ATCC®, реєстраційний № PTA-4570), або його антигензв’язувальний фрагмент. 60. Фармацевтична композиція, до складу якої входять моноклональне антитіло згідно з пунктом 59 або його антигензв’язувальний фрагмент і фармацевтично прийнятний носій. 61. Застосування моноклонального антитіла або антигензв’язувального фрагмента антитіла згідно з пунктом 1 для виготовлення лікувального засобу для лікування СА 125/О772Р-асоційованого розладу. 9 89348 10 62. Застосування згідно з пунктом 61, в якому СА 125/О772Р-асоційований розлад є розладом проліферації клітин. 63. Застосування згідно з пунктом 61, в якому антитіло вибирають з групи, до складу якої входять 325.1 (ATCC®, реєстраційний № PTA-5120), 621.1 (ATCC®, реєстраційний № PTA-5121), 633.1 (ATCC®, реєстраційний № PTA-5122), 654.1 (ATCC®, реєстраційний № PTA-5247), 725.1 (ATCC®, реєстраційний № PTA-5124), 8G9 (ATCC®, реєстраційний № PTA-5119), 7F10 (ATCC®, реєстраційний № PTA-5112), 8A1 (ATCC®, реєстраційний № PTA-5115), 8C3 (ATCC®, реєстраційний № PTA-5246), 15C9 (ATCC®, реєстраційний № PTA5106), 8E3 (ATCC®, реєстраційний № PTA-5246), 8B5 (ATCC®, реєстраційний № PTA-5116), 7G10 (ATCC®, реєстраційний № PTA-5145), 16C7 (ATCC®, реєстраційний № PTA-5107), 7C6 (ATCC®, реєстраційний № PTA-5111), 7H1 (ATCC®, реєстраційний № PTA-5114), 16H9 (ATCC®, реєстраційний № PTA-5108), 7A11 (ATCC®, реєстраційний № PTA-5110), 4E7 (ATCC®, реєстраційний № PTA5109), 117.1 (ATCC®, реєстраційний № PTA-4567), 368.1 (ATCC®, реєстраційний № PTA-4568), 446.1 (ATCC®, реєстраційний № PTA-5540), 501.1 (ATCC®, реєстраційний № PTA-4509) та 776.1 (ATCC®, реєстраційний № PTA-4570). 64. Застосування згідно з будь-яким з пунктів 6163, в якому антитіло чи його антигензв’язувальний фрагмент кон’юговано з цитотоксичним агентом. 1. Область, до якої відноситься винахід Згідно даного винаходу пропонуються антитіла та їх антиген-зв'язуючі фрагменти, що зв'язують переважним чином клітинно-асоційовані поліпептиди СА 125/О772Р, споріднені з вивільненими з поверхні клітинної мембрани (циркулюючими) поліпептидами СА 125/О772Р, способи розпізнавання таких антитіл та їх антиген-зв'язуючих фрагментів, а також способи продукування таких антитіл та їх антиген-зв'язуючих фрагментів. Крім того, відповідно до цього винаходу пропонуються способи профілактики, керування проявами, лікування чи зменшення ступеню проявів одного чи декількох симптомів, що мають відношення до розладів здоров'я, котрі асоціюються з раковим антигеном СА 125/О772Р. Зокрема, згідно винаходу пропонуються способи профілактики, керування проявами, лікування чи зменшення ступеню проявів одного чи декількох симптомів, що асоціюються з ростом і проліферацією клітин. Зокрема, згідно цього винаходу пропонуються способи профілактики, керування проявами, лікування чи зменшення ступеню проявів одного чи декількох симптомів, що пов'язані з раковими захворюваннями. Згідно найкращого варіанту втілення цього винаходу пропонуються способи профілактики, керування проявами, лікування чи зменшення ступеню проявів одного чи декількох симптомів раку яєчників. Згідно винаходу також пропонуються лікарські композиції та промислові вироби, що можуть бути використані з метою профілактики, керування проявами, лікування чи зменшення ступеню проявів одного чи декількох симптомів, що мають відношення до розладів здоров'я, котрі асоціюються з підвищеним рівнем СА 125/О772Р, наприклад, раку, зокрема, раку яєчників. Окрім того, згідно даного винаходу пропонуються методи діагностики захворювань, на які вказує підвищений рівень СА 125/О772Р, або ж схильності до появи та розвитку таких захворювань. 2. Аналоги та прототипи Поліпептид з великою молекулярною масою, відомий як СА 125, виявляють приблизно у 80% хворих на карциному яєчників (див. Kabawat et al., Am. J. Clin. Pathol. 79: 98-104 (1983); а також Gadducci et al., Gynecol. Oncol. 44: 147-154 (1992)). CA 125 локалізується на оболонці пухлинних клітин, а його різновиди під умовною назвою «шедантиген» СА 125, які при підвищеній експресії «вивільняються» в кровоток, виявляють приблизно у 90% хворих на рак яєчників. Антитіла на СА 125 продукували та використовували для визначення концентрацій СА 125 та для очищення СА 125 із клітинно-культурального середовища. Див., напр.., Bast et al., J. Clio. Invest. 68(5): 1331-1337 (1981); Krantz et al., J. Cell. Biochem. (Suppl.) 12(E): 139 (1988); патенти США №№4 921 790, 5 059 680, та 5 976 818; а також JP11014626. На додаток до антитіл для моніторингу наявності СА 125, у патентах США №№5 858 361 та 6 241 985 описуються анти-ідіотипні антитіла на СА 125 в якості терапевтичних засобів. Попри сказане вище, захворювання, маркером яких є СА 125, наприклад, рак яєчників, досі являють собою складну проблему, а, відтак, існує велика потреба в способах та засобах для лікування таких захворювань. Цитування або визначення будь-якого посилання в цьому чи в будь-якому іншому розділі цієї заявки жодною мірою не слід розуміти як припущення щодо того, що це посилання є прототипом даного винаходу. 3. Стислий виклад винаходу Даний винахід певною мірою базується на усвідомленні того, що фактори, котрі призводять до вироблення вивільненого СА 125/О772Р, також полишають частину екстрацелюлярної ділянки амінокислотної послідовності СА 125/О772Р в клітинно-асоційованій формі, так що вони теж продукують клітинно-асоційований СА 125/О772Р. Далі, цей винахід частково базується на усвідомленні того факту, що антитіла та їх анти-ген-зв'язуючі фрагменти, які зв'язують переважно клітинноасоційований СА 125/О772Р, споріднений із вивільненим СА 125/О772Р, можна виробляти, а також того, що такі антитіла та їх антиген-зв'язуючі фрагменти можуть бути використані, наприклад, з метою профілактики, керування проявами, лікування чи зменшення ступеню проявів СА 125/О772Р 11 асоційованого розладу здоров'я, або ж одного чи декількох симптомів, що мають відношення до розладів здоров'я, котрі асоціюються з підвищеним рівнем СА 125/О772Р, наприклад раку, зокрема раку яєчників. У першу чергу відповідно до цього винаходу пропонується ізольоване антитіло або його антиген-зв'язуючий фрагмент, котрий зв'язує переважним чином клітинно-асоційований поліпептид СА 125/О772Р, споріднений із вивільненим поліпептидом СА 125/О772Р. Пропонується також ізольоване антитіло або його антиген-зв'язуючий фрагмент, який зв'язується з пептидом згідно Фіг.1. Такі антитіла або їх антиген-зв'язуючі фрагменти, згідно винаходу, є корисними і можуть застосовуватися для досягнення терапевтичних, профілактичних і діагностичних цілей та для процесів очищення, як це описується далі. В іншому варіанті винаходу, антитіло чи його антиген-зв'язуючий фрагмент є таким, що зв'язує пептид послідовності SEQ ID NO:1 або SEQ ID NO:2 та зв'язує переважно клітинно-асоційований СА 125/О772Р. В одному такому окремому варіанті винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, зв'язує ділянку, що не повторюється, показану в послідовностях SEQ ID NO:1 чи SEQ ID NO:2. В ще одному такому окремому варіанті винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, зв'язує ділянку, що повторюється, представлену в послідовностях SEQ ID NO:1 чи SEQ ID NO:2. У першому варіанті винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, за результатами визначення реактивності методом конкурентного твердо-фазного імуноферментного аналізу (ELISA Competition Assay) демонструє менше приблизно 25%, менше приблизно 20%, менше приблизно 15%, менше приблизно 10% або менше приблизно 5% пригнічування зв'язування з пептидом згідно Фіг.1 (SEQ ID NO:1) за наявності 25-кратного (за вагою) перевищення вмісту вивільненого СА 125/О772Р порівняно з вмістом пептиду згідно Фіг.1 (SEQ ID NO:1). У другому варіанті винаходу антитіло чи його антигензв'язуючий фрагмент, згідно з винаходом, за результатами визначення реактивності методом конкурентної проточної цитофлуориметрії показує визначене за відсотком позитивних клітин значення ІС50, що складає щонайменше приблизно 0,05мг/мл, щонайменше приблизно 0,25мг/мл, щонайменше приблизно 0,5мг/мл, щонайменше приблизно 0,75мг/мл або ж щонайменше приблизно 1,0мг/мл вивільненого СА 125/О772Р. У третьому варіанті винаходу антитіло чи його антигензв'язуючий фрагмент, згідно з винаходом, зв'язує пептид згідно Фіг.1, але не зв'язує вивільнений поліпептид СА 125/О772Р у виявлюваних кількостях. Антитіло або його антиген-зв'язуючий фрагмент, котрі б відповідали вимогам будь-якого з цих трьох варіантів винаходу, і є антитілом або його антиген-зв'язуючим фрагментом, які зв'язують «переважною мірою» клітинно-асоційований поліпептид СА 125/О772Р, споріднений з вивільненим поліпептидом СА 125/О772Р. 89348 12 До антитіл чи їх антиген-зв'язуючих фрагментів, згідно з винаходом, належать антитіла або їх антиген-зв'язуючі фрагменти, що зв'язують пептиди згідно Фіг.1 (SEQ ID NO:1), Kd яких складає менше приблизно 100нМ, менше приблизно 10нМ, менше приблизно 1нМ, менше приблизно 100пМ або менше приблизно 10пМ - за результатами аналізу на визначення афінності за методикою ВІАсоrе, котрий описано далі в розділі 6.4. До референсних варіантів антитіл або їх антиген-зв'язуючих фрагментів, згідно з винаходом, відносяться антитіла чи їх антиген-зв'язуючі фрагменти, які сприяють лізису СА 125/O772Рпозитивних пухлинних клітин у дослідженні антитілозалежної клітиноопосередкованої цитотоксичності (ADCC). До таких антитіл або їх антигензв'язуючих фрагментів належать, зокрема, такі, що сприяють лізису щонайменше приблизно 10% СА 125/О772Р-позитивних пухлинних клітин у дослідженні антитілозалежної клітиноопосередкованої цитотоксичності при співвідношенні ефекторгмішень 50:1 і концентрації в 5мкг антитіла або його антиген-зв'язуючого фрагмента на 1мл; сприяють лізису щонайменше приблизно 20% СА 125/О772Р-позитивних пухлинних клітин у дослідженні антитілозалежної клітиноопосередкованої цитотоксичності при співвідношенні ефектор:мішень 50:1 і концентрації в 5мкг антитіла або його антиген-зв'язуючого фрагмента на 1мл; сприяють лізису щонайменше приблизно 10% СА 125/O772Р-позитивних пухлинних клітин у дослідженні антитілозалежної клітиноопосередкованої цитотоксичності при співвідношенні ефектор:мішень 25:1 і концентрації в 5,0мкг антитіла або його антиген-зв'язуючого фрагмента на 1мл; сприяють лізису щонайменше приблизно 10% СА 125/О772Р-позитивних пухлинних клітин у дослідженні антитілозалежної клітиноопосередкованої цитотоксичності при співвідношенні ефектор:мішень 25:1 і концентрації в 5мкг антитіла або його антиген-зв'язуючого фрагмента на 1мл; сприяють лізису щонайменше приблизно 10% СА 125/О772Р-позитивних пухлинних клітин у дослідженні антитілозалежної клітиноопосередкованої цитотоксичності при співвідношенні ефектор:мішень 12,5:1 і концентрації в 5мкг антитіла або його антиген-зв'язуючого фрагмента на 1мл; сприяють лізису щонайменше приблизно 10% СА 125/О772Р-позитивних пухлинних клітин у дослідженні антитілозалежної клітиноопосередкованої цитотоксичності при співвідношенні ефектор:мішень 12,5:1 і концентрації в 0,5мкг антитіла або його антиген-зв'язуючого фрагмента на 1мл; сприяють лізису щонайменше приблизно 10% СА 125/О772Р-позитивних пухлинних клітин у дослідженні антитілозалежної клітиноопосередкованої цитотоксичності при співвідношенні ефектор:мішень 12,5:1 і концентрації в 0,5нг антитіла або його антиген-зв'язуючого фрагмента на 1мл. Варіанти втілення винаходу, котрим віддано перевагу, також включають у себе антитіла або їх антиген-зв'язуючі фрагменти, котрі сприяють лізису СА 125/О772Р-пози-тивних пухлинних клітин в аналізі на комплементзалежну цитотоксичність (CDC). До таких антитіл або їх антиген-зв'язуючи 13 фрагментів належать, зокрема, такі, що сприяють лізису щонайменше від приблизно 15% при концентрації антитіла або його антиген-зв'язуючого фрагмента 5мкг/мл до приблизно95% - при приблизно 0,1мкг/мл. До варіантів антитіл або їх антиген-зв'язуючих фрагментів, котрим віддано перевагу згідно з винаходом, також відносяться антитіла або їх антиген-зв'язуючі фрагменти, котрі пригнічують ріст СА 125/О772Р-позитивних пухлинних клітин. Згідно до одного конкретного варіанту втілення винаходу, антитіло згідно з винаходом є моноклональним антитілом, продукованим гібридомою 4Е7 (АТСС®, реєстраційний №РТА-5109), або гібридомою 7А11 (АТСС®, реєстраційний №РТА5110), або гібридомою 7С6 (АТСС®, реєстраційний №РТА-5111), або гібридомою 7F10 (АТСС®, реєстраційний №РТА-5112), або гібридомою 7G10 (АТСС®, реєстраційний №РТА-5245), або гібридомою 7Н1 (АТСС®, реєстраційний №РТА-5114), або гібридомою 8А1 (АТСС®, реєстраційний №РТА5115), або гібридомою 8В5 (АТСС®, реєстраційний №РТА-5116), або гібридомою 8С3 (АТСС®, реєстраційний №РТА-5246), або гібридомою 8Е3 (АТСС®, реєстраційний №РТА-5118), або гібридомою 8G9 (АТСС®, реєстраційний №РТА-5119), або гібридомою 15С9 (АТСС®, реєстраційний №РТА5106), або гібридомою 16С7 (АТСС®, реєстраційний №РТА-5107), або гібридомою 16Н9 (АТСС®, реєстраційний №РТА-5108), або гібридомою 117.1 (АТСС®, реєстраційний №РТА-4567), або гібридомою 325.1 (АТСС®, реєстраційний №РТА-5120), або гібридомою 368.1 (АТСС®, реєстраційний №РТА-4568), або гібридомою 446.1 (АТСС®, реєстраційний №РТА-5549), або гібридомою 501.1 (АТСС®, реєстраційний №РТА-4569), або гібридомою 621.1 (АТСС®, реєстраційний №РТА-5121), або гібридомою 633.1 (АТСС®, реєстраційний №РТА-5122), або гібридомою 654.1 (АТСС®, реєстраційний №РТА-5247), або гібридомою 725.1 (АТСС®, реєстраційний №РТА-5124), або гібридомою 776.1 (АТСС®, реєстраційний №РТА-4570). Згідно до ще одного конкретного варіанту виконання винаходу, антитіло або його антигензв'язуючий фрагмент, згідно з винаходом, являє собою антитіло або його антиген-зв'язуючий фрагмент, котрий конкурує з моноклональним антитілом, продукованим гібридомою 4Е7 (АТСС®, реєстраційний №РТА-5109), або гібридомою 7А11 (АТСС®, реєстраційний №РТА-5110), або гібридомою 7С6 (АТСС®, реєстраційний №РТА-5111), або гібридомою 7F10 (АТСС®, інвентарний РТА-5112), або гібридомою 7G10 (АТСС®, інвентарний РТА5245), або гібридомою 7Н1 (АТСС®, інвентарний РТА-5114), або гібридомою 8А1 (АТСС®, інвентарний РТА-5115), або гібридомою 8В5 (АТСС®, інвентарний РТА-5116), або гібридомою 8С3 (АТСС®, інвентарний РТА-5246), або гібридомою 8Е3 (АТСС®, інвентарний РТА-5118), або гібридомою 8G9 (АТСС®, інвентарний РТА-5119), або гібридомою 15С9 (АТСС®, інвентарний РТА-5106), або гібридомою 16С7 (АТСС®, інвентарний РТА-5107), або гібридомою 16Н9 (АТСС®, інвентарний РТА5108), або гібридомою 117.1 (АТСС®, інвентарний РТА-4567), або гібридомою 325.1 (АТСС®, інвента 89348 14 рний РТА-5120), або гібридомою 368.1 (АТСС®, інвентарний РТА-4568), або гібридомою 446.1 (АТСС®, інвентарний РТА-5549), або гібридомою 501.1 (АТСС®, інвентарний РТА-4569), або гібридомою 621.1 (АТСС®, інвентарний РТА-5121), або гібридомою 633.1 (АТСС®, інвентарний РТА-5122), або гібридомою 654.1 (АТСС®, інвентарний РТА5247), або гібридомою 725.1 (АТСС®, інвентарний РТА-5124), або гібридомою 776.1 (АТСС®, інвентарний РТА-4570) у зв'язуванні з клітинноасоційованим СА 125/O772Р. Вважається, що антитіла або їх анти-ген-зв'язуючі фрагменти, згідно з винаходом, конкурують за зв'язування, якщо вони конкурують за зв'язування при визначенні кросреактивності за методом конкурентного твердофазного імуноферментного аналізу (ELISA CrossCompetence Assay) та/або при визначенні кросреактивності за методом конкурентного аналізу з флуоресцентною активацією сортування клітин (FACS Cross-Competition Assay). Вважається, що антитіло або його ан-тиген-зв'язуючий фрагмент, згідно з винаходом, конкурує за зв'язування при визначенні крос-реактивності за методом твердофазного імуноферментного аналізу або при визначенні крос-реактивності в конкурентному аналізі з флуоресцентною активацією сортування клітин, якщо величина IC50 для конкуруючого антитіла чи його антиген-зв'язуючого фрагмента спостерігається при концентрації, яка не більш ніж у 100 разів перевищує концентрацію антитіла або його антиген-зв'язуючого фрагмента. У варіанті втілення винаходу, якому було віддано перевагу, значення ІС50 конкуруючого антитіла чи його антиген-зв'язуючого фрагмента спостерігається при концентрації, яка не більш ніж у 10 разів перевищує концентрацію антитіла або його антигензв'язуючого фрагмента. У найкращому варіанті втілення винаходу величина ІС50 конкуруючого антитіла чи його антиген-зв'язуючого фрагмента спостерігається при концентрації, яка є приблизно еквімолярною концентрації антитіла або його антиген-зв'язуючого фрагмента. В іншому конкретному прикладі втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе 117.1 легколанцюгову поліпептидну варіабельну ділянку ("117.1L"), до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:27 (117.1L). В ще одному конкретному прикладі втілення винаходу антитіло чи його антигензв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе 117.1 важколанцюгову поліпептидну варіабельну ділянку ("117.1Н"), до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:28 (117.1Н). У ще одному конкретному прикладі втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:27 (117.1L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:28 (117.1Н). 15 В іншому конкретному прикладі втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе 368.1 легколанцюгову поліпептидну варіабельну ділянку ("368.1L"), до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:29 (368.1L). В ще одному окремому прикладі виконання винаходу антитіло чи його антигензв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе 368.1 важколанцюгову поліпептидну варіабельну ділянку ("368.1Н"), до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:30 (368.1Н). У ще одному конкретному прикладі втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:29 (368.1L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:30 (368.1Н). Іще в одному конкретному прикладі втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе 501.1 легколанцюгову поліпептидну варіабельну ділянку ("501.1L"), до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:31 (501.1L). А в іще одному конкретному прикладі втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе 501.1 важколанцюгову поліпептидну варіабельну ділянку ("501.1Н"), до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:32 (501.1Н). У ще одному конкретному прикладі втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:31 (501.1L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:32 (501.1Н). Іще в одному конкретному прикладі втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе 776.1 легколанцюгову поліпептидну варіабельну ділянку ("776.1L"), до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:33 (776.1L). А в іще одному конкретному прикладі втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе 776.1 важколанцюгову поліпептидну варіабельну ділянку ("776.1Н"), до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:34 (776.1Н). У ще одному конкретному прикладі втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:33 (776.1L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої 89348 16 входить амінокислотна послідовність, зображена у SEQ ID NO:34 (776.1Н). В іншому конкретному прикладі втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе 725.1 легколанцюгову поліпептидну варіабельну ділянку ("725.1L"), до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:54. Іще в одному конкретному прикладі втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе 725.1 важколанцюгову поліпептидну варіабельну ділянку ("725.1Н"), до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:53. А в іще одному конкретному прикладі втілення винаходу антитіло чи його антигензв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO: 54, та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:53. В іншому конкретному прикладі втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе 16Н9 легколанцюгову поліпептидну варіабельну ділянку ("16H9L"), до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:56. А в іще одному конкретному прикладі втілення винаходу антитіло чи його антигензв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе 16Н9 важколанцюгову поліпептидну варіабельну ділянку ("16Н9"), до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:55. У ще одному конкретному прикладі втілення винаходу антитіло чи його антигензв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:56, та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:55. В ще одному такому варіанті втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:27 (117.1L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:30 (368.1Н), SEQ ID NO:32 (501.1Н), SEQ ID NO:34 (776.1Н), SEQ ID NO:53 (725.1Н), або SEQ ID NO:55 (16Н9Н). В ще одному такому варіанті втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:29 (368.1L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:30 (368.1Н), SEQ ID NO:32 17 (501.1H), SEQ ID NO:34 (776.1Η), SEQ ID NO:53 (725.1H), або SEQ ID NO:55 (16H9H). В ще одному такому варіанті втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе легколанцюгову по-ліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:31 (501.1L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:30 (368.1Н), SEQ ID NO:32 (501.1Н), SEQ ID NO:34 (776.1Н), SEQ ID NO:53 (725.1Н), або SEQ ID NO:55 (16Н9Н). В ще одному такому варіанті втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, ε таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:33 (776.1L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:30 (368.1Н), SEQ ID NO:32 (501.1Н), SEQ ID NO:34 (776.1Н), SEQ ID NO:53 (725.1Н), або SEQ ID NO:55 (16Н9Н). В ще одному такому варіанті втілення винаходу антитіло чи його антиген-зв'язуючий фрагмент, згідно з винаходом, є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:54 (725.1L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:30 (368.1Н), SEQ ID NO:32 (501.1Н), SEQ ID NO:34 (776.1Н), SEQ ID NO:53 (725.1Н), або SEQ ID NO:55 (16Н9Н). В ще одному такому варіанті втілення винаходу антитіло чи його антиген-зв'язую-чий фрагмент, згідно з винаходом, є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:33 (16H9L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:30 (368.1Н), SEQ ID NO:32 (501.1Н), SEQ ID NO:34 (776.1Н), SEQ ID NO:53 (725.1Н), або SEQ ID NO:55 (16Н9Н). Антитіла згідно винаходу можуть містити в собі, але жодною мірою не обмежуючись цим, поліклональні, моноклонапьні, химерні, гуманізовані, людські, біспецифічні, триспецифічні, мультиспецифічні, подвійні (dibodies), потрійні (tribodies), одноланцюгові чи анти-ідіотипні антитіла. У варіанті втілення винаходу, якому віддається перевага, пропонується моноклональне антитіло, яке зв'язує переважним чином клітинно-асоційований поліпептид СА 125/О772Р, споріднений із вивільненим поліпептидом СА 125/О772Р. Фрагменти антиген-зв'язуючих антитіл згідно винаходу можуть включати в себе, але жодною мірою не обмежуючись цим, Fab-фрагменти, F(аb')2-фрагменти, одноланцюгові Fvs-фрагменти, що мають в собі варіабельний легколанцюговий поліпептид (VL), фрагменти, що мають в собі варіабельний важколанцюговий поліпептид (VH), або фрагменти, що містять ділянку визначення ком 89348 18 плементарності (CDR), та фрагменти будь-яких антитіл згідно винаходу, перераховані вище. Крім того, антитіла та їх антиген-зв'язуючі фрагменти, згідно винаходу, можуть належати до імуноглобулінів будь-якого класу. Наприклад, антитіла згідно винаходу можуть бути антитілами класу IgG, IgM, IgE, IgD, IgA чи IgY. Антитіла згідно винаходу можуть також бути будь-якого ізотипу. Наприклад, антитіла згідно винаходу можуть бути антитілами важколанцюгового ізотипу IgG1, lgG2, lgG3, lgG4, IgA1 чи ІgА2. Окрім того, антитіла згідно винаходу можуть, наприклад, містити в собі варіабельну легколанцюгову ділянку, зокрема, варіабельну легколанцюгову ділянку k або l, варіабельну важколанцюгову ділянку або ж ділянку визначення комплементарності з цієї останньої, що локалізована всередині каркасної ділянки. Наприклад, антитіло згідно винаходу може включати в себе константну ділянку Сg1 або ж константну ділянку Сg4. З іншого ж боку, відповідно до цього винаходу пропонуються гібридомні клітини, що продукують моноклональне антитіло згідно винаходу. Згідно до одного варіанту виконання винаходу, пропонується гібридома 4Е7 (АТСС®, реєстраційний №РТА-5109), гібридома 7А11 (АТСС®, реєстраційний №РТА-5110), гібридома 7С6 (АТСС®, реєстраційний №РТА-5111), гібридома 7F10 (АТСС®, реєстраційний №РТА-5112), гібридома 7G10 (АТСС®, реєстраційний №РТА-5245), гібридома 7Н1 (АТСС®, реєстраційний №РТА-5114), гібридома 8А1 (АТСС®, реєстраційний №РТА-5115), гібридома 8В5 (АТСС®, реєстраційний №РТА-5116), гібридома 8С3 (АТСС®, реєстраційний №РТА-5246), гібридома 8Е3 (АТСС®, реєстраційний №РТА5118), гібридома 8G9 (АТСС®, реєстраційний №РТА-5119), гібридома 15С9 (АТСС®, реєстраційний №РТА-5106), гібридома 16С7 (АТСС®, реєстраційний №РТА-5107), гібридома 16Н9 (АТСС®, реєстраційний №РТА-5108), гібридома 117.1 (АТСС®, реєстраційний №РТА-4567), гібридома 325.1 (АТСС®, реєстраційний №РТА-5120), гібридома 368.1 (АТСС®, реєстраційний №РТА-4568), гібридома 446.1 (АТСС®, реєстраційний №РТА5549), гібридома 501.1 (АТСС®, реєстраційний №РТА-4569), гібридома 621.1 (АТСС®, реєстраційний №РТА-5121), гібридома 633.1 (АТСС®, реєстраційний №РТА-5122), гібридома 654.1 (АТСС®, реєстраційний №РТА-5247), гібридома 725.1 (АТСС®, реєстраційний №РТА-5124), або гібридома 776.1 (АТСС®, реєстраційний №РТА-4570). У відповідності до іншого варіанту винаходу, пропонується гібридома, що продукує моноклональні антитіла, котрі конкурують із моноклональним антитілом, що їх продукує гібридома 4Е7 (АТСС®, реєстраційний №РТА-5109), гібридома 7А11 (АТСС®, реєстраційний №РТА-5110), гібридома 7С6 (АТСС®, реєстраційний №РТА-5111), гібридома 7F10 (АТСС®, реєстраційний №РТА-5112), гібридома 7G10 (АТСС®, реєстраційний №РТА-5245), гібридома 7Н1 (АТСС®, реєстраційний №РТА5114), гібридома 8А1 (АТСС®, реєстраційний №РТА-5115), гібридома 8В5 (АТСС®, реєстраційний №РТА-5116), гібридома 8С3 (АТСС®, реєстраційний №РТА-5246), гібридома 8Е3 (АТСС®, ре 19 єстраційний №РТА-5118), гібридома 8G9 (АТСС®, реєстраційний №РТА-5119), гібридома 15С9 (АТСС®, реєстраційний №РТА-5106), гібридома 16С7 (АТСС®, реєстраційний №РТА-5107), гібридома 16Н9 (АТСС®, реєстраційний №РТА-5108), гібридома 117.1 (АТСС®, реєстраційний №РТА4567), гібридома 325.1 (АТСС®, реєстраційний №РТА-5120), гібридома 368.1 (АТСС®, реєстраційний №РТА-4568), гібридома 446.1 (АТСС®, реєстраційний №РТА-5549), гібридома 501.1 (АТСС®, реєстраційний №РТА-4569), гібридома 621.1 (АТСС®, реєстраційний №РТА-5121), гібридома 633.1 (АТСС®, реєстраційний №РТА-5122), гібридома 654.1 (АТСС®, реєстраційний №РТА-5247), гібридома 725.1 (АТСС®, реєстраційний №РТА5.124), або гібридома 776.1 (АТСС®, реєстраційний №РТА-4570) у зв'язуванні з клітинно-асоційованим СА 125/О772Р. Вважається, що антитіла конкурують за зв'язування, якщо вони конкурують за зв'язування при визначенні крос-реактивності за методом конкурентного твердофазного імуноферментного аналізу та/або при визначенні крос-реактивності в конкурентному аналізі з флуоресцентною активацією сортування клітин. Вважається, що антитіло або його антиген-зв'язуючий фрагмент, згідно винаходу, конкурує за зв'язування при визначенні крос-реактивності за конкурентним методом твердофазного імуноферментного аналізу або при визначенні крос-реактивності в конкурентному аналізі з флуоресцентною активацією сортування клітин, якщо IC50 для конкуруючого антитіла чи його антиген-зв'язуючого фрагмента спостерігається при концентрації, яка не більш ніж у 100 разів перевищує концентрацію антитіла або його антиген-зв'язуючого фрагмента. У варіанті винаходу, якому було віддано перевагу, ІС50 конкуруючого антитіла чи його антиген-зв'язуючого фрагмента спостерігається при концентрації, яка не більш ніж у 10 разів перевищує концентрацію антитіла або його антиген-зв'язуючого фрагмента. У найкращому варіанті втілення винаходу ІС50 конкуруючого антитіла чи його антиген-зв'язуючого фрагмента спостерігається при концентрації, яка є приблизно еквімолярною концентрації антитіла або його антиген-зв'язуючого фрагмента. В ще одному аспекті відповідно до цього винаходу пропонується ізольована молекула нуклеїнової кислоти, котра включає в себе нуклеотидну послідовність, в якій закодоване антитіло чи його антиген-зв'язуючий фрагмент згідно винаходу. В ще одному аспекті відповідно до цього винаходу пропонується гібридний поліпептид, що включає в себе антитіло чи його антигензв'язуючий фрагмент згідно винаходу, зокрема, такий, що зв'язує переважною мірою клітинноасоційований поліпептид СА 125/О772Р, споріднений з вивільненим поліпептидом СА 125/О772Р, що оперативно . зв'язаний з гетерологічним агентом. В одному з варіантів гібридного поліпептиду згідно винаходу антитіло або його антигензв'язуючий фрагмент та гетерологічний агент оперативно зчеплені через ковалентний зв'язок типу пептидного зв'язку чи дісульфідного зв'язку, в той час як у іншому варіанті гібридного поліпептиду згідно винаходу антитіло або його антиген 89348 20 зв'язуючий фрагмент та гетерологічний агент оперативно зчеплені через не-ковалентний зв'язок. В ще одному варіанті гібридного поліпептиду згідно винаходу гетерологічний агент включає в себе амінокислотну послідовність або радіоізотоп. В численних інших варіантах, що жодною мірою не обмежують обсягу цього винаходу, гетерологічний агент гібридного поліпептиду згідно винаходу містить в собі цитотоксичний агент або ж агент, що піддається виявленню, зокрема, агент візуалізації. В якості частини цього винаходу пропонуються також аналоги антитіл, антиген-зв'язуючих фрагментів антитіл та гібридних поліпептидів згідно винаходу, котрі зв'язують переважним чином клітинно-асоційований поліпептид СА 125/О772Р, споріднений з вивільненим поліпептидом СА 125/О772Р. В одному з варіантів винаходу такий аналог демонструє підвищену афінність до клітинно-асоційованого СА 125/О772Р, спорідненого з відповідним чином попередньо модифікованим антитілом, антиген-зв'язуючими фрагментами антитіла та гібридним поліпептидом. В іншому варіанті винаходу такий аналог демонструє більш тривалий період напіввиведення з сироватки крові порівняно з відповідним чином попередньо модифікованим антитілом, антиген-зв'язуючими фрагментами антитіла та гібридним поліпептидом. Наприклад, до аналогів згідно винаходу відносяться аналоги моноклонального антитіла, продукованого гібридомою 4Е7 (АТСС®, реєстраційний №РТА5109), або гібридомою 7А11 (АТСС®, реєстраційний №РТА-5110), або гібридомою 7С6 (АТСС®, реєстраційний №РТА-5111), або гібридомою 7F10 (АТСС®, реєстраційний №РТА-5112), або гібридомою 7G10 (АТСС®, реєстраційний №РТА-5245), або гібридомою 7Н1 (АТСС®, реєстраційний №РТА-5114), або гібридомою 8А1 (АТСС®, реєстраційний №РТА-5115), або гібридомою 8В5 (АТСС®, реєстраційний №РТА-5116), або гібридомою 8С3 (АТСС®, реєстраційний №РТА-5246), або гібридомою 8Е3 (АТСС®, реєстраційний №РТА5118), або гібридомою 8G9 (АТСС®, реєстраційний №РТА-5119), або гібридомою 15С9 (АТСС®, реєстраційний №РТА-5106), або гібридомою 16С7 (АТСС®, реєстраційний №РТА-5107), або гібридомою 16Н9 (АТСС®, реєстраційний №РТА-5108), або гібридомою 117.1 (АТСС®, реєстраційний №РТА-4567), або гібридомою 325.1 (АТСС®, реєстраційний №РТА-5120), або гібридомою 368.1 (АТСС®, реєстраційний №РТА-4568), або гібридомою 446.1 (АТСС®, реєстраційний №РТА-5549), або гібридомою 501.1 (АТСС®, реєстраційний №РТА-4569), або гібридомою 621.1 (АТСС®, реєстраційний №РТА-5121), або гібридомою 633.1 (АТСС®, реєстраційний №РТА-5122), або гібридомою 654.1 (АТСС®, реєстраційний №РТА-5247), або гібридомою 725.1 (АТСС®, реєстраційний №РТА-5124), або гібридомою 776.1 (АТСС®, реєстраційний №РТА-4570). З іншого ж боку, відповідно до цього винаходу пропонується фармацевтична композиція, до складу якої входить антитіло, антиген-зв'язуючий фрагмент антитіла, гібридний поліпептид або аналог згідно винаходу, тобто речовина, що зв'язує переважною мірою клітинно-асоційований поліпе 21 птид СА 125/О772Р, споріднений з вивільненим поліпептидом СА 125/О772Р, та фармацевтично нейтральна основа, в той час, як іще з одного боку у відповідності до цього винаходу пропонується спосіб приготування фармацевтичної композиції, що включає в себе домішування антитіла чи його антиген-зв'язуючого фрагмента згідно винаходу до фармацевтично придатної основи. З ще іншого боку, відповідно до цього винаходу пропонується промисловий виріб, що включає в себе пакувальний матеріал та фармацевтичну композицію згідно винаходу, яка розміщена всередині пакувального матеріалу і перебуває в стані, придатному для введення в організм, переважним чином, організм людини. В одному варіанті втілення винаходу до промислового виробу належать також друковані інструкції та/або етикетка, що стосуються застосування фармацевтичної композиції або введення її в організм. В інструкціях та/або на етикетці можуть бути розміщені, наприклад, схема прийому лікарського засобу з метою запобігання або лікування одного чи декількох симптомів захворювання, що асоціюються з наявністю СА 125/О772Р, таких як розлад проліферації клітин, наприклад, раку, зокрема, раку яєчників, сечового міхура, молочної залози або легенів. З ще одного боку відповідно до цього винаходу пропонуються способи профілактики, керування проявами, лікування чи зменшення ступеню проявів симптому захворювання, асоційованого з наявністю СА 125/О772Р, що включає в себе: введення в організм особи, котра потребує такої профілактики , лікування, керування проявами чи зменшення ступеню проявів, антитіла чи його антиген-зв'язуючого фрагмента в кількості, що є ефективною для профілактики, лікування, керування проявами чи зменшення ступеню проявів симптому, асоційованого з розладом проліферації клітин, в якому вказане антитіла чи його антигензв'язуючий фрагмент зв'язує переважним чином клітинно-асоційований СА 125/О772Р, споріднений з вивільненим СА 125/О772Р. Відповідно до одного варіанту втілення винаходу, способи згідно винаходу мають відношення до профілактики, лікування, керування проявами чи зменшення ступеню проявів симптому, асоційованого з розладом проліферації клітин. Згідно іншого варіанту втілення винаходу, такі способи згідно винаходу мають відношення до профілактики, лікування, керування проявами чи зменшення ступеню проявів симптому раку. Згідно ще одного варіанту втілення винаходу, такі способи згідно винаходу мають відношення до профілактики, лікування, керування проявами чи зменшення ступеню проявів симптому раку шийки матки, сечового міхура, молочної залози чи легенів. У варіанті втілення способів згідно цього винаходу, яку віддано перевагу, такі способи стосуються профілактики, лікування, керування проявами чи зменшення ступеню проявів симптому раку яєчників. Відповідно до одного варіанту застосування способів згідно винаходу застосовуване антитіло чи його антиген-зв'язуючий фрагмент є моноклональним антитілом або антиген-зв'язуючим фрагментом моноклонального антитіла. Відповідно до 89348 22 іншого варіанту застосування способів згідно винаходу антитіло чи його антиген-зв'язуючий фрагмент вводять при концентрації дози від приблизно 5мкг/кг до приблизно 10мг/кг, переважно від приблизно 20мкг/кг до приблизно 5мг/кг, i - найбільш оптимальним чином - від приблизно 10мкг/кг до приблизно 5мг/кг. Відповідно до іншого варіанту застосування способів згідно винаходу, вказані способи практикуються як складова частина комбінованої терапії раку. Така комбінована терапія раку може включати в себе, наприклад, застосування хіміотерапевтичних засобів, зокрема, паклітакселю (paclitaxel) чи цісплатіну (cisplatin). Така комбінована терапія раку може включати в себе, жодною мірою не обмежуючись цим, також радіотерапію. З ще одного боку відповідно до цього винаходу пропонується спосіб сприяння розпізнаванню антитіла або його антиген-зв'язуючого фрагмента, котрий зв'язує переважним чином клітинноасоційований СА 125/О772Р, споріднений з вивільненим СА 125/О772Р. Відповідно до одного варіанту втілення винаходу, спосіб сприяння розпізнаванню антитіла або його антиген-зв'язуючого фрагмента, котрий зв'язує переважною мірою клітинно-асоційований СА 125/О772Р, який полягає в контактуванні антитіла чи його антиген-зв'язуючого фрагмента з пептидом, до складу якого входить клітинно-асоційований СА 125/О772Р (зокрема, кпітинно-асоційований поліпептид СА 125/О772Р або й навіть поліпептид СА 125/О772Р повної довжини) у присутності вивільненого СА 125/О772Р (в якому бажана кількісна перевага (за вагою) вивільненого СА 125/О772Р) за умов, що уможливлюють зв'язування антитіла чи його антигензв'язуючого фрагмента зі вказаним пептидом, до складу якого входить клітинно-асоційований СА 125/О772Р або вивільнений СА 125/О772Р. Після інкубації вивільнений СА 125/О772Р (зі зв'язаним з ним антитілом або антиген-зв'язуючим фрагментом останнього чи без нього) та антитіло чи його антиген-зв'язуючий фрагмент, що залишилися незв'язаними, видаляють, після чого визначають кількість антитіла чи його антиген-зв'язуючого фрагмента, котрі зв'язалися з пептидом, що включає в себе клітинно-асоційований СА 125/О772Р. Якщо отримані таким способом антитіло чи його антиген-зв'язуючий фрагмент задовольняє одному із трьох викладених вище варіантів «переважнного зв'язування», то вказане антитіло чи його антигензв'язуючий фрагмент є одним з таких, що зв'язує переважним чином клітинно-асоційований поліпептид СА 125/О772Р, споріднений з вивільненим поліпептидом СА 125/О772Р. Згідно з варіантом втілення винаходу, якому віддано перевагу, співвідношення вивільненого СА 125/О772Р до клітинно-асоційованого СА 125/О772Р в реакційній суміші складає приблизно 25:1 (за вагою). Як складова частина пропонованого способу, клітинно-асоційований СА 125/О772Р може бути іммобілізований на твердій поверхні. Наприклад, цей спосіб може бути реалізовано у форматі твердофазного імуноферментного аналізу. Відповідно до ще одного варіанту винаходу, спосіб сприяння розпізнаванню антитіла або його 23 антиген-зв'язуючого фрагмента, котрий зв'язує переважною мірою клітинно-асоційований СА 125/О772Р, споріднений з вивільненим СА 125/О772Р, полягає в контактуванні антитіла чи його антиген-зв'язуючого фрагмента з пептидом, до складу якого входять клітинно-асоційований СА 125/О772Р та вивільнений СА 125/О772Р (в якому бажана кількісна, наприклад, приблизно 25-кратна перевага (за вагою) вивільненого поліпептиду) за умов, що уможливлюють зв'язування пептиду, до складу якого входить клітинно-асоційований СА 125/О772Р, з антитілом чи його антигензв'язуючим фрагментом, видаленні поліпептиду, що містить в собі клітинно-асоційований СА 125/О772Р, який залишився незв'язаним, визначенні кількості пептиду, що містить в собі клітинноасоційований СА 125/О772Р, який зв'язаний антитілом чи його антиген-зв'язуючим фрагментом, та порівнянні виміряної кількості з кількістю пептиду, що містить в собі клітинно-асоційований СА 125/О772Р, яку антитіло чи його антигензв'язуючий фрагмент в змозі зв'язати за відсутності такої кількості вивільненого СА 125/О772Р (зокрема, при його меншій кількості). Якщо отримані таким способом антитіло чи його антигензв'язуючий фрагмент задовольняє одному із трьох викладених вище варіантів «переважного зв'язування», то вказане антитіло чи його антигензв'язуючий фрагмент є одним з таких, що зв'язує переважним чином клітинно-асоційований поліпептид СА 125/О772Р, споріднений з вивільненим поліпептидом СА 125/О772Р. Як складова частина пропонованого способу, антитіло чи його антигензв'язуючий фрагмент може бути іммобілізовано на твердій поверхні, наприклад, спосіб може бути реалізовано у форматі твердофазного імуноферментного аналізу. Відповідно до ще одного варіанту винаходу, спосіб сприяння розпізнаванню антитіла або його антиген-зв'язуючого фрагмента, котрий зв'язує переважною мірою клітинно-асоційований СА 125/О772Р, полягає в контактуванні антитіла чи його антиген-зв'язуючого фрагмента з клітиною, що продукує СА 125/О772Р у кількості, зокрема, щонайменше приблизно 0,05мг/мл) від кількості вивільненого СА 125/О772Р (в якому бажана кількісна перевага (за вагою) вивільненого СА 125/О772Р) за умов, що уможливлюють зв'язування СА 125/О772Р з антитілом або його антигензв'язуючим фрагментом, видаленні клітин, що залишилися незв'язаними, визначенні кількості СА 125/О772Р-продукуючих клітин, що зв'язані з антитілом чи його антиген-зв'язуючим фрагментом, та порівнянні виміряної кількості з кількістю СА 125/O772Р-продукуючих клітин, яку антитіло чи його антиген-зв'язуючий фрагмент в змозі зв'язати за відсутності такої кількості вивільненого СА 125/О772Р (зокрема, при його меншій кількості). Якщо отримані таким способом антитіло чи його антиген-зв'язуючий фрагмент задовольняє одному із трьох викладених вище варіантів «переважного зв'язування», то вказане антитіло чи його антигензв'язуючий фрагмент є одним з таких, що зв'язує переважним чином клітинно-асоційований поліпептид СА . 125/О772Р, споріднений з вивільненим 89348 24 поліпептидом СА 125/О772Р. Такий спосіб може бути, наприклад, втілено шляхом виконання вимірювань із застосуванням методу проточної цитофлуориметрії, включаючи, зокрема, флуоресцентну активацію сортування клітин (FACS). З ще одного боку, відповідно до цього винаходу пропонуються також методи діагностики захворювань, про які свідчить підвищений рівень СА 125/О772Р, або ж схильності до розвитку таких захворювань. 3.1. Терміни та визначення Як прийнято в цьому описі, терміном «аналог» у відношенні до антитіла чи його антигензв'язуючого фрагмента або гібридного поліпептиду згідно винаходу позначено антитіло чи його антиген-зв'язуючий фрагмент або гібридний поліпептид, що його було модифіковано у порівнянні з відповідним антитілом або його антигензв'язуючим фрагментом або гібридним поліпептидом згідно винаходу (на яких у цьому контексті посилаються як на «попередньо модифіковані» антитіло чи його антиген-зв'язуючий фрагмент або гібридний поліпептид згідно винаходу) іще до модифікації, наявної в аналогу, який, як і до того, зв'язує клітинно-асоційований СА 125/О772Р, споріднений з вивільненим СА 125/О772Р. «Афінність» (Kd) антитіла або його антигензв'язуючого фрагмента згідно винаходу визначають шляхом аналізу на визначення афінності, як це описано далі в розділі 6.4. Терміном «антитіло згідно винаходу» в цьому описі позначено антитіло, яке зв'язує переважною мірою клітинно-асоційований поліпептид СА 125/О772Р, споріднений із вивільненим поліпептидом СА 125/О772Р. Таким же чином терміном «антиген-зв'язуючий фрагмент антитіла згідно винаходу» в цьому описі позначено антиген-зв'язуючий фрагмент антитіла, який зв'язує переважним чином клітинно-асоційований поліпептид СА 125/О772Р, споріднений із вивільненим поліпептидом СА 125/О772Р. Антитілом або його антигензв'язуючим фрагментом вважається антитіло чи його антиген-зв'язуючий фрагмент згідно винаходу, навіть якщо він зв'язує поліпептид СА 125/О772Р, зокрема, попередньо вивільнений поліпептид СА 125/О772Р, якщо тільки таке антитіло чи його антиген-зв'язуючий фрагмент все ж таки зв'язує переважною мірою клітинно-асоційований СА 125/О772Р, споріднений з вивільненим СА 125/О772Р. З огляду на те, що, як про це говориться нижче, клітинно-асоційований СА 125/О772Р ще до вивільнення СА 125/О772Р у кровоток присутній у вигляді попередньо вивільненого СА 125/О772Р, звернули увагу на те, що антитіла, котрі зв'язують переважно клітинноасоційований СА 125/О772Р, в змозі також зв'язувати попередньо вивільнений СА 125/О772Р. Таким чином, незалежно від того, зв'язує антитіло або його антиген-зв'язуючий фрагмент СА 125/О772Р чи ні, воно вважається антитілом або антиген-зв'язуючим фрагментом антитіла згідно винаходу за умови, що це відповідає критеріям, викладеним тут нижче для «зв'язує переважним чином поліпептид СА 125/О772Р, споріднений з вивільненим СА 125/О772Р». Окрім того, вважає 25 мо за потрібне відмітити, що терміни «антитіло» та «імуноглобулін» вживаються тут взаємозамінно, якщо тільки спеціально не зазначено інакше. Терміном «аналіз на антитілозалежну клітиноопосередковану цитотоксичність» (аналіз ADCC) в цьому описі позначено аналіз ADCC, що його описано далі, в розділі 6.5. Як такі, антитіло або його антиген-зв'язуючий фрагмент, що сприяє лізису СА 125/О772Р-позитивних пухлинних клітин в аналізі на антитілозалежну клітиноопосередковану цитотоксичність (ADCC) вважається позитивним, якщо його було протестовано в аналізі на ADCC, що описаний далі у розділі 6.5. Термін «приблизно», як він використовується в цьому описі - якщо тільки не зазначено інакше,відноситься до величин, які щонайбільше на 10% перевищують модифіковані цим терміном значення або настільки ж менші за них. В разі, коли такою модифікованою величиною є довжина послідовності нуклеїнової або амінокислоти, результуючою модифікованою величиною буде ціле число, котре не більш ніж на 10% більше або менше за оригінальну довжину. Далі, випадки, коли модифікуванню цим терміном піддається 10% довжини, мають результатом величину, що мусить бути менша за 1; тоді стає зрозумілим, що, як це має місце в цьому описі, модифікована довжина на 1 нуклеотид або амінокислотний залишок більша чи менша за оригінальне значення. Як прийнято в цьому описі, терміном «зв'язується» в контексті взаємодії антитіло-антиген, зокрема, у розумінні того, що антитіло чи антигензв'язуючий фрагмент антитіла, який зв'язує переважною мірою клітинно-асоційований СА 125/О772Р, стосується антитіл або їх антигензв'язуючих фрагментів антитіла, які вибірково зв'язуються з конкретним антигеном (зокрема, клітинно-асоційованим СА 125/О772Р) і не зв'язуються вибірково з іншими антигенами. Переважним чином антитілом чи його антиген-зв'язуючим фрагментом є таке/такий, що зв'язує СА 125/О772Р зі специфічністю не менше 5ОГ/мікрограм антитіла, що визначається методом твердофазного імуноферментного аналізу на специфічність (ELISA Specificity Assay) або ж дає позитивний результат при визначенні специфічності за методом проточної цитофлуориметрії (Flow Cytometry Specificity Assay). Пептид або поліпептид, що зв'язується з антигеном, може також зв'язуватися й з іншими пептидами чи поліпептидами з більш низькою афінністю, ніж визначена, зокрема, із застосуванням методів імунологічних аналізів, аналізів за методиками ВІАсоrе та Scatchard, або ж інших відомих методик. Антитіла чи їх фрагменти, що специфічно зв'язуються з антигеном, можуть проявляти крос-реактивність зі спорідненими антигенами. В основному, антитіла чи їх фрагменти, що зв'язуються з антигеном, не проявлять кросреактивності з іншими антигенами. Див., наприклад, дискусію у Fundamental Immunology Second Edition, Paul, ed., Raven Press (1989) на стор.332336, що стосується специфічності антитіл. Антитілом або антиген-зв'язуючим фрагментом антитіла згідно винаходу, переважною мірою, є таке/такий, що зв'язує пептид (див. Фіг.1) з афінністю Kd мен 89348 26 ше приблизно 100нМ, ще більш переважно зв'язує пептид (див. Фіг.1) з афінністю Kd менше приблизно 5нМ, все за результатами аналізу на визначення афінності за методикою ВІАсоrе, що описується в розділі 6.4. Відмічається, що антитіло, яке зв'язує переважно клітинно-асоційований СА 125/О772Р, може також являти собою антитіло, яке зв'язує специфічно СА 125/О772Р, включаючи вивільнений СА 125/О772Р, споріднений з іншими, не вивільненими, антигенами СА 125/О772Р. Під кінець також відмічається, що терміни «специфічно» та «імуноспецифічно» в цьому описі застосовуються взаємозамінно, - якщо тільки на зазначено інакше. Визначення специфічності за методом твердофазного імуноферментного аналізу (ELISA Specificity Assay): Цей аналіз, як прийнято в описі винаходу, виконується, в основному, як ферментний імуносорбентний аналіз, описаний далі, в розділі 6.2. За результатами цього аналізу, антитіло (чи антиген-зв'язуючий фрагмент антитіла) вважається позитивним (зокрема, специфічним до СА 125/О772Р), якщо воно/він демонструє екстинкцію від щонайменше 5 до понад 30ОГ/мікрограм антитіла. Визначення специфічності за методом проточної цитофлуориметрії (Flow Cvtometrv Specificity Assay): Цей аналіз, як прийнято в описі винаходу, виконується, в основному, як описаний далі, в розділі 6.2, аналіз за методом проточної цитофлуориметрії. Антитіло (чи антиген-зв'язуючий фрагмент антитіла) вважається позитивним (зокрема, специфічним до СА 125/О772Р), якщо воно/він у проточно-цитофлуориметричному аналізі демонструє результат у нижчезазначеному діапазоні відсотка позитивних клітин: менше ніж 5% NIH/3T3-позитивних клітин, та щонайменше 60% NIH/ЗТЗ-позитивних клітин, що продукують поліпептид послідовності SEQ ID NO:2; та/або менше ніж 25% SK-OV3-позитивних клітин і щонайменше 80% OVCAR-3-позитивних клітин. Терміни «конкурують за зв'язування» та «конкурують поміж собою» в цьому описі вживаються стосовно двох різновидів антитіл або двох різновидів антиген-зв'язуючих фрагментів антитіла (або їх комбінації) та застосовуються взаємозамінно. Вважається, що перше антитіло чи антигензв'язуючий фрагмент антитіла конкурує з другим антитілом або антиген-зв'язуючим фрагментом антитіла, якщо перше антитіло чи його антигензв'язуючий фрагмент конкурує з другим при визначенні крос-реактивності за методом конкурентного твердофазного імуноферментного аналізу (ELISA Cross-Competition Assay) та/або при визначенні крос-реактивності в конкурентному аналізі з флуоресцентною активацією сортування клітин (FACS Cross-Competition Assay). Визначення крос-реактивності за методом конкурентного твердофазного імуноферментного аналізу (ELISA Cross-Competition Assay): Цей аналіз, як прийнято в описі винаходу, виконується, в основному, як ферментний імуносорбентний аналіз, описаний далі, в розділі 7.0. Вважається, що антитіло або антиген-зв'язуючий фрагмент антитіла в цьому аналізі конкурує за зв'язування, якщо ІС50 для конкуруючого антитіла чи його антиген 27 зв'язуючого фрагмента спостерігається при концентрації, яка не більше ніж в 100 разів перевищує концентрацію антитіла чи його антиген-зв'язуючого фрагмента. Визначення крос-реактивності в конкурентному аналізі з флуоресцентною активаціею сортування клітин (FACS Cross-Competition Assay): Цей аналіз, як прийнято в описі винаходу, виконується, в основному, як аналіз із флуоресцентною активацією сортування клітин, описаний далі, в розділі 7.0. Вважається, що антитіло або антигензв'язуючий фрагмент антитіла в цьому аналізі конкурує за зв'язування, якщо ІС50 для конкуруючого антитіла чи його антиген-зв'язуючого фрагмента спостерігається при концентрації, яка не більше ніж в 100 разів перевищує концентрацію антитіла чи його антиген-зв'язуючого фрагмента. Терміном «СА 125/О772Р» або «поліпептид СА 125/О772Р» в цьому описі винаходу позначено попередньо вивільнений трансмембранний поліпептид СА 125/О772Р, який, після свого вивільнення, активізує вироблення вивільненого поліпептиду СА 125/О772Р та клітинно-асоційованого поліпептиду СА 125/О772Р. Нещодавно було виявлено, що амінокислотна послідовність, згадувана в літературі як повна, на всю довжину, послідовність поліпептиду СА 125/О772Р, насправді не є повною, на всю довжину, послідовністю СА 125/О772Р. Див., зокрема, міжнародну заявку WO 02/06317 (PCT/US01/22635) та патент США 2003/0124140, в яких описується поліпептид, названий "О772Р". Амінокислотна послідовність поліпептиду О772Р включає в себе розширення, стосовно якого раніше вважали, що це повний, на всю довжину, СА 125. Оскільки поліпептид в цій галузі науки відомий як СА 125 або О772Р, то ми його тут називатимемо «СА 125/О772Р». Як прийнято в цьому описі винаходу, «розлад здоров'я, асоційований з СА 125/О772Р», - це захворювання, що супроводжується або характеризується надлишковим рівнем клітинноасоційованого СА 125/О772Р у порівнянні з відповідним нормальним статусом та/або надмірним вмістом вивільненого СА 125/О772Р у порівнянні з відповідним нормальним статусом. Наприклад, у випадку раку яєчників спостерігається підвищений рівень клітинно-асоційованого СА 125/О772Р у порівнянні з рівнями, які спостерігаються в нормі, (зокрема, при відсутності захворювання на рак). Надлишковий рівень клітинно-асоційованого СА 125/О772Р та/або вивільненого СА 125/О772Р може бути як наслідком такого розладу здоров'я, так і просто вказувати на нього. Як прийнято в цьому описі винаходу, під терміном «клітинно-асоційований СА 125/О772Р» мається на увазі різновид екстрацелюлярного поліпептиду СА 125/О772Р, який, щоправда, зостається в клітинно-асоційованій формі протягом короткого часу, зокрема, попередньо до свого обновлення, одразу ж після того, як порція попередньо вивільненого поліпептиду СА 125/О772Р буде викинута в кровоток як циркулюючий СА 125/О772Р. Наприклад, клітинно-асоційованим різновидом СА 125/О772Р є різновид екстрацелюлярного поліпептиду СА 125/О772Р, який залиша 89348 28 ється в клітинно-асоційованій формі на поверхні клітин лінії OVCAR-3 (НТВ-161; АТСС®) або асцитних клітин людини після того як порція поліпептиду СА 125/О772Р буде викинута в кровоток як циркулюючий СА 125/О772Р. Різновид клітинноасоційованого пола пептиду СА 125/О772Р присутній в амінокислотних залишках з 1 по 708 послідовності SEQ ID NO:1 та в амінокислотних залишках з 1 по 711 послідовності SEQ ID NO:2. Більше того, СА 125/О772Р може розщеплюватися на сайті розщеплення протеазою, локалізованому в амінокислотних залишках 659-665 послідовності SEQ ID NO:2. Див. також: O'Brien et al., Tumour Biol. 23(3): 154-169 (2002). Як такий, клітинноасоційований поліпептид СА 125/О772Р може включати в себе амінокислотні залишки 659-711 послідовності SEQ ID NO:2. Терміном «аналіз на комплементзалежну цитотоксичність» (аналіз CDC) в цьому описі позначено аналіз на CDC, що його описано далі, в "розділі 6.5. Таким чином, антитілом або його антигензв'язуючим фрагментом, що сприяє лізису пухлинних клітин в аналізі на комплементзалежну цитотоксичність (CDC), є таке/такий, котрий вважається позитивним, якщо його було перевірено в аналізі на CDC, що описаний далі у розділі 6.5. Як прийнято в цьому описі винаходу, терміни «розлад здоров'я» та «захворювання» вживаються взаємозамінно для позначення стану суб'єкта. Як прийнято в цьому описі винаходу, терміном «фрагмент» у фразі «антиген-зв'я-зуючий фрагмент антитіла» позначено пептид або поліпептид, що має в собі амінокислотну послідовність із щонайменше приблизно 5 неперервних амінокислотних залишків, щонайменше приблизно 10 неперервних амінокислотних залишків, щонайменше приблизно 15 неперервних амінокислотних залишків, щонайменше приблизно 20 неперервних амінокислотних залишків, щонайменше приблизно 25 неперервних амінокислотних залишків, щонайменше приблизно 40 неперервних амінокислотних залишків, щонайменше приблизно 50 неперервних амінокислотних залишків, щонайменше приблизно 60 неперервних амінокислотних залишків, щонайменше приблизно 70 неперервних амінокислотних залишків, щонайменше приблизно 80 неперервних амінокислотних залишків, щонайменше приблизно 90 неперервних амінокислотних залишків, щонайменше приблизно 100 неперервних амінокислотних залишків, щонайменше приблизно 110 неперервних амінокислотних залишків, щонайменше приблизно 120 неперервних амінокислотних залишків, амінокислотної послідовності іншого поліпептиду, зокрема, антитіла, яке зв'язує переважним чином клітинно-асоційований СА 125/О772Р. Терміном «клітина-хазяїн» впродовж всього цього опису позначено конкретну клітину, включаючи клітини ссавців та інші еукаріотичні чи прокаріотичні клітини, причому вказані клітини, наприклад, трансформовані або трансфіковані молекулою нуклеїнової кислоти або ж інфіковані вірусами, фаґемідами або бактеріофагами, а також нащадками чи потенційними нащадками такої клітини. Нащадки такої клітини можуть і відрізнятися від батьківських клітин, трансфікованих моле 29 кулою нуклеїнової кислоти в залежності від мутацій або ж впливу навколишнього середовища чи додаткових рекомбінантних маніпуляцій, що можуть трапитися в наступних поколіннях, або й внаслідок інтегрування молекули нуклеїнової кислоти в ґеном клітини-хазяїна. Як прийнято в цьому описі, виразом «гібридизує за суворих умов» позначено умови для гібридизації та промивання, за яких нуклеотидні послідовності, щонайменше на 75% ідентичні одна одній, зазвичай зливаються з гібридизованими до комплементу одна одної. Такі суворі умови фахівцям із цієї галузі знання, підтвердження чому можна знайти в Current Protocols in Molecular Biology, Ausubel et al., eds., John Wiley & Sons (1989-2002), розділи 6.3.1-6.3.6. В одному такому прикладі, який жодною мірою не обмежує обсягу винаходу, під суворими умовами гібридизації мають на увазі гібридизацію у 6Х хлористому натрії / лимоннокислому натрії (SSC) при температурі приблизно 45°С, після чого виконували одну або більше промивок у 0.1XSSC, 0,2% SDS при температурі приблизно 68°С. В прикладі, якому віддано перевагу, який, однак, в жодному разі не обмежує обсягу винаходу, під суворими умовами гібридизації мають на увазі гібридизацію у 6XSSC при температурі приблизно 45°С, після чого виконували одну або більше промивок у 0.2XSSC, 0,1% SDS при температурі від 50 до 65°С ({зокрема, одну або більше промивок при температурі 50°С, 55°С, 60°С або 65°С). Зрозуміло, що в певних варіантах втілення нуклеїнові кислоти згідно винаходу не містять молекул нуклеїнової кислоти, які гібридизують за цих умов одну лише нуклеотидну послідовність, котра складається тільки з нуклеотидів А чи Т. Як прийнято в цьому описі винаходу, терміном «ізольований» у відношенні до пептиду, поліпептиду, гібридного білку, антитіла або антигензв'язуючого фрагмента антитіла позначено пептид, поліпептид, гібридний білок, антитіло або антиген-зв'язуючий фрагмент антитіла, практично звільнені від клітинного матеріалу або контамінуючих білків із клітинного чи тканинного джерела, з якого їх отримують або добувають, або ж практично звільнені від хімічних прекурсорів чи інших хімікатів - у разі їх хімічного синтезування. Під виразом «практично звільнені від клітинного матеріалу або контамінуючого білку» мається на увазі підготовка пептиду, поліпептиду, гібридного білку, антитіла або антиген-зв'язуючого фрагмента антитіла, в процесі якої пептид, поліпептид, гібридний білок, антитіло або антиген-зв'язуючий фрагмент антитіла відсепаровують від компонентів клітин, із яких його ізолюють чи продукують шляхом рекомбінації. Таким чином, пептид, поліпептид, гібридний білок, антитіло або антиген-зв'язуючий фрагмент антитіла, практично звільнені від клітинного матеріалу або контамінуючого білку, означає спеціально підготовлений пептид, поліпептид, гібридний білок, антитіло або антиген-зв'язуючий фрагмент антитіла, що містить менше приблизно 30%, приблизно 20%, приблизно 10% або приблизно 5% (за вагою в сухому стані) інших білків. Якщо пептид, поліпептид, гібридний білок, антитіло або антигензв'язуючий фрагмент антитіла продукують шляхом 89348 30 рекомбінації, то він у переважній більшості випадків є практично вільним від культурального середовища, зокрема, культуральне середовище займає менше приблизно 20%, приблизно 10% або ж приблизно 5% об'єму білкового препарату. Якщо ж пептид, поліпептид, гібридний білок, антитіло або антиген-зв'язуючий фрагмент антитіла продукують шляхом хімічного синтезу, то він у переважній більшості випадків є практично вільним від хімічних прекурсорів або інших хімікатів, зокрема, він відсепарований від хімічних прекурсорів або інших хімікатів, залучених до синтезування пептиду, поліпептиду, гібридного білку, антитіла чи антигензв'язуючого фрагмента антитіла. Відповідним чином, такі препарати пептиду, поліпептиду, гібридного білку, антитіла чи антиген-зв'язуючого фрагмента антитіла містять в собі менше приблизно 30%, приблизно 20%, приблизно 10%, приблизно 5% (за вагою в сухому стані) хімічних прекурсорів або сполук, на відміну від пептиду, поліпептиду, гібридного білку, антитіла чи антиген-зв'язуючого фрагмента антитіла, що становлять інтерес. Як прийнято в цьому описі винаходу, терміном «ізольована» у відношенні до молекул нуклеїнової кислоти позначено молекулу нуклеїнової кислоти, яка відсепарована від інших молекул нуклеїнової кислоти, що присутні в натуральному клітинному джерелі молекул нуклеїнової кислоти. Альтернативно, «ізольована» молекула нуклеїнової кислоти, така як молекула кДНК, може бути фактично вільна від іншого клітинного матеріалу або культурального середовища в разі її отримання шляхом рекомбінації, або ж фактично вільна від хімічних прекурсорів та інших хімікатів в разі її синтезування хімічним шляхом. Як прийнято в цьому описі винаходу, терміном «керувати проявами», «керування проявами» та «управління проявами» позначено позитивні результати, що випливають для суб'єкта із засобу, зокрема, антитіла чи антиген-зв'язуючого фрагмента антитіла, гібридного поліпептиду чи аналога згідно винаходу, який не призводить до повного виліковування хвороби. У певних варіантах втілення винаходу суб'єкту вводять один або й декілька таких засобів з метою «керування проявами» хвороби для того, щоб запобігти або уповільнити прогресування чи погіршання розладу здоров'я. Як прийнято в цьому описі винаходу, терміном «моноклональне антитіло» позначено антитіло, продуковане одним лише клітинним клоном, включаючи будь-які еукаріотичні, прокаріотичні або фаґові клони, причому це не залежить од методу, за яким було отримане. Таким чином, «моноклональне антитіло» може стосуватися композиції, що містить в собі популяцію антитіл, кожне з яких зв'язується з одиночним епітопом, в той час як у вказаній композиції відсутні антитіла, що зв'язують інший епітоп, аніж той одиночний епітоп, з яким зв'язується популяція антитіл. Звичайно ж, було відмічено, що в окремих випадках одиночний епітоп присутній у поліпептиді в багатьох місцях. У таких випадках, попри те, що моноклональне антитіло може зв'язуватись в багатьох місцях, тим не менше вважається, що воно зв'язується з одиночним епітопом. 31 Як прийнято в цьому описі винаходу, терміном «нуклеїнові кислоти» та «нуклеотидні послідовності» позначено молекули ДНК (зокрема, кДНК або ґеномної ДНК), молекули РНК (зокрема, мРНК), комбінації молекул ДНК та РНК або гібридні молекули ДНК/РНК, та . аналоги молекул ДНК або РНК. Такі аналоги можуть бути утворені з використанням, наприклад, нуклеотидних аналогів, котрі включають в себе, жодною мірою не обмежуючись цим, інозин або трифенілметильовані основи. Такі аналоги можуть також містити в собі молекули ДНК чи РНК, що включають в себе модифіковані основні ланцюги, завдяки яким забезпечуються такі переваги цих молекул, як, наприклад, нуклеазна стійкість або ж підвищена спроможність проникати крізь мембрани клітин. Нуклеїнові кислоти або нуклеотидні послідовності можуть бути одноланцюговими, дволанцюговими, можуть містити в собі одно- та дволанцюгові ділянки, а також можуть мати в собі триланцюгові ділянки, хоча вони є переважно дволанцюговими ДНК. Терміном «оперативно зв'язаний», як це прийнято в даному описі, стосовно гібридного поліпептиду названо будь-яку ковалентну чи не ковалентну взаємодію із зв'язування антитіла чи антигензв'язуючого фрагмента антитіла із гетерологічним агентом. Оперативний зв'язок може бути прямим чи опосередкованим. Наприклад, поміж антитілом (або антиген-зв'язуючим фрагментом антитіла) та гетерологічним агентом може знаходитися амінокислотна послідовність. Як прийнято в цьому описі винаходу, антитіло, антиген-зв'язуючий фрагмент антитіла, гібридний поліпептид або аналог, що «зв'язує переважною мірою клітинно-асоційований СА 125/О772Р», «зв'язує переважним чином клітинно-асоційований поліпептид СА 125/О772Р», «зв'язує переважною мірою клітинно-асоційований СА 125/О772Р, споріднений з вивільненим СА 125/О772Р» або ж «зв'язує переважним чином поліпептид СА 125/О772Р, споріднений з вивільненим поліпептидом СА 125/О772Р» означає антитіло чи його антиген-зв'язуючий фрагмент, позитивне/позитивний в конкурентному твердофазному імуноферментному аналізі чи в конкурентному аналізі за методом проточної цитофлу-ориметрії, як це описано тут далі. Антитіло чи його антиген-зв'язуючий фрагмент це, переважно, таке/такий, що є позитивним як в конкурентному твердофазному ІФ-аналізі, так і в конкурентному аналізі за методом проточної цитофлуориметрії, як це описано тут далі. Конкурентний твердофазний імуноферментний аналіз (ELISA Competition Assay): Цей аналіз, як прийнято в описі винаходу, виконується, в основному, як ферментний імуносорбентний аналіз, описаний далі, в розділі 6.3. За результатами цього аналізу антитіло (чи антиген-зв'язуючий фрагмент антитіла) вважається позитивним (тобто зв'язує переважною мірою клітинно-асоційований СА 125/О772Р), якщо воно/він демонструє менш ніж приблизно 25%-не уповільнення зв'язування при 25-кратній перевазі (за вагою) вивільненого СА 125/О772Р порівняно з пептидом згідно Фіг.1 (SEQ ID NO:1). 89348 32 Конкурентний аналіз за методом проточної цитофлуориметрії (Flow Cytometry Competition Assay): Цей аналіз, як прийнято в описі винаходу, виконується, в основному, як описаний далі, в розділі 6.3, проточно-цитофлуориметричний аналіз. Вважається, що антитіло (чи антигензв'язуючий фрагмент антитіла) в цьому аналізі є позитивним (тобто вважається, що воно/він зв'язує переважним чином клітинно-асоційований СА 125/О772Р), якщо величина ІС0, визначена за відсотком позитивних клітин, складає щонайменше 0,05мг/мл вивільненого СА 125/О772Р, тобто якщо йому потрібно щонайменше 0,05мг/мл вивільненого СА 125/О772Р, щоб зменшити наполовину відсоток позитивних клітин в конкурентному аналізі за методом проточної цитофлуориметрії. Як прийнято в цьому описі винаходу, терміни «попередити», «попередження» та «профілактика» означають утруднення рецидивів чи настання у суб'єкта розладу здоров'я, асоційованого з присутністю СА 125/О772Р, або ж одного чи декількох симптомів розладу здоров'я, що асоціюється з СА 125/О772Р. Як прийнято в цьому описі винаходу, «протокол» включає в себе схеми лікування та дозування. Протоколами згідного цього опису є використовувані способи, причому до них належать як профілактичні, так і терапевтичні протоколи. Як прийнято в цьому описі винаходу, під терміном «вивільнений поліпептид СА 125/О772Р» мається на увазі послідовність екстрацелюлярного поліпептиду СА 125/О772Р, що відсепаровується та виділяється із поліпептидів СА 125/О772Р, експресованих на поверхні клітини, котра продукує СА 125/О772Р, за винятком різновиду клітинноасоційованого СА 125/О772Р, що залишається на поверхні клітини, щоправда, тимчасово. Термін, як його використано тут, позначає різновид вивільненого СА 125/О772Р, виявлений у сироватці людини та/або в надосадовій рідині культури клітин лінії OVCAR-3 (НТВ-161; АТСС). Такі вивільнені поліпептиди СА 125/О772Р можуть бути отримані за протоколом, що описаний у de los Frailes et al., Tumour Biol. 14(1): 18-29 (1993), з використанням надосадових рідин асцитних клітин людини чи клітин OVCAR-3. Альтернативно, вивільнені поліпептиди СА 125/О772Р можуть бути отримані з комерційних джерел, таких як Fitzgerald Industries International (м. Конкорд, шт. Масачусетс), Scripps Laboratories (м. Ла-Джолла, шт. Каліфорнія), або в United States Biochemical Corp. (м. Клівленд, шт. Огайо). Як прийнято в цьому описі винаходу, терміни «суб'єкт» та «пацієнт» вживаються взаємозамінно. Як прийнято в цьому описі, терміни «суб'єкт» та «пацієнт» стосуються тварини, переважно ссавця, включаючи не приматів (зокрема, корови, свині, коня, осла, кози, верблюда, кота, собаки, морської свинки, пацюка, миші, вівці) та приматів (зокрема, мавп видів макака-резус, горила, шимпанзе та людини), переважною мірою людини. В одному з прикладів втілення винаходу суб'єкт хворий на рак, наприклад, на рак яєчників. Як прийнято в цьому описі винаходу, терміни «лікувати», «лікування» та «вилікування» стосу 33 ються зменшення ступеню проявів розладу здоров'я, що асоціюється з СА 125/О772Р, що є результатом прийому одного чи декількох антитіл, антиген-зв'язуючих фрагментів антитіл, гібридних поліпептидів або їх аналогів. Під терміном «фармацевтично придатний», як він уживаний в цьому описі винаходу, мається на увазі композиція, зокрема, основа, наповнювач або фізіологічний розчин, що пройшли випробування в діючій на постійній основі аґенції федерального уряду або уряду штату, або ж занесена до Фармакопеї США або іншої загальновизнаної фармакопеї та призначена для введення тваринам, і, зокрема, людям. 4. Стислий опис фігур Фіг.1: Зображує амінокислотну послідовність СА 125/О772Р 3-rpt (SEQ ID NO:1). Виділені курсивом залишки від амінокислоти 14 по амінокислоту 452 репрезентують ділянки повторів. Кожен з трьох повторів в межах ділянки повторів 14-452 відмічений вертикальними лініями та стрілками, як показано на рисунку. Підкреслені залишки представляють собою трансмембранно-проксимальні ділянки, що не повторюються. Послідовність, що йде за підкресленими залишками, не є складовою частиною СА 125/О772Р і включає в себе теґ carboxy-Myc-His. Фіг.2: Зображує амінокислотну послідовність СА 125/О772Р 3-rpt ТМ (SEQ ID NO:2). Виділені курсивом та підкреслені залишки, зокрема, від амінокислоти 14 по амінокислоту 452, представляють собою ділянки повторів. Кожен з трьох повторів в межах ділянки повторів 14-452 відмічений вертикальними лініями та стрілками, як показано на рисунку. Підкреслені не виділені курсивом залишки, зокрема, від амінокислоти 453 по амінокислоту 711, представляють собою трансмембранно-проксимальну ділянку, що не повторюється. Не підкреслені виділені курсивом залишки, зокрема, від амінокислоти 712 по амінокислоту 738, представляють собою трансмембранний домен. Виділені жирним шрифтом залишки, зокрема, від амінокислоти 739 по амінокислоту 769, представляють собою цитоплазмічну ділянку. Послідовність, що йде за виділеними жирним шрифтом залишками, не є складовою частиною СА 125/О772Р і включає в себе теґ carboxy-Myc-His. Фіг.3: Зображує типову діаграму з визначення реактивності за методом конкурентної флуоресцентної активації для сортування клітин концентрацій вивільненого СА 125/О772Р у порівнянні з відсотком позитивних клітин для - в даному випадку антитіла 117.1 та контрольного антитіла М11 (відмічено квадратиками). Як видно з діаграми, конкуренція з М11 за зв'язування з клітинами ОVCAR-3 можлива навіть за низьких концентрацій вивільненого СА 125/О772Р (IC50=0,003мг/мл), тоді як з 117.1 конкуренція неможлива навіть за високих концентрацій вивільненого СА 125/О772Р (значення ІС50 більше за 1мг/мл). Фіг.4: Зображує типову діаграму з аналізу на антитілозалежну клітиноопосередковану цитотоксичність (ADCC) у відсотках лізису в порівнянні з концентрацією антитіла для антитіла 117.1 (середнє арифметичне 4 різних донорів). Як видно з 89348 34 рисунка, антитіло 117.1 сприяє вибірковому лізису клітин ОVCAR-3 в залежності від дози. Фіг.5А: Зображує нуклеотидну послідовність (SEQ ID NO:35), в якій закодована варіабельна легколанцюгова ділянка моноклонального антитіла. Нуклеотидна послідовність, в якій закодована головна послідовність, підкреслена подвійною лінією, в той час як нуклеотидні послідовності, в яких закодовані CDR-послідовності, підкреслені одинарною лінією. Фіг.5В: Зображує нуклеотидну послідовність (SEQ ID NO:36), в якій закодована варіабельна важколанцюгова ділянка моноклонального антитіла 117.1. Нуклеотидна послідовність, в якій закодована головна послідовність, підкреслена подвійною лінією, в той час як нуклеотидні послідовності, в яких закодовані CDRпослідовності, підкреслені одинарною лінією. Фіг.5С: Зображує амінокислотну послідовність (SEQ ID NO:27), в якій закодована варіабельна легколанцюгова ділянка моноклонального антитіла 117.1. Головну послідовність підкреслено подвійною, а CDR-послідовності - одинарною лінією. Фіг.5D: Зображує амінокислотну послідовність (SEQ ID NO:28) варіабельної важколанцюгової ділянки моноклонального антитіла 117.1. Головну послідовність підкреслено подвійною, а CDRпослідовності - одинарною лінією. Фіг.6А: Зображує нуклеотидну послідовність (SEQ ID NO:37), в якій закодована варіабельна легколанцюгова ділянка моноклонального антитіла 368.1. Нуклеотидна послідовність, в якій закодована головна послідовність, підкреслена подвійною лінією, в той час як нуклеотидні послідовності, в яких закодовані CDRпослідовності, підкреслені одинарною лінією. Фіг.6В: Зображує нуклеотидну послідовність (SEQ ID NO:38), в якій закодована варіабельна важколанцюгова ділянка моноклонального антитіла 368.1. Нуклеотидна послідовність, в якій закодована головна послідовність, підкреслена подвійною лінією, в той час як нуклеотидні послідовності, в яких закодовані CDRпослідовності, підкреслені одинарною лінією. Фіг.6С: Зображує амінокислотну послідовність (SEQ ID NO:29), в якій закодована варіабельна легколанцюгова ділянка моноклонального антитіла 368.1. Головну послідовність підкреслено подвійною, а CDR-послідовності - одинарною лінією. Фіг.6D: Зображує амінокислотну послідовність (SEQ ID NO:30) варіабельної важколанцюгової ділянки моноклонального антитіла 368,1. Головну послідовність підкреслено подвійною, а CDRпослідовності - одинарною лінією. Фіг.7А: Зображує нуклеотидну послідовність (SEQ ID NO:39), в якій закодована варіабельна легколанцюгова ділянка моноклонального антитіла 501.1. Нуклеотидна послідовність, в якій закодована головна послідовність, підкреслена подвійною лінією, в той час як нуклеотидні послідовності, в яких закодовані CDRпослідовності, підкреслені одинарною лінією. Фіг.7В: Зображує нуклеотидну послідовність (SEQ ID NO:40), в якій закодована варіабельна важколанцюгова ділянка моноклонального антиті 35 ла 501.1. Нуклеотидна послідовність, в якій закодовані головні послідовності, підкреслено подвійною лінією, в той час як нуклеотидні послідовності, в яких закодовані CDR-послідовності, підкреслено одинарною лінією. Фіг.7С: Зображує амінокислотну послідовність (SEQ ID NO:31), в якій закодована варіабельна легколанцюгова ділянка моноклонального антитіла 501.1. Головну послідовність підкреслено подвійною, а CDR-послідовності - одинарною лінією. Фіг.7D: Зображує амінокислотну послідовність (SEQ ID NO:32) варіабельної важколанцюгової ділянки моноклонального антитіла 501.1. Головні послідовності підкреслено подвійною, а CDRпослідовності - одинарною лінією. Фіг.8А: Зображує нуклеотидну послідовність (SEQ ID NO:41), в якій закодована варіабельна легколанцюгова ділянка моноклонального антитіла 776.1. Нуклеотидна послідовність, в якій закодована головна послідовність, підкреслена подвійною лінією, в той час як нуклеотидні послідовності, в яких закодовані CDRпослідовності, підкреслені одинарною лінією. Фіг.8В: Зображує нуклеотидну послідовність (SEQ ID NO:42), в якій закодована варіабельна важколанцюгова ділянка моноклонального антитіла 776.1. Нуклеотидні послідовності, в яких закодовані головні послідовності, підкреслено подвійною лінією, в той час як нуклеотидні послідовності, в яких закодовані CDR-послідовності, підкреслено одинарною лінією. Фіг.8С: Зображує амінокислотну послідовність (SEQ ID NO:33) варіабельної легколанцюгової ділянки моноклонального антитіла 776.1. Головну послідовність підкреслено подвійною, а CDRпослідовності - одинарною лінією. Фіг.8D: Зображує амінокислотну послідовність (SEQ ID NO:34) варіабельної важколанцюгової ділянки моноклонального антитіла 776.1. Головну послідовність підкреслено подвійною, а CDRпослідовності - одинарною лінією. Фіг.9А: Зображує нуклеотидну послідовність (SEQ ID NO:52), в якій закодована варіабельна легколанцюгова ділянка моноклонального антитіла 725.1. Нуклеотидна послідовність, в якій закодована головна послідовність, підкреслена подвійною лінією, в той час як нуклеотидні послідовності, в яких закодовані CDRпослідовності, підкреслені одинарною лінією. Фіг.9В: Зображує нуклеотидну послідовність (SEQ ID NO:57), в якій закодована варіабельна важколанцюгова ділянка моноклонального антитіла 725.1. Нуклеотидні послідовності, в яких закодовані головні послідовності, підкреслено подвійною лінією, в той час як нуклеотидні послідовності, в яких закодовані CDR-послідовності, підкреслено одинарною лінією. Фіг.9С: Зображує амінокислотну послідовність (SEQ ID NO:54) варіабельної легколанцюгової ділянки моноклонального антитіла 725.1. Головну послідовність підкреслено подвійною, а CDRпослідовності - одинарною лінією. Фіг.9D: Зображує амінокислотну послідовність (SEQ ID NO:53) варіабельної важколанцюгової ділянки моноклонального антитіла 725.1. Головну 89348 36 послідовність підкреслено подвійною, а СОРпослідовності - одинарною лінією. [0108] Фіг.10А: Зображує нуклеотидну послідовність (SEQ ID NO:59), в якій закодована варіабельна легколанцюгова ділянка моноклонального антитіла 16Н9. Нуклеотид-на послідовність, в якій закодована головна послідовність, підкреслена подвійною лінією, в той час як нуклеотидні послідовності, в яких закодовані CDR-послідовності, підкреслені одинарною лінією. Фіг.10В: Зображує нуклеотидну послідовність (SEQ ID NO:58), в якій закодована варіабельна важколанцюгова ділянка моноклонального антитіла 16Н9. Нуклеотидні послідовності, в яких закодовані головні послідовності, підкреслено подвійною лінією, в той час як нуклеотидні послідовності, в яких закодовані CDR-послідовності, підкреслено одинарною лінією. Фіг.10С: Зображує амінокислотну послідовність (SEQ ID NO:56) варіабельної легколанцюгової ділянки моноклонального антитіла 16Н9. Головну послідовність підкреслено подвійною, а CDRпослідовності - одинарною лінією. Фіг.10D: Зображує амінокислотну послідовність (SEQ ID NO:55) варіабельної важколанцюгової ділянки моноклонального антитіла 16Н9. Головну послідовність підкреслено подвійною, а CDRпослідовності - одинарною лінією. Фіг.11: Зображує результати Вестерн-блот аналізу надосадової рідини з клітинами OVCAR-3. Концентрація антитіла та її розпізнавання описуються в робочому прикладі далі за текстом, в розділі 6.7. "3 Rpt Ptn" в кожному блоті означає доріжки, що містять в собі рекомбінантний поліпептид О772Р 3-rpt; решта доріжок у кожному блоті містять в собі кондиційовані OVCAR-3 або контрольні середовища. Протестоване конкретне антитіло показане внизу кожного блоту (зокрема, антитіла М11, ОС125, 776.1 та 368.1). Маркери молекулярної маси показані на рисунку зліва. Фіг.12: Оцінка in vivo міченого 131І антитіла 776.1. Мишам лінії NCR nu/nu, носіям пухлинних клітин OVCAR-3, вводили фізіологічний розчин, 100мкКі [131І]776.1 Igd, 300мкКі [131І]776.1 IgGi, або 17мкг неміченого 776.1LgG1 (та ж доза білку, що і в 300мкКі групи [131І]776.1 IgGi. Лікування полягало у внутрішньовенному введенні однієї дози в день 0. Питома активність [131І]776.1 складала 15мКі/мг з імунореактивністю 51% після мічення. Результати показані як середній об'єм пухлини+/-ASD на всіх 10 мишей групи. Середній розмір пухлини на початку лікування складав 199 мм3 для всіх груп. 5. Детальний опис винаходу Даний винахід певною мірою базується на усвідомленні того, що фактори, котрі призводять до вироблення вивільненого СА 125/О772Р, також полишають частину екстрацелюлярної ділянки амінокислотної послідовності СА 125/О772Р в клітинно-асоційованій формі, так що вони теж продукують клітинно-асоційований СА 125/О772Р. Далі, більш детально описаний далі винахід частково базується на усвідомленні того факту, що антитіла, антиген-зв'язуючі фрагменти антитіл, гібридні поліпептиди та аналоги, які зв'язують переважним чином клітинно-асоційований СА 125/О772Р, спо 37 ріднений із вивільненим СА 125/О772Р, можна продукувати, а також того, що такі антитіла, антиген-зв'язуючі фрагменти антитіл, гібридні поліпептиди та аналоги можуть бути використані, наприклад, з метою профілактики, керування проявами, лікування чи зменшення ступеню проявів розладу здоров'я, асоційованого з наявністю в організмі СА 125/О772Р, або ж одного чи декількох симптомів, що мають відношення до розладів здоров'я через підвищений рівень СА 125/О772Р, таких як розлад проліферації клітин, наприклад раку, зокрема раку яєчників. Як було всебічно продискутовано, антитілами та антиген-зв'язуючими фрагментами антитіл згідно винаходу є такі, котрі зв'язують переважною мірою клітинно-асоційований СА 125/О772Р. Таким же чином і гібридні поліпептиди та аналоги згідно винаходу також зв'язують переважним чином клітинно-асоційований СА 125/О772Р. Як тут також було зазначено, завдяки тому факту, що клітинно-асоційований СА 125/О772Р, ще до вивільнення циркулюючого СА 125/О772Р, присутній як частина попередньо вивільненого СА 125/О772Р, відзначається, що антитіла, антигензв'язуючі фрагменти антитіл, гібридні поліпептиди та аналоги згідно винаходу можуть також зв'язувати і попередньо вивільнений СА 125/О772Р. Таким чином, не бажаючи обмежуватись якимсь конкретним механізмом чи теорією, вважаємо за потрібне зазначити, що описані в цьому розділі методи можуть бути приведені в дію шляхом зв'язування застосовуваного антитіла, антиген-зв'язуючих фрагментів антитіла, гібридних поліпептидів або аналогів згідно винаходу з попередньо вивільненим СА 125/О772Р на додаток до - або ж навзамін - їх зв'язування з клітинно-асоційованим СА 125/О772Р. 5.1. Антитіла та антиген-зв'язуючі фрагменти антитіла згідно винаходу У першу чергу, згідно даного винаходу пропонується ізольоване антитіло або ж антигензв'язуючий фрагмент антитіла, котрі зв'язують переважною мірою клітинно-асоційований поліпептид СА 125/О772Р, споріднений із вивільненим поліпептидом СА 125/О772Р. Такі антитіла та антиген-зв'язуючі фрагменти антитіл згідно винаходу можуть знайти застосування в численних терапевтичних, профілактичних, діагностичних та очищувальних заходах, що описуються далі в цьому документі. Відповідно до одного з варіантів втілення винаходу, антитілом або ж антиген-зв'язуючим фрагментом антитіла згідно винаходу є такі, що зв'язують SEQ ID NO:1 або SEQ ID NO:2 та зв'язують переважним чином клітинно-асоційований СА 125/О772Р. В одному такому конкретному варіанті втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу зв'язує ділянку, що не повторюється, показану в послідовностях SEQ ID NO:1 чи SEQ ID NO:2. В ще одному такому конкретному варіанті втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу зв'язує ділянку, що повторюється, представлену в послідовності SEQ ID NO:1 або SEQ ID NO:2. 89348 38 Відповідно до першого варіанту втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу, за результатами визначення специфічності за методом конкурентного твердофазного імуноферментного аналізу показує менше приблизно 25%, менше приблизно 20%, менше приблизно 15%, менше приблизно 10% або менше приблизно 5% пригнічування зв'язування з пептидом згідно Фіг.1 за наявності 25-кратного (за вагою) перевищення вмісту вивільненого СА 125/О772Р порівняно з вмістом пептиду згідно Фіг.1. Відповідно до другого варіанту втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу, за результатами конкурентного аналізу за методом проточної цитофлуориметрії показує визначену за відсотком позитивних клітин величину ІС50, що складає щонайменше приблизно 0,05мг/мл, щонайменше приблизно 0,1мг/мл, щонайменше приблизно 0,25мг/мл, щонайменше приблизно 0,5мг/мл, щонайменше приблизно 0,75мг/мл, або ж щонайменше приблизно 1,0мг/мл вивільненого СА 125/О772Р. У третьому варіанті винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу зв'язує пептид згідно Фіг.1, але не зв'язує виділений поліпептид СА 125/О772Р у виявлюваних кількостях. Антитіло або антиген-зв'язуючий фрагмент антитіла, котрі відповідають вимогам будь-якого з цих трьох варіантів втілення винаходу, і є антитілом або антигензв'язуючим фрагментом антитіла, які зв'язують переважною мірою клітинно-асоційований поліпептид СА 125/О772Р, споріднений з виділеним поліпептидом СА 125/О772Р. До антитіл чи їх антиген-зв'язуючих фрагментів, згідно з винаходом, належать антитіла або їх антиген-зв'язуючі фрагменти, що зв'язують пептиди згідно Фіг.1 (SEQ ID NO: 1), Kd яких складає менше приблизно 100нМ, менше приблизно 10нМ, менше приблизно 1нМ, менше приблизно 100пМ або менше приблизно 10пМ - за результатами аналізу на визначення афінності за методикою ВІАсоrе, котрий описано далі в розділі 6.4. До варіантів втілення пропонованих антитіл або їх антиген-зв'язуючих фрагментів згідно винаходу відносяться антитіла чи їх антиген-зв'язуючі фрагменти, які сприяють лізису СА 125/О772Рпозитивних пухлинних клітин в аналізі на антитілозалежну клі-тиноопосередковану цитотоксичність (ADCC). До таких антитіл або їх антигензв'язуючих фрагментів належать, зокрема, такі, що сприяють лізису щонайменше приблизно 10%, щонайменше приблизно 20%, щонайменше приблизно 30%, щонайменше приблизно 40%, або ж щонайменше приблизно 50% СА 125/O772Рпозитивних пухлинних клітин в аналізі на антитілозалежну клітиноопосередковану цитотоксичність при співвідношенні ефектор:мішень 50:1 і концентрації в 5мкг антитіла або його антиген-зв'язуючого фрагмента на 1мл; сприяють лізису щонайменше приблизно 10%, щонайменше приблизно 20%, щонайменше приблизно 30%, щонайменше приблизно 40% або ж щонайменше приблизно 50% СА 125/О772Р-позитивних пухлинних клітин в аналізі на ADCC при співвідношенні ефектор:мішень 25:1 і концентрації в 5мкг антитіла або його анти 39 ген-зв'язуючого фрагмента на 1мл; сприяють лізису щонайменше приблизно 10%, щонайменше приблизно 20%, щонайменше приблизно 30%, щонайменше приблизно 40% або ж щонайменше приблизно 50% СА 125/О772Р-позитивних пухлинних клітин в аналізі на ADCC при співвідношенні ефектор:мішень 12,5:1 і концентрації в 5,0мкг антитіла або його антиген-зв'язуючого фрагмента на 1мл; сприяють лізису щонайменше приблизно 10%, щонайменше приблизно 20%, щонайменше приблизно 30%, щонайменше приблизно 40% або ж щонайменше приблизно 50% СА 125/О772Рпозитивних пухлинних клітин в аналізі на ADCC при співвідношенні ефектор:мішень 12,5:1 і концентрації в 5мкг антитіла або його антигензв'язуючого фрагмента на 1мл; сприяють лізису щонайменше приблизно 10%, щонайменше приблизно 20%, щонайменше приблизно 30%, щонайменше приблизно 40% або ж щонайменше приблизно 50% СА 125/О772Р-позитивних пухлинних клітин в аналізі на ADCC при співвідношенні ефектор:мішень 12,5:1 і концентрації в 5нг антитіла або його антиген-зв'язуючого фрагмента на 1мл. Варіанти втілення винаходу, котрим віддано перевагу, також включають у себе антитіла або їх антиген-зв'язуючі фрагменти, котрі сприяють лізису СА 125/О772Р-позитивних пухлинних клітин в аналізі на комплементзалежну цитотоксичність (CDC). До таких антитіл або антиген-зв'язуючих фрагментів антитіл належать, приміром, такі, що є сприяють лізису від приблизно 15% при концентрації антитіла або його антиген-зв'язуючого фрагменту 5мкг/мл до приблизно 95% при концентрації приблизно 0,1мкг/мл. До варіантів антитіл або їх антиген-зв'язуючих фрагментів, котрим віддано перевагу згідно з винаходом, також відносяться антитіла або їх антиген-зв'язуючі фрагменти, котрі пригнічують ріст СА 125/О772Р-позитивних пухлинних клітин. Наприклад, такими антитілами або антиген-зв'язуючими фрагментами антитіл є такі, що пригнічують ріст СА 125/О772Р-позитивних пухлин в таких моделях досліджень на тваринах, які описані в Treskes et al., Eur. J. Cancer. 30A(2): 183-187 (1994); Ahmad etai, Oncol. Res. 11 (6): 273-280 (1999); та Kievit et al., Int. J. Radiat. Oncol. Biol. Phys. 38(2): 419-428 (1997), а також в моделях досліджень на тваринах з ксенографт-пухлинами OVCAR-3, що описуються далі в розділі 6.8. Згідно до одного варіанту втілення винаходу, антитіло згідно винаходу є моноклональним антитілом, продукованим гібридомою 4Е7 (АТСС®, реєстраційний №РТА-5109), або гібридомою 7А11 (АТСС®, реєстраційний №РТА-5110), або гібридомою 7С6 (АТСС®, реєстраційний №РТА-5111), або гібридомою 7F10 (АТСС®, реєстраційний №РТА5112), або гібридомою 7G10 (АТСС®, реєстраційний №РТА-5245), або гібридомою 7H1 (АТСС®, реєстраційний №РТА-5114), або гібридомою 8А1 (АТСС®, реєстраційний №РТА-5115), або гібридомою 8В5 (АТСС®, реєстраційний №РТА-5116), або гібридомою 8С3 (АТСС®, реєстраційний №РТА5246), або гібридомою 8Е3 (АТСС®, реєстраційний №РТА-5118), або гібридомою 8G9 (АТСС®, реєст 89348 40 раційний №РТА-5119), або гібридомою 15С9 (АТСС®, реєстраційний №РТА-5106), або гібридомою 16С7 (АТСС®, реєстраційний №РТА-5107), або гібридомою 16Н9 (АТСС®, реєстраційний №РТА-5108), або гібридомою 117.1 (АТСС®, реєстраційний №РТА-4567), або гібридомою 325.1 (АТСС®, реєстраційний №РТА-5120), або гібридомою 368.1 (АТСС®, реєстраційний №РТА-4568), або гібридомою 446.1 (АТСС®, реєстраційний №РТА-5549), або гібридомою 501.1 (АТСС®, реєстраційний №РТА-4569), або гібридомою 621.1 (АТСС®, реєстраційний №РТА-5121), або гібридомою 633.1 (АТСС®, реєстраційний №РТА-5122), або гібридомою 654.1 (АТСС®, реєстраційний №РТА-5247), або гібридомою 725.1 (АТСС®, реєстраційний №РТА-5124), або гібридомою 776.1 (АТСС®, реєстраційний №РТА-4570). Відповідно до іншого конкретного варіанту втілення винаходу, антитіло згідно винаходу є моноклональним антитілом, продукованим гібридомою 4Е7 (АТСС®, реєстраційний №РТА-5109), або гібридомою 7А11 (АТСС®, реєстраційний №РТА5110), або гібридомою 7С6 (АТСС®, реєстраційний №РТА-5111), або гібридомою 7F10 (АТСС®, реєстраційний №РТА-5112), або гібридомою 7G10 (АТСС®, реєстраційний №РТА-5245), або гібридомою 7Н1 (АТСС®, реєстраційний №РТА-5114), або гібридомою 8А1 (АТСС®, реєстраційний №РТА5115), або гібридомою 8В5 (АТСС®, реєстраційний №РТА-5116), або гібридомою 8С3 (АТСС®, реєстраційний №РТА-5246), або гібридомою 8Е3 (АТСС®, реєстраційний №РТА-5118), або гібридомою 8G9 (АТСС®, реєстраційний №РТА-5119), або гібридомою 15С9 (АТСС®, реєстраційний №РТА5106), або гібридомою 16С7 (АТСС®, реєстраційний №РТА-5107), або гібридомою 16Н9 (АТСС®, реєстраційний №РТА-5108), або гібридомою 117.1 (АТСС®, реєстраційний №РТА-4567), або гібридомою 325.1 (АТСС®, реєстраційний №РТА-5120), або гібридомою 368.1 (АТСС®, реєстраційний №РТА-4568), або гібридомою 446.1 (АТСС®, реєстраційний №РТА-5549), або гібридомою 501.1 (АТСС®, реєстраційний №РТА-4569), або гібридомою 621.1 (АТСС®, реєстраційний №РТА-5121), або гібридомою 633.1 (АТСС®, реєстраційний №РТА-5122), або гібридомою 654.1 (АТСС®, реєстраційний №РТА-5247), або гібридомою 725.1 (АТСС®, реєстраційний №РТА-5124), або гібридомою 776.1 (АТСС®, реєстраційний №РТА-4570) для зв'язування з клітинно-асоційованим СА 125/О772Р. Вважається, що антитіла або антигензв'язуючі фрагменти антитіл згідно винаходу конкурують за зв'язування, якщо вони конкурують за зв'язування при визначенні крос-реактивності за методом конкурентного твердофазного імуноферме-нтного аналізу та/або при визначенні кросреактивності в конкурентному аналізі за методом проточної цитофлуориметрії. Вважається, що антитіло або його антиген-зв'язуючий фрагмент згідно винаходу конкурує за зв'язування при визначенні крос-реактивності за методом конкурентного твердофазного ІФ-аналізу або при визначенні крос-реактивності в конкурентному аналізі за методом проточної цитофлуориметрії, якщо величина ІС50 для конкуруючого антитіла чи його антиген 41 зв'язуючого фрагменту спостерігається при концентрації, яка не біль ніж у 100 разів перевищує концентрацію антитіла або його антиген-зв'язуючого фрагмента. Відповідно до варіанту втілення винаходу, якому було віддано перевагу, ІС50 конкуруючого антитіла чи антиген-зв'язуючого фрагмента антитіла спостерігається при концентрації, яка не більш ніж у 10 разів перевищує концентрацію антитіла чи антиген-зв'язуючого фрагмента антитіла. Відповідно до найкращого варіанту втілення винаходу ІС50 конкуруючого антитіла чи антигензв'язуючого фрагмента антитіла спостерігається при концентрації, яка є приблизно еквімолярною концентрації антитіла або антиген-зв'язуючого фрагмента антитіла. В іншому конкретному прикладі втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюго-ву поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:27 (117.1L). В іншому конкретному прикладі втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:28 (117.1Η). У ще одному окремому прикладі втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:27 (117.1L), та важко-ланцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:28 (117.1Н). В іншому конкретному прикладі втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:29 (368.1L). В ще одному конкретному прикладі втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:30 (368.1Н). У ще одному окремому прикладі втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:29 (368.1L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:30 (368.1Η). В іншому конкретному прикладі втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:31 (501.1L). В ще одному конкретному прикладі втілення вина 89348 42 ходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:32 (501.1Н). У ще одному окремому прикладі втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:31 (501.1L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:32 (501.1Η). В іншому конкретному прикладі втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:33 (776.1L). В ще одному конкретному прикладі втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:34 (776.1Н). У ще одному окремому прикладі втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:33 (776.1L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:34 (776.1Н). В іншому конкретному прикладі втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе 725.1 легколанцюгову поліпептидну варіабельну ділянку ("725.1L"), до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:54. В ще одному конкретному прикладі втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе 725.1 важколанцюгову поліпептидну варіабельну ділянку ("725.1Н"), до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:53. А в іще одному окремому прикладі виконання винаходу антитіло чи антигензв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:54, та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:53. В іншому конкретному прикладі втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе 16Н9 легколанцюгову поліпептидну варіабельну ділянку ("16H9L"), до складу якої входить амінокислотна послідовність, зображена у SEQ ID 43 NO:56. А в іще одному конкретному прикладі втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе 16Н9 важколанцюгову поліпептидну варіабельну ділянку ("16Н9"), до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:55. У ще одному конкретному прикладі втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:56, та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:55. В ще одному такому варіанті втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:27 (117.1L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:30 (368.1Н), SEQ ID NO:32 (501.1Н), SEQ ID NO:34 (776.1Н), SEQ ID NO:53 (725.1Н), або SEQ ID NO:55(16H9H). В ще одному такому варіанті втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:29 (368.1L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:28 (117.1Н), SEQ ID NO:32 (501.1Н), SEQ ID NO:34 (776.1Н), SEQ ID NO:53 (725.1Н), або SEQ ID NO:55(16H9H). В ще одному такому варіанті втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:31 (501.1L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:28 (117.1Н), SEQ ID NO:30 (368.1Н), SEQ ID NO:34 (776.1Н), SEQ ID NO:53 (725.1Н), або SEQ ID NO:55(16H9H). В ще одному такому варіанті втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:33 (776.1L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:28 (117.1Н), SEQ ID NO:30 (368.1Н), SEQ ID NO:32 (501.1H), SEQ ID NO:53 (725.1Η), або SEQ ID NO:55(16H9H). В ще одному конкретному варіанті втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID 89348 44 NO:54 (725.1L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:30 (368.1Н), SEQ ID NO:32 (501.1Н), SEQ ID NO:34 (776.1Н), SEQ ID NO:53 (725.1Н), або SEQ ID NO:55(16H9H). В ще одному такому варіанті втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легкбланцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:33 (16H9L), та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входить амінокислотна послідовність, зображена у SEQ ID NO:30 (368.1Н), SEQ ID NO:32 (501.1Н), SEQ ID N0.34 (776.1Н), SEQ ID NO:53 (725.1Н), або SEQ ID NO:55 (16Н9Н). В одному конкретному варіанті втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входять будь-які одна, дві чи три ділянки визначення комплементарності VL CDR, що зображені в таблиці 1, таблиці 2, таблиці 3, таблиці 4, таблиці 5 та таблиці 6. В іншому конкретному варіанті втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе важколанцюгову поліпептидну варіабельну ділянку, до складу якої входять будь-які одна, дві чи три ділянки визначення комплементарності VH CDR, зображені в таблиці 1, таблиці 2, таблиці 3, таблиці 4, таблиці 5 та таблиці 6. В ще одному конкретному варіанті втілення винаходу антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входять будь-які одна, дві чи три ділянки визначення комплементарності VL CDR, що зображені в таблиці 1, таблиці 2, таблиці 3, таблиці 4, таблиці 5 та таблиці 6, та важколанцюгову поліпептидну варіабельну ділянку, до складу якої входять будь-які одна, дві чи три ділянки визначення комплементарності VH CDR, зображені в таблиці 1, таблиці 2, таблиці3, таблиці 4, таблиці 5 та таблиці 6. У варіанті втілення винаходу, якому віддається перевага, антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку, до складу якої входять будь-які дві чи три ділянки визначення комплементарності VL CDR, що зображені в таблиці 1; або будь-які дві чи три ділянки визначення комплементарності VL CDR, що зображені в таблиці 2; або будь-які дві чи три ділянки визначення комплементарності VL CDR, що зображені в таблиці 3; або будь-які дві чи три ділянки визначення комплементарності VL CDR, що зображені в таблиці 4; або будь-які дві чи три ділянки визначення комплементарності VL CDR, що зображені в таблиці 5; або будь-які дві чи три ділянки визначення комплементарності VL CDR, що зображені в таблиці 6. В іншому варіанті втілення винаходу, якому віддається перевага, антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе важ 45 коланцюгову поліпептидну варіабельну ділянку, до складу якої входять будь-які дві чи три ділянки визначення комплементарності VH CDR, що зображені в таблиці 1; або будь-які дві чи три ділянки визначення комплементарності VH CDR, що зображені в таблиці 2; або будь-які дві чи три ділянки визначення комплементарності (VH CDR), що зображені в таблиці 3; або будь-які дві чи три ділянки визначення комплементарності VH CDR, що зображені в таблиці 4; або будь-які дві чи три ділянки визначення комплементарності VH CDR, що зображені в таблиці 5; або будь-які дві чи три ділянки визначення комплементарності VH CDR, що зображені в таблиці 6. В ще одному варіанті втілення винаходу, якому віддається перевага, антитіло чи антигензв'язуючий фрагмент антитіла згідно винаходу є таким, що включає в себе легколанцюгову поліпептидну варіабельну ділянку та важколанцюгову поліпептидну варіабельну ділянку, причому до складу вказаної легколанцюгової поліпептидної варіабельної ділянки входять будь-які дві чи три ділянки визначення комплементарності VL CDR, що зображені в таблиці 1, а до складу вказаної важколанцюгової поліпептидної варіабельної ділянки входять будь-які дві чи три ділянки визначення комплементарності VH CDR, що зображені в таблиці 1; або ж до складу вказаної легколанцюгової поліпептидної варіабельної ділянки входять будь-які дві чи три ділянки визначення комплементарності VL CDR, що зображені в таблиці 2, а до складу вказаної важколанцюгової поліпептидної варіабельної ділянки входять будь-які дві чи три ділянки визначення комплементарності VH CDR, що зображені в таблиці 2; або ж до складу вказаної легколанцюгової поліпептидної варіабельної ділянки входять будь-які дві чи три ділянки визначення комплементарності VL CDR, що зображені в таблиці 3, а до складу вказаної важколанцюгової поліпептидної варіабельної ділянки входять будьякі дві чи три ділянки визначення комплементарності VH CDR, що зображені в таблиці 3; або ж до складу вказаної легколанцюгової поліпептидної варіабельної ділянки входять будь-які дві чи три ділянки визначення комплементарності VL CDR, що зображені в таблиці 4, а до складу вказаної важколанцюгової поліпептидної варіабельної ділянки входять будь-які дві чи три ділянки визначення комплементарності VH CDR, що зображені в таблиці 4; або ж до складу вказаної легколанцюгової поліпептидної варіабельної ділянки входять будь-які дві чи три ділянки визначення комплементарності VL CDR, що зображені в таблиці 5, а до складу вказаної важколанцюгової поліпептидної варіабельної ділянки входять будь-які дві чи три ділянки визначення комплементарності VH CDR, що зображені в таблиці 5; або ж до складу вказаної легколанцюгової поліпептидної варіабельної ділянки входять будь-які дві чи три ділянки визначення комплементарності VL CDR, що зображені в 89348 46 таблиці 6, а до складу вказаної важколанцюгової поліпеп-тидної варіабельної ділянки входять будьякі дві чи три ділянки визначення комплементарності VH CDR, що зображені в таблиці 6. Наприклад, антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу може включати в себе домен VL1, до складу якого входить будьяка з ділянок визначення комплементарності VL1 CDR, зображених в таблиці 1, таблиці 2, таблиці 3, таблиці 4, таблиці 5 та таблиці 6; антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу може включати в себе домен VL2, до складу якого входить будь-яка з ділянок визначення комплементарності VL2 CDR, зображених в таблиці 1, таблиці 2, таблиці 3, таблиці 4, таблиці 5 та таблиці 6; або ж антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу може включати в себе домен VL3, до складу якого входить будь-яка з ділянок визначення комплементарності VL3 CDR, зображених в таблиці 1, таблиці 2, таблиці 3, таблиці 4, таблиці 5 та таблиці 6; антитіло чи антигензв'язуючий фрагмент антитіла згідно винаходу може включати в себе домен VL1 та домен VL2, до складу яких входить будь-яка з ділянок визначення комплементарності VL1 CDR та VL2 CDR, зображених в таблиці 1, таблиці 2, таблиці 3, таблиці 4, таблиці 5 та таблиці 6; антитіло чи антигензв'язуючий фрагмент антитіла згідно винаходу може включати в себе домен VL1 та домен VL3, до складу яких входить будь-яка з ділянок визначення комплементарності VL1 CDR та VL3 CDR, зображених в таблиці 1, таблиці 2, таблиці 3, таблиці 4, таблиці 5 та таблиці 6; антитіло чи антигензв'язуючий фрагмент антитіла згідно винаходу може включати в себе домен VL2 та домен VL3, до складу яких входить будь-яка з ділянок визначення комплементарності VL2 CDR та VL3 CDR, зображених в таблиці 1, таблиці 2, таблиці 3, таблиці 4, таблиці 5 та таблиці 6; а також антитіло чи антиген-зв'язуючий фрагмент антитіла згідно винаходу може включати в себе домен VL1, домен VL2 та домен VL3, до складу яких входить будьяка з ділянок визначення комплементарності VL1 CDR, VL2 CDR та VL3 CDR, зображених в таблиці 1, таблиці 2, таблиці 3, таблиці 4, таблиці 5 та таблиці 6. Таблиця 1 CDR-послідовності 117.1 CDR VH1 VH2 VH3 VL1 VL2 VL3 Послідовність GFSLSTPGMGVG HIWWDDFKHDNPALKS VDGNFLSWYFDV RSSQSLVHSNGNTYLH KVSNRFS SQSRYVPET SEQ ID NO: 3 4 5 6 7 8 47 89348 Таблиця 2 СDR-послідовності 368.1 CDR VH1 VH2 VH3 VL1 VL2 VL3 Послідовність GYSFTGFYMH YVSCYTGATTYTQKFKG EGDYYSMDF RSSQSLERTNGTSTTYLH KVSSRFS SQTTHGPPT SEQ ID NO: 9 10 Ц 12 13 14 Таблиця 3 CDR-послідовності 501.1 CDR VH1 VH2 VH3 VL1 VL2 VL3 Послідовність GYIFTDYGMN CINTYTGETIYSDDFRG GNYRDAIDY KASQDIKSYLS YATTLAD LHHDESPFT SEQ ID NO: 15 16 17 18 19 20 Таблиця 4 CDR-послідовності 776.1 CDR VH1 VH2 VH3 VL1 VL2 VL3 Послідовність GYTFTDYNIH YIYPYNGVSDYNQNF RWDFGSGYYFDY RASSSV1YMC GTSTLAS QQWSSNPFT SEQ ID NO: 21 22 23 24 25 26 Таблиця 5 CDR-послідовності 725.1 CDR VH1 VH2 VH3 VL1 VL2 VL3 Послідовність GYSFTNYGMN WINAYIGEPTYADDFKG GGNSLDF RASSSVSSIH ATSNLAS QQWSIDPAT SEQ ID NO: 60 61 62 63 64 65 Таблиця 6 CDR-послідовності 16H9 CDR VH1 VH2 VH3 VL1 VL2 VL3 Послідовність GFNIKDTYMH RIDPANGNTKYDPKFQG SDIYYGNPGGFAY TASSSVSSSYLH STSNLAS HQYHRSPFT SEQ ID NO: 66 67 68 69 70 71 Антитіла та антиген-зв'язуючі фрагменти антитіл згідно винаходу не є антитілами типу ОС125, 48 антитілами типу М11 чи антитілами OV 197, а також не конкурують з ними, як це визначено у Nustad et al., Tumor Biol. 17:196:219 (1996). Відповідно до одного з варіантів втілення винаходу, антитіла та антиген-зв'язуючі фрагменти антитіл згідно винаходу не є антитілами, похідними від ОС125 чи похідними одноланцюговими антитілами від VK-8, а також не конкурують з ними, як це описано в WO 03/076465. Антитіла згідно винаходу можуть містити в собі, але жодною мірою не обмежуючись цим, поліклональні, моноклональні, химерні, гуманізовані, людські, біспецифічні, триспецифічні, мультиспецифічні, одноланцюгові, з дісульфідним зв'язком Fvs, однолан-цюгові Fvs або анти-ідіотипні антитіла. У варіанті втілення винаходу, якому віддається перевага, пропоноване згідно винаходу антитіло є моноклональним антитілом, яке зв'язує переважним чином клітинно-асоційований поліпептид СА 125/О772Р, споріднений із вивільненим поліпептидом СА 125/О772Р. Мультиспецифічні антитіла можуть взаємодіяти вибірково з найрізноманітнішими епітопами клітинно-асоційованого СА 125/О772Р або можуть бути специфічними як до епітопу клітинно-асоційованого СА 125/О772Р, так і до гетерологічного епітопу, такого як гетерологічний поліпептид або матеріал підкладки. Див., наприклад, Tutt et al., J. Immunol. 147(1): 60-69 (1991); Kostelny et al., J. Immunol. 148(5): 15471553 (1992); а також патенти США №№4 474 893, 4 714 681, 4 925 648, 5 573 920, 5 601819, 5 798 229, 5 855 866, 5 869 620, 5 897 861, 5 959 084, 6 106 833, 6 248 332, 6 258 358, 6 303 755 та 6 420 140. Фрагменти антиген-зв'язуючих антитіл згідно винаходу можуть включати в себе, але жодною мірою не обмежуючись цим, Fab-фрагменти, F(аb')2-фрагменти, одноланцюгові Fvs, фрагменти, що мають в собі варіабельний легколанцюговий поліпептид (VL), фрагменти, що мають в собі варіабельний важколанцюговий поліпептид (VH), або фрагменти, що містять ділянку визначення комплементарності (CDR). Крім того, антитіла та їх антиген-зв'язуючі фрагменти згідно винаходу можуть належати до імуноглобулінів будь-якого класу. Наприклад, антитіла згідно винаходу можуть бути антитілами класу IgG, IgM, IgE, IgD, IgA чи IgY. Антитіла згідно винаходу можуть також бути будь-якого ізотипу. Наприклад, антитіла згідно винаходу можуть бути антитілами важколанцюгового ізотипу IgG1, lgG2, lgG3, lgG4, IgA1 чи ІgА2. Переважною мірою антитіло згідно винаходу є антитілом ізотипу IgG1. Окрім всього цього, антитіла та їх антигензв'язуючі фрагменти згідно винаходу можуть містити в собі одну або декілька ділянок визначення комплементарності (CDR), зокрема, описаних в цьому документі СОВ-послідовностей, що локалізуються всередині природних або ж консенсусних каркасних ділянок, переважним чином каркасних ділянок людини. Окрім того, антитіла та їх антигензв'язуючі фрагменти можуть мати в собі варіабельний легкий ланцюг, зокрема, варіабельну легко 49 ланцюгову ділянку k або l, та/або, - як описано в цьому документі,- варіабельний важкий ланцюг, що локалізовані всередині природних або ж консенсусних каркасних ділянок, переважною мірою каркасних ділянок людини. Такі структурні зони добре відомі фахівцям і можуть включати в себе, зокрема, константну ділянку Сg1 або ж константну ділянку Сg4. Антитіла чи антиген-зв'язуючі фрагменти антитіл, які зв'язують переважним чином клітинноасоційований СА 125/О772Р, можуть бути тваринного походження, включаючи птицю, зокрема, курчат, а також ссавців, включаючи не приматів (зокрема, корови, свині, коня, осла, кози, верблюда, кішки, собаки, морської свинки, щура, миші, вівці) та приматів (зокрема, мавпи, у тому числі макакарезус, горила, шимпанзе, а також людини). Антитіла та антиген-зв'язуючі фрагменти антитіл, які зв'язують переважною мірою клітинноасоційований СА 125/О772Р, є переважно химерними, людськими чи гуманізованими антитілами, включаючи моноклональні антитіла або ж антигензв'язуючі фрагменти антитіл. Як прийнято в цьому описі, до «людських» антитіл або антигензв'язуючих фрагментів антитіл належить антитіла або антиген-зв'язуючі фрагменти антитіл, котрі мають амінокислотну послідовність людського імуноглобуліну, та включають в себе антитіла або антиген-зв'язуючі фрагменти антитіл, ізольовані від бібліотек людського імуноглобуліну або від мишей, які забезпечують експресію антитіл із людських генів. 3 іншого ж боку, згідно з винаходом, пропонуються гібридомні клітини, що продукують моноклональне антитіло згідно винаходу. Згідно одного варіанту виконання винаходу, відповідно до цього винаходу пропонується гібридома 4Е7 (АТСС®, реєстраційний №РТА-5109), гібридома 7А11 (АТСС®, реєстраційний №РТА-5110), гібридома 7С6 (АТСС®, реєстраційний №РТА-5111), гібридома 7F10 (АТСС®, реєстраційний №РТА-5112), гібридома 7G10 (АТСС®, реєстраційний №РТА-5245), гібридома 7Н1 (АТСС®, реєстраційний №РТА5114), гібридома 8А1 (АТСС®, реєстраційний №РТА-5115), гібридома 8В5 (АТСС®, реєстраційний №РТА-5116), гібридома 8С3 (АТСС®, реєстраційний №РТА-5246), гібридома 8Е3 (АТСС®, реєстраційний №РТА-5118), гібридома 8G9 (АТСС®, реєстраційний №РТА-5119), гібридома 15С9 (АТСС®, реєстраційний №РТА-5106), гібридома 16С7 (АТСС®, реєстраційний №РТА-5107), гібридома 16Н9 (АТСС®, реєстраційний №РТА-5108), гібридома 117.1 (АТСС®, реєстраційний №РТА4567), гібридома 325.1 (АТСС®, реєстраційний №РТА-5120), гібридома 368.1 (АТСС®, реєстраційний №РТА-4568), гібридома 446.1 (АТСС®, реєстраційний №РТА-5549), гібридома 501.1 (АТСС®, реєстраційний №РТА-4569), гібридома 621.1 (АТСС®, реєстраційний №РТА-5121), гібридома 633.1 (АТСС®, реєстраційний №РТА-5122), гібридома 654.1 (АТСС®, реєстраційний №РТА-5247), гібридома 725.1 (АТСС®, реєстраційний №РТА5124), гібридома 776.1 (АТСС®, реєстраційний №РТА-4570). 89348 50 Згідно іншого варіанту винаходу, відповідно до цього винаходу пропонується гібридома, що продукує моноклональні антитіла, котрі конкурують із моноклональним антитілом, що їх продукує гібридома 4Е7 (АТСС®, реєстраційний №РТА-5109), гібридома 7А11 (АТСС®, реєстраційний №РТА5110), гібридома 7С6 (АТСС®, реєстраційний №РТА-5111), гібридома 7F10 (АТСС®, реєстраційний №РТА-5112), гібридома 7G10 (АТСС®, реєстраційний №РТА-5245), гібридома 7Н1 (АТСС®, реєстраційний №РТА-5114), гібридома 8А1 (АТСС®, реєстраційний №РТА-5115), гібридома 8В5 (АТСС®, реєстраційний №РТА-5116), гібридома 8С3 (АТСС®, реєстраційний №РТА-5246), гібридома 8Е3 (АТСС®, реєстраційний №РТА-5118), гібридома 8G9 (АТСС®, реєстраційний №РТА5119), гібридома 15C9 (АТСС®, реєстраційний №РТА-5106), гібридома 16С7 (АТСС®, реєстраційний №РТА-5107), гібридома 16Н9 (АТСС®, реєстраційний №РТА-5108), гібридома 117.1 (АТСС®, реєстраційний №РТА-4567), гібридома 325.1 (АТСС®, реєстраційний №РТА-5120), гібридома 368.1 (АТСС®, реєстраційний №РТА-4568), гібридома 446.1 (АТСС®, реєстраційний №РТА-5549), гібридома 501.1 (АТСС®, реєстраційний №РТА4569), гібридома 621.1 (АТСС®, реєстраційний №РТА-5121), гібридома 633.1 (АТСС®, реєстраційний №РТА-5122), гібридома 654.1 (АТСС®, реєстраційний №РТА-5247), гібридома 725.1 (АТСС®, реєстраційний №РТА-5124), гібридома 776.1 (АТСС®, реєстраційний №РТА-4570) для зв'язування з клітинно-асоційованим СА 125/О772Р. 5.2 Гібридні поліпептиди згідно винаходу В ще одному аспекті відповідно до цього винаходу пропонується гібридний поліпептид, що включає в себе антитіло чи його антигензв'язуючий фрагмент згідно винаходу, приміром, такий, що зв'язує переважним чином клітинноасоційований поліпептид СА 125/О772Р, споріднений з вивільненим поліпептидом СА 125/О772Р, що оперативно зчеплений з гетерологічним агентом. Гібридні поліпептиди згідно винаходу також зв'язують переважним чином клітинноасоційований СА 125/О772Р. В одному з варіантів втілення гібридного поліпептиду згідно винаходу антитіло або антиген-зв'язуючий фрагмент антитіла та гетерологічний агент оперативно зчеплені через ковалентний зв'язок типу пептидного зв'язку чи дісульфідного зв'язку. В іншому варіанті втілення гібридного поліпептиду згідно винаходу антитіло або антиген-зв'язуючий фрагмент антитіла та гетерологічний агент оперативно зчеплені через нековалентний зв'язок. Гетерологічний агент може приєднуватись до амінного чи карбоксильного кінця, або й до будь-якої іншої точки вздовж суміжної послідовності антитіл або антиген-зв'язуючих фрагментів антитіл. Оперативний зв'язок не обов'язково повинен бути безпосередньо між антитілом або антиген-зв'язуючим фрагментом антитіла та гетерологічним агентом; він може забезпечуватися, наприклад, через лінкер-агент, спейсер-агент або й через послідовність. В одному варіанті втілення гібридного поліпептиду згідно винаходу гетерологічний агент включає в себе амінокислотну послідовність або радіоізо 51 топ. Гетерологічний агент гібридного поліпептиду згідно винаходу може містити в собі цитотоксичний агент або ж агент, що піддається виявленню. Гібридні поліпептиди згідно винаходу можуть, зокрема, застосовуватись для продукування антитіл або антиген-зв'язуючих фрагментів антитіл згідно винаходу. З іншого ж боку, гібридні поліпептиди можуть застосовуватись як складова частина способів профілактики або лікування, котрі описані тут далі. Крім того, гібридні поліпептиди згідно винаходу можуть застосовуватись як складова частина імунологічних обстежень in vivo та in vitro, а також для способів очищення із застосуванням відомих методик. Див., зокрема, опубліковану заявку РСТ №WO 93/21232; патенти США №№5 314 995, 5 474 981, 5 514 558, 6 362 317, а також №6 403 769; Nakamura et al., Immunol. Lett. 39(1): 91-99 (1993); Gillies et al., Proc. Natl. Acad. Sci. USA. 89(4): 1428-1432 (1992); та Fell et al., J. Immunol. 146(7): 2446-2452 (1991), які включені до цього опису шляхом посилання на них в цілому. У випадках, коли гетерологічний агент є поліпептидом, до складу гетероло-гічного поліпептиду входить, головним чином, щонайменше приблизно 5, щонайменше приблизно 10, щонайменше приблизно 20, щонайменше приблизно 30, щонайменше приблизно 40, щонайменше приблизно 50, щонайменше приблизно 60, щонайменше приблизно 70, щонайменше приблизно 80, щонайменше приблизно 90, щонайменше приблизно 100 амінокислот. В одному з варіантів втілення винаходу гібридні поліпептиди згідно винаходу включають в себе антитіла чи антиген-зв'язуючі фрагменти антитіл, котрі зв'язують переважною мірою клітинноасоційований СА 125/О772Р і при цьому оперативно зчеплені з гетерологічним агентом, що дозволяє забезпечити позитивний терапевтичний ефект. Наприклад, антитіло чи його антигензв'язуючий фрагмент, що зв'язує переважним чином клітинно-асоційований СА 125/О772Р, можуть бути оперативно зв'язані з лікувальним компонентом цитотоксичної дії, зокрема, цитостатичним або цитопатичним агентом, агентом або радіоактивним іоном, зокрема, таким, що випромінює альфачастинки. Див., зокрема, патенти США №№5 624 827, 5 643 573, 5 789 554, 5 824 782, 5 994 151, 6 042 829, 6 074 644, 6 099 842, 6 132 722, 6 187 287, 6 197 299, а також 6 207 805. До складу цитотоксину чи цитотоксичного агента можуть входити будь-які агенти, які шкідливо впливають на ріст клітин або їх життєздатність. Приклади цитотоксину або цитотоксичного агента включають, жодною мірою не обмежуючись лише цим, паклітаксол (paclitaxol), цитохалазин В (cytochalasin В), граміцидін D (gramicidin D), бромистий етидій (ethidium bromide), еметин (emetine), мітоміцин (mitomycin), етопозид (etoposide), тенопозид (tenoposide), вінкристін (vincristine), вінбластін (vinblastine), колхіцин (colchicin), доксорубіцин (doxorubiein), даунорубіцин (daunorubicin), дігідроксі-антрациндіон (dihydroxy anthracin dione), мітоксантрон (mitoxantrone), мітраміцин (mithramycin), актиноміцин D (actinomycin D), 1-дегідротестостерон (1dehydrotestosterone), глюкокортикоїди 89348 52 (glucocorticoids), прокаїн (procaine), тетракаїн (tetracaine), лідокаїн (lidocaine), пропранолол (propranolol) та пуроміцин (puromycin), а також їх аналоги та гомологи. Інші агенти, які мають потенціальний терапевтичній ефект, включають в себе, жодною мірою не обмежуючись лише цим, антиметаболіти (зокрема, метотрексат (methotrexate), 6-меркаптопурин (б-mercaptopurine), 6-тіогуанін (6thioguanine), цитарабін (cytarabine), 5фтороурацил декарбазин (5-fluorouracil decarbazine), алкілуючі агенти (зокрема, мехлоретамін (mechlorethamine), тіоепа хлорамбуцил (thioepa chlorambucil), мельфалан (melphalan), кармустин (carmustine) (BSNU) та ломустин (lomustine) (CCNU), циклофосфамід (cyclothosphamide), бузулфан (busulfan), дібромоманітол (dibromomannitol), стрептозотоцин (streptozotocin), мітоміцин С (mitomycin С), та цісдихлородіамін платини (II) (DDP) цісплатін (cisdichlorodiamine platinum (II) (DDP) cisplatin), антрацикліни (anthracyclines) (зокрема, даунорубіцин (daunorubicin) (раніше: дауноміцин (daunomycin)) та доксорубіцин (doxorubicin)), антибіотики (зокрема, дактиноміцин (dactinomycin) (раніше: актинономіцин (actinomycin)), блеоміцин (bleomycin), мітрамічин (mithramycin) та антраміцин (АМС) (anthramycin (AMC)), мейтансиноїди (maytansinoids) та анти мітотичні агенти (зокрема, вінкристін (vincristine) та вінбластін (vinblastine)), а також радіоактивні матеріали, включачи, але жодною мірою не обмежуючись лише цим, вісмут (213Ві), вуглець (14С), хром (51Сr), кобальт (57Со), фтор (18F), ґадоліній (153Gd, 159Gd), ґаллій (68Ga, 67 Ga), ґерманій (68Ge), холмій (166Но), індій (115ln, 113 ln, 112In, 111ln), йод (131І, 125І, 123І, 1211), лантан 140 ( La), лютецій (177Lu), марганець (54Мn), молібден (99Мо), палладій (103Pd), фосфор (32Р), празеодим (142Рr), прометій (149Рm), реній (186Re, 188Re), родій (105Rh), рутеній (97Ru), самарій (153Sm), скандій (47Sc), селен (75Se), стронцій (85Sr), сірка (35S), технецій (99Тс), таллій (201Ті), олово (113Sn, 117Sn), тритій (3Н), ксенон (133Хе), ітербій (169Yb, 175Yb), іттрій (90Y) та цинк (65Ζn). Далі, антитіло чи антиген-зв'язуючий фрагмент антитіла можуть бути кон'юговані з терапевтичним агентом або лікарським засобом. Терапевтичні агенти або лікарські засоби не можуть бути сконструйовані типово для класичних хімічних терапевтичних агентів. Приміром, лікарський засіб може бути білком або поліпептидом, що має бажану біологічну активність. До таких білків можуть належати, наприклад, але жодною мірою не обмежуючись лише ними, токсини, такі як абрін (abrin), рицин А (rісіn А), екзотоксин синьогнійної палички (pseudomonas exotoxin) (зокрема, РЕ-40), або дифтерійний токсин (diphtheria toxin), рицин (rісіn), ґелонін (gelonin) та антивірусний білок лаконоса (pokeweed antiviral protein), білок типу фактора некрозу пухлини, що включає в себе інтерферон, однак жодною мірою не обмежений лише цим, aінтерферон (IFN-a), b-інтерферон (IFN-b), фактор росту нервів (ФРН), тромбоцитарний фактор росту (PDGF), плазміногенний активатор тканин (ТРА), апоптотичний агент (зокрема, TNF-α, TNF-b, AIM І, як описано в міжнародній заявці РСТ №WO 53 97/33899), AIM II (див. міжнародну заявку РСТ №WO 97/34911), Fas-ліганд (Takahashi et al., J. Immunol., 6: 1567-1574,1994), та VEGI (міжнародна заявка РСТ №WO 99/23105), тромботичний агент або антиангіогенний агент (зокрема, антистатин або ендостатин), або модулятор біологічної реакції, такий як, наприклад, лімфокін (зокрема, інтерлейкін-1 («IL-1»), інтерлейкін-2 («IL-2»), інтерлейкін-6 («IL-6»), гранулоцитарно-макрофагальний колонієстимулюючий фактор («GM-CSF»), а також гранулоцитарний колонієстимулюючий фактор («G-CSF»), макрофагальний колонієстимулюючий фактор («M-CSF») або фактор росту (зокрема, гормон росту («GH»)); протеази або рибонуклеази. 3 іншого ж боку, гібридні поліпептиди згідно винаходу можуть застосовуватися для діагностики, зокрема, для моніторингу розвитку або прогресування раку чи пухлини як складова частина клінічних аналізів, наприклад, для визначення ефективності курсу проведеного лікування, як це роблять, зв'язуючи антитіло з агентом, що піддається виявленню. До агентів, що піддаються виявленню, належать численні ферменти, простетичні групи, флуоресцентні матеріали, люмінесцентні матеріали, біолюмінесцентні матеріали, радіоактивні матеріали, позитронвипромінюючі метали та парамагнітні іони нерадіоактивних металів. Агент, що піддається виявленню, може бути зв'язаний або кон'юґований з антитілом безпосередньо чи опосередковано, через проміжну сполуку (таку, як, наприклад, широковідомий у фаховому світі лінкер) з використанням відомих фахівцям методів та прийомів - див., зокрема, патенти США №№4 741 900, 5 693 764, 5 776 095, 6 008 002, 6 013 531, 6 110 750, 6 124 105, 6 197 523 та 6 225 050. В якості прикладів, що жодною мірою не обмежують обсягу винаходу, до ферментів, котрі можуть бути кон'юґовані з антитілом або антигензв'язуючим фрагментом антитіла згідно винаходу належать b-лактамази, b-галактозідази, фосфатази, пероксідази, редуктази, естерази, гідролази, ізомерази та протеази, такі як пероксидаза хрону, лужна фосфатаза, бета-галактозідаза або ацетилхолінестераза; в якості прикладів, що не обмежують винаходу, до комплексів простетичних груп входять стрептавідин/біотин (streptavidin/biotin) та авідин/біотин (avidin/biotin). В якості не обмежуючих прикладів придатних флуоресцентних матеріалів до цих останніх можуть належати умбелліферон (umbelliferone), флуоресцеїн (fluorescein), флуоресцеїн-ізотіоціанат (fluorescein isothiocyanate), родамін (rhodamine), діхлоротріазініламін-флуоресцеїн (dichlorotriazinylamine fiuorescein), зелений флуоресцентний білок, червоний флуоресцентний білок, дансіл-хлорид (dansyl chloride) або фікоеретрин (phycoerythrin); в якості не обмежуючого прикладу до складу люмінесцентного матеріалу може входити люмінол (luminol). В якості не обмежуючих прикладів до складу біолюмінесцентних матеріалів можуть входити люцифераза (luciferase), люциферин (luciferin) та екворин (aequorin); а прикладами придатних радіоактивних матеріалів є 125І,131I,111Іn, 99m Тс, або 90Y. 89348 54 Відповідно до цього винаходу пропонуються також антитіла або їх антиген-зв'язуючі фрагменти, котрі зв'язують переважною мірою клітинноасоційований СА 125/О772Р, зчеплений з маркерними послідовностями типу пептиду, що сприяє очищенню. Зокрема, в якості маркерної амінокислотної послідовності може виступати гексагістидин-пептид (hexa-histidine peptide), такий як теґ у векторі pQE (QIAGEN, Inc., 9259 Eton Avenue, м. Четуорс, шт. Каліфорнія, 91311), поряд з іншими, що пропонуються в продажу. Як, наприклад, описано в Gentz et al., Proc. Natl. Acad. Sci. USA. 86(3): 821-824 (1989), гістидин, зокрема, гексагістидин забезпечує надійне очищення злитого (або гібридного) білку. До інших пептидних теґів, корисних з точки зору очищення, належать, жодною мірою не обмежуючись лише наведеними далі, також гемаглютиніновий «НА» теґ, який є відповідником епітопу, виробленого з геамглютинінового білку інфлюенци (Wilson et al., Cell. 37(31: 767-778 (1984)), а також «сигнальний» теґ ("flag" tag) (Brizzard еt al., Biotechniques. 16(4): 730-735 (1994)). Такі теґи або маркерні послідовності видаляють із гібриднного поліпептиду переважно ще до застосування, зокрема, використовують їх як складову частину терапевтичного методу. Антитіло чи його антиген-зв'язуючий фрагмент, що зв'язує переважним чином клітинноасоційований СА 125/О772Р, може також, наприклад, бути оперативно зв'язаним з іншим антитілом з метою утворення гетерокон'юґату, що його описано в патенті США №4 676 980, який включено до цього винаходу шляхом посилання в цілому. Прийоми оперативного зв'язування лікарських засобів з антитілами добре відомі, див., зокрема, Arnon et al., "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy", в Monoclonal Antibodies And Cancer Therapy, Reisfeld et al., eds., Alan R. Liss, Inc. (1985) на стор.243-256; Hellstrom et al., "Antibodies For Drug Delivery", в Controlled Drug Delivery (2nd Ed.), Robinson et al., eds., Marcel Dekker, Inc. (1987) на стор.623-653; Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", в Monoclonal Antibodies '84: Biological And Clinical Applications, Pinchera et al., eds., Editrice Kurds (1985) на стор.475-506; Order et al., "Analysis, Results, And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy", in Monoclonal Antibodies For Cancer Detection And Therapy, Baldwin et al., eds., Academic Press (1985) на стор.303-316; Thorpe et al., Immunol. Rev. 62: 119158 (1982); а також патенти США №№5 639 879, 5 744 119, 5 773 001 та 6 441 163. Методи зв'язування або кон'юґації поліпептидів з константними ділянками антитіл добре відомі спеціалістам. Див., зокрема, патенти США №№5 336 603, 5 622 929, 5 359 046, 5 349 053, 5 447 851, 5 648 218, 5 723 125, 5 783181, 5 908 626, 5 844 095, 5112 946, 6 030 613, 6 086 875, 6 194 177, 6 238 667, 6 262 026 та 6 277 375; європейські патенти ЕР 307 434; ЕР 367 166; ЕР 394 827; міжнародну заявку РСТ WO 91/06570; Ashkenazi et al., Proc. Natl. Acad. Sci. USA. 88(23):10535-10539 (1991); Traunecker et al., Nature. 331[615Ц:84-86 55 (1988); Zheng et al., J. Immunol. 154(10): 5590-5600 (1995), а також Vie et al., Proc. Natl. Acad. Sci. USA. 89(23): 11337-11341 (1992), які включені до цього винаходу шляхом посилання на них в цілому. 5.3. Аналоги згідно винаходу До антитіл, антиген-зв'язуючих фрагментів антитіл та гібридних поліпептидів згідно з винаходом відповідно до цього винаходу належать також аналоги антитіл, антиген-зв'язуючих фрагментів антитіл та гібридних поліпептидів, що зв'язують переважною мірою клітинно-асоційований СА 125/О772Р, споріднений з вивільненим СА 125/О772Р. Наприклад, до аналогів згідно винаходу відносяться аналоги моноклонального антитіла, продукованого гібридомою 4Е7 (АТСС®, реєстраційний №РТА-5109), гібридомою 7А11 (АТСС®, реєстраційний №РТА-5110), гібридомою 7С6 (АТСС®, реєстраційний №РТА-5111), гібридомою 7F10 (АТСС®, реєстраційний №РТА-5112), гібридомою 7G10 (АТСС®, реєстраційний №РТА-5245), гібридомою 7Н1 (АТСС® реєстраційний №РТА5114), гібридомою 8А1 (АТСС®, реєстраційний №РТА-5115), гібридомою 8В5 (АТСС®, реєстраційний №РТА-5116), гібридомою 8С3 (АТСС®, реєстраційний №РТА-5246), гібридомою 8Е3 (АТСС®, реєстраційний №РТА-5118), гібридомою 8G9 (АТСС®, реєстраційний №РТА-5119), гібридомою 15С9 (АТСС®, реєстраційний №РТА-5106), гібридомою 16С7 (АТСС®, реєстраційний №РТА-5107), гібридомою 16Н9 (АТСС®, реєстраційний №РТА5108), гібридомою 117.1 (АТСС®, реєстраційний №РТА-4567), гібридомою 325.1 (АТСС®, реєстраційний №РТА-5120), гібридомою 368.1 (АТСС®, реєстраційний №РТА-4568), гібридомою 446.1 (ATCC®, реєстраційний №PTA-5549), гібридомою 501.1 (АТСС®, реєстраційний №РТА-4569), гібридомою 621.1 (АТСС®, реєстраційний №РТА-5121), гібридомою 633.1 (АТСС®, реєстраційний №РТА5122), гібридомою 654.1 (АТСС®, реєстраційний №РТА-5247), гібридомою 725.1 (АТСС®, реєстраційний №РТА-5124), гібридомою 776.1 (АТСС®, реєстраційний №РТА-4570), або ж аналогами антиген-зв'язуючих фрагментів антитіл. Такий аналог має щонайменше одну з перерахованих нижче структурних ознак: а) амінокислотна послідовність, яка переважним чином щонайменше приблизно на 30%, щонайменше приблизно на 35%, щонайменше приблизно на 40%, щонайменше приблизно на 45%, щонайменше приблизно на 50%, щонайменше приблизно на 55%, щонайменше приблизно на 60%, щонайменше приблизно на 65%, щонайменше приблизно на 70%, щонайменше приблизно на 75%, щонайменше приблизно на 80%, щонайменше приблизно на 85%, щонайменше приблизно на 90%, щонайменше приблизно на 95%, або ж щонайменше приблизно на 99% ідентична амінокислотній послідовності попередньо модифікованого антитіла, антиген-зв'язуючого фрагмента антитіла або гібридного поліпептиду; б) закодований в нуклеотидній послідовності, котра гібридизує за суворих умов до комплементу нуклеотидної послідовності, в якій закодовано щонайменше приблизно 5 неперервних амінокислотних залишків, щонайменше приблизно 10 неперервних амінокислотних залиш 89348 56 ків, щонайменше приблизно 15 неперервних амінокислотних залишків, щонайменше приблизно 20 неперервних амінокислотних залишків, щонайменше приблизно 25 неперервних амінокислотних залишків, щонайменше приблизно 40 неперервних амінокислотних залишків, щонайменше приблизно 50 неперервних амінокислотних залишків, щонайменше приблизно 60 неперервних амінокислотних залишків, щонайменше приблизно 70 неперервних амінокислотних залишків, щонайменше приблизно 80 неперервних амінокислотних залишків, щонайменше приблизно 90 неперервних амінокислотних залишків, щонайменше приблизно 100 неперервних амінокислотних залишків, щонайменше приблизно 110 неперервних амінокислотних залишків, щонайменше приблизно 120 неперервних амінокислотних залишків амінокислотної послідовності попередньо модифікованого антитіла, антиген-зв'язуючого фрагменту антитіла або гібридного поліпептиду; або с) закодований в нуклеотидній послідовності, котра щонайменше на приблизно 30%, щонайменше на приблизно 35%, щонайменше на приблизно 40%, щонайменше на приблизно 45%, щонайменше на приблизно 50%, щонайменше на приблизно 55%, щонайменше на приблизно 60%, щонайменше на приблизно 65%, щонайменше на приблизно 70%, щонайменше на приблизно 75%, щонайменше на приблизно 80%, щонайменше на приблизно 85%, щонайменше на приблизно 90%, щонайменше на приблизно 95%, або ж щонайменше на приблизно 99% ідентична кодуючій нуклеотидній послідовності попередньо модифікованого антитіла, антиген-зв'язуючого фрагмента антитіла або ж гібридного поліпептиду. В окремому прикладі втілення винаходу, де аналог антитіла, антиген-зв'язуючого фрагмента антитіла чи гібридного поліпептиду, що зв'язують переважною мірою клітинно-асоційований СА 125/О772Р, включає в себе амінокислотну послідовність, яка переважним чином щонайменше приблизно на 30%, щонайменше приблизно на 35%, щонайменше приблизно на 40%, щонайменше приблизно на 45%, щонайменше приблизно на 50%, щонайменше приблизно на 55%, щонайменше приблизно на 60%, щонайменше приблизно на 65%, щонайменше приблизно на 70%, щонайменше приблизно на 75%, щонайменше приблизно на 80%, щонайменше приблизно на 85%, щонайменше приблизно на 90%, щонайменше приблизно на 95%, або ж щонайменше приблизно на 99% ідентична амінокислотній послідовності моноклонального антитіла, продукованого гібридомою 4Е7 (АТСС®, реєстраційний №РТА-5109), гібридомою 7А11 (АТСС®, реєстраційний №РТА-5110), гібридомою 7С6 (АТСС®, реєстраційний №РТА-5111), гібридомою 7F10 (АТСС®, реєстраційний №РТА5112), гібридомою 7G10 (АТСС®, реєстраційний №РТА-5245), гібридомою 7Н1 (АТСС®, реєстраційний №РТА-5114), гібридомою 8А1 (АТСС®, реєстраційний №РТА-5115), гібридомою 8В5 (АТСС®, реєстраційний №РТА-5116), гібридомою 8С3 (АТСС®, реєстраційний №РТА-5246), гібридомою 8Е3 (АТСС®, реєстраційний №РТА-5118), гібридомою 8G9 (АТСС®, реєстраційний №РТА-5119), гібридомою 15С9 (АТСС®, реєстраційний №РТА 57 5106), гібридомою 16С7 (АТСС®, реєстраційний №РТА-5107), гібридомою 16Н9 (АТСС®, реєстраційний №РТА-5108), гібридомою 117.1 (АТСС®, реєстраційний №РТА-4567), гібридомою 325.1 (АТСС®, реєстраційний №РТА-5120), гібридомою 368.1 (АТСС®, реєстраційний №РТА-4568), гібридомою 446.1 (АТСС®, реєстраційний №РТА-5549), гібридомою 501.1 (АТСС®, реєстраційний №РТА4569), гібридомою 621.1 (АТСС®, реєстраційний №РТА-5121), гібридомою 633.1 (АТСС®, реєстраційний №РТА-5122), гібридомою 654.1 (АТСС®, реєстраційний №РТА-5247), гібридомою 725.1 (АТСС®, реєстраційний №РТА-5124), або ж гібридомою 776.1 (АТСС®, реєстраційний №РТА-4570). Здебільшого аналоги містять менше ніж приблизно 25, менше ніж приблизно 20, менше ніж приблизно 15, менше ніж приблизно 10, менше ніж приблизно 5, менше ніж приблизно 4, менше ніж приблизно 3, менше ніж приблизно 2 амінокислотні заміни, амінокислотні вставки, амінокислотні делеції або амінокислотні комбінації - порівняно з оригінальною молекулою. У варіанті втілення винаходу, якому віддано перевагу, аналоги містять в собі консервативні амінокислотні заміни, виконані на одному чи декількох амінокислотних залишках, які вважаються не надто істотними (це, зокрема, амінокислотні залишки, які не є надто критичними для антитіла в аспекті специфічного чи переважного зв'язування з клітинно-асоційованим СА 125/О772Р). «Консервативною амінокислотною заміною» є така, в котрій амінокислотний залишок замінений мімічним або аналогічним амінокислотним залишком, в якому є боковий ланцюг однойменного заряду чи полярності. Сімейства амінокислотних залишків з боковими ланцюгами однойменного заряду раніше вже описувалися в науковій літературі. До складу цих сімейств входять амінокислоти, що мають лужні бокові ланцюги (зокрема, лізин, аргінін, гістидін), кислотні бокові ланцюги (зокрема, аспарагінова кислота, глутамінова кислота), незаряджені полярні бокові ланцюги (гліцин, аспарагін, глутамін, серін, треонін, тирозин, цистеїн), неполярні бокові ланцюги (аланін, валін, лейцін, ізолейкін, пролін, фенілаланін, метіонін, триптофан), бета-розгалужені бокові ланцюги (зокрема, треонін, валін, ізолейцін) та ароматичні бокові ланцюги (зокрема, тирозин, фенілаланін, триптофан, гістидін). Більше того, аналоги згідно винаходу можуть включати в себе вставки та/або бути, щонайменше частково, продукованими з делецій, споріднених з оригінальною молекулою. Вставки та/або делеції можуть бути будь-якого різновиду або комбінації, якщо тільки задовольняються викладені вище структурні критерії для аналогів згідно винаходу. 3 метою встановлення відсотку ідентичності двох амінокислотних послідовностей або ж двох послідовностей нуклеїнової кислоти ці послідовності вирівнюють, щоб їх порівняння могло бути проведене оптимальним шляхом (зокрема, можуть бути введені розриви в послідовність першої амінокислоти або послідовність нуклеїнової кислоти з метою її оптимального вирівнювання з послідовністю другої аміно- або нуклеїнової кислоти. Після цього виконують порівняння амінокислотних зали 89348 58 шків або нуклеотидів у відповідних амінокислотних або нуклеотидних позиціях. Якщо позиція у першій послідовності зайнята тим самим амінокислотним залишком або нуклеотидом, що й відповідна позиція у другій послідовності, то молекули у цій позиції ідентичні. Відсоток ідентичності двох послідовностей є функцією кількості ідентичних позицій у всіх послідовностях (зокрема, % ідентичність =кількість позицій , що перекриваються/сумарна кількість позицій ´100%). В одному варіанті втілення винаходу обидві послідовності мають однакову довжину. Відсоток ідентичності двох послідовностей може також бути визначений із застосуванням математичного алгоритму. Прикладом такого математичного алгоритму для порівняння двох послідовностей, якому віддано перевагу, причому він, однак, жодною мірою не обмежує обсягу цього винаходу, є алгоритм, що його запропонував Karlin et al., Proc. Natl. Acad. Sci. USA. 87(6): 2264-2268 (1990), а потім модифікував Karlin et al., Proc. Natl. Acad. Sci. USA. 90(12): 5873-5877 (1993). Базуючись на цьому алгоритмі, працюють програми BLASTN та BLASTX (див. Altschul et al, J. Моl. Biol. 215(3): 403-410 (1990)). Пошук нуклеотидів за допомогою сервера BLAST може бути виконаний із використанням набору параметрів програми пошуку нуклеотидів BLASTN, зокрема, на score=100, wordlength=12 з метою визначення нуклеотидної послідовності, гомологічної молекулам нуклеїнової кислоти згідно цього винаходу. Пошук білків за допомогою сервера BLAST може бути виконаний із використанням набору параметрів програми пошуку нуклеотидів BLASTX, зокрема, на score=50, wordlength=3 з метою визначення амінокислотної послідовності, гомологічної молекулам білку згідно цього винаходу. Щоб отримати вирівнювання з інтервалами для порівнювання, можна застосувати методику Gapped BLAST, описану у Altschul et al., Nucleic Acids Res. 25(17): 3389-3402 (1997). Альтернативно цьому, можна вдатися до методики PSI-BLAST, щоб виконати ітераційний пошук, який дає змогу виявити віддалену спорідненість між молекулами (там же). Під час застосування програм BLAST, Gapped BLAST та PSI-Blast можна використовувати параметри за умовчуванням відповідної програми (зокрема, BLASTX та BLASTN). Прикладом іншого математичного алгоритму для порівняння послідовностей, якому віддано перевагу, причому він, однак, жодною мірою не обмежує обсягу прав автора винаходу, є алгоритм Майєрса та Міллера (Myers et al, Comput. Appl. Biosci. 4(1): 11-17 (1988)). На цьому алгоритмі базується робота програми ALIGN (версія 2.0), що є частиною програмного пакету GCG для вирівнювання послідовностей. Під час застосування програми ALIGN для порівняння амінокислотних послідовностей можна застосовувати таблицю маси залишків РАМ120, штраф на довжину делеції 12 та штраф на введення делеції 4. Відсоток ідентичності двох послідовностей може бути також визначений із застосуванням методик, подібних до описаної вище, з використанням дозвільних інтервалів або без них. При 59 обліку відсотка ідентичності зазвичай зараховують лише точні збіги. Аналогом може також бути антитіло, антигензв'язуючий фрагмент антитіла або гібридний поліпептид згідно винаходу, модифіковані шляхом приєднання, зокрема, ковалентного приєднання молекули будь-якого типу до відповідного попередньо модифікованого антитіла чи антигензв'язуючого фрагменту антитіла, що все ще зв'язує переважною мірою клітинно-асоційований СА 125/О772Р. Наприклад, але не обмежуючись тільки цим, антитіло, антиген-зв'язуючий фрагмент антитіла або гібридний поліпептид можуть бути модифіковані шляхом глікозування (glycosylation), ацетилювання (acetylation), алкилювання (alkylation), естерифікації (esterification), ліпідації (lipidation), формилювання (formylation), пеґилювання (pegylation), фосфорилювання (phosphorylation), амідування (amidation), дериватування (derivatization) шляхом захисту/блокування груп, протеолітичного розщеплення, приєднання до клітинного ліганду чи іншого білку, тощо. Крім того, аналог може включати в себе одну чи декілька некласичних амінокислот. До некласичних амінокислот належать - але не виключно - D-ізомери загальних амінокислот, ааміноізомасляна кислота, 4-аміномасляна кислота (4-Abu), 2-аміномасляна кислота (2-Abu), 6амінокапронова кислота (Ahx), 2-аміноізомасляна кислота (2-Аіb), 3-амінопропанова кислота, орнітин (ornithine), норлейцин (norleucine), норвалін (norvaline), гідроксіпролін (hydroxyproline), саркозин (sarcosine), цітрулін (citrulline), цистеїнова кислота, t-бутилгліцин, t-бутилаланін, фенілгліцин, циклогексилаланін, β-аланін, фторамінові кислоти, штучні амінокислоти, такі як: β-метиламінокислоти, Саметиламінокислоти, Na-метиламінокислоти та загальні аналоги амінокислот. В одному з варіантів втілення винаходу аналог демонструє підвищену афін-ність до клітинноасоційованого СА 125/О772Р, спорідненого з відповідним чином попередньо модифікованим антитілом, антиген-зв'язуючими фрагментом антитіла або гібридним поліпептидом. В іншому конкретному варіанті втілення винаходу антитіло, антигензв'язуючий фрагмент антитіла або гібридний поліпептид, що зв'язує переважним чином клітинноасоційований СА 125/О772Р, демонструє більш тривалий період напіввиведення з сироватки крові порівняно з відповідним чином попередньо модифікованим антитілом, антиген-зв'язуючим фрагментом антитіла або гібридним поліпептидом. Наприклад, аналог може демонструвати період напіввиведення з організму тварини, переважно ссавця, ще більш переважно людини, який має тривалість більше приблизно 1 доби, більше приблизно 2 діб, більше приблизно 3 діб, більше приблизно 7 діб, більше приблизно 10 діб, переважною мірою більше приблизно 15 діб, більше приблизно 25 діб, більше приблизно 30 діб, більше приблизно 35 діб, більше приблизно 40 діб, або більше приблизно 45 діб. Для того, щоб продовжити циркулювання в сироватці антитіл, антиген-зв'язуючих фрагментів антитіла або гібридних поліпептидів in vivo, до ан 89348 60 титіл, антиген-зв'язуючих фрагментів антитіла або гібридних поліпептидів, наприклад, можуть бути приєднані молекули інертних полімерів, такі як політелингліколь високої молекулярної ваги (PEG) з мультифункціональним лінкером або без нього шляхом сайт-специфічної кон'югації політелингліколю високої молекулярної ваги (PEG) до амінного чи карбоксильного кінця антитіл, антигензв'язуючих фрагментів антитіл чи гібридних поліпептидів або ж епсілон-аміногрупи, що присутні в лізинових залишках. Перевага віддається дериватизації лінійного полімеру чи полімеру з розгалуженою структурою, що має наслідком мінімальну втрату біологічної активності. Ступінь кон'юґації можна дуже уважно контролювати за методом SDS-PAGE або мас-спектрометрії, що має на меті забезпечити належне приєднання молекул PEG до антитіл. PEG, що не вступив у реакцію, можна відсепарувати від кон'юґату антитіла, антигензв'язуючого фрагменту антитіла чи гібридного поліпептиду з PEG шляхом витіснення за розміром або ж методами іонообмінної хроматографії. PEGдериватизовані антитіла, антиген-зв'язуючі фрагменти антитіл та гібридні поліпептиди можуть бути протестовані на зв'язуючу активність, також на ефективність in vivo із застосуванням методів, що добре відомі фахівцям у цій галузі знань, наприклад, методами імуноферментного аналізу, що описуються далі. Антитіла бо антиген-зв'язуючі фрагменти антитіл, що відзначаються більш тривалим періодом напіввиведення in vivo, можуть також бути продуковані шляхом уведення однієї чи декількох модифікацій амінокислот (зокрема, замін, вставок або делецій) у константний домен IgG або його зв'язуючий фрагмент FcRn (здебільшого фрагмент домену Fc або hinge-Fc). Див., зокрема, міжнародну заявку РСТ №WO 98/23289 та патент США №6 277 375, котрі включені до цього винаходу шляхом посилання на них в цілому. 5.4. Молекули нуклеїнової кислоти згідно винаходу В ще одному аспекті відповідно до цього винаходу пропонується ізольована молекула нуклеїнової кислоти, котра включає в себе нуклеотидну послідовність, в якій закодоване антитіло, антигензв'язуючий фрагмент антитіла, гібридний поліпептид або їх аналоги згідно винаходу. Відповідно до одного варіанту втілення винаходу в молекулі нуклеїнової кислоти згідно винаходу закодоване антитіло, антиген-зв'язуючий фрагмент антитіла, гібридний поліпептид або його аналог, до складу якого входить щонайменше одна, але здебільшого дві або три легколанцюгові ділянки визначення комплементарності (CDR), що перелічені в таблиці 1, таблиці 2, таблиці 3, таблиці 4, таблиці 5 або таблиці 6. Наприклад, молекула нуклеїнової кислоти згідно винаходу може включати в себе нуклеотидні послідовності SEQ ID NO:35, SEQ ID NO:37, SEQ ID NO:39, SEQ ID NO:41, SEQ ID NO:52 або SEQ ID NO:59, в яких закодовано щонайменше одну, здебільшого дві чи три легколанцюгові CDR. Відповідно до іншого варіанту втілення винаходу в молекулі нуклеїнової кислоти згідно вина
ДивитисяДодаткова інформація
Назва патенту англійськоюIsolated monoclonal antibody that binds cell-associated ca 125/0772p polypeptide
Автори англійськоюAlbone Earl F., Soltis Daniel A.
Назва патенту російськоюИзолированное моноклональное антитело, которое связывает клеточно-ассоциированный полипептид са 125/о772р
Автори російськоюОлбон Эрл Ф., Солтис Дениэл А.
МПК / Мітки
МПК: C07K 16/30, C12N 5/16, A61P 35/00, A61K 39/395
Мітки: клітинно-асоційований, антитіло, поліпептид, моноклональне, зв'язує, ізольоване
Код посилання
<a href="https://ua.patents.su/83-89348-izolovane-monoklonalne-antitilo-shho-zvyazueh-klitinno-asocijjovanijj-polipeptid-sa-125-o772r.html" target="_blank" rel="follow" title="База патентів України">Ізольоване моноклональне антитіло, що зв’язує клітинно-асоційований поліпептид са 125/о772р</a>
Попередній патент: Легеневі клітини бавовняного щура sigmodon hispidus для культивування вірусів
Наступний патент: Таблетка без покриття, яка містить оланзапін, та спосіб її одержання
Випадковий патент: Спосіб тепломасообміну