Похідні тетрагідроімідазо[1,5-а]піразину, спосіб одержання і їх медичне застосування
Номер патенту: 101002
Опубліковано: 25.02.2013
Автори: Фан Джянг, Ванг Янг, Танг Пенг Чо, Янг Фанглонг, Фенг Ху, Янг Тао
Формула / Реферат
1. Сполука формули (І) або її фармацевтично прийнятні солі:
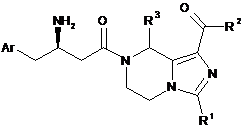 , (I)
, (I)
де:
Аr є феніл, де феніл є незаміщеним або додатково заміщеним 1-5 замісниками, що незалежно вибирають з групи, яка містить галоген, ціано, гідроксил, алкіл або алкоксил, де алкіл або алкоксил є кожен незалежно незаміщеним або заміщеним одним або більше галогенами;
R1 вибирають з групи, що містить водень, алкіл, трифторметил, циклоалкіл, арил і гетероарил, де алкіл, циклоалкіл, арил або гетероарил є кожен необов'язково заміщеним однією або більше групами, що вибирають з групи, яка містить галоген, ціано, арил, гідроксил і аміно, переважно R1 є трифторметил;
R2 вибирають з групи, що містить гідроксил, аміно, алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил, гетероарил і -NR4R5, де алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил або гетероарил є кожен необов'язково заміщеним однією або більше групами, що вибирають з групи, яка містить галоген, аміно, ціано, гідроксил, алкіл, циклоалкіл, алкоксил, арил, гетероарил, -NR4R5, -OC(O)OR8, карбонова кислота i естер карбонової кислоти;
R3 вибирають з групи, що містить водень і алкіл;
R4 і R5 кожен незалежно вибирають з групи, яка містить водень, алкіл, циклоалкіл, гетероциклалкіл, арил і гетероарил, де алкіл, циклоалкіл, гетероциклалкіл, арил або гетероарил є кожен необов'язково заміщеним однією або більше групами, що вибирають з групи, яка містить галоген, гідроксил, аміно, алкоксил, алкіл, ціано, арил, циклоалкіл, гетероциклалкіл, гетероциклічний арил, гідроксіалкіл, -SO2R7, -NR4R5, карбонова кислота і естер карбонової кислоти;
або R4 і R5, узяті разом з атомом, до якого вони приєднані, утворюють 4-8-членний гетероцикл, де 4-8-членний гетероцикл містить один або більше атомів N, О, S, і кожен 4-8-членний гетероцикл є необов'язково заміщеним однією або більше групами, що вибирають з групи, яка містить галоген, гідроксил, аміно, алкоксил, алкіл, ціано, арил, гетероциклалкіл, гетероарил, карбоніл, гідроксіалкіл, -SO2R7, -NR4R5, -C(O)NR4R5, -C(O)R7, =O, карбонова кислота і естер карбонової кислоти;
R7 є алкіл; і
R8 вибирають з групи, що містить алкіл і циклоалкіл.
2. Сполука або її фармацевтично прийнятні солі за пунктом 1, де сполуку вибирають з групи, що містить:
 ,
,
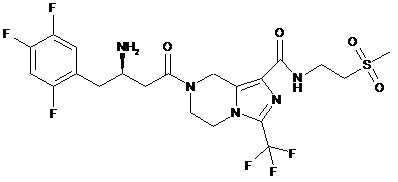 ,
,
 ,
,
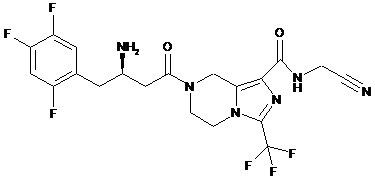 ,
,
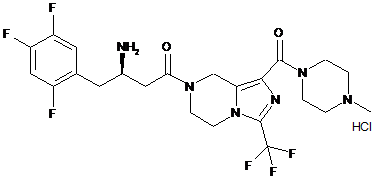 ,
,
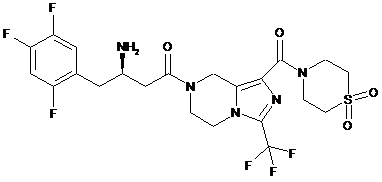 ,
,
 ,
,
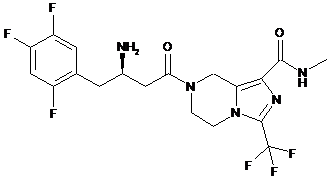 ,
,
,
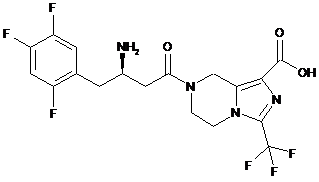 ,
,
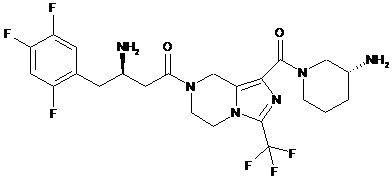 ,
,
 ,
,
 ,
,
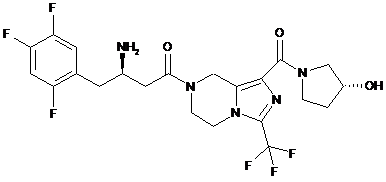 ,
,
 ,
,
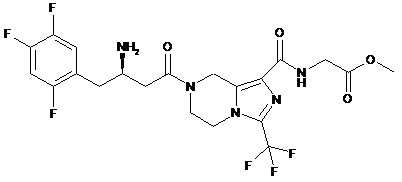 ,
,
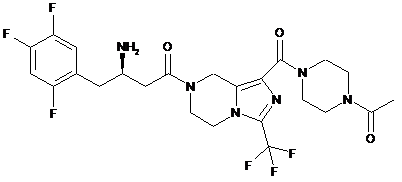 ,
,
 ,
,
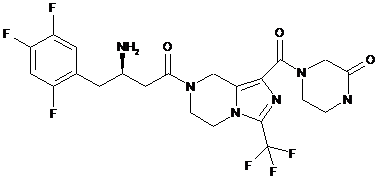 ,
,
 ,
,
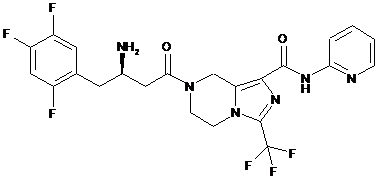 ,
,
 ,
,
 ,
,
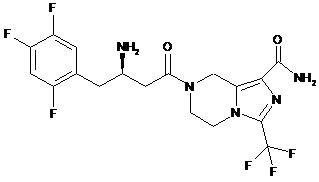 ,
,
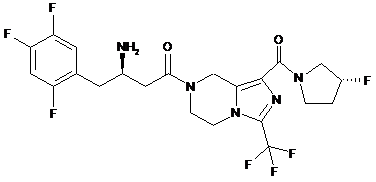 ,
,
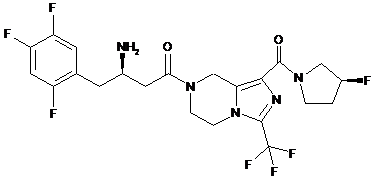 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
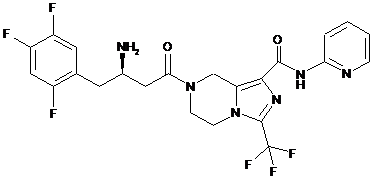 ,
,
 ,
,
 ,
,
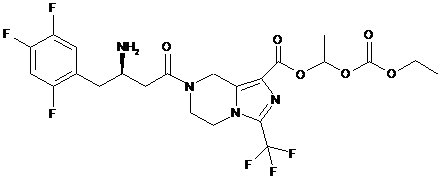 ,
,
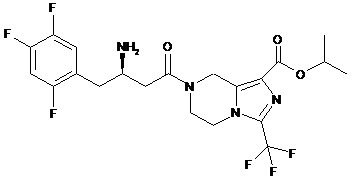 ,
,
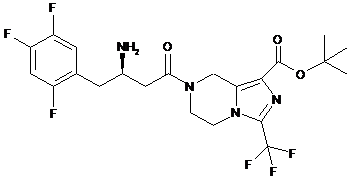 ,
,
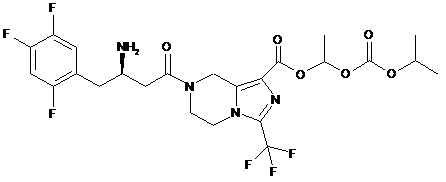 ,
,
 ,
,
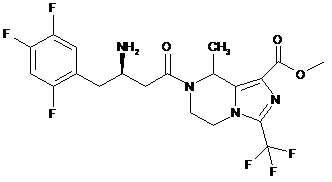 ,
,
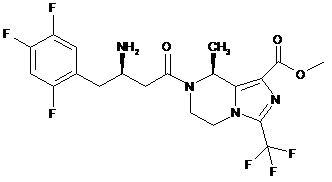 ,
,
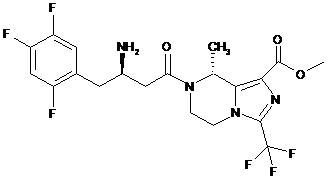 ,
,
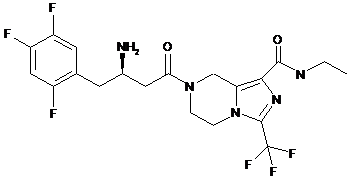 ,
,
 ,
,
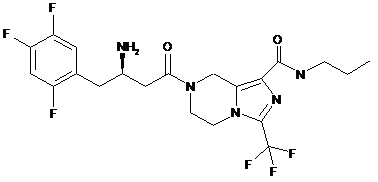 .
.
3. Сполуки або їх фармацевтично прийнятні солі за пунктом 1, де сполуки вибирають з групи, що містить:
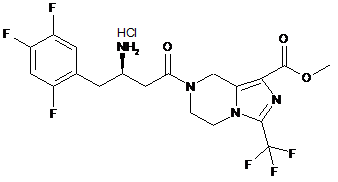 ,
,
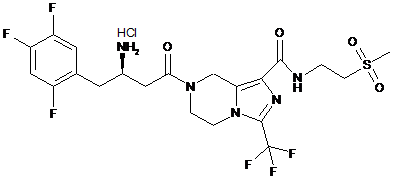 ,
,
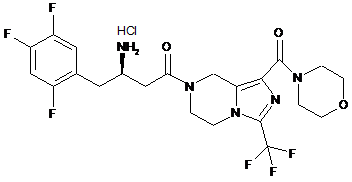 ,
,
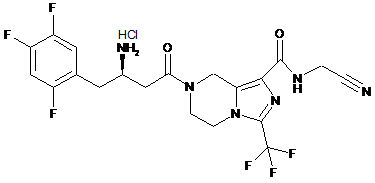 ,
,
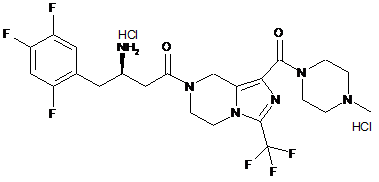 ,
,
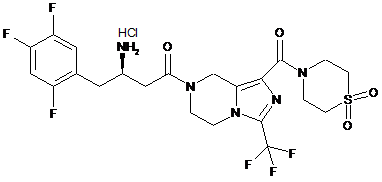 ,
,
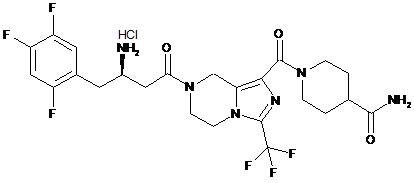 ,
,
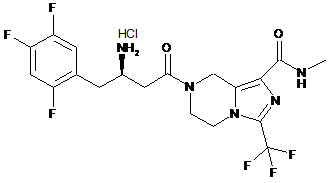 ,
,
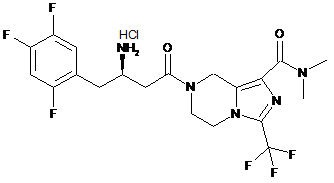 ,
,
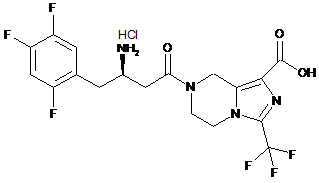 ,
,
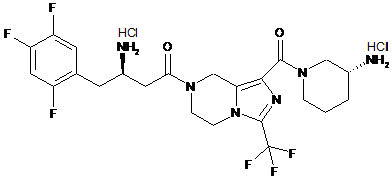 ,
,
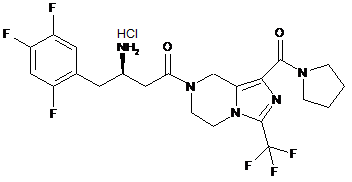 ,
,
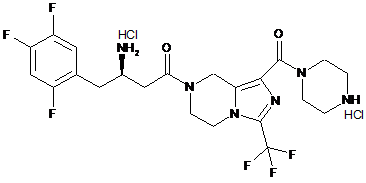 ,
,
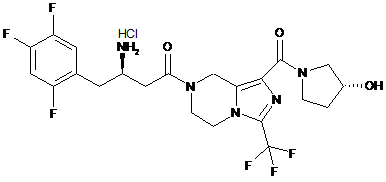 ,
,
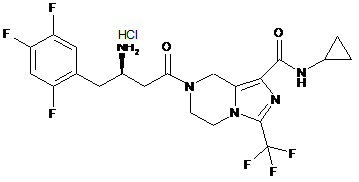 ,
,
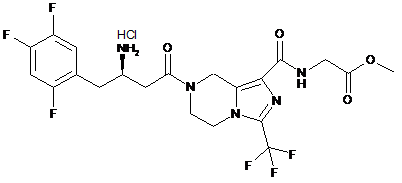 ,
,
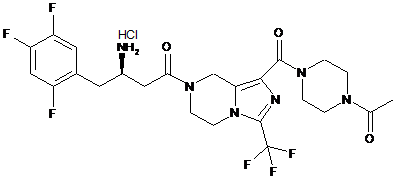 ,
,
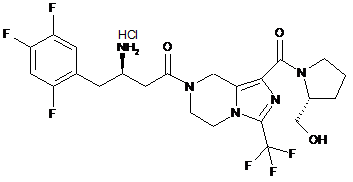 ,
,
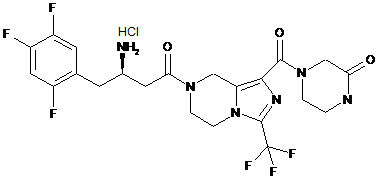 ,
,
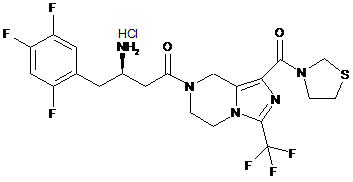 ,
,
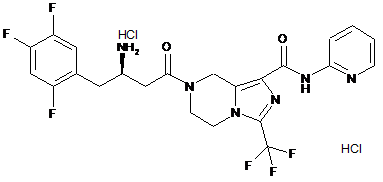 ,
,
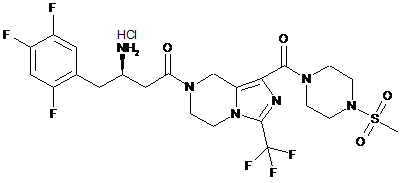 ,
,
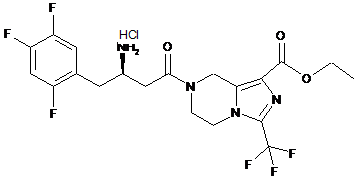 ,
,
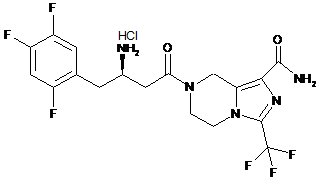 ,
,
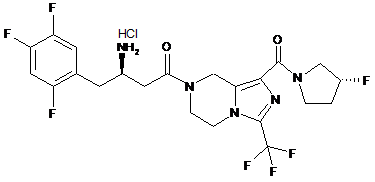 ,
,
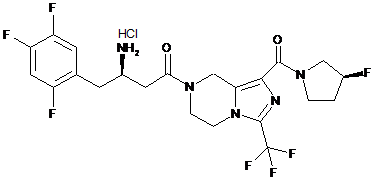 ,
,
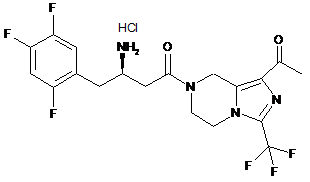 ,
,
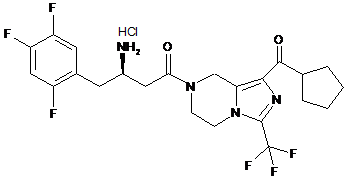 ,
,
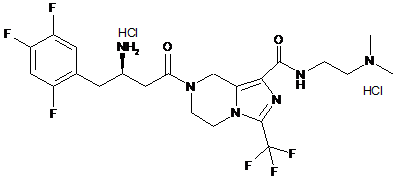 ,
,
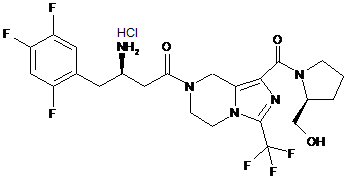 ,
,
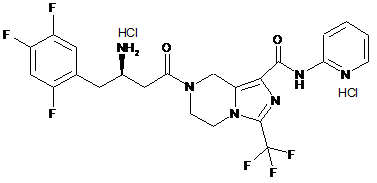 ,
,
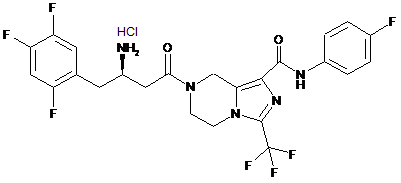 ,
,
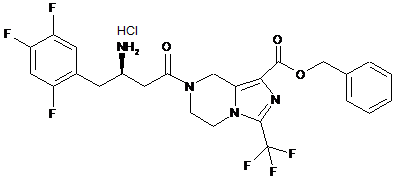 ,
,
 ,
,
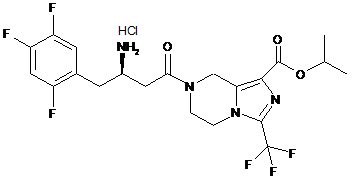 ,
,
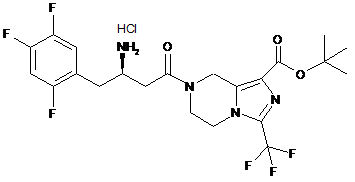 ,
,
 ,
,
 ,
,
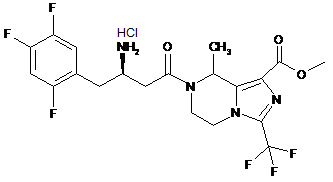 ,
,
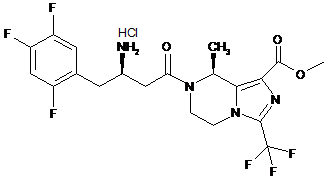 ,
,
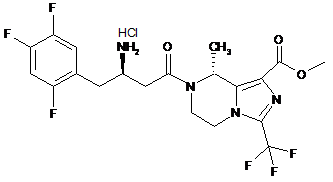 ,
,
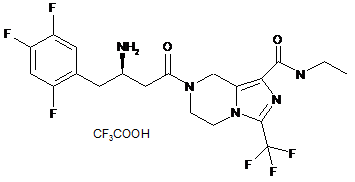 ,
,
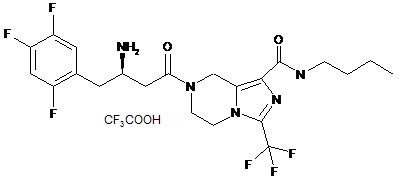 i
i
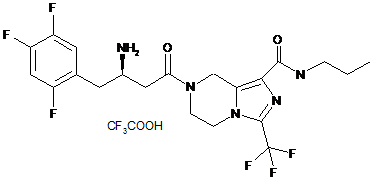 .
.
4. Сполуки або їх фармацевтично прийнятні солі за пунктом 1 або 2, де солями є солі, утворені з сполук і кислот, що вибирають з групи, яка містить яблучну кислоту, молочну кислоту, малеїнову кислоту, хлорводневу кислоту, метансульфонову кислоту, сірчану кислоту, фосфорну кислоту, лимонну кислоту, винну кислоту, оцтову кислоту і трифтороцтову кислоту, переважно сіллю є гідрохлорид.
5. Сполуки формули (ІА) як проміжні сполуки в синтезі сполук формули (І) за пунктом 1:
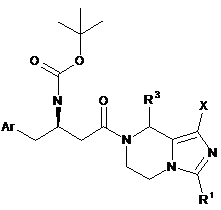 , (ІА)
, (ІА)
де:
Аr є феніл, де феніл є незаміщеним або додатково заміщеним 1-5 замісниками, що незалежно вибирають з групи, яка містить галоген, ціано, гідроксил, алкіл або алкоксил, де алкіл або алкоксил є кожен незалежно незаміщеним або заміщеним одним або більше галогенами;
R1 вибирають з групи, що містить водень, алкіл, трифторметил, циклоалкіл, арил і гетероарил, де алкіл, циклоалкіл, арил або гетероарил є кожен необов'язково заміщеним однією або більше групами, що вибирають згрупи, яка містить галоген, ціано, арил, гідроксил і аміно, переважно R1 є трифторметил;
R3 вибирають з групи, що містить водень і алкіл; і
X є галоген.
6. Сполуки формули (IB) як проміжні сполуки в синтезі сполук формули (І) за пунктом 1:
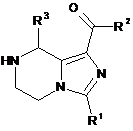 , (IB)
, (IB)
де:
R1 вибирають з групи, що містить водень, алкіл, трифторметил, циклоалкіл, арил і гетероарил, де алкіл, циклоалкіл, арил або гетероарил є кожен необов'язково заміщеним однією або більше групами, що вибирають з групи, яка містить галоген, ціано, арил, гідроксил і аміно, переважно R1 є трифторметил;
R2 вибирають з групи, що містить гідроксил, аміно, алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил, гетероарил і -NR4R5, де алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил або гетероарил є кожен необов'язково заміщеним однією або більше групами, що вибирають з групи, яка містить галоген, аміно, ціано, гідроксил, алкіл, циклоалкіл, алкоксил, арил, гетероарил, -NR4R5, -OC(O)OR8, карбонова кислота і естер карбонової кислоти;
R3 вибирають з групи, що містить водень і алкіл;
R4 і R5 кожен незалежно вибирають з групи, яка містить водень, алкіл, циклоалкіл, гетероциклалкіл, арил і гетероарил, де алкіл, циклоалкіл, гетероциклалкіл, арил або гетероарил є кожен необов'язково заміщеним однією або більше групами, що вибирають з групи, яка містить галоген, гідроксил, аміно, алкоксил, алкіл, ціано, арил, циклоалкіл, гетероциклалкіл, гетероарил, гідроксиалкіл, -SO2R7, -NR4R5, карбонова кислота і естер карбонової кислоти;
або R4 і R5, узяті разом з атомом, до якого вони приєднані, утворюють 4-8-членний гетероцикл, де 4-8-членний гетероцикл містить один або більше атомів N, О, S, і кожен 4-8-членний гетероцикл є необов'язково заміщеним однією або більше групами, що вибирають з групи, яка містить галоген, гідроксил, аміно, алкоксил, алкіл, ціано, арил, гетероциклалкіл, гетероарил, карбоніл, гідроксіалкіл, -SO2R7, -NR4R5, -C(O)NR4R5, -C(O)R7, карбонова кислота і естер карбонової кислоти;
R7 є алкіл; і
R8 вибирають з групи, що містить алкіл і циклоалкіл.
7. Спосіб одержання сполук формули (ІА) за пунктом 5, в якому здійснюють наступні стадії:

взаємодію ангідриду кислоти з піразин-2-метиламіном (ІА_1) з утворенням аміду (ІА_2), де R1 вибирають з групи, що містить водень, алкіл, трифторметил, циклоалкіл, арил і гетероарил, де алкіл, циклоалкіл, арил або гетероарил є кожен незалежно або незаміщеним, або заміщеним однією або більше групами, що незалежно вибирають з групи, яка містить галоген, ціано, арил, гідроксил і аміно; і
R3 вибирають з групи, що містить водень і алкіл;
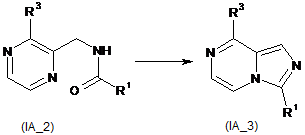
конденсування аміду (ІА_2) з утворенням імідазол[1,5-α]піразину (ІА_3);

відновлення імідазол[1,5-a]піразину (ІА_3) з утворенням R1- і R3-заміщеного тетрагідроімідазо[1,5-a]піразину (ІА_4);
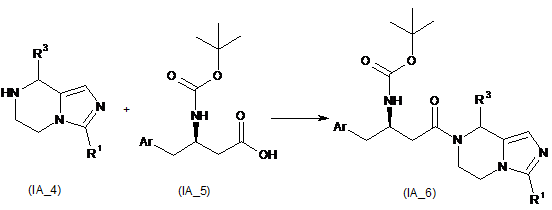
взаємодію R1- і R3-заміщеного тетрагідроімідазо[1,5-a]піразину (ІА_4) з карбоновою кислотою (ІА_5) в присутності конденсувального реагенту з утворенням продукту конденсації (ІА_6), де Аr є феніл, або незаміщений, або заміщений 1-5 замісниками, що незалежно вибирають з групи, яка містить галоген, ціано, гідроксил, алкіл або алкоксил, де алкіл або алкоксил є кожен незалежно незаміщеним або заміщеним одним або більше галогенами;
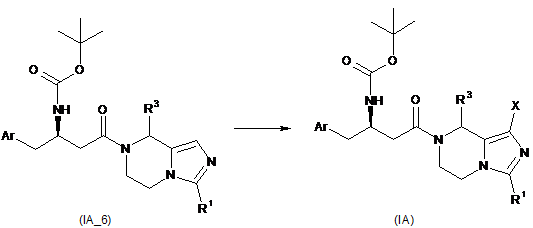
галогенування продукту конденсації (ІА_6) з утворенням сполуки формули (ІА), де X є галоген.
8. Спосіб одержання сполуки формули (IB) за пунктом 6, в якому здійснюють наступні стадії:

відновлення R1 заміщеного імідазол[1,5-a]піразину (IB_1) і захищення аміногрупи одержаного відновленого продукту з утворенням амінозахищеного R1-заміщеного імідазол[1,5-a]піразину (ІВ_2), де R1 вибирають з групи, що містить водень, алкіл, трифторметил, циклоалкіл, арил і гетероарил, де алкіл, циклоалкіл, арил або гетероарил є кожен незалежно або незаміщеним, або заміщеним однією або більше групами, що незалежно вибирають з групи, яка містить галоген, ціано, арил, гідроксил і аміно; X є галоген;
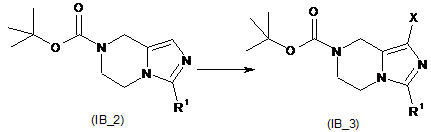
галогенування амінозахищеного R1-заміщеного імідазол[1,5-a]піразину (ІВ_2) з утворенням галогенованої сполуки (ІВ_3);
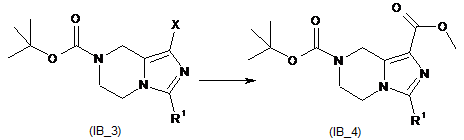
перетворення галогенованої сполуки (ІВ_3) на естерзаміщений тетрагідроімідазо[1,5-a]піразин (ІВ_4);
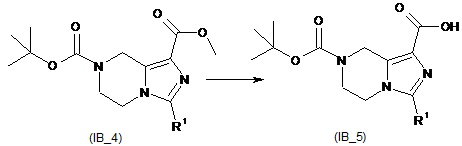
гідроліз естерзаміщеного тетрагідроімідазо[1,5-a]піразину (ІВ_4) з утворенням карбонової кислоти (ІВ_5);

перетворення карбонової кислоти (ІВ_5) з утворенням сполуки (ІВ_6), коли R3 є алкіл,
де R3 вибирають з групи, що містить водень і алкіл;
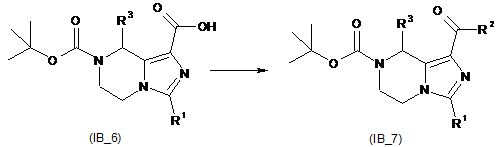
перетворення сполуки (ІВ_6) з утворенням кетонзаміщеного тетрагідроімідазо[1,5-a]піразину (ІВ_7), де R2 вибирають з групи, що містить гідроксил, аміно, алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил, гетероарил і -NR4R5, де алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил або гетероарил є кожен незалежно або незаміщений, або заміщений однією або більше групами, що незалежно вибирають з групи, яка містить галоген, аміно, ціано, гідроксил, алкіл, циклоалкіл, алкоксил, арил, гетероарил, -NR4R5, -OC(O)OR8, карбонова кислота і естер карбонової кислоти;
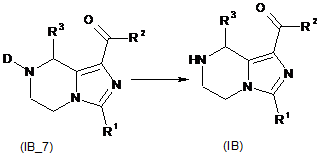
зняття захисту з кетонзаміщеного тетрагідроімідазо[1,5-a]піразину (ІВ_7) з утворенням сполуки формули (IB).
9. Спосіб одержання сполуки формули (І) за пунктами 1-3, в якому здійснюють наступні стадії:
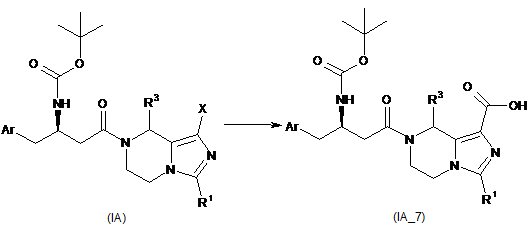
перетворення сполуки формули (ІА) у відповідну карбонову кислоту (ІА_7);
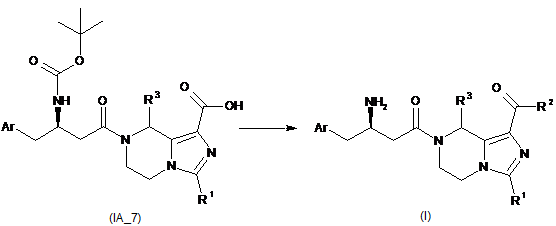
взаємодію карбонової кислоти (ІА_7) з аміном або спиртом в присутності конденсувального реагенту або з 1-галогенованим карбонатом, де R2 вибирають з групи, що містить гідроксил, аміно, алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил, гетероарил і -NR4R5, де алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил або гетероарил є кожен незалежно або незаміщений, або заміщений однією або більше групами, що незалежно вибирають з групи, яка містить галоген, аміно, ціано, гідроксил, алкіл, циклоалкіл, алкоксил, арил, гетероарил, -NR4R5, -OC(O)OR8, карбонова кислота і естер карбонової кислоти; і
зняття захисту із амінозахищеної групи з утворенням сполуки формули (І).
10. Спосіб одержання сполуки формули (І) за пунктом 1-3, в якому здійснюють наступні стадії:

взаємодію сполуки формули (IB) з карбоновою кислотою (ІА_5) в присутності конденсувального реагенту з утворенням продукту конденсації; і
зняття захисту з амінозахищеної групи з утворенням сполуки формули (І).
11. Спосіб одержання за пунктом 9 або 10, в якому здійснюють стадію взаємодії одержаної сполуки формули (І) з кислотами з утворенням кислотно-адитивних солей, де кислоти вибирають з групи, що містить яблучну кислоту, молочну кислоту, малеїнову кислоту, хлорводневу кислоту, метансульфонову кислоту, сірчану кислоту, фосфорну кислоту, лимонну кислоту, винну кислоту, оцтову кислоту і трифтороцтову кислоту, переважно сіллю є гідрохлорид.
12. Фармацевтична композиція, що містить сполуку або її сіль в ефективній терапевтичній дозі за будь-яким з пунктів 1-4, також як і фармацевтично прийнятний носій або екципієнт.
13. Застосування сполуки або її фармацевтично прийнятних солей за будь-яким з пунктів 1-4, при одержанні медикаменту для лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну.
14. Спосіб інгібування каталітичної активності дипептидилпептидази IV, який відрізняється тим, що дипептидилсинтетазу IV піддають контакту із сполукою або її фармацевтично прийнятними солями за будь-яким з пунктів 1-4.
15. Застосування фармацевтичної композиції за пунктом 12 при одержанні медикаменту для лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну.
Текст
Реферат: Описуються похідні тетрагідроімідазо[1,5-а]піразину формули (І), способи їх одержання, фармацевтичні композиції, що містять похідні, і їх використання як медикаментів, особливо як інгібітора дипептидилпептидази IV, де замісники в формулі (І) є такими, як визначено в описі. NH2 Ar R O O 3 R N N N R 1 2 UA 101002 C2 (12) UA 101002 C2 UA 101002 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь винаходу Представлений винахід стосується нових похідних тетрагідро-імідазо[1,5-a]піразину формули (I), способу їх одержання, фармацевтичних композицій, що їх містять, і їх терапевтичного використання, особливо їх фармацевтичного використання як інгібіторів дипептидилпептидази IV. Передумови створення винаходу Діабет відноситься до захворювання, що має множину каузативних факторів і характеризується підвищеними рівнями глюкози в плазмі або гіперглікемією поряд з розладами метаболізму цукру, ліпіду і протеїну, що викликано дефектами секретування і/або дії інсуліну. Діабет є давнім захворюванням і внаслідок абсолютної або відносної нестачі в тілі людини інсуліну призводить до збільшення концентрації глюкози в крові і драматичному вивільненню глюкози в сечу, поряд із збільшенням вживання рідини, збільшенням сечопускання, збільшенням апетиту, втратою ваги, запамороченням, слабкістю і іншими симптомами. Персистентна або неконтрольована гіперглікемія пов„язана із збільшенням захворюваності і передчасною смертю. Часто ненормальний гомеостаз глюкози пов„язаний безпосередньо або не безпосередньо із зміною метаболізму ліпіду, ліпопротеїдну і аполіпопротеїну і іншими метаболічними і гемодинамічними захворюваннями. Пацієнти з цукровим діабетом типу 2 мають особливо підвищений ризик макроваскулярних і мікроваскулярних ускладнень, таких як коронарна хвороба серця, інсульт, периферійне васкулярне захворювання, гіпертензія, нефропатія, нейропатія і ретинопатія. Крім того, критично важливим при клінічному лікуванні цукрового діабету є терапевтичний контроль гомеостазу глюкози, метаболізму ліпіду і гіпертензії. Існує дві загальноприйняті форми діабету. При діабеті типу 1, тобто, інсулінозалежному цукровому діабеті (IDDM), пацієнти мало продукують інсуліну або не продукують інсулін зовсім, який є гормоном, що регулює утилізацію інсуліну. При діабеті типу 2, тобто, неінсулінозалежному цукровому діабеті (NIDDM), пацієнти часто мають рівні інсуліну в плазмі, що є такими ж самими або навіть підвищеними порівняно з недіабетичними суб„єктами; однак, ці пацієнти мають розвинуту резистентність до інсуліностимулювальної дії на глюкозу і метаболізм інсуліну в основних інсулін-чутливих тканинах, таких як м„язи, печінка і жирова тканина, і рівні інсуліну в плазмі, навіть підвищені, недостатні для подолання різко вираженої резистентності до інсуліну. Резистентність до інсуліну не є первинною внаслідок зменшення кількості рецепторів інсуліну, але дефектом постзв„язування інсулінового рецептора, що не є зрозумілим. Ця реактивність резистентності до інсуліну призводить до недостатньої інсулінозалежної активації поглинання глюкози, окиснення і зберігання в м„язах і неадекватне пригнічення ліполізу в адипозній тканині і продукування глюкози і секретування в печінці. Дипептидилсинтетаза-IV (DPP-IV) є серинпротеазою, яка відщеплює N-термінальні дипептиди з поліпептиду, що містить пролінів залишок в передостанньому положенні. Хоча біологічна роль DPP-IV у ссавців ще повністю не встановлена, вважають, що вона відіграє важливу роль в метаболізмі нейропептиду, активації T-клітин, адгезії і інвазії ракових клітин в ендотелій і потрапляння ВІЛ в лімфоїдні клітини (WO98/19998). Нещодавно, було встановлено, що DPP-IV відповідає за попередження секретування GLP-1. Більш особливо, DPP-IV відщеплює аміно-термінальний His-Ala дипептид GLP-1, що інактивує GLP-1(7-36)NH2 з утворенням GLP-1(9-36)NH2 (Endocrinology, 1999, 140: 5356-5363). З фізичної точки зору, час напівжиття цілого GLP-1 в циркулюючій крові є коротшим. неактивний метаболіт GLP-1 після деградації DPP-IV може зв„язуватись з GLP-1 рецептором, ант агонізуючи активність GLP-1 і зменшувати фізіологічна відповідь на GLP-1. Однак, інгібітор DPP-IV може захищати ендогенний або навіть екзогенний GLP-1 від інактивації для значного збільшення біоактивності GLP-1 (5-10-разів). Оскільки GLP-1 є основним стимулятором панкреатичного секретування інсуліну і має безпосередню корисну дію на відкладення глюкози, інгібітор DPP-IV представляє привабливий підхід до лікування неінсулінзалежного цукрового діабету (NIDDM) (US6110949). На сьогодні, було описано декілька інгібіторів DPP-IV (US5462928, US5543396, WO9515309, WO2003004498, WO2003082817, WO2004032836, WO2004085661), де Сітагліптин (MK-0431, Merk) проявляє добру активність і селективність по інгібуванню DPP-IV. Серед них, Сітагліптин поступив у продаж у 2006 році. 1 UA 101002 C2 F F NH2 O N N N N F .H3 PO4 FF MK-0431 5 10 F Хоча були описані деякі інгібітори DPP-IV, відсутні довгодіючі лікарські засоби. І існує потреба в інгібіторах DPP-IV, чиї характеристики будуть кращими. Ціллю представленого винаходу є забезпечення ряду сполук, які можуть інгібувати активність DPP-IV і бути використані для лікування діабету або подібного захворювання, або використані як пом„якшуючі лікарські засоби. Короткий опис суті винаходу Для того щоб обійти недостатність рівня техніки, представлений винахід описує одержання похідних тетрагідро-імідазо[1,5-a]піразину формули (I) і їх таутомерів, енантіомерів, діастереомерів, рацематів, фармацевтично прийнятних солей і метаболітів, метаболічних попередників або їх проліків. Ar O 3 NH2 O R 2 R N N N 1 (I) 15 20 25 30 35 40 45 R де: Ar є феніл, де феніл є незаміщеним або додатково заміщеним 1 - 5 замісниками, що незалежно вибирають з групи, яка містить галоген, ціано, гідроксил, алкіл або алкоксил, де алкіл або алкоксил є кожен незалежно незаміщенним або заміщеним одним або більше галогенів; R1 вибирають з групи, що містить водень, алкіл, трифторметил, циклоалкіл, арил і гетероарил, де алкіл, циклоалкіл, арил або гетероарил є кожен необов„язково заміщеним однією або більше груп, що вибирають з групи, яка містить галоген, ціано, арил, гідроксил і аміно, переважно трифторметил; R2 вибирають з групи, що містить гідроксил, аміно, алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил, гетероарил і -NR4R5, де алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил або гетероарил є кожен необов„язково заміщеним однією або більше груп, що вибирають з групи, яка містить галоген, аміно, ціано, гідроксил, алкіл, циклоалкіл, алкоксил, арил, гетероарил, -NR4R5, -OC(O)OR8, карбонова кислота і естер карбонової кислоти; R3 вибирають з групи, що містить водень і алкіл; R4 і R5 кожен незалежно вибирають з групи, яка містить водень, алкіл, циклоалкіл, гетероциклалкіл, арил і гетероарил, де алкіл, циклоалкіл, гетероциклалкіл, арил або гетероарил є кожен необов„язково заміщеним однією або більше груп, що вибирають з групи, яка містить галоген, гідроксил, аміно, алкоксил, алкіл, ціано, арил, циклоалкіл, гетероциклалкіл, гетероциклічний арил, гідроксиалкіл, -SO2R7, -NR4R5, карбонова кислота і естер карбонової кислоти; або, R4 і R5 узяті разом з атомом до якого вони приєднані утворюючи 4 - 8 членний гетероцикл, де 4 - 8 членний гетероцикл містить один або більше атомів N, O, S, і 4 - 8 членний гетероцикл, необов„язково, заміщений однією або більше груп, що вибирають з групи, яка містить галоген, гідроксил, аміно, алкоксил, алкіл, ціано, арил, гетероциклалкіл, гетероарил, карбоніл, гідроксиалкіл, -SO2R7, -NR4R5, -C(O)NR4R5, -C(O)R7, оксо, карбонова кислота і естер карбонової кислоти; R7 є алкіл; і R8 вибирають з групи, що містить алкіл і циклоалкіл. Фармацевтично прийнятними солями згідно з представленим винаходом є солі утворені представленою сполукою і кислотами, що вибирають з групи, яка містить яблучну кислоту, молочну кислоту, малеїнову кислота, хлорводневу кислоту, метансульфонову кислоту, сірчану кислоту, фосфорну кислоту, лимонну кислоту, винну кислоту, оцтову кислоту і трифтороцтову кислоту. Типовими сполуками представленого винаходу є, але не обмежується: 2 UA 101002 C2 № Структура Назва F F 1 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти метиловий естер O NH2 O O N N N F F F F (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти (2-метансульфонілетил)-амід F F O NH2 O 2 N N H N N F O S O F F F F F N N 3 (R)-3-Аміно-1-[1-(морфолін-4-карбоніл)3трифторметил-5,6-дигідро-8Hімідазо[1,5-a]піразин-7іл]-4-(2,4,5трифторфеніл)-бутан-1-он O NH2 O O N N F F F F F F 4 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти ціанометил-амід O NH2 O N N N F N H N F F F F F O NH2 O N 5 (R)-3-Аміно-1-[1-(4-метил-піперазин-1карбоніл)-3- трифторметил-5,6-дигідро8H-імідазо[1,5-a]піразин-7- іл]-4-(2,4,5трифторфеніл)-бутан-1-он N N N N F HCl F F F F F 6 (R)-3-Аміно-1-[1-(1,1-діоксотіоморфолін-4-карбоніл)-3трифторметил-5,6-дигідро-8Hімідазо[1,5-a]піразин-7-іл]-4-(2,4,5трифтор-феніл)-бутан-1-он (R)-1-{7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3трифторметил-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбоніл}піперидин-4-карбонової кислоти амід (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбонової кислоти метиламід O NH2 O N N S O O N N F F F F F F O NH2 O 7 N N NH2 N N F F F O F F F O NH2 O 8 N N H N N F F F F F F 9 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти диметиламід O NH2 O N N N N F F F F F F 10 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонова кислота O NH2 O OH N N N F F F F F F 11 N N F (R)-3-Аміно-1-[1-(3-аміно-піперидин-1карбоніл)-3- трифторметил-5,6-дигідро8H-імідазо[1,5-a]піразин-7- іл]-4-(2,4,5трифторфеніл)-бутан-1-он O NH2 O N HCl N F F NH2 F 3 UA 101002 C2 F F O NH2 O 12 (R)-3-Аміно-1-[1-(піролідин-1-карбоніл)3трифторметил-5,6-дигідро-8Hімідазо[1,5-a]піразин-7-іл]-4-(2,4,5трифторфеніл)-бутан-1-он N N N N F F F F F F 13 (R)-3-Аміно-1-[1-(піперазин-1-карбоніл)3трифторметил-5,6-дигідро-8Hімідазо[1,5-a]піразин-7-іл]-4-(2,4,5трифторфеніл)-бутан-1-он O NH2 O N N NH N N F HCl F F F F F 14 (R)-3-Аміно-1-[1-((R)-3-гідроксипіролідин-1-карбоніл)-3-трифторметил5,6-дигідро-8H-імідазо[1,5-a]піразин-7іл]-4-(2,4,5-трифторфеніл)-бутан-1-он O NH2 O N N N N F OH F F F F F 15 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбонової кислоти циклопропіламід (R)-({7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3трифторметил-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбоніл}-аміно)оцтової кислоти метиловий естер O NH2 O N N H N N F F F F F F O NH2 O 16 N N F O N H N O F F F F F 17 (R)-1-[1-(4-ацетил-піперазин-1карбоніл)-3- трифторметил-5,6-дигідро8H-імідазо[1,5-a]піразин-7- іл]-3-аміно-4(2,4,5-трифторфеніл)-бутан-1-он O NH2 O N N N N N F O F F F F F 18 (R)-3-Аміно-1-[1-(2-гідроксиметилпіролідин-1- карбоніл)-3-трифторметил5,6-дигідро-8H-імідазо[1,5-a]піразин-7іл]-4-(2,4,5-трифторфеніл)-бутан-1-он O NH2 O N N N N F OH F F F F F 19 (R)-4-{7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил5,6,7,8-тетрагідро- імідазо[1,5-a]піразин1-карбоніл}-піперазин-2-он O NH2 O O N N N N N F F F F F F O NH2 O N N 20 N N F (R)-3-Аміно-1-[1-(тіазолідин-3карбоніл)-3-трифторметил-5,6-дигідро8H-імідазо[1,5-a]піразин-7-іл]-4-(2,4,5трифторфеніл)-бутан-1-он S F F F F F 21 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти (піридин-2-іл)амід O NH2 O N N H N N F F F N F F F 22 (R)-3-Аміно-1-[1-(4-метансульфонілпіперазин-1- карбоніл)-3-трифторметил5,6-дигідро-8H-імідазо[1,5-a]піразин-7іл]-4-(2,4,5-трифторфеніл)- бутан-1-он O NH2 O N N N N N F F F O S O F F F 23 O N F (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти етиловий естер O NH2 O N N F F F 4 UA 101002 C2 F F 24 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти амід O NH2 O NH2 N N N F F F F F F 25 (R)-3-Аміно-1-[1-((R)-3-фтор-піролідин1-карбоніл)-3трифторметил-5,6дигідро-8H-імідазо[1,5-a]піразин-7- іл]-4(2,4,5-трифторфеніл)-бутан-1-он O NH2 O N N N N F F F F F F F 26 (R)-3-Аміно-1-[1-((S)-3-фтор-піролідин1-карбоніл)-3трифторметил-5,6дигідро-8H-імідазо[1,5-a]піразин-7- іл]-4(2,4,5-трифторфеніл)-бутан-1-он O NH2 O N N N N F F F F F F F O NH2 O N 27 N N F (R)-1-(1-Ацетил-3-трифторметил-5,6дигідро-8H- імідазо[1,5-a]піразин-7-іл)-3аміно-4-(2,4,5-трифторфеніл)-бутан-1-он F F F F F 28 (R)-3-Аміно-1-(1-циклопентанкарбоніл3трифторметил-5,6-дигідро-8Hімідазо[1,5-a]піразин-7іл)-4-(2,4,5трифтор-феніл)-бутан-1-он O NH2 O N N N F F F F (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти (2-диметиламіноетил)-амід F F O NH2 O 29 N N H N N F N F F F F F 30 (R)-3-Аміно-1-[1-((S)-2-гідроксиметилпіролідин-1- карбоніл)-3-трифторметил5,6-дигідро-8H-імідазо[1,5-a]піразин-7іл]-4-(2,4,5-трифторфеніл)-бутан-1-он O NH2 O N N N N F F F F OH F F 31 N N H N N F N F F F F F N N H N N F F F (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти (4-фтор-феніл)-амід F O NH2 O 32 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти (піридин-2-іл)амід O NH2 O F F F O N 33 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти бензиловий естер O NH2 O N N F F F F (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти (1етоксикарбонілокси)-етиловий естер F F O NH2 O 34 O N N F O O O N F F F F F 35 O N F (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти ізопропіловий естер O NH2 O N N F F F 5 UA 101002 C2 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти трет-бутиловий естер (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти 1ізопропоксикарбонілокси-етиловий естер (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти (1циклогексилоксикарбонілокси)етиловий естер F F O NH2 O 36 O N N N F F F F F F O NH2 O 37 O O N F O O N N F F F F F O NH2 O 38 O O N F O O N N F F F F F NH2 O 39 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-8метил-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин1-карбонової кислоти метиловий естер O CH3 O N F N N F F F F F NH2 O O N 40 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-(S)-8-метил-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин1-карбонової кислоти метиловий естер O CH3 F N N F F F F F NH2 O 41 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-(R)-8-метил-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин1-карбонової кислоти метиловий естер O CH3 O N F N N F F F F F 42 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти етиламід O NH2 O N N F N N F F F F F 43 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти бутиламід O NH2 O N N F N N F F F F F 44 N N F (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти пропіламід O NH2 O N N F F F або їх фармацевтично прийнятні солі. Типовими сполуками представленого винаходу, але не обмежується: Приклад № Структура Назва F (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)HCl F O NH O бутирил]-3-трифторметил-5,6,7,8O N 1 тетрагідро-імідазо[1,5-a]-піразин-1N N F карбонової кислоти метилового естеру F F F гідрохлорид 2 F F 2 HCl NH2 O O N F N N F F N H (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]-піразин-1карбонової кислоти (2-метансульфоніл O S O F 6 UA 101002 C2 етил)-аміду гідрохлорид F HCl NH2 O F N N 3 O N N F F F F F HCl NH2 O F 4 N N H N N HCl NH2 O N N N N F HCl F F F F HCl NH2 O F O N N 6 F F F HCl NH2 O 7 N N F F 8 NH2 N N F F O F F S O O N N F F O F HCl NH2 O O N F F F 9 N H N N F F HCl NH2 O F O N N N N F F F F F 10 (R)-3-Аміно-1-[1-(4-метил-піперазин-1карбоніл)-3-трифторметил-5,6-дигідро8H-імідазо[1,5-a]піразин-7-іл]-4-(2,4,5-трифторфеніл)бутан-1-ону дигідрохлорид (R)-3-Аміно-1-[1-(1,1-діоксотіоморфолін-4карбоніл)-3трифторметил-5,6-дигідро-8Hімідазо[1,5-a]піразин-7-іл]-4-(2,4,5трифторфеніл)-бутан-1-ону гідрохлорид (R)-1-{7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин1-карбоніл}-піперидин-4-карбонової кислоти аміду гідрохлорид (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]-піразин-1карбонової кислоти метиламіду гідрохлорид (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]-піразин-1карбонової кислоти диметиламіду гідрохлорид O N 5 N F F F F (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]-піразин-1карбонової кислоти ціанометил-аміду гідрохлорид O F F (R)-3-Аміно-1-[1-(морфолін-4карбоніл)-3-трифторметил-5,6-дигідро8H-імідазо[1,5-a]піразин-7-іл]-4-(2,4,5трифторфеніл)-бутан-1-ону гідрохлорид O HCl NH2 O F (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти гідрохлорид O OH N N N F F F F (R)-3-Аміно-1-[1-(3-аміно-піперидин-1карбоніл)-3-трифторметил-5,6-дигідро8H-імідазо[1,5-a]піразин-7-іл]-4-(2,4,5-трифторфеніл)бутан-1-ону дигідрохлорид (R)-3-Аміно-1-[1-(піролідин-1-карбоніл)3-трифторметил-5,6-дигідро-8H-імідазо[1,5a]піразин-7-іл]-4-(2,4,5-трифторфеніл)бутан-1-ону гідрохлорид (R)-3-Аміно-1-[1-(піперазин-1-карбоніл)3трифторметил-5,6-дигідро-8Hімідазо[1,5-a] піразин-7-іл]-4-(2,4,5-трифторфеніл)бутан-1-ону дигідрохлорид F HCl NH2 O F O NH2 N 11 N F F F F HCl N N F F HCl NH2 O O N N 12 N N F F F F F 13 HCl NH2 O O N N F F N NH N HCl F F F 7 UA 101002 C2 F HCl NH2 O F 14 N N F F F F 15 HCl NH2 O O N N H N N F F F F F HCl NH2 O F 16 O N F F F HCl NH2 O 17 N N O F F F 18 F N N F F HCl NH2 O O N N N N F F HCl NH2 O 19 O N N N F F F F F HCl NH2 O O N N 20 F F F F 21 HCl NH2 O O N N H N N F N F HCl F F F HCl NH2 O F 22 O N N F F F 23 HCl NH2 O F O O N N N F F F F F 24 HCl NH2 O F O NH2 N F O S O N N N F F S N N F F O N N F OH F F F F O O N F O N H N N F F OH N N F F (R)-3-Аміно-1-[1-((R)-3-гідроксипіролідин-1-карбоніл)-3-трифторметил5,6дигідро-8H-імідазо[1,5-a]піразин-7-іл]-4(2,4,5трифторфеніл)-бутан-1-ону гідрохлорид (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]-піразин-1карбонової кислоти циклопропіламіду гідрохлорид (R)-({7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбоніл}-аміно)-оцтової кислоти метилового естеру гідрохлорид (R)-1-[1-(4-Ацетил-піперазин-1карбоніл)-3- трифторметил-5,6-дигідро8H-імідазо[1,5-a]піразин-7-іл]-3-аміно-4-(2,4,5трифторфеніл)бутан-1-ону гідрохлорид (R)-3-Аміно-1-[1-(2гідроксиметилпіролідин-1- карбоніл)-3трифторметил-5,6-дигідро-8Hімідазо[1,5-a]піразин-7-іл]-4-(2,4,5трифторфеніл)-бутан-1-ону гідрохлорид (R)-4-{7-[3-Аміно-4-(2,4,5трифторфеніл)бутирил]-3трифторметил-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбоніл}піперазин-2-ону гідрохлорид (R)-3-Аміно-1-[1-(тіазолідин-3-карбоніл)3трифторметил-5,6-дигідро-8Hімідазо[1,5-a]-піразин-7-іл]-4-(2,4,5трифторфеніл)бутан-1-ону гідрохлорид (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]-піразин-1карбонової кислоти (піридин-2-іл)аміду дигідрохлорид (R)-3-Аміно-1-[1-(4-метансульфонілпіперазин-1-карбоніл)-3-трифторметил5,6- дигідро-8H-імідазо[1,5-a]піразин-7іл]-4-(2,4,5- трифторфеніл)-бутан-1-ону гідрохлорид (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти етилового естеру гідрохлорид (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]-піразин-1карбонової кислоти аміду гідрохлорид O N N F F F 8 UA 101002 C2 F HCl NH2 O F 25 N N F F F F 26 HCl NH2 O N N F N N F F F HCl F N N N F F F F HCl F N F F F F 29 HCl NH2 O O N F F F HCl F O NH2 O N N 30 N HCl N H N N F F N N F F F F HCl F N N H N N F N F F F HCl NH2 O O N N F F F F HCl F O NH2 O 34 F O N F N H N N F F F O NH2 O 33 N HCl HCl F 32 OH F F F F F O NH2 O 31 (R)-3-Аміно-1-(1-циклопентанкарбоніл3трифторметил-5,6-дигідро-8Hімідазо[1,5-a]піразин-7-іл)-4-(2,4,5-трифторфеніл)бутан-1-ону гідрохлорид (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]-піразин-1карбонової кислоти (2-диметиламіноетил)-аміду дигідрохлорид (R)-3-Аміно-1-[1-((S)-2-гідроксиметилпіролідин-1-карбоніл)-3-трифторметил5,6-дигідро-8H-імідазо[1,5-a]піразин-7іл]-4-(2,4,5-трифторфеніл)-бутан-1-ону гідрохлорид (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]-піразин-1карбонової кислоти (піридин-2-іл)аміду дигідрохлорид (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]-піразин-1карбонової кислоти (4-фтор-феніл)аміду гідрохлорид (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]-піразин-1карбонової кислоти бензилового естеру гідрохлорид (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]-піразин-1карбонової кислоти (1етоксикарбонілокси)-етилового естеру гідрохлорид (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]-піразин-1карбонової кислоти ізопропілового естеру гідрохлорид N N F F F O NH2 O 28 (R)-1-(1-Ацетил-3-трифторметил-5,6дигідро-8H- імідазо[1,5-a]піразин-7-іл)-3аміно-4-(2,4,5трифторфеніл)-бутан-1-ону гідрохлорид O NH2 O 27 (R)-3-Аміно-1-[1-((S)-3-фторпіролідин-1карбоніл)-3-трифторметил-5,6-дигідро8H-імідазо[1,5-a]піразин-7-іл]-4-(2,4,5-трифторфеніл)бутан-1-ону гідрохлорид O F F F N N F F (R)-3-Аміно-1-[1-((R)-3-фторпіролідин-1карбоніл)-3-трифторметил-5,6-дигідро8H- імідазо[1,5-a]піразин-7-іл]-4-(2,4,5трифторфеніл)-бутан-1-ону гідрохлорид O N F O O N O O N F F F F HCl NH2 O F 35 O O N F N N F F F 9 UA 101002 C2 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]-піразин-1карбонової кислоти трет-бутилового естеру гідрохлорид (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]-піразин-1карбонової кислоти 1ізопропоксикарбонілокси-етилового естеру гідрохлорид (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a] піразин-1карбонової кислоти (1циклогексилоксикарбонілокси)етилового естеру гідрохлорид (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-8-метил-3-трифторметил5,6,7,8-тетрагідро- імідазо[1,5-a]піразин1-карбонової кислоти метилового естеру гідрохлорид (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-(S)-8-метил-3-трифторметил5,6,7,8-тетрагідро- імідазо[1,5-a]піразин1-карбонової кислоти метилового естеру гідрохлорид F HCl NH2 O F 36 O O N N N F F F F F HCl NH2 O F 37 O O O N F O O N N F F F F HCl NH2 O F 38 O O O N F O O N N F F F F HCl NH2 O F 39 O CH3 O N F N N F F F F HCl NH2 O F O CH3 O N 40 F N N F F F F HCl NH2 O F O N 41 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]- (R)-8-метил-3-трифторметил5,6,7,8-тетрагідро- імідазо[1,5-a]піразин1-карбонової кислоти метилового естеру гідрохлорид (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти етиламіду трифторацетат O CH3 F N N F F F F F O NH2 O N N 42 F N N CF3COOH F F F F F 43 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти бутиламіду трифторацетат (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1карбонової кислоти пропіламіду трифторацетат O NH2 O N N F N N CF3COOH F F F F F 44 O NH2 O N N F N N CF3COOH F F F або їх фармацевтично прийнятні солі. Крім того, представлений винахід стосується наступних сполук формули (IA), як проміжних сполук в синтезі сполук формули (I): O O N Ar 3 O R X N N (IA) 5 N 1 R де: 10 UA 101002 C2 5 10 Ar є феніл, де феніл є незаміщеним або додатково заміщеним 1 - 5 замісниками, що незалежно вибирають з групи, яка містить галоген, ціано, гідроксил, алкіл або алкоксил, де алкіл або алкоксил є кожен незалежно незаміщенним або заміщеним одним або більше галогенів; R1 вибирають з групи, що містить водень, алкіл, трифторметил, циклоалкіл, арил і гетероарил, де алкіл, циклоалкіл, арил або гетероарил є кожен необов„язково заміщеним однією або більше груп, що вибирають з групи, яка містить галоген, ціано, арил, гідроксил і аміно, переважно трифторметил; R3 вибирають з групи, що містить водень і алкіл; і X є галоген. Крім того, представлений винахід стосується наступних сполук формули (IB), як проміжних сполук в синтезі сполук формули (I): O 3 R 2 R HN N N 1 R (IB) 15 20 25 30 35 де: R1 вибирають з групи, що містить водень, алкіл, трифторметил, циклоалкіл, арил і гетероарил, де алкіл, циклоалкіл, арил або гетероарил є кожен необов„язково заміщеним однією або більше груп, що вибирають з групи, яка містить галоген, ціано, арил, гідроксил і аміно, переважно трифторметил; R2 вибирають з групи, що містить гідроксил, аміно, алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил, гетероарил і -NR4R5, де алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил або гетероарил є кожен необов„язково заміщеним однією або більше груп, що вибирають з групи, яка містить галоген, аміно, ціано, гідроксил, алкіл, циклоалкіл, алкоксил, арил, гетероарил, -NR4R5, -OC(O)OR8, карбонова кислота і естер карбонової кислоти; R3 вибирають з групи, що містить водень і алкіл; R4 і R5 кожен незалежно вибирають з групи, яка містить водень, алкіл, циклоалкіл, гетероциклалкіл, арил і гетероарил, де алкіл, циклоалкіл, гетероциклалкіл, арил або гетероарил є кожен необов„язково заміщеним однією або більше груп, що вибирають з групи, яка містить галоген, гідроксил, аміно, алкоксил, алкіл, ціано, арил, циклоалкіл, гетероциклалкіл, гетероарил, гідроксиалкіл, -SO2R7, -NR4R5, карбонова кислота і естер карбонової кислоти; або, R4 і R5 узяті разом з атомом до якого вони приєднані утворюючи 4 - 8 членний гетероцикл, де 4 - 8 членний гетероцикл містить один або більше атомів N, O, S, і 4 - 8 членний гетероцикл, утворений таким чином, необов„язково заміщений однією або більше груп, що вибирають з групи, яка містить галоген, гідроксил, аміно, алкоксил, алкіл, ціано, арил, гетероциклалкіл, гетероарил, карбоніл, гідроксиалкіл, -SO2R7, -NR4R5, -C(O)NR4R5, -C(O)R7, карбонова кислота і естер карбонової кислоти; R7 є алкіл; і R8 вибирають з групи, що містить алкіл і циклоалкіл. Інший аспект представленого винаходу стосується способу одержання проміжних сполук формули (IA), де спосіб одержання включає наступні стадії: 3 3 R R NH N NH2 N N N (IA_1) 40 O 1 R (IA_2) взаємодію ангідриду кислоти з піразин 2-метиламіном (IA_1) з утворенням аміду (IA_2), де R1 вибирають з групи, що містить водень, алкіл, трифторметил, циклоалкіл, арил і гетероарил, де алкіл, циклоалкіл, арил або гетероарил є кожен незалежно або незаміщений, або заміщений однією або більше груп, що незалежно вибирають з групи, яка містить галоген, ціано, арил, гідроксил і аміно; і R3 вибирають з групи, що містить водень і алкіл; 3 3 R R NH N N O N 1 R N N 1 R 45 (IA_3) (IA_2) конденсування аміду (IA_2) з утворенням імідазол[1,5-α]піразину (IA_3); 11 UA 101002 C2 3 3 R R HN N N N N N 1 1 R R (IA_3) (IA_4) відновлення імідазол[1,5-α]піразину (IA_3) з утворенням R1 і R3 заміщеного тетрагідроімідазо[1,5-α]піразину (IA_4); 3 R N N NH + NH O 3 R O Ar Ar 1 R O O O O HN N OH N (IA_4) 5 1 (IA_5) R (IA_6) взаємодію R1 і R3 заміщеного тетрагідро-імідазо[1,5-α]піразину (IA_4) з карбоновою кислотою (IA_5), в присутності конденсувального реагенту, з утворенням продукту конденсації (IA_6), де Ar є феніл або незаміщений, або заміщений 1 - 5 замісниками, що незалежно вибирають з групи, яка містить галоген, ціано, гідроксил, алкіл або алкоксил, де алкіл або алкоксил є кожен незалежно незаміщенним або заміщеним одним або більше галогенів; O O O O NH NH 3 R O Ar N 3 R O Ar X N N N N N 1 R 1 R 10 N (IA) (IA_6) галогенування продукту конденсації (IA_6) з утворенням сполуки формули (IA). Інший аспект представленого винаходу стосується способу одержання проміжних сполук формули (IB), де спосіб одержання включає наступні стадії: O N O N N N N N 1 R 1 R (IB_1) 15 20 (IB_2) відновлення R1 заміщеного імідазол[1,5-a]піразину (IB_1) і захищення аміногрупи одержаного відновленого продукту з утворенням амінозахищеного R1 заміщеного імідазол[1,5α]піразину (IB_2), де R1 вибирають з групи, що містить водень, алкіл, трифторметил, циклоалкіл, арил і гетероарил, де алкіл, циклоалкіл, арил або гетероарил є кожен незалежно або незаміщений, або заміщений однією або більше груп, що незалежно вибирають з групи, яка містить галоген, ціано, арил, гідроксил і аміно; O O N O N N O X N N 1 N 1 R R (IB_2) (IB_3) галогенування амінозахищеного R1 заміщеного імідазол[1,5-α]піразину (IB_2) з утворенням галогенованої сполуки (IB_3); O O N N O O X N O O N N 1 1 R (IB_3) N R (IB_4) 12 UA 101002 C2 перетворення галогенованої сполуки (IB_3) на естер заміщений тетрагідро-імідазо[1,5α]піразин (IB_4); O O O O O O OH O N N N N N N 1 R 1 R (IB_4) 5 (IB_5) гідроліз естер заміщеного тетрагідро-імідазо[1,5-α]піразину (IB_4) з утворенням карбонової кислоти (IB_5); O O O N O N N O 3 R O OH OH N N N 1 1 R R (IB_5) (IB_6) перетворення карбонової кислоти (IB_5) з утворенням сполуки (IB_6), коли R3 є алкіл, де R3 вибирають з групи, що містить водень і алкіл; O O 3 R O N O N N O 3 R O OH N N N 1 1 R R (IB_7) (IB_6) 10 15 перетворення сполуки (IB_6) з утворенням кетонзаміщеного тетрагідро-імідазо[1,5α]піразину (IB_7), де R2 вибирають з групи, що містить гідроксил, аміно, алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил, гетероарил і -NR4R5, де алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил або гетероарил є кожен незалежно або незаміщений, або заміщений однією або більше груп, що незалежно вибирають з групи, яка містить галоген, аміно, ціано, гідроксил, алкіл, циклоалкіл, алкоксил, арил, гетероарил, -NR4R5, -OC(O)OR8, карбонова кислота і естер карбонової кислоти; O O 3 O 3 R O R 2 2 R R HN N N N N N 1 R 1 R (IB) (IB_7) 20 2 R зняття захисту з кетонзаміщеного тетрагідро-імідазо[1,5-α]піразину (IB_7) з утворенням сполуки формули (IB). Крім того, інший аспект представленого винаходу стосується способу одержання сполук формули (I), де спосіб одержання включає наступні стадії: O O NH O 3 R O Ar NH X Ar N N O O 3 R O OH N N N N 1 1 R R (IA_7) (IA) перетворення сполуки формули (IA) на відповідну карбонову кислоту (IA_7); O O NH Ar O 3 R O OH N N Ar R 2 R N N N N 1 R 1 R (IA_7) O 3 NH2 O (I) 13 UA 101002 C2 5 10 взаємодію карбонової кислоти (IA_7) з аміном або спиртом в присутності конденсувального реагенту, або з 1-галогенованим карбонатом, де R2 вибирають з групи, що містить гідроксил, аміно, алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил, гетероарил і -NR4R5, де алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил або гетероарил є кожен незалежно або незаміщений, або заміщений однією або більше груп, що незалежно вибирають з групи, яка містить галоген, аміно, ціано, гідроксил, алкіл, циклоалкіл, алкоксил, арил, гетероарил, -NR4R5, -OC(O)OR8, карбонова кислота і естер карбонової кислоти; і зняття захисту з амінозахищеної групи з утворенням сполуки формули (I). Інший аспект представленого винаходу стосується способу одержання сполук формули (I), де спосіб одержання включає наступні стадії: O 3 R 2 R HN N N 1 O + O NH Ar O Ar R 2 R N N OH R O 3 NH2 O N 1 R (IB) 15 20 25 30 35 40 45 50 (I) (IA_5) взаємодію сполуки формули (IB) з карбоновою кислотою (IA_5) в присутності конденсувального реагенту з утворенням продукту конденсації; і зняття захисту з амінозахищеної групи з утворенням сполуки формули (I). Крім того, спосіб одержання згаданої сполуки формули (I) також включає стадію взаємодії одержаної сполуки формули (I) з кислотами з утворенням кислотноадитивних солей, де солями є солі утворені із згаданих сполук і кислот, що вибирають з групи, яка містить яблучну кислоту, молочну кислоту, малеїнові кислоту, хлорводневу кислоту, метансульфонову кислоту, сірчану кислоту, фосфорну кислоту, лимонну кислоту, винну кислоту, оцтову кислоту і трифтороцтову кислоту, переважно, хлорводневу кислоту. Представлений винахід стосується фармацевтичної композиції, що містить сполуку або її фармацевтично прийнятні солі, згідно з представленим винаходом, в ефективній терапевтичній дозі, також як і фармацевтично прийнтяний носій або екціпієнт. В іншому аспекті, представлений винахід стосується застосування сполук або їх фармацевтично прийнятних солей при одержанні медикаменту для лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну. В іншому аспекті, представлений винахід стосується способу інгібування каталітичної активності дипептидилпептидази IV, який відрізняється тим, що дипептидилсинтетаза IV контактує із сполукою формулою (I) або її фармацевтично прийнятними солями. В іншому аспекті, представлений винахід стосується застосування будь-якої сполуки формули (І), її солей або фармацевтичної композиції для лікування діабету типу 2, гіперглікемії, ожиріння або резистентності до інсуліну. Детальний опис винаходу Якщо не вказано інше, наступні терміни використовувані в описі і пунктах формули мають значення описані нижче. "Алкіл" стосується насиченої аліфатичної вуглеводневої групи, що включає C1-C20 нерозгалужені і розгалужені групи. Переважно, алкільною групою є алкіл, що має 1 - 10 атомів вуглецю, наприклад, метил, етил, пропіл, 2-пропіл, н-бутил, ізо-бутил, трет-бутил, пентил, і т.і.. Більш переважно, це є нижчий алкіл, що має 1 - 4 атомів вуглецю, наприклад, метил, етил, пропіл, 2-пропіл, н-бутил, ізо-бутил або трет-бутил, і т.і.. Алкільна група може бути заміщеною або незаміщеною. Коли заміщена, групою(ами) замісником є переважно одна або більше, що незалежно вибирають з групи, яка містить галоген, гідроксил, аміно, алкоксил, алкіл, ціано, арил, гетероциклалкіл, гетероарил, карбоніл, гідроксиалкіл, -SO2R7, -NR4R5, -C(O)NR4R5, C(O)R7, -OC(O)OR8, карбонова кислота і естер карбонової кислоти. "Циклоалкіл" стосується 3 - 8 членного повністю вуглецевого моноциклічного кільця, повністю вуглецевого 5-членного/6-членного або 6-членного/6-членного конденсованого бі циклічного кільця або поліциклічного конденсованого кільця ("конденсована" циклічна система означає, що кожне кільце в системі ділить сусідню пару атомів вуглецю з іншим кільцем в системі), де одне або більше кілець можуть містити один або більше подвійних зв„язків, але жодне з кілець не має повністю кон„югованої π-електронної системи. Прикладами циклоалкільних груп є циклопропан, циклобутан, циклопентан, циклопентен, циклогексен, циклогексадієн, адамантан, циклогептан, циклогептатрієн і т.і.. Циклоалкільна група може бути заміщеною або незаміщеною. Коли заміщена, групою(ами) замісником є переважно одна або більше, що незалежно вибирають з групи, яка містить галоген, гідроксил, аміно, алкоксил, алкіл, 14 UA 101002 C2 5 10 15 20 25 30 35 40 45 50 ціано, арил, гетероциклалкіл, гетероарил, карбоніл, гідроксиалкіл, -SO2R7, -NR4R5, C(O)NR4R5, -C(O)R7, карбонова кислота і естер карбонової кислоти. "Арил" стосується груп, що мають, принаймні, одне ароматичне кільце, тобто, що мають кон„юговану π-електронну систему, і він включає повністю вуглецеві циклічні арильну, гетероарильну і біарильну групу. Арильна група може бути заміщеною або незаміщеною. Коли заміщена, групою(ами) замісником є переважно одна або більше, що незалежно вибирають з групи, яка містить галоген, гідроксил, аміно, алкоксил, алкіл, ціано, арил, гетероциклалкіл, гетероарил, карбоніл, гідроксиалкіл, -SO2R7, -NR4R5, -C(O)NR4R5, -C(O)R7, карбонова кислота і естер карбонової кислоти. "Гетероарил" стосується арилу, що має 1 - 3 гетероатомів, що вибирають з групи, яка містить N, O і S, як кільцеві атоми, іншими атомами кільця є C. Згаданим кільцем є 5- або 6членне кільце. Прикладами гетероарильних груп є фурил, тієніл, піридил, піроліл, Nалкілпіроліл, піримідиніл, піразиніл, імідазоліл і т.і.. Гетероарильна група може бути заміщеною або незаміщеною. Коли заміщена, групою(ами) замісником є переважно одна або більше, що незалежно вибирають з групи, яка містить галоген, гідроксил, аміно, алкоксил, алкіл, ціано, арил, гетероциклалкіл, гетероарил, карбоніл, гідроксиалкіл, -SO2R7, -NR4R5, -C(O)NR4R5, C(O)R7, карбонова кислота і естер карбонової кислоти. "Гетероциклалкіл" стосується моноциклічної або конденсованої циклічної групи, що має 5 - 9 кільцевих атомів, де один або два кільцевих гетероатомів вибирають з групи, що містить N, O, і S(O)n (n є цілим числом від 0 до 2), іншими атомами кільця є C, крім того, кільце також має один або більше подвійних зв„язків, але не має повністю кон„югованої π-електронної системи. Незаміщеним гетероциклічним алкілом є, але не обмежується, піролідил, піперидил, піперазиніл, морфолініл, тіоморфолініл, гомопіперазиніл і т.і.. Гетероциклалкіл може бути заміщеним або незаміщеним. Коли заміщений, замісником є, переважно, один або більше, що незалежно вибирають з групи, яка містить галоген, гідроксил, аміно, алкоксил, алкіл, ціано, арил, гетероциклалкіл, гетероарил, карбоніл, гідроксиалкіл, -SO2R7, -NR4R5, -C(O)NR4R5, C(O)R7, карбонова кислота і естер карбонової кислоти. "Гідрокси" стосується -OH групи. "Алкоксил" стосується і -O-(алкілу), і -O-(незаміщеного циклоалкілу). Типовими прикладами є, але не обмежується, метокси, етокси, пропокси, бутокси, циклопропілокси, циклобутилокси, циклопентилокси, циклогексилокси, і т.і.. Алкоксил може бути заміщеним або незаміщеним. Коли заміщений, замісником є, переважно, один або більше, що незалежно вибирають з групи, яка містить галоген, гідроксил, аміно, алкоксил, алкіл, ціано, арил, гетероциклалкіл, гетероарил, карбоніл, гідроксиалкіл, -SO2R7, -NR4R5, -C(O)NR4R5, -C(O)R7, карбонова кислота і естер карбонової кислоти. "Галоген" стосується фтору, хлору, брому або йоду, переважно фтору або хлору. "Трифторметил" стосується -CF3 групи. "Аміно" стосується -NH2 групи. "Ціано" стосується -C≡N групи. "Карбоніл" стосується C(=O) групи. "Карбонова кислота" стосується (алкіл)C(=O)OH групи. "Естер карбонової кислоти" стосується (алкіл) C(=O)O(алкіл). "Гідроксилалкіл" стосується алкільної групи заміщеної гідроксилом. “Фармацевтична композиція" стосується суміші однієї або більше сполук описаних тут або їх фізіологічно/фармацевтично прийнятних солей або проліків, з іншими хімічними компонентами, такими як фізіологічно/фармацевтично прийнятні носії і екціпієнти. Призначенням фармацевтичної композиції є полегшення введення сполуки в організм. СПОСІБ СИНТЕЗУ СПОЛУКИ ВИНАХОДУ Для того щоб досягти цілі винаходу, винахід використовує наступне технічне рішення: Спосіб одержання сполук формули (I) винаходу, що включає наступні стадії: 15 UA 101002 C2 O O 3 R R N N (IA_1) R N NH N NH2 N 3 R 3 3 1 R (IA_3) N N 1 (IA_2) N N N 3 R O Ar HN N N 1 R O NH R (IA_4) 1 R (IA_6) O O O O NH 3 R O Ar NH X (IA_7) 1 R 10 15 20 O N O N N N 1 R R (I) N N O N (IB_6) N N R HN N N R N 1 R 2 R 1 N Ar (IB) R 2 R N N R (IB_7) O 3 NH2 O 1 R 1 N (IB_5) O 3 2 R N OH N R (IB_4) O 3 R O O 1 R OH N N N (IB_3) O 3 N O O O 1 R R O N N (IB_2) O O O O O X 1 (IB_1) 35 1 1 взаємодію ангідриду кислоти з піразин 2-метиламіном (IA_1) з утворенням аміду (IA_2), де R1 вибирають з групи, що містить водень, алкіл, трифторметил, циклоалкіл, арил і гетероарил, де алкіл, циклоалкіл, арил або гетероарил є кожен незалежно або незаміщений, або заміщений однією або більше груп, що незалежно вибирають з групи, яка містить галоген, ціано, арил, гідроксил і аміно; і R3 вибирають з групи, що містить водень і алкіл; конденсування аміду (IA_2) з утворенням імідазол[1,5-α]піразину (IA_3); відновлення імідазол[1,5-α]піразину (IA_3) з утворенням R1 і R3 заміщеного тетрагідро-імідазо[1,5-α]піразину (IA_4); взаємодію R1 і R3 заміщеного тетрагідро-імідазо[1,5-α]піразину (IA_4) з карбоновою кислотою (IA_5), в присутності конденсувального реагенту, з утворенням продукту конденсації (IA_6), де Ar є феніл або незаміщений, або заміщений 1 - 5 замісниками, що незалежно вибирають з групи, яка містить галоген, ціано, гідроксил, алкіл або алкоксил, де алкіл або алкоксил є кожен незалежно незаміщенним або заміщеним одним або більше галогенів; галогенування продукту конденсації (IA_6) з утворенням сполуки формули (IA); перетворення сполуки формули (IA) на відповідну карбонову кислоту (IA_7); взаємодію карбонової кислоти (IA_7) з аміном або спиртом в присутності конденсувального реагенту, або з 1-галогенованим карбонатом, де R2 вибирають з групи, що містить гідроксил, аміно, алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил, гетероарил і -NR4R5, де алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил або гетероарил є кожен незалежно або незаміщений, або заміщений однією або більше груп, що незалежно вибирають з групи, яка містить галоген, аміно, ціано, гідроксил, алкіл, циклоалкіл, алкоксил, арил, гетероарил, -NR4R5, -OC(O)OR8, карбонова кислота і естер карбонової кислоти; і зняття захисту з амінозахищеної групи з утворенням сполуки формули ( I ). Спосіб одержання сполуки формули (I) винаходу, що включає наступні стадії: N 30 N N R O 25 N N N 3 R O Ar OH N N (IA) NH O 3 R O Ar N N 5 O O N 1 R (I) відновлення R1 заміщеного імідазол[1,5-a]піразину (IB_1) і захищення аміногрупиодержаного відновленого продукту з утворенням амінозахищеного R1 заміщеного імідазол[1,5-α]піразину (IB_2), де R1 вибирають з групи, що містить водень, алкіл, трифторметил, циклоалкіл, арил і гетероарил, де алкіл, циклоалкіл, арил або гетероарил є кожен незалежно або незаміщений, або заміщений однією або більше груп, що незалежно вибирають з групи, яка містить галоген, ціано, арил, гідроксил і аміно; галогенування амінозахищеного R1 заміщеного імідазол[1,5-α]піразину (IB_2) з утворенням галогенованої сполуки (IB_3); перетворення галогенованої сполуки (IB_3) на естер заміщений тетрагідроімідазо[1,5-α]піразин (IB_4); гідроліз естер заміщеного тетрагідро-імідазо[1,5-α]піразину (IB_4) з утворенням карбонової кислоти (IB_5); перетворення сполуки (IB_6) з утворенням кетонзаміщеного тетрагідро-імідазо[1,5-α]піразину (IB_7), де R2 вибирають з групи, що містить гідроксил, аміно, алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил, гетероарил і -NR4R5, де алкіл, алкоксил, циклоалкіл, гетероциклалкіл, арил або гетероарил є кожен незалежно або незаміщений, або заміщений однією або більше груп, що незалежно вибирають з групи, яка 16 UA 101002 C2 5 10 15 20 25 30 містить галоген, аміно, ціано, гідроксил, алкіл, циклоалкіл, алкоксил, арил, гетероарил, -NR4R5, -OC(O)OR8, карбонова кислота і естер карбонової кислоти; зняття захисту з кетонзаміщеного тетрагідро-імідазо[1,5-α]піразину (IB_7) з утворенням сполуки формули (IB), взаємодію сполуки ормули (IB) з карбоновою кислотою в присутності конденсувального реагенту з утворенням продукту конденсації; і зняття захисту з амінозахищеної групи з утворенням сполуки формули (I). Очищені сполуки формули (I) безпосередньо взаємодіють з кислотами в метанолі, дихлорметані або етилацетаті з утворенням кислотно-адитивних солей. ПЕРЕВАЖНІ ВТІЛЕННЯ Наступні приклади слугують для ілюстрації винаходу, але приклади не повинні розглядатись як обмеження рамок винаходу. Приклади Структури сполук підтверджували за допомогою 1H ЯМР і МС. Хімічні зсуви 1H ЯМР () приведені в м.ч. (10-6). 1H ЯМР знімали на приладі Bruker AVANCE-400. Розчинниками були дейтерований-метанол (CD3OD), дейтерований-хлороформ (CDCl3) і дейтерованийдиметилсульфоксид (ДМСО-d6) з тетраметилсиланом (TMS) як внутрішній стандарт. Хімічні зсуви приведені в м.ч. (10-6); МС визначали на масспектрометрі FINNIGAN LCQAd (ЕСІ) (виробник: Therm, тип: Finnigan LCQ advantage MAX); IC50 визначали за допомогою NovoStar ELIASA (BMG Co. German); Силікагелем для тонкошарової хроматографії були силікагелеві пластинки Yantai Huanghai HSGF254 або Qingdao GF254; Як носій для колонкової хроматографії зазвичай використовували силікагель Yantai Huanghai 200-300 меш; Всі приклади здійснювали в атмосфері азоту, якщо не було спеціальних пояснень. Атмосфера азоту стосується реакційної колби наповненої з балону 1 л азоту. Атмосфера водню стосується реакційної колби наповненої з балону 1 л водню. Приклад 1 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти метилового естеру гідрохлорид F HCl NH2 O F O O N N N F F F F F F F O O Стадія 1 F O O O Стадія 2 F O F F CN N N N Стадія 6 1g Стадія 7 1h O F HN N NH N NH2 N Стадія 5 F F F N N F F 1j F F F 1k F N N Стадія 9 Стадія 8 1i F F F NH O Стадія 10 Стадія 11 N N F N 1l F O O NH F O N 1m 35 40 F Br N F N F F O O O F F F O O 1f F N O NH 1e 1d 1c 1b 1a O F F OH O NH F Стадія 4 NH2 O Стадія 3 F F F O O COOH F F O O F Стадія 12 F O O NH F O O N N F 1n N F F HCl O NH2 O O O N Стадія 13 F F N F 1 N F F F Стадія 1 2,2-Диметил-5-[2-(2,4,5-трифторфеніл)-ацетил]-[1,3]діоксан-4,6-діон 2,2-Диметил-[1,3]діоксан-4,6-діон (5,69 г, 39,5 ммоль) розчиняли в 400 мл дихлорметану при перемішуванні, після чого додавали (2,4,5-трифторфеніл)-оцтову кислоту 1a (7,15 г, 37,6 ммоль) і 4-диметиламінопіридин (7,35 г, 60,2 ммоль) на бані лід-вода. Потім по краплям повільно додавали суспензію 1-(3-диметиламінопропіл)-3-етилкарбодііміду гідрохлориду (8,28 г, 43,2 ммоль) в 250 мл дихлорметану. Після перемішування при кімнатній температурі протягом 36 годин, реакційну суміш промивали розчином 5% бісульфату калію (250 мл×7) і насиченим розчином хлориду натрію (250 мл×2), сушили над безводним сульфатом натрію, фільтрували і концентрували при пониженому тиску одержуючи вказану в заголовку сполуку 2,2-диметил-5-[2 17 UA 101002 C2 5 10 15 20 25 30 35 40 45 50 55 60 (2,4,5-трифторфеніл)-ацетил]-[1,3]діоксан-4,6-діон 1b (11,4 г, вихід 96%) як білу тверду речовину. МС m/z (ЕСІ): 315,5 [M-1] Стадія 2 3-Оксо-4-(2,4,5-трифторфеніл)-масляної кислоти етиловий естер 2,2-Диметил-5-[2-(2,4,5-трифторфеніл)-ацетил]-[1,3]діоксан-4,6-діон 1b (15,72 г, 49,6 ммоль) розчиняли в 280 мл етанолу при перемішуванні, потім реакційну суміш нагрівали при 70 °C на масляній бані протягом ночі. Після охолодження, суміш концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку 3-оксо-4-(2,4,5-трифторфеніл)-масляної кислоти етиловий естер 1c (12 г, вихід 88%) як жовте масло. МС m/z (ЕСІ): 259 [M-1] Стадія 3 3-Аміно-4-(2,4,5-трифторфеніл)-бут-2-енової кислоти етиловий естер 3-Оксо-4-(2,4,5-трифторфеніл)-масляної кислоти етиловий естер 1c (24,6 г, 94,5 ммоль) розчиняли в 240 мл метанолу, і до розчину додавали ацетат амонію (36,4 г, 473 ммоль). Реакційну суміш нагрівали із зворотнім холодильником 3 години і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску, потім до залишку додавали 100 мл води. Суміш екстрагували етилацетатом (200 мл×3), і об„єднану органічну фазу промивали 200 мл насиченого розчину хлориду натрію, сушили над безводним сульфатом натрію, фільтрували і концентрували при пониженому тиску одержуючи світло-жовту тверду речовину. Одержану тверду речовину розчиняли в 50 мл етилацетату при 80 °C, потім до розчину додавали 50 мл н-гексану і кристал затравку. Суміш охолоджували до кімнатної температури, через пів години додавали 100 мл нгексану. Суміш тримали в холодильнику протягом ночі і потім фільтрували при пониженому тиску одержуючи вказану в заголовку сполуку 3-аміно-4-(2,4,5-трифторфеніл)-бут-2-енової кислоти етиловий естер 1d (19,5 г, вихід 80%) як білу тверду речовину. МС m/z (ЕСІ): 260,1 [M+1] Стадія 4 (R)-3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-масляної кислоти етиловий естер 3-Аміно-4-(2,4,5-трифторфеніл)-бут-2-енової кислоти етиловий естер 1d (4,1 г, 15,8 ммоль) додавали в автоклав, після чого додавали 70 мл метанолу, ди-трет-бутилдикарбонат (3,8 г, 17,4 ммоль), димер хлор(1,5-циклооктадієн)родію (I) (32 мг, 0,0632 ммоль) і (R)-1-[(S)-2(дифенілфосфіно)фероценіл]-етил-трет-бутилфосфін (68 мг, 0,126 ммоль). Реакційну суміш гідрували протягом 24 годин при 6,67 атмосферах при 30 °C. Суміш фільтрували і фільтрат концентрували при пониженому тиску. Потім до залишку при 50 °C додавали 34 мл метанолу, після чого додавали 12 мл води до повного розчинення. Після охолодження до кімнатної температури, суміш тримали в холодильнику протягом ночі і потім фільтрували. Твердий продукт промивали сумішшю розчинників метанолу/вода (об:об = 3:2), сушили у вакуумі одержуючи вказану в заголовку сполуку (R)-3-трет-бутоксикарбоніламіно-4-(2,4,5трифторфеніл)-масляної кислоти етиловий естер 1e (4 г, вихід 70%) як світло-жовту тверду речовину. МС m/z (ЕСІ): 362,4 [M+1] Стадія 5 (R)-3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-масляна кислота (R)-3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-масляної кислоти етиловий естер 1e (10 г, 27,7 ммоль) і гідроксид натрію (3,32 г, 83,1 ммоль) при перемішуванні розчиняли в суміші розчинників 100 мл метанолу і 50 мл води. Реакційна суміш реагували при 40-45 °C протягом 1-1,5 годин, потім частину розчинника упарювали при пониженому тиску. До залишку додавали воду, потім pH доводили до 2-3 використовуючи 1 N хлорводневу кислоту на бані лідвода. Суміш екстрагували етилацетатом (200 мл×3) і об„єднану органічну фазу промивали 200 мл насиченого розчину хлориду натрію, сушили над безводним сульфатом натрію, фільтрували і концентрували при пониженому тиску, і потім перекристалізували з етилацетат/н-гексан одержуючи вказану в заголовку сполуку (R)-3-трет-бутоксикарбоніламіно-4- (2,4,5трифторфеніл)-масляна кислота 1f (9,2 г), як білу тверду речовину, яку безпосередньо використовували на наступній стадії. МС m/z (ЕСІ): 332,3 [M-1] Посилання: Tetrahedron Asymmetry, 2006, 17(2), 205-209 Стадія 6 C-Піразин-2-іл-метиламін 18 UA 101002 C2 5 10 15 20 25 30 35 40 45 50 55 60 Піразин-2-карбонітрил 1g (10,5 г, 100 ммоль) розчиняли в 150 мл 1,4-діоксану при перемішуванні, потім додавали нікель Ренея (1,0 г) в 250 мл автоклаві. Реакційну суміш гідрували протягом 8 годин при 40 атмосферах при 60 °C, фільтрували і концентрували при пониженому тиску одержуючи вказану в заголовку сполуку C-піразин-2-іл-метиламін 1h (10,7 г, вихід 98%) як коричневе масло. МС m/z (ЕСІ): 110 [M+1] Стадія 7 2,2,2-Трифтор-N-піразин-2-ілметил-ацетамід C-Піразин-2-іл-метиламін 1h (10,9 г, 100 ммоль) додавали в реакційну колбу, потім по краплям повільно протягом години при 0 °C на бані лід-вода додавали 20 мл трифтороцтового ангідриду. Реакційна суміш реагували при кімнатній температурі 2 години і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Потім, її концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку 2,2,2-трифтор-N-піразин2-ілметил-ацетамід 1i (21,0 г) як коричневе масло. МС m/z (ЕСІ): 206,1 [M+1] Стадія 8 3-Трифторметил-імідазо[1,5-a]піразин 2,2,2-Трифтор-N-піразин-2-ілметил-ацетамід 1i (21,0 г, 100 ммоль) додавали в реакційну колбу при кімнатній температурі, після чого додавали 100 мл оксихлориду фосфору. Після перемішування при кімнатній температурі протягом 30 хвилин, до розчину додавали пентаоксид фосфору (17,8 г, 125 ммоль). Реакційну суміш нагрівали із зворотнім холодильником 5 годин і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Оксихлорид фосфору видаляли і реакційну систему гасили деіонізованою водою. Суміш доводили до pH 5-6 20% розчином гідроксиду натрію на бані лід-вода. Суміш екстрагували етилацетатом (250 мл×4) і об„єднану органічну фазу сушили над безводним сульфатом натрію, фільтрували і концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку 3-трифторметилімідазо[1,5-a]піразин 1j (12,0 г, вихід 65%) як жовту тверду речовину. МС m/z (ЕСІ): 188,0 [M+1] 1H ЯМР (400 МГц, CDCl3): δ 9,15 (с, 1H), 8,06 (д, 1H), 7,92 (с, 1H), 7,81 (д, 1H) Стадія 9 3-Трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-a]піразин 3-Трифторметил-імідазо[1,5-a]піразин 1j (12,0 г, 64,2 ммоль) розчиняли в 150 мл безводного етанолу при перемішуванні, потім до розчину додавали 10% Pd/C (500 мг). Реакційну суміш перемішували при кімнатній температурі в атмосфері водню протягом ночі. Реакційний розчин фільтрували через шар грубого силікагелю і концентрували при пониженому тиску одержуючи вказану в заголовку сполуку 3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-a]піразин 1k (12,2 г, вихід 99%) як коричневу тверду речовину. 1H ЯМР (400 МГц, CDCl3): δ 6,84 (с, 1H), 4,10 (м, 4H), 3,26 (м, 2H), 1,81 (с, 1H) Стадія 10 (R)-[3-Оксо-1-(2,4,5-трифтор-бензил)-3-(3-трифторметил-5,6-дигідро-8H-імідазо[1,5a]піразин-7-іл)-пропіл]-карбамінової кислоти трет-бутиловий естер В атмосфері азоту, 3-трет-бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-масляну кислоту 1k (8,6 г, 45 ммоль) і 9,4 мл триетиламін розчиняли в 300 мл дихлорметану при перемішуванні. Після перемішування при кімнатній температурі протягом 5 хвилин, до розчину додавали послідовно 3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-a]піразин 1f (15,0 г, 45 ммоль) і біс(2оксо-3-оксазолідиніл)фосфохлорид (17,1 г, 67,3 ммоль). Реакційна суміш реагувала при кімнатній температурі 2 години і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів і потім концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку (R)-[3-оксо-1-(2,4,5-трифтор-бензил)-3-(3-трифторметил-5,6-дигідро-8H-імідазо[1,5a]піразин-7-іл)-пропіл]-карбамінової кислоти трет-бутиловий естер 1l (20,0 г, вихід 88%) як білу тверду речовину. 1H ЯМР (400 МГц, CD3OD): δ 7,25 (м, 1H), 7,11 (м, 1H), 7,032 (с, 1H), 4,93 (м, 2H), 4,35 (м, 3H), 4,05 (м, 2H), 2,99 (м, 2H), 2,73 (м, 2H), 1,34 (с, 9H) Стадія 11 (R)-[3-(1-Бром-3-трифторметил-5,6-дигідро-8H-імідазо[1,5-a]піразин-7-іл)-3оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер (R)-[3-Оксо-1-(2,4,5-трифтор-бензил)-3-(3-трифторметил-5,6-дигідро-8H-імідазо[1,5 19 UA 101002 C2 5 10 15 20 25 30 35 40 45 a]піразин-7-іл)-пропіл]-карбамінової кислоти трет-бутиловий естер 1l (20,0 г, 39,6 ммоль) розчиняли в 300 мл безводного етанолу при перемішуванні і потім до розчину при кімнатній температурі додавали 1-бром-2,5-піролідиндіон (14,1 г, 79,2 ммоль). Після перемішування годину, до суміш додавали карбонат калію (10,9 г, 79,2 ммоль) і ди-трет-бутилдикарбонат (8,6 г, 39,6 ммоль) і суміш перемішували годину і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш фільтрували через шар грубого силікагелю для видалення карбонату калію і потім концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку (R)-[3-оксо-1-(2,4,5-трифтор-бензил)-3-(1-бром-3-трифторметил5,6-дигідро-8H-імідазо[1,5-a]піразин-7-іл)-пропіл]-карбамінової кислоти трет-бутиловий естер 1m (20,0 г, вихід 86%) як білу тверду речовину. 1H ЯМР (400 МГц, CDCl3): δ 7,063 (м, 1H), 6,88 (м, 1H), 4,72 (с, 1H), 4,56 (с, 1H), 4,13 (м, 3H), 3,88 (м, 2H), 2,94 (м, 2H), 2,62 (м, 2H), 1,36 (с, 9H) Стадія 12 (R)-7-[3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти метиловий естер Октакарбонілдикобальт (4,02 г, 11,76 ммоль), етилхлорацетат (0,71 г, 5,88 ммоль), карбонат калію (1,62 г, 11,76 ммоль) і 50 мл метанолу додавали в реакційну колбу. Після перемішування 5 хвилин додавали (R)-[3-оксо-1-(2,4,5-трифторбензил)-3- (1-бром-3-трифторметил-5,6-дигідро8H-імідазо[1,5-a]піразин-7-іл)-пропіл]-карбамінової кислоти трет-бутиловий естер 1m (2,3 г, 3,92 ммоль). Реакційна суміш реагувала при 60 °C на масляній бані і колір реакційної суміші змінювався з червонувато-коричневого на пурпуровий. Через 2 години, мас спектрометрія з електроспрей іонізацією (ЕСІ) показала зникнення вихідного матеріалу. Реакційну суміш концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку (R)-7-[3-третбутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбонової кислоти метиловий естер 1n (1,1 г, вихід 50%) як білу тверду речовину. МС m/z (ЕСІ): 565,0 [M+1] Посилання: Journal of Organometallic Chemistry, 1985, 285(1-3), 293-303 Стадія 13 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти метилового естеру гідрохлорид (R)-7-[3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти метиловий естер 1n (0,12 г, 2,12 ммоль) додавали до розчину 2,2 N хлорводневої кислоти в 5 мл етилацетату. Реакційна суміш реагували при кімнатній температурі 5 годин і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку (R)-7-[3-аміно-4-(2,4,5трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти метилового естеру гідрохлорид 1 (0,12 г, вихід 94,3%) як світло-жовту тверду речовину. МС m/z (ЕСІ): 465,2 [M+1] 1H ЯМР (400 МГц, CD3OD): δ 7,101-7,08 (м, 1H), 6,906-6,864 (м, 1H), 5,343-4,995 (м, 2H), 4,221-4,093 (м, 5H), 3,954 (с, 3H), 2,978-2,937 (м, 2H), 2,71-2,643 (м, 2H), 2,061 (с, 2H) Приклад 2 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти (2-метансульфоніл-етил)-амід гідрохлорид F HCl NH2 O F O N N N F F F 50 F F NH O O N N F 1n O O F F O O N N F F O NH Стадія 1 N F F O F F O O O S N H 2a OH N F F Стадія 2 F O O F NH O O N N F 2b N F F N H F O S F HCl N Стадія 3 F O NH2 O O N F N 2 F F 20 N H F O S O UA 101002 C2 5 10 15 20 25 30 35 40 45 50 Стадія 1 (R)-7-[3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонова кислота (R)-7-[3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти метиловий естер 1n (2,0 г, 3,5 ммоль) розчиняли в 50 мл метанолу при перемішуванні, і до розчину додавали 4 N розчин гідроксиду натрію (30 мл). Реакційна суміш реагувала при кімнатній температурі протягом години доки тонкошарова хроматографія не показала зникнення вихідного матеріалу і доводили до pH 3 використовуючи 2 N розчин хлорводневої кислоти. Реакційну суміш екстрагували етилацетатом (50 мл×4), і об„єднану органічну фазу сушили над безводним сульфатом натрію, фільтрували і концентрували при пониженому тиску одержуючи вказану в заголовку сполуку (R)-7-[3-трет-бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1-карбонова кислота 2a (1,9 г) як світло-жовту тверду речовину. 1H ЯМР (400 МГц, CD3OD): δ 7,29-7,226 (м, 1H), 7,121-7,082 (м, 1H), 5,151-5,028 (м, 2H), 4,409-4,064 (м, 5H), 2,984-2,769 (м, 4H), 1,417-1,255 (м, 9H) Стадія 2 (R)-[3-[1-(2-Метансульфоніл-етилкарбамоїл)-3-трифторметил-5,6-дигідро-8Hімідазо[1,5-a]піразин-7-іл]-3-оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер (R)-7-[3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонова кислота 2a (0,15 г, 0,27 ммоль), 2метансульфоніл-етиламін (65,5 мг, 0,41 ммоль) і біс(2-оксо-3-оксазолідиніл)фосфохлорид (0,104 г, 0,41 ммоль) розчиняли в 5 мл дихлорметану при перемішуванні і потім до розчину додавали триетиламін (0,25 мл, 1,62 ммоль). Реакційна суміш реагувала при кімнатній температурі протягом ночі і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку (R)-[3-[1-(2метансульфоніл-етилкарбамоїл)-3-трифторметил-5,6-дигідро-8Hімідазо[1,5-a]піразин-7-іл]-3-оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти третбутиловий естер 2b (60 мг, вихід 34%) як білу тверду речовину. МС m/z (ЕСІ): 678,2 [M+23] Посилання: Journal of Organic Chemistry, 2006, 71(3), 1220-1225 Стадія 3 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти (2-метансульфоніл-етил)-аміду гідрохлорид (R)-[3-[1-(2-Метансульфоніл-етилкарбамоїл)-3-трифторметил-5,6-дигідро-8H-імідазо[1,5a]піразин-7-іл]-3-оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер 2b (0,06 г, 0,091 ммоль) розчиняли в незначній кількості етилацетату. Потім до розчину додавали розчин 3,1 N хлорводневої кислоти в 4 мл етилацетату. Реакційна суміш реагувала при кімнатній температурі 4 години доки тонкошарова хроматографія не показала зникнення вихідного матеріалу, і її концентрували при пониженому тиску одержуючи вказану в заголовку сполуку (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбонової кислоти (2-метансульфоніл-етил)-аміду гідрохлорид 2 (60 мг) як білу тверду речовину. МС m/z (ЕСІ): 556,3 [M+1]. 1H ЯМР (400 МГц, CD3OD): δ7,44-7,35 (м, 1H), 7,30-7,21 (м, 1H), 5,15-5,02 (м, 2H), 4,53-4,45 (м, 2H), 4,34-4,27 (м, 2H), 4,05-3,94 (м, 4H), 3,89-3,62 (с, 4H), 3,12-3,07 (м, 2H), 3,03-2,82 (м, 2H). Приклад 3 (R)-3-Аміно-1-[1-(морфолін-4-карбоніл)-3-трифторметил-5,6-дигідро-8Hімідазо[1,5-a]піразин-7-іл]-4-(2,4,5-трифторфеніл)-бутан-1-ону гідрохлорид F F HCl NH2 O O N N F N O N F F F 21 UA 101002 C2 F F O O F NH O O N 2a 5 10 15 20 25 30 F F F O O HCl NH2 O F O N N F F F 3a O N N F Стадія 2 N N N F F F F 3 O N F Стадія 1 (R)-[3-[1-(Морфолін-4-карбоніл)-3-трифторметил-5,6-дигідро-8H-імідазо[1,5-a]піразин-7-іл]-3оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер (R)-7-[3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонову кислоту 2a (60 мг, 0,109 ммоль), морфолін (19 мг, 0,218 ммоль) і біс(2-оксо-3-оксазолідиніл)фосфохлорид (53,5 мг, 0,218 ммоль) розчиняли в 5 мл дихлорметану при перемішуванні і потім до розчину додавали триетиламін (0,1 мл, 0,65 ммоль). Реакційна суміш реагувала при кімнатній температурі протягом ночі доки тонкошарова хроматографія не показала зникнення вихідного матеріалу і її концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку (R)-[3-[1-(морфолін-4-карбоніл)-3-трифторметил-5,6-дигідро-8H– імідазо[1,5-a]піразин-7-іл]-3-оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти третбутиловий естер 3a (60 мг, вихід 89%) як білу тверду речовину. МС m/z (ЕСІ): 620,0 [M+1]. Стадія 2 (R)-3-Аміно-1-[1-(морфолін-4-карбоніл)-3-трифторметил-5,6-дигідро-8Hімідазо[1,5-a]піразин-7-іл]-4-(2,4,5-трифторфеніл)-бутан-1-ону гідрохлорид (R)-[3-[1-(Морфолін-4-карбоніл)-3-трифторметил-5,6-дигідро-8H–імідазо[1,5-a]піразин-7-іл]-3оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер 3a (0,07 г, 0,11 ммоль) розчиняли в малій кількості етилацетату. Потім до розчину додавали розчин 3,1N хлорводневої кислоти в 6 мл етилацетату. Реакційна суміш реагувала при кімнатній температурі 4 години і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку (R)-3-аміно-1-[1-(морфолін-4-карбоніл)-3-трифторметил-5,6-дигідро-8Hімідазо[1,5-a]піразин-7-іл]-4-(2,4,5-трифторфеніл)-бутан-1-ону гідрохлорид 3 (70 мг) як світложовту тверду речовину. МС m/z (ЕСІ): 520,2 [M+1]. 1H ЯМР (400 МГц, CD3OD): δ7,42-7,37 (м, 1H), 7,26-7,22 (м, 1H), 5,15-5,05 (м, 2H), 4,53-4,44 (м, 2H), 4,34-4,26 (м, 2H), 4,02-3,94 (м, 4H), 3,89-3,84 (м, 1H), 3,76-3,61 (м, 4H), 3,11-3,06 (м, 2H), 3,05-2,83 (м, 2H). Приклад 4 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти ціанометил-аміду гідрохлорид F F HCl NH2 O O N N F N F F 35 F F O N H N F F O NH O O N N F OH F F F NH O N N 4a F O N F F F O O Стадія 1 N 2a 40 N Стадія 1 N N F OH O O F F F N H F N Стадія 2 HCl NH2 O O N N F 4 N F F N H N F Стадія 1 (R)-[3-[1-(Ціанометил-карбамоїл)-3-трифторметил-5,6-дигідро-8H-імідазо [1,5-a]піразин-7-іл]-3-оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти третбутиловий естер (R)-7-[3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонову кислоту 2a (150 мг, 0,27 ммоль), аміноацетонітрилсульфат (85 мг, 0,41 ммоль), біс(2-оксо-3-оксазолідиніл)фосфохлорид (0,206 г, 0,81 ммоль) і триетиламін (0,37 мл, 2,7 ммоль) розчиняли в 10 мл дихлорметану при 22 UA 101002 C2 5 10 15 20 перемішуванні. Реакційна суміш реагувала при кімнатній температурі протягом ночі і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку (R)-[3-[1(ціанометил-карбамоїл)-3-трифторметил-5,6-дигідро-8H-імідазо[1,5-a]піразин-7-іл]-3-оксо-1(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер 4a (150 мг, вихід 94,4%) як білу тверду речовину. Стадія 2 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти ціанометил-амід гідрохлорид (R)-[3-[1-(Ціанометил-карбамоїл)-3-трифторметил-5,6-дигідро-8H-імідазо[1,5-a]піразин-7-іл]3-оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер 4a (0,3 г, 0,25 ммоль) розчиняли в 10 мл дихлорметану і потім до розчину додавали 5 мл трифтороцтової кислоти. Реакційна суміш реагувала при кімнатній температурі 1 годину доки тонкошарова хроматографія не показала зникнення вихідного матеріалу. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку (R)-7-[3-аміно-4-(2,4,5трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти ціанометил-аміду гідрохлорид 4 (130 мг) як світло-жовту тверду речовину. МС m/z (ЕСІ): 489,2 [M+1]. Приклад 5 (R)-3-Аміно-1-[1-(4-метил-піперазин-1-карбоніл)-3-трифторметил-5,6-дигідро8H-імідазо[1,5-a]піразин-7-іл]-4-(2,4,5-трифторфеніл)-бутан-1-ону дигідрохлорид F F HCl NH2 O O N N HCl F F F F O N N N F F F O NH O O N N F OH F F 25 30 35 40 45 50 NH O HCl NH2 O N F F F O N N N N N 5a F O N F F F O O Стадія 1 N 2a F Стадія 2 N F 5 N HCl N F F F Стадія 1 (R)-[3-[1-(4-Метил-піперазин-1-карбоніл)-3-трифторметил-5,6-дигідро-8Hімідазо[1,5-a]піразин-7-іл]-3-оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер (R)-7-[3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонову кислоту 2a (150 мг, 0,27 ммоль), 1метилпіперазин (54 мг, 0,54 ммоль) і біс(2-оксо-3-оксазолідиніл)фосфохлорид (0,138 г, 0,54 ммоль) розчиняли в 8 мл дихлорметану при перемішуванні і потім до розчину додавали триетиламін (0,25 мл, 1,62 ммоль). Реакційна суміш реагувала при кімнатній температурі протягом ночі і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку (R)-[3-[1-(4-метил- піперазин-1-карбоніл)-3-трифторметил-5,6-дигідро-8H-імідазо[1,5a]піразин-7-іл]-3-оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер 5a (80 мг, вихід 49%) як білу тверду речовину. МС m/z (ЕСІ): 633,2 [M+1]. Стадія 2 (R)-3-Аміно-1-[1-(4-метил-піперазин-1-карбоніл)-3-трифторметил-5,6-дигідро8H-імідазо[1,5-a]піразин-7-іл]-4-(2,4,5-трифторфеніл)-бутан-1-ону дигідрохлорид (R)-[3-[1-(4-Метил-піперазин-1-карбоніл)-3-трифторметил-5,6-дигідро-8H-імідазо[1,5a]піразин-7-іл]-3-оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер 5a (0,08 г, 0,126 ммоль) розчиняли в розчині 3,1 N хлорводневої кислоти в 6 мл етилацетату. Реакційна суміш реагувала при кімнатній температурі протягом ночі і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку (R)-3-аміно-1-[1-(4-метилпіперазин-1-карбоніл)-3-трифторметил-5,6-дигідро-8H-імідазо[1,5 23 UA 101002 C2 5 a]піразин-7-іл]-4-(2,4,5-трифторфеніл)-бутан-1-ону дигідрохлорид 5 (90 мг) як білу тверду речовину. МС m/z (ЕСІ): 533,2 [M+1]. 1H ЯМР (400 МГц, CD3OD): δ7,45-7,38 (м, 1H), 7,27-7,23 (м, 1H), 5,10-5,05 (м, 2H), 4,35-4,28 (м, 2H), 4,10-4,09 (м, 1H), 4,00-3,95 (м, 2H), 3,68-3,56 (м, 4H), 3,35-3,24 (м, 4H), 3,13 (м, 2H), 3,002,88 (м, 5H). Приклад 6 (R)-3-Аміно-1-[1-(1,1-діоксо-тіоморфолін-4-карбоніл)-3-трифторметил-5,6дигідро-8H-імідазо[1,5-a]піразин-7-іл]-4-(2,4,5-трифторфеніл)-бутан-1-ону гідрохлорид F HCl NH2 O F O N N F F 10 S O O N N F F F F F F O O NH O O N 2a 15 20 25 30 35 40 45 OH F F NH O O 6a HCl NH2 O F F S O Стадія 2 O F O N N N N N F F F N Стадія 1 N N F F O O N F 6 S O O N F F F Стадія 1 (R)-[3-[1-(1,1-Діоксо-тіоморфолін-4-карбоніл)-3-трифторметил-5,6-дигідро-8Hімідазо[1,5-a]піразин-7-іл]-3-оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер (R)-7-[3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонову кислоту 2a (150 мг, 0,27 ммоль), тіоморфолін-1,1-діоксиду гідрохлорид (73 мг, 0,54 ммоль), біс(2-оксо-3оксазолідиніл)фосфохлорид (0,138 г, 0,54 ммоль) і триетиламін (0,25 мл, 1,62 ммоль) розчиняли в 8 мл дихлорметану при перемішуванні і потім до розчину додавали 4 мл N,Nдиметилформаміду. Реакційна суміш реагувала при кімнатній температурі протягом ночі і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку (R)-[3-[1-(1,1діоксо-тіоморфолін-4-карбоніл)-3-трифторметил-5,6-дигідро-8H-імідазо[1,5-a]піразин-7-іл]-3оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер 6a (170 мг, вихід 94%) як білу тверду речовину. МС m/z (ЕСІ): 668,1 [M+1]. Стадія 2 (R)-3-Аміно-1-[1-(1,1-діоксо-тіоморфолін-4-карбоніл)-3-трифторметил-5,6дигідро-8H-імідазо[1,5-a]піразин-7-іл]-4-(2,4,5-трифторфеніл)-бутан-1-ону гідрохлорид (R)-[3-[1-(1,1-Діоксо-тіоморфолін-4-карбоніл)-3-трифторметил-5,6-дигідро-8H-імідазо[1,5a]піразин-7-іл]-3-оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер 6a (0,15 г, 0,22 ммоль) розчиняли в розчині 3,1 N хлорводневої кислоти в 4 мл етилацетату. Реакційна суміш реагувала при кімнатній температурі протягом ночі і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку (R)-3-аміно-1-[1-(1,1-діоксо-тіоморфолін-4-карбоніл)-3-трифторметил-5,6-дигідро-8H-імідазо[1,5a]піразин-7-іл]-4-(2,4,5-трифторфеніл)-бутан-1-ону гідрохлорид 6 (140 мг) як світло-жовту тверду речовину. МС m/z (ЕСІ): 568,2 [M+1]. 1H ЯМР (400 МГц, CD3OD): δ 7,45-7,39 (м, 1H), 7,29-7,20 (м, 1H), 5,10-5,04 (м, 2H), 4,35-4,28 (м, 2H), 4,16-4,09 (м, 2H), 4,02-3,93 (м, 5H), 3,27-3,13 (м, 4H), 3,18-3,04 (м, 2H), 2,99-2,85 (м, 2H). Приклад 7 (R)-1-{7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1-карбоніл}-піперидин-4-карбонової кислоти аміду гідрохлорид F F HCl NH2 O O N N F N NH2 N F F F O 24 UA 101002 C2 F F F O O NH O O N 2a 5 10 15 20 25 30 35 F F N N N 7a F F N O F NH2 N N F F F O F 7 Стадія 1 (R)-[3-[1-(4-Карбамоїл-піперидин-1-карбоніл)-3-трифторметил-5,6-дигідро-8Hімідазо[1,5-a]піразин-7-іл]-3-оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер (R)-7-[3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонову кислоту 2a (150 мг, 0,27 ммоль), піперидин4-карбонової кислоти амід (70 мг, 0,54 ммоль) і біс(2-оксо-3-оксазолідиніл)фосфохлорид (0,138 г, 0,54 ммоль) розчиняли в 8 мл дихлорметану при перемішуванні і триетиламін (0,25 мл, 1,62 ммоль) і потім до розчину послідовно додавали 4 мл N,N-диметилформаміду. Реакційна суміш реагувала при кімнатній температурі протягом ночі і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку (R)-[3-[1-(4-карбамоїл-піперидин-1-карбоніл)-3трифторметил-5,6-дигідро-8H-імідазо[1,5-a]піразин-7-іл]-3-оксо-1-(2,4,5-трифтор-бензил)пропіл]-карбамінової кислоти трет-бутиловий естер 7a (180 мг, вихід 98%) як білу тверду речовину. МС m/z (ЕСІ): 660,9 [M+1]. Стадія 2 (R)-1-{7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбоніл}-піперидин-4-карбонової кислоти аміду гідрохлорид (R)-[3-[1-(4-Карбамоїл-піперидин-1-карбоніл)-3-трифторметил-5,6-дигідро-8H-імідазо[1,5a]піразин-7-іл]-3-оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер 7a (0,18 г, 0,27 ммоль) і 2 мл етилацетату додавали в реакційну колбу. Потім до колби додавали розчин 2,3 N хлорводневої кислоти в 6 мл етилацетату. Реакційна суміш реагувала при кімнатній температурі 3,5 години і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку (R)-1-{7-[3-аміно-4-(2,4,5трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбоніл}піперидин-4-карбонової кислоти аміду гідрохлорид 7 (0,12 г, вихід 74%) як білу тверду речовину. МС m/z (ЕСІ): 561,2 [M+1]. 1H ЯМР (400 МГц, CD3OD): δ7,42-7,31 (м, 1H), 7,28-7,16 (м, 1H), 5,17-4,97 (м, 2H), 4,43-4,24 (м, 2H), 4,20-4,03 (м, 1H), 4,03-3,89 (м, 2H), 3,30-3,18 (м, 2H), 3,17-3,06 (м, 2H), 3,03-2,72 (м, 4H), 2,65-2,53 (м, 1H), 2,15-2,03 (м, 2H), 1,93-1,83 (м, 2H), 1,77-1,60 (м, 2H). Приклад 8 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти метиламіду гідрохлорид F F HCl NH2 O O N N N F F F N H F F F F O F O NH O O N N F 2a 40 O N NH2 Стадія 2 N N F F HCl NH2 O F O O Стадія 1 N N F OH F O O F OH N O O N N F F F N Стадія 1 N F F F O O 8a F F N H F HCl NH2 O O N Стадія 2 N F 8 N F F N H F Стадія 1 (R)-[3-(1-Метилкарбамоїл-3-трифторметил-5,6-дигідро-8H-імідазо[1,5-a]піразин-7-іл)-3-оксо1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер (R)-7-[3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонова кислота 2a (150 мг, 0,27 ммоль), 25 UA 101002 C2 5 10 15 20 25 метиламіну гідрохлорид (36,5 мг, 0,54 ммоль) і біс(2-оксо-3-оксазолідиніл)фосфохлорид (0,138 г, 0,54 ммоль) розчиняли в 8 мл дихлорметану при перемішуванні, і потім до розчину додавали триетиламін (0,25 мл, 1,62 ммоль). Реакційна суміш реагувала при кімнатній температурі протягом ночі і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку (R)- [3-(1-метилкарбамоїл-3-трифторметил-5,6-дигідро-8H-імідазо[1,5-a]піразин-7-іл)-3оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер 8a (150 мг, вихід 98,6%) як білу тверду речовину. МС m/z (ЕСІ): 563,9 [M+1]. Стадія 2 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти метиламіду гідрохлорид (R)-[3-(1-Метилкарбамоїл-3-трифторметил-5,6-дигідро-8H-імідазо[1,5-a]піразин-7-іл)-3-оксо1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер 8a (0,15 г, 0,27 ммоль) і 2 мл етилацетату додавали в реакційну колбу. Потім до колби додавали розчин 2,3 N хлорводневої кислоти в 5 мл етилацетату. Реакційна суміш реагувала при кімнатній температурі протягом 4 годин і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти метиламіду гідрохлорид 8 (0,135 г, вихід 90%) як білу тверду речовину. МС m/z (ЕСІ): 464,2 [M+1]. 1H ЯМР (400 МГц, CD3OD): δ7,40-7,38 (м, 1H), 7,23 (м, 1H), 5,13-5,04 (м, 2H), 4,31-4,25 (м, 2H), 4,07 (м, 1H), 3,96 (м, 2H), 3,10 (м, 2H), 2,99-2,76 (м, 5H). Приклад 9 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти диметиламіду гідрохлорид F HCl NH2 O F O N N N N F F F F F F F O F O NH O O N N F OH 30 35 40 45 F F N Стадія 1 N 2a F O O F O O N N N F F 9a N F F F HCl NH2 O O N N Стадія 2 N F 9 N F F F Стадія 1 (R)-[3-(1-Диметилкарбамоїл-3-трифторметил-5,6-дигідро-8H-імідазо[1,5-a] піразин-7-іл)-3-оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер (R)-7-[3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонову кислоту 2a (150 мг, 0,27 ммоль), диметиламіну гідрохлорид (44 мг, 0,54 ммоль) і біс(2-оксо-3-оксазолідиніл)фосфохлорид (0,138 г, 0,54 ммоль) розчиняли в 8 мл дихлорметану при перемішуванні і потім до розчину додавали триетиламін (0,25 мл, 1,62 ммоль). Реакційна суміш реагувала при кімнатній температурі протягом ночі і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку (R)-[3-(1-диметилкарбамоїл-3- трифторметил-5,6-дигідро-8H-імідазо[1,5-a]піразин-7-іл)3-оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер 9a (120 мг, вихід 77%) як білу тверду речовину. МС m/z (ЕСІ): 578,1 [M+1]. Стадія 2 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти диметиламід гідрохлорид 26 UA 101002 C2 5 10 (R)-[3-(1-Диметилкарбамоїл-3-трифторметил-5,6-дигідро-8H-імідазо[1,5-a]піразин-7-іл)-3оксо-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер 9a (0,138 г, 0,245 ммоль) і 2 мл етилацетат додавали в реакційну колбу. Потім до колби додавали розчин 2,3 N хлорводневої кислоти в 4 мл етилацетату. Реакційна суміш реагувала при кімнатній температурі протягом 3 годин і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку (R)-7-[3-аміно-4-(2,4,5-трифторфеніл)-бутирил]-3трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти диметиламіду гідрохлорид 9 (0,12 г, вихід 98%) як білу тверду речовину. МС m/z (ЕСІ): 478,2 [M+1]. Приклад 10 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти гідрохлорид F HCl NH2 O F O OH N N N F F F F F F F O O NH O O N OH 2a 15 20 25 30 Стадія 1 N N F F F HCl NH2 O F O OH N N F N 10 F F F F Стадія 1 (R)-7-[3-Аміно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти гідрохлорид (R)-7-[3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонову кислоту 2a (218 мг, 0,4 ммоль) додавали в реакційну колбу. Потім до колби додавали розчин хлорводневої кислоти в 5 мл етанолу. Реакційна суміш реагувала при кімнатній температурі і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку (R)-7-[3-аміно-4-(2,4,5трифторфеніл)-бутирил]-3-трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонової кислоти гідрохлорид 10 (60 мг, вихід 30,8%) як білу тверду речовину. МС m/z (ЕСІ): 451,2 [M+1]. 1H ЯМР (400 МГц, CD3OD): δ 7,416-7,37 (м, 1H), 7,281-7,234 (м, 1H), 5,189-5,053 (м, 2H), 4,361-4,286 (м, 1H), 4,15-3,999 (м, 2H), 3,941-3,925 (м, 2H), 3,212-2,883 (м, 2H), 2,861-2,805 (м, 2H). Приклад 11 (R)-3-Аміно-1-[1-(3-аміно-піперидин-1-карбоніл)-3-трифторметил-5,6-дигідро-8H-імідазо[1,5a]піразин-7-іл]-4-(2,4,5-трифторфеніл)-бутан-1-ону дигідрохлорид F F HCl NH2 HCl NH2 O O N N N N F F F F HCl F HN NH2 HCl HN H N Стадія 1 11a 35 O O F O O NH Стадія 2 O O O O F F Стадія 3 N N 11c F F F NH2 HCl NH2 O N N F 11b H N O N N N F 11 N F F F Стадія 1 Піперидин-3-іл-карбамінової кислоти трет-бутиловий естер (R)-Піперидин-3-іламіну гідрохлорид 11a (3 г, 22,1 ммоль) і карбонат калію (6,1 г, 44,2 ммоль) розчиняли в 60 мл метанолу при перемішуванні. Після перемішування протягом 30 27 UA 101002 C2 5 10 15 20 25 30 35 40 хвилин, до суміші додавали ди-трет-бутилдикарбонат (4,8 г, 22,1 ммоль). Реакційна суміш реагувала при кімнатній температурі протягом ночі і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку піперидин-3-іл-карбамінової кислоти трет-бутиловий естер 11b (1,3 г, вихід 29%) як масло. МС m/z (ЕСІ): 201,0 [M+1]. Стадія 2 (R)-(1-{7-[3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбоніл}-піперидин-3-іл) карбамінової кислоти трет-бутиловий естер (R)-7-[3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонова кислота 2a (0,12 г, 0,218 ммоль), піперидин3-іл-карбамінової кислоти трет-бутиловий естер 11b (0,173 г, 0,545 ммоль) і триетиламін (0,275 г, 2,18 ммоль) розчиняли в 12 мл дихлорметану при перемішуванні, і потім до суміші додавали біс(2-оксо-3-оксазолідиніл)фосфінхлорид (0,138 г, 0,545 ммоль). Реакційна суміш реагувала при кімнатній температурі протягом ночі. Реакційну суміш концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі одержуючи вказану в заголовку сполуку (R)-(1-{7-[3-трет-бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3трифторметил-5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбоніл}-піперидин-3-іл)-карбамінової кислоти трет-бутиловий естер 11c (0,1 г, вихід 63%)як масло. МС m/z (ЕСІ): 733,1 [M+1]. Стадія 3 (R)-3-Аміно-1-[1-(3-аміно-піперидин-1-карбоніл)-3-трифторметил-5,6-дигідро-8H-імідазо[1,5a]піразин-7-іл]-4-(2,4,5-трифторфеніл)-бутан-1-ону дигідрохлорид (R)-(1-{7-[3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбоніл}-піперидин-3-іл)-карбамінової кислоти третбутиловий естер 11c (0,1 г, 0,163 ммоль) додавали до розчину 2,3 N хлорводневої кислоти в 10 мл етилацетату. Реакційна суміш реагувала при кімнатній температурі протягом ночі і її контролювали за допомогою тонкошарової хроматографії до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску одержуючи вказану в заголовку сполуку (R)-3-аміно-1-[1-(3-аміно-піперидин-1-карбоніл)-3-трифторметил-5,6-дигідро-8H-імідазо[1,5a]піразин-7-іл]-4-(2,4,5-трифторфеніл)-бутан-1-ону дигідрохлорид 11 (0,09 г, вихід 98%) як білу тверду речовину. МС m/z (ЕСІ): 533,3 [M+1]. 1H ЯМР (400 МГц, CD3OD): δ 7,415-7,396 (м, 1H), 7,26-7,2154 (м, 1H), 5,131-4,085 (м, 11H), 3,994-2,837 (м, 8H), 2,11-1,846 (м, 5H). Приклад 12 (R)-3-Аміно-1-[1-(піролідин-1-карбоніл)-3-трифторметил-5,6-дигідро-8Hімідазо[1,5-a]піразин-7-іл]-4-(2,4,5-трифторфеніл)-бутан-1-ону гідрохлорид F F HCl NH2 O O N N N F N F F F F F F O F O NH O O N N F 2a 45 50 OH O NH Стадія 1 N F F F O O O N N N F F F 12a N F F F HCl NH2 O O N N Стадія 2 N F N F F F 12 Стадія 1 (R)-[3-Оксо-3-[1-(піролідин-1-карбоніл)-3-трифторметил-5,6-дигідро-8H-імідазо [1,5-a]піразин-7-іл]-1-(2,4,5-трифтор-бензил)-пропіл]-карбамінової кислоти трет-бутиловий естер (R)-7-[3-трет-Бутоксикарбоніламіно-4-(2,4,5-трифторфеніл)-бутирил]-3-трифторметил5,6,7,8-тетрагідро-імідазо[1,5-a]піразин-1-карбонову кислоту 2a (150 мг, 0,27 ммоль), піролідин (38,4 мг, 0,54 ммоль) і біс(2-оксо-3-оксазолідиніл)фосфохлорид (0,138 г, 0,54 ммоль) розчиняли в 8 мл дихлорметану при перемішуванні, і потім до розчину додавали триетиламін (0,25 мл, 1,62 ммоль). Реакційна суміш реагувала при кімнатній температурі протягом ночі і її 28
ДивитисяДодаткова інформація
Назва патенту англійськоюTetrahydro-imidazo[1,5-a]pyrazine derivatives, preparation methods and medical uses thereof
Автори англійськоюTang, Peng Cho, Yang, Fanglong, Fan, Jiang, Feng, Hu, Wang, Yang, Yang, Tao
Назва патенту російськоюПроизводные тетрагидроимидазо[1,5-а]пиразина, способ получения и их медицинское применение
Автори російськоюТанг Пенг Чо, Янг Фанглонг, Фан Джянг, Фенг Ху, Ванг Янг, Янг Тао
МПК / Мітки
МПК: C07D 487/04, A61P 3/10, A61P 5/48, A61K 31/498, A61P 3/04
Мітки: спосіб, тетрагідроімідазо[1,5-а]піразину, похідні, застосування, медичне, одержання
Код посилання
<a href="https://ua.patents.su/84-101002-pokhidni-tetragidroimidazo15-apirazinu-sposib-oderzhannya-i-kh-medichne-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні тетрагідроімідазо[1,5-а]піразину, спосіб одержання і їх медичне застосування</a>
Попередній патент: Спосіб одержання грані, колінеарної кристалографічній осі с, в шаруватих кристалах inse і gase
Наступний патент: Пептид фактора fviii та його застосування для індукції толерантності у хворих гемофілією
Випадковий патент: Спосіб нанесення багатокомпонентної оксидної системи на основі 3d-металів на вуглецеві нанотрубки при синтезі каталізаторів реакції окиснення co












