Ациклічно-заміщені похідні фуропіримідину та їх застосування для лікування серцево-судинних захворювань
Номер патенту: 94080
Опубліковано: 11.04.2011
Автори: Кляйн Мартіна, Берфаккер Ларс, Беккер Ева-Марія, Єске Маріо, Каст Раімунд, Майнінгхаус Марк, Хілліш Александер, Шумахер Йоахім, Шташ Йоханнес-Петер, Каріг Гунтер, Бекк Хартмут, Шое-Лооп Рудольф, Акбаба Метін, Лампе Томас, Штолль Фрідеріке, Шлєммер Карл-Хайнц, Кнорр Андреас
Формула / Реферат
1. Сполука формули (І)
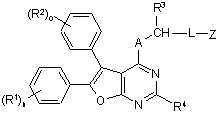 , (I)
, (I)
в якій
А означає О, S або N-R5, в якій
R5 означає водень, (С1-С6)-алкіл, (С3-С7)-циклоалкіл або (С4-С7)-циклоалкеніл,
L означає (С1-С7)-алкандіїл або (С2-С7)-алкендіїл, які можуть бути один або два рази заміщені фтором, або групу формули *-L1-Q-L2, в якій
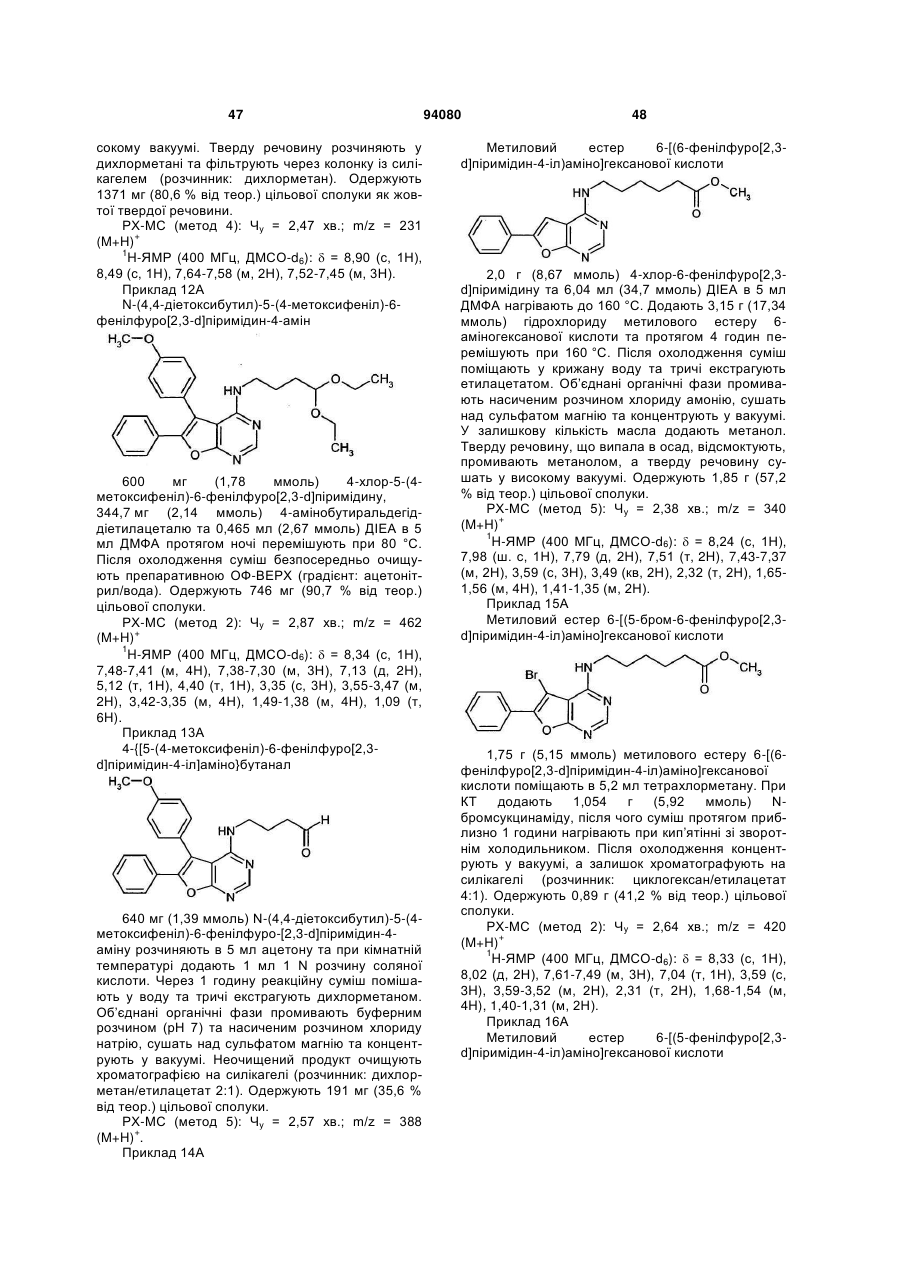
* означає місце приєднання до CHR3-групи,
L1 означає (С1-С5)-алкандіїл, який може бути заміщений (С1-С4)-алкілом або (С1-С4)-алкокси,
L2 означає зв'язок або (С1-С3)-алкандіїл, який може бути один або два рази заміщений фтором, та
Q означає О або N-R6, де
R6 означає водень, (С1-С6)-алкіл або (С3-С7)-циклоалкіл,
Z означає групу формули
 ,
, 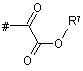 ,
, 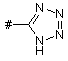 або
або 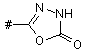 ,
,
в якій
# означає місце приєднання до групи L
та
R7 означає водень або (С1-С4)-алкіл,
R1 та R2 незалежно один від одного означають замісник, вибраний із ряду, що включає галоген, ціано, нітро, (С1-С6)-алкіл, (С2-С6)-алкеніл, (С2-С4)-алкініл, (С3-С7)-циклоалкіл, (С4-С7)-циклоалкеніл, (С1-С6)-алкокси, трифторметил, трифторметокси, (С1-С6)-алкілтіо, (С1-С6)-ацил, аміно, моно-(С1-С6)-алкіламіно, ді-(С1-С6)-алкіламіно та (С1-С6)-ациламіно,
причому (С1-С6)-алкіл та (С1-С6)-алкокси зі свого боку можуть бути заміщені відповідно ціано, гідрокси, (С1-С4)-алкокси, (С1-С4)-алкілтіо, аміно, моно- або ді-(С1-С4)-алкіламіно,
або
два залишки R1 та/або R2, які приєднані до сусідніх атомів вуглецю відповідного фенільного кільця, разом утворюють групу формули -О-СН2-О-, -O-CHF-O-, -О-CF2-O-, -О-СН2-СН2-О- або -O-CF2-CF2-O-,
n та о незалежно один від одного означають 0, 1, 2 або 3,
причому у випадку, якщо R1 або R2 зустрічаються кілька разів, їх значення можуть бути відповідно однаковими або різними,
R3 означає водень або (С1-С4)-алкіл, який може бути заміщений гідрокси або аміно, та
R4 означає водень, (С1-С4)-алкіл або циклопропіл, а також її солі, сольвати та сольвати солей.
2. Сполука формули (І) за пунктом 1, в якій А означає О, S або N-R5, де
R5 означає водень, (С1-С6)-алкіл, (С3-С7)-циклоалкіл або (С4-С7)-циклоалкеніл, L означає (С1-С7)-алкандіїл або (С2-С7)-алкендіїл, які можуть бути один або два рази заміщені фтором, або групу формули *-L1-Q-L2, в якій
* означає місце приєднання до CHR3-групи,
L1 означає (С1-С5)-алкандіїл,
L2 означає зв'язок або (С1-С3)-алкандіїл, який може бути один або два рази заміщений фтором,
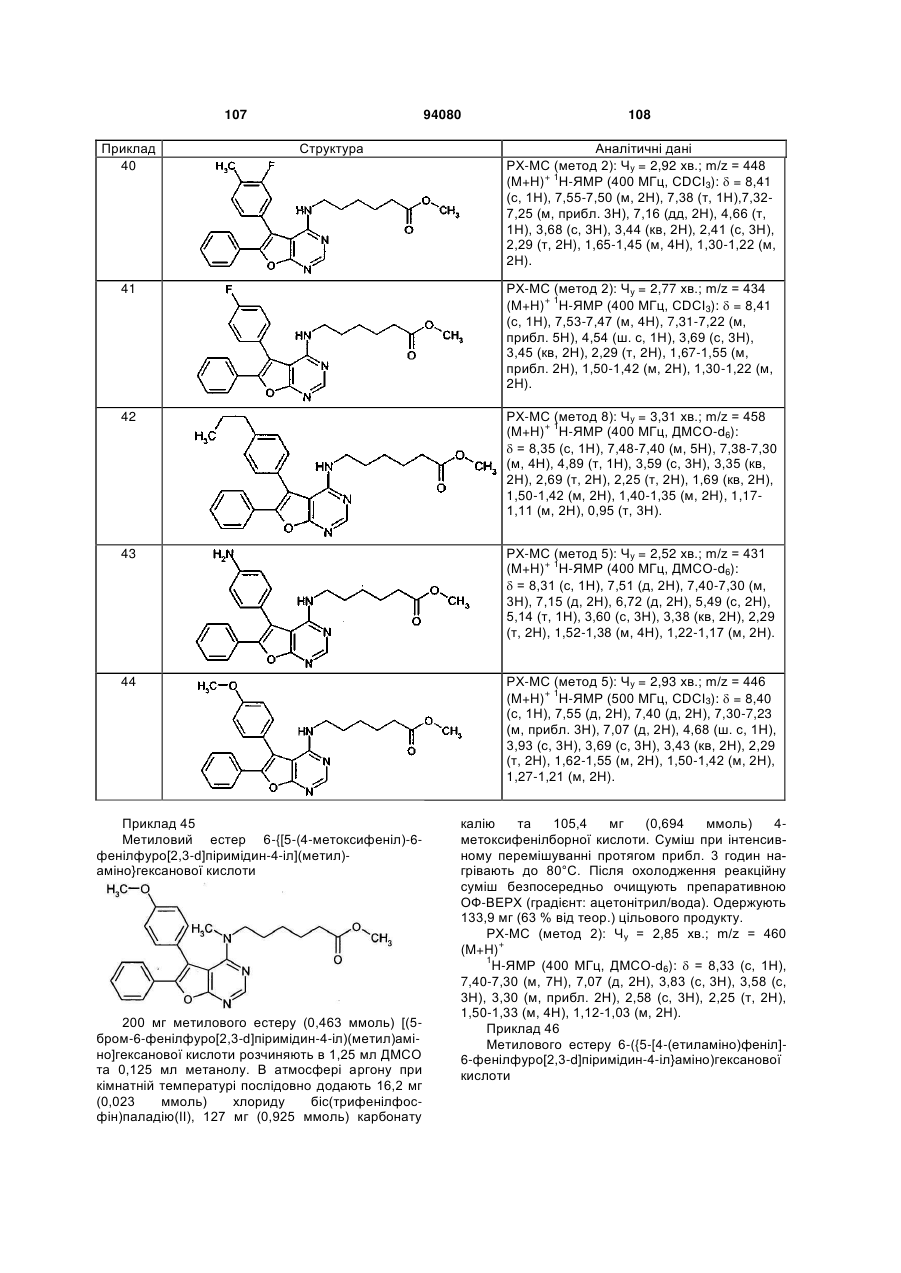
та
Q означає О або N-R6, де
R6 означаєводень, (С1-С6)-алкіл або (С3-С7)-циклоалкіл,
Z означає групу формули
 ,
, 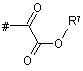 ,
, 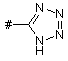 або
або  ,
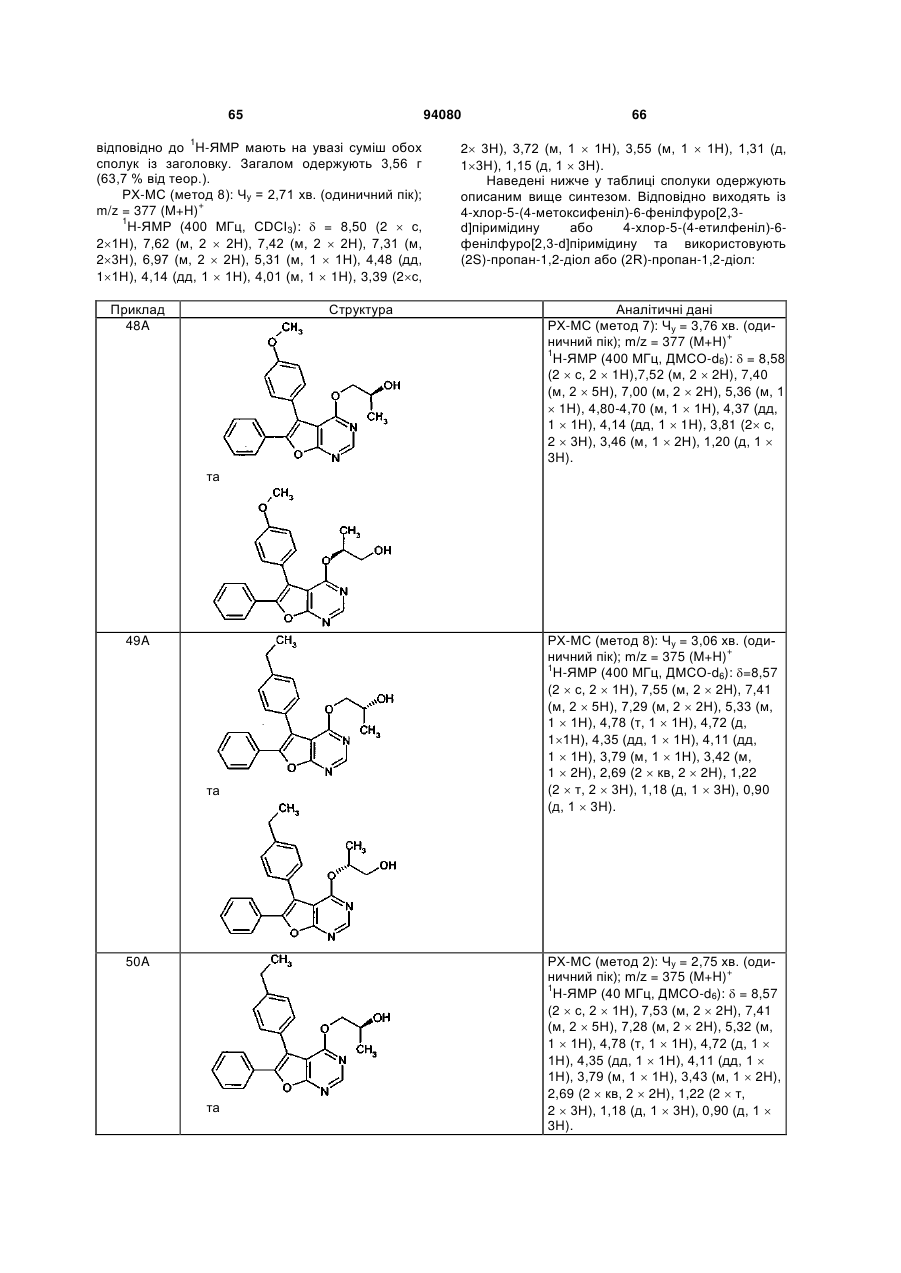
,
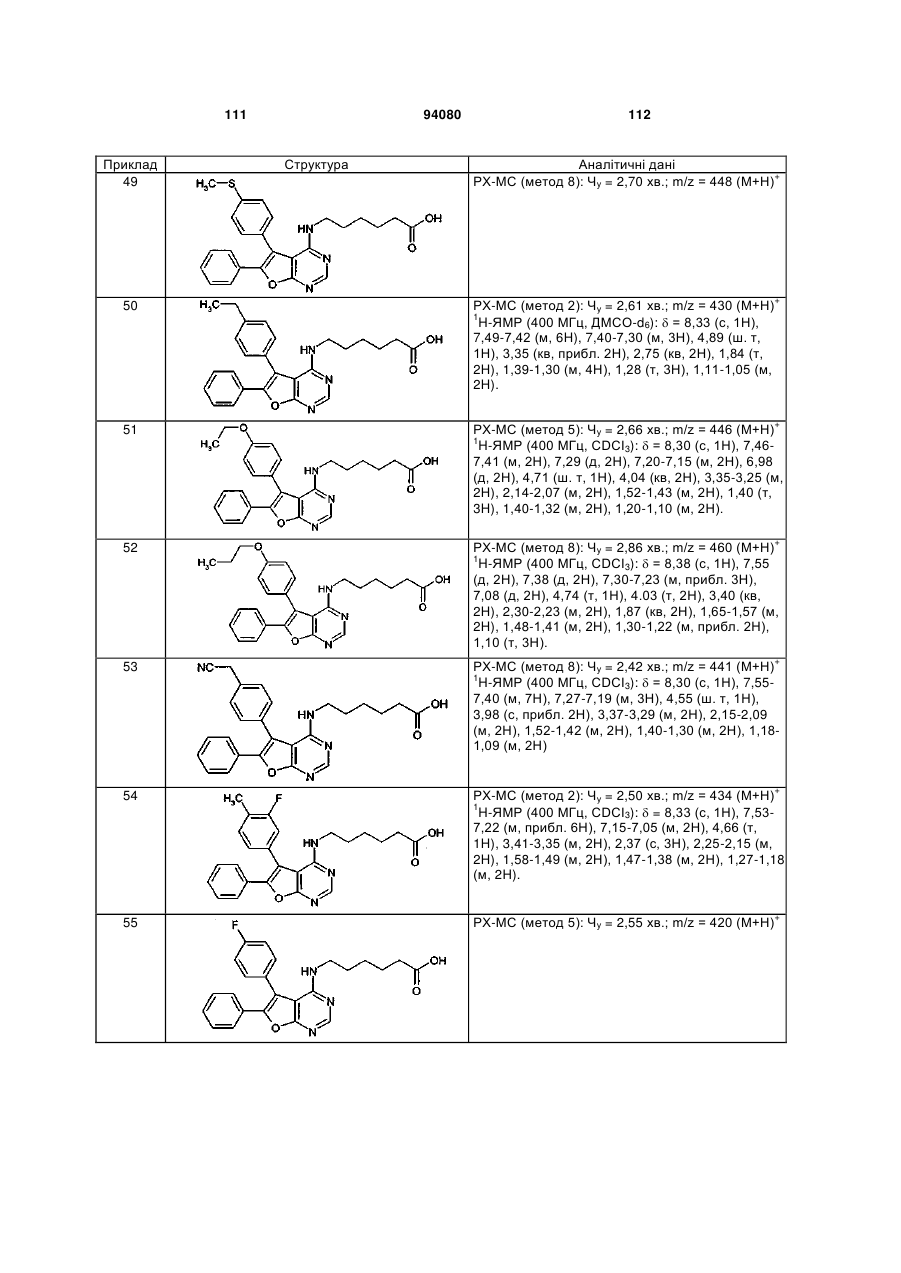
в якій
# означає місце приєднання до групи L
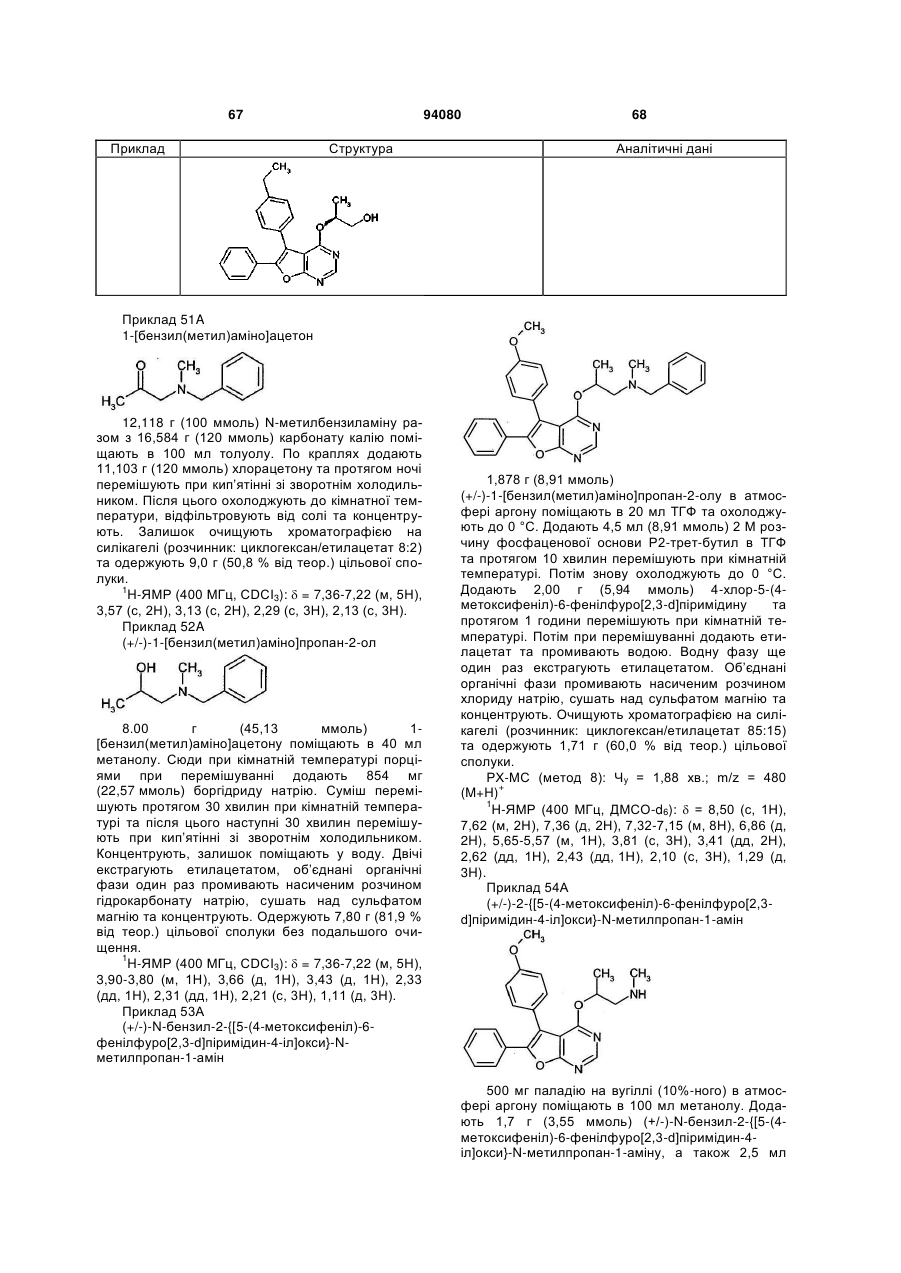
та
R7 означає водень або (С1-С4)-алкіл,
R1 та R2 незалежно один від одного означають замісник, вибраний із ряду, що включає галоген, ціано, нітро, (С1-С6)-алкіл, (С2-С6)-алкеніл, (С2-С4)-алкініл, (С3-С7)-циклоалкіл, (С4-С7)-циклоалкеніл, (С1-С6)-алкокси, трифторметил, трифторметокси, (С1-С6)-алкілтіо, (С1-С6)-ацил, аміно, моно-(С1-С6)-алкіламіно, ді-(С1-С6)-алкіламіно та (С1-С6)-ациламіно,
причому (С1-С6)-алкіл та (С1-С6)-алкокси зі свого боку можуть бути заміщені відповідно гідрокси, (С1-С4)-алкокси, аміно, моно- або ді-( С1-С4)-алкіламіно,
або
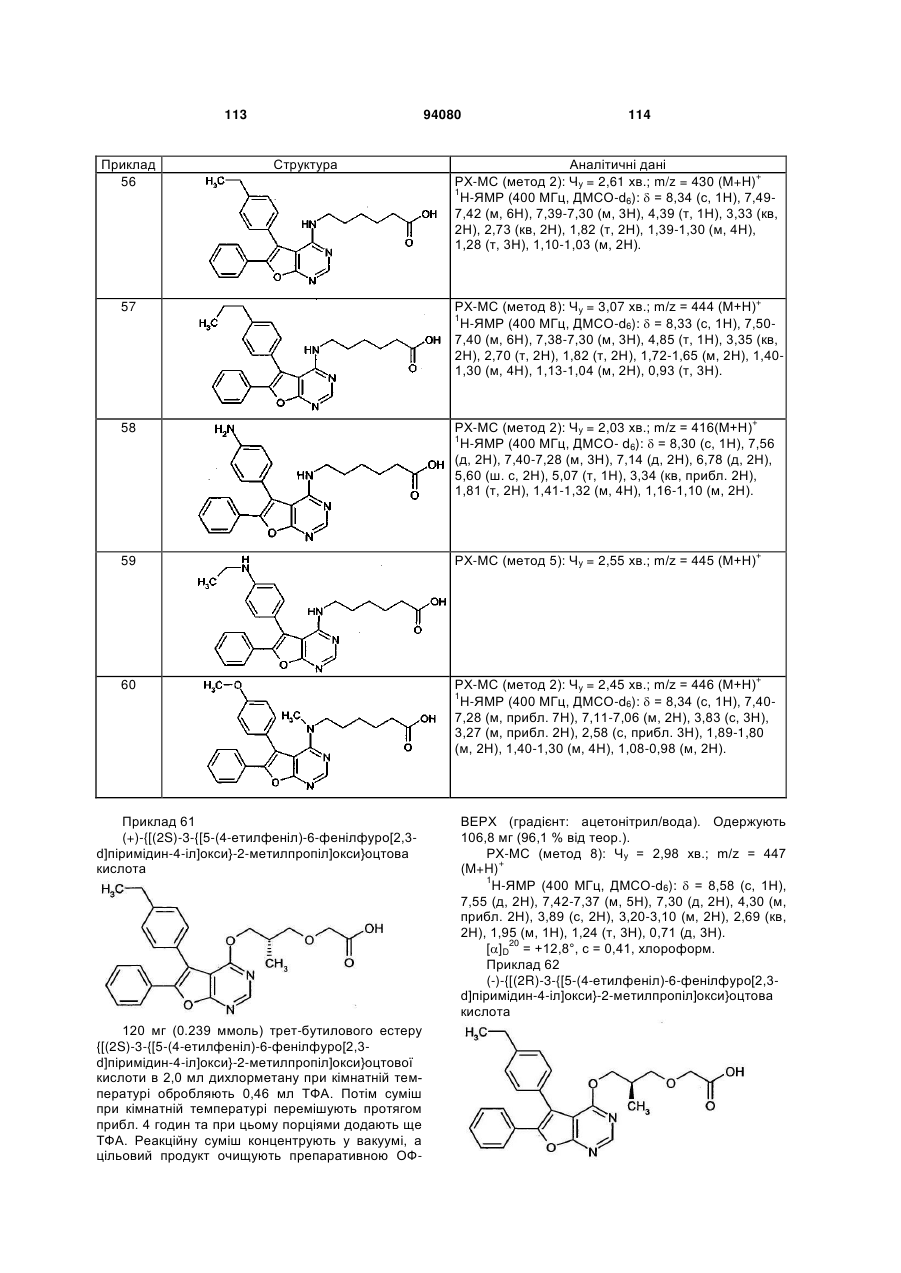
два залишки R1 та/або R2, які приєднані до сусідніх атомів вуглецю відповідного фенільного кільця, разом утворюють групу формули -О-СН2-О-, -O-CHF-O-, -O-CF2-O-, -О-СН2-СН2-О- або -O-CF2-CF2-O-,
n та о незалежно один від одного означають 0, 1, 2 або 3,
причому у випадку, якщо R1 або R2 зустрічаються кілька разів, їх значення можуть бути відповідно однаковими або різними,
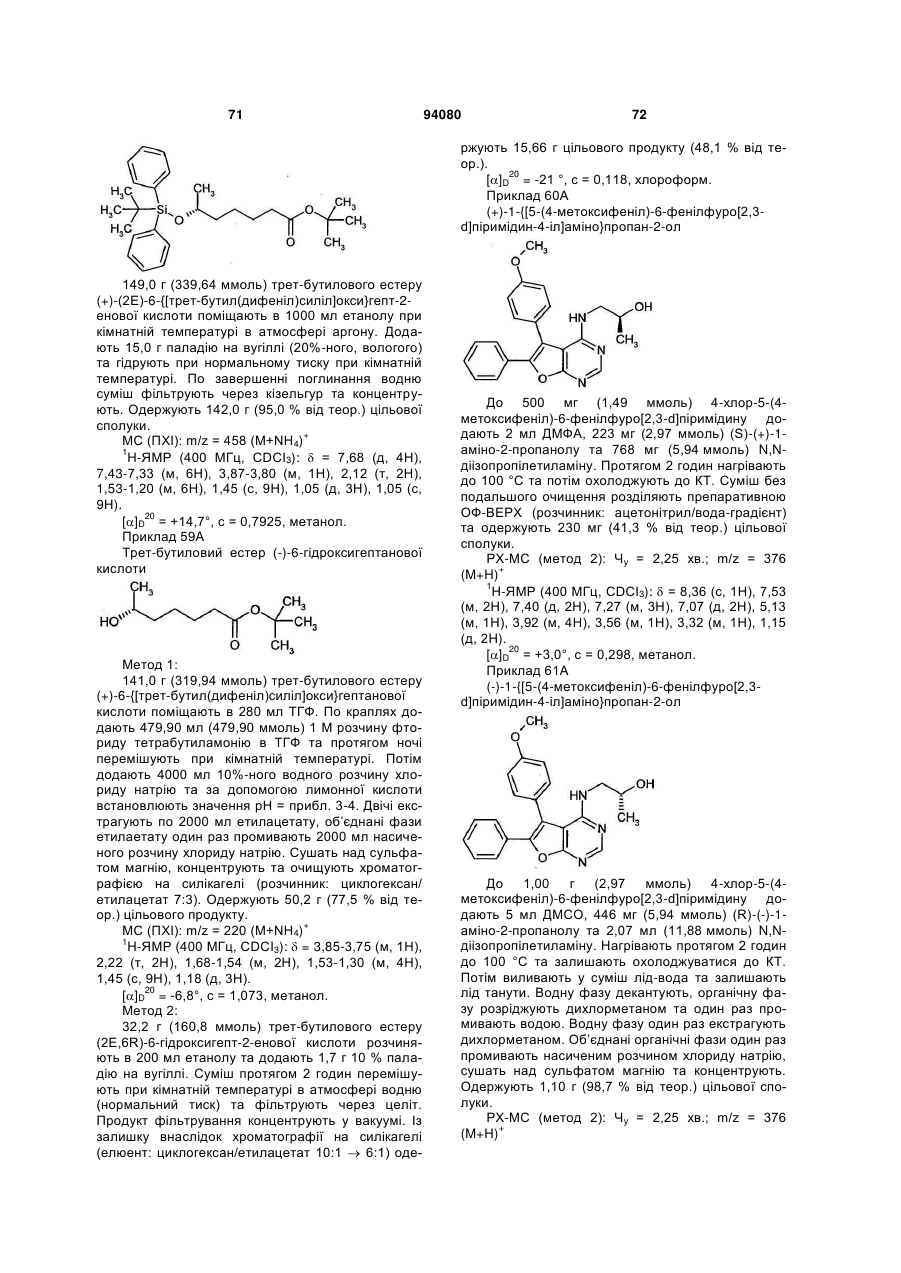
R3 означає водень або (С1-С4)-алкіл, який може бути заміщений гідрокси або аміно,
та
R4 означає водень, (С1-С4)-алкіл або циклопропіл,
а також її солі, сольвати та сольвати солей.
3. Сполука формули (І) за пунктом 1 або 2, в якій
А означає О або N-R5, де
R5 означає водень, (С1-С4)-алкіл або (С3-С6)-циклоалкіл,
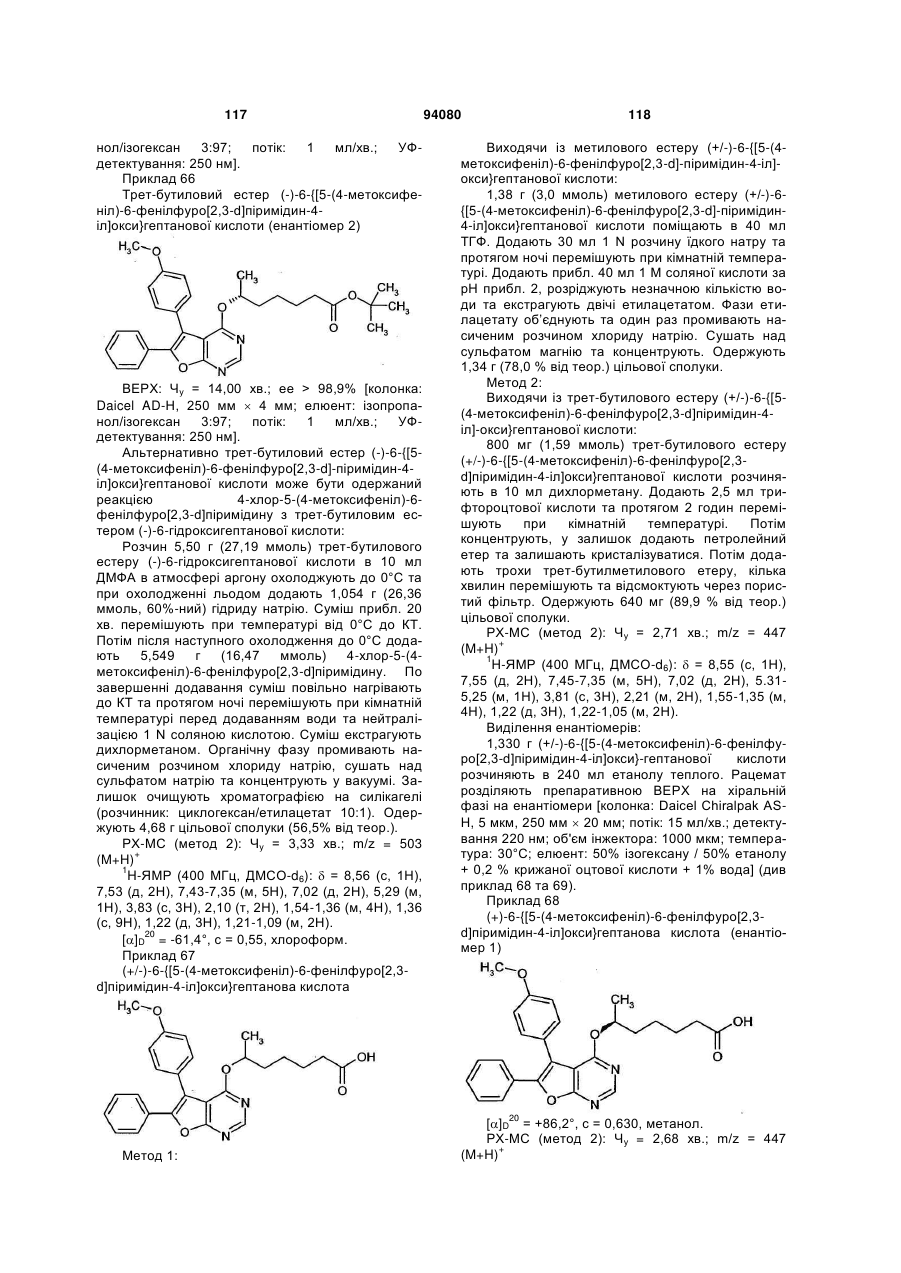
L означає (С3-С7)-алкандіїл або (С3-С7)-алкендіїл, які можуть бути один або два рази заміщені фтором, або групу формули *-L1-Q-L2, в якій
* означає місце приєднання до CHR3-групи,
L1 означає (С1-С3)-алкандіїл,
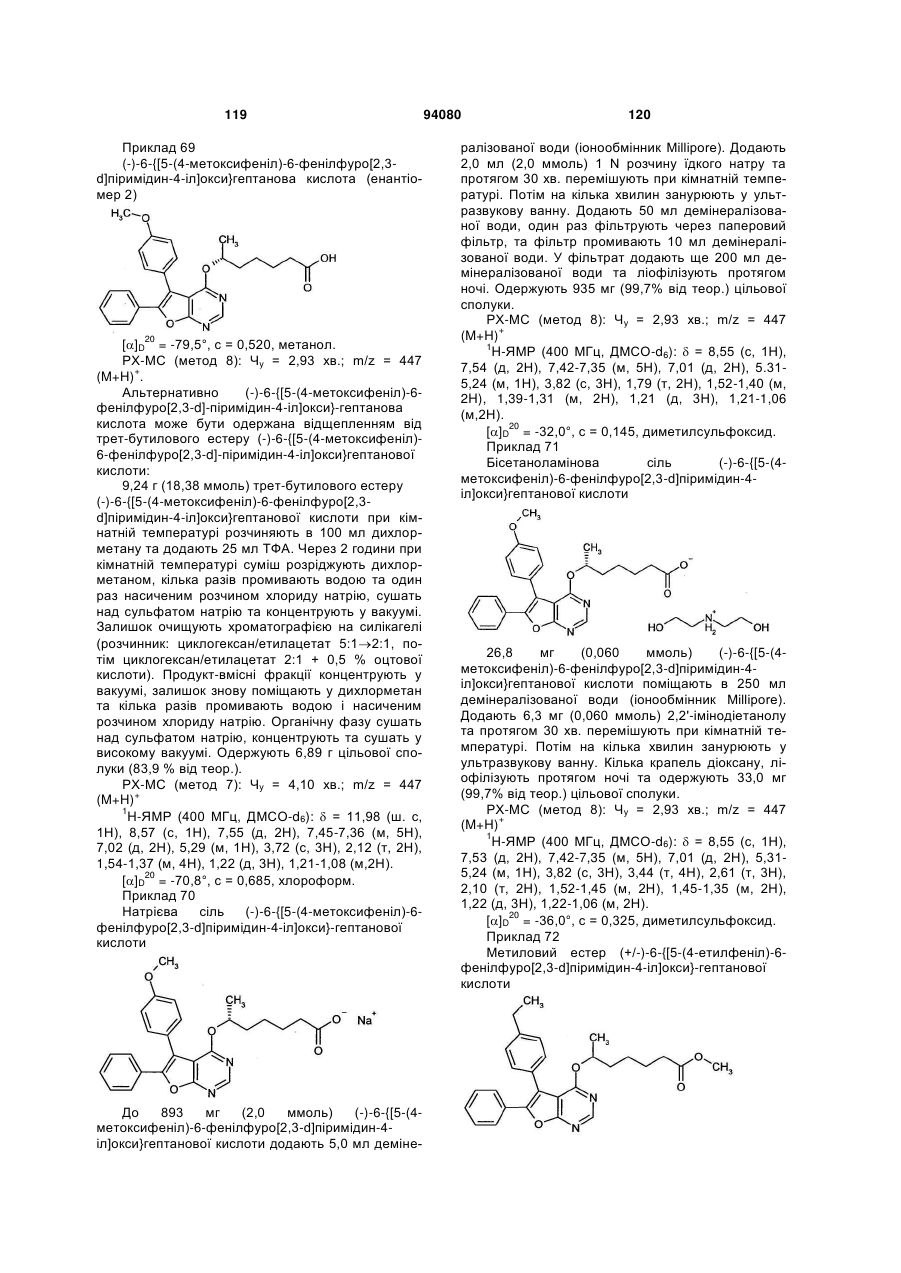
L2 означає (С1-С3)-алкандіїл, який може бути один або два рази заміщений фтором, та
Q означає О або N-R6, де
R6 означає водень, (С1-С3)-алкіл або циклопропіл,
Z означає групу формули
 ,
, 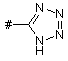 або
або  ,
,
в якій
# означає місце приєднання до групи L
та
R7 означає водень, метил або етил,
R1 та R2 незалежно один від одного означають замісник, вибраний із ряду, що включає фтор, хлор, ціано, (С1-С5)-алкіл, (С2-С5)-алкеніл, (С3-С6)-циклоалкіл, (С4-С6)-циклоалкеніл, (С1-С4)-алкокси, трифторметил, трифторметокси, (С1-С4)-алкілтіо, (С1-С5)-ацил, аміно, моно-(С1-С4)-алкіламіно, ді-(С1-С4)-алкіламіно та (С1-С4)-ациламіно,
або
два залишки R1 та/або R2, які приєднані до сусідніх атомів вуглецю відповідного фенільного кільця, разом утворюють групу формули -О-СН2-О-, -O-CHF-O- або -O-CF2-O-,
n та о незалежно один від одного означають 0, 1, 2 або 3,
причому у випадку, якщо R1 або R2 зустрічаються кілька разів, їх значення можуть бути відповідно однаковими або різними,
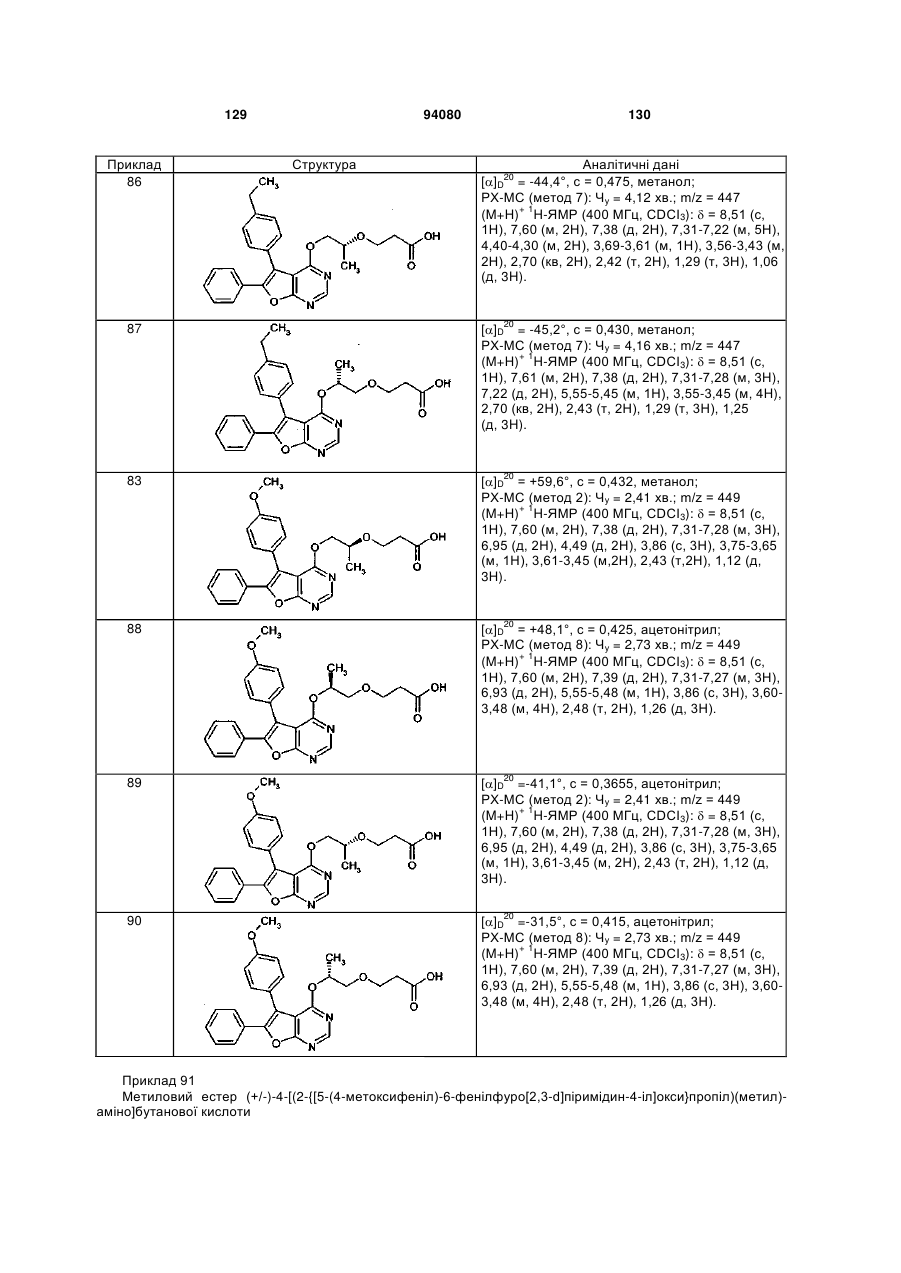
R3 означає водень або (С1-С3)-алкіл, який може бути заміщений гідрокси або аміно,
та
R4 означає водень або (С1-С3)-алкіл,
а також її солі, сольвати та сольвати солей.
4. Сполука формули (І) за пунктом 1, 2 або 3, в якій
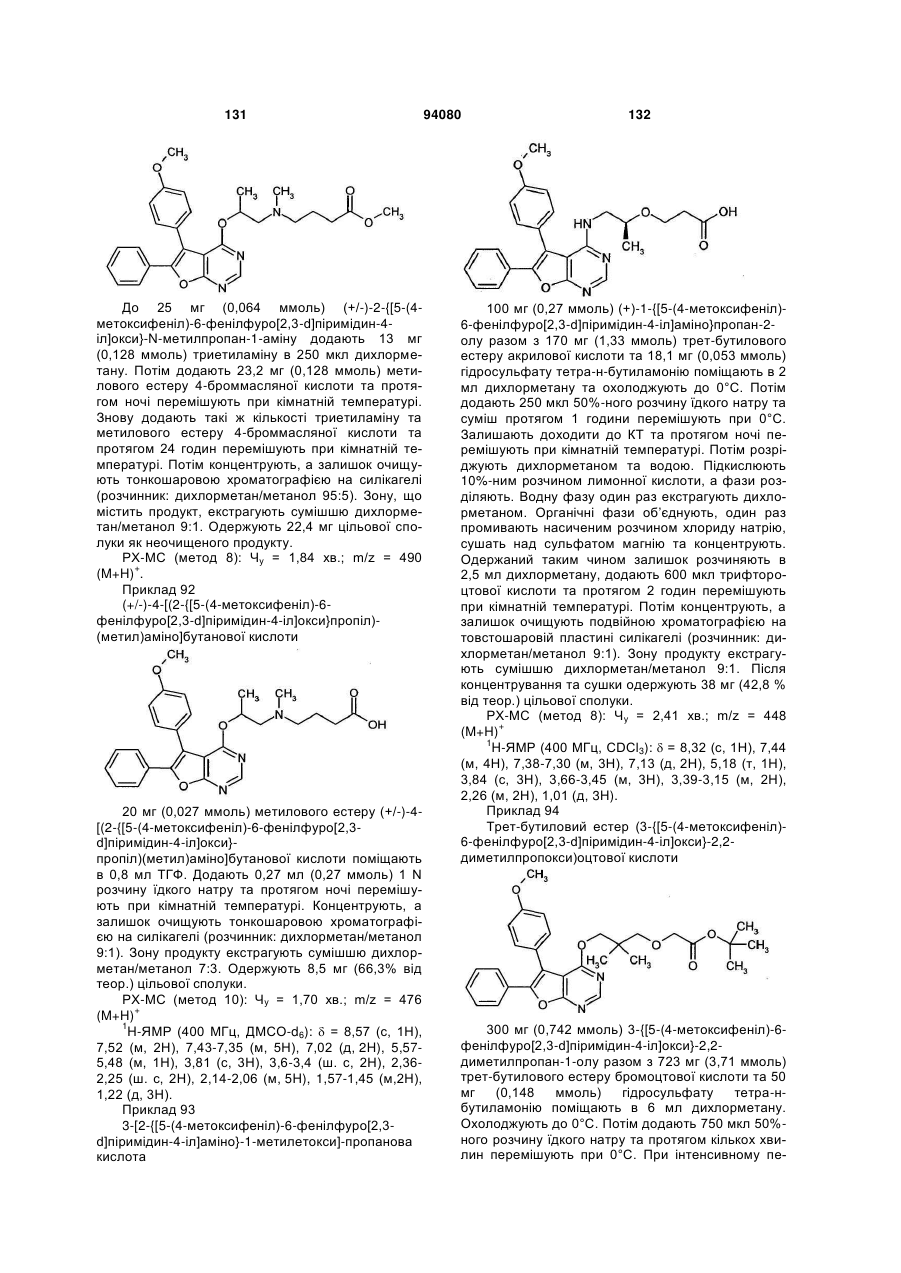
А означає О або NH,
L означає (С3-С7)-алкандіїл, (С3-С7)-алкендіїл або групу формули *-L1-О-L2, в якій
* означає місце приєднання до CHR3-групи
та
L1 та L2 незалежно один від одного означають (С1-С3)-алкандіїл,
Z означає групу формули
 або
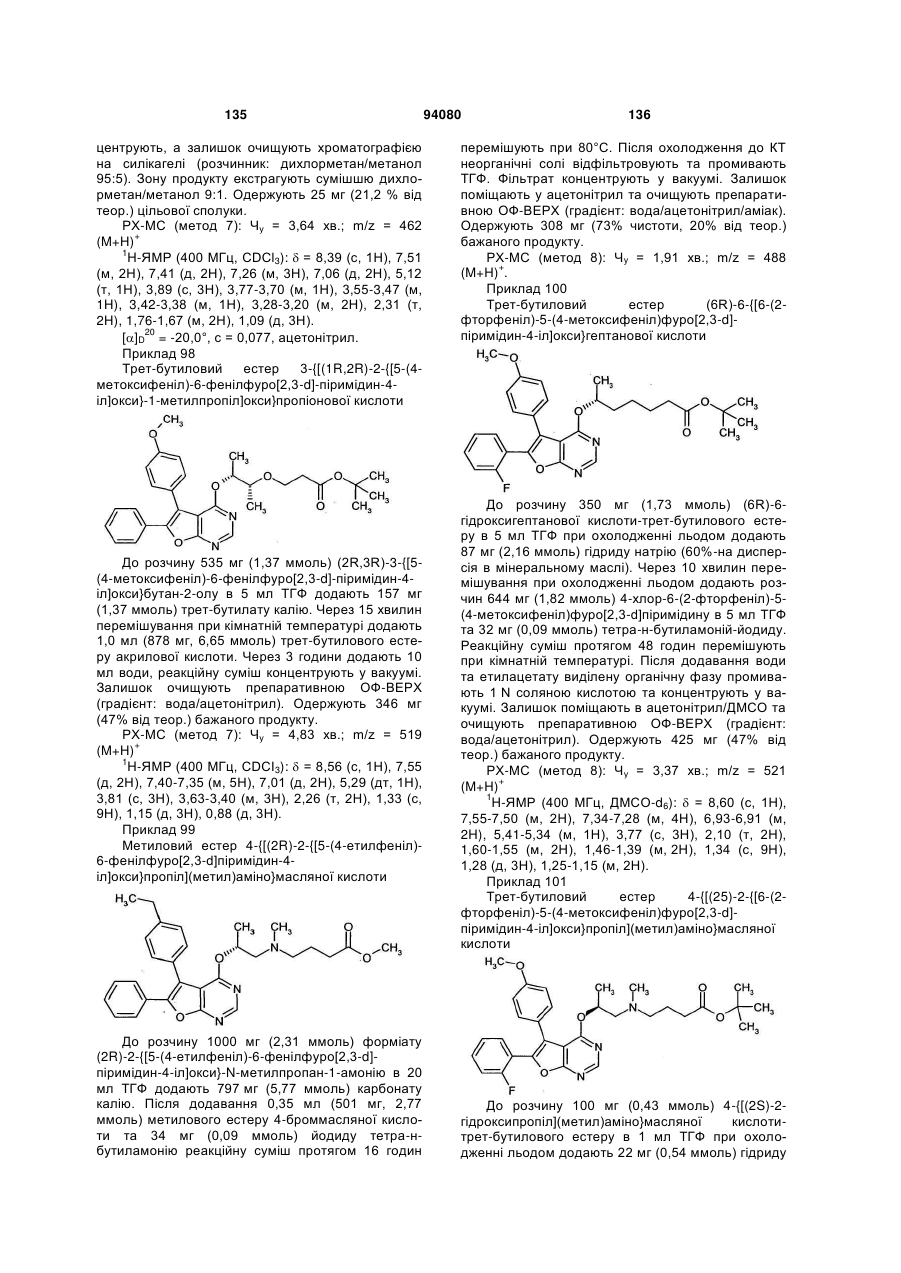
або 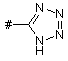 ,
,
в якій
# означає місце приєднання до групи L
та
R7 означає водень, метил або етил,
R1 та R2 незалежно один від одного означають замісник, вибраний із ряду, що включає фтор, хлор, ціано, (С1-С5)-алкіл, (С2-С5)-алкеніл, (С3-С6)-циклоалкіл, (С4-С6)-циклоалкеніл, (С1-С4)-алкокси, трифторметил, трифторметокси, (С1-С4)-алкілтіо, (С1-С5)-ацил, аміно, моно-(С1-С4)-алкіламіно, ді-(С1-С4)-алкіламіно та (С1-С4)-ациламіно,
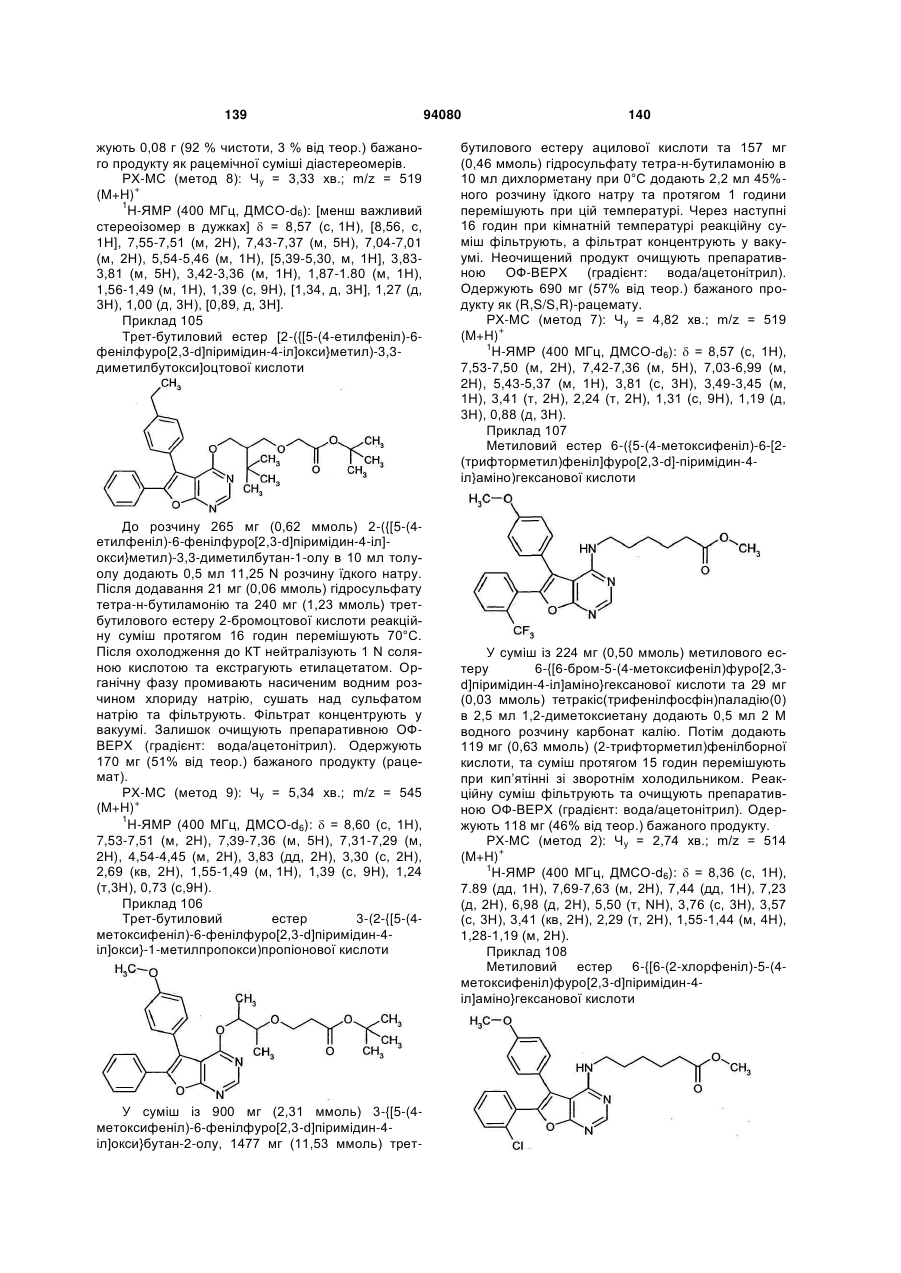
або
два залишки R1 та/або R2, які приєднані до сусідніх атомів вуглецю відповідного фенільного кільця, разом утворюють групу формули -О-СН2-О-, -O-CHF-O- або -O-CF2-O-,
n та о незалежно один від одного означають 0, 1 або 2,
причому у випадку, якщо R1 або R2 зустрічаються кілька разів, їх значення можуть бути відповідно однаковими або різними,
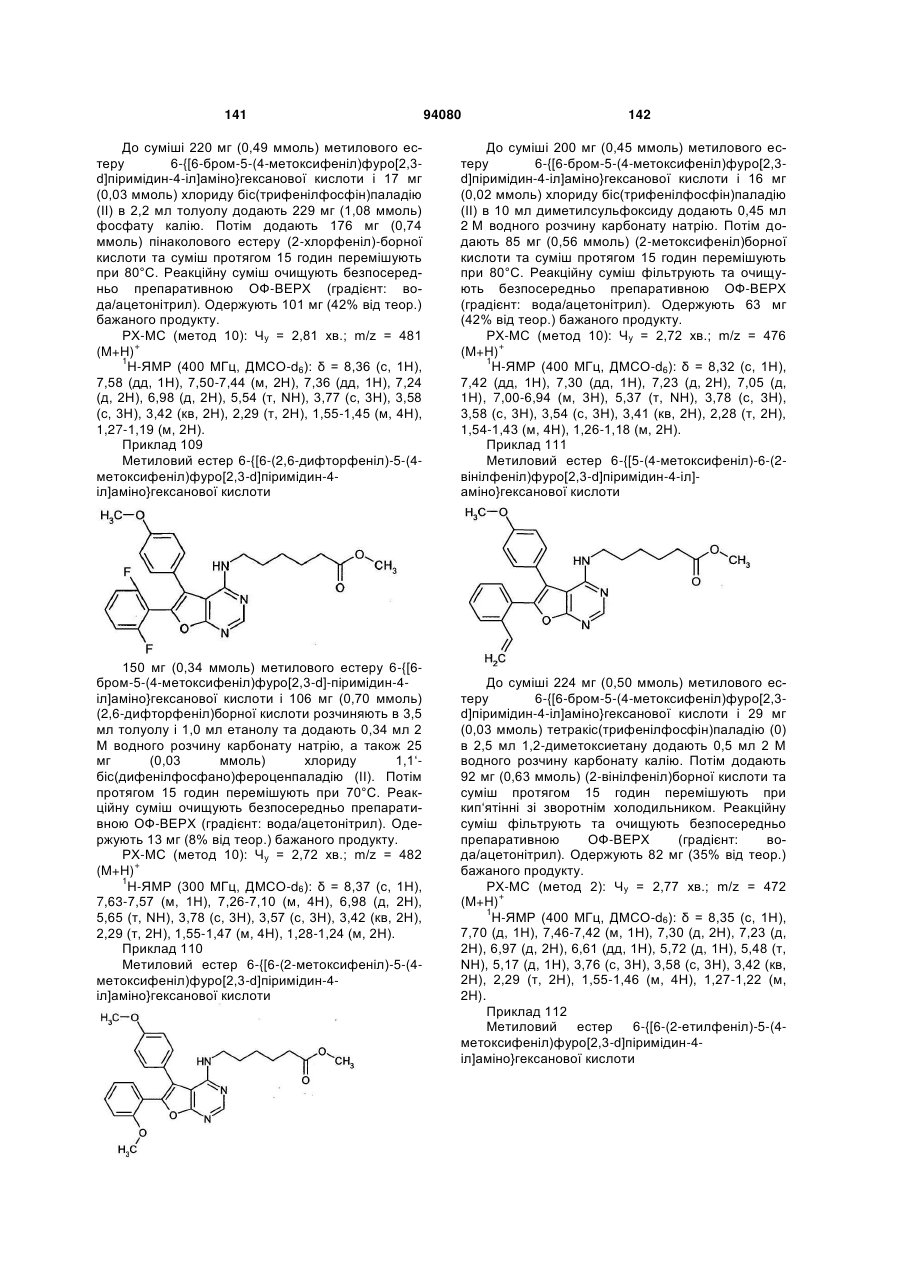
R3 означає водень, метил або етил
та
R4 означає водень,
а також її солі, сольвати та сольвати солей.
5. Сполука формули (І) за будь-яким з пунктів 1, 2 або 3, в якій
А означає О або NH,
L означає групу формули *-L1-N-(CH3)-L2, в якій
* означає місце приєднання до CHR3-групи та
L1 та L2 незалежно один від одного означають (С1-С3)-алкандіїл,
Z означає групу формули
 або
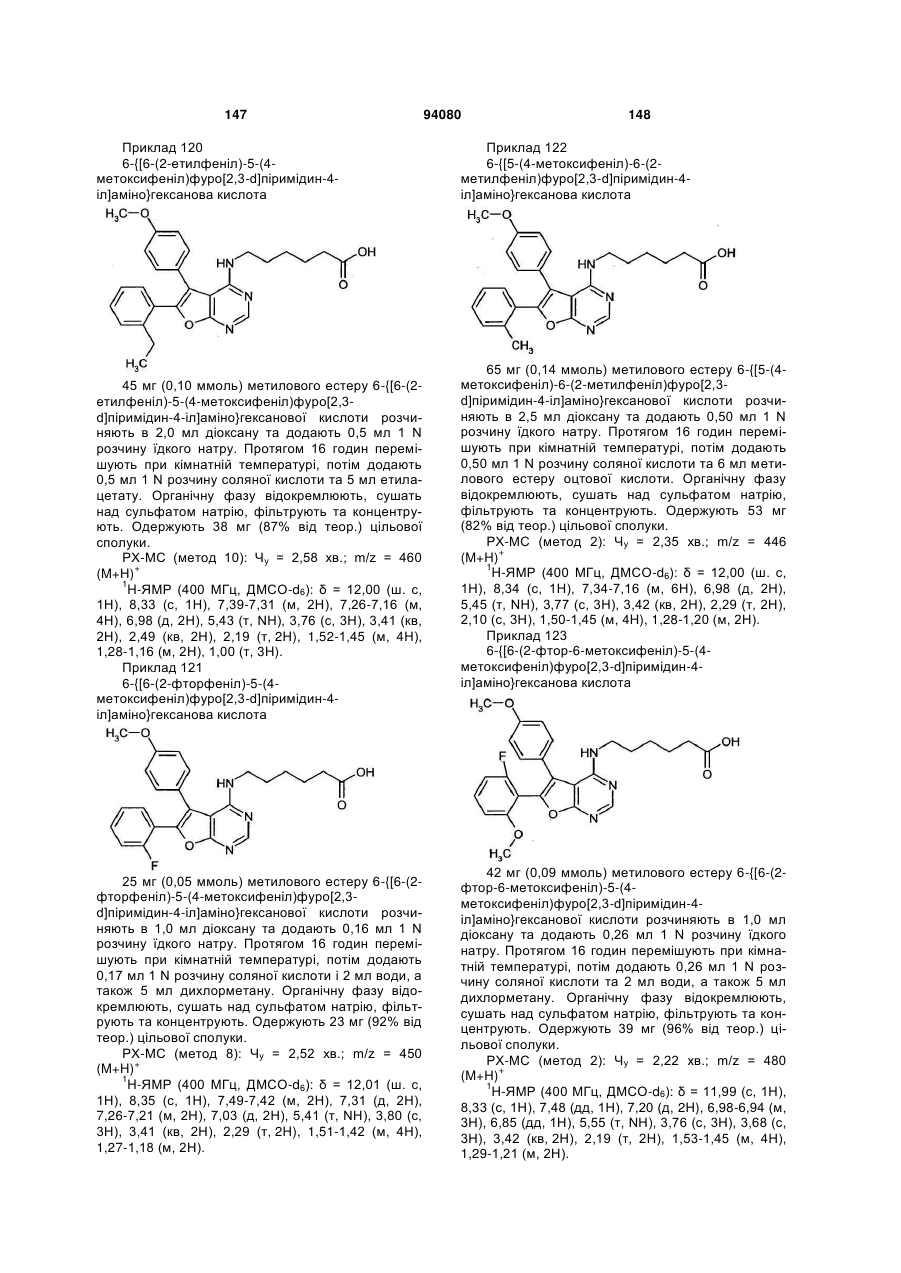
або 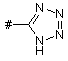 ,
,
в якій
# означає місце приєднання до групи L
та
R7 означає водень, метил або етил,
R1 та R2 незалежно один від одного означають замісник, вибраний із ряду, що включає фтор, хлор, ціано, (С1-С5)-алкіл, (С2-С5)-алкеніл, (С3-С6)-циклоалкіл, (С4-С6)-циклоалкеніл, (С1-С4)-алкокси, трифторметил, трифторметокси, (С1-С4)-алкілтіо, (С1-С5)-ацил, аміно, моно-(С1-С4)-алкіламіно, ді-(С1-С4)-алкіламіно та (С1-С4)-ациламіно,
або
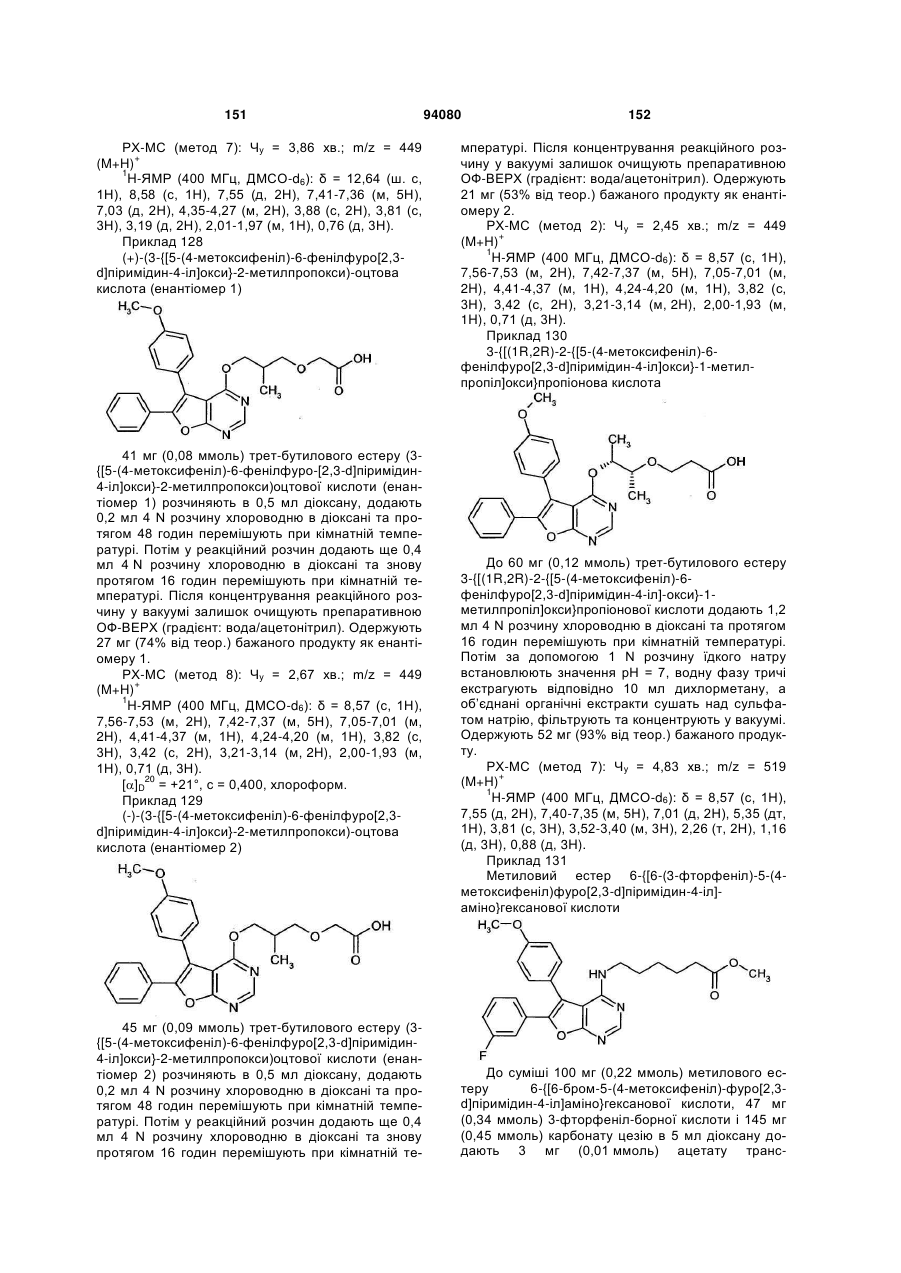
два залишки R1 та/або R2, які приєднані до сусідніх атомів вуглецю відповідного фенільного кільця, разом утворюють групу формули -О-СН2-О-, -O-CHF-O- або -O-CF2-O-,
n та о незалежно один від одного означають 0, 1 або 2,
причому у випадку, якщо R1 або R2 зустрічаються кілька разів, їх значення можуть бути відповідно однаковими або різними,
R3 означає водень, метил або етил
та
R4 означає водень,
а також її солі, сольвати та сольвати солей.
6. Сполука формули (І) за будь-яким з пунктів 1-5, в якій
А означає О або NH,
L означає (С3-С7)-алкандіїл, (С3-С7)-алкендіїл або групу формули *-L1-Q-L2, в якій
* означає місце приєднання до CHR3-групи,
L1 та L2 незалежно один від одного означають (С1-С3)-алкандіїл
та
Q означає О або N(CH3),
Z означає групу формули
 або
або 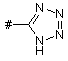 ,
,
в якій
# означає місце приєднання до групи L
та
R7 означає водень, метил або етил,
R1 означає замісник, вибраний із ряду, що включає фтор, хлор, метил, етил, вініл, трифторметил або метокси,
R2 означає замісник, вибраний із ряду, що включає фтор, хлор, ціано, метил,
етил, н-пропіл, вініл, трифторметил, метокси, етокси, трифторметокси, метилтіо, етилтіо, аміно, метиламіно та етиламіно,
n та о незалежно один від одного означають 0, 1 або 2,
причому у випадку, якщо R1 або R2 зустрічаються два рази, їх значення можуть бути відповідно однаковими або різними,
R3 означає водень, метил або етил
та
R4 означає водень,
а також її солі, сольвати та сольвати солей.
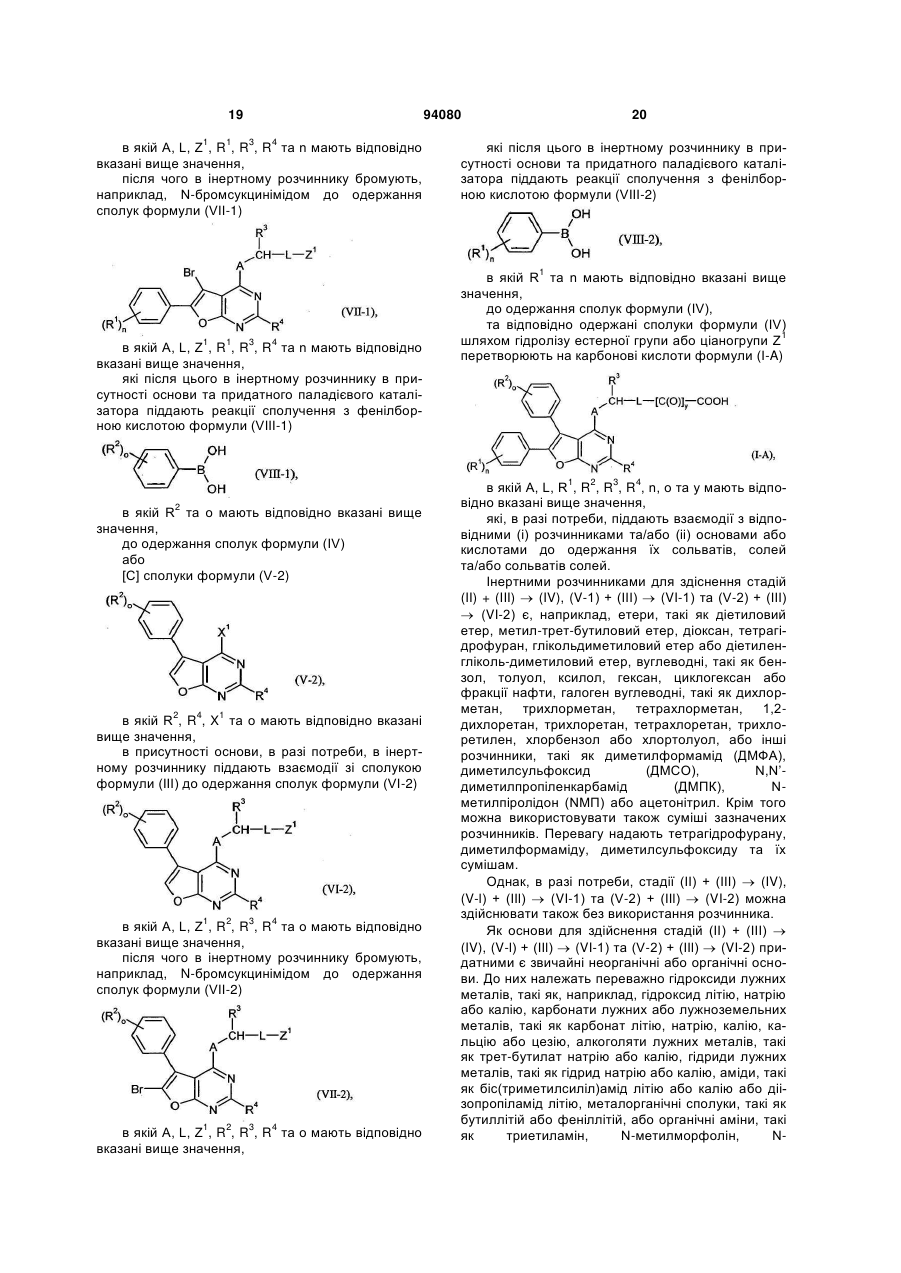
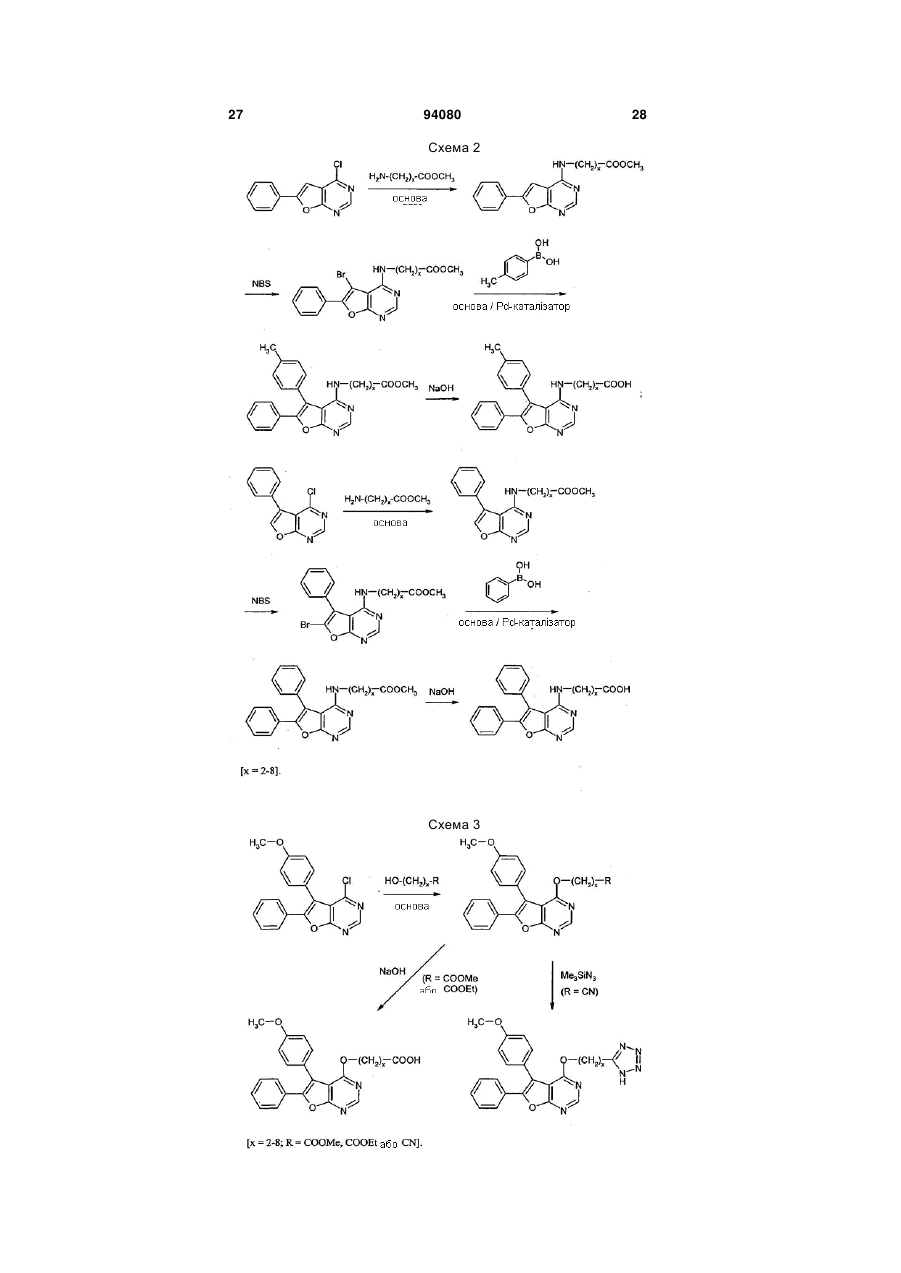
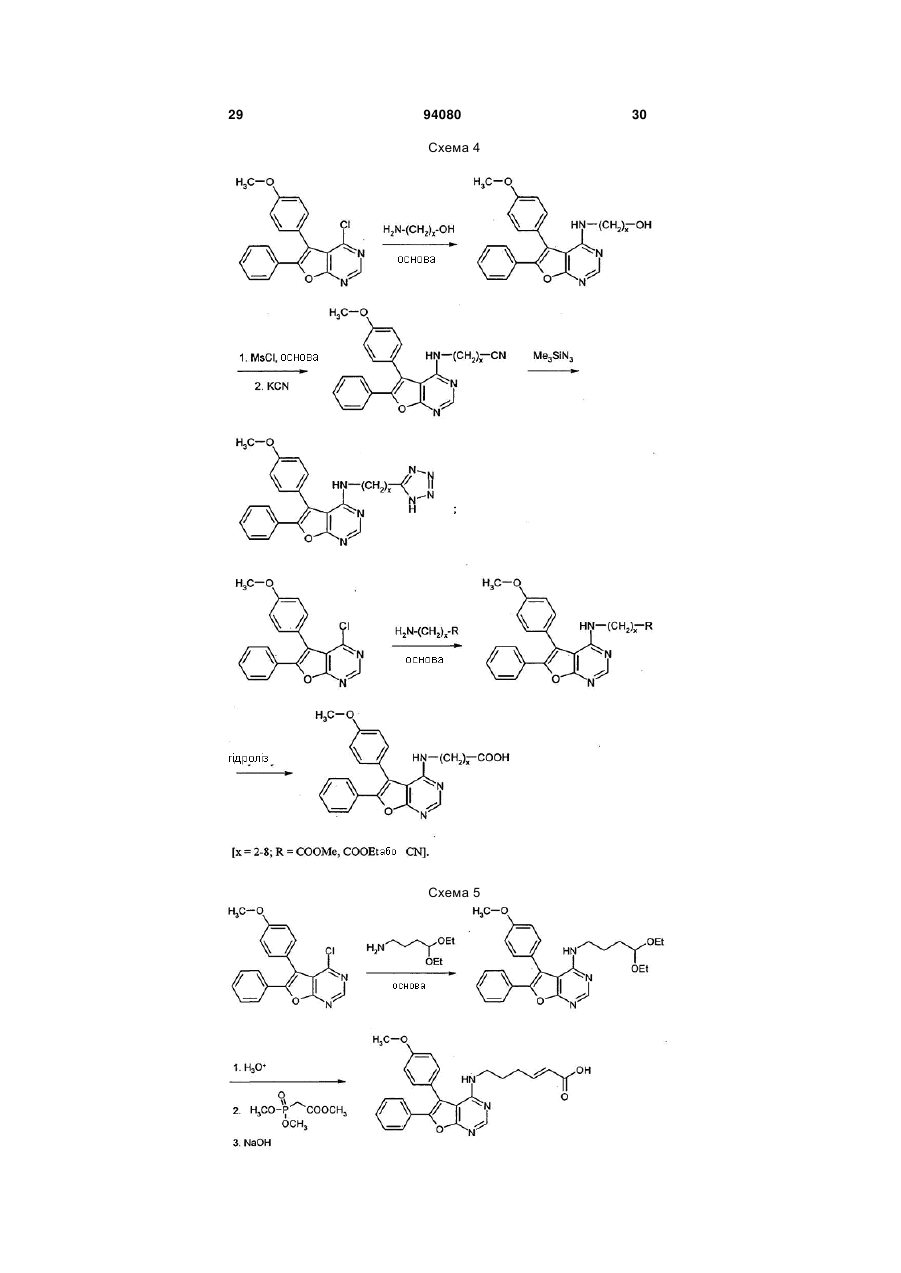
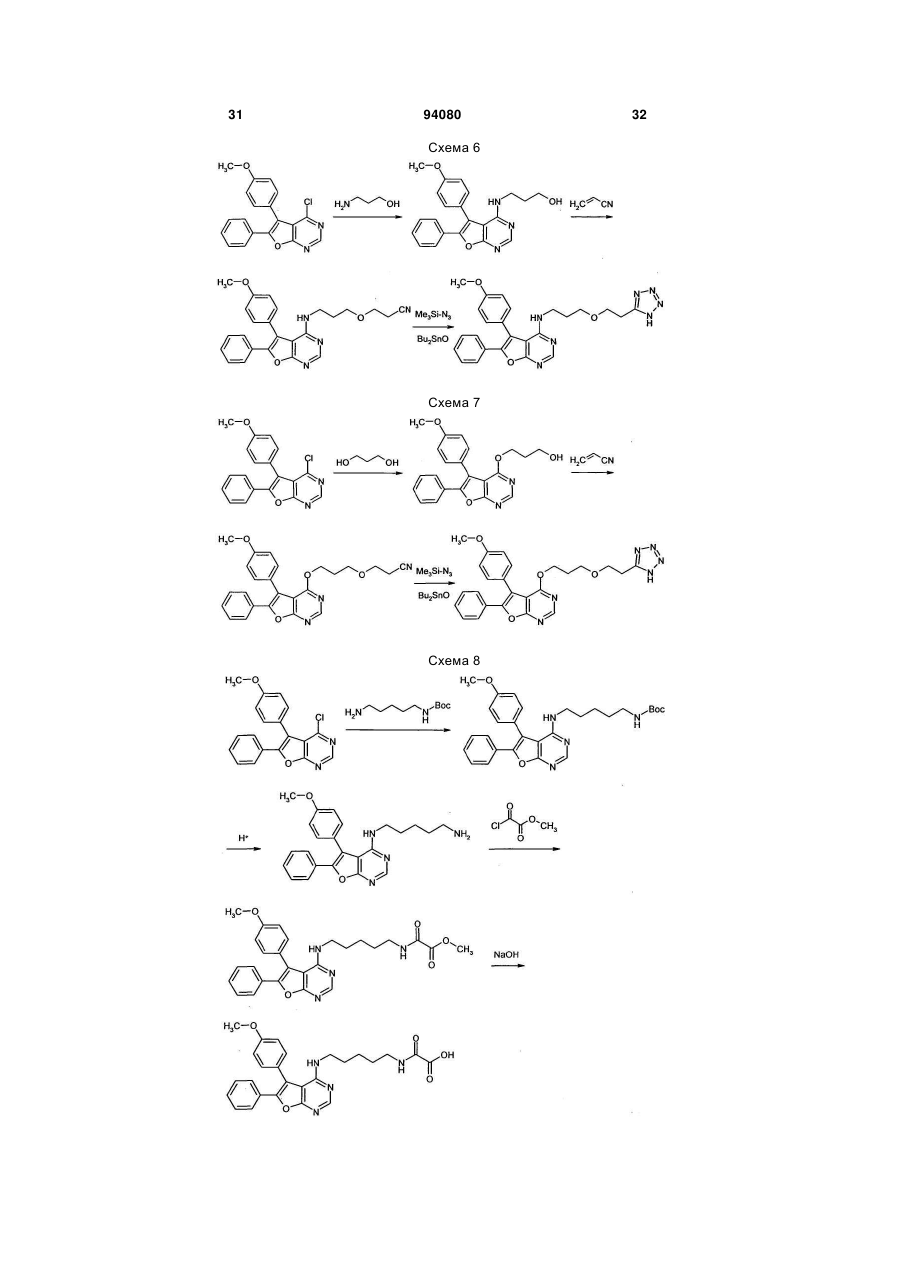
7. Спосіб одержання сполук формули (І) за будь-яким з пунктів 1-6, який відрізняється тим, що сполуку формули (II)
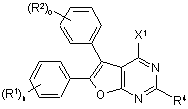 , (II)
, (II)
в якій R1, R2, R4, n та о мають відповідно вказані в пунктах 1-6 значення
та
X1 означає групу, що відходить, таку як, наприклад, галоген, зокрема хлор,
в присутності основи, в разі потреби, в інертному розчиннику піддають взаємодії зі сполукою формули (III)
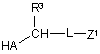 , (III)
, (III)
в якій A, L та R3 мають відповідно вказані в пунктах 1-6 значення
та
Z1 означає ціано або групу формули -[C(O)]y-COOR7A, в якій
у означає 0 або 1
та
R7A означає (С1-С4)-алкіл,
до одержання сполук формули (IV)
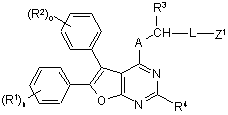 , (IV)
, (IV)
в якій A, L, Z1, R1, R2, R3, R4, n та о мають відповідно вказані вище значення,
та одержані сполуки формули (IV) шляхом гідролізу естерної групи або ціаногрупи Z1 перетворюють на карбонові кислоти формули (I-А)
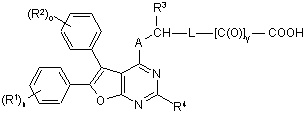 , (I-А)
, (I-А)
в якій A, L, R1, R2, R3, R4, n, о та у мають відповідно вказані вище значення,
які, в разі потреби, піддають взаємодії з відповідними (і) розчинниками та/або (іі) основами або кислотами до одержання їх сольватів, солей та/або сольватів солей.
Текст
УКРАЇНА (19) UA (11) 94080 (13) C2 (51) МПК (2011.01) C07D 491/04 (2006.01) A61K 31/519 (2011.01) A61P 9/00 МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ОПИС ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ДО ПАТЕНТУ НА ВИНАХІД (54) АЦИКЛІЧНО-ЗАМІЩЕНІ ПОХІДНІ ФУРОПІРИМІДИНУ ТА ЇХ ЗАСТОСУВАННЯ ДЛЯ ЛІКУВАННЯ СЕРЦЕВО-СУДИННИХ ЗАХВОРЮВАНЬ 1 2 Z N (R1)n O N R4 , (I) в якій 5 А означає О, S або N-R , в якій 5 R означає водень, (С1-С6)-алкіл, (С3-С7)циклоалкіл або (С4-С7)-циклоалкеніл, L означає (С1-С7)-алкандіїл або (С2-С7)-алкендіїл, які можуть бути один або два рази заміщені фто1 2 ром, або групу формули *-L -Q-L , в якій 3 * означає місце приєднання до CHR -групи, 1 L означає (С1-С5)-алкандіїл, який може бути заміщений (С1-С4)-алкілом або (С1-С4)-алкокси, 2 L означає зв'язок або (С1-С3)-алкандіїл, який може бути один або два рази заміщений фтором, та 6 Q означає О або N-R , де (13) , в якій # означає місце приєднання до групи L та 7 R означає водень або (С1-С4)-алкіл, 1 2 R та R незалежно один від одного означають замісник, вибраний із ряду, що включає галоген, ціано, нітро, (С1-С6)-алкіл, (С2-С6)-алкеніл, (С2-С4)алкініл, (С3-С7)-циклоалкіл, (С4-С7)-циклоалкеніл, (С1-С6)-алкокси, трифторметил, трифторметокси, (С1-С6)-алкілтіо, (С1-С6)-ацил, аміно, моно-(С1-С6)алкіламіно, ді-(С1-С6)-алкіламіно та (С1-С6)ациламіно, причому (С1-С6)-алкіл та (С1-С6)-алкокси зі свого боку можуть бути заміщені відповідно ціано, гідрокси, (С1-С4)-алкокси, (С1-С4)-алкілтіо, аміно, моноабо ді-(С1-С4)-алкіламіно, або 1 2 два залишки R та/або R , які приєднані до сусідніх атомів вуглецю відповідного фенільного кільця, разом утворюють групу формули -О-СН2-О-, -OCHF-O-, -О-CF2-O-, -О-СН2-СН2-О- або -O-CF2-CF2O-, n та о незалежно один від одного означають 0, 1, 2 або 3, 1 2 причому у випадку, якщо R або R зустрічаються кілька разів, їх значення можуть бути відповідно однаковими або різними, 3 R означає водень або (С1-С4)-алкіл, який може бути заміщений гідрокси або аміно, та 4 R означає водень, (С1-С4)-алкіл або циклопропіл, а також її солі, сольвати та сольвати солей. C2 O 94080 L O NH (11) CH N # UA A 6 R означає водень, (С1-С6)-алкіл або (С3-С7)циклоалкіл, Z означає групу формули O N R7 N O # # O # N N H O O R7 , , або (19) (21) a200809519 (22) 08.12.2006 (24) 11.04.2011 (86) PCT/EP2006/011826, 08.12.2006 (31) 10 2005 061 170.2 (32) 21.12.2005 (33) DE (46) 11.04.2011, Бюл.№ 7, 2011 р. (72) ЛАМПЕ ТОМАС, DE, БЕККЕР ЕВА-МАРІЯ, DE, КАСТ РАІМУНД, DE, БЕКК ХАРТМУТ, DE, ЄСКЕ МАРІО, DE, ШУМАХЕР ЙОАХІМ, DE, ШТОЛЛЬ ФРІДЕРІКЕ, DE, КЛЯЙН МАРТІНА, DE, АКБАБА МЕТІН, DE, КНОРР АНДРЕАС, DE, ШТАШ ЙОХАННЕС-ПЕТЕР, DE, БЕРФАККЕР ЛАРС, DE, ХІЛЛІШ АЛЕКСАНДЕР, AT/DE, КАРІГ ГУНТЕР, DE, МАЙНІНГХАУС МАРК, DE, ШЛЄММЕР КАРЛХАЙНЦ, DE, ШОЕ-ЛООП РУДОЛЬФ, DE (73) БАЄР ШЕРІНГ ФАРМА АКЦІЕНГЕЗЕЛЬШАФТ, DE (56) WO 03018589 (A1) 06.03.2003 US 2003225098 (A1) 04.12.2003 DE 10148883 (A1) 10.04.2003 (57) 1. Сполука формули (І) R3 (R2)o 3 2. Сполука формули (І) за пунктом 1, в якій А озна5 чає О, S або N-R , де 5 R означає водень, (С1-С6)-алкіл, (С3-С7)циклоалкіл або (С4-С7)-циклоалкеніл, L означає (С1-С7)-алкандіїл або (С2-С7)-алкендіїл, які можуть бути один або два рази заміщені фтором, або гру1 2 пу формули *-L -Q-L , в якій 3 * означає місце приєднання до CHR -групи, 1 L означає (С1-С5)-алкандіїл, 2 L означає зв'язок або (С1-С3)-алкандіїл, який може бути один або два рази заміщений фтором, та 6 Q означає О або N-R , де 6 R означає водень, (С1-С6)-алкіл або (С3-С7)циклоалкіл, Z означає групу формули O N R7 N O # # O # N N H O O R7 , , або N NH # O O , в якій # означає місце приєднання до групи L та 7 R означає водень або (С1-С4)-алкіл, 1 2 R та R незалежно один від одного означають замісник, вибраний із ряду, що включає галоген, ціано, нітро, (С1-С6)-алкіл, (С2-С6)-алкеніл, (С2-С4)алкініл, (С3-С7)-циклоалкіл, (С4-С7)-циклоалкеніл, (С1-С6)-алкокси, трифторметил, трифторметокси, (С1-С6)-алкілтіо, (С1-С6)-ацил, аміно, моно-(С1-С6)алкіламіно, ді-(С1-С6)-алкіламіно та (С1-С6)ациламіно, причому (С1-С6)-алкіл та (С1-С6)-алкокси зі свого боку можуть бути заміщені відповідно гідрокси, (С1-С4)-алкокси, аміно, моно- або ді-( С1-С4)алкіламіно, або 1 2 два залишки R та/або R , які приєднані до сусідніх атомів вуглецю відповідного фенільного кільця, разом утворюють групу формули -О-СН2-О-, -OCHF-O-, -O-CF2-O-, -О-СН2-СН2-О- або -O-CF2-CF2O-, n та о незалежно один від одного означають 0, 1, 2 або 3, 1 2 причому у випадку, якщо R або R зустрічаються кілька разів, їх значення можуть бути відповідно однаковими або різними, 3 R означає водень або (С1-С4)-алкіл, який може бути заміщений гідрокси або аміно, та 4 R означає водень, (С1-С4)-алкіл або циклопропіл, а також її солі, сольвати та сольвати солей. 3. Сполука формули (І) за пунктом 1 або 2, в якій 5 А означає О або N-R , де 5 R означає водень, (С1-С4)-алкіл або (С3-С6)циклоалкіл, L означає (С3-С7)-алкандіїл або (С3-С7)-алкендіїл, які можуть бути один або два рази заміщені фто1 2 ром, або групу формули *-L -Q-L , в якій 3 * означає місце приєднання до CHR -групи, 94080 4 1 L означає (С1-С3)-алкандіїл, 2 L означає (С1-С3)-алкандіїл, який може бути один або два рази заміщений фтором, та 6 Q означає О або N-R , де 6 R означає водень, (С1-С3)-алкіл або циклопропіл, Z означає групу формули N N N O NH # # # N N O H O O R7 , або , в якій # означає місце приєднання до групи L та 7 R означає водень, метил або етил, 1 2 R та R незалежно один від одного означають замісник, вибраний із ряду, що включає фтор, хлор, ціано, (С1-С5)-алкіл, (С2-С5)-алкеніл, (С3-С6)циклоалкіл, (С4-С6)-циклоалкеніл, (С1-С4)-алкокси, трифторметил, трифторметокси, (С1-С4)-алкілтіо, (С1-С5)-ацил, аміно, моно-(С1-С4)-алкіламіно, ді(С1-С4)-алкіламіно та (С1-С4)-ациламіно, або 1 2 два залишки R та/або R , які приєднані до сусідніх атомів вуглецю відповідного фенільного кільця, разом утворюють групу формули -О-СН2-О-, -OCHF-O- або -O-CF2-O-, n та о незалежно один від одного означають 0, 1, 2 або 3, 1 2 причому у випадку, якщо R або R зустрічаються кілька разів, їх значення можуть бути відповідно однаковими або різними, 3 R означає водень або (С1-С3)-алкіл, який може бути заміщений гідрокси або аміно, та 4 R означає водень або (С1-С3)-алкіл, а також її солі, сольвати та сольвати солей. 4. Сполука формули (І) за пунктом 1, 2 або 3, в якій А означає О або NH, L означає (С3-С7)-алкандіїл, (С3-С7)-алкендіїл або 1 2 групу формули *-L -О-L , в якій 3 * означає місце приєднання до CHR -групи та 1 2 L та L незалежно один від одного означають (С1С3)-алкандіїл, Z означає групу формули N N O # # N N 7 H O R або , в якій # означає місце приєднання до групи L та 7 R означає водень, метил або етил, 1 2 R та R незалежно один від одного означають замісник, вибраний із ряду, що включає фтор, хлор, ціано, (С1-С5)-алкіл, (С2-С5)-алкеніл, (С3-С6)циклоалкіл, (С4-С6)-циклоалкеніл, (С1-С4)-алкокси, трифторметил, трифторметокси, (С1-С4)-алкілтіо, (С1-С5)-ацил, аміно, моно-(С1-С4)-алкіламіно, ді(С1-С4)-алкіламіно та (С1-С4)-ациламіно, або 1 2 два залишки R та/або R , які приєднані до сусідніх атомів вуглецю відповідного фенільного кільця, 5 разом утворюють групу формули -О-СН2-О-, -OCHF-O- або -O-CF2-O-, n та о незалежно один від одного означають 0, 1 або 2, 1 2 причому у випадку, якщо R або R зустрічаються кілька разів, їх значення можуть бути відповідно однаковими або різними, 3 R означає водень, метил або етил та 4 R означає водень, а також її солі, сольвати та сольвати солей. 5. Сполука формули (І) за будь-яким з пунктів 1, 2 або 3, в якій А означає О або NH, 1 2 L означає групу формули *-L -N-(CH3)-L , в якій 3 * означає місце приєднання до CHR -групи та 1 2 L та L незалежно один від одного означають (С1С3)-алкандіїл, Z означає групу формули N N O # # N N H O R7 або , в якій # означає місце приєднання до групи L та 7 R означає водень, метил або етил, 1 2 R та R незалежно один від одного означають замісник, вибраний із ряду, що включає фтор, хлор, ціано, (С1-С5)-алкіл, (С2-С5)-алкеніл, (С3-С6)циклоалкіл, (С4-С6)-циклоалкеніл, (С1-С4)-алкокси, трифторметил, трифторметокси, (С1-С4)-алкілтіо, (С1-С5)-ацил, аміно, моно-(С1-С4)-алкіламіно, ді(С1-С4)-алкіламіно та (С1-С4)-ациламіно, або 1 2 два залишки R та/або R , які приєднані до сусідніх атомів вуглецю відповідного фенільного кільця, разом утворюють групу формули -О-СН2-О-, -OCHF-O- або -O-CF2-O-, n та о незалежно один від одного означають 0, 1 або 2, 1 2 причому у випадку, якщо R або R зустрічаються кілька разів, їх значення можуть бути відповідно однаковими або різними, 3 R означає водень, метил або етил та 4 R означає водень, а також її солі, сольвати та сольвати солей. 6. Сполука формули (І) за будь-яким з пунктів 1-5, в якій А означає О або NH, L означає (С3-С7)-алкандіїл, (С3-С7)-алкендіїл або 1 2 групу формули *-L -Q-L , в якій 3 * означає місце приєднання до CHR -групи, 1 2 L та L незалежно один від одного означають (С1С3)-алкандіїл та Q означає О або N(CH3), Z означає групу формули N N O # # N N H O R7 або , в якій 94080 6 # означає місце приєднання до групи L та 7 R означає водень, метил або етил, 1 R означає замісник, вибраний із ряду, що включає фтор, хлор, метил, етил, вініл, трифторметил або метокси, 2 R означає замісник, вибраний із ряду, що включає фтор, хлор, ціано, метил, етил, н-пропіл, вініл, трифторметил, метокси, етокси, трифторметокси, метилтіо, етилтіо, аміно, метиламіно та етиламіно, n та о незалежно один від одного означають 0, 1 або 2, 1 2 причому у випадку, якщо R або R зустрічаються два рази, їх значення можуть бути відповідно однаковими або різними, 3 R означає водень, метил або етил та 4 R означає водень, а також її солі, сольвати та сольвати солей. 7. Спосіб одержання сполук формули (І) за будьяким з пунктів 1-6, який відрізняється тим, що сполуку формули (II) (R2)o X1 N (R1)n O 1 2 N R4 , (II) 4 в якій R , R , R , n та о мають відповідно вказані в пунктах 1-6 значення та 1 X означає групу, що відходить, таку як, наприклад, галоген, зокрема хлор, в присутності основи, в разі потреби, в інертному розчиннику піддають взаємодії зі сполукою формули (III) R3 CH L Z1 HA , (III) 3 в якій A, L та R мають відповідно вказані в пунктах 1-6 значення та 1 Z означає ціано або групу формули -[C(O)]y7A COOR , в якій у означає 0 або 1 та 7A R означає (С1-С4)-алкіл, до одержання сполук формули (IV) R3 (R2)o A CH L Z1 N (R1)n O N R4 , (IV) в якій A, L, Z , R , R , R , R , n та о мають відповідно вказані вище значення, та одержані сполуки формули (IV) шляхом гідролі1 зу естерної групи або ціаногрупи Z перетворюють на карбонові кислоти формули (I-А) 1 1 2 3 4 7 94080 8 R3 (R2)o A CH L [C(O)]y COOH N (R1)n 1 2 3 O N 4 R4 , (I-А) в якій A, L, R , R , R , R , n, о та у мають відповідно вказані вище значення, які, в разі потреби, піддають взаємодії з відповідними (і) розчинниками та/або (іі) основами або кислотами до одержання їх сольватів, солей та/або сольватів солей. Даний винахід стосується нових ациклічнозаміщених похідних фуропіримідину, способу їх одержання, їх застосування для лікування та/або профілактики захворювань, а також їх застосування для одержання лікарських засобів для лікування та/або профілактики захворювань, зокрема для лікування та/або профілактики серцево-судинних захворювань. Простациклін (PGI2) належить до родини біоактивних простагландинів, які є похідними арахідонової кислоти. PGI2 є основним продуктом обміну речовин арахідонової кислоти в клітинах ендотелію та проявляє вигідні судинорозширювальні та антинакопичувальні властивості. PGI2 є фізіологічним антиподом тромбоксану A2 (TxA2), сильного вазоконстриктора та стимулятора накопичення тромбоцитів, і таким чином сприяє підтриманню васкулярного гомеостазу. Зниження рівня PGI2, скоріше за все, є однією з причин розвитку серцево-судинних захворювань [Dusting, G.J. та ін., Pharmac. Ther. 1990, 48: 323-344; Vane, J. та ін., Eur. J. Vase. Endovasc. Surg. 2003,26: 571-578]. Після вивільнення арахідонової кислоти із фосфоліпідів через фосфоліпази A2 PGI2 синтезується циклооксигеназами та після цього PGI2синтазою. PGI2 не накопичується, а відразу ж вивільнюється після синтезу, що сприяє поширенню його локальної дії. PGI2 є нестабільною молекулою, яка швидко (період напіврозпаду прибл. 3 хвилини) неферментативним способом перетворюється на неактивний метаболіт, 6-кетопростагландин-F1альфа [Dusting, G.J. та ін., Pharmac. Ther. 1990,48:323-344]. Біологічні ефекти PGI2 проявляються в результаті зв‗язування з мембранним рецептором, так званим простацикліновим рецептором або BPрецептором [Narumiya, S. та ін., Physiol. Rev. 1999, 79: 1193-1226]. BP-рецептор належить до Gпротеїн-зв‘язувальних рецепторів, які характеризуються 7 трансмембранними доменами. Поряд із IP-рецептором людини були клоновані також простациклінові рецептори із пацюків та мишей [Vane, J. та ін., Eur. J. Vase. Endovasc. Surg. 2003, 26: 571-578]. У клітинах гладкої мускулатури активування IP-рецептора приводить до стимуляції аденілатциклази, яка каталізує утворення cAMP із ATP. Підвищення внутрішньоклітинної концентрації cAMP відповідає за простациклін-індуковане розширення судин, а також за інгібування накопичення тромбоцитів. Поряд із вазоактивними властивостями для PGI2 були описані також антипроліферативні [Schroer, K. та ін., Agents Actions Suppl. 1997, 48: 63-91; Kothapalli, D. та ін., Mol. Pharmacol. 2003, 64: 249-258; Planchon, P. та ін., Life Sei. 1995, 57: 1233-1240] та антиартеріосклеротичні властивості [Rudic, R.D. та ін., Circ. Res. 2005, 96: 1240-1247; Egan K.M. та ін., Science 2004, 114: 784-794]. Крім того процес утворення метастаз також інгібується PGI2 [Schneider, M.R. та ін., Cancer Metastasis Rev. 1994, 13: 349-64). Однак невідомо, чи викликані ці ефекти стимуляцією утворення cAMP або опосередкованим IPрецептором активуванням інших шляхів трансдукції сигналу у відповідній клітині [Wise, H. та ін. TIPS 1996, 17: 17-21], наприклад, фосфоінозитидний каскад, а також калієві канали. Хоча дія PGI2 загалом є терапевтично важливою, клінічне застосування PGІ2 значним чином обмежується через його хімічну та метаболічну нестабільність. При цьому могли б бути використані більш стабільні аналоги PGI2, такі як, наприклад, ілопрост [Badesch, D.B. та ін., J. Am. Coll. Cardiol 2004,43: 56S-61S] та трепростиніл [Chattaraj, S.C., Curr. Opion. Invest. Drugs 2002, 3: 582-586], однак термін дії цих сполук є дуже коротким. Крім того, ці речовини можуть бути введені пацієнту лише складними методами, наприклад, тривалою інфузією, підшкірно або багаторазовими інгаляціями. До того ж такі методи введення можуть призвести до виникнення додаткових побічних ефектів, таких як, наприклад, інфекції або болі у місці ін‘єкції. Застосування єдиної до цього часу перорально доступної для пацієнта похідної PGІ2, берапросту [Barst, R.J. та ін., J. Am. Coll. Cardiol. 2003, 41: 2119-2125] також обмежується короткою тривалістю дії цієї речовини. Описані в даній заявці сполуки у порівнянні з PGI2 є хімічно та метаболічно стабільними, непростаноїдними активаторами IP-рецептора, які імітують біологічну дію PGI2 і таким чином можуть бути застосовані для лікування захворювань. Зокрема серцево-судинних захворювань. В DE 1 817 146, EP 1 018 514, EP 1 132 093, WO 02/092603, WO 03/022852, WO 2005/092896, WO 2005/121149 та WO 2006/004658 описані різні 4-окси-, 4-тіота/або 4-аміно-фуро[2,3 9 d]піримідинові похідні та їх застосування для лікування захворювань. В WO 03/018589 описані 4амінофуропіримідини як інгібітори аденозинкінази для лікування серцево-судинних захворювань. Спосіб одержання певних 4-амінофуропіримідинових похідних описаний в Chemica Scripta 1986, 26 (2): 337-342, Yakugaku Zasshi 1969, 89 (10): 1434-1439, а також Yakugaku Zasshi 1977, 97 (9): 1022-1033. В WO 00/75145 заявлені сполуки, що мають біциклічну гетероарильну структуру ядра, як інгібітори адгезії клітин. Заявлені в рамках даного винаходу сполуки у порівнянні зі сполуками рівня техніки відрізняються 5,6-дифенілфуро[2,3-d]піримідиновою структурою ядра, яка в положенні 4 на певній відстані зв‘язана із залишком карбонової кислоти або залишком, подібним карбоновій кислоті. Предметом даного винаходу є сполуки загальної формули (I) в якій 5 A означає O, S або N-R , в якій 5 R означає водень, (C1-C6)-алкіл, (C3-C7)циклоалкіл або (C4-C7)-циклоалкеніл, L означає (C1-C7)-алкандіїл або (C2-C7)алкендіїл, які можуть бути один або два рази за1 2 міщені фтором, або групу формули *-L -Q-L , в якій 3 * означає місце приєднання до CHR -групи, 1 L означає (C1-C5)-алкандіїл, який може бути заміщений (C1-C4)-алкілом або (C1-C4)-алкокси, 2 L означає зв‘язок або (C1-C3)-алкандіїл, який може бути один або два рази заміщений фтором, та 6 Q означає O або N-R , де 6 R означає водень, (C1-C6)-алкіл або (C3-C7)циклоалкіл, Z означає групу формули в якій # означає місце приєднання до групи L та 7 R означає водень або (C1-C4)-алкіл, 1 2 R та R незалежно один від одного означають замісник, вибраний із ряду, що включає галоген, ціано, нітро, (C1-C6)-алкіл, (C2-C6)-алкеніл, (C2-C4)алкініл, (C3-C7)-циклоалкіл, (C4-C7)-циклоалкеніл, (C1-C6)-алкокси, трифторметил, трифторметокси, (C1-C6)-алкілтіо, (C1-C6)-ацил, аміно, моно-(C1-C6) 94080 10 алкіламіно, ді-(C1-C6)-алкіламіно та (C1-C6)ациламіно, причому (C1-C6)-алкіл та (С1-C6)-алкокси зі свого боку можуть бути заміщені відповідно ціано, гідрокси, (C1-C4)-алкокси, (C1-C4)-алкілтіо, аміно, моно- або ді-(C1-C4)-алкіламіно, або 1 2 два залишки R та/або R , які приєднані до сусідніх атомів вуглецю відповідного фенільного кільця, разом утворюють групу формули -O-CH2-O-, -O-CHF-O-, -O-CF2-O-, -O-CH2-CH2-O- або -O-CF2CF2-O-, n та o незалежно один від одного означають 0, 1, 2 або 3, 1 2 причому у випадку, якщо R або R зустрічаються кілька разів, їх значення можуть бути відповідно однаковими або різними, 3 R означає водень або (C1-C4)-алкіл, який може бути заміщений гідрокси або аміно, та 4 R означає водень, (C1-C4)-алкіл або циклопропіл, а також їх солі, сольвати та сольвати солей. Сполуками згідно з винаходом є сполуки формули (I) та їх солі, сольвати і сольвати солей, охоплені формулою (I) сполуки вказаних нижче формул та їх солі, сольвати і сольвати солей, а також охоплені формулою (I) наведені нижче як приклади виконання сполуки та їх солі, сольвати і сольвати солей, якщо під охопленими формулою (I) наведеними нижче сполуками вже не мають на увазі солі, сольвати та сольвати солей. Сполуки згідно з винаходом залежно від їх структури можуть існувати в ізомерних формах (енантіомери, діастереомери) Тому винахід стосується також енантіомерів і діастереомерів та їх відповідних сумішей. Із таких сумішей енантіомерів та/або діастереомерів стереоізомерні компоненти можуть бути виділені відомими способами. Якщо сполуки згідно з винаходом можуть існувати у таутомерних формах, то даний винахід включає також всі таутомерні форми. Як солі в рамках даного винаходу переважними є фізіологічно прийнятні солі сполук згідно з винаходом. Винахід включає також солі, які самі є непридатними для фармацевтичного застосування, однак можуть бути використані, наприклад, для виділення або очищення сполук згідно з винаходом. Фізіологічно прийнятними солями сполук згідно з винаходом є кислотно-адитивні солі мінеральних, карбонових та сульфонових кислот, наприклад, солі хлорводневої, бромводневої, сірчаної, фосфорної, метансульфонової, етансульфонової, толуолсульфонової, бензолсульфонової, нафталіндисульфонової, оцтової, трифтороцтової, пропіонової, молочної, винної, яблучної, лимонної, фумарової, малеїнової та бензойної кислоти. Фізіологічно прийнятними солями сполук згідно з винаходом є також солі звичайних основ, такі як, наприклад, переважно солі лужних металів (наприклад, натрію та калію), солі лужноземельних металів (наприклад, кальцію та магнію) та амонієві солі, похідні від аміаку або органічних амінів, що містять від 1 до 16 атомів вуглецю, такі як, напри 11 клад, та переважно етиламін, діетиламін, триетиламін, етилдіізопропіламін, моноетаноламін, діетаноламін, триетаноламін, дициклогексиламін, диметиламіноетанол, прокаїн, дибензиламін, Nметилморфолін, аргінин, лізин, етилендіамін та Nметилпіперидин. Сольватами в рамках даного винаходу є такі форми сполук згідно з винаходом, які у твердому або рідкому стані шляхом координації з молекулами розчинника утворюють комплекс. Гідрати - це спеціальна форма сольватів, в яких координація відбувається з водою. Як сольвати в рамках даного винаходу переважними є гідрати. Крім того даний винахід включає також проліки сполук згідно з винаходом. Поняття "проліки" означає сполуки, які самі можуть бути біологічно активними або неактивними, однак під час свого перебування в організмі перетворюються на сполуки згідно з винаходом (наприклад, метаболічно або гідролітично). Зокрема в рамках даного винаходу під сполуками формули (I), в якій Z означає групу формули розуміють також здатні до гідролізу похідні естерів цих сполук. При цьому йдеться про естери, які у фізіологічних середовищах в умовах описаних нижче біологічних досліджень та зокрема in vivo ферментативним або хімічним способом можуть бути гідролізовані до вільних карбонових кислот, тобто біологічно активних сполук. Як таким естерам перевагу надають (С1-С4)-алкіловим естерам, в яких алкільна група може бути нерозгалуженою або розгалуженою. Особливу перевагу надають метиловим або етиловим естерам (див. також від7 повідні визначення залишка R ). В рамках даного винаходу замісники, якщо не зазначено нічого іншого, мають такі значення: (C1-C6)-алкіл, (С1-С5)-алкіл, (С1-С4)-алкіл та (С1-С3)-алкіл в рамках даного винаходу означають нерозгалужений або розгалужений алкільний залишок, що містить від 1 до 6, від 1 до 5, від 1 до 4 або відповідно від 1 до 3 атомів вуглецю. Перевагу надають нерозгалуженому або розгалуженому алкільному залишку, що містить від 1 до 4, особливо переважно від 1 до 3 атомів вуглецю. Переважними прикладами цих залишків є: метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, 1-етилпропіл, н-пентил та н-гексил. (С2-С6)-алкеніл та (C2-С5)-алкеніл в рамках даного винаходу означають нерозгалужений або розгалужений алкенільний залишок, що містить від 2 до 6 або відповідно від 2 до 5 атомів вуглецю та один або два подвійних зв‘язки. Перевагу надають нерозгалуженому або розгалуженому алкенільному залишку, що містить від 2 до 5 атомів вуглецю та один подвійний зв‘язок. Переважними прикладами цих залишків є: вініл, аліл, ізопропеніл та нбут-2-ен-1-іл. 94080 12 (С2-С4)-алкініл в рамках даного винаходу означає нерозгалужений або розгалужений алкінільний залишок, що містить від 2 до 4 атомів вуглецю та один потрійний зв‗язок. Перевагу надають нерозгалуженому алкінільному залишку, що містить від 2 до 4 атомів вуглецю. Переважними прикладами цих залишків є: етиніл, н-проп-1-ін-1-іл, н-проп-2ін-1-іл, н-бут-2-ин-1-іл та н-бут-3-ин-1-іл. (C1-C7)-алкандіїл, (C1-C5)-алкандіїл, (C1-C3)алкандіїл та (C3-C7)-алкандіїл в рамках даного винаходу означають нерозгалужений або розгалужений двовалентний алкільний залишок, що містить від 1 до 7, від 1 до 5, від 1 до 3 або відповідно від 3 до 7 атомів вуглецю. Перевагу надають нерозгалуженому або розгалуженому алкандіїльному залишку, що містить від 1 до 5, від 1 до 3 або відповідно від 3 до 7 атомів вуглецю. Переважними прикладами цих залишків є: метилен, 1,2-етилен, етан-1,1-діїл, 1,3-пропілен, пропан-1,1-діїл, пропан-1,2-діїл, пропан-2,2-діїл, 1,4-бутилен, бутан1,2-діїл, бутан-1,3-діїл, бутан-2,3-діїл, пентан-1,5діїл, пентан-2,4-діїл, 3-метилпентан-2,4-діїл та гексан-1,6-діїл. (C2-C7)-алкендіїл та (С3-С7)-алкендіїл в рамках даного винаходу означають нерозгалужений або розгалужений двовалентний алкенільний залишок, що містить від 2 до 7 або відповідно від 3 до 7 атомів вуглецю та до 3 подвійних зв‘язків. Перевагу надають нерозгалуженому або розгалуженому алкендіїльному залишку, що містить від 3 до 7 атомів вуглецю та один подвійний зв‘язок. Переважними прикладами цих залишків є: етен-1,1-діїл, етен-1,2-діїл, пропен-1,1-діїл, пропен-1,2-діїл, пропен-1,3-діїл, бут-1-ен-1,4-діїл, бут-1-ен-1,3-діїл, бут-2-ен-1,4-діїл, бута-1,3-дієн-1,4-діїл, пент-2-ен1,5-діїл, гекс-3-ен-1,6-діїл та гекса-2,4-дієн-1,6-діїл. (C1-С6)-алкокси та (C1-С4)-алкокси в рамках даного винаходу означають нерозгалужений або розгалужений алкоксизалишок, що містить від 1 до 6 або відповідно від 1 до 4 атомів вуглецю. Перевагу надають нерозгалуженому або розгалуженому алкоксизалишку, що містить від 1 до 4 атомів вуглецю. Переважними прикладами цих залишків є: метокси, етокси, н-пропокси, ізопропокси, нбутокси, трет-бутокси, н-пентокси та н-гексокси. (C1-С6)-алкілтіо та (C1-С4)-алкілтіо в рамках даного винаходу означають нерозгалужений або розгалужений алкілтіозалишок, що містить від 1 до 6 або відповідно від 1 до 4 атомів вуглецю. Перевагу надають нерозгалуженому або розгалуженому алкілтіозалишку, що містить від 1 до 4 атомів вуглецю Переважними прикладами цих залишків є: метилтіо, етилтіо, н-пропілтіо, ізопропілтіо, нбутилтіо, трет-бутилтіо, н-пентилтіо та н-гексилтіо. (C1-С6)-ацил [(C1-C6)-алканоїл], (C1-C5)-ацил [(C1-C5)-алканоїл] та (C1-С4)-ацил [(C1-C4)алканоїл] в рамках даного винаходу означають нерозгалужений або розгалужений алкільний залишок, що містить від 1 до 6, від 1 до 5 або відповідно від 1 до 4 атомів вуглецю та в положенні 1 містить зв‘язаний подвійним зв‗язком атом кисню і приєднаний через положення 1. Перевагу надають нерозгалуженому або розгалуженому ацильному залишку, що містить від 1 до 4 атомів вуглецю. Переважними прикладами цих залишків є: форміл, 13 ацетил, пропіоніл, н-бутирил, ізобутирил та півалоїл. Моно-(C1-C6)-алкіламіно та моно-(C1-C4)алкіламіно в рамках даного винаходу означають аміногрупу, що має нерозгалужений або розгалужений алкільний замісник, який містить від 1 до 6 або відповідно від 1 до 4 атомів вуглецю. Перевагу надають нерозгалуженому або розгалуженому моноалкіламінозалишку, що містить від 1 до 4 атомів вуглецю. Переважними прикладами цих залишків є: метиламіно, етиламіно, н-пропіламіно, ізопропіламіно та трет-бутиламіно. Ді-(C1-C6)-алкіламіно та ді-(С1-C4)-алкіламіно в рамках даного винаходу означають аміногрупу, що має два однакових або різних нерозгалужених або розгалужених алкільних замісника, які містять відповідно від 1 до 6 або від 1 до 4 атомів вуглецю. Перевагу надають нерозгалуженим або розгалуженим діалкіламінозалишкам, що містять від 1 до 4 атомів вуглецю. Переважними прикладами цих залишків є: N,N-диметиламіно, N,N-діетиламіно, Nетил-N-метиламіно, N-метил-N-н-пропіламіно, Nізопропіл-N-н-пропіламіно, N-трет-бутил-Nметиламіно, N-етил-N-н-пентиламіно та N-нгексил-N-метиламіно. (C1-С6)-ациламіно та (С1-С4)-ациламіно в рамках даного винаходу означають аміногрупу, що має нерозгалужений або розгалужений ацильний замісник, який містить від 1 до 6 або відповідно від 1 до 4 атомів вуглецю та приєднаний через карбонільну групу. Перевагу надають ациламінозалишку, що містить від 1 до 4 атомів вуглецю. Переважними прикладами цих залишків є: формамідо, ацетамідо, пропіонамідо, н-бутирамідо та півалоїламідо. (C3-C7)-циклоалкіл та (C3-С6)-циклоалкіл в рамках даного винаходу означають моноциклічну насичену циклоалкільну групу, що містить від 3 до 7 або відповідно від 3 до 6 атомів вуглецю. Перевагу надають циклоалкільному залишку, що містить від 3 до 6 атомів вуглецю. Переважними прикладами цих залишків є: циклопропіл, циклобутил, циклопентил, циклогексил та циклогептил. (C4-C7)-циклоалкеніл та (C4-С6)-циклоалкеніл в рамках даного винаходу означають моноциклічну циклоалкільну групу, що містить від 4 до 7 або відповідно від 4 до 6 атомів вуглецю та один подвійний зв‗язок. Перевагу надають циклоалкенільному залишку, що містить від 4 до 6 атомів вуглецю. Переважними прикладами цих залишків є: циклобутеніл, циклопентеніл, циклогексеніл та циклогептеніл. Галоген в рамках даного винаходу включає фтор, хлор, бром та йод. Перевагу надають хлору або фтору. Якщо залишки у сполуках згідно з винаходом є заміщеними, то вони, якщо не зазначено нічого іншого, можуть бути заміщені один або кілька разів. В рамках даного винаходу всі залишки, які зустрічаються неодноразово, мають незалежні один від одного значення. Перевагу надають заміщенню одним, двома або трьома однаковими або різними замісниками. Найбільшу перевагу надають заміщенню одним замісником. 94080 14 Перевагу в рамках даного винаходу надають сполукам формули (I), в якій 5 A означає O, S або N-R , де 5 R означає водень, (C1-C6)-алкіл, (C3-C7)циклоалкіл або (C4-C7)-циклоалкеніл, L означає (C1-C7)-алкандіїл або (C2-C7)алкендіїл, які можуть бути один або два рази за1 2 міщені фтором, або групу формули *-L -Q-L , в якій 3 * означає місце приєднання до CHR -групи, 1 L означає (C1-C5)-алкандіїл, 2 L означає зв‗язок або (C1-C3)-алкандіїл, який може бути один або два рази заміщений фтором, та 6 Q означає O або N-R , де 6 R означає водень, (C1-C6)-алкіл або (C3-C7)циклоалкіл, Z означає групу формули в якій # означає місце приєднання до групи L та 7 R означає водень або (C1-C4)-алкіл, 1 2 R та R незалежно один від одного означають замісник, вибраний із ряду, що включає галоген, ціано, нітро, (C1-C6)-алкіл, (C2-C6)-алкеніл, (C2-C4)алкініл, (C3-C7)-циклоалкіл, (C4-C7)-циклоалкеніл, (C1-C6)-алкокси, трифторметил, трифторметокси, (C1-C6)-алкілтіо, (C1-C6)-ацил, аміно, моно-(C1-C6)алкіламіно, ді-(C1-C6)-алкіламіно та (C1-C6)ациламіно, причому (C1-C6)-алкіл та (С1-C6)-алкокси зі свого боку можуть бути заміщені відповідно гідрокси, (C1-C4)-алкокси, аміно, моно- або ді-(C1-C4)алкіламіно, або 1 2 два залишки R та/або R , які приєднані до сусідніх атомів вуглецю відповідного фенільного кільця, разом утворюють групу формули -O-CH2-O-, -O-CHF-O-, -O-CF2-O-, -O-CH2-CH2-O- або -O-CF2CF2-O-, n та o незалежно один від одного означають 0, 1, 2 або 3, 1 2 причому у випадку, якщо R або R зустрічаються кілька разів, їх значення можуть бути відповідно однаковими або різними, 3 R означає водень або (C1-C4)-алкіл, який може бути заміщений гідрокси або аміно, та 4 R означає водень, (C1-C4)-алкіл або циклопропіл, а також їх солям, сольватам та сольватам солей. Особливу перевагу в рамках винаходу надають сполукам формули (I), в якій 15 94080 5 A означає O або N-R , де 5 R означає водень, (С1-С4)-алкіл або (C3-C6)циклоалкіл, L означає (C3-C7)-алкандіїл або (C3-C7)алкендіїл, які можуть бути один або два рази за1 2 міщені фтором, або групу формули *-L -Q-L , в якій 3 * означає місце приєднання до CHR -групи, 1 L означає (C1-C3)-алкандіїл, 2 L означає (C1-C3)-алкандіїл, який може бути один або два рази заміщений фтором, та 6 Q означає O або N-R , де 6 R означає водень, (C1-C3)-алкіл або циклопропіл, Z означає групу формули в якій # означає місце приєднання до групи L та 7 R означає водень, метил або етил, 1 2 R та R незалежно один від одного означають замісник, вибраний із ряду, що включає фтор, хлор, ціано, (C1-C5)-алкіл, (C2-C5)-алкеніл, (C3-C6)циклоалкіл, (C4-C6)-циклоалкеніл, (C1-C4)-алкокси, трифторметил, трифторметокси, (C1-C4)-алкілтіо, (C1-C5)-ацил, аміно, моно-(C1-C4)-алкіламіно, ді(C1-C4)-алкіламіно та (C1-C4)-ациламіно, або 1 2 два залишки R та/або R , які приєднані до сусідніх атомів вуглецю відповідного фенільного кільця, разом утворюють групу формули -O-CH2-O-, -O-CHF-O- або -O-CF2-O-, n та o незалежно один від одного означають 0, 1, 2 або 3, 1 2 причому у випадку, якщо R або R зустрічаються кілька разів, їх значення можуть бути відповідно однаковими або різними, 3 R означає водень або (C1-C3)-алкіл, який може бути заміщений гідрокси або аміно, та 4 R означає водень або (C1-C3)-алкіл, а також їх солям, сольватам та сольватам солей. Найбільшу перевагу в рамках винаходу надають сполукам формули (I), в якій A означає O або NН, L означає (C3-C7)-алкандіїл, (C3-C7)-алкендіїл 1 2 або групу формули *-L -О-L , в якій 3 * означає місце приєднання до CHR -групи та 1 2 L та L незалежно один від одного означають (C1-C3)-алкандіїл, Z означає групу формули в якій # означає місце приєднання до групи L та 7 R означає водень, метил або етил, 16 1 2 R та R незалежно один від одного означають замісник, вибраний із ряду, що включає фтор, хлор, ціано, (C1-C5)-алкіл, (C2-C5)-алкеніл, (C3-C6)циклоалкіл, (C4-C6)-циклоалкеніл, (C1-C4)-алкокси, трифторметил, трифторметокси, (C1-C4)-алкілтіо, (C1-C5)-ацил, аміно, моно-(C1-C4)-алкіламіно, ді(C1-C4)-алкіламіно та (C1-C4)-ациламіно, або 1 2 два залишки R та/або R , які приєднані до сусідніх атомів вуглецю відповідного фенільного кільця, разом утворюють групу формули -O-CH2-O-, -O-CHF-O- або -O-CF2-O-, n та o незалежно один від одного означають 0, 1 або 2, 1 2 причому у випадку, якщо R або R зустрічаються кілька разів, їх значення можуть бути відповідно однаковими або різними, 3 R означає водень, метил або етил та 4 R означає водень, а також їх солям, сольватам та сольватам солей. Найбільшу перевагу в рамках винаходу надають також сполукам формули (I), в якій A означає O або NН, 1 2 L означає групу формули *-L -N-(CH3)-L , в якій 3 * означає місце приєднання до CHR -групи та 1 2 L та L незалежно один від одного означають (C1-C3)-алкандіїл, Z означає групу формули в якій # означає місце приєднання до групи L та 7 R означає водень, метил або етил, 1 2 R та R незалежно один від одного означають замісник, вибраний із ряду, що включає фтор, хлор, ціано, (C1-C5)-алкіл, (C2-C5)-алкеніл, (C3-C6)циклоалкіл, (C4-C6)-циклоалкеніл, (C1-C4)-алкокси, трифторметил, трифторметокси, (C1-C4)-алкілтіо, (C1-C5)-ацил, аміно, моно-(C1-C4)-алкіламіно, ді(C1-C4)-алкіламіно та (C1-C4)-ациламіно, або 1 2 два залишки R та/або R , які приєднані до сусідніх атомів вуглецю відповідного фенільного кільця, разом утворюють групу формули -O-CH2-O-, -O-CHF-O- або -O-CF2-O-, n та o незалежно один від одного означають 0, 1 або 2, 1 2 причому у випадку, якщо R або R зустрічаються кілька разів, їх значення можуть бути відповідно однаковими або різними, 3 R означає водень, метил або етил та 4 R означає водень, а також їх солям, сольватам та сольватам солей. Передусім перевагу в рамках даного винаходу надають сполукам формули (I), в якій A означає O або NH, 17 L означає (C3-C7)-алкандіїл, (C3-C7)-алкендіїл 1 2 або групу формули *-L -Q-L , в якій 3 * означає місце приєднання до CHR -групи, 1 2 L та L незалежно один від одного означають (C1-C3)-алкандіїл та Q означає О або N(CH3), Z означає групу формули в якій # означає місце приєднання до групи L та 7 R означає водень, метил або етил, 1 R означає замісник, вибраний із ряду, що включає фтор, хлор, метил, етил, вініл, трифторметил або метокси, 2 R означає замісник, вибраний із ряду, що включає фтор, хлор, ціано, метил, етил, н-пропіл, вініл, трифторметил, метокси, стокси, трифторметокси, метилтіо, етилтіо, аміно, метиламіно та етиламіно, n та o незалежно один від одного означають 0, 1 або 2, 1 2 причому у випадку, якщо R або R зустрічаються два рази, їх значення можуть бути відповідно однаковими або різними, 3 R означає водень, метил або етил та 4 R означає водень, а також їх солям, сольватам та сольватам солей. Особливе значення в рамках даного винаходу мають сполуки формули (I), в якій A означає O, а також їх солі, сольвати та сольвати солей. Особливе значення в рамках даного винаходу мають також сполуки формули (I), в якій 1 2 L означає групу формули *-L -Q-L , де 3 * означає місце приєднання до групи CHR , 1 L означає (C1-C5)-алкандіїл, 2 L означає зв‗язок або (C1-C3)-алкандіїл, який може бути один або два рази заміщений фтором, та 6 Q означає O або N-R , де 6 R означає водень, (C1-C6)-алкіл або (C3-C7)циклоалкіл, а також їх солі, сольвати та сольвати солей. Окремі значення залишків, вказані для відповідних комбінацій або переважних комбінацій залишків, незалежно від цих відповідних комбінацій можуть бути в будь-якому порядку замінені значеннями залишків інших комбінацій. 94080 18 Найбільш переважними є комбінації двох або більше вказаних вище переважних значень. Іншим предметом даного винаходу є спосіб одержання відповідних винаходу сполук формули (I), який відрізняється тим, що [A] сполуки формули (ІІ) 1 2 4 в якій R , R , R , n та o мають відповідно вказані вище значення та 1 X означає групу, що відходить, таку як, наприклад, галоген, зокрема хлор, в присутності основи, в разі потреби, в інертному розчиннику піддають взаємодії зі сполукою формули (IІІ) 3 в якій A, L та R мають відповідно вказані вище значення та 1 Z означає ціано або групу формули -[C(O)]y7A COOR , в якій y означає 0 або 1 та 7A R означає (C1-С4)-алкіл, до одержання сполук формули (IV) 1 1 2 3 4 в якій A, L, Z , R , R , R , R , n та o мають відповідно вказані вище значення, або [B] сполуки формули (V-l) 1 4 1 в якій R , R , X та n мають відповідно вказані вище значення, в присутності основи, в разі потреби, в інертному розчиннику піддають взаємодії зі сполукою формули (ІІІ) до одержання сполук формули (VI-1) 19 1 1 94080 3 4 в якій A, L, Z , R , R , R та n мають відповідно вказані вище значення, після чого в інертному розчиннику бромують, наприклад, N-бромсукцинімідом до одержання сполук формули (VII-1) 20 які після цього в інертному розчиннику в присутності основи та придатного паладієвого каталізатора піддають реакції сполучення з фенілборною кислотою формули (VІІІ-2) 1 1 1 3 4 в якій A, L, Z , R , R , R та n мають відповідно вказані вище значення, які після цього в інертному розчиннику в присутності основи та придатного паладієвого каталізатора піддають реакції сполучення з фенілборною кислотою формули (VІІІ-1) в якій R та n мають відповідно вказані вище значення, до одержання сполук формули (IV), та відповідно одержані сполуки формули (IV) 1 шляхом гідролізу естерної групи або ціаногрупи Z перетворюють на карбонові кислоти формули (I-A) 1 2 в якій R та o мають відповідно вказані вище значення, до одержання сполук формули (ІV) або [C] сполуки формули (V-2) 2 4 1 в якій R , R , X та o мають відповідно вказані вище значення, в присутності основи, в разі потреби, в інертному розчиннику піддають взаємодії зі сполукою формули (ІІI) до одержання сполук формули (VI-2) 1 2 3 4 1 2 3 4 в якій A, L, Z , R , R , R та o мають відповідно вказані вище значення, після чого в інертному розчиннику бромують, наприклад, N-бромсукцинімідом до одержання сполук формули (VІІ-2) в якій A, L, Z , R , R , R та o мають відповідно вказані вище значення, 2 3 4 в якій A, L, R , R , R , R , n, o та y мають відповідно вказані вище значення, які, в разі потреби, піддають взаємодії з відповідними (i) розчинниками та/або (ii) основами або кислотами до одержання їх сольватів, солей та/або сольватів солей. Інертними розчинниками для здіснення стадій (II) + (III) (IV), (V-1) + (ІІІ) (VI-1) та (V-2) + (ІІІ) (VI-2) є, наприклад, етери, такі як діетиловий етер, метил-трет-бутиловий етер, діоксан, тетрагідрофуран, глікольдиметиловий етер або діетиленгліколь-диметиловий етер, вуглеводні, такі як бензол, толуол, ксилол, гексан, циклогексан або фракції нафти, галоген вуглеводні, такі як дихлорметан, трихлорметан, тетрахлорметан, 1,2дихлоретан, трихлоретан, тетрахлоретан, трихлоретилен, хлорбензол або хлортолуол, або інші розчинники, такі як диметилформамід (ДМФА), диметилсульфоксид (ДМСО), N,N‘диметилпропіленкарбамід (ДМПК), Nметилпіролідон (NMП) або ацетонітрил. Крім того можна використовувати також суміші зазначених розчинників. Перевагу надають тетрагідрофурану, диметилформаміду, диметилсульфоксиду та їх сумішам. Однак, в разі потреби, стадії (II) + (ІІI) (IV), (V-l) + (ІІl) (VI-1) та (V-2) + (ІІl) (VI-2) можна здійснювати також без використання розчинника. Як основи для здійснення стадій (II) + (ІІI) (IV), (V-l) + (ІІl) (VI-1) та (V-2) + (ІІl) (VI-2) придатними є звичайні неорганічні або органічні основи. До них належать переважно гідроксиди лужних металів, такі як, наприклад, гідроксид літію, натрію або калію, карбонати лужних або лужноземельних металів, такі як карбонат літію, натрію, калію, кальцію або цезію, алкоголяти лужних металів, такі як трет-бутилат натрію або калію, гідриди лужних металів, такі як гідрид натрію або калію, аміди, такі як біс(триметилсиліл)амід літію або калію або діізопропіламід літію, металорганічні сполуки, такі як бутиллітій або феніллітій, або органічні аміни, такі як триетиламін, N-метилморфолін, N 21 метилпіперидин, N,N-діізопропілетиламін або піридин. У випадку взаємодії з похідними спирту [A в (ІІl) = O] доцільними є також фосфаценові основи (так звані "Основи Швезінгенра"), такі як, наприклад, P2-t-Bu або P4-t-Bu [див., наприклад, R. Schwesinger, H. Schlemper, Angew. Chem. Int. Ed. Engl. 26, 1167 (1987); T. Pietzonka, D. Seebach, Chem. Ber. 124, 1837 (1991)]. При здійсненні взаємодії з амінопохідними [A в (ІІI) = N] як основу використовують переважно третинні аміни, такі як, наприклад, N,Nдіізопропілетиламін. В разі потреби, цю взаємодію - при використанні надлишкової кількості амінокомпоненту (ІІІ) - можна здійснювати також без додавання допоміжної основи. У випадку реакції з похідними спирту [A в (ІІl) = O] перевагу надають карбонату калію або цезію або фосфаценовим основам P2-t-Bu та P4-t-Bu. Стадії (II) + (ІІl) (IV), (V-l) + (ІІl) (VI-1) та (V2) + (ІІl) (VI-2), в разі потреби, можна здійснювати з додаванням краун-етеру. Відповідно до одного з варіантів здійснення способу реакції (II) + (ІІl) (ІV), (V-l) + (ІІl) (VI-1) та (V-2) + (III) (VI-2) можуть бути здійснені також в двофазній суміші, що складається із водного розчину гідроксиду лужного металу як основи та одного із вказаних вище вуглеводнів або галогенвуглеводнів як іншого розчинника, з використанням каталізатора переносу фаз, такого як гідросульфат тетрабутиламонію або бромід тетрабутиламонію. При взаємодії з амінопохідними [A в (ІІl) = N] стадії (II) + (ІІl) (ІV), (V-l) + (ІІl) (VI-1) та (V-2) + (III) (VI-2) загалом здійснюють при температурі від +50 до +150 °C. При взаємодії з похідними спирту [A в (ІІl) = O] реакції загалом здійснюють при температурі від -20 до +120 °C, переважно від 0 до +60°C. Бромування на стадіях (VI-1) (VII-1) або відповідно (VI-2) (VІІ-2) здійснюють переважно в галогенвуглеводні як розчиннику, зокрема в тетрахлорметані, при температурі від +50 до +100 °C. Як агенти бромування придатними є елементарний бром, а також зокрема N-бромсукцинімід (NBS), в разі потреби, при додаванні ,'азобіс(ізобутиронітрилу) (АІБН) як інгібітора. Інертними розчинниками для здійснення стадій (VII-1) + (VIII-1) (IV) та (VII-2) + (VIІІ-2) (IV) є, наприклад, спирти, такі як метанол, етанол, нпропанол, ізопропанол, н-бутанол або третбутанол, етери, такі як діетиловий етер, діоксан, тетрагідрофуран, глікольдиметиловий етер або діетиленглікольдиметиловий етер, вуглеводні, такі як бензол, ксилол, толуол, гексан, циклогексан або фракції нафти, або інші розчинники, такі як диметилформамід, диметилсульфоксид, N,N'диметилпропіленкарбамід (ДМПК), Nметилпіролідон (NМП), піридин, ацетонітрил або вода. Крім того можливо також використовувати суміші зазначених розчинників. Перевагу надають суміші диметилсульфоксиду та води. Як основи для здійснення стадій (VII-1) + (VІІI1) (IV) та (VII-2) + (VІІI-2) (IV) придатними є 94080 22 звичайні неорганічні основи. До них належать зокрема гідроксиди лужних металів, такі як, наприклад, гідроксид літію, натрію або калію, гідрокарбонати лужних металів, такі як гідрокарбонат натрію або калію, карбонати лужних або лужноземельних металів, такі як карбонат літію, натрію, калію, кальцію або цезію, гідрофосфати лужних металів, такі як гідрофосфат динатрію або дикалію. Перевагу надають карбонату натрію або калію. Як паладієвий каталізатор для здійснення стадій (VII-1) + (VІІl-1) (ІV) та (VII-2) + (VІІІ-2) (IV) ["сполучення Сузукі"] використовують, наприклад, паладій на активованому вугіллі, ацетат паладію(ІІ), тетракіс(трифенілфосфін)паладій(0), хлорид біс-(трифенілфосфін)паладію(ІІ), хлорид біс(ацетонітрил)паладію(II) та комплекс [1,1'біс(дифенілфосфіно)фероцен]дихлорпаладій(ІІ)дихлорметан [див., наприклад, J. Hassan та ін., Chem. Rev. 102, 1359-1469 (2002)]. Реакції (VII-1) + (VІІl-1) (ІV) та (VII-2) + (VІІІ2) (IV) здійснюють загалом при температурі від +20 до +150°C, переважно від +50 до +100°C. Гідроліз естерної або відповідно нітрильної 1 групи Z на стадії (IV) (I-A) здійснюють звичайними методами шляхом обробки естерів або нітрилів кислотами або основами в інертних розчинниках, причому в останньому випадку утворені солі шляхом обробки кислотою перетворюють на вільні карбонові кислоти. У випадку третбутилових естерів розщеплення естеру відбувається переважно за допомогою кислот. Як інертні розчинники для таких реакцій придатними є вода або зазвичай використовувані для розщеплення естерів органічні розчинники. Сюди належать переважно спирти, такі як метанол, етанол, н-пропанол, ізопропанол, н-бутанол або третбутанол, або етери, такі як діетиловий етер, тетрагідрофуран, діоксан або глікольдиметиловий етер, або інші розчинники, такі як ацетон, дихлорметан, диметилформамід або диметилсульфоксид. Крім того можливим є використання сумішей зазначених розчинників. У випадку основного гідролізу естерів перевагу надають сумішам води з діоксаном, тетрагідрофураном, метанолом та/або етанолом, у випадку гідролізу нітрилів перевагу надають воді та/або н-пропанолу. У випадку взаємодії з трифтороцтовою кислотою переважно використовують дихлорметан, а у випадку взаємодії з хлороводнем перевагу надають тетрагідрофурану, діетиловому етеру, діоксану або воді. Як основи використовують звичайні неорганічні основи. Сюди належать переважно гідроксиди лужних або лужноземельних металів, такі як, наприклад, гідроксид натрію, літію, калію або барію, або карбонати лужних або лужноземельних металів, такі як карбонат натрію, калію або кальцію. Особливу перевагу надають гідроксиду натрію або літію. Як кислоти придатними для розщеплення естерів є загалом сірчана кислота, хлороводень/соляна кислота, бромоводень/бромводнева кислота, фосфорна, оцтова, трифтороцтова толуолсульфонова, метансульфонова або трифторметансульфонова кислота або їх суміші, в разі пот 23 реби, при додаванні води. Перевагу надають хлороводню або трифтороцтовій кислоті у випадку трет-бутилового естеру та соляній кислоті у випадку метилового естеру. Розщеплення естерів здійснюють загалом при температурі від 0 до +100°C, переважно від 0 до +50°C. Гідроліз нітрилів здійснюють загалом при температурі від +50 до +150°C, переважно від +80 до +120°C. Зазначені реакції можна здійснювати при нормальному, підвищеному або пониженому тиску (наприклад, від 0,5 до 5 бар). Загалом працюють при нормальному тиску. Відповідні винаходу сполуки формули (I), в якій Z означає групу формули можуть бути одержані взаємодією сполук формули 1 (IV), в якій Z означає ціано, в інертному розчиннику з азидом лужного металу в присутності хлориду амонію або з триметилсилілазидом, в разі потреби, в присутності каталізатора. Інертними розчинниками, придатними для такої взаємодії, є, наприклад, етери, такі як діетиловий етер, діоксан, тетрагідрофуран, глікольдиметиловий етер або діетиленглікольдиметиловий етер, вуглеводні, такі як бензол, толуол, ксилол, гексан, циклогексан або фракції нафти, або інші розчинники, такі як диметилсульфоксид, диметилформамід, N,N-диметилпропіленкарбамід (ДМПК) або N-метилпіролідон (NМП). Крім того можливо також використовувати суміші зазначених розчинників. Перевагу надають толуолу. Як азидний реагент придатним є зокрема азид натрію в присутності хлориду амонію або триметилсилілазид. Останню реакцію можна здійснювати переважно в присутності каталізатора. Придатними для цього є зокрема такі сполуки, як оксид ди-н-бутилолова, триметилалюміній або бромід цинку. Перевагу надають триметилсилілазиду у комбінації з оксидом ди-н-бутилолова. Реакцію здійснюють загалом при температурі від +50 до +150°C, переважно від +60 до +110°C. Реакцію можна здійснювати при нормальному, підвищеному або пониженому тиску (наприклад, від 0,5 до 5 бар). Загалом працюють при нормальному тиску. Відповідні винаходу сполуки формули (I), в якій Z означає групу формули 94080 24 1 2 3 4 1 2 3 в якій A, L, R , R , R , R , n та o мають відповідно вказані вище значення, та їх взаємодією в інертному розчиннику з фосгеном або еквівалентом фосгену, таким як, наприклад, N,N'-карбонілдіімідазол. Як інертні розчинники на першій стадії цієї реакції використовують зокрема спирти, такі як метанол, етанол, н-пропанол, ізопропанол, н-бутанол або трет-бутанол, або етери, такі як діетиловий етер, діоксан, тетрагідрофуран, глікольдиметиловий етер або діетиленглікольдиметиловий етер. Можливими є також суміші цих розчинників. Перевагу надають суміші метанолу та тетрагідрофурану. Другу стадію реакції здійснюють переважно в етері, зокрема в тетрагідрофурані. Взаємодію проводять загалом при температурі від 0 до +70°C та при нормальному тиску. Сполуки формули (I) згідно з винаходом, в якій 1 2 1 2 L означає групу формули *-L -Q-L , де L , L та Q мають вказані вище значення, можуть бути альтернативно одержані шляхом перетворення сполук формули (X) 1 4 в якій A, L , Q, R , R , R , R , n та o мають відповідно вказані вище значення, в присутності основи, в разі потреби, в інертному розчиннику за допомогою сполуки формули (XI) 2 1 X — L—Z (XI), 2 1 в якій L та Z мають вказані вище значення та 2 X означає групу, що відходить, наприклад, галоген, мезилат або тозилат, 2 або у випадку, якщо L означає -CH2CH2-, за допомогою сполуки формули (XІІ) 1 в якій Z має вказані вище значення, на сполуки формули (IV-A) можуть бути одержані перетворенням сполук фо1 рмули (IV), в якій Z означає метокси- або етоксикарбоніл, у інертному розчиннику за допомогою гідразину у сполуки формули (ІХ) 1 2 1 1 2 3 4 в якій A, L , L , Q, Z , R , R , R , R , n та o мають відповідно вказані вище значення, 25 94080 та ці сполуки потім перетворюють відповідно описаними вище способами. Сполуки формули (X) можуть бути одержані, виходячи зі сполуки формули (II), (V-l) або (V-2) в присутності основного каталізатора реакцією зі сполукою формули (XIII) 1 3 в якій A, L , Q та R мають відповідно вказані вище значення та T означає водень або тимчасову O- або Nзахисну групу, а також подальшим перетворенням аналогічно описаним вище варіантам [B] або [C] способу, причому у випадку послідовності реакцій (V-l) або 26 (V-2) (IV-A) послідовність окремих стадій, в разі потреби, також можна варіювати (див. також наведені нижче схеми реакцій 2-8). Для стадій (X) + (XI) або (XІІ) (IV-A) та (II) + (XIІІ) (X) аналогічно використовують описані для реакцій (Іl) + (ІІl) (IV), (V-l) + (ІІI) (VI-1) або (V2) + (ІІІ) (VI-2) параметри, такі як розчинники, основи та температури реакцій. Сполуки формул (II), (ІІl), (V-l), (VІІl-1), (V-2), (VІІl-2), (XI), (XІІ) та (XІІІ) є наявними у продажу, відомими з літературних джерел або можуть бути одержані відповідно до описаних у літературі способів (див., наприклад, WO 03/018589; див. також схему реакції 1). Наведені нижче схеми синтезу унаочнюють процес одержання сполук згідно з винаходом: Схема 1 27 94080 Схема 2 Схема 3 28 29 94080 Схема 4 Схема 5 30 31 94080 Схема 6 Схема 7 Схема 8 32 33 Сполуки згідно з винаходом проявляють цінні фармакологічні властивості та можуть бути застосовані для запобігання та лікування захворювань у людей і тварин. Вони є придатними зокрема для профілактики та/або лікування серцево-судинних захворювань, таких як, наприклад, стабільна та нестабільна стенокардія, захворювань периферійних та серцевих судин, артеріальної гіпертонії та серцевої недостатності, легеневої гіпертонії, периферійних порушень місцевого кровообігу, для профілактики та/або лікування тромбоемболічних захворювань та ішемій, таких як інфаркт міокарда, крововилив у мозок, транзиторних ішемічних нападів, а також субарахноїдальних крововиливів, та для запобігання рестенозам, таким як, наприклад, після тромболітичної терапії, перкутанної транслюминальної ангіопластики (PTA), коронарної ангіопластики (PTCA) та шунтування. Крім того сполуки згідно з винаходом можуть бути застосовані для лікування артеріосклерозу, гепатиту, астматичних захворювань, хронічнообструктивних захворювань дихальних шляхів (COPD), фіброзних легеневих захворювань, таких як ідіопатичний легеневий фіброз (IPF) та ARDS, запальних судинних захворювань, таких як склеродермія та еритематоз, ниркової недостатності, артриту та остеопорозу. Сполуки згідно з винаходом також можуть бути застосовані для профілактики та/або лікування ракових захворювань, зокрема метастазуючих пухлин. Крім того сполуки згідно з винаходом можуть бути застосовані як добавки до середовища консервування трансплантату, такого як, наприклад, нирки, легені, серце або клітини острівкового апарату підшлункової залози. Іншим предметом даного винаходу є застосування сполук згідно з винаходом для лікування та/або запобігання захворюванням, зокрема зазначеним вище захворюванням. Ще одним предметом даного винаходу є застосування сполук згідно з винаходом для одержання лікарського засобу для лікування та/або запобігання захворюванням, зокрема зазначеним вище захворюванням. Ще одним предметом даного винаходу є спосіб лікування та/або запобігання захворюванням, зокрема зазначеним вище захворюванням шляхом застосування ефективної кількості щонайменше однієї зі сполук згідно з винаходом. Сполуки згідно з винаходом можуть бути застосовані окремо або, в разі потреби, у комбінації з іншими активними речовинами. Ще одним предметом даного винаходу є лікарські засоби, що містять щонайменше одну зі сполук згідно з винаходом та одну або кілька інших активних речовин, зокрема для лікування та/або запобігання зазначеним вище захворюванням. Нижче наведені приклади придатних та переважних компонентів для комбінування: - органічні нітрати та NO-донори, такі як, наприклад, нітропрусид натрію, нітрогліцерин, ізосо 94080 34 рбідмононітрат, ізосорбіддинітрат, молсидомін або SIN-1, а також інгалятивний NO; - сполуки, що інгібіють розпад циклічного гуанозинмонофосфату (cGMP) та/або циклічного аденозинмонофосфату (cAMP), такі як, наприклад, інгібітори фосфодіестераз (PDE) 1, 2, 3, 4 та/або 5, зокрема інгібітори PDE 5, такі як силденафіл, варденафіл та тадалафіл; - NO-незалежні, однак Häm-залежні стимулятори гуанілатциклази, зокрема описані в WO 00/06568, WO 00/06569, WO 02/42301 та WO 03/095451 сполуки; - NO- та Häm-незалежні активатори гуанілатциклази, зокрема описані в WO 01/19355, WO 01/19776, WO 01/19778, WO 01/19780, WO 02/070462 та WO 02/070510 сполуки; - сполуки, що інгібують нейтрофільну еластазу людини, такі як, наприклад, сівелестат або DX-890 (Reltran); - сполуки, що інгібують каскад трансдукції сигналу, такі як, наприклад, інгібітори тиросинкінази та/або серину/треонінкінази, зокрема іматиніб, гефітиніб, ерлотиніб, сорафеніб та сунітиніб; - сполуки, що впливають на енергообмін серця, такі як, наприклад, переважно етомоксир, дихлорацетат, ранолазин або триметазидин; - антитромботичні засоби, такі як, наприклад, переважно з групи інгібітори накопичення тромбоцитів, антикоагулянти або профібринодітичні сполуки; - активні речовини, що знижують тиск, такі як, наприклад, переважно з групи антагоністів кальцію, антагоністів ангіотензину AD, інгібіторів ACE, антагоністів ендотеліну, інгібіторів реніну, блокаторів альфа-рецепторів, блокаторів бетарецепторів, антагоністів мінералокортикоїдного рецептора, інгібіторів Ро-кінази, а також діуретиків; та/або - активні речовини, що змінюють обмін речовин, такі як, наприклад, переважно з групи агоністів тифоїдних рецептора, інгібіторів синтезу холестерину, таких як переважно інгібітори HMG-CoAредуктази або скваленсинтази, ACAT-інгібіторів, СЕРТ-інгібіторів, MTP-інгібіторів, PPAR-альфа-, PPAR-гама- та/або PPAR-дельта-агоністів, інгібіторів абсорбції холестерину, інгібіторів ліпази, полімерних абсорберів жовчної кислоти, інгібіторів реабсорбції жовчної кислоти та антагоністів ліпопротеїдну(нів). Під антитромботичними засобами розуміють переважно сполук з групи, що включає інгібітори накопичення тромбоцитів, антикоагулянти або профібронолітичні речовини. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з інгібітором накопичення тромбоцитів, таким як, наприклад, переважно аспірин, клопідогрель, тиклопідин або дипіридамол. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з інгібітором тромбіну, таким як, наприклад, переважно ксимелагатран, мелагатран, бівалірудин або клексан. 35 Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з GPIIb/IIla-агоністами, такими як, наприклад, переважно тирофібан або абциксимаб. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з інгібітором фактору Xa, таким як, наприклад, переважно BAY 59-7939, DU-176b, фідексабан, разаксабан, фондапаринукс, ідрапаринукс, PMD-3112, YM-150, KFA-1982, EMD503982, MCM-17, MLN-1021, DX 9065a, DPC 906, JTV 803, SSR-126512 або SSR-128428. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з гепарином або похідною (LMW)-гепарину (з низькою молекулярною вагою). Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з антагоністами вітаміну К, такими як, наприклад, переважно кумарин. Під засобами, що знижують тиск, переважно розуміють сполуки з групи, що включає антагоністи кальцію, антагоністи андіотензину AІІ, ACEінгібітори, антагоністи ендотеліну, інгібітори реніну, блокатори альфа-рецепторів, блокатори бетарецепторів, антагоністи мінералокортикоїдного рецептора, інгібітори Ро-кінази, а також діуретики. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з антагоністом кальцію, таким як, наприклад, переважно ніфедипін, амлодипін, верапаміл або дилтіазем. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з блокатором альфа-1-рецепторів, таким як, наприклад, переважно празосин. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з блокатором бета-рецепторів, таким як, наприклад, переважно пропранолол, атенолол, тимолол, піндолол, алпренолол, окспренолол, пенбутолол, бупранолол, метипранолол, надолол, мепіндолол, каразалол, соталол, метопролол, бетаксолол, целіпролол, бісопролол, картеолол, есмолол, лабеталол, карведілол, адапролол, ландіолол, небіволол, епанолол або буциндолол. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з антагоністами рецептору ангіотензину II, такими як, наприклад, переважно лазортан, кандезартан, валзартан, телмізартан або ембузартан. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінацію з ACE-інгібітором, таким як, наприклад, переважно, еналаприл, каптоприл, лізиноприл, раміприл, делаприл, фозиноприл, хіноприл, периндоприл або трандоприл. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінацію з антагоністом ендотеліну, таким як, наприклад, переважно бозентан, дарузентан, амбрізентан або ситаксзентан. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбі 94080 36 націю з інгібітором реніну, таким як, наприклад, переважно аліскірен, SPP-600 або SPP-800. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінацію з антагоністом мінералокортикоїдного рецептора, таким як, наприклад, переважно спіронолактон або еплеренон. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінацію з інгібітором Ро-кінази, таким як, наприклад, переважно фазудил, Y-27632, SLx-2119, BF-66851, BF-66852, BF-66853, KI-23095 або BA-1049. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з діуретиком, таким як, наприклад, переважно фуроземід. Під засобами, що впливають на обмін речовин розуміють, наприклад, переважно сполуки з групи, що включає CETP-інгібітори, агоністи тиреоїдних рецепторів, інгібітори синтезу холестерину, такі як інгібітори HMG-CoA-редуктази або скваленсинтази, ACAT-інгібітори, MTP-інгібітори, PPAR-альфа-, PPAR-гама- та/або PPAR-дельта-агоністи, інгібітори абсорбції холестерину, полімерні абсорбери жовчної кислоти, інгібітори реабсорбції жовчної кислоти, інгібітори ліпази, а також антагоністи ліпопротеїнів. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінацію з CETP-інгібітором, таким як, наприклад, переважно торцетрапіб (CP-529 414), JJT-705 або CETP-вакцина (Avant). Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінацію з агоністом тиреоїдного рецептора, таким як, наприклад, переважно D-тироксин, 3,5,3'трийодотиронін (T3), CGS 23425 або акситиром (CGS 26214). Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінацію з інгібітором HMG-CoA-редуктази з класу статинів, таких як, наприклад, переважно ловастатин, симвастатин, правастатин, флувастатин, аторвастатин, розувастатин, церивастатин або пітавастатин. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з інгібітором скваленсинтази, таким як, наприклад, переважно BMS-188494 або TAK-475. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з ACAT-інгібітором, таким як, наприклад, переважно авасиміб, мелінамід, пактиміб, ефлуциміб або SMP-797. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з MTP-інгібітором, таким як, наприклад, переважно імплітапід, BMS-201038, R-103757 або JTT130. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з PPAR-гама-агоністами, такими як, наприклад, переважно піоглітазон або розиглітазон. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбі 37 нації з PPAR-дельта-агоністами, такими як, наприклад, переважно GW 501516 або BAY 68-5042. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з інгібіторами абсорбції холестерину, такими як, наприклад, переважно езетиміб, тиквезид або памаквезид. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з інгібітором ліпази, таким як, наприклад, переважно орлістат. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з полімерними абсорберами жовчної кислоти, такими як, наприклад, переважно холестирамін, колестипол, колесолвам, холестагель або колестимід. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з інгібіторами реабсорбції жовчної кислоти, такими як, наприклад, переважно ASBT (= IBAT)інгібітори, наприклад, AZD-7806, S-8921, AK-105, BARI-1741, SC-435 або SC-635. Згідно з переважною формою виконання винаходу сполуки згідно з винаходом вводять у комбінації з антагоністами ліпопротеїнів, такими як, наприклад, переважно гемкабен кальцій (CI-1027) або нікотинова кислота. Ще одним предметом даного винаходу є лікарські засоби, що містять щонайменше одну зі сполук згідно з винаходом, як правило, у комбінації з однією або кількома інертними, нетоксичними, фармацевтично придатними допоміжними речовинами, а також їх застосування для зазначених вище цілей. Сполуки згідно з винаходом можуть проявляти систематичну та/або локальну дію. Для досягнення цієї мети їх наносять відповідним чином, наприклад, перорально, парентерально, легеневим способом, назально, під язик, на язик, за щоку, ректально, дермально, трансдермально, кон‘юктивально, у вухо або у вигляді імплантату або стенту. Для таких видів застосовання згідно сполуки з винаходом можуть бути використані у відповідних формах. Для перорального застосування згідно з рівнем техніки придатними є функціонуючі лікарські форми, що характеризуються швидким та/або модифікованим вивільненням сполук згідно з винаходом та до складу яких ці сполуки входять у кристалічній та/або аморфній та/або розчиненій формі, такі як, наприклад, таблетки (не покриті або покриті оболонками, наприклад, оболонками, стійкими до шлункового соку, або оболонками, які повільно розчиняються або не розчиняються взагалі, що контролюють вивільнення сполуки згідно з винаходом), таблетки або плівки/облатки, плівки/ліофілізати, капсули, які швидко розчиняються у ротовій порожнині (наприклад, тверді або м‘які желатинові капсули), драже, грануляти, гранули, порошки, емульсії, суспензії, аерозолі або розчини. Парентеральне застосування може відбуватися при виключенні стадії всмоктування (наприклад, 94080 38 внутрішньовенно, внутрішньоартеріально, внутрішньосерцево, інтраспінально або інтралюмбально) або за умови включення стадії всмоктування (наприклад, внутрішньом‘язово, підшкірно, у шкіру, перкутанно або внутрішньобрюшинно). Придатними для парентерального застосування є такі форми, як ін‘єкційні та інфузійні композиції у вигляді розчинів, суспензій, емульсій, ліофілізатів або стерильних порошків. Для інших видів застосування придатними є, наприклад, лікарські засоби для інгаляції (а саме порошкові інгалятори, розпилювачі), краплі, розчини або спреї в ніс; таблетки на язик, під язик або за щоку, плівки/облатки або капсули, супозиторії, композиції для вух або очей, вагінальні капсули, водні суспензії (лосьйони, мікстури «бовтушки»), ліпофільні суспензії, мазі, креми, трансдермальні терапевтичні системи (наприклад, пластирі), молочко, пасти, піни, присипки, імплантати або стенти. Перевагу надають пероральному або парентеральному застосуванню, зокрема пероральному застосуванню. Сполуки згідно з винаходом можуть бути переведені у згадані форми застосування. Це можна здійснювати відомими способами шляхом змішування з інертними, нетоксичними, фармацевтично придатними допоміжними речовинами. До таких допоміжних речовин належать зокрема носії (наприклад, мікрокристалічна целюлоза, лактоза, маніт), розчинники (наприклад, рідкі поліетиленгліколі), емульгатори та диспергатори або змочувальні агенти (наприклад, додецилсульфат натрію, олеат поліоксисорбіту), зв‘язувальні агенти (наприклад, полівінілпіролідон), синтетичні та природні полімери (наприклад, альбумін), стабілізатори (наприклад, антиоксиданти, такі як аскорбінова кислота), барвники (наприклад, неорганічні пігменти, такі як оксиди заліза) та речовини, що коригують смак та/або запах. Загалом виявили, що при парентеральному застосуванні для досягнення необхідних результатів кількість активної речовини переважно становить приблизно від 0,001 до 1 мг/кг ваги тіла, переважно від приблизно 0,01 до 5 мг/кг ваги тіла. При пероральному застосуванні дозування становить приблизно від 0,01 до 100 мг/кг, переважно приблизно від 0,01 до 20 мг/кг та особливо переважно від 0,1 до 10 мг/кг ваги тіла. Крім того, в разі потреби, можна відступати від вказаних кількостей залежно від ваги тіла, форми застосування, індивідуальної реакції на активну речовину, виду композиції та моменту або інтервалу її застосування. Так, наприклад, у деяких випадках достатнім може виявитися застосування меншої кількості, ніж вказана вище мінімальна гранична кількість, а у інших випадках необхідно перевищувати максимальну граничну кількість. У випадку застосування більших кількостей варто розподілити цю кількість на кілька окремих доз для застосування протягом дня. Наведені нижче приклади виконання пояснюють винахід та в жодному разі не обмежують обсяг його охорони. 39 Показники в % у дослідженнях та прикладах, якщо не зазначено нічого іншого, означають мас. %; частини - масові частини. Співвідношення розчинників, коефіцієнти розчинення та показники концентрації розчинів рідина/рідина стосуються відповідно об‗єму. A. Приклади Скорочення: абс. - абсолютний, Ac - ацетил, Ac2O - ангідрид оцтової кислоти, Boc трет-бутоксикарбоніл, Bu - бутил, к - концентрація, ТШХ - тонкошарова хроматографія, ПХІ - пряма хімічна іонізація (при МС), ДІБАГ - діізобутилалюміній гідрид, ДІЕА - діізопропілетиламін ("основа Хюніга"), ДМАП - 4-N,N-диметиламінопіридин, ДМЕ - 1,2-диметоксиетан, ДМФА - N,N-диметилформамід, ДМСО - диметилсульфоксид, від теор. - від теоретичного (на виході), ee - енантіомерний надлишок, EI - іонізація електронним ударом (при МС), ESI - електророзпилювальна іонізація (при МС), Et - етил, Т.пл. - температура плавлення, ГХ - газова хроматографія, насич. - насичений, год. - година(и), ВЕРХ - рідинна хроматографія високого тиску, конц. - концентрований, РХ/МС - рідинна хроматографія при масспектроскопії, Me - метил, хв. - хвилина(и), Ms - метансульфоніл (мезил), МС - мас-спектроскопія, NBS - N-бромсукцинімід, ЯМР - ядерно-магнітний резонанс, Pd/C - паладій на активованому вугіллі, рац. - рацемічний, ОФ - обернена фаза (при ВЕРХ), КТ - кімнатна температура, Чу - час утримування (при ВЕРХ), ТФА - трифтороцтова кислота, ТГФ - тетрагідрофуран Методи РХ-МС та ВЕРХ та ГХ: Метод 1 (ВЕРХ): Прилад: HP 1100 з діодно-матричним детектором; колонка: Kromasil 100 RP-18, 60 мм 2,1 мм, 3,5, мкм; елюент A: 5 мл HCІO4 (70 %-ний) / л води, елюент B: ацетонітрил; градієнт: 0 хв. 2 % B 0,5 хв. 2 % B 4,5 хв. 90 % B 6,5 хв. 90 % B 6,7 хв. 2 % B 7,5 хв. 2 % B; потік: 0,75 мл/хв.; температура: 30°C; УФ-детектування: 210 нм. Метод 2 (РХ-МС): Прилад МС: Micromass ZQ; тип приладу ВЕРХ: Waters Alliance 2795; колонка: Phenomenex Synergi 2 мкм Hydro-RP Mercury 20 мм 4 мм; елюент A: 1 л води + 0,5 мл 50%-ної мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50%-ної мурашиної кислоти; градієнт: 0,0 хв. 90 % A 2,5 хв. 30 % 94080 40 A 3,0 хв. 5 % A 4,5 хв. 5 % A; потік: 0,0 хв. 1 мл/хв. 2,5 хв./3,0 хв./4,5 хв. 2 мл/хв.; температура: 50°C; УФ-детектування: 210 нм. Метод 3 (РХ-МС): Прилад: Micromass Plattform LCZ з ВЕРХ Agilent 1100; колонка: Thermo Hypersil GOLD 3 мкм 20 мм 4 мм; елюент A: 1 л води + 0,5 мл 50%-ної мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50%-ної мурашиної кислоти; градієнт: 0,0 хв. 100 % A 0,2 хв. 100 % A 2,9 хв. 30 % A 3,1 хв. 10 % A 5,5 хв. 10 % A; температура: 50 °C; потік: 0,8 мл/хв.; УФ-детектування: 210 нм. Метод 4 (РХ-МС): Прилад МС: Micromass ZQ; тип приладу ВЕРХ: HP 1100; УФ діодно-матричний детектор; колонка: Phenomenex Synergi 2 мкм Hydro-RP Mercury 20 мм 4 мм; елюент A: 1 л води + 0,5 мл 50%-ної мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50%-ної мурашиної кислоти; градієнт: 0,0 хв. 90 % A 2,5 хв. 30 % A 3,0 хв. 5 % A 4,5 хв. 5 % A; потік: 0,0 хв. 1 мл/хв. 2,5 хв./3,0 хв./4,5 хв. 2 мл/хв.; температура: 50°C; УФдетектування: 210 нм. Метод 5 (РХ-МС): Прилад: Micromass Quattro LCZ з ВЕРХ Agilent 1100; колонка: Phenomenex Synergi 2 мкм HydroRP Mercury 20 мм 4 мм; елюент A: 1 л води + 0,5 мл 50%-ної мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50%-ної мурашиної кислоти; градієнт: 0,0 хв. 90 % A 2,5 хв. 30 % A 3,0 хв. 5 % A 4,5 хв. 5 % A; потік: 0,0 хв. 1 мл/хв. 2,5 хв./3,0 хв./4,5 хв. 2 мл/хв.; температура: 50°C; УФ-детектування: 208-400 нм. Метод 6 (ВЕРХ): Прилад: HP 1100 з діодно-матричним детектором; колонка: Kromasil 100 RP-18, 60 мм 2,1 мм, 3,5 мкм; елюент A: 5 мл HCІO4 (70%-ний) / л води, елюент B: ацетонітрил; градієнт: 0 хв. 2 % B 0,5 хв. 2 % B 4,5 хв. 90 % B 9 хв. 90 % B 9,2 хв. 2 % B 10 хв. 2 % B; потік: 0,75 мл/хв.; температура: 30°C; УФ-детектування: 210 нм. Метод 7 (РХ-МС): Прилад: Micromass Quattro LCZ з ВЕРХ Agilent 1100; колонка: Phenomenex Onyx Monolithic C18, 100 мм 3 мм; елюент A: 1 л води + 0,5 мл 50%ної мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50%-ної мурашиної кислоти; градієнт: 0,0 хв. 90 % A 2 хв. 65 % A 4,5 хв. 5 % A 6 хв. 5 % A; потік: 2 мл/хв.; температура: 40°C; УФдетектування: 208-400 нм. Метод 8 (РХ-МС): Прилад МС: Micromass ZQ; тип приладу ВЕРХ: HP 1100; УФ діодно-матричний детектор; колонка: Phenomenex Gemini 3 мкм 30 мм 3,00 мм; елюент A: 1 л води + 0,5 мл 50%-ної мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50%-ної мурашиної кислоти; градієнт: 0,0 хв. 90 % A 2,5 хв. 30 % A 3,0 хв. 5 % A 4,5хв. 5 % A; потік: 0,0 хв. 1 мл/хв. 2,5 хв./3,0 хв./4,5 хв. 2 мл/хв.; температура: 50°C; УФ-детектування: 210 нм. Метод 9 (РХ-МС): Прилад МС: Waters ZQ; тип приладу ВЕРХ: Waters Alliance 2795; колонка: Merck Chromolith RP18e, 100 мм 3 мм; елюент A: 1 л води + 0,5 мл 41 50%-ної мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50%-ної мурашиної кислоти; градієнт: 0,0 хв. 90 % A 2 хв. 65 % A 4,5 хв. 5 % A 6 хв. 5 % A; потік: 2 мл/хв.; температура: 40°C; УФ-детектування: 210 нм. Метод 10 (РХ-МС): Прилад: Micromass Quattro LCZ з ВЕРХ Agilent 1100; колонка: Phenomenex Gemini 3 мкм, 30 мм 3,00 мм; елюент A: 1 л води + 0,5 мл 50%-ної мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50%-ної мурашиної кислоти; градієнт: 0,0 хв. 90 % A 2,5 хв. 30 % A 3,0 хв. 5 % A 4,5 хв. 5 % A; потік: 0,0 хв. 1 мл/хв. 2,5 хв./3,0 хв./4,5 хв. 2 мл/хв.; температура: 50°C; УФ-детектування: 208-400 нм. Метод 11 (РХ-МС): Прилад МС: Micromass ZQ; тип приладу ВЕРХ: Waters Alliance 2795; колонка: Merck Chromolith SpeedROD RP-18e 100 мм 4,6 мм; елюент A: вода + 500 мкл 50%-ної мурашиної кислоти / л, елюент B: ацетонітрил + 500 мкл 50%-ної мурашиної кислоти / л; градієнт: 0,0 хв. 10 % B 7,0 хв. 95 % B 9,0 хв. 95 % B; потік: 0,0 хв. 1,0 мл/хв. 7,0 хв. 2,0 мл/хв. 9,0 хв. 2,0 мл/хв.; температура: 35°C; УФ-детектування: 210 нм. Метод 12 (ГХ): Прилад: Micromass GCT, GC 6890; колонка: Restek RTX-35, 15 м 200 мкм 0,33 мкм; постійний потік гелію: 0,88 мл/хв.; температура: 70°C; інжектор: 250°C; градієнт: 70°C, 30°C/хв. 310°C (3 хв. утримування). Вихідні та проміжні сполуки: Приклад 1A (4-метоксифеніл)[(триметилсиліл)окси]ацетонітрил Аналогічно інформації з літературних джерел [J. Chem. Soc. Perkin Trans. I, 1992, 2409-2417] у суміш 290,0 г (2130 ммоль) 4метоксибензальдегіду та 1,156 г (3,622 ммоль) йодиду цинку в 37,5 л бензолу при кімнатній температурі при охолодженні протягом приблизно 5 хвилин додають розчин 221,88 г (2236 ммоль) триметилсилілціаніду в 25 л бензолу. Суміш протягом 90 хвилин перемішують при кімнатній температурі, після чого концентрують у вакуумі. Залишок очищують фільтруванням через колонку на силікагелі (розчинник: циклогексан/етилацетат 4:1). Одержують 442,4 г (88,3 % від теор.) цільової сполуки. ВЕРХ (метод 1): Чу = 3,76 хв. + МС (ПХІ): m/z = 253 (M + NН4) 1 H-ЯМР (400 МГц, CDCІ3): = 7,49 (д, 2H), 6,92 (д, 2H), 5,42 (с, 1H) 3,81 (с, 3H). Приклад 2A 2-гідрокси-1-(4-метоксифеніл)-2-фенілетанон 94080 42 Відповідно до інформації з літературних джерел [J. Chem. Soc. Perkin Trans. I, 1992, 2409-2417] 292 мл (2,08 моль) діізопропіламіну розчиняють в 3,6 л 1,2-диметоксиетану та охолоджують до 78°C. При температурі нижче -60°C додають 826 мл розчину н-бутиллітію (2,5 M в н-гексані, 2,066 моль). Суміш протягом 15 хвилин перемішують при температурі -60°C та потім по краплях додають розчин 442 г (1,877 моль) (4метоксифеніл)[(триметилсиліл)окси]ацетонітрилу в 1,41 л 1,2-диметоксиетану при температурі 9). По завершенні додавання суміш охолоджують до кімнатної температури та тричі екстрагують по 1,0 л дихлорметану. Об‗єднані органічні фази сушать та концентрують у вакуумі. Залишок змішують з діетиловим етером, відсмоктують та сушать у високому вакуумі. Одержують 134,4 г (94,1 % від теор.) сполуки із заголовку. ВЕРХ (метод 1): Чу = 4,96 хв. + + МС (ПХІ): m/z = 354 (M+NH4) , 337 (M+H) 1 H-ЯМР (400 МГц, CDCІ3): = 8,76 (с, 1H), 7,62 (д, 2H), 7,40-7,30 (м, 5H), 7,03 (д, 2H), 3,90 (с, 3H). Приклад 6A 2-аміно-5-феніл-3-фуронітрил У суміш 60,0 г (301 ммоль) бромацетофенону та 25,89 г (391,86 ммоль) динітрилу малонової кислоти в 130 мл ДМФА при кімнатній температурі по краплях додають 68,6 мл (663 ммоль) діетиламіну (охолодження необхідне, щоб підтримувати температуру). Наприкінці додавання охолодження припиняють, суміш протягом 1 години перемішують при кімнатній температурі та потім додають у 385 мл води. Суміш змішують ще з 125 мл води та протягом 20 хвилин перемішують при кімнатній температурі. Твердий продукт, що випав у осад, відсмоктують, двічі промивають по 125 мл води, відсмоктують до суха та промивають петролейним етером. Залишок сушать у високому вакуумі. Одержують 33,3 г (50,1 % від теор.) цільової сполуки у вигляді жовто-коричневих кристалів. ВЕРХ (метод 1): Чу = 4,27 хв. + + МС (ПХІ): m/z = 202 (M+NH4) , 185 (M+H) 1 H-ЯМР (400 МГц, CDCІ3): = 7,51-7,45 (м, 2H), 7,39-7,32 (м, 3H), 6,54 (с, 1H), 4,89 (ш. с, 1H). Приклад 7A 6-фенілфуро[2,3-d]піримідин-4(3Н)-он У 884,9 мл (9.378 моль) ангідриду оцтової кислоти при 0°C по краплях додають 424,5 мл (11,25 моль) мурашиної кислоти. Суміш протягом 30 хвилин перемішують при 0°C та потім додають 69,1 г (0,375 моль) 2-аміно-5-феніл-3-фуронітрилу. Охолодження припиняють, а суміш нагрівають; при приблизно 80°C розпочинається виділення газу, яке припиняється через приблизно 3 години. Перемішують загалом протягом 24 годин при кип‘ятінні зі зворотнім холодильником (температура бані приблизно 130°C). Після охолодження су 45 спензії до кімнатної температури додають 750 мл діізопропілового етеру, охолоджують до 0°C та відфільтровують. Залишок промивають діізопропіловим етером та сушать у високому вакуумі. Одержують 50,83 г (58,7 % від теор.) цільової сполуки у вигляді коричневої твердої речовини. ВЕРХ (метод 1): Чу = 3,92 хв. + МС: m/z = 213 (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6): = 12,68 (ш. с, 1H), 8,17 (с, 1H), 7,88 (д, 2H), 7,52-7,48 (м, 3H), 7,42-7,38 (м, 1H). Приклад 8A 4-хлор-6-фенілфуро[2,3-d]піримідин 50 г (235,6 ммоль) 6-фенілфуро[2,3d]піримідин-4(3Н)-ону при кімнатній температурі суспендують в 375 мл (4023 ммоль) оксихлориду фосфору, після чого суміш нагрівають до кипіння (виділення HCl). Через 1 годину темний розчин охолоджують до кімнатної температури та по краплях додають у інтенсивно перемішувану суміш 1,25 л води і 2,25 л концентрованого розчину аміаку (25 мас. %) (нагрівання до 55-75°C, pH >9). По завершенні подачі суміш охолоджують до кімнатної температури та тричі екстрагують по 1,6 л дихлорметану. Об‘єднані органічні фази сушать та концентрують у вакуумі. Залишок змішують з діетиловим етером, відсмоктують та сушать у високому вакуумі. Одержують 47,3 г (87 % від теор.) цільової сполуки. ВЕРХ (метод 1): Чу = 4,67 хв. + МС: m/z = 231(M+H) 1 H-ЯМР (300 МГц, ДМСО-d6): = 8,84 (с, 1H), 8,05 (м, 2H), 7,77 (с, 1H), 7,61-7,50 (м, 3H). Приклад 9A 2-аміно-4-феніл-3-фуронітрил У суміш 10 г (73,4 ммоль) гідроксиацетофенону та 4,852 г (73,4 ммоль) динітрилу малонової кислоти в 24 мл ДМФА при охолодженні при кімнатній температурі по краплях додають 3,78 мл (36,7 ммоль) діетиламіну. Темну суміш протягом 2 годин перемішують при кімнатній температурі та потім повільно при перемішуванні та охолодженні додають у воду (200 мл). Осад перемішують протягом 30 хвилин при приблизно 10°C, відсмоктують, двічі змулюють водою та знову відсмоктують. Залишок сушать у високому вакуумі до постійної ваги. Одержують 10,99 г (81,2 % від теор.) цільової сполуки у вигляді жовто-коричневої твердої речовини. РХ-МС (метод 2): Чу = 1,81 хв.; m/z = 185 + (M+H) 94080 46 H-ЯМР (400 МГц, ДМСО-d6): = 7,54 (д, 2H), 7,50 (с, 2H), 7,45-7,32 (м, 4H). Приклад 10A 5-фенілфуро[2,3-d]піримідин-4(3Н)-он 1 108,5 мл (1154 ммоль) ангідриду оцтової кислоти охолоджують до 0°C та в атмосфері аргону додають 52,2 мл (1384 ммоль) мурашиної кислоти. Суміш протягом приблизно 45 хвилин перемішують при 0°C, після чого додають порціями 8,5 г (46,2 ммоль) 2-аміно-4-феніл-3-фуронітрилу. Одержують темну суміш, яка через 15 хвилин при 0°C набуває фіолетового забарвлення. Охолодження припиняють та голубу суспензію нагрівають до кімнатної температури. Через 15 хв. суміш кип‘ятять зі зворотнім холодильником (температура бані 125-130°C), після чого розпочинається процес газоутворення. Суміш протягом ночі перемішують при кип‘ятінні зі зворотнім холодильником. Після охолодження суміш концентрують у вакуумі, а залишок сушать у високому вакуумі. Із неочищеного продукту шляхом фільтрування через колонку із силікагелем (градієнт розчинника: дихлорметан дихлорметан/метанол 50:1) одержують приблизно 3 г від темно-червоної до чорної твердої речовини. Цю речовину розчиняють у приблизно 8 мл дихлорметану, осаджують діізопропіловим етером, відсмоктують та сушать у високому вакуумі. Одержують 1,81 г (чистота приблизно 84 %, вихід приблизно 15 % від теор.) цільової сполуки як темно-червоної твердої речовини. + РХ-МС (метод 3): Чу = 3,2 хв.; m/z = 211 (M-H) 1 H-ЯМР (400 МГц, ДМСО-d6): = 12,7 (с, 1H), 8,26 (с, 1H), 8,19 (с, 1H), 7,98 (д, 2H), 7,50-7,30 (м, 3H). Приклад 11A 4-хлор-5-фенілфуро[2,3-d]піримідин До 1,8 г (прибл. 6,8 ммоль) 5-фенілфуро[2,3d]піримідин-4(3Н)-ону при кімнатній температурі додають 9,5 мл (101,8 ммоль) оксихлориду фосфору та суміш протягом 1 години нагрівають при кип‘ятінні зі зворотнім холодильником. Одержану чорну суміш охолоджують до КТ та обережно по краплях при 9). Наприкінці додавання чорну суспензію нагрівають до КТ та перемішують ще протягом 15 хв.. Чорну тверду речовину відсмоктують, тричі змулюють водою, знову відсмоктують та сушать у ви 47 сокому вакуумі. Тверду речовину розчиняють у дихлорметані та фільтрують через колонку із силікагелем (розчинник: дихлорметан). Одержують 1371 мг (80,6 % від теор.) цільової сполуки як жовтої твердої речовини. РХ-МС (метод 4): Чу = 2,47 хв.; m/z = 231 + (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6): = 8,90 (с, 1H), 8,49 (с, 1H), 7,64-7,58 (м, 2H), 7,52-7,45 (м, 3H). Приклад 12A N-(4,4-діетоксибутил)-5-(4-метоксифеніл)-6фенілфуро[2,3-d]піримідин-4-амін 600 мг (1,78 ммоль) 4-хлор-5-(4метоксифеніл)-6-фенілфуро[2,3-d]піримідину, 344,7 мг (2,14 ммоль) 4-амінобутиральдегіддіетилацеталю та 0,465 мл (2,67 ммоль) ДІЕА в 5 мл ДМФА протягом ночі перемішують при 80 °C. Після охолодження суміш безпосередньо очищують препаративною ОФ-ВЕРХ (градієнт: ацетонітрил/вода). Одержують 746 мг (90,7 % від теор.) цільової сполуки. РХ-МС (метод 2): Чу = 2,87 хв.; m/z = 462 + (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6): = 8,34 (с, 1H), 7,48-7,41 (м, 4H), 7,38-7,30 (м, 3H), 7,13 (д, 2H), 5,12 (т, 1H), 4,40 (т, 1H), 3,35 (с, 3H), 3,55-3,47 (м, 2H), 3,42-3,35 (м, 4H), 1,49-1,38 (м, 4H), 1,09 (т, 6H). Приклад 13A 4-{[5-(4-метоксифеніл)-6-фенілфуро[2,3d]піримідин-4-іл]аміно}бутанал 640 мг (1,39 ммоль) N-(4,4-діетоксибутил)-5-(4метоксифеніл)-6-фенілфуро-[2,3-d]піримідин-4аміну розчиняють в 5 мл ацетону та при кімнатній температурі додають 1 мл 1 N розчину соляної кислоти. Через 1 годину реакційну суміш помішають у воду та тричі екстрагують дихлорметаном. Об‘єднані органічні фази промивають буферним розчином (pH 7) та насиченим розчином хлориду натрію, сушать над сульфатом магнію та концентрують у вакуумі. Неочищений продукт очищують хроматографією на силікагелі (розчинник: дихлорметан/етилацетат 2:1). Одержують 191 мг (35,6 % від теор.) цільової сполуки. РХ-МС (метод 5): Чу = 2,57 хв.; m/z = 388 + (M+H) . Приклад 14A 94080 48 Метиловий естер 6-[(6-фенілфуро[2,3d]піримідин-4-іл)аміно]гексанової кислоти 2,0 г (8,67 ммоль) 4-хлор-6-фенілфуро[2,3d]піримідину та 6,04 мл (34,7 ммоль) ДІЕА в 5 мл ДМФА нагрівають до 160 °C. Додають 3,15 г (17,34 ммоль) гідрохлориду метилового естеру 6аміногексанової кислоти та протягом 4 годин перемішують при 160 °C. Після охолодження суміш поміщають у крижану воду та тричі екстрагують етилацетатом. Об‘єднані органічні фази промивають насиченим розчином хлориду амонію, сушать над сульфатом магнію та концентрують у вакуумі. У залишкову кількість масла додають метанол. Тверду речовину, що випала в осад, відсмоктують, промивають метанолом, а тверду речовину сушать у високому вакуумі. Одержують 1,85 г (57,2 % від теор.) цільової сполуки. РХ-МС (метод 5): Чу = 2,38 хв.; m/z = 340 + (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6): = 8,24 (с, 1H), 7,98 (ш. с, 1H), 7,79 (д, 2H), 7,51 (т, 2H), 7,43-7,37 (м, 2H), 3,59 (с, 3H), 3,49 (кв, 2H), 2,32 (т, 2H), 1,651,56 (м, 4H), 1,41-1,35 (м, 2H). Приклад 15A Метиловий естер 6-[(5-бром-6-фенілфуро[2,3d]піримідин-4-іл)аміно]гексанової кислоти 1,75 г (5,15 ммоль) метилового естеру 6-[(6фенілфуро[2,3-d]піримідин-4-іл)аміно]гексанової кислоти поміщають в 5,2 мл тетрахлорметану. При КТ додають 1,054 г (5,92 ммоль) Nбромсукцинаміду, після чого суміш протягом приблизно 1 години нагрівають при кип‘ятінні зі зворотнім холодильником. Після охолодження концентрують у вакуумі, а залишок хроматографують на силікагелі (розчинник: циклогексан/етилацетат 4:1). Одержують 0,89 г (41,2 % від теор.) цільової сполуки. РХ-МС (метод 2): Чу = 2,64 хв.; m/z = 420 + (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6): = 8,33 (с, 1H), 8,02 (д, 2H), 7,61-7,49 (м, 3H), 7,04 (т, 1H), 3,59 (с, 3H), 3,59-3,52 (м, 2H), 2,31 (т, 2H), 1,68-1,54 (м, 4H), 1,40-1,31 (м, 2H). Приклад 16A Метиловий естер 6-[(5-фенілфуро[2,3d]піримідин-4-іл)аміно]гексанової кислоти 49 500 мг (2,19 ммоль) 4-хлор-5-фенілфуро[2,3d]піримідину, 1,51 мл (8,67 ммоль) ДІЕА та 1 мл ДМФА нагрівають до 160 °C та додають 787,6 мг (4,34 ммоль) гідрохлориду метилового естеру 6аміногексанової кислоти. Через 4 години при 160 °C реакційну суміш охолоджують до КТ, поміщають у крижану воду та тричі екстрагують етилацетатом. Об‘єднані органічні фази промивають насиченим розчином хлориду амонію, сушать над сульфатом магнію та концентрують у вакуумі. Залишок очищують хроматографією на силікагелі (розчинник: циклогексан/етилацетат 10:1 3:1). Одержують 470 мг (63,9% від теор.) цільової сполуки. РХ-МС (метод 5): Чу = 2,43 хв.; m/z = 340 + (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6): = 8,35 (с, 1H), 7,48 (с, 1H), 7,55-7,45 (м, 5H), 5,82 (т, 1H), 3,49 (с, 3H), 3,44 (кв, 2H), 2,31 (т, 2H), 1,60-1,50 (м, 4H), 1,33-1,25 (м, 2H). Приклад 17A Метиловий естер 6-[(6-бром-5-фенілфуро[2,3d]піримідин-4-іл)аміно]гексанової кислоти До суміші 100 мг (0,295 ммоль) 4-хлор-5фенілфуро[2,3-d]піримідину та 0,3 мл тетрахлорметану при кімнатній температурі додають 57,7 мг (0,324 ммоль) N-бромсукцинімід. Через 1 годину при кімнатній температурі реакційну суміш концентрують у вакуумі, а залишок очищують препаративною ОФ-ВЕРХ (градієнт: ацетонітрил/вода). Одержують 72 мг (58,4 % від теор.) цільової сполуки. РХ-МС (метод 2): Чу = 2,52 хв.; m/z = 418/420 + (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6): = 8,32 (с, 1H), 7,61-7,50 (м, 5H), 5,07 (т, 1H), 3,57 (с, 3H), 3,49 (кв, 2H), 2,29 (т, 2H), 1,52-1,42 (м, 4H), 1,28-1,20 (м, 2H). Приклад 18A 6-{[5-(4-метоксифеніл)-6-фенілфуро[2,3d]піримідин-4-іл]аміно}гексаннітрил 94080 50 До 1,0 г (3,0 ммоль) 4-хлор-5-(4метоксифеніл)-6-фенілфуро[2,3-d]піримідину в 10 мл ДМФА додають 1,15 г (8,9 ммоль) ДІЕА і 0,67 г (5,9 ммоль) 6-амінокапронітрилу та протягом 2 годин нагрівають до 120 °C. Після охолодження у суміш додають воду та тричі екстрагують етилацетатом. Органічну фазу промивають водою, розрідженою соляною кислотою та насиченим розчином хлориду натрію, сушать та концентрують. Одержують 1,2 г (98 % від теор.) жовтого масла, яке як неочищений продукт вводять у подальшу реакцію. РХ-МС (метод 5): Чу = 2,87 хв.; m/z = 412 + (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6): = 8,4 (с, 1H), 7,55 (м, 2H), 7,4 (м, 2H), 7,25 (м, 3H), 7,15 (м, 2H), 4,4 (ш. с, 1H), 3,9 (с, 3H), 3,5 (м, 2H), 2,35 (т, 2H), 1,65 (м, 2H), 1,5 (м, 2H), 1,4 (м, 2H). Приклад 19A 7-{[5-(4-метоксифеніл)-6-фенілфуро[2,3d]піримідин-4-іл]аміно}гептаннітрил Сполуку із заголовку одержують трьома стадіями із 4-хлор-5-(4-метоксифеніл)-6-фенілфуро[2,3d]піримідину: Стадія 1: До 1,0 г (3,0 ммоль) 4-хлор-5-(4метоксифеніл)-6-фенілфуро[2,3-d]піримідину та 0,70 г (5,9 ммоль) 6-аміногексанолу в 10 мл ДМФА додають 1,15 г (8,9 ммоль) ДІЕА та протягом 4 годин нагрівають до 120 °C. Потім суміш розріджують етилацетатом, промивають водою та розрідженою соляною кислотою, сушать та концентрують. Залишок очищують ОФ-ВЕРХ (колонка: Gromsil 250 мм 40 мм, 10 мкм; градієнт: ацетонітрил/вода: 0-3 хв. 5 % ацетонітрилу, 3-34 хв. 5 % 98 % ацетонітрилу, 34-38 хв. 98 % ацетонітрилу). Одержують 364 мг (29 % від теор.) 6-{[5-(4метоксифеніл)-6-фенілфуро[2,3-d]піримідин-4іл]аміно}гексан-1-олу як жовтого масла, яке через 2 години покою застигає. Стадія 2: 333 мг (0,80 ммоль) 6-{[5-(4-метоксифеніл)-6фенілфуро[2,3-d]піримідин-4-іл]аміно}гексан-1-олу та 122 мкл (0,88 ммоль) триетиламіну розчиняють в дихлорметані та при 0°C додають 62 мкл (0,80 ммоль) хлориду метансульфонової кислоти, розчиненої в дихлорметані (загальна кількість дихлорметану становить 20 мл). Після перемішування протягом ночі при кімнатній температурі суміш промивають водою і насиченим розчином хлористого натрію та сушать над сульфатом магнію. Після концентрування одержують 400 мг (кількісн.) 6{[5-(4-метоксифеніл)-6-фенілфуро[2,3-d]піримідин4-іл]аміно}гексил-метансульфонату, який як неочищений продукт вводять у подальшу реакцію. Стадія 3: 51 Суміш 400 мг (прибл. 0,80 ммоль) 6-{[5-(4метоксифеніл)-6-фенілфуро[2,3-d]-піримідин-4іл]аміно}гексилметансульфонату та 526 мг (8,1 ммоль) ціаніду калію в 20 мл ДМФА протягом ночі перемішують при 80 °C. Після охолодження розріджують етилацетатом та промивають водою і насиченим розчином хлористого натрію. Органічну фазу сушать над сульфатом магнію та концентрують. Неочищений продукт очищують ОФ-ВЕРХ (колонка: Gromsil 250 мм 40 мм, 10 мкм; градієнт: ацетонітрил/вода: 0-3 хв. 5 % ацетонітрилу, 3-50 хв. 5 % 98 % ацетонітрилу, 50-55 хв. 98 % ацетонітрилу). Одержують 249 мг (72 % від теор.) сполуки із заголовку як жовтуватого масла. РХ-МС (метод 4): Чу = 2,90 хв.; m/z = 426 + (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6): = 8,35 (с, 1H), 7,55 (м, 4H), 7,35 (м, 3H), 7,15 (м, 2H), 5,0 (т, 1H), 3,85 (с, 3H), 3,45 (м, 2H), 2,45 (т, 2H), 1,55 (м, 2H), 1,4 (м, 2H), 1,3 (м, 2H), 1,15 (м, 2H). Приклад 20A 6-{[5-(4-метоксифеніл)-6-фенілфуро[2,3d]піримідин-4-іл]окси}гексаннітрил 850 мг (3,8 ммоль) 6-гідроксигексаннітрилу [одержаного відповідно до Eur. J. Med. Chem. 36 (4), 303-311 (2001)] розчиняють в 15 мл ДМФА, при 0°C додають 180 мг 60 %-ного гідриду натрію (дисперсія у мінеральному маслі; прибл. 4,5 ммоль) та суміш протягом 1 години перемішують при кімнатній температурі. Потім додають 1,26 г (3,8 ммоль) 4-хлор-5-(4-метоксифеніл)-6фенілфуро[2,3-d]піримідину, після чого суміш протягом ночі перемішують при 120 °C. Після охолодження додають воду та екстрагують етилацетатом. Органічну фазу сушать та концентрують. Залишок очищують флеш-хроматографією на силікагелі (розчинник: циклогексан/етилацетат 2:1 циклогексан/етилацетат 1:2). Одержують 1,05 г (68 % від теор.) оранжевого масла, яке як неочищений продукт вводять у подальшу реакцію. РХ-МС (метод 5): Чу = 2,97 хв.; m/z = 413 + (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6): = 8,60 (с, 1H), 7,55 (м, 2H), 7,25-7,45 (м, 5H), 7,0-7,1 (м, 2H), 4,4 (т, 2H), 3,85 (с, 3H), 2,4 (т, 2H), 1,6 (м, 2H), 1,5 (м, 2H), 1,25 (м, 2H). Приклад 21A 5-(4-метоксифеніл)-6-феніл-N-{3-[2ціаноетокси]пропіл}фуро[2,3-d]піримідин-4-амін 94080 52 Стадія 1: 1,00 г (3,0 ммоль) 4-хлор-5-(4-метоксифеніл)6-фенілфуро[2,3-d]піримідину розчиняють в 10 мл ДМФА та додають 1,15 г (8,9 ммоль) ДІЕА. Потім додають 0,45 г (5,9 ммоль) 3-амінопропанолу та суміш протягом 2 годин нагрівають до 120°C. Після охолодження суміш розріджують етилацетатом та послідовно промивають розрідженою соляною кислотою та насиченим розчином хлористого натрію. Органічну фазу сушать над сульфатом магнію та концентрують. Залишок очищують ОФВЕРХ (колонка: Gromsil 250 мм 30 мм, 10 мкм; градієнт: ацетонітрил/вода: 0-3 хв. 5 % ацетонітрилу, 3-50 хв. 5 % 98 % ацетонітрилу, 50-55 хв. 98 % ацетонітрилу). Одержують 671 мг (60 % від теор.) 3-{[5-(4-метоксифеніл)-6-фенілфуро[2,3d]піримідин-4-іл]аміно}пропан-1-олу у формі бежевих кристалів. РХ-МС (метод 2): Чу = 2,13 хв.; m/z = 376 + (M+H) . Стадія 2: До 300 мг (0,80 ммоль) сполуки стадії 1 додають 47 мг (0,89 ммоль) нітрилу акрилової кислоти та 57 мг (0,83 ммоль) етилату натрію. Суміш протягом ночі перемішують при 80 °C. Після охолодження суміш поміщають в ДМСО та безпосередньо очищують ОФ-ВЕРХ (колонка: Gromsil 250 мм 30 мм, 10 мкм; градієнт: ацетонітрил/вода: 0-3 хв. 5 % ацетонітрилу, 3-50 хв. 5 % 98 % ацетонітрилу, 50-55 хв. 98 % ацетонітрилу). Одержують 160 мг (47 % від теор.) сполуки із заголовку як жовтого масла. РХ-МС (метод 2): Чу = 2,43 хв.; m/z = 429 + (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6): = 8,3 (с, 1H), 7,1-7,45 (м, 9H), 5,2 (м, 1H), 3,85 (с, 3H), 3,5 (м, 4H), прибл. 3,3 (м, 2H, частково перекритий H2O), 2,7 (т, 2H), 1,7 (квін, 2H). Приклад 22A 5-(4-метоксифеніл)-6-феніл-N-(5-амінопентил)фуро[2,3-d]піримідин-4-амін Стадія 1: 1,00 г(3,0 ммоль) 4-хлор-5-(4-метоксифеніл)6-фенілфуро[2,3-d]піримідину розчиняють в 5 мл ДМФА та додають 1,15 г (8,9 ммоль) ДІЕА. Потім додають 1,20 г (5,9 ммоль) 5-[(трет-бутилоксикарбоніл)аміно]-1-пентиламіну [одержаного із 1,5 53 діамінопентану відповідно до J. Med. Chem. 47 (20), 4933-4940 (2004)], після чого суміш протягом 3 годин нагрівають до 80 °C. Після охолодження суміш розріджують дихлорметаном та послідовно промивають водою та насиченим розчином хлористого натрію. Органічну фазу сушать над сульфатом магнію та концентрують. Залишок очищують ОФ-ВЕРХ (колонка: Gromsil 250 мм 30 мм, 10 мкм; градієнт: ацетонітрил/вода: 0-3 хв. 5 % ацетонітрилу, 3-50 хв. 5 % 98 % ацетонітрилу, 50-55 хв. 98 % ацетонітрилу). У двох фракціях одержують загалом 1,07 г (67 % від теор.) трет-бутил-(5{[5-(4-метоксифеніл)-6-фенілфуро[2,3-d]піримідин4-іл]аміно}пентил)карбамату у формі бежевих кристалів. РХ-МС (метод 2): Чу = 2,85 хв.; m/z = 503 + (M+H) . Стадія 2: 380 мг (0,76 ммоль) сполуки стадії 1 розчиняють в 5 мл метиленхлориду та послідовно додають 0,4 мл анізолу, а також 5,5 мл трифтороцтової кислоти. Суміш протягом 2 годин перемішують при кімнатній температурі. Потім суміш розріджують дихлорметаном та нейтрально промивають розчином гідрокарбонату натрію. Після промивання органічної фази насиченим розчином хлориду натрію її сушать над сульфатом магнію. Залишок після концентрування розчиняють в етанолі та концентрують; цей процес повторюють тричі. Одержують 349 мг (82 % від теор.) сполуки із заголовку як жовтуватої піни. РХ-МС (метод 2): Чу = 2,43 хв.; m/z = 429 + (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6): = 8,3 (с, 1H), 7,1-7,45 (м, 9H), 5,4 (ш. м, 1H), 5,1 (м, 1H), 3,85 (с, 3H), прибл. 3,3 (м, 2H, частково перекрит. H2O), 2,6 (т, 2H), 1,1-1,57 (м, 6H). Приклад 23A 4-[3-(2-ціаноетокси)етокси]-5-(4метоксифеніл)-6-фенілфуро[2,3-d]піримідин Стадія 1: До розчину 461 мг (7,4 ммоль) етиленгліколю в 10 мл ДМФА при 0 °C додають 59 мг (1,5 ммоль) 60%-ного гідриду натрію. Після нагрівання до кімнатної температури суміш перемішують протягом 1 години. Потім додають 0,50 г (1,5 ммоль) 4-хлор5-(4-метоксифеніл)-6-фенілфуро[2,3-d]піримідину та суміш протягом 3 годин перемішують при кімнатній температурі. Після цього розріджують водою та екстрагують етилацетатом. Органічну фазу промивають насиченим розчином хлористого натрію, сушать над сульфатом магнію та концентрують. Одержаний таким чином неочищений продукт очищують ОФ-ВЕРХ (колонка: Gromsil 250 мм 30 мм, 10 мкм; градієнт: ацетонітрил/ вода: 0-3 хв. 5 % ацетонітрилу, 3-50 хв. 5 % 98 % ацетонітри 94080 54 лу, 50-55 хв. 98 % ацетонітрилу). Таким чином одержують 412 мг (77 % від теор.) 2-{[5-(4метоксифеніл)-6-фенілфуро[2,3-d]піримідин-4іл]окси}етанолу. Стадія 2: Аналогічно прикладу 21A на стадії 2 із 350 мг (0,97 ммоль) сполуки стадії 1 одержують 245 мг (61 % від теор.) сполуки із заголовку у формі жовтих кристалів. Т.сп.: 103-104°C РХ-МС (метод 2): Чу = 2,84 хв.; m/z = 416 + (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6): = 8,6 (с, 1H), 7,35-7,55 (м, 7H), 7,05 (м, 2H), 4,55 (м, 2H), 3,85 (с, 3H), 3,7 (м, 2H), 3,45 (т, 2H), 2,7 (т, 2H). Приклад 24A 4-[3-(2-ціаноетокси)пропокси]-5-(4метоксифеніл)-6-фенілфуро[2,3-d]піримідин Сполуку із заголовку одержують аналогічно прикладу 23 A в дві стадії із 1,3-пропандіолу та 4хлор-5-(4-метоксифеніл)-6-фенілфуро[2,3d]піримідину. Вихід: 304 мг (89 % від теор.) Т.сп.: 88-89°C РХ-МС (метод 4): Чу = 2,94 хв.; m/z = 430 + (M+H) 1 H-ЯМР (400 МГц, ДМСO-d6): = 8,6 (с, 1H), 7,35-7,55 (м, 7H), 7,05 (м, 2H), 4,45 (м, 2H), 3,85 (с, 3H), 3,7 (м, 2H), 3,5 (т, 2H), 2,7 (т, 2H), 1,7 (квін, 2H). Приклад 25A (4-етилфеніл)[(триметилсиліл)окси]ацетонітрил 600 г (4,47 моль) 4-етилбензальдегіду в 5,3 л толуолу змішують з 2,4 г (7,5 ммоль) йодиду цинку. При КТ при помірному охолодженні протягом прибл. 5 хвилин додають 587,4 мл (4,7 моль) триметилсилілціаніду, розчиненого в 3,6 л толуолу. Суміш протягом 90 хвилин перемішують при кімнатній температурі перед початком видалення летких компонентів у вакуумі, а залишок швидко хроматографують на силікагелі (елюент: петролейний етер/етилацетат 9:1). Одержують 990 г (94,9 % від теор.) сполуки із заголовку як безбарвного масла. 1 H-ЯМР (400 МГц, CDCІ3): = 7,38 (д, 2H), 7,23 (д, 2H), 4,97 (с, 1H), 2,68 (кв, 2H), 1,25 (т, 3H), 0,23 (с, 9H). Приклад 26A 1-(4-етилфеніл)-2-гідрокси-2-фенілетанон 55 290 мл (2,069 моль) діізопропіламіну розчиняють в 3,6 л ДМЕ та охолоджують до -78 °C. Протягом приблизно 20 хвилин по краплях додають 820 мл (2,05 моль) н-бутиллітію (2,5 M розчину в гексані, температура < -60 °C). Через 15 хвилин при 60 °C по краплях додають 435 г (1,864 моль) (4етилфеніл)[(триметилсиліл)окси]ацетонітрилу в 1,4 л ДМЕ (температура 9, температура 55-75 °C). Водну суміш тричі екстрагують дихлорметаном, об‘єднані органічні фази сушать над сульфатом натрію та концентрують у вакуумі. Залишок промивають незначною кількістю діізопропілового етеру та після відфільтровування та сушки у високому вакуумі одержують 66,1 г (85,2 % від теор.) цільового продукту. ВЕРХ (метод 6): Чу = 5,68 хв.. МС (ПХІ): m/z = + 335 (M+H) 1 H-ЯМР (400 МГц, CDCІ3): = 8,76 (с, 1H), 7,61 (д, 2H), 7,48-7,30 (м, 7H), 2,78 (кв, 2H), 1,36 (т, 3H). Приклад 30A 6-фенілфуро[2,3-d]піримідин-4-амін 110 г (597 ммоль) 2-аміно-5-феніл-3фуронітрилу суспендують в 355 мл (9 моль) формаміду та нагрівають протягом 1,5 години (температура бані прибл. 210°C). Потім суміш охолоджують до кімнатної температури та при перемішуванні додають у воду. Тверду речовину, що випала в осад, відсмоктують та промивають водою. Вологий продукт змішують з дихлорметаном, знову відсмоктують та сушать у вакуумі. Одержують 106 г (80 % від теор.) цільової сполуки. + РХ-МС (метод 3): Чу = 3,1 хв.; m/z = 212 (M+H) ВЕРХ (метод 1): Чу = 3,63 хв. 1 H-ЯМР (400 МГц, ДМСО-d6): = 8,20 (с, 1H), 7,8 (д, 2H), 7,55-7,32 (м, 6H). Приклад 31A 5-бром-6-фенілфуро[2,3-d]піримідин-4-амін 80 г (378,7 ммоль) 6-фенілфуро[2,3d]піримідин-4-аміну в 770 мл тетрахлорвуглецю нагрівають до 60 °C. Додають 84,3 г (473,4 ммоль) N-бромсукциніміду, після чого суміш протягом ночі перемішують при кип‘ятінні зі зворотнім холодильником. Після охолодження суміш фільтрують, осад на фільтрі послідовно змішують з дихлорметаном і ацетонітрилом та знову фільтрують. Після цього осад на фільтрі сушать у вакуумі. Одержують 86 г цільового продукту (78,2 % від теор.). + МС (ПХІ): m/z = 290/292 (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6): = 8,28 (с, 1H), 8,03 (д, 2H), 7,60-7,50 (м, 5H). Приклад 32A 5-бром-4-хлор-6-фенілфуро[2,3-d]піримідин 94080 58 54 г (186 ммоль) 5-бром-6-фенілфуро[2,3d]піримідин-4-аміну поміщають в 135 мл хлороформу, додають 70 мл 4 N розчину хлороводню в діоксані (280 ммоль) та кип‘ятять зі зворотнім холодильником. По краплях в ході газоутворення додають 50 мл (372 ммоль) ізоамілнітрилу. По завершенні додавання суміш протягом 3 годин перемішують при кип‘ятінні зі зворотнім холодильником перед тим, як розпочати процес додавання охолодженої реакційної суміші у воду та екстрагування дихлорметаном. Органічну фазу промивають насиченим розчином гідрокарбонату натрію, сушать над сульфатом натрію та концентрують у вакуумі. Неочищений продукт очищують хроматографією на силікагелі (елюент: дихлорметан). Для подальшого очищення продукт при перемішуванні додають у метанол, відсмоктують та сушать у високому вакуумі. Одержують 32 г цільового продукту (55,5 % від теор.). РХ-МС (метод 2): Чу = 2,54 хв.; m/z = 309/310 + (M+H) ВЕРХ (метод 1): Чу = 5,08 хв. 1 H-ЯМР (400 МГц, CDCІ3): = 8,79 (с, 1H), 8,23-8,20 (м, 2H), 7,58-7,51 (м, 3H). Приклад 33A Метиловий естер [(5-бром-6-фенілфуро[2,3d]піримідин-4-іл)(метил)аміно]-гексанової кислоти До суміші 500 мг (1,2 ммоль) метилового естеру 6-[(5-бром-6-фенілфуро[2,3-d]-піримідин-4іл)аміно]гексанової кислоти та 112 мкл (1,79 ммоль) метилйодиду в 1 мл ДМФА при 0 °C порціями додають 52,5 мг (1,32 ммоль) 60 %-ного гідриду натрію. Охолодження льодом припиняють, а суміш нагрівають до КТ. Через 1 годину суміш розріджують водою та дихлорметаном, а відділену водну фазу екстрагують дихлорметаном. Об‘єднані органічні фази промивають насиченим розчином хлориду натрію, сушать над сульфатом натрію та концентрують у вакуумі. Одержують 472,6 мг (91,2 % від теор.) масла. РХ-МС (метод 7): Чу = 4,24 хв.; m/z = 432/434 + (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6): = 8,38 (с, 1H), 8,0 (д, 2H), 7,60-7,50 (м, 3H), 3,70 (т, 2H), 3,29 (с, 3H), 2,29 (т, 2H), 1,72-1,65 (м, 2H), 1,60-1,52 (м, 2H), 1,31-1,26 (м, 2H). Приклад 34A Метиловий естер (-)-(2R)-2-метил-3(тритилокси)пропанової кислоти 1,5 г (12,7 ммоль) (-)-метил-D--гідроксиізобутирату поміщають в 13 мл дихлорметану та 2,5 мл (17,8 ммоль) триетиламіну, охолоджують до 0 59 °C та додають 4,43 г (15,9 ммоль) трифенілметилхлориду, розчиненого в дихлорметані. Охолодження припиняють, а суміш перемішують протягом 2 годин перед тим, як після розрідження дихлорметаном розпочати процес кількаразового промивання водою та насиченим розчином хлориду натрію. Органічну фазу сушать над сульфатом магнію та концентрують у вакуумі. Продукт очищують хроматографією на силікагелі (елюент: циклогексан/етилацетат 20:1). Одержують 2,81 г цільового продукту (61,4 % від теор.). РХ-МС (метод 2): Чу = 2,98 хв.; m/z = 243 1 H-ЯМР (400 МГц, ДМСО-d6): = 7,38-7,20 (м, прибл. 15H), 3,63 (с, 3H), 3,17-3,09 (м, 2H), 2,72 (кв, 1H), 1,05 (д, 3H). 20 []D = -15,5°, c = 0,545, хлороформ. Приклад 35A (-)-(2S)-2-метил-3-(тритилокси)пропан-1-ол 1,4 г (3,88 ммоль) метилового естеру (-)-(2R)2-метил-3-(тритилокси)пропанової кислоти розчиняють в 5 мл абсолютного ТГФ, охолоджують до 20°C та по краплях додають 1,94 мл (1,94 ммоль) 1 M розчину алюмогідриду літію в ТГФ. Суміш протягом 1 години перемішують при -10 °C перед початком процесу розріджування цієї суміші ацетоном і дихлорметаном та додавання води. Водну фазу двічі екстрагують дихлорметаном. Органічні фази об‘єднують, промивають насиченим розчином хлориду натрію, сушать над сульфатом магнію та концентрують у вакуумі. Після очищення хроматографією на силікагелі (елюент: циклогексан/етилацетат 8:1 4:1) одержують 0,98 г (75,5 % від теор.) цільового продукту. РХ-МС (метод 8): Чу = 2,85 хв.; m/z = 243, 355 + (M+Na) + МС (ПХІ): m/z = 243, 350 (M+NH4) 1 H-ЯМР (400 МГц, ДМСО-d6): = 7,40-7,24 (м, прибл. 15H), 4,38 (т, 1H), 3,43-3,37 (м, 1H), 3,323,28 (м, 1H), 3,01 (дд, 1H), 2,83 (дд, 1H), 1,84 (м, 1H), 0,88 (д, 3H). 20 []D = -30°, c = 0,49, хлороформ. Приклад 36A Трет-бутиловий естер (-)-{[(2S)-2-метил-3(тритилокси)пропіл]окси}оцтової кислоти До розчину 800 мг (2,41 ммоль) (-)-(2S)-2метил-3-(тритилокси)пропан-1-олу в 2 мл дихлорметану додають 53,2 мг (0,12 ммоль) діацетату родію [як димеру Rh2(OAc)4]. У інтенсивно перемішувану суспензію при утворенні N2 повільно по краплях додають надлишок трет-бутилового есте 94080 60 ру діазооцтової кислоти (прибл. 2 еквіваленти, тривалість прибл. 1 година). Потім реакційну суміш розріджують дихлорметаном, тричі промивають водою та один раз промивають насиченим розчином хлориду натрію, сушать над сульфатом магнію та концентрують у вакуумі. Продукт очищують хроматографією на силікагелі (елюент: циклогексан/етилацетат 10:1). Одержують прибл. 1000 мг незначним чином забрудненого цільового продукту. + МС (ПХІ): m/z = 464 (M+NH4) 1 H-ЯМР (400 МГц, ДМСО-d6): = 7,40-7,25 (м, 15H), 3,91 (с, 2H), 3,48 (дд, 1H), 3,35 (дд, 1H), 2,98 (дд, 1H), 2,88 (дд, 1H), 1,98 (м, 1H), 1,41 (с, 9H), 0,89 (д, 3H). 20 []D = -6,6°, c = 0,505, хлороформ. Приклад 37A Трет-бутиловий естер (+)-{[(2S)-3-гідрокси-2метилпропіл]окси}оцтової кислоти 900 мг (прибл. 2,02 ммоль) трет-бутилового естеру (-)-{[(2S)-2-метил-3-(тритилокси)пропіл]окси}оцтової кислоти розчиняють в 2 мл дихлорметану і 0,5 мл метанолу та спочатку при 0 °C, а потім при кімнатній температурі порціями додають надлишок (прибл. 3 еквіваленти) безводного броміду цинку. Суміш протягом 2-3 годин перемішують при кімнатній температурі перед тим, як після розрідження дихлорметаном двічі промити водою та насиченим розчином хлориду натрію. Сушать над сульфатом магнію та концентрують у вакуумі. Після очищення хроматографією на силікагелі (елюент: циклогексан/етилацетат 10:1 2:1) ізолюють 257 мг цільового продукту (прибл. 62 % від теор.). + МС (ПХІ): m/z = 222 (M+NH4) 1 H-ЯМР (400 МГц, ДМСО-d6): = 4,40 (т, 1H), 3,95 (с, 2H), 3,42-3,36 (м, 2H), 3,28-3,22 (м, 2H), 1,77 (м, 1H), 1,44 (с, 9H), 0,85 (д, 3H). 20 []D = +10,5°, c = 0,525, хлороформ. Приклад 38A Метиловий естер (+)-(2S)-2-метил-3(тритилокси)пропанової кислоти 10,33 г (87,5 ммоль) (+)-метил-L-гідроксиізобутирату поміщають в 10 мл дихлорметану та 14,2 мл (174,9 ммоль) піридину, охолоджують до 0 °C та додають 1,07 г (8,7 ммоль) ДМАП та потім при охолодженні льодом ще 30,5 г (109 ммоль) трифенілметилхлориду, розчиненого в дихлорметані. Охолодження припиняють, а суміш перемішують протягом 5 годин перед тим, як після розрідження достатньою кількістю дихлорметану послідовно промити водою, 1 N розчином соляної кислоти, насиченим розчином гідрокарбо
ДивитисяДодаткова інформація
Назва патенту англійськоюAcyclic substituted furopyrimidine derivatives and use thereof for treating cardiovascular diseases
Автори англійськоюLampe Thomas, Becker Eva-Maria, Kast Raimund, Beck Hartmut, Jeske Mario, Schuhmacher Joachim, Stoll Friederike, Klein Martina, Akbaba Metin, Knorr Andreas, Stasch Johannes-Peter, Baerfacker Lars, Hillisch Alexander, Karig Gunter, Meininghaus Mark, Schlemmer Karl-Heinz, Schohe-Loop Rudolf
Назва патенту російськоюАциклически-замещенные производные фуропиримидина и их применение для лечения сердечно-сосудистых заболеваний
Автори російськоюЛампэ Томас, Беккер Эва-Мария, Каст Раимунд, Бекк Хартмут, Еске Марио, Шумахер Йоахим, Штолль Фридерике, Кляйн Мартина, Акбаба Метин, Кнорр Андреас, Шташ Йоханнес-Петер, Берфаккер Ларс, Хиллиш Александер, КаригГунтер, Майнингхаус Марк, Шлеммер Карл-Хайнц, Шоэ-Лооп Рудольф
МПК / Мітки
МПК: C07D 491/04, A61P 9/00, A61K 31/519
Мітки: фуропіримідину, лікування, ациклічно-заміщені, захворювань, похідні, застосування, серцево-судинних
Код посилання
<a href="https://ua.patents.su/86-94080-aciklichno-zamishheni-pokhidni-furopirimidinu-ta-kh-zastosuvannya-dlya-likuvannya-sercevo-sudinnikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Ациклічно-заміщені похідні фуропіримідину та їх застосування для лікування серцево-судинних захворювань</a>
Попередній патент: Застосування бензоконденсованих гетероциклічних сульфамідних похідних для зняття болю
Випадковий патент: Електропневматичний регулятор