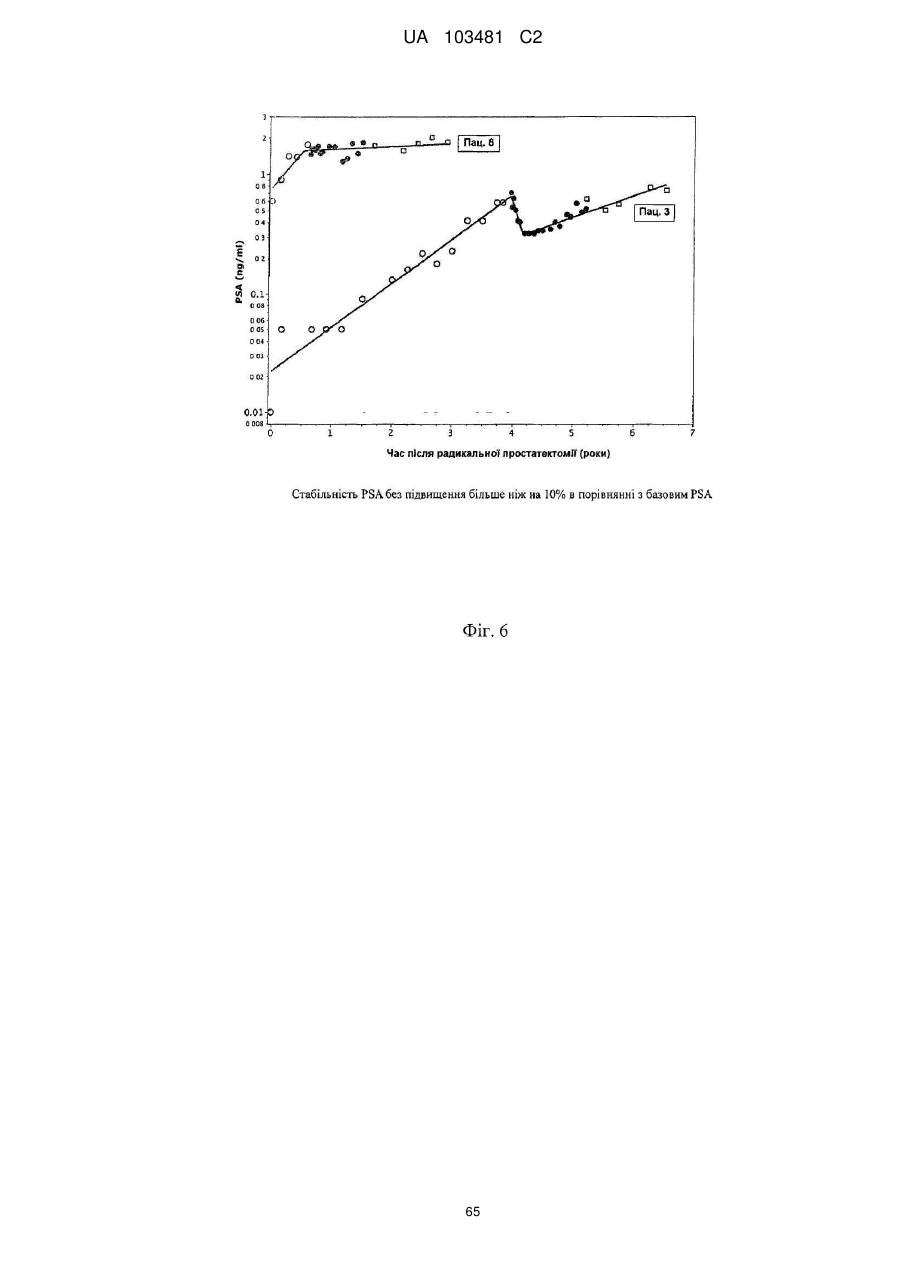
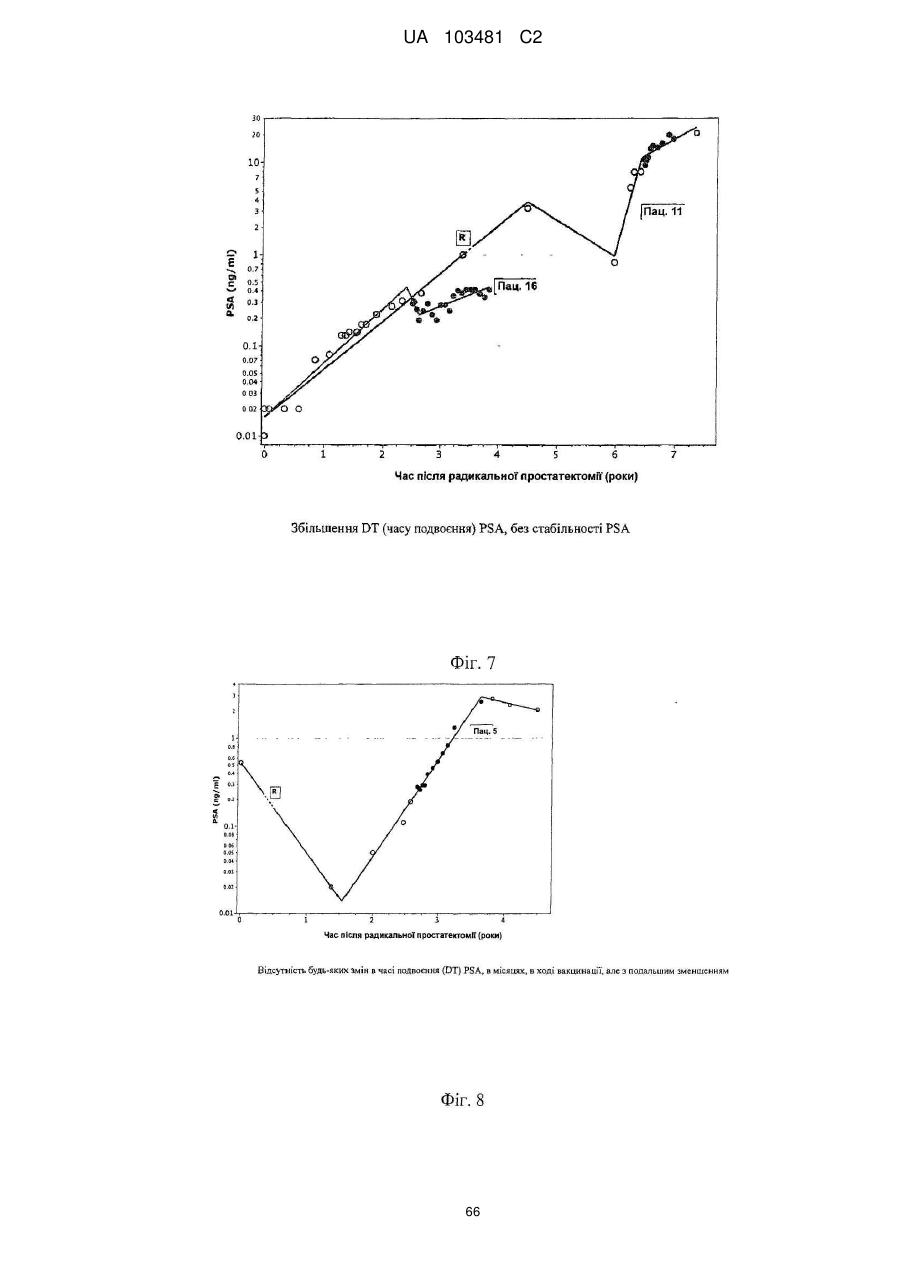
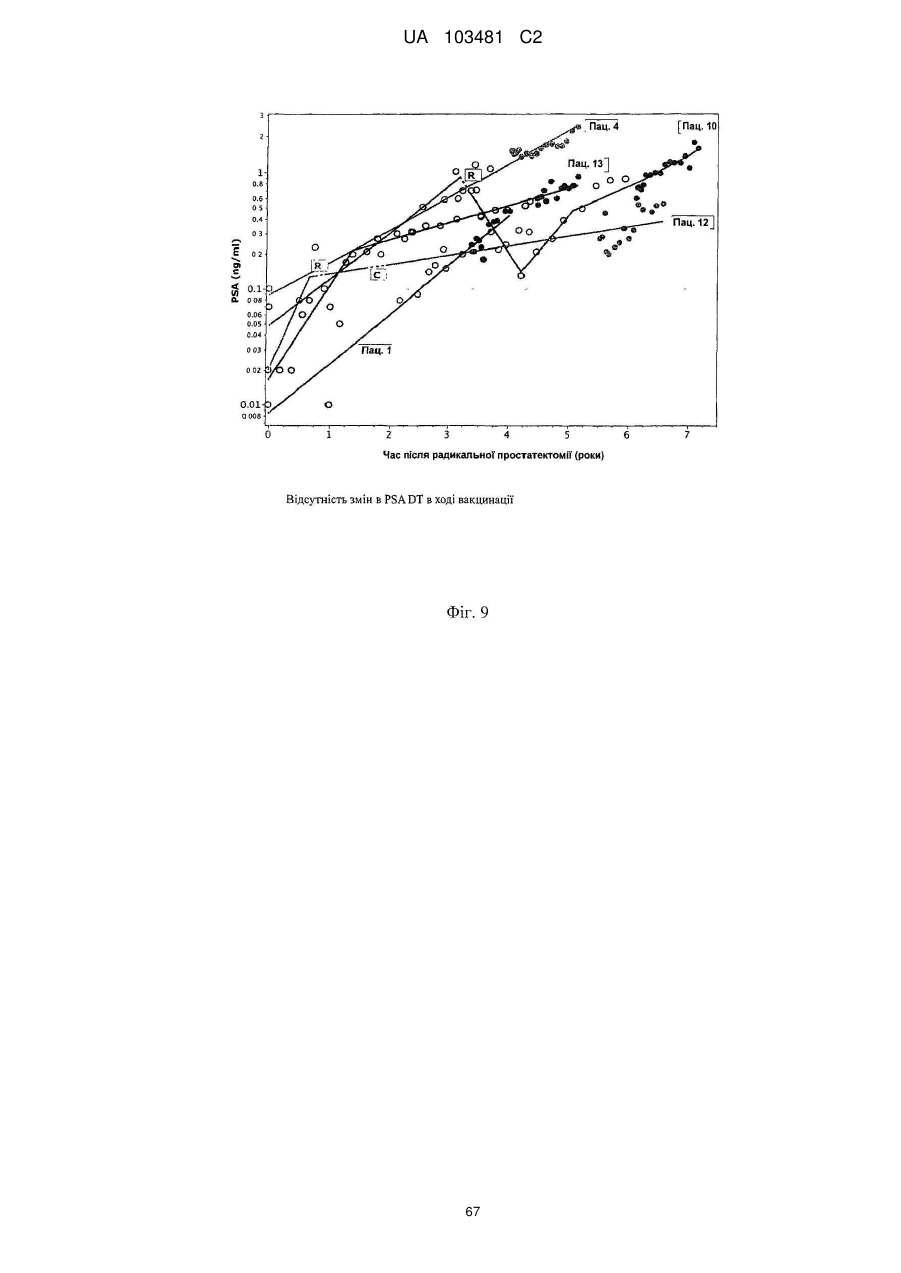
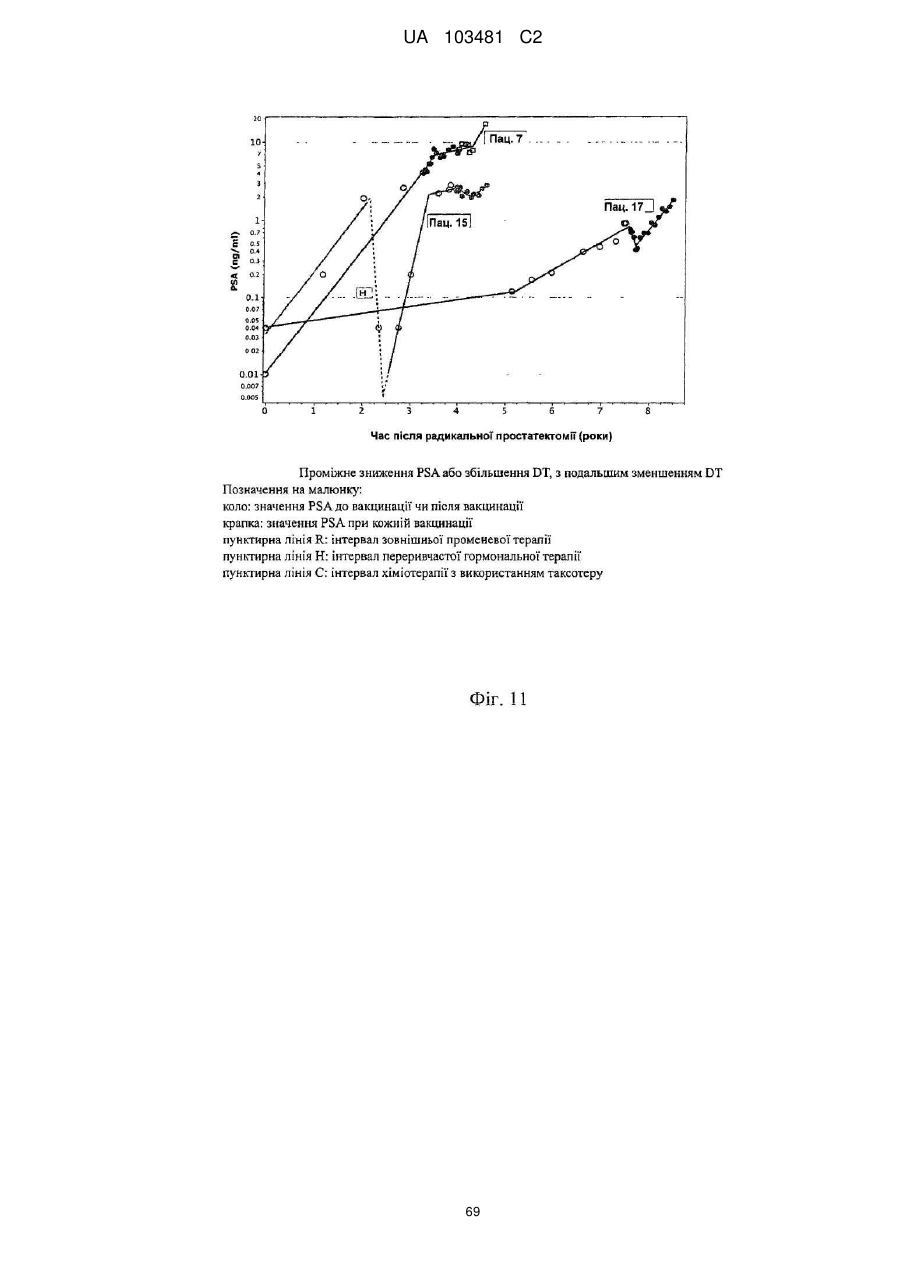
Одержані з сурвівіну пептиди, що мають здатність звязуватися з mhc класу ii
Номер патенту: 103481
Опубліковано: 25.10.2013
Автори: Левандровскій Петер, Штефанофік Штефан, Раммензеє Ханс-Георг, Гуттефанж Сесіль, Вайншенк Тоні
Формула / Реферат
1. Пептид, який складається з послідовності, яка вибирається з амінокислотних послідовностей SEQ ID NО: 1 (TLGEFLKLDRERAKN) та SEQ ID NО: 2 (ELTLGEFLKLDRERAKN).
2. Пептид за п. 1, в якому зазначений пептид з послідовністю SEQ ID NO: 1 здатний зв’язуватися з молекулою головного комплексу гістосумісності людини (МНС) класу II, і де зазначений пептид з послідовністю SEQ ID NO: 2 здатний зв’язуватися з молекулою головного комплексу гістосумісності людини (МНС) класу І і ІІ.
3. Пептид за п. 2, в якому зазначений пептид здатний стимулювати Т-клітини CD4 та CD8.
4. Злитий білок, що містить пептид за будь-яким з пп. 1-3, який, зокрема, містить N-кінцеві амінокислоти антигенасоційованого інваріантного ланцюга (Ii) HLA-DR.
5. Нуклеїнова кислота, що кодує пептид за пп. 1-4, або вектор експресії, здатний експресувати таку нуклеїнову кислоту.
6. Пептид за будь-яким з пп. 1-4 або нуклеїнова кислота або вектор експресії за п. 5 для використання в медицині.
7. Клітина-хазяїн, яка містить нуклеїнову кислоту або вектор експресії за п. 5, де зазначена клітина-хазяїн є переважно антигенпрезентуючою клітиною, зокрема дендритною клітиною або антигенпрезентуючою клітиною.
8. Спосіб одержання пептиду за будь-яким з пунктів 1-4, який включає культивування клітини-хазяїна за п. 7, що експресує нуклеїнову кислоту або вектор експресії за п. 5, та виділення пептиду з клітини-хазяїна або її культурального середовища.
9. Спосіб одержання активованих цитотоксичних Т-лімфоцитів (ЦТЛ) in vitro, що включає контактування ЦТЛ in vitro з антиген-навантаженими людськими МНС-молекулами класу І або ІІ, експресованими на поверхні відповідної антигенпрезентуючої клітини або штучної конструкції, що імітує антигенпрезентуючу клітину, в період часу, достатній для активації зазначених ЦТЛ антигенспецифічним способом, де зазначений антиген являє собою пептид за будь-яким з пп. 1-3.
10. Пептид за будь-яким з пп. 1-4, нуклеїнова кислота або вектор експресії за п. 5, клітина за п. 7 або активовані цитотоксичні Т-лімфоцити, одержані згідно з п. 9, для лікування раку, переважно у вигляді вакцини.
11. Пептид за п. 10, де зазначене ракове захворювання вибирається з групи: астроцитома, пілоцитна астроцитома, дисембріопластична нейроепітеліальна пухлина, олігодендрогліоми, епендимома, мультиформна гліобластома, змішані гліоми, олігоастроцитоми, медулобластома, ретинобластома, нейробластома, гермінома, тератома, гангліогліоми, гангліоцитома, центральна гангліоцитома, примітивні нейроектодермальні пухлини (PNET, наприклад, медулобластома, медулоепітеліома, нейробластома, ретинобластома, епендимобластома), пухлини пінеальної паренхіми (наприклад, пінеоцитома, пінеобластома), епендимальні клітинні пухлини, пухлини хороїдного сплетіння, нейроепітеліальні пухлини неясного походження (гліоматоз головного мозку, астробластома), гліобластома, рак простати, рак молочної залози, рак стравоходу, рак товстої кишки, колоректальний рак, гіпернефрома, світлоклітинний рак нирки, рак легенів, ЦНС, рак яєчників, меланома, рак підшлункової залози, плоскоклітинна карцинома, лейкемія та медулобластома, а також інші пухлини або види раку, які виявляють гіперекспресію сурвівіну.
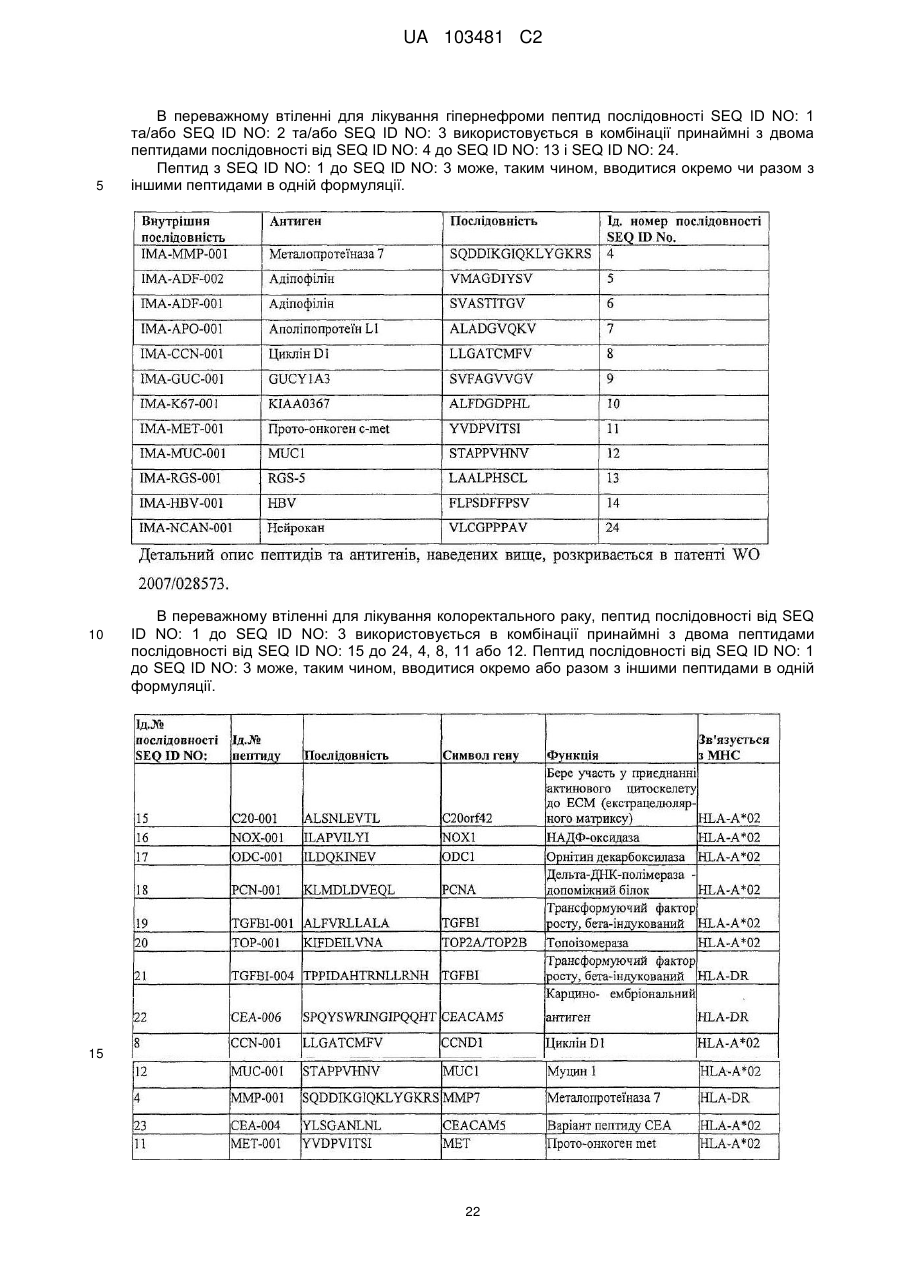
12. Пептид за п. 10 або 11, в комбінації з принаймні одним пептидом, який вибирається з групи, яка складається з пептидів згідно з SEQ ID NO: 4-13, для лікування раку нирок, або в комбінації з принаймні одним пептидом, який вибирається з групи, яка складається з пептидів згідно з SEQ ID NO: 4, 8, 11, 12 та 15-23, для лікування раку товстого кишечнику.
13. Набір, який включає:
(a) контейнер, який містить фармацевтичну композицію, що містить пептид за будь-яким з пп. 1-4, нуклеїнову кислоту або вектор експресії за п. 5, клітину за п. 7 або активовані цитотоксичні Т-лімфоцити за п. 9, в розчині або в ліофілізованій формі;
(b) необов’язково, другий контейнер, який містить розріджувач або відновлюючий розчин для ліофілізованого складу;
(c) необов’язково, принаймні один пептид, вибраний з групи, яка складається з пептидів відповідно до SEQ ID NO: 3-23, та
(d) необов’язково, інструкції з використання розчину і/або відновленого розчину і/або з використання ліофілізованого складу.
Текст
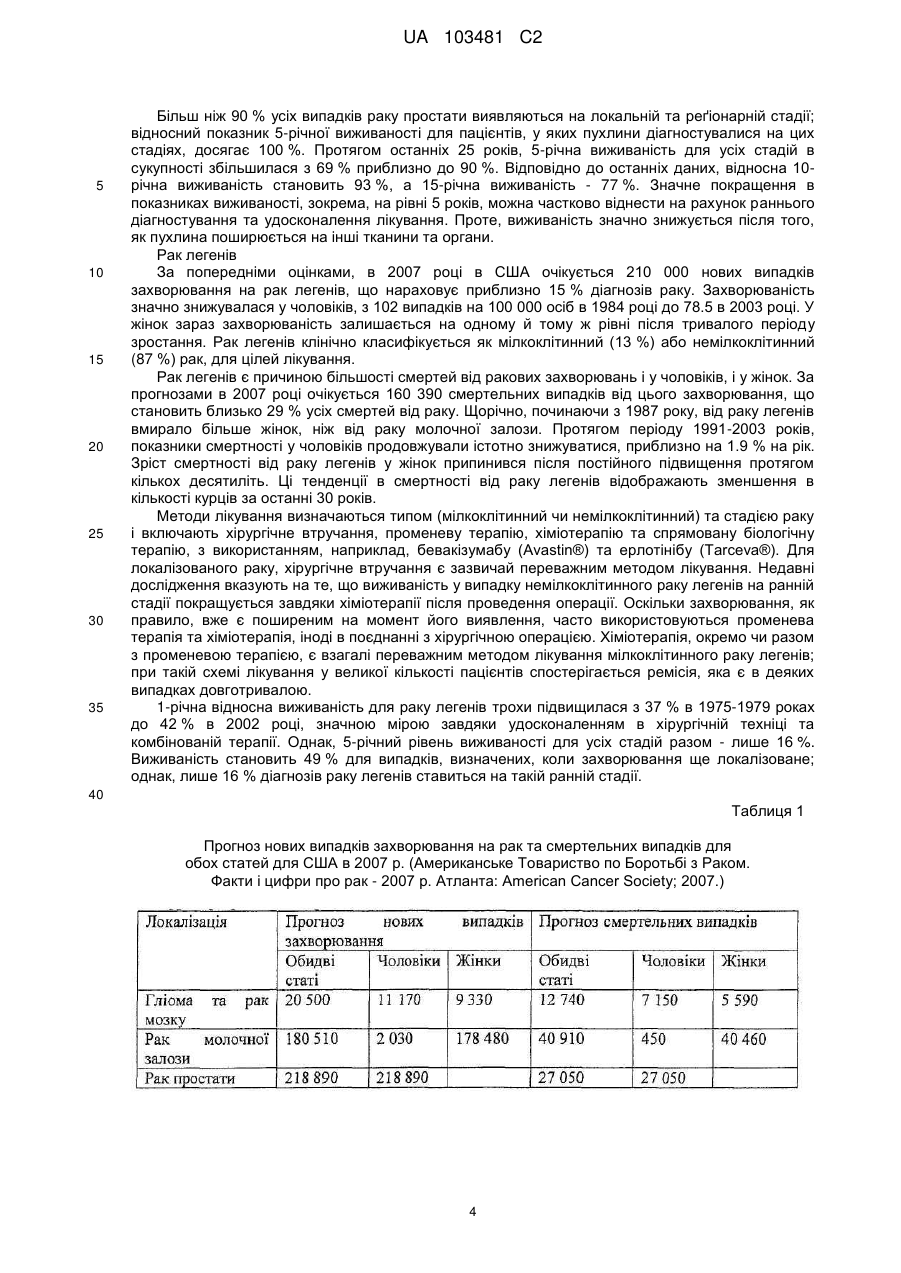
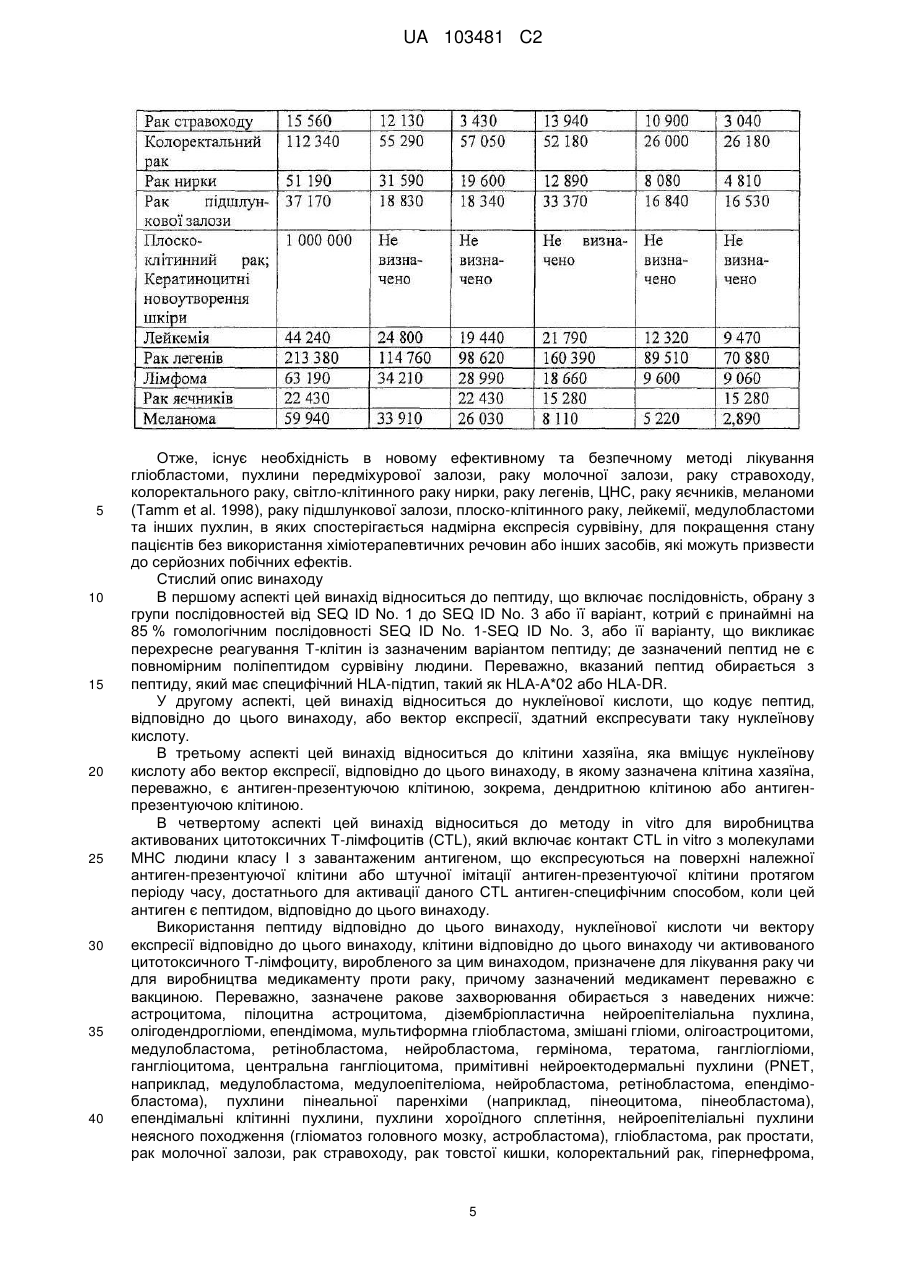
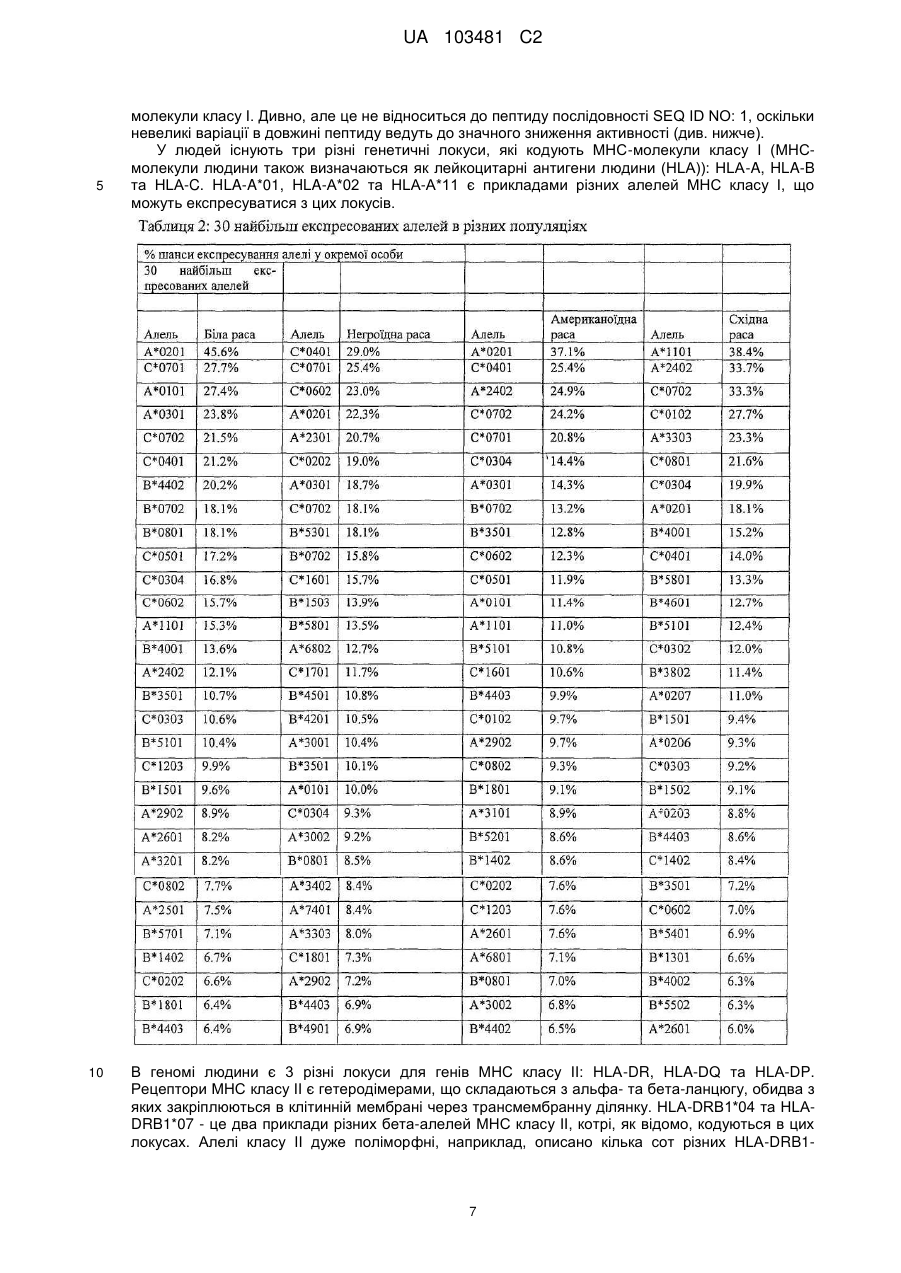
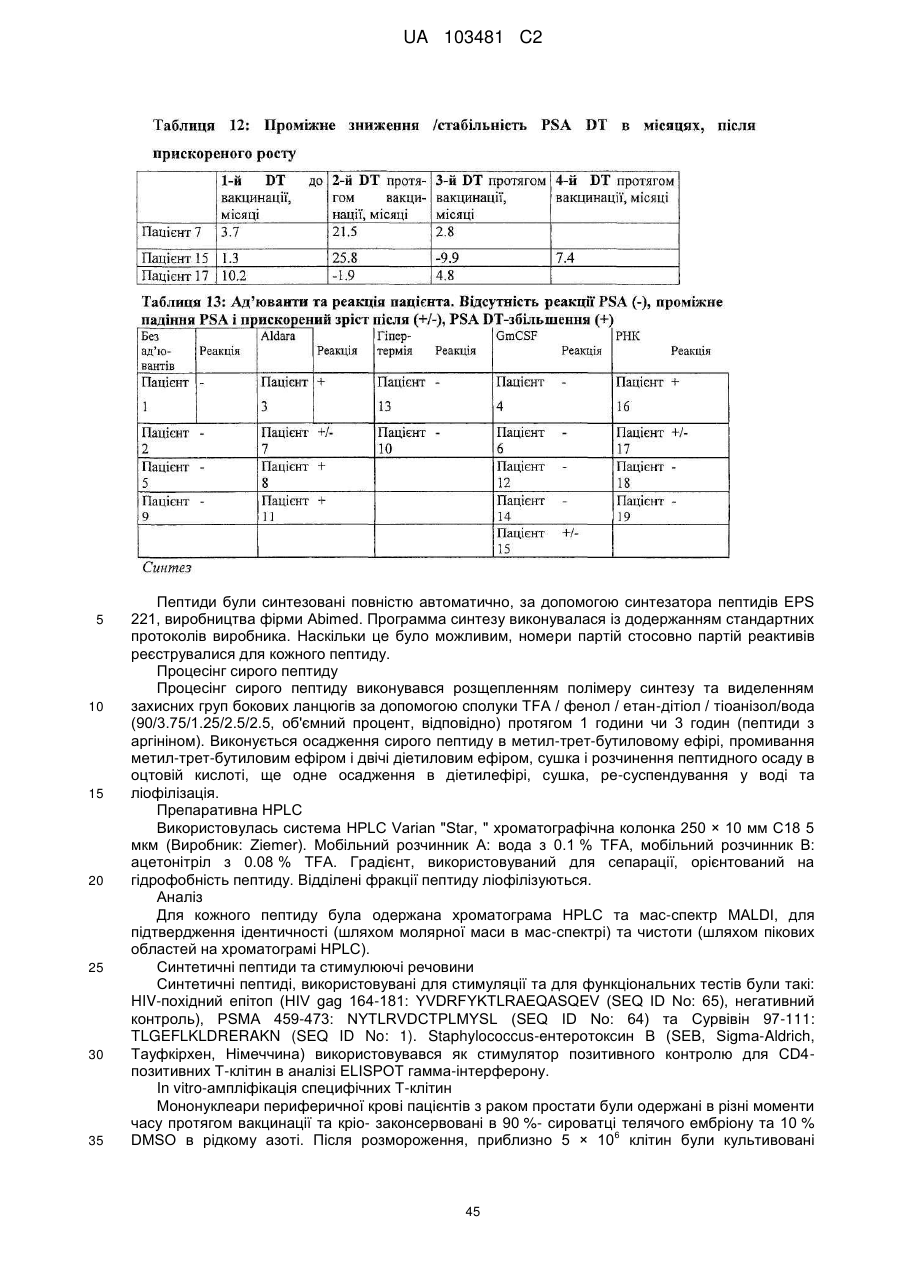
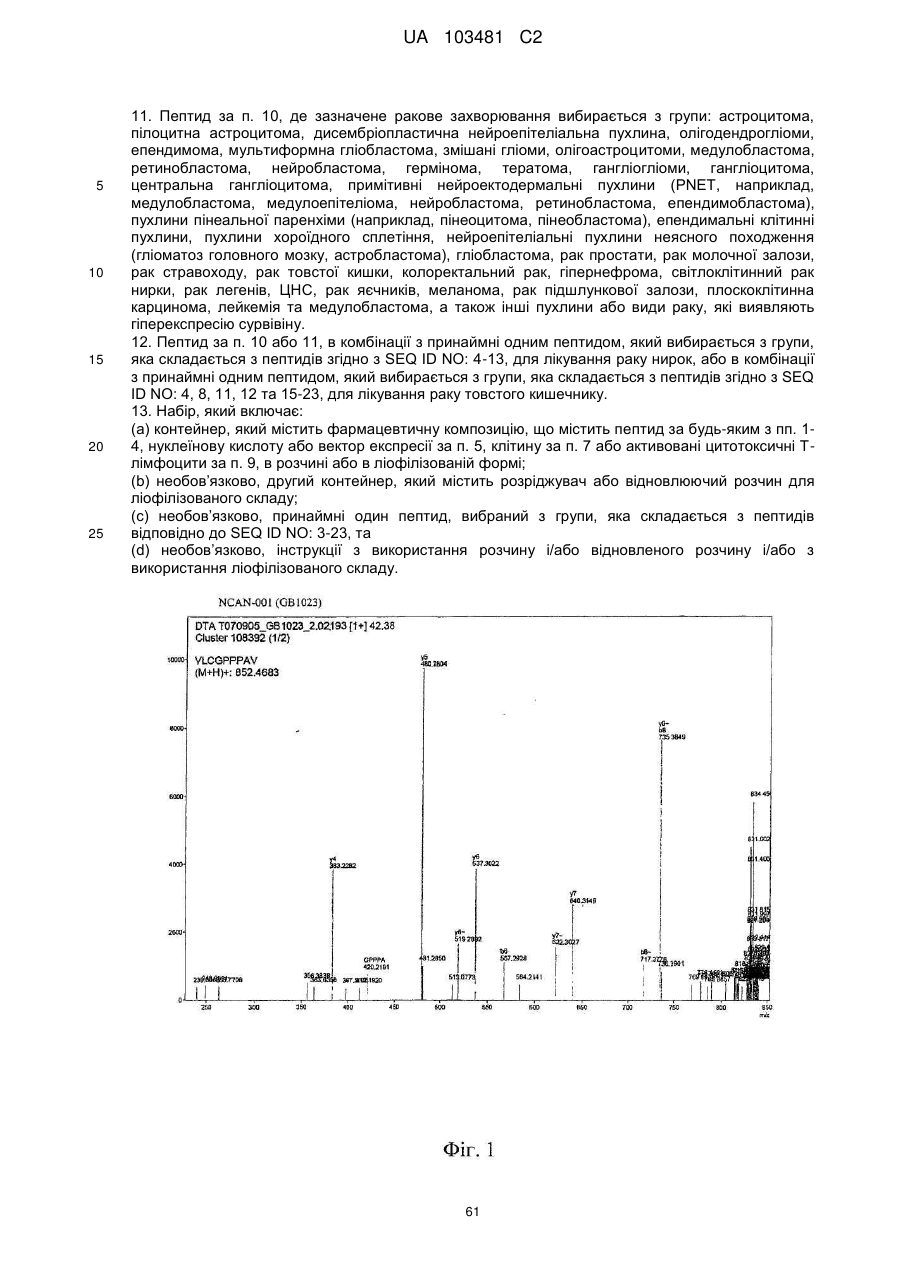
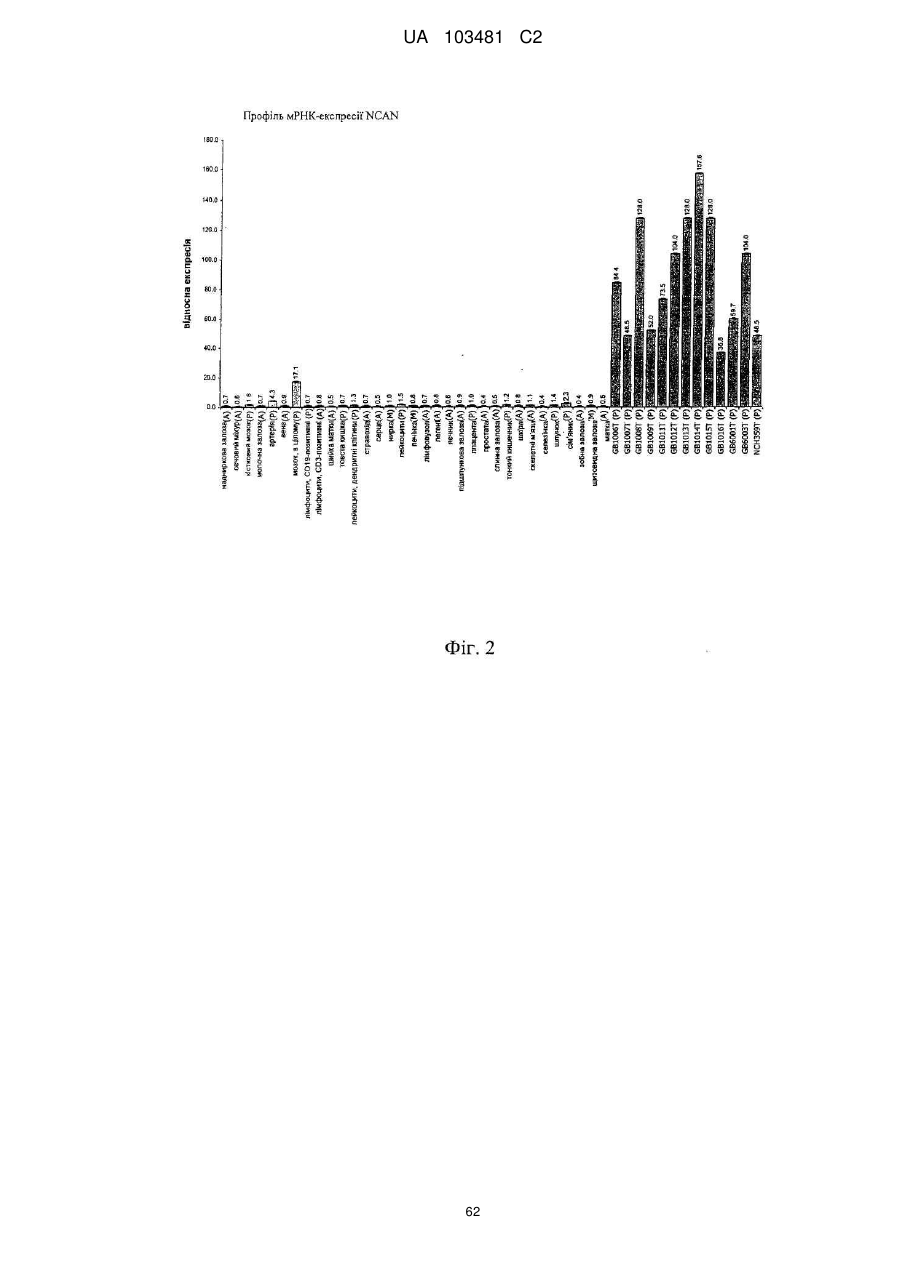
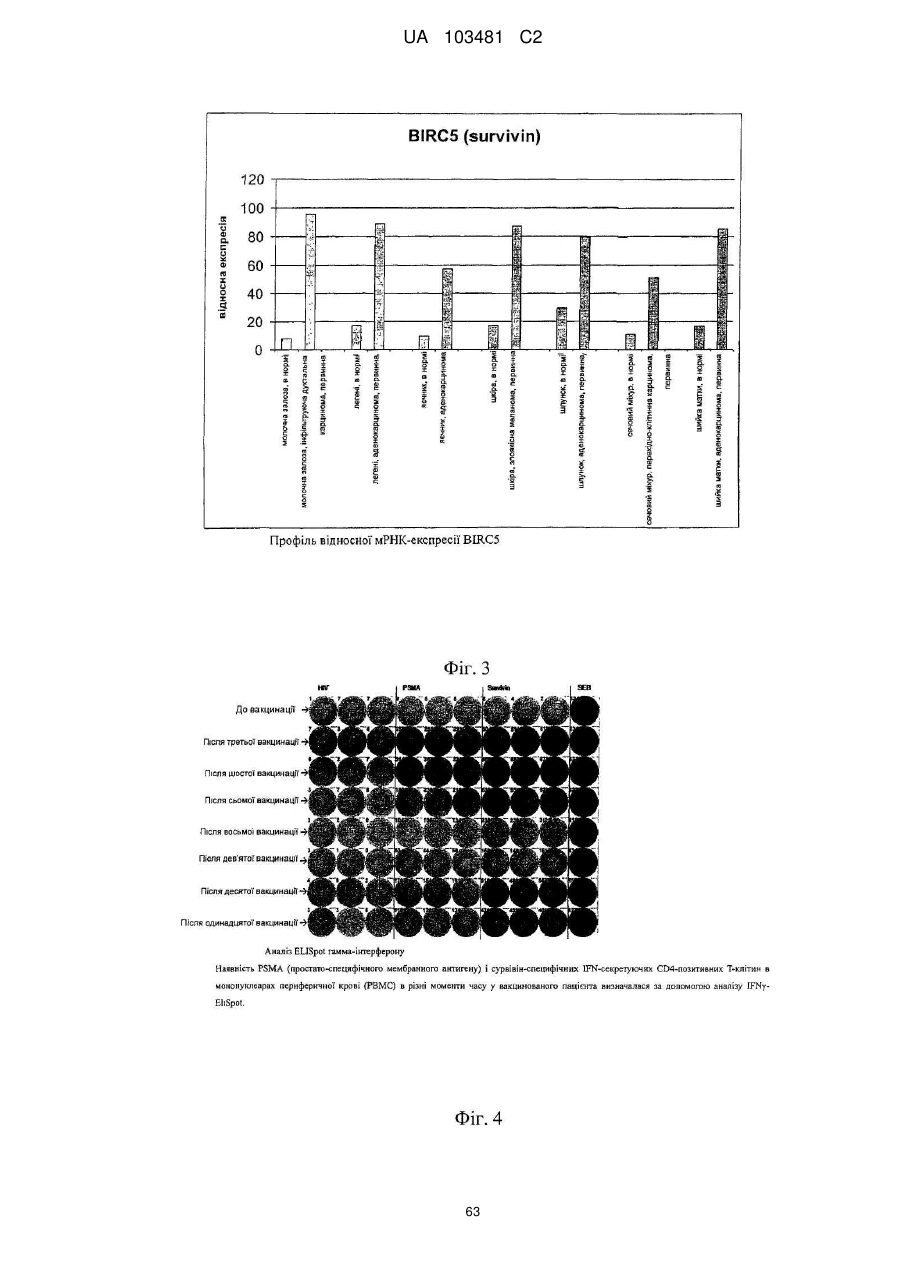
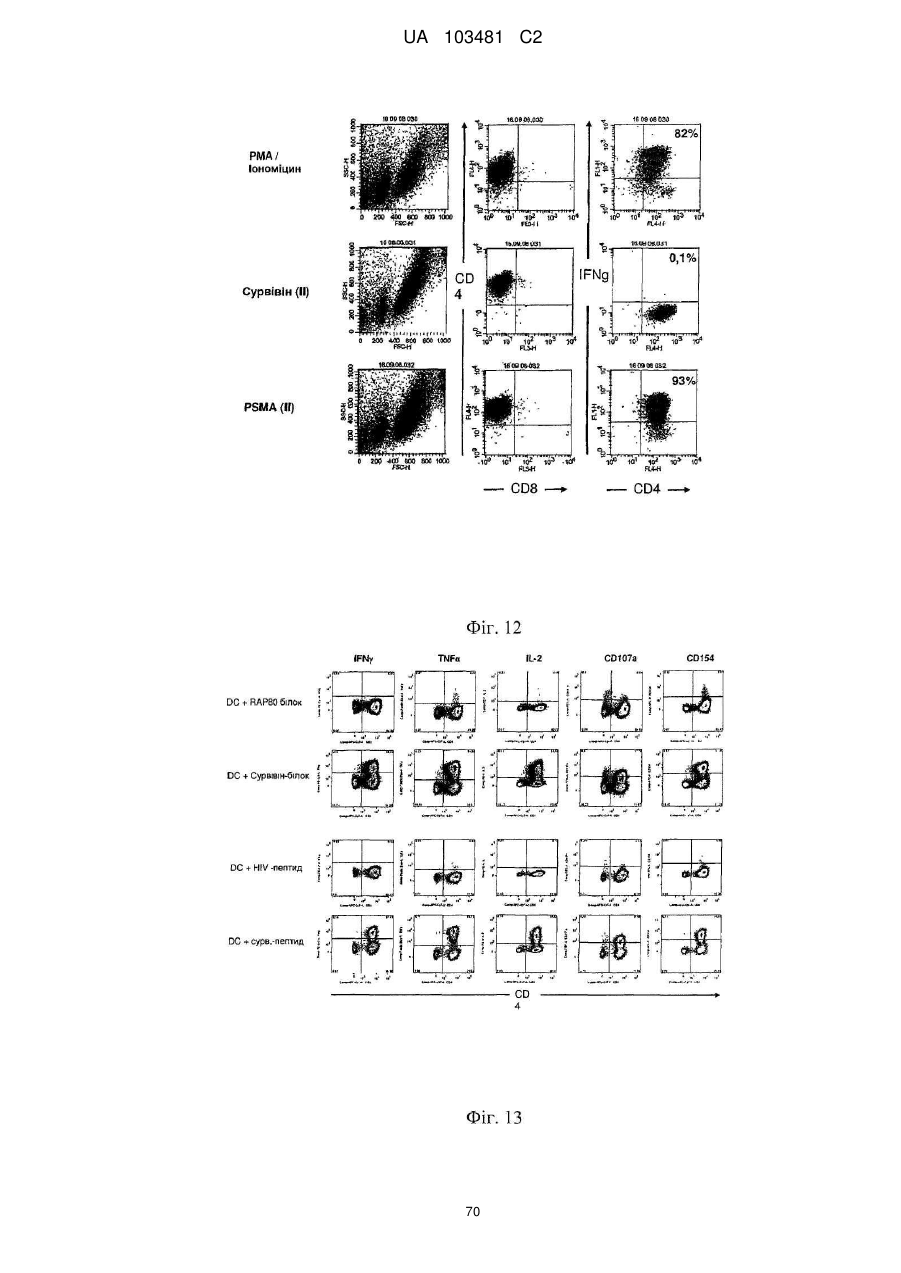
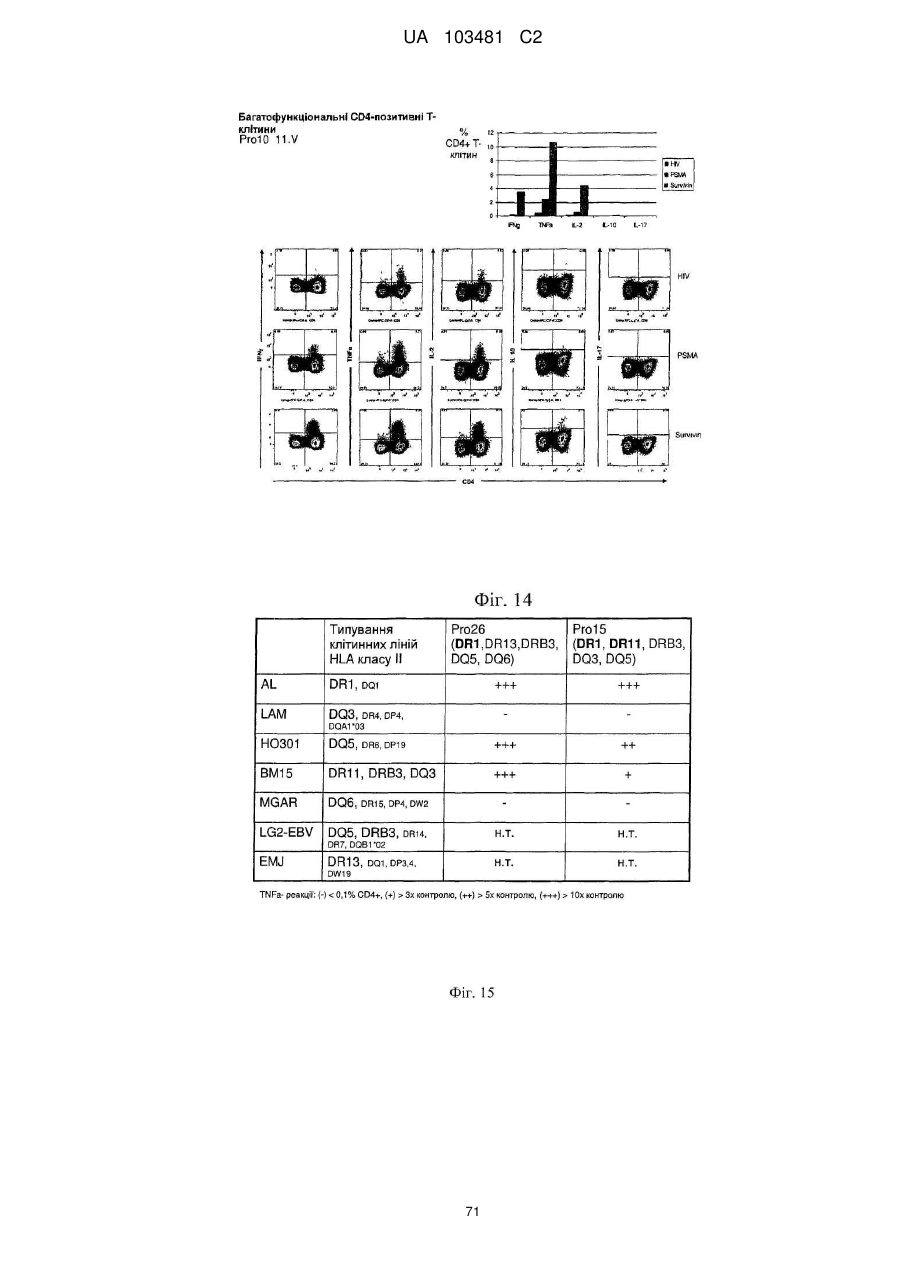
Реферат: UA 103481 C2 (12) UA 103481 C2 Винахід належить до пептиду, який здатний зв’язуватися з молекулою головного комплексу гістосумісності людини (МНС) І і ІІ, нуклеїнової кислоти і клітини-хазяїна для використання в медицині, зокрема для лікування раку. UA 103481 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід відноситься до пептидів, нуклеїнових кислот і клітин для використання в імунотерапевтичних методах. Зокрема, цей винахід стосується імунотерапії раку. Крім того, цей винахід відноситься до епітопів пухлино-асоційованих пептидів цитотоксичних Т-клітин (CTL), одержаних з сурвівіну, разом або в поєднанні з іншими пухлино-асоційованими пептидами, котрі служать активними фармацевтичними інгредієнтами композицій вакцин, стимулюючих протипухлинні імунні реакції. Цей винахід, головним чином, відноситься до трьох нових пептидних послідовностей та їхніх варіантів, одержаних з молекул HLA класу І і класу II пухлинних клітин людини, котрі можуть використовуватись в композиціях вакцин для викликання протипухлинних імунних реакцій. Рівень техніки Гліоми - це пухлини головного мозку, які мають походження з гліальних клітин у нервовій системі. Гліальні клітини, що зазвичай називаються нейроглія чи просто глія, є ненервовими клітинами, котрі забезпечують підтримку та харчування клітин, утримують гомеостаз, утворюють мієлін та беруть участь у передачі сигналів в нервовій системі. Двома найбільш важливими підгрупами гліом є астроцитоми та олігодендрогліоми, названі відповідно до типу нормальних гліальних клітин, з яких вони походять (астроцити або олігодендроцити, відповідно). Мультиформна гліобластома (далі іменується "гліобластома"), що належить до підгрупи астроцитом, є найбільш типовою злоякісною пухлиною мозку у дорослих людей і становить приблизно 40 % усіх злоякісних пухлин мозку та близько 50 % гліом (CBTRUS, 2006). Вона агресивно втручається у центральну нервову систему та відзначається найвищим рівнем злоякісності (клас IV) серед усіх гліом. Хоча є стабільний прогрес в лікуванні цього захворювання, завдяки досягненням в нейровізуалізації, мікрохірургії, різним варіантам лікування, наприклад, темозоломід чи опромінювання, гліобластоми залишаються невиліковними (Macdonald, 2001; Burton and Prados, 2000; Prados and Levin, 2000). Смертність від цієї пухлини мозку дуже висока: середня тривалість життя дорівнює від 9 до 12 місяців після першого діагнозу. 5-річна виживаність в період спостереження з 1986 по 1990 рік становила 8.0 %. На даний час, п'ятирічна виживаність після інвазивного лікування, включаючи повне видалення пухлини, все ж таки менше 10 % (Burton and Prados, 2000; Nieder et al., 2000; Napolitano et al., 1999; Dazzi et al., 2000). Відповідно, існує велика медична потреба в альтернативному та ефективному терапевтичному методі. Пухлинні клітини гліобластом є найбільш недиференційованими серед пухлин мозку, отже клітини пухлини мають великий потенціал міграції та проліферації і є високо інвазивними, що пояснює дуже несприятливий прогноз. Гліобластоми призводять до смерті внаслідок швидкого, агресивного та інфільтративного росту в мозку. Тип інфільтративного росту відповідає за нерезектабельний характер цих пухлин. Гліобластоми також відносно резистентні до опромінювання та хіміотерапії, і тому випадки рецидивів після курсу лікування є частими. Крім того, імунна реакція на неопластичні клітини є достатньо неефективною, з точки зору повного знищення усіх неопластичних клітин після хірургічного видалення та променевої терапії (Roth and Weller, 1999; Dix et al., 1999; Sablotzki et al., 2000). Гліобластоми розділяються на первинні гліобластоми (de novo) та вторинні гліобластоми, в залежності від різниці в генному механізмі протягом злоякісної трансформації недиференційованих астроцитів або гліальних прекурсорних клітин. Вторинна гліобластома зустрічається у людей віком до 45 років. Протягом, в середньому, 4-5 років вторинна гліобластома розвивається з астроцитоми більш низької злоякісності в недиференційовану астроцитому. І навпаки, первинна гліобластома, переважно, зустрічається у старших людей, з середнім віком 55 років. В цілому, первинна гліобластома є швидкоплинною гліобластомою, яка характеризується прогресуванням пухлини протягом 3 місяців з того стану, коли не виявлено ніяких клінічних або патологічних аномалій (Pathology and Genetics of the Nervous Systems. 2939 (IARC Press, Lyon, France, 2000)). Гліобластома мігрує по мієлінованих нервах та широко розповсюджується в центральній нервовій системі. В більшості випадків хірургічне втручання має лише обмежений тривалий терапевтичний ефект (Neurol. Med, . Chir. (Tokyo) 34, 91-94, 1994; Neurol. Med.Chir. (Tokyo) 33, 425-458, 1993; Neuropathology 17, 186-188, 1997) (Macdonald, 2001; Prados and Levin, 2000). Клітини злоякісної гліоми уникають детекції імунною системою хазяїна, оскільки вони генерують імуно-супресивні речовини, що погіршують проліферацію Т-клітин і виробництво імуно-стимулюючого цитокіну IL-2 (Dix et al., 1999). Внутрішньочерепні неоплазми можуть виникати з будь-яких конструкцій чи типів клітин, присутніх в ЦНС, включаючи мозок, м'які мозкові оболонки, гіпофіз, череп і навіть залишкові ембріональні тканини. Загальна щорічна захворюваність на первинні пухлини мозку в Сполучених Штатах становить 14 випадків на 100 000 людей. Найбільш типовими первинними 1 UA 103481 C2 5 10 15 20 25 30 35 40 45 50 55 пухлинами мозку є менінгіоми, які представляють 27 % від усіх первинних пухлин мозку, та гліобластоми - 23 % ві д усіх первинних пухлин мозку (в той час як гліобластоми нараховують 40 % злоякісних пухлин мозку у дорослих). Більшість з цих пухлин мають агресивну дію та високу злоякісність. Первинні пухлини мозку - найбільш розповсюджені солідні пухлини у дітей, і вони є второю найчастішою причиною смерті від раку у дітей, після лейкемії. Пошук ефективних методів лікування гліобластом у пацієнтів все ще триває. Ведуться дослідження в галузі імунотерапії, або лікування із залученням імунної системи, у боротьбі з цими неопластичними клітинами. Перші багатообіцяючі результати були отримані компанією Northwest Therapeutics при використанні препарату "DCVax Brain" для лікування гліобластоми в імунотерапевтичних дослідженнях у людей, коли індукувалися антиген-специфічні реакції CTL, що вели до тривалої середньої виживаності, в порівнянні з результатом застосування стандартного лікування, та супроводжувалися мінімальною токсичністю (Heimberger et al., 2006). Колоректальна карцинома Згідно із даними Американського Товариства по Боротьбі з Раком, колоректальний рак (CRC) є третім з найбільш розповсюджених видів раку в СІЛА, на який захворюють більш ніж 175 000 нових пацієнтів кожного року. В США, Японії, Франції, Німеччині, Італії, Іспанії та Великобританії він уражає більш ніж 480 000 людей. Колоректальний рак є однією з найчастіших причин смертності від раку в розвинених країнах. Відносна виживаність протягом 1 року та 5 років для осіб з колоректальним раком становить 84 % та 64 %, відповідно. По закінченні 5 років виживаність продовжує знижуватись -до 57 % через 10 років після постановки діагнозу. Коли захворювання на колоректальний рак визначаються на ранній, локалізованій стадії, 5-річна виживаність дорівнює 90 %; однак, лише 39 % випадків колоректального раку діагностується на цьому етапі, переважно, внаслідок недостатнього скринінгу. Після регіонального розповсюдження раку, коли він уражає сусідні органи чи лімфовузли, виживаність протягом п'яти років падає до 68 %. У осіб з віддаленими метастазами 5-річна виживаність становить 10 %. Дослідження показують ймовірність виникнення колоректального раку як результату взаємодії між успадкованими факторами та впливом зовнішнього середовища. В більшості випадків, попередниками колоректальних пухлин вважаються аденоматозні поліпи; однак, переродження може тривати багато років. Основним фактором ризику колоректального раку є вік, оскільки 90 % випадків захворювання діагностуються у людей старше 50 років. Інші фактори ризику колоректального раку, за даними Американського Товариства по Боротьбі з Раком, включають вживання алкоголю, раціон харчування з великим вмістом жирів та/або червоного м'яса і недостатнім вживанням фруктів та овочів. Захворюваність продовжує зростати, зокрема, в таких регіонах, як Японія, де це може бути обумовлено переходом на західний стиль харчування, з надмірною кількістю жирів та м'яса в раціоні та зменшенням вживання харчових волокон. Однак, частота захворювань зростає не настільки швидко, як раніше, і це може бути обумовлено більш активним скринінгом та видаленням поліпів, що запобігає переродженню поліпів на рак. Як і у відношенні більшості солідних пухлин, терапією першого ряду є хірургічне втручання, однак, його переваги обмежуються ранніми стадіями захворювання, в той час як у значної частини пацієнтів діагностується запущена стадія. Стандартом лікування прогресуючого колоректального раку є режими хіміотерапії, які базуються на схемах з використанням фторурацила. Більшість таких режимів - це так звані схеми FOLFOX (інфузійне введення 5фторурацилу/лейковоріну плюс оксаліплатін) та FOLFIRI (ірінотекан, лейковорін, бюлюсне і тривале інфузійне введення 5-FU). Введення цитотоксичних препаратів третього покоління, таких як ірінотекан та оксаліплатін, збільшило надію на значне підвищення ефективності лікування, але прогноз все ще відносно несприятливий, і виживаність, в цілому, залишається на рівні приблизно 20 місяців при наявності метастаз, отже, незадоволені потреби стосовно лікування цієї хвороби поки що є високими. Останнім часом з'явилося нове покоління медикаментів, що діють цілеспрямовано на молекулярному рівні, таких як Avastin (бевакізумаб) та Erbitux (цетуксімаб), і близько 40 сполук знаходяться на завершальному етапі клінічної розробки для різних стадій колоректального раку. Комбінації декількох з цих сполук збільшують кількість потенційних варіантів терапії, які очікуються в майбутньому. Переважна більшість речовин є у фазі II, причому на EGFR (рецептори епідермального фактора росту) ці сполуки діють частіше, ніж будь-які інші ліки, розроблені для колоректального раку, і це обумовлено фактом, що приблизно у 80 % хворих на колоректальний рак експресія EGFR підвищується. 2 UA 103481 C2 5 10 15 20 25 30 35 40 45 50 55 60 Зараз проводяться клінічні дослідження пацієнтів з II стадією захворювання, з поєднанням хіміотерапії та недавно ухвалених моноклональних антитіл (mAbs) (цетуксімаб + ірінотекан або FOLFOX4; бевакізумаб як одиночний препарат або разом з FOLFOX4). Очікується, що період спостережень для одержання статистично значимих результатів цих досліджень становитиме від трьох до чотирьох років. Моноклональні антитіла (mAbs), які на даний час використовуються в онкології, в цілому мають прекрасні шанси щодо їхнього використання без втручання в активну імунотерапію. Фактично, були одержані доклінічні дані (GABRILOVICH 1999) та клінічні докази, які свідчать про те, що зниження експресії VEGF (фактору росту ендотелія судин) (за допомогою бевакізумабу) позитивно впливає на активацію Т-клітин, опосередковану DC (дендритними клітинами) (Osada T, Chong G, Tansik R, Hong T, Spector N, Kumar R, Hurwitz HI, Dev I, Nixon AB, Lyerly HK, Clay T, Morse MA. The effect of anti-VEGF therapy on immature myeloid cell and dendritic cells in cancer patients. Cancer Immunol Immunother. 2008 Jan 10.). Рак простати та інші пухлини Рак простати (рак передміхурової залози) є основною причиною смерті від раку у чоловіків: за наявними оцінками, в 2007 році було зареєстровано 27 050 смертельних випадків від цієї хвороби. Хоча з початку 1990-х років смертність серед білих чоловіків та афроамериканців знижувалася, показники смертності у афроамериканців залишаються більш ніж в два рази вищими, ніж у білих чоловіків. Рак простати - це найчастіше діагностований вид раку у чоловіків. За невиясненими до цього часу причинами, захворюваність у афроамериканців значно більша, ніж у білих. Показники захворюваності на рак простати значно змінилися за останні 20 років: із швидким збільшенням за період 1988-1992 років, різким спадом в 1992-1995 роках, та помірним ростом з 1995 році. Ці тенденції, значною мірою, відображають покращення скринінгу раку простати з аналізом крові для визначення рівня простато-специфічного антигену (PSA). Помірний зріст випадків захворювання за останнє десятиріччя, скоріше за все, пояснюється широко поширеним PSA-скринінгом серед чоловіків, молодших 65 років. Показники частоти захворювання на рак простати вирівнялися у чоловіків віком 65 років і більше. Захворюваність досягла піку у білих чоловіків в 1992 році (237.6 на 100 000 осіб) та афроамериканців у 1993 році (342.8 на 100 000 осіб). Лікування раку простати може включати пильне спостереження, хірургічне втручання, променеву терапію, терапію Високо-інтенсивним Фокусованим Ультразвуком (HIFU), хіміотерапію, кріохірургію, гормональну терапію або комбінацію деяких з цих методів. Вибір варіанту лікування залежить від стадії захворювання, індексу Глісона та рівня PSA. Іншими важливими факторами є вік чоловіка, загальний стан його здоров'я та відношення до потенційного лікування і можливих побічних ефектів. Оскільки будь-яке лікування може мати серйозні побічні ефекти, такі як, еректильна дисфункція та недержання сечі, обговорення методу лікування часто зосереджені на досягненні балансу між задачами терапії та ризиками змін у стилі життя. Якщо рак поширюється за межі передміхурової залози, варіанти лікування значно змінюються, оскільки більшість лікарів, котрі займаються терапією раку передміхурової залози, використовують різні номограми для прогнозування ймовірності поширення. Лікування пильним спостереженням, HIFU, променевою терапією, кріохірургією та хірургічним втручанням взагалі пропонуються чоловікам, у яких рак залишається в межах передміхурової залози. Гормональна терапія та хіміотерапія часто призначаються у випадку захворювання, котре поширюється за межі передміхурової залози. Однак, є й винятки: променева терапія може використовуватись для деяких запущених пухлин, а гормональна терапія - для певних випадків пухлин на ранній стадії. Кріотерапія, гормональна терапія та хіміотерапія також можуть пропонуватись, якщо первісний варіант лікування не дає результату, і рак прогресує. У значної кількості пацієнтів, хворих на рак простати, які перенесли радикальну простатектомію внаслідок клінічно очікуваного росту, обмеженого ураженим органом, заключний гістологічний аналіз хірургічної проби показує локальне екстенсивне поширення пухлини за межі органу. У цих пацієнтів відзначається високий ризик ранніх місцевих рецидивів, що, як правило, можуть бути виявлені як підвищений рівень PSA, тобто, біохімічний рецидив. Можливі методи лікування в цьому випадку включають дистанційну променеву терапію та гормон- пригнічувальну терапію; однак, цінність таких терапевтичних підходів, зокрема, для подовження тривалого виживання пацієнта, не може вважатися доказаним. Крім того, треба враховувати можливі ускладнення, пов'язані з лікуванням, такі як розвиток звуження уретри (променева терапія), втрата лібідо та імпотенція, ризик зменшення солей кальцію в костях скелету, що проявляється як остеопороз, та помітно збільшений ризик патологічних переломів костей (при гормон-пригнічувальній терапії). 3 UA 103481 C2 5 10 15 20 25 30 35 Більш ніж 90 % усіх випадків раку простати виявляються на локальній та реґіонарній стадії; відносний показник 5-річної виживаності для пацієнтів, у яких пухлини діагностувалися на цих стадіях, досягає 100 %. Протягом останніх 25 років, 5-річна виживаність для усіх стадій в сукупності збільшилася з 69 % приблизно до 90 %. Відповідно до останніх даних, відносна 10річна виживаність становить 93 %, а 15-річна виживаність - 77 %. Значне покращення в показниках виживаності, зокрема, на рівні 5 років, можна частково віднести на рахунок раннього діагностування та удосконалення лікування. Проте, виживаність значно знижується після того, як пухлина поширюється на інші тканини та органи. Рак легенів За попередніми оцінками, в 2007 році в США очікується 210 000 нових випадків захворювання на рак легенів, що нараховує приблизно 15 % діагнозів раку. Захворюваність значно знижувалася у чоловіків, з 102 випадків на 100 000 осіб в 1984 році до 78.5 в 2003 році. У жінок зараз захворюваність залишається на одному й тому ж рівні після тривалого періоду зростання. Рак легенів клінічно класифікується як мілкоклітинний (13 %) або немілкоклітинний (87 %) рак, для цілей лікування. Рак легенів є причиною більшості смертей від ракових захворювань і у чоловіків, і у жінок. За прогнозами в 2007 році очікується 160 390 смертельних випадків від цього захворювання, що становить близько 29 % усіх смертей від раку. Щорічно, починаючи з 1987 року, від раку легенів вмирало більше жінок, ніж від раку молочної залози. Протягом періоду 1991-2003 років, показники смертності у чоловіків продовжували істотно знижуватися, приблизно на 1.9 % на рік. Зріст смертності від раку легенів у жінок припинився після постійного підвищення протягом кількох десятиліть. Ці тенденції в смертності від раку легенів відображають зменшення в кількості курців за останні 30 років. Методи лікування визначаються типом (мілкоклітинний чи немілкоклітинний) та стадією раку і включають хірургічне втручання, променеву терапію, хіміотерапію та спрямовану біологічну терапію, з використанням, наприклад, бевакізумабу (Avastin®) та ерлотінібу (Tarceva®). Для локалізованого раку, хірургічне втручання є зазвичай переважним методом лікування. Недавні дослідження вказують на те, що виживаність у випадку немілкоклітинного раку легенів на ранній стадії покращується завдяки хіміотерапії після проведення операції. Оскільки захворювання, як правило, вже є поширеним на момент його виявлення, часто використовуються променева терапія та хіміотерапія, іноді в поєднанні з хірургічною операцією. Хіміотерапія, окремо чи разом з променевою терапією, є взагалі переважним методом лікування мілкоклітинного раку легенів; при такій схемі лікування у великої кількості пацієнтів спостерігається ремісія, яка є в деяких випадках довготривалою. 1-річна відносна виживаність для раку легенів трохи підвищилася з 37 % в 1975-1979 роках до 42 % в 2002 році, значною мірою завдяки удосконаленням в хірургічній техніці та комбінованій терапії. Однак, 5-річний рівень виживаності для усіх стадій разом - лише 16 %. Виживаність становить 49 % для випадків, визначених, коли захворювання ще локалізоване; однак, лише 16 % діагнозів раку легенів ставиться на такій ранній стадії. 40 Таблиця 1 Прогноз нових випадків захворювання на рак та смертельних випадків для обох статей для США в 2007 р. (Американське Товариство по Боротьбі з Раком. Факти і цифри про рак - 2007 р. Атланта: American Cancer Society; 2007.) 4 UA 103481 C2 5 10 15 20 25 30 35 40 Отже, існує необхідність в новому ефективному та безпечному методі лікування гліобластоми, пухлини передміхурової залози, раку молочної залози, раку стравоходу, колоректального раку, світло-клітинного раку нирки, раку легенів, ЦНС, раку яєчників, меланоми (Tamm et al. 1998), раку підшлункової залози, плоско-клітинного раку, лейкемії, медулобластоми та інших пухлин, в яких спостерігається надмірна експресія сурвівіну, для покращення стану пацієнтів без використання хіміотерапевтичних речовин або інших засобів, які можуть призвести до серйозних побічних ефектів. Стислий опис винаходу В першому аспекті цей винахід відноситься до пептиду, що включає послідовність, обрану з групи послідовностей від SEQ ID No. 1 до SEQ ID No. 3 або її варіант, котрий є принаймні на 85 % гомологічним послідовності SEQ ID No. 1-SEQ ID No. 3, або її варіанту, що викликає перехресне реагування Т-клітин із зазначеним варіантом пептиду; де зазначений пептид не є повномірним поліпептидом сурвівіну людини. Переважно, вказаний пептид обирається з пептиду, який має специфічний HLA-підтип, такий як HLA-A*02 або HLA-DR. У другому аспекті, цей винахід відноситься до нуклеїнової кислоти, що кодує пептид, відповідно до цього винаходу, або вектор експресії, здатний експресувати таку нуклеїнову кислоту. В третьому аспекті цей винахід відноситься до клітини хазяїна, яка вміщує нуклеїнову кислоту або вектор експресії, відповідно до цього винаходу, в якому зазначена клітина хазяїна, переважно, є антиген-презентуючою клітиною, зокрема, дендритною клітиною або антигенпрезентуючою клітиною. В четвертому аспекті цей винахід відноситься до методу in vitro для виробництва активованих цитотоксичних Т-лімфоцитів (CTL), який включає контакт CTL in vitro з молекулами МНС людини класу І з завантаженим антигеном, що експресуються на поверхні належної антиген-презентуючої клітини або штучної імітації антиген-презентуючої клітини протягом періоду часу, достатнього для активації даного CTL антиген-специфічним способом, коли цей антиген є пептидом, відповідно до цього винаходу. Використання пептиду відповідно до цього винаходу, нуклеїнової кислоти чи вектору експресії відповідно до цього винаходу, клітини відповідно до цього винаходу чи активованого цитотоксичного Т-лімфоциту, виробленого за цим винаходом, призначене для лікування раку чи для виробництва медикаменту проти раку, причому зазначений медикамент переважно є вакциною. Переважно, зазначене ракове захворювання обирається з наведених нижче: астроцитома, пілоцитна астроцитома, дізембріопластична нейроепітеліальна пухлина, олігодендрогліоми, епендімома, мультиформна гліобластома, змішані гліоми, олігоастроцитоми, медулобластома, ретінобластома, нейробластома, гермінома, тератома, гангліогліоми, гангліоцитома, центральна гангліоцитома, примітивні нейроектодермальні пухлини (PNET, наприклад, медулобластома, медулоепітеліома, нейробластома, ретінобластома, епендімобластома), пухлини пінеальної паренхіми (наприклад, пінеоцитома, пінеобластома), епендімальні клітинні пухлини, пухлини хороїдного сплетіння, нейроепітеліальні пухлини неясного походження (гліоматоз головного мозку, астробластома), гліобластома, рак простати, рак молочної залози, рак стравоходу, рак товстої кишки, колоректальний рак, гіпернефрома, 5 UA 103481 C2 5 10 15 20 25 30 35 40 45 50 55 світло-клітинний рак нирки, рак легенів, ЦНС, рак яєчників, меланома, рак підшлункової залози, плоско-клітинний рак, лейкемія та медулобластома, а також інші пухлини або види раку, що характеризуються підвищеною експресію сурвівіну. Цей винахід включає комплект у такому складі: (а) контейнер, який вміщує фармацевтичну композицію, що включає пептид, відповідно до цього винаходу, нуклеїнову кислоту чи вектор експресії, відповідно до цього винаходу, клітину, відповідно до цього винаходу, або активований цитотоксичний Т-лімфоцит, відповідно до цього винаходу, в розчині або в ліофілізованій формі; (b) додатково, другий контейнер, який вміщує розріджувач або відновлюючий розчин для ліофілізованої формуляції; (с) додатково, принаймні, один пептид, обраний з групи, яка складається з пептидів, відповідно до послідовності SEQ ID NOs 4-24, та (d) додатково, інструкції по використанню розчину та/або відновленню та/або використанню ліофілізованої формуляції. Пропонується метод виробництва рекомбінантного антитіла, що специфічно зв'язується з класом І чи II головного комплексу гістосумісності людини (МНС), в комплексі з HLA-обмеженим антигеном, який включає: імунізацію клітин нелюдиноподібних ссавців, які розроблені шляхом генної інженерії та експресують зазначений головний комплекс гістосумісності людини (МНС) класу І чи II з розчинною формою молекули МНС клас у І чи II, в комплексі з зазначеним HLAобмеженим антигеном; виділення молекул мРНК з клітин, продукуючих антитіло, зазначеного нелюдиноподібного ссавця; створення бібліотеки фагового дисплея, що демонструє кодування молекул білку зазначеними молекулами мРНК; та виділення принаймні одного фагу з наведеної вище бібліотеки фагового дисплея, причому принаймні один такий фат буде показувати специфічний зв'язок зазначеного антитіла з вказаним класом І чи II головного комплексу гістосумісності людини (МНС), в комплексі з зазначеним HLA-обмеженим антигеном. Антитіло, що специфічно зв'язується з класом І чи II головного комплексу гістосумісності людини (МНС), в комплексі з HLA-обмеженим антигеном, переважно, є поліклональним антитілом, моноклональним антитілом та/або химерним антитілом. Детальний опис винаходу Термін "пептид" використовується тут для визначення ряду амінокислотних залишків, з'єднаних один з одним, як правило, пептидними зв'язками між альфа-аміно- та та карбонільною групами суміжних амінокислот. Зазвичай пептиди мають довжину 9 амінокислот, але можуть мати довжину лише 8 амінокислот чи досягати довжини 16 амінокислот. Термін "олігопептид" використовується тут для визначення ряду амінокислотних залишків, з'єднаних один з одним, як правило, пептидними зв'язками між альфа-аміно-та карбонільною групами суміжних амінокислот. Довжина олігопептиду не є критичною для винаходу, якщо в ньому вміщені належний епітоп чи епітопи. Олігопептиди, як правило, за довжиною є меншими, ніж приблизно 30 амінокислот, та більшими, ніж приблизно 14 амінокислот. Термін "поліпептид" означає ряд амінокислотних залишків, з'єднаних один з одним, як правило, пептидними зв'язками між альфа-аміно- та карбонільною групами суміжних амінокислот. Довжина поліпептиду не є критичною для винаходу, якщо він вміщує належні епітопи. На відміну від термінів "пептид" чи "олігопептид", термін "поліпептид" вживається для визначення молекул, які вміщують більш ніж приблизно 30 амінокислотних залишків. Пептид, олігопептид, білок чи полінуклеотид, що кодує таку молекулу, є "імуногенним" (тобто, "імуногеном" в рамках цього винаходу), якщо він здатний індукувати імунну реакцію. У випадку цього винаходу, імуногенність більш специфічно визначена як здатність індукувати Тклітинну реакцію. Отже, "імуноген" буде молекулою, здатною індукувати імунну реакцію, та у випадку цього винаходу, -молекулою, здатною індукувати Т-клітинну реакцію. Т-клітинний "епітоп" є молекулою короткого пептиду, яка зв'язується з рецептором МНС класу І чи II, формуючи потрійний комплекс (альфа-ланцюг МНС класу І, бета-2-мікроглобулін та пептид), здатний розпізнаватися Т-клітиною, яка має відповідний Т-клітинний рецептор, що зв'язується з МНС/пептидним комплексом з належною афінністю. Пептиди, що зв'язуються з МНС-молекулами класу І, як правило, мають довжину 8-14 амінокислот, і найбільш типовою є довжина 9 амінокислот. Епітопи Т-клітин, що зв'язуються з МНС-молекулами класу II, як правило, мають довжину 12-30 амінокислот. У випадку пептидів, котрі зв'язуються з молекулами МНС класу II, один і той самий пептид та відповідний Т-клітинний епітоп можуть займати спільний коровий сегмент, але мати різну загальну довжину, внаслідок того, що бокові послідовності відрізняються за довжиною вище аміно-кінця ключової послідовності та нижче її карбоксильного кінця, відповідно. Рецептори МНС класу II мають більш відкриту конформацію, пептиди, зв'язані з рецепторами МНС класу II, відповідно, не повністю заглиблені в структуру пептидно-зв'язуючої "кишені" МНС-молекули класу II, як в пептидно-зв'язуючій "кишені" МНС 6 UA 103481 C2 5 10 молекули класу І. Дивно, але це не відноситься до пептиду послідовності SEQ ID NO: 1, оскільки невеликі варіації в довжині пептиду ведуть до значного зниження активності (див. нижче). У людей існують три різні генетичні локуси, які кодують МНС-молекули класу І (МНСмолекули людини також визначаються як лейкоцитарні антигени людини (HLA)): HLA-A, HLA-B та HLA-C. HLA-A*01, HLA-A*02 та HLA-A*11 є прикладами різних алелей МНС класу І, що можуть експресуватися з цих локусів. В геномі людини є 3 різні локуси для генів МНС класу II: HLA-DR, HLA-DQ та HLA-DP. Рецептори МНС класу II є гетеродімерами, що складаються з альфа- та бета-ланцюгу, обидва з яких закріплюються в клітинній мембрані через трансмембранну ділянку. HLA-DRB1*04 та HLADRB1*07 - це два приклади різних бета-алелей МНС класу II, котрі, як відомо, кодуються в цих локусах. Алелі класу II дуже поліморфні, наприклад, описано кілька сот різних HLA-DRB1 7 UA 103481 C2 5 10 15 20 25 30 35 40 45 50 55 60 алелей. Отже, для терапевтичних та діагностичних цілей в значній мірі доцільним є пептид, що зв'язується з належною афінністю з кількома різними рецепторами HLA класу II. Пептид, який зв'язується з кількома різними молекулами HLA класу II, називається гетерогенним лігандом. Посилання на ДНК-послідовність в цьому винаході включає однониткові та двониткові ДНК. Отже, конкретна послідовність, якщо контекст не передбачає іншого, відноситься до однониткової ДНК такої послідовності, дуплексу такої послідовності з її комплементом (двониткова ДНК) та комплементу такої послідовності. Термін "кодуюча ділянка" відноситься до тієї частини гену, яка природним чи нормальним способом кодує продукт експресії того гену в його природному геномному середовищі, тобто, до ділянки, що кодує in vivo природний продукт експресії гену. Кодуюча ділянка може бути з нормального гену, або гену, що мутував чи був змінений, або навіть бути з послідовності ДНК чи гену, повністю синтезованого в лабораторії з використанням методів, добре відомих досвідченим фахівцям в галузі синтезу ДНК. Термін "нуклеотидна послідовність" відноситься до гетерополімеру дезоксирібонуклеотидів. Нуклеотидна послідовність, що кодує конкретний пептид, олігопептид чи поліпептид, може мати природне походження чи створюватися синтетичним шляхом. В цілому, сегменти ДНК, що кодують пептиди, поліпептиди та білки цього винаходу, збираються з фрагментів кДНК та коротких олігонуклеотидних лінкерів, або з серії олігонуклеотидів, для одержання синтетичного гену, здатного експресуватися в рекомбінантній транскрипційній одиниці, яка вміщує регуляторні елементи, одержані з мікробного чи вірусного оперону. Термін "продукт експресії" означає поліпептид або білок, котрий є природним трансляційним продуктом гену та будь-якої нуклеїново-кислотної послідовності, що кодує еквіваленти, які є результатом деградації генетичного коду, і також кодує ті ж амінокислоти. Термін "фрагмент", стосовно кодуючої послідовності, означає частину ДНК, яка вміщує менш ніж повну кодуючу ділянку, і продукт експресії якої зберігає по суті ту ж біологічну функцію чи діяльність, що й продукт експресії повної кодуючої ділянки. Термін "сегмент ДНК" відноситься до полімеру ДНК, у формі окремого фрагменту чи як компонент більшої структури ДНК, що одержаний з ДНК, виділеної принаймні один раз по суті в чистій формі, тобто, без забруднюючих ендогенних матеріалів та в кількості чи концентрації, яка дає змогу ідентифікувати, виконувати маніпуляції та відновлювати сегмент і його складові нуклеотидні послідовності за допомогою стандартних біохімічних методів, наприклад, з використанням вектору клонування. Такі сегменти надаються у формі відкритої рамки зчитування, без порушень внутрішніми нетрансльованими послідовностями, чи інтронами, які зазвичай присутні в еукаріотичних генах. Послідовності нетрансльованих ДНК можуть бути присутні по низхідній від відкритої рамки зчитування, де вони не заважають маніпуляціям або експресії кодуючих ділянок. Термін "праймер" означає коротку нуклеїново-кислотну послідовність, котра може бути спарена з однією ниткою ДНК та надає вільний 3'ОН-кінець, на якому ДНК- полімераза розпочинає синтез дезоксирібонуклеотидного ланцюгу. Термін "промотор" означає ділянку ДНК, включену у зв'язування РНК-полімерази для ініціації транскрипції. Термін "відкрита рамка зчитування (ORF)» означає серію тріплетів, що кодують амінокислоти без будь-яких термінаційних кодонів, та є послідовністю, яка може (потенційно) транслюватися в білок. Термін "виділений" означає, що матеріал видаляється зі свого первісного середовища (наприклад, природного середовища, якщо він має природне походження). Наприклад, природно існуючий полінуклеотид чи поліпептид, присутній у живих тварин, не є виділеним, але той самий полінуклеотид чи поліпептид, відокремлений від якихось чи всіх співіснуючих матеріалів в природній системі, є виділеним. Такі полінуклеотиди можуть бути часткою вектору, та/або такі полінуклеотиди чи поліпептиди можуть становити частину композиції і продовжувати бути виділеними, якщо такий вектор чи композиція не є частиною свого природного середовища. Полінуклеотиди та рекомбінантні чи імуногенні поліпептиди, розкриті відповідно до цього винаходу, також можуть бути в "очищеній" формі. Термін "очищений" не вимагає абсолютної чистоти; він має на увазі відносне визначення та може включати препарати високого ступеню очищення або препарати, які тільки частково очищені, в тому сенсі, як розуміються такі терміни спеціалістами в цій галузі. Наприклад, окремі клони, виділені з бібліотеки кДНК, були умовно очищені до електрофорезної однорідності. Очищення вихідного матеріалу чи природного матеріалу принаймні на порядок величини, переважно на два-три порядки, та більш переважно, 8 UA 103481 C2 5 10 15 20 25 30 35 40 45 50 55 60 на чотири-п'ять порядків величини, чітко передбачається в цьому винаході. Крім того, заявлений поліпептид, котрий має чистоту переважно в 99.999 %, або принаймні в 99.99 % чи 99.9 %; і навіть бажано 99 % за вагою, чи більше, також чітко пропонується. Нуклеїнові кислоти та продукти експресії поліпептидів, що розкриваються відповідно до цього винаходу, а також вектори експресії, які вміщують такі нуклеїнові кислоти та/або такі поліпептиди, можуть бути в "збагаченій формі". Термін "збагачений" в тому виді, в якому він використовується тут, означає, що концентрація матеріалу принаймні в 2, 5, 10, 100 або 1000 разів перевищує його природну концентрацію (наприклад), переважно 0.01 %, за вагою, принаймні переважно приблизно 0.1 % за вагою. Також передбачаються збагачені препарати приблизно в 0.5 %, 1 %, 5 %, 10 % та 20 % за вагою. Послідовності, структури, вектори, клони' та інші матеріали, які складають цей винахід, можуть переважно бути у збагаченій чи виділений формі. Термін "активний фрагмент" означає фрагмент, що генерує імунну реакцію (тобто, має імуногенну функцію) при введенні, разом чи як додатково з прийнятним ад'ювантом, тварині, наприклад, ссавцю, такому як кролик чи миша, і також включаючи людину. Така імунна реакція має вид стимуляції Т-клітинної реакції у тварини-реципієнта, такої як людина. Альтернативно, "активний фрагмент" також може використовуватись для індукування Т-клітинної реакції in vitro. В цьому винаході терміни "частка", "сегмент" і "фрагмент", якщо вони використовуються по відношенню до поліпептидів, означають безперервну послідовність залишків, таких як амінокислотні залишки, причому ця послідовність утворює підгрупу більшої послідовності. Наприклад, якщо поліпептид був підданий обробці будь-якою з типових ендопептідаз, таких як трипсин або химотрипсин, олігопептиди, одержані в результаті такої обробки, будуть представляти частки, сегменти чи фрагменти початкового поліпептиду. Це означає, що будьякий такий фрагмент буде обов'язково вміщувати, як частину своєї амінокислотної послідовності, сегмент, фрагмент або частину, яка є по суті ідентичною, якщо не повністю ідентичною, послідовності від SEQ ID NO: 1 до SEQ ID NO: 3, котра відповідає природним або "вихідним" білкам послідовностей від SEQ ID NO: 1 до SEQ ID NO: 3, a саме, сурвівіну. Якщо такі терміни використовуються стосовно полінуклеотидів, вони означають продукти, одержані після обробки зазначених полінуклеотидів будь-якою з типових ендонуклеаз. Відповідно до цього винаходу, термін "процентна ідентичність" або "процент ідентичності", відносно послідовності, означає, що послідовність порівнюється із заявленою або описаною послідовністю після вивірки послідовності, яка порівнюється ("Порівняна Послідовність"), з описаною або заявленою послідовністю ("Контрольна Послідовність"). Процентна ідентичність визначається відповідно до наведеної нижче формули: Процентна ідентичність = 100 [І -(C/R)] де С - кількість різниць між Контрольною Послідовністю та Порівняною Послідовністю на довжині вивірки в інтервалі порівняння між Контрольною Послідовністю та Порівняною Послідовністю, де (і) кожна основа чи амінокислота в Контрольній Послідовності, котра не має відповідної вивіреної основи чи амінокислоти у Порівняній Послідовності, та (іі) кожній розрив у Контрольній Послідовності, та (ііі) кожна вивірена основа чи амінокислота у Контрольній Послідовності, яка відрізняється від вивіреної основи чи амінокислоти у Порівняній Послідовності, становить різницю; R - кількість основ чи амінокислот в Контрольній Послідовності на довжині вивірки з Порівняною Послідовністю з будь-яким розривом, утвореним в Контрольній Послідовності, також зарахованим як основа чи амінокислота. Якщо існує вивірка між Порівняною Послідовністю та Контрольною Послідовністю, для якої процентна ідентичність, розрахована вище, є приблизно рівною чи більшою, ніж зазначена мінімальна Процентна Ідентичність, то Порівняна Послідовність має зазначену мінімальну процентну ідентичність до Контрольної Послідовності, навіть якщо можуть існувати вивірки, в яких розрахована, як описано вище, Процентна Ідентичність менша, ніж зазначена Процентна Ідентичність. Первісні пептиди, що розкриваються в цьому винаході, можуть модифікуватися заміщенням одного чи кількох залишків на різних, можливо, селективних, ділянках пептидного ланцюгу, якщо не зазначається інше. Такі заміщення можуть бути консервативного характеру, наприклад, коли одна амінокислота замінюється амінокислотою подібної структури та характеристик, тобто, коли гідрофобна амінокислота замінюється іншою гідрофобною амінокислотою. Навіть більш консервативною буде заміна амінокислот такого ж чи подібного розміру та хімічного характеру, наприклад, коли лейцин замінюється ізолейцином. В дослідженнях варіацій послідовностей в сімействах природних гомологічних білків, певні амінокислотні заміщення частіше 9 UA 103481 C2 5 10 15 20 25 30 35 40 45 50 55 60 допускаються, ніж інші, і вони часто демонструють кореляцію зі схожістю в розмірі, заряді, полярності та гідрофобності між первісною амінокислотою та її заміною, і це є основою для визначення "консервативних заміщень". Консервативні заміщення визначаються тут як заміни в межах однієї з наведених нижче п'яти груп: Група 1 - малі аліфатичні, неполярні чи слабо полярні залишки (Ala, Ser, Thr, Pro, Gly); Група 2 - полярні, негативно заряджені залишки та їхні аміди (Asp, Asn, Glu, Gln); Група 3 полярні, позитивно заряджені залишки (His, Arg, Lys); Група 4-великі аліфатичні неполярні залишки (Met, Leu, Ile, Val, Cys); та Група 5 - великі ароматичні залишки (Phe, Туr, Тrр). Менш консервативні заміщення можуть включати заміну однієї амінокислоти іншою, котра має подібні характеристики, але трохи відрізняється за розміром, наприклад, заміна аланіну ізолейциновим залишком. Високо-неконсервативні заміни можуть включати заміщення кислотної амінокислоти полярною, або навіть такою, що є основною за своїм характером. Такі "радикальні" заміщення не можуть, однак, відхилятись як потенційно неефективні, оскільки їхні хімічні наслідки не є повністю прогнозованими, та радикальні заміщення також можуть мати сприятливий ефект, який неможливо передбачити за простими хімічними принципами. Безумовно, такі заміщення можуть включати структури, інші ніж звичайні L-амінокислоти. Отже, D-амінокислоти можуть заміщуватися L-амінокислотами, котрі зазвичай виявляються в антигенних пептидах винаходу та охоплюються розкриттям в ньому. Крім того, амінокислоти, які мають нестандартні R-групи (тобто, R-групи, інші ніж можна знайти в типових 20 амінокислотах природних білків) також можуть використовуватись для цілей заміщення, з метою виробництва імуногенів та імуногенних поліпептидів, відповідно до цього винаходу. Якщо виявляється, що заміщення в більш ніж одній позиції призводять до утворення пептиду по суті з еквівалентною чи більшою антигенною активністю, як визначено нижче, тоді комбінації цих заміщень будуть досліджуватись з метою визначення, чи мають комбіновані заміщення додатковий чи синергічний вплив на антигенність пептиду. Більшою частиною, не більш ніж чотири позиції в пептиді замінюються одночасно. Термін "Т-клітинна реакція" означає специфічну проліферацію та активацію ефекторних функцій, індукованих пептидом in vitro чи in vivo. Для CTL, обмежених МНС класу І, ефекторними функціями можуть бути лізис клітин-мішеней з імпульсно введеним пептидом, пептидним прекурсором чи клітин-мішеней, природно презентуючих пептид, секреція цитокінів, переважно гамма-інтерферону, TNF-альфа, або IL-2, індукована пептидом, секреція ефекторних молекул, переважно, гранзимів чи перфорінів, індукована пептидом, або дегрануляція. Для обмежених МНС класу II Т-клітин- хелперів, ефекторні функції - це, ймовірно, індукована пептидом секреція цитокінів, переважно, IFN-гамма, TNF-alpha, IL-4, IL5, IL-10 або IL2, чи індукована пептидом дегрануляція. Можливі ефекторні функції для CTL і Т-клітин- хелперів не обмежуються цим переліком. Переважно, коли CTL, специфічні для пептиду будь-яких послідовностей від SEQ ID NO: 1 до SEQ ID NO:3, перевіряються в порівнянні з заміщеними пептидами, пептидна концентрація, при якій заміщені пептиди досягають половини від максимального зростання в лізисі, відносно вихідних даних, становить не більше, ніж приблизно 1 мМ, переважно не більше, ніж приблизно 1 мкМ, ще більш переважно не більше близько 1 нМ, і ще більш переважно не більше 100 пМ, та найбільш переважно - не більше, ніж приблизно 10 пМ. Також є переважним, щоб заміщений пептид розпізнавався CTL від більш, ніж однієї людини, принаймні, від двох та, більш переважно, від трьох людей. Отже, епітопи цього винаходу можуть бути ідентичними природно існуючим пухлиноасоційованим чи пухлино-специфічним епітопам та можуть включати епітопи, що відрізняються не більш, ніж на чотири залишки від контрольного пептиду, за умови, що вони мають по суті ідентичну антигенну активність. Стимуляція імунної реакції залежить від наявності антигенів, які визнаються імунною системою хазяїна як чужорідні. Виявлення існування пухлино-асоційованих антигенів дало можливість використовувати імунну систему хазяїна для сприяння імунній реакції, котра є специфічною для цільових антигенів, експресованих на поверхні клітин пухлин, що завдяки такому механізму дії здатна призводити до ремісії, затримки чи сповільнення росту пухлини. Зараз досліджуються різні механізми використання як гуморальних, так і клітинних важелів імунної системи для імунотерапії раку. Окремі елементи клітинної імунної реакції здатні специфічно розпізнавати та знищувати клітини пухлин. Виділення цитотоксичних Т-лімфоцитів (CTL) з пухлино-інфільтруючих клітинних популяцій чи з периферичної крові наводить на думку, що такі клітини грають важливу роль в природному імунному захисті проти раку (Cheever et al., 1993; Zeh, III et al., 1999). На основі аналізу 415 зразків, взятих у пацієнтів з колоректальним раком, автори Galon et al. змогли 10 UA 103481 C2 5 10 15 20 25 30 35 40 45 50 55 60 продемонструвати, що тип, щільність та локалізація імунних клітин в пухлинній тканині, фактично, є кращим прогностичним фактором виживаності пацієнтів, ніж широко використовувана TNM-класифікація пухлин (Galon et al., 2006). МНС класу І презентують пептиди, які є результатом протеолітичного розщеплення, в основному, ендогенних протеїнів, DRIPS (дефектних продуктів рибосом) та більших за розміром пептидів. МНС-молекули класу II, переважно, знаходяться на професійних антигенпрезентуючих клітинах (АРС); вони, в першу чергу, презентують пептиди екзогенних чи трансмембранних білків, що поглинаються АРС в ході ендоцитозу, та проходять подальшу обробку (Cresswell, 1994). Комплекси пептиду та МНС-молекули класу І розпізнаються CD8позитивними цитотоксичними Т-лімфоцитами, які презентують відповідні рецептори Т-клітин (TCR), а комплекси пептиду і МНС-молекули класу II розпізнаються СD4-позитивними Тклітинами- хелперами, що презентують відповідні TCR. Добре відомим є той факт, що TCR, пептид і МНС присутні в стехіометричному співвідношенні 1:1:1. СD4-позитивні Т-клітини- хелпери відіграють важливу роль в індукуванні та підтриманні ефекторних реакцій CD8-позитивними цитотоксичними Т-клітинами (Wang and Livingstone, 2003; Sun and Bevan, 2003; Shedlock and Shen, 2003). Спочатку примування та розповсюдження CTL в лімфовузлах підтримується CD4- позитивними Т-клітинами (Schoenberger et al., 1998). Відповідно, одним з механізмів може бути спрямування непідготовлених CD8-позитивних клітин до місця функціональної взаємодії CD4+ Т-клітина - АРС (Castellino et al., 2006). Нарешті, утворення функціональних СD8-позитивних клітин пам'яті в більшості випадків залежить від допомоги СD4-позитивних Т-клітин (Sun and Bevan, 2003; Janssen et al., 2003). З цієї причини, ідентифікація епітопів СD4-позитивних Т-клітин, одержаних з пухлино-асоційованих антигенів (ТАА), може мати велике значення для розробки фармацевтичних продуктів для викликання протипухлинних імунних реакцій (Kobayashi et al., 2002; Qin et al., 2003; Gnjatic et al., 2003). В місці локалізації пухлини, Т-клітини- хелпери підтримують CTL-сприяюче цитокінне оточення (Qin and Blankenstein, 2000; Mortara et al., 2006) та притягують ефекторні клітини, наприклад, CTLS, NK-клітини, макрофаги, гранулоцити (Marzo et al., 2000; Hwang et al., 2007). За відсутністю запалення, експресія молекул МНС класу II, переважно, зводиться до клітин імунної системи, зокрема, до професійних антиген-презентуючих клітин (АРС), наприклад, моноцитів, клітин, що походять з моноцитів, макрофагів, дендритних клітин. При дослідженні пацієнтів з пухлинами було несподівано виявлено, що клітини пухлини експресують МНСмолекули класу II (Dengjel et al., 2006). На моделях ссавців, наприклад, мишей, було продемонстровано, що навіть за відсутністю цитотоксичних Т-лімфоцитарних (CTL) ефекторних клітин (тобто, CD8-позитивних Тлімфоцитів), СD4-позитивні Т-клітини є достатніми для візуалізації інгібування пухлин шляхом інгібування ангіогенезу завдяки секреції гамма-інтерферону (IFN) (Qin and Blankenstein, 2000). Крім того, було запропоноване пряме знищення клітин пухлин цитотоксичними СD4позитивними Т-клітинами за допомогою лімфотоксинів та гранзиму В (Penna et al., 1992; Littaua et al., 1992). Крім того, було показано, що СD4-позитивні Т-клітини, які розпізнають пептиди з пухлиноасоційованих антигенів, представлених молекулами HLA класу II, можуть протидіяти розвитку пухлин за допомогою індукування реакцій антитіл (Ab) (Kennedy et al., 2003). На відміну від пухлино-асоційованих пептидів, які зв'язуються з молекулами HLA класу І, лише невелика кількість лігандів класу II пухлино-асоційованих антигенів (ТАА) була описана на даний час. Оскільки визначальна експресія молекул HLA класу II зазвичай обмежується клітинами імунної системи (Mach et al., 1996), можливість виділення пептидів класу II безпосередньо з первинних пухлин не вважалася ймовірною. Однак, автори Dengjel et al. за останній час досягай успіху в ідентифікації ряду епітопів МНС класу II безпосередньо з пухлин (WO 2007/028574, ЕР 1 760 088 Bl; (Dengjel et al., 2006). Антигени, котрі розпізнаються пухлино-специфічними цитотоксичними Т-лімфоцитами, тобто, їхні епітопи, можуть бути молекулами, одержаними з усіх класів білків, таких як ферменти, рецептори, транскрипційні фактори та ін., котрі експресуються та, в порівнянні з незміненими клітинами того ж самого походження, мають підвищену концентрацію в клітинах відповідної пухлини. Діюча класифікація пухлино-асоційованих антигенів (ТАА) включає наведені нижче основні групи (Novellino et al., 2005): 1. Антигени Cancer-testis: Перші ТАА, що були ідентифіковані, котрі можуть розпізнаватися Т-клітинами (van der Bruggen et al., 1991), належать до цього класу, і вони спочатку були названі антигени cancer-testis (CT), внаслідок експресії членів цього класу в гістологічно різних пухлинах 11 UA 103481 C2 5 10 15 20 25 30 35 40 45 50 55 60 людини та, серед нормальних тканин, тільки в сперматоцитах/сперматогонії сем'яників та, час від часу, в плаценті. Оскільки клітини сім'яників не експресують молекули HLA класу І і II, ці антигени не можуть розпізнаватися Т-клітинами в нормальних тканинах і тому можуть вважатися імунологічно пухлино-специфічними. Добре відомі приклади СТ-антигенів - це члени сімейства MAGE або NY-ESO-1. 2. Диференційовані антигени: Ці ТАА зустрічаються і в пухлинах, і в нормальній тканині, з якої виникає пухлина; більшість з них знаходиться в меланомах та нормальних меланоцитах. Багато з цих меланоцитних білків, що відносяться до лінії диференціювання, беруть участь в біосинтезі меланіну і тому не є пухлино-специфічними, але незважаючи на це широко використовуються для імунотерапії раку. Приклади включають, без обмежень, тирозиназу та Melan-A/MART-1 для меланоми або PSA для раку простати. 3. Надмірно експресовані ТАА: Гени, що кодують широко експресовані ТАА, були визначені в гістологічно різних типах пухлин, а також в багатьох нормальних тканинах, в цілому, з більш низькими рівнями експресії. Можливо, багато епітопів, що процесуються та потенційно презентуються нормальними тканинами, нижче порогового рівня для розпізнавання Тклітинами, в той час як їхня надмірна експресія в клітинах пухлин може запускати протиракову реакцію за допомогою порушення раніше встановленої толерантності. Яскравими прикладами цього класу ТАА є Неr-2/neu, Сурвівін, Теломераза або WT1. 4. Пухлино-специфічні антигени: Ці унікальні ТАА виникають з мутацій нормальних генів (таких як -катенін, CDK4, та ін.). Деякі з цих молекулярних змін асоціюються з неопластичною трансформацією та/або прогресуванням. Пухлино-специфічні антигени, в цілому, здатні індукувати сильні імунні реакції без ризику аутоімунних реакцій проти нормальних тканин. З іншого боку, ці ТАА в більшості випадків є релевантними тільки до конкретної пухлини, на якій вони були ідентифіковані, і зазвичай не зустрічаються на великій кількості інших пухлин. 5. ТАА, що виникають з аномальних пост-трансляційних модифікацій: Такі ТАА можуть виникати з білків, котрі не є пухлино-специфічними і не експресуються надмірно в пухлинах, але незважаючи на це стають пухлино-асоційованими внаслідок пост-трансляційних процесів, активних, перш за все, в пухлинах. Приклади цього класу виникають зі змінених моделей глікозилювання, котрі ведуть до нових епітопів в пухлинах, як у випадку MUC1 чи сплайсингу білків в ході деструкції, що може чи не може бути пухлино-специфічною (Hanada et al., 2004; Vigneron et al., 2004). 6. Онковірусні білки: Ці ТАА є вірусними білками, котрі можуть відігравати вирішальну роль в онкогенному процесі, та внаслідок того, що ці білки є чужорідними (не людського походження), вони можуть викликати Т-клітинну реакцію. Прикладами таких білків є вірусні білки папіломи типу 16 у людини, Е6 та Е7, котрі експресуються в цервікальній карциномі. Для того, щоб білки розпізнавалися цитотоксичними Т-лімфоцитами як пухлино-специфічні або пухлино-асоційовані антигени, та з метою використання в лікуванні, мають бути дотримані деякі попередні умови. Антиген повинен експресуватися, головним чином, клітинами пухлин, а не нормальними здоровими тканинами, чи бути присутнім в здорових клітинах в порівняно невеликих кількостях. Крім того, бажано, щоб відповідний антиген був не тільки присутнім в будь-якому виді пухлин, але також знаходився у високих концентраціях (наприклад, кількість копій відповідного пептиду на клітину). Пухлино-специфічні та пухлино-асоційовані антигени часто походять з білків, що беруть безпосередню участь у трансформації нормальної клітини в пухлинну клітину внаслідок їхньої функції, наприклад, в контролі клітинного циклу чи в супресії апоптозу. До того ж, наступні мішені цих білків, які є основною причиною трансформації, можуть мати підвищену експресію і, відповідно, бути непрямим чином асоційованими з пухлинами. Такі непрямо пухлино-асоційовані антигени також можуть бути мішенями у вакцинаційному підході (Singh-Jasuja et al., 2004). Істотно важливою в обох випадках є присутність епітопів в амінокислотній послідовності антигену, оскільки такий пептид ("імуногенний пептид"), одержаний з пухлино-асоційованого антигену, повинен призводити до Т-клітинної реакції in vitro чи in vivo. По суті, будь-який пептид, здатний зв'язувати молекулу МНС, може функціонувати як Тклітинний епітоп. Передумовою для індукування Т-клітинної реакції in vitro чи in vivo є наявність Т-клітини з відповідним рецептором TCR та відсутність імунологічної толерантності до цього конкретного епітопу. Отже, ТАА є відправною точкою для розробки протипухлинної вакцини. Методи ідентифікації та характеризації ТАА основані на використанні CTL, котрі можуть бути виділені у пацієнтів або здорових людей, або вони базуються на генерації різних профілів транскрипції або різних моделей експресії пептидів пухлин і нормальних тканин (Lemmel et al., 2004; Weinschenk et al, 2002). 12 UA 103481 C2 5 10 15 20 25 30 35 40 45 50 55 60 Однак, ідентифікація генів, надмірно експресованих в тканинах пухлин чи клітинних лініях пухлин людини, або селективно експресованих в таких тканинах чи клітинних лініях, не дає точної інформації щодо використання антигенів, транскрибованих з цих генів, в імунній терапії. Це можна пояснити тим, що тільки індивідуальна субпопуляція епітопів з цих антигенів є прийнятною для такого застосування, оскільки Т-клітина з відповідним TCR повинна бути присутньою, а імунологічна толерантність до цього конкретного епітопа має бути відсутньою чи мінімальною. Отже, важливо обирати тільки ті пептиди з надмірно експресованих чи селективно експресованих білків, котрі презентуються в зв'язку із молекулами МНС, проти яких можна знайти функціональну Т-клітину. Така функціональна Т-клітина визначається як Т-клітина, що після стимуляції специфічним антигеном може клонально розмножуватись і здатна виконувати ефекторні функції ("ефекторна Т-клітина"). Т-клітини - хелпери відіграють важливу роль в регуляції ефекторної функції CTL в протипухлинному імунітеті. Епітопи Т-хелперів, які запускають реакцію Т-клітин-хелперів типу ТH1, підтримують ефекторні функції СD8-позитивних Т-клітин- кілерів, котрі включають цитотоксичні функції, спрямовані проти клітин пухлин, що експресують комплекси пухлиноасоційованого пептиду/МНС на своїх клітинних поверхнях. Таким чином, епітопи пухлиноасоційованих пептидів Т-хелперів, самостійно чи в комбінації з іншими пухлино-асоційованими пептидами, можуть служити активними фармацевтичними інгредієнтами композицій вакцин, які стимулюють протипухлинні імунні реакції. Оскільки обидва типи реакцій, залежні від CD8 та CD4, спільно та синергічно роблять свій внесок у протипухлинну дію, для розробки протипухлинних вакцин важливими є ідентифікація та характеристика пухлино-асоційованих антигенів, які розпізнаються СО8-позитивними CTL (ліганд: молекула МНС класу І + пептидний епітоп) чи CD4-позитивними Т-клітинами-хелперами (ліганд: молекула МНС класу II + пептидний епітоп). Враховуючи серйозні побічні ефекти і витрати, пов'язані з лікуванням, існує гостра необхідність в кращому прогнозуванні раку та удосконаленні методів його діагностики. Отже, треба ідентифікувати інші фактори, які представляють біомаркери для раку в цілому та гліобластоми, в особливості. Крім того, необхідно визначити фактори, котрі можна використовувати в лікуванні раку взагалі та, зокрема, гліобластоми. До того ж, не існує загально прийнятого терапевтичного методу стосовно пацієнтів, хворих на рак простати, з біохімічним рецидивом після радикальної простатектомії, зазвичай викликаним наявністю резідуальної пухлини in situ, в присутності локально прискореного росту пухлини. Потрібні нові терапевтичні підходи, що забезпечують зниження рівня смертності та мають лікувальну ефективність, порівнюваною з існуючими терапевтичними підходами. Цей винахід пропонує пептиди, котрі є прийнятними для лікування гліобластоми, раку простати та інших пухлин, які надмірно експресують сурвівін. За допомогою масспектрометричного аналізу, було частково показано, що ці пептиди природно презентуються молекулами HLA на зразках первинних гліобластом людини (див. Приклад 1 та Малюнок 1), або у випадку SEQ ID NO: 1 та 2 оцінюються, відповідно до алгоритму прогнозування SYFPEITHI (Rammensee et al, 1995), як гетерогенні ліганди, що зв'язуються з HLA-DR-алелями HLADRB1*01, DRB1*03, DRB1*04, DRB1*11 та DRB1*15 (див. додаток). На основі цих даних і частоти зустрічальності таких DRB1-алелей (Mori et al., 1995; Chanock et al., 2004), можна припустити, що 92 % A*02-позитивних представників білої раси експресують принаймні одну DRB1-алель, що зв'язує ці пептиди (SEQ ID NO: I-SEQ ID NO: 3). SEQ ID NO: 2 вміщує ту ж саму ключову послідовність, що й SEQ ID NO: 1, подовжену двома N-термінальними амінокислотами з послідовності природного сурвівіну для включення описаного епітопу Т-клітини класу І з сурвівіну (Schmitz et al., 2000). SEQ ID NO: 3 вміщує ту ж саму послідовність, що й SEQ ID NO: 1, в якій остання С-термінальна амінокислота модифікується з аспарагіну (N) в аспарагінову кислоту (D). Було показано, що вихідний ген, з якого одержані послідовності від SEQ ID NO: 1 до SEQ ID NO: 3 - сурвівін - в значній мірі надмірно експресується в гліобластомі, пухлині простати, у випадках раку молочної залози, раку стравоходу, колоректального раку, світло-клітинного раку нирки, раку легенів, ЦНС, раку яєчників, меланомі (Tamm et al. 1998), раку підшлункової залози, плоско-клітинного раку, лейкемії та медулобластоми, в порівнянні з нормальними тканинами (див. Приклад 2 і Малюнок 2), що демонструє високий ступінь пухлинної асоціації пептиду, тобто, ці пептиди надмірно презентуються на тканині пухлини, а не на нормальних тканинах. HLA-зв'язані пептиди можуть розпізнаватися імунною системою, зокрема, Т-лімфоцитами/Тклітинами. Т-клітини здатні руйнувати клітини, які презентують розпізнаний комплекс HLA/пептид, наприклад, пухлинні клітини гліобластоми, що презентують сурвівін-похідні послідовності (SEQ ID NO: 1-SEQ ID NO: 3). Т-клітини -хелпери, активовані сурвівін-похідними 13 UA 103481 C2 5 10 15 20 25 30 35 40 45 50 55 пептидами, можуть інгібувати васкулярізацію пухлини, притягувати ефекторні клітини імунної системи та сприяти CTL-примуванню, проліферації та тривалій реакції CD8-позитивних Т-клітин. Було продемонстровано, що усі пептиди цього винаходу здатні стимулювати Т-клітинні реакції (див. Приклад 3 і Малюнок 3). Отже, пептиди є прийнятними для генерації імунної реакції у пацієнта, за допомогою якої можна руйнувати клітини пухлин. Імунна реакція у пацієнта може бути індукована прямим введенням описаних пептидів чи відповідних прекурсорів (наприклад, подовжених пептидів, білків чи нуклеїнових кислот, що кодують ці пептиди) пацієнту, в ідеалі в комбінації з речовиною, яка посилює імуногенність (тобто, ад'ювантом). Імунна реакція, яка відбувається в результаті такої терапевтичної вакцинації, може вважатись високо-специфічною проти клітин пухлини, оскільки цільові пептиди цього винаходу не презентуються на нормальних тканинах в порівнюваній кількості копій, і це усуває ризик небажаних аутоімунних реакцій проти нормальних клітин у пацієнта. Фармацевтичні композиції вміщують пептиди у вільній формі чи у формі фармацевтично прийнятної солі. Термін "фармацевтично прийнятна сіль", в тому виді, в якому він використовується тут, відноситься до похідної сполуки розкритих пептидів, в якій пептид модифікується шляхом створення кислої чи основної солі речовини. Наприклад, кислі солі готуються з вільної основи (як правило, де нейтральна форма лікарського засобу має нейтральну -NH2-групу), за участю реакції з прийнятною кислотою. Прийнятні кислоти для приготування кислих солей включають органічні кислоти, такі, наприклад, як оцтова кислота, пропанова кислота, гліколева кислота, піровиноградна кислота, щавлева кислота, яблучна кислота, малонова кислота, бурштинова кислота, малеїнова кислота, фумарова кислота, винна кислота, лимонна кислота, бензойна кислота, корична кислота, мигдальна кислота, метансульфокислота, етансульфокислота, ртолуолсульфокислота, саліцилова кислота та ін., а також неорганічні кислоти, наприклад, соляна кислота, бромисто-воднева кислота, сірчана кислота, азотна кислота, фосфорна кислота та ін. І навпаки, приготування основних солей кислотних компонентів, які можуть бути присутні на пептиді, здійснюється з використанням фармацевтично прийнятної основи, такої як гідроксид натрію, гідроксид калію, гідроксид амонію, гідроксид кальцію, триметиламін чи тому подібні. В особливо переважному втіленні, фармацевтичні композиції вміщують пептиди у виді солей оцтової кислоти (ацетати) або соляної кислоти (хлориди). На додаток до використання з метою лікування раку, пептиди цього винаходу також є прийнятними як діагностичні реактиви. Оскільки пептиди були генеровані з гліобластоми, і було визначено, що ці пептиди не присутні в нормальних тканинах, дані пептиди можуть використовуватися для діагностування наявності раку. Присутність заявлених пептидів на біоптатах тканин може допомогти патологоанатому в діагностуванні раку. Визначення окремих пептидів за допомогою антитіл, мас-спектрометрії чи інших методів, відомих у цій галузі, може підказати патологоанатому, що тканина є злоякісною чи запаленою або взагалі ураженою хворобою. Наявність груп пептидів може дозволити проведення класифікації чи суб-класифікації хворих тканин. Визначення пептидів на зразку хворої тканини може підказати рішення про необхідність терапії із включенням імунної системи, зокрема, якщо відомо або передбачається, що Тлімфоцити беруть участь в механізм дії. Втрата МНС-експресії є добре описаним механізмом уникнення імунного контролю інфікованими або злоякісними клітинами. Тобто, присутність пептидів показує, що цей механізм не використовується проаналізованими клітинами. Пептиди могли б використовуватися для аналізу реакцій лімфоцитів проти цих пептидів, таких як Т-клітинні реакції або реакції антитіл проти пептиду, чи пептиду в комплексі з молекулами МНС. Такі лімфоцитарні реакції можуть використовуватися як кислота, пропанова кислота, гліколева кислота, піровиноградна кислота, щавлева кислота, яблучна кислота, малонова кислота, бурштинова кислота, малеїнова кислота, фумарова кислота, винна кислота, лимонна кислота, бензойна кислота, корична кислота, мигдальна кислота, метансульфокислота, етансульфокислота, р-толуолсульфокислота, саліцилова кислота та ін., а також неорганічні кислоти, наприклад, соляна кислота, бромисто-воднева кислота, сірчана кислота, азотна кислота, фосфорна кислота та ін. І навпаки, приготування основних солей кислотних компонентів, які можуть бути присутні на пептиді, здійснюється з використанням фармацевтично прийнятної основи, такої як гідроксид натрію, гідроксид калію, гідроксид амонію, гідроксид кальцію, триметиламін чи тому подібні. В особливо переважному втіленні, фармацевтичні композиції вміщують пептиди у виді солей оцтової кислоти (ацетати) або соляної кислоти (хлориди). 14 UA 103481 C2 5 10 15 20 25 30 35 На додаток до використання з метою лікування раку, пептиди цього винаходу також є прийнятними як діагностичні реактиви. Оскільки пептиди були генеровані з гліобластоми, і було визначено, що ці пептиди не присутні в нормальних тканинах, дані пептиди можуть використовуватися для діагностування наявності раку. Присутність заявлених пептидів на біоптатах тканин може допомогти патологоанатому в діагностуванні раку. Визначення окремих пептидів за допомогою антитіл, мас-спектрометрії чи інших методів, відомих у цій галузі, може підказати патологоанатому, що тканина є злоякісною чи запаленою або взагалі ураженою хворобою. Наявність груп пептидів може дозволити проведення класифікації чи суб-класифікації хворих тканин. Визначення пептидів на зразку хворої тканини може підказати рішення про необхідність терапії із включенням імунної системи, зокрема, якщо відомо або передбачається, що Тлімфоцити беруть участь в механізм дії. Втрата МНС-експресії є добре описаним механізмом уникнення імунного контролю інфікованими або злоякісними клітинами. Тобто, присутність пептидів показує, що цей механізм не використовується проаналізованими клітинами. Пептиди могли б використовуватися для аналізу реакцій лімфоцитів проти цих пептидів, таких як Т-клітинні реакції або реакції антитіл проти пептиду, чи пептиду в комплексі з молекулами МНС. Такі лімфоцитарні реакції можуть використовуватися як прогностичні маркери для прийняття рішення щодо подальших етапів лікування. Ці реакції також можна застосовувати як сурогатні маркери в імунотерапевтичних підходах, спрямованих на індукування реакцій лімфоцитів різними засобами, наприклад, вакцинацією білком, нуклеїновими кислотами, аутологічними матеріалами, адоптивним переносом лімфоцитів. В генній терапії, реакції лімфоцитів проти пептидів можуть розглядатись в ході оцінки побічних ефектів. Моніторинг реакцій лімфоцитів також може стати корисним засобом для подальшого обстеження при трансплантаційній терапії, наприклад, для виявлення реакцій "трансплантат проти хазяїна" та "хазяїн проти трансплантата". Пептиди можуть використовуватися для створення та розробки специфічних антитіл проти комплексів МНС/пептид. Вони можуть використовуватись для терапії, із спрямуванням токсинів чи радіоактивних речовин на тканину, уражену хворобою. Ще одним способом використання цих антитіл може бути спрямування радіонуклідів на уражену тканину, в цілях томографії, наприклад, PET (позитронно-емісійної томографії). Це може допомогти у визначенні початку розвитку метастаз або визначенні розміру і точної локалізації хворих тканин. Крім того, вони можуть використовуватись для підтвердження діагнозу раку, поставленого патологоанатомом на основі біопсії. Таблиця 3 показує пептиди, відповідно до цього винаходу, їхні номери послідовностей SEQ ID NO, HLA-алелі, з якими зв'язуються відповідні пептиди, та вихідні білки, з яких можуть походити пептиди. Особливо цікавим є той факт, що пептид відповідно до SEQ ID NO: 2 зв'язується з HLA-DR, а також HLA-A*02, тобто, викликає дві різні реакції. 40 45 50 Експресія BIRC5 (сурвівіну), члена сімейства білків-інгібіторів апоптозу (ІАР), підвищена в фетальних тканинах та в різних видах ракових захворювань людини, з набагато зменшеною експресією в нормальних диференційованих тканинах дорослих людей, особливо, якщо їхній індекс проліферації є низьким. Передбачається, що сурвівін здатний регулювати клітинну проліферацію та смерть апоптотичних клітин. Хоча сурвівін зазвичай знаходиться на цитоплазматичній ділянці клітини і асоціюється з несприятливим прогнозом у випадках раку, також є інформація про його локалізацію в ядрі, що свідчить про сприятливий прогноз (O'Driscoll et al., 2003). Регуляція за допомогою сурвівіну була описана за кількома механізмами. Сурвівін, ймовірно, асоціюється з молекулярним шапероном Hsp60. In vivo, Hsp60 у великій кількості експресується в первинних пухлинах у людей, в порівнянні з відповідними нормальними тканинами. Гостре пригнічення Hsp60 малими інтерферуючими РНК дестабілізує мітохондріальний пул сурвівіну, викликає мітохондріальну дисфункцію та активує каспазозалежний апоптоз (Ghosh et al., 2008). Більше того, інгібування Ras призводить до відпускання 15 UA 103481 C2 5 10 15 20 25 30 35 40 45 сурвівінового "гальма" щодо апоптозу і до активації мітохондріального апоптотичного шляху. В гліобластомі, зокрема, стійкість до апоптозу може зникнути під впливом інгібітору Ras, що націлений на сурвівін (Blum et al., 2006). Також може існувати взаємозв'язок між підвищеною активністю NF-kappaB в гліомах та гіпер-експресією сурвівіну, одного з генів-мішеней NFkappaB. Наприклад, NF-kappaB-активовані анті-апоптотичні гени надмірно експресуються в зразках пухлин. Дуже високі рівні експресії сурвівіну можна визначити, зокрема, в гліобластомі (Angileri et al., 2008). Існує думка, що надмірна експресія сурвівіну в гліомах мозку може грати важливу роль в злоякісній проліферації, анти -апоптозі та ангіогенезі (Zhen et al., 2005; Liu et al., 2006). Були проведені декілька аналізів для вивчення експресії сурвівіну та її впливу на виживаність у випадку гліобластоми. Підводячи підсумок, можна сказати, що експресія сурвівіну, зокрема, одночасна експресія в ядрі та цитоплазмі в астроцитарних пухлинах, значною мірою асоціюється зі ступенем злоякісності (з найбільшою експресією сурвівіну в гліобластомі) та більш короткою загальною виживаністю, в порівнянні з пацієнтами з сурвівіннегативними пухлинами (Kajiwara et al., 2003; Saito et al., 2007; Uematsu et al., 2005; Mellai et al., 2008; Grunda et al., 2006; Xie et al., 2006; Sasaki et al., 2002; Chakravarti et al., 2002). Надмірна експресія сурвівіну також була описана для інших пухлинних форм. У випадках раку молочної залози, експресія сурвівіну асоціюється з більш високою злоякісністю та меншим показником безрецидивної виживаності (Yamashita et al., 2007; Al-Joudi et al., 2007; Span et al., 2004). Було показано, що в клітинних лініях пухлин стравоходу активність сурвівіну в якості промотору в 28.5 разі вища, в порівнянні з нормальними тканинами (Sato et al., 2006). У випадках колоректального раку, експресія сурвівіну також асоціюється з високою ступінню патології та метастазами у лімфовузли (Tan et al., 2005). Показано, що агресивність раку нирки пов'язана з експресією сурвівіну. До того ж, експресія сурвівіну знаходиться в зворотній залежності від виживаності від онкозахворювань (Kosari et al., 2005). Експресію сурвівіну можна виявити в ряді кератиноцитних новоутворень та гіперпроліферативних ушкоджень шкіри, а не в нормальній шкірі (Bowen et al., 2004). В клітинних лініях раку підшлункової залози підвищений рівень сурвівіну спостерігався в 58 % з перевірених клітинних ліній (Mahlamaki et al., 2002). Експресія сурвівіну у випадках плоско-клітинного раку може допомогти в ідентифікації випадків з більш агресивним та інвазивним клінічним фенотипом (Lo et al., 2001). Сурвівін є багатообіцяючим об'єктом вивчення для лікування раку; крім того, дослідження з використанням сурвівін-похідних пептидів показали, що сурвівін є імуногенним у пацієнтів з пухлинами, оскільки викликає реакції, опосередковані CD8-позитивними Т-клітинами. До того ж, сурвівін специфічно стимулював реактивність СD4-позитивних Т-клітин в лімфоцитах периферичної крові у тих самих пацієнтів (Casati et al., 2003; Piesche et al., 2007). Сурвівін (SVN, BIRC) надмірно експресується в багатьох формах раку. Отже, в цілому, надмірна експресія сурвівіну може асоціюватись із меншою загальною виживаністю та більш високими ступінями злоякісності. Автор Piesche (2006 p.) в своєму дослідженні (див. також (Piesche et al., 2007)) розкрив епітопи-кандидати, обмежені МНС класу II та HLA класу II, в сурвівіні (SVN) та в протеїназі-3 (PR.3), котрі були визначені з використанням комп'ютерної програми ТЕРІТОРЕ (Bian and Hammer, 2004). Аналіз ТЕРІТОРЕ дав в результаті 6 епітопів-кандидатів для SVN і 11 епітопівкандидатів для PR3 з високою ймовірністю зв'язування для різних алелей HLA-DR. Ці 17 пептидів були використані в імунологічних експериментах з Т-клітинами, після синтезу та хроматографічного очищення. Різні довжини пептидів пояснюються перекриттям епітопів, які розглядалися разом в одному пептиді (Таблиця 4). 16 UA 103481 C2 5 10 15 20 25 30 35 40 45 50 55 60 (Примітка: S88 - це фактично S98, тобто, автори Piesche et al, можливо, зробили помилку у визначенні позиції цього епітопу). Piesche провів титрувальні експерименти з відповідними пептидами для оцінки афінності пептидів до HLA або їхньої HLA/TCR-авідності. Чим нижче концентрація пептиду, тим вище афінність зв'язування пептидних епітопів з МНС-молекулами, це є важливою передумовою природної презентації "істинних" епітопів Т-клітин з внутрішньоклітинного процесінгу антигену білку. Виміряна напівмаксимальна проліферативна активність пептид-специфічних Т-клітинних клонів становила
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel and powerful mhc-class ii petptides derived from survivin
Автори російськоюStevanovic, Stefan, Gouttefanges, Cecile, Rammensee, Hans-Georg, Weinschenk, Toni, Lewandrowski, Peter
МПК / Мітки
МПК: C07K 14/47, A61K 38/00, C07K 16/18, C12N 15/12
Мітки: одержані, зв'язуватися, мають, пептиди, здатність, сурвівіну, класу
Код посилання
<a href="https://ua.patents.su/87-103481-oderzhani-z-survivinu-peptidi-shho-mayut-zdatnist-zvyazuvatisya-z-mhc-klasu-ii.html" target="_blank" rel="follow" title="База патентів України">Одержані з сурвівіну пептиди, що мають здатність звязуватися з mhc класу ii</a>
Попередній патент: Галогенідвмісний кремній, спосіб його одержання і застосування
Наступний патент: Гербіцидна композиція, спосіб боротьби з небажаною рослинністю з її використанням (варіанти)
Випадковий патент: Фільтр для очищення газів конусний (фгк)