Каліксарен-1-гідроксиметилен-1,1-бісфосфонові кислоти як інгібітори протеїнтирозинфосфатази 1в
Номер патенту: 100640
Опубліковано: 10.01.2013
Автори: Кальченко Віталій Іванович, Труш В'ячеслав Володимирович, Кухар Валерій Павлович, Черенок Сергій Олексійович, Вовк Андрій Іванович, Ющенко Олександр Анатолійович, Танчук Всеволод Юлійович
Формула / Реферат
Каліксарен-1-гідроксиметилен-1,1-бісфосфонові кислоти загальної формули
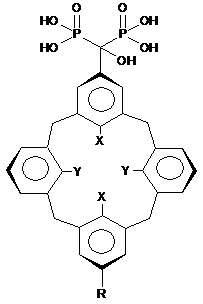 ,
,
де R=H або R=CH(OH)[PO(OH)2]2, X=OH, Y=OCH2CH2CH3, як інгібітори протеїнтирозинфосфатази 1В.
Текст
Реферат: Винахід належить до біоорганічної хімії, а саме до синтезу каліксарен-1-гідроксиметилен-1,1бісфосфонових кислот загальної формули UA 100640 C2 (12) UA 100640 C2 HO HO O O P P OH OH OH X Y Y X R , де R=H, X=OH, Y=OCH2CH2CH3 (сполука A), R=CH(OH)[PO(OH)2]2, Х=OН, Y=ОСН2СН2СН3 (сполука Б), і вивчення їх властивостей як інгібіторів протеїнтирозинфосфатази 1В. Сполуки (А) і (Б) отримують послідовною реакцією калікс[4]аренкарбонілхлоридів з тристриметилсилілфосфітом та метанолом. В системі in vitro сполуки (А) і (Б) демонструють інгібуючу здатність до людської РТР1В з ІС50 в мікромолярному діапазоні значень і селективністю у порівнянні з іншими протеїнтирозинфосфатазами (ТС-РТР, PTP-LAR). Сполуки (А) і (Б) рекомендуються як інгібітори протеїнтирозинфосфатази 1В і можуть знайти застосування в біології, фармакології і медицині. HO HO O O P P OH X Y Y X R OH OH UA 100640 C2 5 10 15 20 25 30 35 40 Винахід належить до органічної хімії, а саме до синтезу і вивчення нових біологічно активних каліксарен-1-гідроксиметилен-1,1-бісфосфонових кислот, які можуть бути використані в біології, фармакології та медицині. Нові запропоновані сполуки, спосіб їх отримання, властивості і застосування в науковій літературі і патентних виданнях не описані. Фосфорилювання і дефосфорилювання тирозинових залишків білків є ключовою стадією сигнальних процесів, які регулюють ріст, проліферацію, диференціацію, метаболізм та міграцію клітин живих організмів. Порушення функцій протеїнтирозинфосфатаз (РТРаз) приводить до порушення балансу між фосфорильованими і дефосфорильованими білками, що супроводжується виникненням і перебігом ряду хвороб, включаючи рак і діабет [1-3]. Протеїнтирозинфосфатаза 1В (PTP1B) здатна дефосфорилювати тирозинові залишки інсулінових рецепторів, що приводить до блокування приєднання інсуліну та наступних інсулінзалежних процесів [1-4]. Крім того, РТР1В впливає на передачу сигналу від лептину [5]. Тому інгібітори РТР1В розглядаються як ліки нової генерації від діабету 2 типу та ожиріння [1, 2]. Останнім часом спостерігається зростаючий інтерес до синтезу і подальших досліджень потенційних інгібіторів РТР1В [6, 7]. Найпершими інгібіторами РТР1В, що вивчалися in vivo, були сполуки ванадію, але фізіологічна дія цих сполук не була специфічною [8, 9]. Було також синтезовано і вивчено in vitro ряд органічних похідних карбонових, фосфонових і сульфонових кислот [10-13], гетероциклічних та інших сполук [6, 14, 15]. Хоч це й привело до виявлення потужних інгібіторів РТР1В, проте їх дослідження не вийшли за межі доклінічної стадії [1, 6]. Так, подальші тестування одного з інгібіторів під назвою "ертіпротафіб" було припинено, оскільки ця сполука впливає не лише на РТР1В, але й активує деякі рецептори клітинного ядра [16, 17]. Однією з інших причин, що стримують впровадження інгібіторів РТР1В, є низька селективність у порівнянні з іншими ферментами, особливо Т-клітинною протеїнтирозинфосфатазою (ТС-РТР), що є модулятором запальних процесів в організмі людини [18]. Раніше нами було встановлено, що ковалентне закріплення фрагментів фосфонових кислот на верхньому ободі калікс[4]арену приводить до значного зростання інгібуючої активності фосфорильованих макроциклів щодо лужних фосфатаз [19, 20]. Такі сполуки можуть мати переваги через здатність утворювати комплекси з іонами металів або амінокислотними залишками білків [21] та кращу проникність через біологічні мембрани завдяки наявності ліпофільної макроциклічної платформи [22]. Подальші результати наших досліджень показали, що калікс[4]аренметиленбісфосфонові і калікс[4]аренметилфосфонові кислоти є потужними інгібіторами РТРази з Єрсинії (Yop51*) та РТРβ з константами інгібування в низькомікромолярному діапазоні значень [23-26]. З огляду на те, що похідні 1-гідроксиметилен-1,1-бісфосфонової кислоти, такі як алендронат або памідронат, здатні інгібувати фосфатази [27, 28], можна було сподіватися, що наявність одного або двох фрагментів гідроксиметиленбісфосфонової кислоти на платформі каліксарсну надасть макроциклічній сполуці властивості інгібітора РТР1В. Але до цього часу нанорозмірні каліксаренфосфонові кислоти не були синтезовані і не були досліджені як інгібітори РТР1В. Задачею винаходу був синтез калікс[4]арен-1-гідроксиметилен-1,1-бісфосфонових кислот, а саме 5-[біс(дигідроксифосфорил)гідроксиметил]-25,27-дипропокси-26,28дигідроксикалікс[4]арену (А) та 5,17-біс[біс(дигідроксифосфорил)гідроксиметил]-25,27дипропокси-26,28-дигідроксикалікс[4]арену (Б) загальної формули HO HO O O P P OH OH OH X Y Y X R , 1 UA 100640 C2 5 10 15 20 де R=H, Х=ОН, Y=OCH2CH2CH3 (сполука A), R=CH(OH)[PO(OH)2]2, X=OH, Y=OCH2CH2CH3 (сполука Б),і дослідження їх властивостей як інгібіторів протеїнтирозинфосфатази 1В. Структурно ці сполуки через наявність фрагментів метиленбісфосфонової кислоти належать до групи макроциклічних метиленбісфосфонових кислот. Однак у випадку сполук (А) або (Б) інгібітор має в своїй структурі один або два залишки 1-гідроксиметилен-1,1-бісфосфонової кислоти, що відрізняє їх від раніше відомих калікс[4]аренметилен-1,1-бісфосфонових кислот [24]. Так як РТР1В характеризується високою гомологічністю з еукаріотичним сімейством РТРаз, інгібуючий вплив сполуки А на активність РТР1В необхідно було оцінити з огляду на його ефективність та селективність по відношенню до інших фосфатаз, особливо до Т-клітинної РТРази (ТС-РТР). Калікс[4]арен-1-гідроксиметилен-1,1-бісфосфонову кислоту (А) та калікс[4]арен-біс-1-гідроксиметилен-1,1-бісфосфонову кислоту (Б) синтезовано у відділі фосфоранів Інституту органічної хімії НАН України. Вивчення інгібуючого впливу сполук (А) та (Б) на активність РТР1В виконано у відділі механізмів біоорганічних реакцій Інституту біоорганічної хімії та нафтохімії НАН України. Поставлена задача досягається розробкою методу синтезу калікс[4]арен-1-гідроксиметилен1,1-бісфосфонової кислоти (А) та калікс[4]арен-біс-1-гідроксиметилен-1,1-бісфосфонової кислоти (Б) і встановленням ефективності та селективності інгібуючого впливу цих сполук на активність людської РТР1В. Калікс[4]арен-1-гідроксиметилен-1,1-бісфосфонову кислоту (А) та калікс[4]арен-біс-1гідроксиметилен-1,1-бісфосфонову кислоту (Б) отримують послідовною реакцією калікс[4]аренкарбонілхлоридів (сполуки (В) і (Г), відповідно) з тристриметилсилілфосфітом та метанолом. O HO Cl HO OH OPr PrO O P P OH OH 1. (Me3SiO)3P 2. MeOH OH 25 O OPr PrO OH (A) (B) 2 OH OH UA 100640 C2 O HO Cl HO O O P P OH OH OPr 1. (Me3SiO)3P OPr 2. MeOH OH PrO OH HO O HO (Г) OH P P O O (Б) 5 10 15 20 25 30 35 OH OH PrO Cl OH OH OH . В результаті дослідження біологічних властивостей in vitro встановлено, що сполуки (А) і (Б) інгібують активність РТР1В в мікромолярному діапазоні концентрацій. За умов дослідів при використанні n-нітрофенілфосфату як субстрату (концентрація 2 мМ) значення IC50 сполуки (А) складає 3,8±0,2 мкМ, а сполуки (Б) - 4,4±0,3 мкМ (Рис.). Важливим також є те, що вплив запропонованих інгібіторів (А) та (Б) на активність РТР1В є значно більшим у порівнянні з виливом на інші фосфатази з тканин людини. Так, значення IC 50 інгібування ТС-РТР, PTP-LAR сполукою (А) складають 23 мкМ, 90 мкМ, відповідно, та 18 мкМ, 113 мкМ сполукою (Б), відповідно. Значення IC50 інгібування плацентарної лужної фосфатази є більшим за 200 мкМ для обох сполук (Таблиця). У випадку сполуки (А) значення IC 50 інгібування РТР1В приблизно на порядок менше від значення IC50 інгібування РТР(3. У випадку сполуки (Б) значення ІС 5о інгібування РТР1В і РТРβ приблизно однакові. Отже, інгібуючий вплив калікс[4]арен-1гідроксиметилен-1Д-бісфосфонової кислоти (А) та калікс[4]арен-біс-1-гідроксиметилен-1,1бісфосфонової кислоти (Б) є селективним у порівнянні з впливом цих сполук на людські протеїнтирозинфосфатази ТС-РТР, PTP-LAR та лужну фосфатазу з плаценти людини. Таким чином, нові калікс[4]арен-1-гідроксиметилен-1,1-бісфосфонові кислоти, а саме 5[біс(дигідроксифосфорил)гідроксиметил]-25,27-дипропокси-26,28-дигідроксикалікс[4]арен (А) і 5,17-біс[біс(дигідроксифосфорил)гідроксиметил]-25,27-дипропокси-26,28дигідроксикалікс[4]арен (Б) є ефективними інгібіторами РТР1В і діють селективно у порівнянні з іншими людськими РТРазами (ТС-РТР, PTP-LAR) та плацентарною лужною фосфатазою. Сполуки (А) і (Б) можуть знайти застосування в галузі біології, фармакології і медицині при дослідженні інгібіторів РТРаз та створенні нових лікарських засобів. Винахід ілюструється наступними прикладами. Приклад 1 Синтез 5-[біс(дигідроксифосфорил)гідроксиметил]-25,27-дипропокси-26,28дигідроксикалікс[4]арену (А). Калікс[4]аренкарбонілхлорид (В) (0,5 г, 0,875 ммоль) розчиняють в 15 мл тетрагідрофурану і до отриманого розчину додають трис-триметилсилілфосфіт (0,78 г, 2,63 ммоль). Реакційну суміш перемішують при кімнатній температурі впродовж 24 год. Потім розчинник випарюють і залишок висушують у вакуумі (0,05 мм рт. ст., 10 год.) при температурі 50 °C. Отриманий силіловий естер розчиняють в абсолютному метанолі (15 мл). Реакційну суміш перемішують при температурі 30 °C протягом 2 год., метанол випарюють при зниженому тиску. Залишок висушують у вакуумі (0,05 мм рт. ст.) протягом 2 год. Отримують 0,56 г калікс[4]арену (А) у 1 вигляді світлого порошку (вихід 93 %). Тпл >200 °C Н ЯМР (300 МГц, ДМСО-d6): δ, м. ч.: 8,41, 8,47 (два с, 1Н + 1Н, АrОН); 7,19 (с, 2 Н, м-ArH), 7,09 (м, 2Н + 2Н + 2Н, м-ArH 6,51, 6,73 (два т, 2Н + 1Н, J 7,5 Гц, р - ArH), 4,22 (д, 4Н, J 13,2 Гц ArCH2ах), 3,93 (уш. с, 4Н, ОСH2СН2СН3), 3,15, 3,43 (два д, 4Н, J 13,2 Гц, ArCH2cq), 2,06 (м, 4H, ОСH2СН2СН3), 1,35 (т, 6Н, J 7,5 Гц, 3 UA 100640 C2 31 5 10 15 20 25 30 35 40 45 50 55 60 + ОСH2СН2СН3). ЯМР Р (121,5 МГц, ДМСO-d6), δ, м. ч.: 19,9; m/z (FAB MASS) 700,3 ([М+Н] , 75 %. Приклад 2 Синтез 5,17-біс[біс(дигідроксифосфорил)гідроксиметил]-25,27-дипропокси-26,28дигідроксикалікс[4]арену (Б). Калікс[4]арен-біс-карбонілхлорид (Г) (1 г, 1,57 ммоль) розчиняють в 15 мл теграгідрофурану, а до отриманого розчину додають тристриметилсилілфосфіт (3,06 г, 10,26 ммоль). Далі реакційну суміш перемішують при кімнатній температурі протягом 24 год., а потім розчинник випарюють і залишок висушують у вакуумі (0,05 мм рт. ст., 10 год.) при температурі 50 °C. Отриманий силіловий естер розчиняють в абсолютному метанолі (15 мл). Реакційну суміш перемішують при температурі 30 °C протягом 2 год., метанол випарюють при зниженому тиску. Залишок висушують у вакуумі (0,05 мм рт. ст.) протягом 2 год. Отримують 1,3 г калікс[4]арену 1 (Б) у вигляді світлого порошку (вихід 91 %). Тпл >200 °C Н ЯМР (300 МГц, ДМСО-d6): δ, м.ч.: 8,4 (шир. с, 2Н, РhОH); 7,63 (шир. с, 4Н, ArH); 7,23 (шир. с, 4Н, ArH); 6,79 (шир. с, 2Н, ArH); 4,23 (шир. с, 4Н, ArCH2ах); 3,98 (шир. с, 4Н, ОСH2СН2СН3), 3,36 (шир. с, 4Н, ArCH2eq), 2,05 (м, 31 СH2СН2О), 1,24 (шир. с, 6Н, СН2СH3), ЯМР Р (121,5 МГц, ДМСO-4), 5, м. ч.: 19,6. Мас-спектр + (FAB) m/z; 890[M+H] . Розраховано М 888,6. Приклад 2 Ефективність інгібування РТР1В калікс[4]арен-1-гідроксиметилен-1,1-бісфосфоновими кислотами (А) і (Б). Досліди було проведено in vitro з використанням препаратів рекомбінантної РТР1В, що були придбані у фірми "Sigma". Фермент був прототипом нетрансмембранного білка з масою 37,4 кДа, отриманого шляхом експресії в Е. соlі (1-322 амінокислотних залишків людської РТР1В). Підготовлений до роботи розчин РТР1В зберігався при -70 °C в середовищі з 45 мМ трис-НСl (рН 8,0), 3 мМ DTT, 124 мМ NaCl, 2,4 мМ КСl, 18 мМ глутатіоном та 10 %-ним гліцерином. Реакційна суміш вміщувала 0,05 М біс-трис-буфер (рН 7,2), 100 мМ NaCI, 2,0 мМ ЕДТА, 3,0 мМ DTT та 40 нМ РТР1В і 2 мМ n-нітрофенілфосфат як субстрат (реактиви фірми "Sigma"). Загальний об'єм реакційної суміші складав 0,5 мл. Кожну пробу витримували 10 хв. при 30 °C. Реакцію розпочинали додаванням ферменту. Активність ферменту розраховували за швидкістю утворення n-нітрофенолу в результаті ферментативного гідролізу n-нітрофенілфосфату, вимірюючи оптичну густину розчину при 410 нм. Інгібітор був попередньо розчинений в системі диметилсульфоксид - вода. Вміст диметилсульфоксиду в реакційній суміші складав 1 об. %. Для визначення значення IC50 було вивчено залежність залишкової активності РТР1В від концентрації інгібіторів (2 мкМ, 4 мкМ, 6 мкМ для сполуки (А) і 4 мкМ, 5 мкМ, 6 мкМ, 8 мкМ для сполуки (Б). Залишкову активність ферменту розраховували в процентах до активності ферменту в дослідах без інгібітора. Величина ІС50 відповідала концентрації інгібітора, яка спричиняла зниження активності ферменту на 50 %. Обраховували середнє значення IC 50 та стандартну похибку. Рис. демонструє залежність інгібуючої дії сполук (А) і (Б) від їх концентрації в реакційній суміші. Видно, що зі збільшенням концентрації калікс[4]арен-1-гідроксиметилен-1,1бісфосфонової кислоти (А) до 6 мкМ інгібування ферменту складає приблизно 90 %. Залишкова активність в присутності 6 мкМ калікс[4]аренбіс-1-гідроксиметилен-1,1-бісфосфонової кислоти (Б) дорівнює 31 %. Середнє значення IC50 сполуки (А) дорівнює 3,8±0,2 мкМ, а сполуки (Б) 4,4±0,3 мкМ. Приклад 3 Селективність інгібування РТР1В калікс[4]арен-1-гідроксиметилен-1,1-бісфосфоновими кислотами (А) і (Б). Для дослідження селективності інгібування РТР-1В сполуками (А) і (Б) використовували протеїнтирозинфосфатази з тканин людини: ТС-РТР, РТРр, PTP-LAR, а також плацентарну лужну фосфатазу (Таблиця). Реакційна суміш (30 °C) при дослідженні інгібуючої здатності калікс[4]арен-α-кетофосфонових кислот (А) і (Б) відносно ТС-РТР вміщувала 0,05 М біс-трисбуфер (рН 7,0), 100 мМ NaCI, 1,0 мМ EDTA, 1,0 мМ DTT, 0,8 % DMSO та 1,0 мМ nнітрофенілфосфат як субстрат. При дослідженні інгібування РТР(3 (30 °C) реакційна суміш складалася з 0,05 М біс-трис- буферу (рН 7,2), 100 мМ NaCI, 2,0 мМ DETA, 3,0 мМ DTT, 1 % DMSO та 2,0 мМ n-нітрофенілфосфату як штучного субстрату. Вплив інгібіторів (А) і (Б) на активність PTP-LAR (30 °C) досліджували в 0,05 М біс-трис-буфері (рН 7,2) в присутності 100 мМ NaCI, 1,0 мМ EDTA, 1,0 мМ DTT, 0,8 % DMSO та 2,0 мМ n-нітрофенілфосфату як субстрату. При дослідженні інгібування плацентарної лужної фосфатази (25 °C) реакційна суміш вміщувала 0,1 М трис-НСІ-буфер (рН 9,0), 0,25 % DMSO та 0,75 мМ n-нітрофенілфосфат як субстрат. Утворення n-нітрофенолу внаслідок ферментативного гідролізу n-нітрофенілфосфату 4 UA 100640 C2 5 вимірювали за зростанням оптичної густини реакційної суміші при 410 нм, використовуючи -1 -1 молярний коефіцієнт абсорбції n-нітрофенолу 18300 М сm . Залишкову активність ферменту оцінювали в процентах до активності ферменту в дослідах без інгібітора. Обраховували середнє значення IC50 та стандартну похибку. Одержані результати свідчать про те, що вплив калікс[4]арен-1-гідроксиметилен-1,1бісфосфонової кислоти (А) на активність РТР1В є селективним у порівнянні з ТС-РТР, РТРβ, PTP-LAR і плацентарною лужною фосфатазою. Вплив калікс[4]арен-біс-1-гідроксиметилен-1,1бісфосфонової кислоти (Б) на активність РТР1В є селективним у порівнянні з ТС-РТР, PTP-LAR і плацентарною лужною фосфатазою 10 Таблиця Значення IC50 калікс[4]арен-1-гідроксиметилен- 1,1-бісфосфонової кислоти (А) та калікс[4]аренбіс-1-гідроксиметилен-1,1-бісфосфонової кислоти (Б) як інгібіторів РТР1В та інших РТРаз. Фермент РТР1В ТС-РТР РТРβ PTP-LAR Лужна фосфатаза (плацентарна) 15 20 25 30 35 40 45 IC50, мкМ (сполука А) 3,8±0,2 23±1 41±9 90±9 >200 IC50, мкМ (сполука Б) 4,4±0,3 18±1 5±0,4 >100 >200 Відносні значення IC50 при інгібуванні сполукою (А) для РТР1В, ТС-РТР, РТРβ, PTP-LAR складають 1,6, 11, 24, відповідно. Інгібуючий вплив інгібітора (А) на РТР1В більше ніж у 50 разів перевищує його вплив на плацентарну лужну фосфатазу. Відносні значення IC 50 при інгібуванні сполукою (Б) для РТР1В і ТС-РТР складають 1 і 4, відповідно. Важливим може бути той факт, що інгібітор (Б) демонструє мікромолярні значення IC50 як до РТР1В, гак і до РТРβ. Вплив інгібітора (Б) на РТР1В більше ніж у 45 разів сильніший, ніж його вплив на плацентарну лужну фосфатазу і більше ніж у 20 разів сильніший ніж вплив на PTP-LAR. ПЕРЕЛІК ПОСИЛАНЬ 1. Blaskovich M.A. Drug discovery and protein tyrosine phosphatases // Curr. Med. Chem. - 2009. - Vol. 16. - P. 2095-2176. 2. Montalibet J., Kennedy B. P. Therapeutic strategies for targeting PTP1B in diabetes // Drug Discovery Today: Therapeutic Strategies.-2005. - Vol. 2, No. 2. – P. 129-135. 3. Lessard L., Stuible M., Tremblay M. L. The two faces of PTP1B in cancer // Biochim. Biophys. Acta.-2010. - Vol. 1804. - P. 613-619. 4. Yip S.-C, Saha S., Chernoff J. PTP1B: a double agent in metabolism and oncogenesis // Trends Biochem. Scienc. - 2010. - Vol. 35. - P. 442-449. 5. Cheng A., Uetani N., Simoncic P.D., Chaubey V.P., Lee-Loy A., McGlade C.J., Kennedy B.P., Tremblay M.L. Attenuation of leptin action and regulation of obesity by protein tyrosine phosphatase 1В // Dev. Cell.-2002. - Vol. 2, No. 4. - P. 497-503. 6. Vintonyak V.V., Antonchick A.P., Rauh D., Waldmann H. The therapeutic potential of phosphatase inhibitors // Curr. Opin. Chem. Biol.-2009. - Vol. 13. - P. 272-283. 7. Zhang S., Zhang Z.Y. PTP1B as a drug target: recent developments in PTP1B inhibitor discovery // Drug Discovery Today.-2007. - Vol. 12. - P. 373-381. 8. Posnera B.I., Faureb R., Burgessc W.J., Bevand A.P., Lachancee D., Zhang-Sund G., Fantusf I.G., Ne J.B., Hallg D.A., Lumg B.S., Shavers A. Peroxovanadium compounds: a new class of potent phospho tyro sine phosphatase inhibitors which are insulin mimetics //J. Biol. Chem. - 1994. Vol. 269. - P. 4596-604. 9. Fantus I.G., Tsiani E. Multifunctional actions of vanadium compounds on insulin signaling pathways: evidence for preferential enhancement of metabolic versus mitogenic effects //Моl. Cell. Biochem. - 1998. - Vol. 182, No. 1-2. - P. 109-119. 10. Chen Y.T., Seto C.T. Divalent and Trivalent a-Ketocarboxylic Acids as Inhibitors of Protein Tyrosine Phosphatases //J. Med. Chem. - 2002. - Vol. 45. - P. 3946-3952. 11. Zhang Z.Y. Functional studies of protein tyrosine phosphatases with chemical approaches // Biochim. Biophys. Acta. - 2005. - Vol. 1754. - P. 100-107. 12. Li X., Bhandari A., Holmes C.P., Szardenings A.K. a, a-Difluoro-|3-ketophosphonates as potent inhibitors of protein tyrosine phosphatase 1B // Bioorg. Med. Chem. Lett.-2004. - Vol. 14. P. 4301-4306. 5 UA 100640 C2 5 10 15 20 25 30 35 40 45 13. Tautz L., Mustelin T. Strategies for developing protein tyrosine phosphatase inhibitors // Methods.-2007. - Vol. 42. - P. 250-260. 14. Kumar A., Ahmad P., Maurya R.A., Singh А.В., Srivastava A.K. Novel 2-aryl-naphtho[l, 2d]oxazole derivatives as potential PTP-1B inhibitors showing antihyperglycemic activities //Eur. J. Med. Chem. - 2009. - Vol. 44. - P. 109-116. 15. Lau C.K., Bayly C.I., Gauthier J.Y., Li C.S., Therien M., Asante-Appiah E., Cromlish W., Boie Y., Forghani F., Desmarais S., Wang Q., Skorey K., Waddleton D., Payette P., Ramachandran C, Kennedy B.P., Scapin G. Structure based design of a series of potent and selective non peptidic PTP1B inhibitors // Bioorg. Med. Chem. Lett.-2004. - Vol. 14. - P. 1043-1048. 16. Tobin J.F., Tarn S. Recent advances in the development of small molecule inhibitors of PTP1B for the treatment of insulin resistance and type 2 diabetes // Curr. Opin. Drug Discovery Develop.-2002. - Vol. 5, No. 4. - P. 500-512. 17. Erbe D.V., Wang S., Zhang Y.L. et al. Ertiprotafib improves glycemic control and lowers lipids via multiple mechanisms // Мої. Pharm.-2005. - Vol. 67, No. l. - P. 69-77. 18. Stuible M., Doody K.M., Tremblay M.L. PTP1B and TC-PTP: regulators of transformation and tumorigenesis // Cancer Metastasis Rev. - 2008. - Vol. 27. - P. 215-230. 19. Vovk A., Kalchenko V., Cherenok S., Kukhar V., Muzychka O., Lozynsky M. Calix[4]arene methylenebisphosphonic acids as calf intestine alkaline phosphatase inhibitors // Org. Biomol. Chem.2004. - Vol. 2, N 21. - P. 3162-3166. 20. Cherenok S., Vovk A., Muravyova I., Shivanyuk A., Kukhar V., Lipkowski J., Kalchenko V. Calix[4]arene a-aminophosphonic acids: asymmetric synthesis and enantioselective inhibition of an alkaline phosphatase // Org. Lett.-2006. - Vol. 8, N 4. - P. 549-552. 21. Asfari Z., Bohmer V., Harrowfield J., Vicens J. Netherlandes Eds. Calixarenes. // Kluwer Academic Publishers: Dordrecht. - 2001. - P. 642. 22. Lalor R., Baillie-Johnson H., Redshaw C, Matthews S. E., Mueller A… Cellular uptake of a fluorescent calix[4]arene derivative // J. Am. Chem. Soc.-2008. - Vol. 130, N 10. - P. 2892-2893. 23. Vovk A.I., Kononets L.A., Tanchuk V. Yu., Cherenok S.O., Drapailo А.В., Kalchenko V.I., Kukhar V.P. Inhibition of Yersinia protein tyrosine phosphatase by phosphonate derivatives of calixarenes // Bioorg. Med. Chem. Lett. - 2010. - Vol. 20. - P. 483-487. 24. Пат. на корисну модель № 45551, Україна, МПК С07С 15/006 C12N 9/12, А61K 31/662. Застосування 5,17-біс[біс(дигідроксифосфорил)метил]-25,27-дипропокси-26,28дигідроксикалікс[4]арену як інгібітора протеїнтирозинфосфатази / Кононець Л.А., Вовк А.І., Танчук В.Ю., Черенок С.Ю., Кальченко В.І., Кухар В.П. - Заявл. 06.07.2009; Опубл. 10.11.2009, Бюл. № 21. 25. Пат. на корисну модель № 48049, Україна МПК С07С 15/006 C12N 9/12, А61K 31/662. Застосування 5,11,17,23-тетракіс[(дигідроксифосфорил)метил]-25,26,27,28тетрагідроксикалікс[4]арену як інгібітора протеїнтирозинфосфатази / Кононець Л.А., Вовк А.І., Танчук В.Ю., Драпайло А.Б., Кальченко В.І., Кухар В.П. Заявл. 06.07.2009. Опубл. 10.03.2010, Бюл. № 5. 26. Пат. на корисну модель № 48050. Застосування 5,11,17,23тетракіс[(дигідроксифосфорил)метил]-25,26,27,28-тетрагідрокситіакалікс[4]арену як інгібітора протеїнтирозинфосфатази / Кононець Л.А., Вовк А.І., Танчук В.Ю., Драпайло А.Б., Кальченко В.І., Кухар В.П. Заявл. 06.07.2009. Опубл. 10.03.2010, Бюл. № 5. 27. Morelli S., Bilbao P.S., Katz S., Lezcano V., Roldan E., Boland R., Santillan G. Protein phosphatases: Possible bisphosphonate binding sites mediating stimulation of osteoblast proliferation // Arch. Biochem. Biophys.-2011. - Vol. 507, N 2. - P. 248-253. 28. Skorey K., Ly H. D., Kelly J., Hammond M., Ramachandran C, Huang Z., Gresser M. J., Wang Q. How Does Alendronate Inhibit Protein-tyrosine Phosphatases // J. Biol. Chem.-1997. - Vol. 272, No. 36. - P. 22472-22480. 50 ФОРМУЛА ВИНАХОДУ Каліксарен-1-гідроксиметилен-1,1-бісфосфонові кислоти загальної формули 6 UA 100640 C2 HO HO O O P P OH OH OH X Y Y X R , де R=H або R=CH(OH)[PO(OH)2]2, протеїнтирозинфосфатази 1В. X=OH, Y=OCH2CH2CH3, як Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7 інгібітори
ДивитисяДодаткова інформація
Назва патенту англійськоюCalixarene-1-hydroxymethylene-1,1-bisphosphonic acids as protein tyrosine phosphatase 1b inhibitors
Автори англійськоюCherenok Serhii Oleksiiovych, Trush Viacheslav Volodymyrovych, Tanchuk Vsevolod Yuliiovych, Yuschenko Oleksandr Anatoliiovych, Kalchenko Vitalii Ivanovych, Vovk Andrii Ivanovych, Kukhar Valerii Pavlovych
Назва патенту російськоюКаликсарен-1-гидроксиметилен-1,1-бисфосфоновые кислоты как ингибиторы протеинтирозинфосфатазы 1в
Автори російськоюЧеренок Сергей Алексеевич, Труш Вячеслав Владимирович, Танчук Всеволод Юлиевич, Ющенко Александр Анатольевич, Кальченко Виталий Иванович, Вовк Андрей Иванович, Кухар Валерий Павлович
МПК / Мітки
МПК: C12N 9/12, C07C 15/00, A61K 31/662
Мітки: інгібітори, протеїнтирозинфосфатази, каліксарен-1-гідроксиметилен-1,1-бісфосфонові, кислоти
Код посилання
<a href="https://ua.patents.su/9-100640-kaliksaren-1-gidroksimetilen-11-bisfosfonovi-kisloti-yak-ingibitori-protentirozinfosfatazi-1v.html" target="_blank" rel="follow" title="База патентів України">Каліксарен-1-гідроксиметилен-1,1-бісфосфонові кислоти як інгібітори протеїнтирозинфосфатази 1в</a>
Попередній патент: Абразивний виріб з поліпшеним утримуванням зерен і поліпшеними характеристиками
Наступний патент: Стрічковий фільтр-прес
Випадковий патент: Спосіб діагностування тепловозних двигунів внутрішнього згоряння за нерівномірністю частоти обертання колінчастого вала та параметрами пускового струму












