Похідні ксантину, спосіб їх одержання, та фармацевтична композиція
Номер патенту: 32512
Опубліковано: 15.02.2001
Автори: Сото Хосе Мануель Прієто, Гріствуд Роберт В., Маурі Хасінто Морагес, Новерола Армандо Вега
Формула / Реферат
(57) 1 Производные ксантина общей формулы (І)
Где R1 представляет собой прямую или разветвленную цепь алкил-, алкенил- или алкинилгруппы из 3-6 атомов углерода,
R2 и R3 могут быть одинаковыми или различными и каждый представляет собой водород или галоген, или метил-, метокси, нитро- или трифторметильную группу, или R2 и R3 вместе образуют метилендиокси- или этилендиоксигруппу, при условии, что R2 и R3 оба не являются водородом,
Или их фармацевтически приемлемые соли с основанием щелочного металла или азотсодержащим органическим основанием, обладающие свойствами ингибирования фосфодиэстеразы типа IV
2. Производные ксантина общей формулы (І) по п.1, где R1 представляет собой н-пропил, изопропил, н-бутил, изобутил, трет- бутил или н-гексил.
3. Производные ксантина общей формулы (І) по п.1 или 2, где R2, R3 одинаковые или различные и каждый представляет собой водород, фтор, хлор, бром, метоксигруппу или R2 и R3 вместе образуют метилендиоксигруппу
4. Производные ксантина общей формулы (I) по п.1, выбранные из группы:
1-н-пропил-3-(4-хлорфенил)-ксантин
1-н-пропил-3-(3,4-дихлорфенил)-ксантин
1-н-бутил-3-(3-нитрофенил)-ксантин
1-н-бутил-3-(3-метоксифенил)-ксантин
1-н-гексил-3-(3,4-метилендиоксифенил)-ксантин.
5. Способ получения производных ксантина общей формулы (I)
где R1 представляет собой прямую или разветвленную цепь алкил-, алкенил- или алкинильной группы из 3-6 атомов углерода,
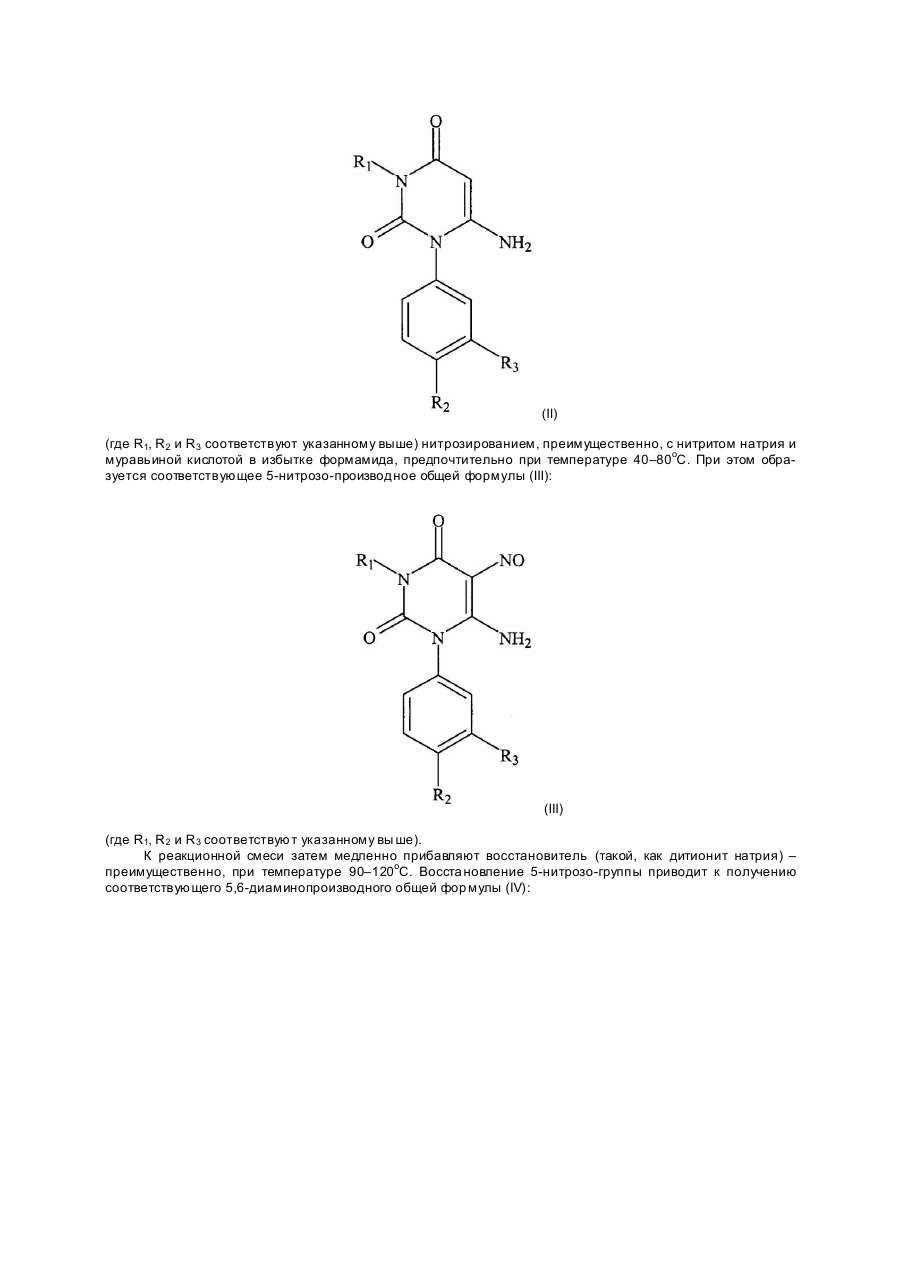
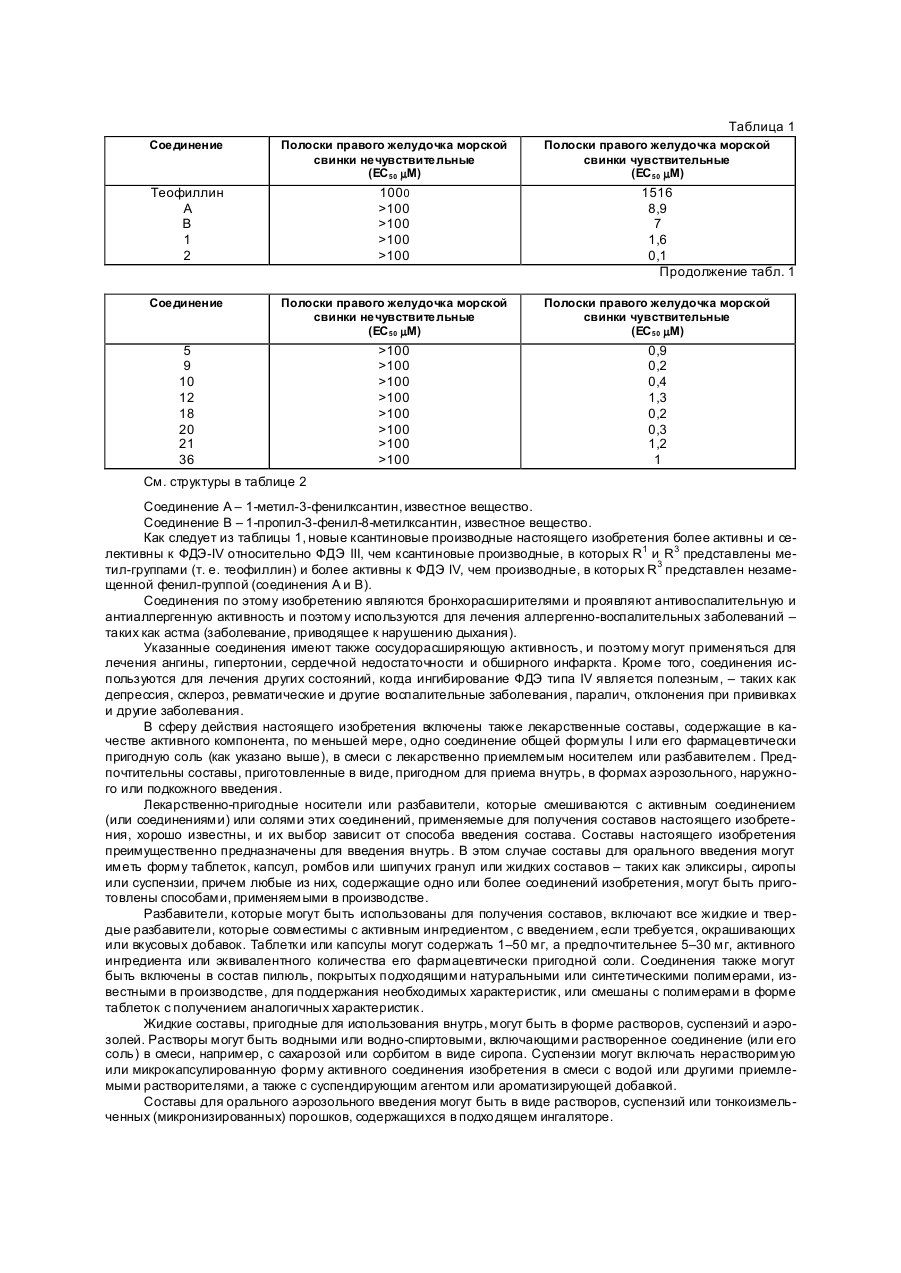
R2 и R3 могут быть одинаковыми или различными и каждый представляет собой водород или галоген, или метил-, метокси-, нитро- или трифторметильную группу, или R2 и R3 вместе образуют метилендиокси- или этилендиоксигруппу, при условии, что R2 и R3 оба не являются водородом, или их фармацевтически приемлемые соли с основанием щелочного металла или азотсодержащим органическим основанием, отличающийся тем, что проводят нитрозирование 6- аминоурацила формулы (ІІ)
где R1, R2, R3 определены выше и восстанавливают полученный 6-амино-5-нитрозоурацил формулы (III)
где R1, R2, R3 определены выше до соответствующего амина формулы (IV)
где R1, R2, R3 определены выше, конденсируют последний с формамидом с получением соединения формулы (I), причем 6-амино-5- нитрозопроизводные и 5,6-диамин образуются in situ.
6. Способ по п. 5, отличающийся тем, что 6-аминоурацил формулы (II) подвергают взаимодействию с нитритом натрия и муравьиной кислотой в избытке формамида и проводят восстановление полученного 6-амино-5-нитросоединения путем добавления к реакционной смеси дитионита натрия.
7. Способ по п. 5 или 6, отличающийся тем, что полученный ксантин формулы (I) выделяют в виде соли щелочного металла азотсодержащего органического основания
8. Фармацевтическая композиция для лечения состояний, требующих ингибирование фосфо-диэстеразы IV типа, содержащая активное начало, представляющее собой производное ксантина и фармацевтически приемлемый носитель или разбавитель, отличающаяся тем, что в качестве производного ксантина она содержит соединения общей формулы (I) или их соли по любому из пп. 1-4 в эффективном количестве.
Текст
Изобретение касается новых терапевти чески пригодных ксантиновых производных, спо собов получения их и лекарственных составов, со держащи х указанные производные. Известно, что циклический аденозинмонофосфат (АМФ, циклический нуклеотид) является важным переносчиком клеточной функции и при увеличении его внутриклеточной концентрации (например, за счет воздействия адентилатциклазы) вызываются такие эффекты, как плавное мышечное сокращение, сердечное возбуждение и угнетение секреторных клеток. Фосфодиэстеразы (ФДЭ) – ферменты, ответственные за разруше ние циклических нуклеотидов и подобных возбудите лей нуклеотидциклаз; ФДЭ – ингибито ры также повышают уровни циклических АМФ и являются, таким образом, эффективными бронхо расширителями, сосудорасширяющими, сердечными стимуляторами и т.д. Много ксантиновых производных – таких как теофиллин, – описанных как ФДЭ-ингибиторы, имеют недостаточную избирательность против различных ти пов ФДЭ, что вызывает нежелательный побочный эффект при применении теофиллина человеком. Известно, по меньшей мере, 7 различных ти пов ФДЭ-ферментов. Ин гибирование ФДЭ III (циклический гуанозинмонофосфат ингибированный, большое сходство с циклическим аденозинмонофосфатферментом, см. Reeves et all., 1987, Biochem. J, 241, 535, повышает внутриклеточные концентрации циклического аденозинмонофосфата и вызывает специфи ческое сердечное возбуждение. Избирательное ингибирование ФДЭ IV (в частности, циклический АМФ-фосфодиэсте раза, см. Reeves et al., 1987), с другой стороны, повышает внутренние концентрации циклического аденозинмонофосфата, и вырабаты ваются отклики, связанные с этими повышениями, но без непосредственного проявления сердечного возбуждения. Так, избирательное ФДЭ IV ингибирование является полезным при лечении болезней, которым не свойственно проявление сердечного возбуждения (например, астма). Мы неожиданно обнаружили, что ксантиновые производные с замещенной фенильной группой в положении 3 и цепью из 3–6 углеродных атомов в положении I, эффективно ингибируют тип IV ФДЭ и являются более слабыми ингибиторами типа III – фермента, и с уче том этого они полезны при лечении болезни, не вызывающей непосредственно сердечного возбуждения. Новые ксанти новые производные настояще го изобретения – соответствующие соединения общей формулы: (І) 1 где R – прямая или разветвленная цепь алкил-, алкенил- или алкинил- группы, содержащая от 3 до 6 (преимущественно 3 или 4) углеродных атомов, R2 и R3 – (каждый) представлены водородом или галоге ном, или метил-, метокси-, нитро- или трифторметил- груп пой, или R2 и R3 – (вместе) образуют метилендиокси- или этилендиоксигруппу; при условии, что R2 и R3 (оба) не являются водородом; и фармацевти чески приемлемые соли этих соединений, образованные с основанием щелочного металла или азотсодержащим органическим основанием. Предпочти тельны те соединения общей формулы I, в которых R1 представлен прямой цепью алкилгруп пы или те, где R1 представлены н- или изопропилом, н-, изо- или трет-бутилом или н-гексил-группой, R2 и R3 могут быть одинаковыми или различными заместителями и представлены водородом или галогеном (например, F, Cl или Br), или метокси-группой; или R 2 и R3 (вместе) представлены метилендиокси-груп пой. Наибольший интерес представляют: I-н-пропил-3-(4-хлорфенил)-ксантин, I-н-пропил-3-(3,4-дихлорфе нил)-ксантин, I-н-бутил-3-(3-нитрофенил)-ксантин, I-н-бутил-3-(3-метоксифе нил)-ксантин и I-н-гексил-3-(3,4-метилендиоксифе нил)-ксантин. Согласно следующе му аспекту настоящего изобретения, ксантиновые производные могут быть получены из соответствующи х 6-аминоурацилов общей фор мулы: (II) (где R1, R2 и R3 соответствуют указанному выше) нитрозированием, преимущественно, с нитритом натрия и муравьиной кислотой в избытке формамида, предпочтительно при температуре 40–80оС. При этом образуется соответствующее 5-нитрозо-производное общей формулы (III): (III) (где R1, R2 и R3 соответствуют указанному вы ше). К реакционной смеси затем медленно прибавляют восстановитель (такой, как дитионит натрия) – преимущественно, при температуре 90–120оС. Восста новление 5-нитрозо-группы приводит к получению соответствующего 5,6-диаминопроизводного общей фор мулы (IV): (IV) (где R1, R2 и R 3 соответствуют указанному вы ше), кото рое затем реагируeт с формамидом, обычно при температуре 170–190оС, с получением ксантинового производного общей формулы I, выделяемого затем известными способами. Термин "известные способы", используемый в данном описании и в формуле заявки, имеет в виду способы, до этого применявшиеся или описанные в литературе. При взаимодействии производного 6-аминоурацила II и нитрита натрия должен применяться избыток муравьиной кислоты – предпочти тельно, по меньшей мере, два моль муравьиной кислоты на моль производного 6-аминоурацила. Хо тя соединения III и IV, последовательно образующиеся в ходе процесса, могут быть выделены, получение производных ксантина общей фор мулы I преимущественно ведут в одну стадию без выделения промежуточных продуктов III и IV. Производные 6-аминоурацила общей фор мулы II могут быть получены из соответствующи х N,N-дизамещенных мочевин известными способами, например, V. Papesch and E.F. Sehroeder, J. Org. Chem. 16 1879–90 1951). Ксантиновые производные общей формулы I, полученные описанными выше способами, могут быть очищены с использованием известных способов, например, перекристаллизацией из органического растворителя (например, метанол, этанол, изопропанол, тетрагидрофуран, диоксан или этилацетат). Ксанти новые производные общей формулы I могут быть переведены в фармацевти чески приемлемые соли щелочных металлов или азотсодержащих органических оснований, причем образование солей проводят взаимодействием при температуре 40–100оС соединения общей формулы I с гидроксидом щелочного металла или азотсодержащим органическим основанием – с использованием в качестве растворителя, например, воды, метанола, этанола. Испытание, используемое для определения ФДЭ IV ингибиторной активности и селективности, основано на наблюдениях, сообщен ных Гриствудом и Суэном. Эффекты реолипрама в желудочках морской свинки in vitro: Признаки неожиданного синергизма с SK&F 94120. Br. J. Pharmacol., 87, 91P., 1985) о том, что в выделенных желудочках морских свинок избирательные к ФДЭ III ингибиторы (например, SK&F 94120) создают положительный инотропический ответ, тогда как ФДЭ IV ингибиторы (например, ролипрам) не дают эффекта. Имеется также синергисти ческое взаимодействие между селективными ингибито рами ФДЭ III и ФДЭ IV в желудочке морской свинки. Предлечение желудочка морской свинки с концентрацией ингибитора ФДЭ III повышает чувстви тельность при применении ингибитора ФДЭ IV, кото рый, при последующем вве дении, будет вызывать положительный инотропический эффект. Ме тодика испыта ния следующая: были умерщвлены самцы морских свинок весом 400–600 г, удалены их сердца и с правой сто роны были высечены 2 желудочных препарата 3 (размером 1 см х 1 мм). Затем они были помещены в ванны, содержащие модифи цированный Krebs-Henseleit раствор следующего состава (мМ): NaCl 118; NaHCO3 25; Глюкоза II, KCl 5,4; CaCl 2 2,5; NaH 2PO4 1,2 и MgCl 2 0,8. Физиологический буфер поддерживался при 37оС и постоянно продувался 95% О2 (5% СО2 об./об.). Препараты были помещены под 1 г оста точного натяжения и электрически возбуждены к сокращению при 1 Гц (сила возбуждения измерялась с применением датчика изометрической силы). Препараты были выдержаны в течение 60 минут, причем в те чение каждых 15 минут они промывались свежим буфером. Концентрация селективного ФДЭ III ингибитора (например, амринона, приводящая почти к 100% увеличению отмеченного напряжения) была затем добавлена в ванну с одним препаратом с целью повышения чувствительности ингибиторов ФДЭ IV. Другой препарат оставался необработанным (с целью определения ингибиторной активности ФДЭ III) и спустя 10 минут, исследуемые соединения были добавлены в ванны с препарата ми в увеличенных концентрациях; эффекты в обоих препаратах измерялись как процент уве личения проявляюще гося напряжения. Были рассчитаны концентрации, приводящие к 50-процентному уве личению, – ЕС50. Таблица 1 Соединение Полоски правого желудочка морской свинки нечувствительные (ЕС50 mМ) Полоски правого желудочка морской свинки чувствительные (ЕС50 mМ) Теофиллин А В 1 2 1000 >100 >100 >100 >100 Соединение Полоски правого желудочка морской свинки нечувствительные (ЕС50 mМ) Полоски правого желудочка морской свинки чувствительные (ЕС50 mМ) 5 9 10 12 18 20 21 36 >100 >100 >100 >100 >100 >100 >100 >100 0,9 0,2 0,4 1,3 0,2 0,3 1,2 1 1516 8,9 7 1,6 0,1 Продолжение табл. 1 См. структуры в таблице 2 Соединение А – 1-метил-3-фенилксантин, известное вещество. Соединение В – 1-пропил-3-фенил-8-метилксантин, известное вещество. Как следует из таблицы 1, новые ксантиновые производные настоящего изобретения более активны и селективны к ФДЭ-IV относительно ФДЭ III, чем ксантиновые производные, в которых R1 и R3 представлены метил-группами (т. е. теофиллин) и более активны к ФДЭ IV, чем производные, в которых R3 представлен незамещенной фенил-группой (соединения А и В). Соединения по этому изобретению являются бронхорасширителями и проявляют антивоспалительную и антиаллергенную активность и поэтому используются для лечения аллергенно-воспалительных заболеваний – таких как астма (заболевание, приводящее к нарушению дыхания). Указанные соединения имеют также сосудорасширяющую активность, и поэтому могут применяться для лечения ангины, гипертонии, сердечной недостаточности и обширного инфаркта. Кроме того, соединения используются для лечения других состояний, когда ингибирование ФДЭ типа IV является полезным, – таких как депрессия, склероз, ревматические и другие воспалительные заболевания, паралич, отклонения при прививках и другие заболевания. В сферу действия настоящего изобретения включены также лекарственные составы, содержащие в качестве активного компонента, по меньшей мере, одно соединение общей формулы I или его фармацевтически пригодную соль (как указано выше), в смеси с лекарственно приемлемым носителем или разбавителем . Предпочтительны составы, приготовленные в виде, пригодном для приема внутрь, в формах аэрозольного, наружного или подкожного введения. Лекарственно-пригодные носители или разбавители, которые смешиваются с активным соединением (или соединениями) или солями этих соединений, применяемые для получения составов настоящего изобретения, хорошо известны, и их выбор зависит от способа введения состава. Составы настоящего изобретения преимущественно предназначены для введения внутрь . В этом случае составы для орального введения могут иметь форму таблеток, капсул, ромбов или шипучих гранул или жидких составов – таких как эликсиры, сиропы или суспензии, причем любые из них, содержащие одно или более соединений изобретения, могут быть приготовлены способами, применяемыми в производстве. Разбавители, которые могут быть использованы для получения составов, включают все жидкие и твердые разбавители, которые совместимы с активным ингредиентом, с введением, если требуется, окрашивающих или вкусовых добавок. Таблетки или капсулы могут содержать 1–50 мг, а предпочтительнее 5–30 мг, активного ингредиента или эквивалентного количества его фармацевтически пригодной соли. Соединения также могут быть включены в состав пилюль, покрытых подходящими натуральными или синтетическими полимерами, известными в производстве, для поддержания необходимых характеристик, или смешаны с полимерами в форме таблеток с получением аналогичных характеристик. Жидкие составы, пригодные для использования внутрь, могут быть в форме растворов, суспензий и аэрозолей. Растворы могут быть водными или водно-спиртовыми, включающими растворенное соединение (или его соль) в смеси, например, с сахарозой или сорбитом в виде сиропа. Суспензии могут включать нерастворимую или микрокапсулированную форму активного соединения изобретения в смеси с водой или другими приемлемыми растворителями, а также с суспендирующим агентом или ароматизирующей добавкой. Составы для орального аэрозольного введения могут быть в виде растворов, суспензий или тонкоизмельченных (микронизированных) порошков, содержащихся в подхо дящем ингаляторе. Составы для внутримышечной инъекции могут быть приготовлены из растворимых соединений или их солей, которые могут быть (что не обязательно) высушены замораживанием и растворены в воде или подходящей для внутримышечной инъекции жидкости. При лечении людей дозы ксантиновых производных зависят от желаемого эффекта и продолжительности болезни: "взрослые" дозы обычно 1–100 мг в день. Вообще врач при лечении выбирает режим лечения, принимая во внимание возраст, тяжесть внутреннего состояния больного пациента. Следующие примеры иллюстрируют изобретение. Пример 1. Смесь 1-(4-хлорфенил)-3-н-пропил-6-аминоурацила (28,0 г 0,1 моль), муравьиной кислоты (15,1 мл; 0,4 моль) и нитрита натрия (7 г, 0,1 моль) в формамиде (600 мл) нагревали при 60оС в течение 10 минут. Температуру затем повысили до 100оС и в течение 10 минут добавили дитионит натрия (2,3 г, 0,013 моль). По окончании дозировки температуру повысили до 190оС, выдержали 30 минут, реакционную смесь охладили и экстрагировали хлороформом. Органический раствор был экстрагирован 2н водным раствором гидроксида натрия, промыт диэтиловым эфиром, подкислен 2н соляной кислотой (водным раствором) и экстрагирован хлороформом. Органические экстракты были промыты водой, высушены (Na2SO4) и в вакууме отогнан растворитель с получением в итоге 1-н-пропил-3-(4-хлорфенил)-ксантина (19,5 г, выход 64,3%). После перекристаллизации из 90% этанола температура плавления = 233–234оС. Ксанти новые производные общей фор мулы I, приве денные в таблице 2, бы ли получены согласно спосо бу, описанному в примере 1, но с соответствующим замести те лем в реагенте 6-амино урациле. Таблица 2 Соед. № R1 R2 R3 Темп. плавл., оС 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 HC3H7 -“-“-“-“-“-“-“-“-“-“-“-“-“-“HC4H9 -“-“-“-“-“-“-“-“HC5H11 -“HC6H13 -“ Cl H F H Br CH3 -“OCH3 H -“-“Cl F OCH3 -“Cl H F H OCH3 H -“Cl H Cl -“-“-“ H Cl H F H -“CH3 H OCH3 NO2 CF2 Cl F OCH3 Cl H Cl H F H OCH3 NO2 Cl CF3 H Cl H Cl 233-234 196-198 258-259 213-214 228-229 227-229 224-226 203-205 203-205 224-228 159-161 231-232 231-232 248-249 266-268 197-198 191-192 246-248 172-173 197-200 189-190 177-180 206-208 167-168 180-183 211-212 161-163 190-191(d) 29 30 31 32 33 34 35 36 37 38 39 изо-C4H9 -“CH2-CH=CH 2 CH2-C=CH HС3H7 HC4H9 HC5H11 HC6H13 изо-C4H9 HC3H7 HC4H9 4 -“-“-/ -“O-CH2-O -“-“-“-“O-CH2-CH2-O -“ H Cl H -“O-CH2-O -“-“-“-“O-CH2-CH2-O -“ 218-219 218-219 242-244 261-262 225-227 214-216 218-219 167-169 247-248 222-223 180-18 Следующие примеры поясняют лекарственные составы согласно изобретению. Пример 2. 100.000 капсул, со держащи х (каждая) 20 мг 1-н-пропил-3-(4-хлор- или 3,4-дихлорфенил)-ксанти на (активного ингредиента), бы ли получены исхо дя из следующей рецептуры: 1-н-пропил-3-(4-хлор- или 3,4-дихлорфенил)-ксантин 2 кг Мо ногидрат лакторы 11,7 кг Кукурузный крахмал 1 кг Коллоидный диоксид кремния 0,1 кг Ме тодика Указанные ингредиенты были просеяны через сито 60 меш, затем смешаны в подхо дящем смесителе и помеще ны в 100.000 желатиновых капсул. Пример 3. 1000 бутылок суспензии (емкость 150 мл), каждая из которых со держит 150 мг 1-н-бутил-3-(3-нитрофе нил)-ксанти на, были приготовлены следующим образом: 1-н-бутил-3-(3-нитрофе нил)-ксантин 150 г микрокристаллическая целлюлоза 1500 г натриевая соль карбоксиметилцеллюлозы 900 г 70% водный раствор сорбита 33000 г глицерин 4500 г полисорбат 80 400 г натриевая соль метил-nгидроксибензоата 240 г пропил-n-гидроксибензоат натрия 60 г анти пенный силоксан 150 г натриевая соль, сахарин 300 г ароматизирующая добавка q.s. деминерализованная вода q.s. 150 литров Ме тодика К раствору метил-n-гидроксибензоата натрия, пропил-n-гидроксибензоата натрия и сахарного натрия в 30 литрах деминерализованной воды была добавлена эмульсия натриевой соли карбоксиметилцеллюлозы в глицерине. После перемешивания в течение часа была добавлена суспензия микрокристаллической целлюлозы в 60 литрах деминерализованной воды, а затем при перемешивании – раствор сорбита, полисорбат 80, 1-н-бутил-3-(3-нитрофенил)- ксантин и ароматизирующая добавка. Объем смеси был доведен до 125 литров деминерализованной водой и смесь пропущена через коллоидную мельницу. Был добавлен антипенный силоксан и суспензия доведена до требуемого объема деминерализованной водой, а затем разлита в бутылки емкостью 150 мл с использованием соответствующей разливочной машины. Пример 4. 20.000 бутылей раствора (емкостью 150 мл), каждая из которых содержит 150 мг 1-н-бутил-3-(3-метоксифе нил)-ксантина, были приготовлены следующим образом: 1-н-бутил-3-(3-метоксифе нил)-ксантин 3 кг этанол 45 кг 70% водный раствор сорбита 1050 кг натриевая соль сахарина 3 кг натриевая соль карбоксиметилцеллюлозы 60 кг ароматизирующая добавка q.s. деминерализованная вода q.s. 3.000 литров Ме тодика Раствор на триевой со ли карбоксиметилцеллюло зы в 1000 литрах во ды и 5 кг эта нола был добавлен к друго му раствор у, состояще му из 1 -н-бутил-3 -(3-ме токсифе нил)-ксанти на в 40 кг эта нола и 500 литрах во ды, при температуре 50оС. За тем были до бавле ны раствор сорби та, на триевая соль саха рина и ароматизирующая до бавка, после чего объем смеси был до ве ден до 3000 литров де минерализованной во дой. После филь трации раствор был расфа сован в 150 мл-буты ли с применением соответствующей раз ливочной маши ны. Пример 5. 10.000 мылец, каждое из которых содержит 50 мг 1-н-гексид-3-(3,4-метилендиоксифенил)-ксантина, были приготовлены следующим образом: 1-к-гексил-3-(3,4-метилендиоксифенил)-ксантин 500 г масло какао 19500 г Было расплавлено масло какао и в нем суспендировано активное соединение. Смесь затем была разлита в соответствующие формы с получением мылец массой по 2,0 г. Пример 6. 8.000 ингаляционных фла конов, каждый из которых содержит 100 мг 1-н-гексил-3-(3,4-метилендиоксифенил)-ксантина (активного соединения), были получены следующим образом: 1-н-гексил-3-(3,4-метилендиоксифенил)-ксантин 800 г сорбитантриолеат 8г вода q.s. 160 литров азот q/s. при давлении 7–8 кг/см 2 Микрокристаллическая суспензия, приготовленная из указанных ингредиентов, была помещена в ингаляционные флаконы в объеме 20 мл в каждый флакон с помощью разливочной маши ны при давлении азота 7–8 кг/см 2. Флаконы снабжены клапаном, который при каждом срабатывании выпускает 0,2 мл суспензии (1 мг активного соединения). Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03
ДивитисяДодаткова інформація
Назва патенту англійськоюXanthine derivatives, a process for preparation thereof and a pharmaceutical composition
Автори англійськоюNoverola Armando Vega, Soto Jose Manuel Prieto, Mauri Jasinto Morages, Gristwood Robert V.
Назва патенту російськоюПроизводные ксантина, способ их получения и фармацевтическая композиция
Автори російськоюНоверола Армандо Вега, Сото Хосе Мануэль Прието, Маури Хасинто Морагес, Гриствуд Роберт В.
МПК / Мітки
МПК: C07D 473/04, A61K 31/522, C07D 473/06, A61K 38/46
Мітки: композиція, похідні, спосіб, фармацевтична, одержання, ксантину
Код посилання
<a href="https://ua.patents.su/9-32512-pokhidni-ksantinu-sposib-kh-oderzhannya-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Похідні ксантину, спосіб їх одержання, та фармацевтична композиція</a>