Похідні триазолілу, спосіб їх одержання та фунгіцидний засіб
Номер патенту: 47418
Опубліковано: 15.07.2002
Автори: Тіманн Ральф, Яутелат Манфред, Дутцманн Штефан, Хенсслер Герд, Штенцель Клаус
Формула / Реферат
1. Производные триазолила формулы (I):
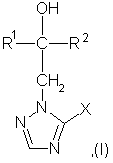
где
R1 означает линейный алкил с 1-6 атомами углерода, замещенный галоидфенилом или галоидфеноксигруппой, фенил, замещенный галоидом или галоидалкоксигруппой,
R2 означает циклоалкил с 3-7 атомами углерода, замещенный галоидом или цианогруппой, линейный или разветвленный алкил с 1-6 атомами углерода, который может быть замещен галоидом, алкоксиминогруппой с 1-4 атомами углерода или галоидфеноксигруппой, или фенил замещенный галоидом,
X означает группу -SH, -SR3, -SО2R3 или -SО3Н, где R3 означает линейный алкил с 1-6 атомами углерода или фенил,
и их кислотно-аддитивные соли или комплексы с солями металлов.
2. Производное триазолила формулы (I) по п. 1, представляющее собой 2-(1-хлорциклопропил)-1 -(2-хлорфенил)-3-(5-меркапто-1,2,4-триазол-1-ил)-пропан-2-ол.
3.Способ получения производных триазолила формулы (I):

R1 означает линейный алкил с 1-6 атомами углерода, замещенный галоидфенилом или галоидфеноксигруппой, фенил, замещенный галоидом или галоидалкоксигруппой,
R2 означает циклоалкил с 3-7 атомами углерода, замещенный галоидом или цианогруппой, линейный или разветвленный алкил с 1-6 атомами углерода, который может быть замещен галоидом, алкоксиминогруппой с 1-4 атомами углерода или галоидфеноксигруппой, или фенил замещенный галоидом,
X означает -SR3, где R3 означает фенил,
или их кислотно-аддитивных солей или комплексов с солями металлов,
отличающийся тем, что соединение формулы (II):
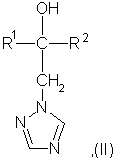
где R1 и R2 имеют указанные выше значения,
подвергают последовательному взаимодействию с сильным основанием и дифенилдисульфидом формулы (III):
R3-S-S-R3 ,(III)
где R3 означает фенил,
в присутствии разбавителя с последующим выделением целевого продукта в свободном виде или в виде кислотно-аддитивной соли или комплекса с солью металла.
4. Фунгицидное средство, отличающееся тем, что содержит производное триазолила формулы (I) по п. 1 или его кислотно-аддитивную соль или комплекс с солью металла.
Текст
1 Производные триазолила формулы (І) ОН R1— С—R' СН. N. N X .(І) где R означает линейный алкил с 1-6 атомами углерода, замещенный галоидфенилом или галоидфеноксигруппой, фенил, замещенный галоидом или галоидалкоксигруппой, R2 означает циклоалкил с 3-7 атомами углерода, замещенный галоидом или цианогруппой, линейный или разветвленный алкил с 1-6 атомами углерода, который может быть замещен галоидом, алкоксиминогруппой с 1-4 атомами углерода или галоидфеноксигруппой, или фенил замещенный галоидом, X означает группу -SH, -SR3, -SO2R3 или -SO3H, где R3 означает линейный алкил с 1-6 атомами углерода или фенил, и их кислотно-аддитивные соли или комплексы с солями металлов 2 Производное триазолила формулы (І) по п 1, представляющее собой 2-(1-хлорциклопропил)-1 (2-хлорфенил)-3-(5-меркапто-1,2,4-триазол-1 -ил)пропан-2-ол 3 Способ получения производных триазолила формулы (I) ОН R1— С—R' СН. N. N X .(I) R1 означает линейный алкил с 1-6 атомами углерода, замещенный галоидфенилом или галоидфеноксигруппой, фенил, замещенный галоидом или галоидалкоксигруппой, R2 означает циклоалкил с 3-7 атомами углерода, замещенный галоидом или цианогруппой, линейный или разветвленный алкил с 1-6 атомами углерода, который может быть замещен галоидом, алкоксиминогруппой с 1-4 атомами углерода или галоидфеноксигруппой, или фенил замещенный галоидом, X означает -SR3, где R3 означает фенил, или их кислотно-аддитивных солей или комплексов с солями металлов, отличающийся тем, что соединение формулы (II) ОН •R' R СН. N. N .(II) О 00 47418 где R1 и R2 имеют указанные выше значения, подвергают последовательному взаимодействию с сильным основанием и дифенилдисульфидом формулы (III) 3 3 R3-S-S-R3 где R означает фенил, в присутствии разбавителя с последующим выде лением целевого продукта в свободном виде или в виде кислотно-аддитивной соли или комплекса с солью металла 4 Фунгицидное средство, отличающееся тем, что содержит производное триазолила формулы (I) по п 1 или его кислотно-аддитивную соль или комплекс с солью металла Изобретение относится к новым азотсодержащим гетероциклическим соединениям, обладающим биологической активностью, в частности, фунгицидной активностью, более конкретно к производным триазолила, способу их получения и фунгицидному средству Известны производные триазолила, обладающие биологической активностью, в частности, фунгицидной активностью (см заявку ЕР № 251 086, С 07 D 249/08, 07 01 1988г) Задачей изобретения является расширение производных триазолила, обладающих биологической активностью, в частности, фунгицидной активностью Поставленная задача решается предлагаемыми производными формулы (1) он толуолсульфокислоту и 1,5нафталиндисульфокислоту, а также сахарин и тиосахарин Предпочтительными комплексами с солями металлов являются продукты присоединения солей металлов II- IV основной группы и I и II, а также IV-VIII побочных групп периодической системы элементов и тех производных триазолила формулы I, у которых R1, R2 и X имеют вышеуказанные значения При этом особенно предпочтительными являются соли меди, цинка, марганца, магния, олова, железа и никеля Анионами этих солей могут быть такие, которые образованы от кислот, дающих физиологически переносимые продукты присоединения Особенно предпочтительными кислотами такого вида являются галогенводородные кислоты, например, хлористо-водородная кислота и бромисто-водородная кислота, далее, фосфорная кислота, азотная кислота и серная кислота Производные триазолила формулы (І), у которых X означает -SH-группу, могут находиться в «меркапто»- форме он R—С—R СН, ; ,л-. где R означает линейный алкил с 1 - 6 атомами углерода, замещенный галоидфенилом или галоидфенокси-группой, фенил, замещенный галоидом или галоидалкоксигруппой, R2 означает циклоалкил с 3 - 7 атомами углерода, замещенный галоидом или циангруппой, линейный или разветвленный алкил с 1 - 6 атомами углерода, который может быть замещен галоидом, алкоксиминогруппой с 1 - 4 атомами углерода или галоидфеноксигруппой, или фенил, замещенный галоидом, X означает группировки -SH, -SR3, -SO2R3 или SO3H, где R3 означает линейный алкил с 1 - 6 атомами углерода или фенил радикал Предпочтительным производным триазолила формулы (I) является 2- (1-хлорциклопропил)- 1(2-хлорфенил)-3 -(5-меркапто-1,2,4-триазол-1 -ил)про-пан-2-ол Для образования кислотно-аддитивных солей предпочтительно используют галогенводородные кислоты, например, хлористо-водородную кислоту и бромисто-водородную кислоту, в частности, хлористо-водородную кислоту, далее фосфорную кислоту, азотную кислоту, одно- и двухосновные карбоновые кислоты и гидроксикарбоновые кислоты, например, уксусную кислоту, малеиновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, салициловую кислоту, сорбиновую кислоту и молочную кислоту, а также сульфокислота, например, п сн. (А) Н или втаутомерной «тионо»- форме ОН он R—С — R2 і сн. (Б) Ради простоты каждый раз будет указываться только "меркапто" - форма Производные триазолила формулы (I) относятся к категории металло-токсичных веществ Производные триазолила формулы (І), у которых X означает группировку -SR3, где R3 означает фенил радикал, и их кислотно-аддитивные соли или комплексы с солями металлов получают за счет того, что соединение формулы (II) 47418 он 1 R— он -С— (II) где R1 и R2 имеют указанные выше значения, подвергают последовательному взаимодействию с сильным основанием и дифенил-дисульфидом формулы (III) R*-S-S-FT (IN) где R означает фенил, в присутствии разбавителя с последующим выделением целевого продукта в свободном виде или в виде кислотно-аддитивной соли или комплекса с солью металла Данный способ является дополнительным объектом данной заявки Производные триазолила формулы (I), где R1, R2 и X имеют вышеуказанные значения, можно получать следующим образом (а) Гидроксиэтил-триазолы формулы (II) где ОН P~ C-R СН (II) '2 м. N R1 и R2 имеют указанные выше значения, или а) последовательно подвергают превращению с сильным основанием и серой в присутствии разбавителя и затем гидролизуют водой, при необходимости в присутствии кислоты, или (3) подвергают взаимодействию с серой в присутствии высококипящего разбавителя и затем обрабатывают водой, а также при необходимости с кислотой, и при необходимости полученные по вариантам (а) и (р) соединения формулы (1а) он p ,, ., p m сн. (1а) .Sh в которой R1 и R2 имеют указанные выше значения, подвергают взаимодействию с галогеновыми соединениями формулы (IV) (IV) в которой R3 означает линейный алкил с 1 - 6 атомами углерода или фенил, Hal означает хлор, бром или йод, в присутствии связывающего кислоту средства и в присутствии разбавителя и полученные при этом соединения формулы (16) снг (16) в которой R1, R2 и R3 имеют указанные выше значения, при необходимости подвергают взаимодействию с окисляющими средствами в присутствии разбавителя, б) Производные триазолила формулы (1а) он -C — R' (1а) СН, .SH в которой, R1 и R2 имеют указанные выше значения, подвергают взаимодействию с перманганатом калия в присутствии разбавителя, и в заключение, при необходимости, к полученным соединениям формулы (1) присоединяют кислоты или соль металла Предлагаемый способ получения производных триазолила формулы (1), у которых X означает группировки SR3, поясняется в нижеследующем Если используют в качестве исходного соединения 2-(1 -хлор-циклопропил)-1 -(2-хлорфенил)-3(1,2,4-триазол-1-ил) - пропан-2-ол, н-бутиллитий в качестве сильного основания и дифенилдисульфид в качестве реагента, то протекание реакции можно изобразить следующей схемой -с—u I сн. І.бутнялятйй б сн, Гидроксиэтил-триазолы формулы (II) и дифенил-дисульфиды формулы (III) известны или могут быть получены известными способами В качестве сильных оснований используются все обычные для такого типа реакций сильные основания на основе щелочных металлов Предпочтительно применяются н-бутиллитий, литийдиизопропил-амид, гидрид натрия, амид натрия и калий-трет -бутилат в смеси с тетрамети л эти лендиамином В качестве разбавителей используются все обычные для такого типа реакций органические растворители Предпочтительными являются простые эфиры, такие как тетрагидрофуран, диоксан, диэтиловый эфир и 1,2-диме-токсиэтан, далее жидкий аммиак или сильно полярные растворители, такие как диметилсульфоксид Температуры реакции могут варьироваться в широком интервале Обычно работают при температурах между -70°С и +20°С, предпочтительно между -70°С и 0°С При проведении предлагаемого способа работают обычно при нормальном давлении Но можно также работать при повышенном или пониженном 47418 давлении Упомянутые выше способы (а) и (б), которые не являются объектом изобретения, поясняются в нижеследующем Если используют в качестве исходного соединения 2-(1 -хлор-циклопропил)-1 -(2-хлорфенил)-3(1,2,4-триазол-1 -ил)-пропан-2-ол, н-бутиллитий в качестве сильного основания и порошок серы в качестве реагента, то протекание первой стадии способа (а), вариант (а), можно изобразить следующей схемой -с— 1 сн. \ буткдлитнй 2 серя — (Ч Если используют в качестве исходного соединения 2-(1 -хлор-циклопропил)-1 -(2-хлорфенил)-1 (1,2,4-триазол-1-ил)-пропан-2-ол, порошок серы в качестве реагента и N-метил-пирролидон в качестве разбавителя, то протекание первой стадии способа (а), вариант (р), можно изобразить следующей схемой у СИ: s сн. М-метнлпирролядон Если используют з качестве исходного соединения 2-(1 -хлор-циклопропил)-1 -(2-хлорфенил)-3(5-меркапто-1,2,4-триазол-1 -ил) -пропан-2-оп и метил-йодид в качестве реагента, то протекание второй стадии способа (а) можно изобразить следующей схемой Я \=У он ' і ! CH 3 J основание ! Если используют в качестве исходного соединения 2-(1 -хлор-циклопропил)-1 -(2-хлорфенил)-35-метилтио-1,2,4-триазол-1-ил)прпан-2-ол и избыток перекиси водорода в качестве окислителя, то протекание третьей стадии способа (а) можно изобразить следующей схемой он Я с V Если используют в качестве исходного соединения 2-(1 -хлор-циклопропил)-1 -(2-хлорфенил)-3(5-меркапто-1,2,4-триазол-1 -ил)-пропан-2-ол и в качестве окислителя перманганат калия, то протекания способа (б) можно изобразить следующей схемой LJi iLJJ, Сера используется предпочтительно в виде порошка Для гидролиза при проведении первой стадии способа (а), вариант (а), используют воду, при необходимости в присутствии кислоты При этом используются все обычные для такого типа реакций неорганические или органические кислоты Предпочтительно используются уксусная кислота, разбавленная серная кислота и разбавленная соляная кислота Однако, возможно также проводить гидролиз с водным раствором хлорида аммония При проведении первой стадии способа (а) по варианту (а) вводят обычно на один моль гидроксиэтил-триазола формулы (II) от двух до трех эквивалентов, предпочтительно 2,0 - 2,5 эквивалента, сильного основания и затем эквивалентное количество или также избыток серы Взаимодействие может происходить в атмосфере инертного газа, например, в среде аргона или азота Работают при такой же температуре и таком же давлении, что и при проведении предлагаемого способа Переработка происходит обычными методами Обычно поступают таким образом, что реакционную смесь экстрагируют слабо растворимым в воде органическим растворителем, сушат объединенные органические фазы, сгущают и оставшийся остаток очищают при необходимости перекристаллизацией и/или хроматографией При проведении первой стадии способа (а), вариант (р), используются в качестве разбавителей все обычные для такого типа реакций высококипящие органические растворители Предпочтительными являются амиды, такие как диметилформамид и диметилацетамид, кроме того гетероциклические соединения, такие как Nметил-пирролидон, и также простые эфиры, такие какдифениловый эфир При проведении первой стадии способа (а), вариант (р), серу используют обычно в виде порошка После взаимодействия можно при необходимости проводить обработку водой или кислотой Переработку проводят так же, как гидролиз при проведении первой стадии способа (а) по варианту (а) Температуры реакции при проведении первой стадии способа (а) по варианту (р) могут варьироваться в широком интервале Обычно работают при температурах между 150°С и 300°С, предпочтительно между 180°С и 250°С При проведении первой стадии способа (а) по варианту (р) вводят обычно на один моль гидрокиэтил-триазола формулы (II) от одного до пяти молей, предпочтительно 1,5-Змоля, серы Переработка происходит обычными методами Обычно поступают таким образом, что реакционную смесь экстрагируют слабо растворимым в воде органическим растворителем, сушат объединенные органические фазы, сгущают и оставшийся остаток очищают при необходимости перекристаллизацией и/или хроматографией 47418 10 Галогеновые производные формулы (IV) из10°Си 100°С вестны При проведении третьей стадии способа (а) вводят обычно на один моль соединения формуВ качестве связывающего кислоту средства лы (16) эквивалентное количество или избыток используют при проведении второй стадии спосоокислителя Если хотят получить SO-соединения, ба (а) все обычные неорганические или органичето работают с эквимолярными количествами Есские основания Предпочтительно применяют гидли хотят получить 502-соединения, то берут избыроокиси щелочных или щелочноземельных ток окислителя Обработка происходит обычными металлов, такие как гидроокись натрия, гидрометодами Обычно поступают таким образом, что окись калия, гидроокись кальция, или также гидразбавляют льдом или водой, при необходимости роокись аммония, карбонаты щелочных металлов, подщелачивают добавкой основания, экстрагирутакие как карбонат натрия, карбонат калия, бикарют слабо смешиваемым с водой органическим бонат калия, бикарбонат натрия, ацетаты щелочрастворителем, сушат объединенные органиченых или щелочноземельных металлов, ские такие как ацетат натрия, ацетат калия, ацетат кальция, а также третичные амины, такие как трифазы, сгущают и полученный продукт при неметиламин, трибутиламин, N.N-диметиланилин, обходимости перекри-сталлизовывают Если рапиридин, N-метил пиперидин, диазабициклооктан, ботают с перманганатом калия в водном растворе, диазабициклононен или диа-забициклоундецен то поступают таким образом, что твердое вещество отфильтровывают, промывают и сушат В качестве разбавителя применяют при проведении второй стадии способа (а) все обычные Получаемые согласно вышеописанным спосодля таких реакций инертные органические раствобам производные триазола формулы (I) могут рители Предпочтительно применяют простые быть переведены в соли присоединения кислот эфиры, например, диэтиловый эфир, метил-трет или в комплексы с солями металлов бутиловый эфир, диметиловый эфир этиленглиСоли соединений формулы (I) с кислотами коля, тетраги-дрофуран или диоксан, далее, нитполучают простым способом обычными методами, рилы, например, ацетонитрил, и, кроме того, вынапример, растворением соединения формулы (I) сокополярные растворители, например, в подходящем инертном растворителе и добавлед и мети л сульфоксид или диметилформамид нием кислоты, например, хлористо-водородной кислоты, и известным способом, например, Температуры реакции при проведении второй фильтрацией выделяют и при необходимости стадии способа (а) могут варьироваться в широочищают путем промывки инертным органическим ком интервале Обычно работают при температурастворителем рах между 0°С и 120°С, предпочтительно между 20°Си 100°С Комплексы соединений формулы (I) с солями металлов могут быть простым способом получены При проведении второй стадии способа (а) известными методами, например, растворением вводят обычно на один моль производного триасоли металла в спирте, например, этаноле, и дозолила формулы (1а) от одного до двух молей бавлением к соединениям формулы (I) Комплекгалогенового соединения формулы (IV), а также сы известным способом, например, фильтрацией, эквивалентное количество или избыток связывыделяют и при необходимости очищают перевающего кислоту средства Обработка происходит кристаллизацией обычными методами Обычно поступают таким образом, что реакционную смесь смешивают с Как уже указывалось выше, производные водным основанием и слабо смешиваемым с вотриазола формулы (I) проявляют фунгицидную дой органическим растворителем, отделяют оргаактивность ническую фазу, сушат и сгущают Полученный Поэтому дальнейшим объектом изобретения продукт очищают от имеющихся примесей, при является фунгицидное средство, отличающееся необходимости перекристаллизацией содержанием производного триазолила формулы (I) или его кислотно-аддитивной соли или комВ качестве окислителя используют при провеплекса с солью металла дении третьей стадии способа (а) все применимые для окисления серы вещества Предпочтительно Производные триазолила формулы (І) в дальиспользуют перекись водорода и надкислоты, нанейшем обозначается как "активные вещества" пример, надуксусную кислоту и мета-хлорАктивные вещества могут применяться как танадбензойную кислоту, и, кроме того, неорганичековые, в виде их концентратов или в виде пригоской соли, например, перманганат калия товляемых из них рабочих форм, как, например, готовые к употреблению растворы, эмульгируеВ качестве разбавителя используют при промые концентраты, эмульсии, пены, суспензии, ведении третьей стадии способа (а) все обычные порошки для опрыскивания, пасты, растворимые для таких реакций растворители Если используют порошки, препараты для опыливания и грануляты перекись водорода или надкислоты в качестве Применение происходит обычным образом, наокислителя, то в качестве разбавителя использупример, поливом, опрыскиванием, разбрасываниют предпочтительно уксусную кислот/ или ледяем, распылением, намазыванием т д Также возную уксусную кислоту Если работают с пермангаможно наносить активные вещества натом калия в качестве окислителя, то используют ультранизкообъемным методом или композицию с также воду или спирты, например, трет - бутанол активным веществом или само активное вещество Температуры реакции при проведении третьвносить з почву Также можно обрабатывать поей стадии способа (а) могут варьироваться в шисевной материал роком интервале Обычно работают при температурах между 0°С и 100°С, предпочтительно между При обработке частей растений концентрации 11 12 47418 активного веществав форме, готовой для применения, варьируются в широком интервале обычно они составляют от 1 до 0,0001 вес %, предпочтительно от 0,5 до 0,001 вес % При обработке посевного материала количество активного вещества составляет обычно от 0,001 до 50 г на кг семян, предпочтительно от 0,01 до Юг При обработке почвы концентрация активного вещества в местах применения составляет от 0,00001 до 0,1 вес %, предпочтительно от 0,0001 до 0,02вес % Концентрация при применении активных веществ зависит от вида и происхождения грибков, а также от состава защищаемого материала Оптимальное количество определяют путем ряда опытов Обычно концентрации применения составляют от 0,001 до 5вес %, предпочтительно от 0,05вес % до 1,0вес%, считая на защищаемый материал Получение производных триазолила формулы (1) иллюстрируется следующими примерами Пример 1 он \7 он ,S-CH. Смесь из 3,43 г (10 ммолей) 2-(1 -хлорциклолропил)-1-(2-хлорфенил)-3-(5-меркаптоабсолютного ацетонитрила и 1,38 г (10 ммолей) карбоната калия смешивают с 0,93 перемешивают при 40°С После этого реакционную смесь смешивают с насыщенные, многократно экстрагируют этилацетатом Объединенные органические фазы сушат Получают таким образом 3,4 г (95% от теории) 2-(1-хлор-циклопропил)-1-(2-хлорф пропан-2ола в виде масла 'Н-ЯМР-спектр (200мГц, дейтерохлороформ, ТМС) 5 = 0 4,4 (АВ, 2Н), 4,7 (ОН), 7,2-7,6 (м, 4Н),7,9(с,1Н) 5 = 0,6-1,05 (м, 4Н),2,7 (с, ЗН), 3,35 (АВ, 2Н), 4,4 (АВ, 2Н), 4,7 (ОН), 7,2-7,6 (м, 4Н),7,9< Пример 3 сь (1-1) Вариант а Смесь из 3,12 г (10 ммолей) 2-(1 -хлорциклопропил)-1 -(2-хлорфенил)-3-(1,2,4-триазол-1 ил)-пропан-2-ола и 45 мл абсолютного тетрагидрофурана смешивают при 20°С с 8,4 мл (21 ммоль) н-бутиллития в гексане и перемешивают 30 минут при 0°С Затем охлаждают реакционную смесь до -70°С, смешивают с 0,32 г (10 ммолей) порошка серы и перемешивают 30 минут при 70°С Нагревают до -Ю°С, смешивают с ледяной водой и устанавливают значение рН=5 добавлением разбавленной серной кислоты Многократно экстрагируют этилацетатом, сушат объединенные органические фазы сульфатом натрия и сгущают при пониженном давлении Получают таким образом 3,2 г (93% от теории) 2-(1-хлор-циклопропил)1 -(2-хлорфенил)-3-(5-меркапто-1,2,4-триазол-1 ил)-пропан-2-ола в виде твердого вещества, которое после перекристаллизации плавится при 138139°С Вариант р Смесь из 3,12 г (10 ммолей) 2-(1 -хлорциклопропил)-1 -(2-хлорфенил)-3-(1,2,4-триазол-1 ил)-пропан-2-ола, 0,96 г (30 ммолей) порошка серы и 20 мл абсолютного N-метил-пирролидона нагревают при перемешивании 44 часа при 200°С Затем реакционную смесь сгущают при пониженном давлении (0,2мбар) Полученный сырой продукт (3,1 г) перекристаллизовывают из толуола Получают 0,7 г (20% от теории) 2-(1-хлорциклопропил)-1-(2-хлор-фенил)-3-(5-меркапто1,2,4-триазол-1-ил)-пропан-2-ола в виде твердого вещества, которое плавится при 138-139°С Пример 2 (1-2) СН , S O , СИ, (-) 1 3 Раствор 3,57г (1 Оммолей) 2-(1 -хлорциклопропил)-1-(2-хлорфенил)-3-(5-метилтио1,2,4-триазол-1-ил)-пропан-2-ола в 40 мл ледяной уксусной кислоты смешивают по каплям при 90°С и при перемешивании с 4 мл водного раствора перекиси водорода (35%-ная) Реакционную смесь перемешивают после окончания прибавления еще 30 минут при 90°С, затем охлаждают до комнатной температуры, смешивают со льдом и подщелачивают добавлением водной натриевой щелочи Экстрагируют многократно этилацетатом, сушат объединенные органические фазы сульфатом натрия и сгущают при пониженном давлении Оставшийся медленно кристаллизующийся продукт отфильтровывают Получают 2,0 г (51% от теории) 2-(1-хлор-циклопропил)-1 -(2-хлорфенил)-3-(5метилсул ьфонил-1,2,4-триазол-1 -ил)-пропан-2ола в виде твердого вещества, которое имеет т пл 125-128°С Пример 4 он сн, (1-4) —N Смесь из 1,71 г (5 ммолей) 2-(1 хлорциклопропил)-1-(2-хлорфенил)-3-(5-меркапто1,2,4-триазол-1-ил)-пропан-2-ола, 1,58 г (10 ммолей) перманганата калия и 20 мл воды перемешивают 30 минут при комнатной температуре После этого отсасывают твердое вещество, промывают водой и сушат Получают 2,0 г (100% от теории) 2(1 -хлорциклопропил)-1 -(2~хлорфенил)-3-(5сульфо-1,2,4-триазол-1 -ил)-пропан-2-ола в виде твердого вещества с т пл 68-70°С Пример 5 13 47418 14 он fH3 (1-5) Смесь из 3,12г (1 Оммолей) 2-(1 хлорциклопропил)-1 -(2-хлорфенил)-3-(1,2,4триазол-1-ил)-пропан-2-ола и 45мл абсолютного тетрагидрофурана смешивают при -20°С с 8,4мл (21 ммолей) н-бутиллития в гексане и перемешивают ЗО минут при 0°С Затем реакционную смесь охлаждают до -70°С смешивают с 2,18г (10 ммолей) дифенил-дисульфида и медленно доводят до комнатной температуры Перемешивают еще 19 часов при комнатной температуре, разбавляют этилацетатом и несколько раз встряхивают с насыщенным водным раствором карбоната натрия Органическую фазу сушат сульфатом натрия и сгущают при пониженном давлении Полученный остаток 4,2г хроматографируют через 500г силикагеля со смесью растворителей петролейный эфир/этилацетат при соотношении 2 1 После упаривания элюата получают 3,5г (84% от теории) 2-(1 -хлорци-клопропил)-1 -(2-хлорфенил)-3-(5фенилтио-1,2,4-триазоп-1 -ил)-пропан-2ола в виде масла Масс-спектр (СІ) 420 (М+Н) Аналогично получают соединения, приведенные в таблице 1 *) Соединение характеризуется следующими сигналами в "Н-ЯМР-спектре (400мГц, дейтерохлороформ/ТМС) 5= 0,8 (т, ЗН), 0,85 (м, 2Н), 1,25 (м, 2Н), 1,8 (м, 1Н), 2,55 (м, 1Н), 4,6 (ОН), 4,9 (АВ, 2Н), 7,35 (д, 1Н), 7,7 (с, 1Н), 7,75 (д, 1Н), 12,3 (5Н) м д Нижеследующие примеры иллюстрируют фунгицид ную активность производных триазолила формулы (I) Пример 19 Испытание защитной активности против Erysiphe в ячмене 1вес часть активного вещества № 1-1 смешивают с Ювес частей N-метил-пирролидона в качестве растворителя и 0,6 вес частей алкиларилпо-лигликолевого эфира в качестве эмульгатора и полученный концентрат разбавляют водой до желаемой концентрации Для испытания защитной активности опрыскивают молодые растения получаемым средством при расходе активного вещества, равном 250 г/га После высыхания нанесенного налета растения опыляют спорами Erysiphe gramims f sp hordei Растения помещают в теплицу при температуре около 20°С и относительной влажностью воздуха около 80 % для благоприятствования развитию пустул мучнистой росы Спустя 7 дней после инокуляции производят процентную оценку При этом устанавливают 100 %-ную активность по сравнению с необработанными контрольными растениями Пример 20 Испытание защитной активности против Erysiphe в пшенице 1 вес часть активного вещества № 1-1 смешивают с 10 вес частей N-метил-пирролидона в качестве растворителя и 10 вес частей алкила 16 15 47418 рил-полигликолевого эфира в качестве эмульгаметил-пирролидона в качестве растворителя и тора и полученный концентрат разбавляют водой О.бвес частей алкиларилполигликолевого эфира в до желаемой концентрации качестве эмульгатора и полученный концентрат Для испытания защитной активности опрыскиразбавляют водой до желаемой концентрации вают молодые растения получаемым средством Для испытания защитной активности опрыскипри расходе активного вещества, равном 250 г/га вают молодые растения получаемым средством После высыхания нанесенного налета растения при расходе активного вещества, равном 250г/га опыляют спорами Erysiphe gramims f sp tntici После высыхания нанесенного налета растения опыляют спорами Fusanum culmorum Растения помещают в теплицу при температуре около 20°С и относительной влажностью Растения помещают в теплицу под светопровоздуха около 80 % для благоприятствования разницаемой инкубационной сеткой при температуре витию пустул мучнистой росы около 20°С и относительной влажностью воздуха около 100% Спустя 7 дней после инокуляции производят процентную оценку При этом устанавливают 100 Спустя 4 дней после инокуляции производят %-нуга активность по сравнению с необработанпроцентную оценку ными контрольными растениями Устанавливают, что активное вещество № 1-1 проявляет 100 %-ную фунгицидную активность по Пример 21 сравнению с необработанными контрольными Испытание защитной активности против растениями, а активное вещество № 1-15 -75%Pseudocerosporella herpotnchoides в пшенице ную фунгицидную активность 1вес часть активного вещества № 1-1 смешивают с 10 вес частей N-метил-пирролидона в Пример 24 качестве растворителя и 0,6 вес частей алкилаПовторяют пример 23 с той лишь разницей, рил-полигликолевого эфира в качестве эмульгачто применяют активное вещество № 1-16 при тора и полученный концентрат разбавляют водой расходе 125 г/га При этом устанавливают 100 %до желаемой концентрации ную активность по сравнению с необработанными контрольными растениями Для испытания защитной активности опрыскивают молодые растения получаемым средством Пример 25 при расходе активного вещества, равном 250г/га Испытание защитной активности против После высыхания нанесенного налета растения Pelliculana в рисе опыляют спорами Pseudocerosporella 1вес часть активного вещества № 1-1 смеherpotnchoides шивают с 12,5вес частей ацетона в качестве растворителя и 0,3 вес частей алкиларилполигликоРастения помещают в теплицу при темпералевого эфира в качестве эмульгатора и туре около 20°С и относительной влажностью полученный концентрат разбавляют водой до жевоздуха около 80 % для благоприятствования разлаемой концентрации активного вещества, равной витию пустул мучнистой росы 0,025вес % Спустя 21 день после инокуляции производят процентную оценку При этом устанавливают 100 Для испытания защитной активности опрыски%-ную активность по сравнению с необработанвают молодые растения получаемым средством ными контрольными растениями После высыхания нанесенного налета растения инокулируют Pelliculana sasakn и выдерживают Пример 22 при 25°С и относительной влажности 100 % Испытание защитной активности против Fusanum mvale (var mvale) в пшенице Через 8 дней после инокуляции производят процентную оценку При этом устанавливают 100 1вес часть активного вещества № 1-1 сме%-ную активность по сравнению с необработаншивают с 10 вес частей N-метил-пирролидона в ными контрольными растениями качестве растворителя и О.бвес частей алкиларил-полигликолевого эфира в качестве эмульгаПример 26 тора и полученный концентрат разбавляют водой Испытание защитной активности против до желаемой концентрации Sphaerotheca в огурцах Для испытания защитной активности опрыски1 вес часть активного вещества № 1-1 смевают молодые растения получаемым средством шивают с 4,7 вес частей ацетона в качестве распри расходе активного вещества, равном 250 г/га творителя и 0,3 вес частей алкиларилполигликоПосле высыхания нанесенного налета растения левого эфира в качестве эмульгатора и опыляют спорами Fusanum mvale (var mvale) полученный концентрат разбавляют водой до желаемой концентрации активного вещества, равной Растения помещают в теплицу под светопро1ч/милл ницаемой инкубационной сеткой при температуре около 15°С и относительной влажностью воздуха Для испытания защитной активности опрыскиоколо 100% вают молодые растения до образования капель После высыхания нанесенного налета растения Спустя 21 дня после инокуляции производят опыляют конидиями грибка Sphaerotheca fuhdinea процентную оценку При этом устанавливают 100 %-ную активность по сравнению с необработанРастения помещают в теплицу при темпераными контрольными растениями туре около 23 - 24°С и относительной влажностью воздуха около 75 % для благоприятствования разПример 23 витию пустул мучнистой росы Испытание защитной активности против Fusanum culmorum в пшенице Через 10 дней после инокуляции производят процентную оценку При этом устанавливают 100 1вес часть активного вещества № 1-1 и № 1%-ную активность по сравнению с необработан15, соответственно, смешивают с Ювес частей N 18 17 47418 ными контрольными растениями ство № ме расхода активного вещества, Пример 27 равной 500г/га Испытание защитной активности против 1-1 100 Botrytis в бобовых культурах 1-15 97 1вес часть указанного в таблице 2 активного 1-7 97 вещества смешивают с 47вес частей ацетона в 1-16 100 качестве растворителя и Звес частей алкиларил1-17 99 полигликолевого эфира в качестве эмульгатора и Известное сополученный концентрат разбавляют водой до же72 единение А лаемой концентрации Известное соДля испытания защитной активности опрыски44 единение Б вают молодые растения полученным средством Соединение А описано в заявке ЕР 251 086 и при расходе активного вещества, раном 500г/га имеет формулу После высыхания нанесенного налета на каждый СН, ОН лист кладут два агаровых куска с выращенным на них грибком Botrytis cmerea 4 ^ Инокулированные растения помещают в темсн (А) ную теплицу при температуре около 23 - 24°С и SH N' относительной влажностью воздуха 100 N Спустя 2 дня после инокуляции производят Соединение Б также описано в заявке ЕР № процентную оценку путем грибков на листях При 251 086 и имеет формулу этом 0 % означает степень действия, соответствующее степени действия на необработанных ,Cl СН. ОН контрольных растениях, а 100 % означает, что СІ поражения не наблюдается (Б) сн г Активные вещества и результаты опыта покаЖ ,$Н заны в таблице 2 Таблица 2 Активное веще- Степень действия в % при нор ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна ( 0 4 4 ) 4 5 6 - 2 0 - 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of triazolyl, method of production thereof and fungicidal agent
Автори англійськоюDutzmann Stefan, STENZEL, Klaus
Назва патенту російськоюПроизводные триазолила, способ их получения и фунгицидное средство
Автори російськоюДутцманн Штефан
МПК / Мітки
МПК: C07D 405/06, C07D 401/06, A01N 43/653, C07D 249/12
Мітки: похідні, триазолілу, засіб, одержання, спосіб, фунгіцидний
Код посилання
<a href="https://ua.patents.su/9-47418-pokhidni-triazolilu-sposib-kh-oderzhannya-ta-fungicidnijj-zasib.html" target="_blank" rel="follow" title="База патентів України">Похідні триазолілу, спосіб їх одержання та фунгіцидний засіб</a>
Попередній патент: Поживне середовище для вирощування мікроклонів винограду
Наступний патент: Роторно-лопатевий гідромотор
Випадковий патент: Стабілізовані карбапенемові напівпродукти та cпосіб одержання сполук з їх використанням












