Пептид, що здатний зв’язуватися та інгібувати фосфорилювальну ділянку казеїнкінази ii (скіі), та його застосування
Номер патенту: 81403
Опубліковано: 10.01.2008
Автори: Реєс Акоста Освальдо, Пучадес Ісагірре Якелін, Моро Сорія Алехандро, Сантьяго Віспо Нельсон Франсі, Переа Родрігес Сільвіо Ерн, Гонсалес Лопес Луїс Хавьєр, Сільва Родрігес Рікардо, Сантос Савіо Алісія, Гонсалес Барріос Белькіс
Формула / Реферат
1. Пептиди, які зв'язують і інгібують фосфорилювальну ділянку казеїнкінази II (СКІІ), які представлені наступними послідовностями, вибраними з групи:
a. CSVRQGPVQKC;
b. CSSCQNSPALC;
с. CQIPQRTATRC;
d. CAKQRTDPGYC;
е. CWMSPRHLGTC;
f. CRNCTVIQFSC;
g. CHYIAGTVQGC;
h. CPLVSLRDHSC;
і. CKQSYLHHLLC;
j. CFQPLTPLCRC;
k. CQSYHELLLQS;
а також будь-який гомологічний або міметичний варіант (синтетичний або рекомбінантний) вказаних пептидів.
2. Пептиди за п. 1, які представлені циклічною структурою.
3. Пептиди за пп. 1 або 2, які складають злитий поліпептид.
4. Фармацевтична композиція для інгібування проліферації пухлинної клітини, яка включає в себе один або декілька пептидів за пп. 1-3, а також прийнятний носій.
5. Фармацевтична композиція за п. 4, яка додатково містить цитокін.
6. Фармацевтична композиція за п. 5, де вказаний цитокін являє собою інтерферон (ІФН).
7. Застосування пептидів за пп. 1-3 для інгібування проліферації пухлинної клітини.
8. Застосування за п. 7 для лікування асоційованих і не асоційованих з папіломовірусом людини (HPV) пухлин.
9. Застосування пептидів для лікування HPV-асоційованого ураження на стадіях, попередніх малігнізації.
10. Застосування за пп. 7-9, де пептиди використовуються нарівні з цитокінами.
11. Застосування за п. 10, де цитокін являє собою ІФН.
12. Застосування за пп. 7-9, де пептиди використовуються для лікування пацієнтів, уражених HPV і резистентних до лікування ІФН.
13. Експресуючий вектор ссавця, що містить ДНК-послідовності, які кодують будь-який з пептидів за пп.1-3.
Текст
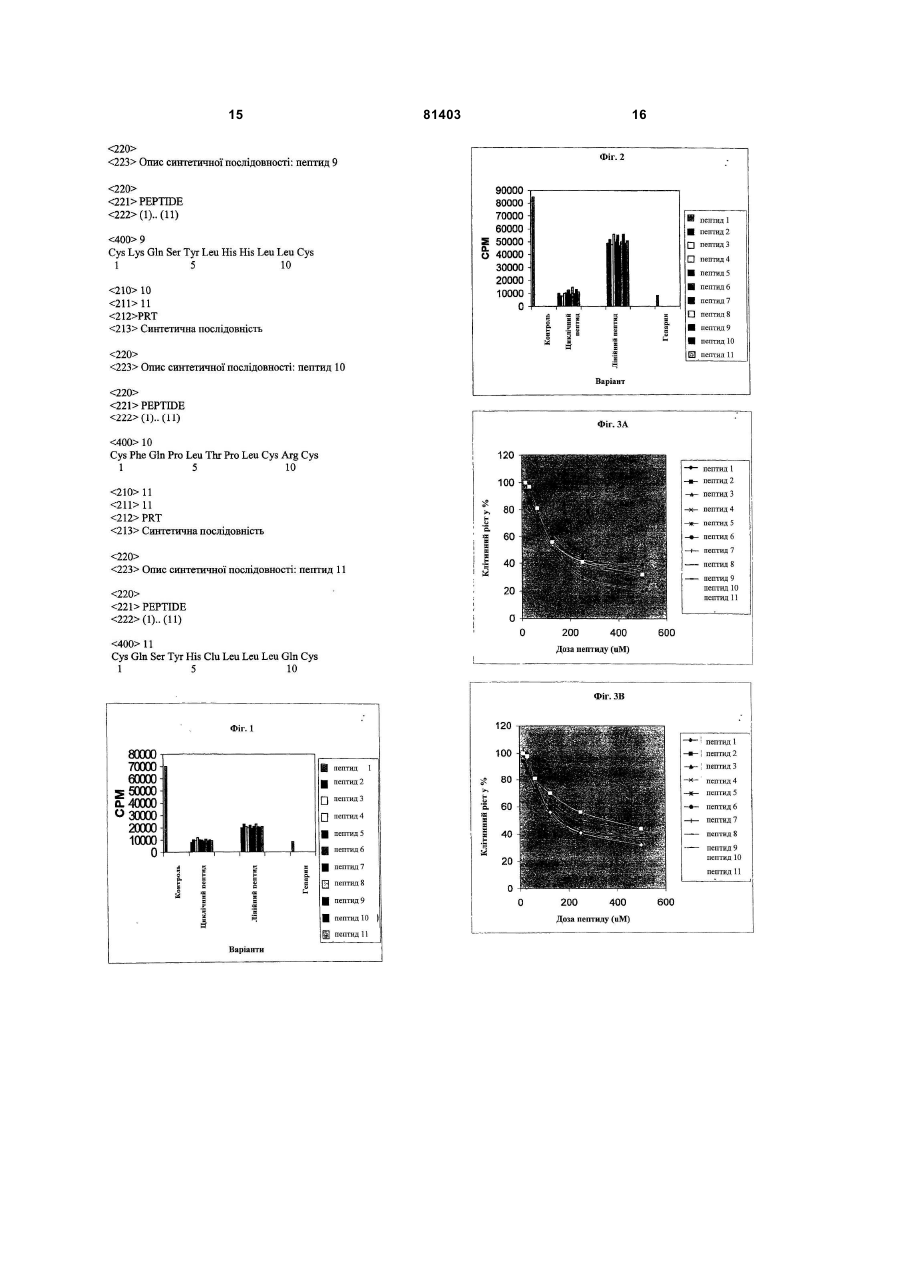
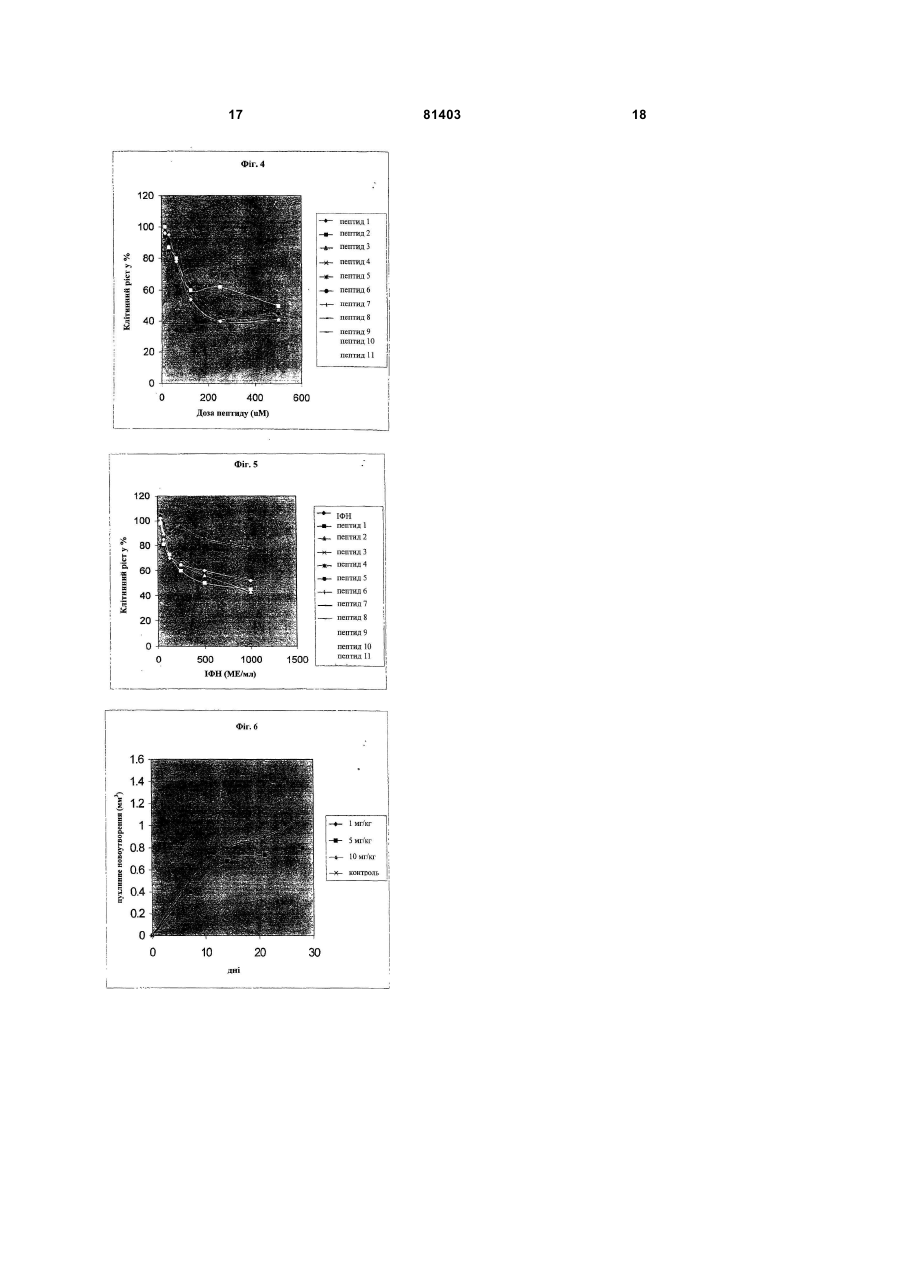
1. Пептиди, які зв'язують і інгібують фосфорилювальну ділянку казеїнкінази II (СКІІ), які представлені наступними послідовностями, вибраними з групи: a. CSVRQGPVQKC; b. CSSCQNSPALC; с. CQIPQRTATRC; d. CAKQRTDPGYC; е. CWMSPRHLGTC; f. CRNCTVIQFSC; g. CHYIAGTVQGC; h. CPLVSLRDHSC; і. CKQSYLHHLLC; j. CFQPLTPLCRC; 2 (19) 1 3 Даний винахід відноситься до галузі молекулярної фармакології, і, зокрема до отримання пептидів, придатних для обробки епітеліальних пухлин, і в основному пухлин, асоційованих з онкогенними типами HPV. Головна мета даного винаходу полягає в ідентифікації пептидів, структура яких дозволяє блокувати фосфорилювальний домен казеїнкінази (СКІІ) внаслідок прямої взаємодії з такою ділянкою. У даному винаході представлено одинадцять циклічних пептидів з різними амінокислотними послідовностями, які інгібують in vitro СКІІфосфорилювання, виявляють цитотоксичність відносно трансформованих HPV-16 клітин (CaSki) і, крім того, підвищують чутливість цих клітин до цитостатичної дії інтерферону (ІФН). Крім того, даний винахід відноситься до застосування вказаних пептидів, кон'югованих або злитих з іншими пептидами і хімічними сполуками, які проникають в клітини, а також до застосування і пептидів і хімічних молекул-міметиків. Даний винахід відноситься до галузі молекулярної фармакології і, зокрема до отримання пептидів, що використовуються для лікування асоційованих з HPV епітеліальних пухлин, оскільки вони дозволяють блокувати фосфорилювальний домен казеїнкінази II (СКІІ) шляхом прямої їх взаємодії з такою ділянкою. СКІІ являє собою треонін/сериновий фермент, що бере участь в клітинній проліферації, і в процесі малігнізації він локалізований всередині клітини, головним чином, в ядрі [Tawfic S., Yu S., Wang H., Faust R., Davis Α., Ahmed K., 2001, Histol. Histopathol. 16:573-582]. На основі існуючих даних про високі рівні СКІІ в різних епітеліальних солідних пухлинах було висловлене припущення, що фосфорилювання, яке викликається цим ферментом, є істотною ознакою злоякісної трансформації і маркером пухлинної прогресії [Seidin D.C., Leder P., 1995, Science 267:894-897] [Faust R.A., Gapany M., Tristani P., Davis Α., Adams G.L., Ahmed K., 1996, Cancer Letters 101:31-35]. З іншого боку, надекспресія СКІІ у трансгенних мишей приводить до утворення пухлин в молочних залозах через збільшення шляхів передачі Wnt/бета-катенінових сигналів в епітеліальних клітинах цих молочних залоз [Landesman-Bollag Ε., Romien-Mourez R., Song D.H., Sonenshein G.E., Cardiff R.D., Seidin D.C., 2001, Oncogene 20:3247-3257]. Серед епітеліальних пухлин ті, які виникають внаслідок HPV, становлять більшу частину. Наприклад, більшість пухлин сечостатевої системи асоціюється з діяльністю цих онковірусів, і наявність ДНК-послідовностей HPV виявляється в 99,7% даних пухлин, що виникають з сквамозних клітин шийки матки [Walboormers J.M., Jacobs M.V., Manos MM., Bosch F.X., Kurnmer J.A., Shah K.V., Snijders P.J., Peto J., Meijer C.J., Munoz N., 1999, J. Pathol. 189:12-19]. BOO3 також повідомляє про 500000 пацієнтів у всьому світі, що захворюють щорічно на злоякісну пухлину шийки матки [Parkin D.M., Laara E., Muir C.S., 1980, Int. J. 81403 4 Cancer 41:184, 1972]. На Кубі через цю хворобу щорічно вмирає 370 жінок з діагнозом злоякісна пухлина шийки матки [Organization Panamericana de la Salud, 1999, Basic Country Health Profiles for the Americas, Куба, 206-219]. У залежності від того, чи розвивається малігнізація чи ні, HPV ділять на онкогенні і неонкогенні папіломавіруси [Lorincz А. Т., Temple G.F., Kurman R.J., Jenson A.B., Lancaster W.D., 1987, J. Natl. Cancer Inst. 79:671-677]. HPV-16 і HPV-18 асоційовані з інтраепітеліальною неоплазією, яка в більшості випадків малігнізує, але крім того, обидва типи HPV асоційовані більш ніж з 90% дисплазій і карциномами шийки матки [Fujinaga Y., Shimada M., Okasawa Κ., Fukushima M., Kato I., Fujinaga К., 1991 J. gen. Virol. 72:10391044]. Оскільки терапевтична або профілактична вакцина все ще недоступна для радикального лікування (видалення) HPV-асоційованих злоякісних пухлин, використання інгібіторів вірусної транскрипції і вірусних онкогенних білків стає більш привабливим. Біомодулятори, подібні до IFN, використовують з певною ефективністю відносно деяких HPV-асоційованих захворювань, подібних до кондиломи, підошовних бородавок і респіраторних папіломатозів [Koromilas A.E., Li S., Matlashewski G., 2001, Cytokine & Growth Factor Reviews 12:157-170]. В попередніх експериментах з HPV-трансформованими клітинами (HeLa) нами показано, що тривале їх витримування з альфаІФН повертає їх до початкового фенотипу і супроводжується інгібуванням експресії мРНК HPV в цих клітинах [Lopez-Oceio О., Регеа S.E., Reyes Α., Vigoa L., Lopez-Saura P., 1993. J. IFN Res 13:369-375]. На цій же клітинній моделі нами встановлено, що альфа-ІФН модулює мРНК HPV шляхом репресії ендогенної вірусної транскрипції [Регеа S.E., Lopez-Oceio О., Garcia-Milian R., Arana M.J., 1995, J. IFN & Cytokine Res. 15:495-501]. Відповідно до даних результатів, отриманих на клітинних лініях, в попередньому експериментальному дослідженні пацієнтів, що страждають злоякісною пухлиною шийки матки, ми спостерігали, що обробка за допомогою альфаІФН модулює експресію мРНК [Garcia-Milian R., Rios М.А., Diaz D., Silveria Μ., Guilar О., Amigo Μ., Arana M.J., Регеа S.E., 1996, J. IFN and Cytokine Res. 16:709-713]. Незважаючи на багатообіцяючі дані з використання ІФН як регулятора експресії мРНК HPV, встановлені дані свідчать про варіабельність ІФН-відповіді і про феномен резистентності до даного цитокіну, який в клінічних випробуваннях складає у пацієнтів 40-50% [Arany I., Tyring S.K., Stanley M.A., Tomai M.A., Miller R.L., Smith M.H., McDermott D.J., Slade H.B., 1999, Antiviral Res. 43:55-63]. Деякі молекулярні і клінічні факти свідчать про те, що онкогенний білок Е7 грає ключову роль в феномені ІФН-резистентності. Наприклад, повідомлялося, що Е7 зв'язується з індукованим ІФН фактором транскрипції (р48), викликаючи тим самим ІФН-відповідь внаслідок блокування активації транскрипції [Barnard P. and 5 McMillan N.A.J., 1999, Virology 259:305-313]. Крім того, повідомляється також про зміну в присутності Е7 регуляторного ІФН-чинника (IRF-1) [Park J.S., Kim E.J., Know H.J., Hwang E.S., Namkoong S.E., Urn S.J., 2000, J. Biol. Chem. 275:6764-6769) (Perea S.E., Massimi P., Banks L., 2000, J. Мої. Med. 5:661666]. За результатами клінічних випробувань вважають, що відповідь на ІФН залежить від експресії Е7 в HPV-вмісних осередках ураження [Frazer I.H., McMillan N.A.J., 1997, Papillomatosis and condyloma acuminate. Clinical Applications of the interferons (R. Stuart Harris and R.D. Penny, eds. ) Pp 79-90. Chapman and Hall Medical, London]. Онкогенний білок Е7 грає істотну роль в малігнізації, що викликається даними онкогенними вірусами. Так, було показано, що індукована Е7 іморталізація первинних клітин приводить до мутацій і хромосомної аберації після початку процесу іморталізації [Mougin C,Humbey 0., Gay С, Riethmuller D., 2000, J. Gynecol. Obstet Biol Reprod. 29:13-20]. 3 іншого боку, нами показано, що стабільна трансфекція за допомогою гена Е7 приводить до створення в чутливих пухлинних клітинах феномену ІФН-резистентності [Мого Α., Calixto Α., Suarez E., Arana M.J., Perea S.E., 1998, Bioch. Biophys. Res. Comm. 245:752-756]. Повідомляється також, що онкогенний білок Е7 зв'язує і блокує функцію пухлинних супресорних генів, подібних до генів ретинобластоми ((Rb) і інсулінподІбного фактора росту 3, зв'язуючому білок (IGFBP-3), відповідно, через Cys 24 і Скінцевий домен [Nevins J.R., 1992, Science 258:424-429] [Zwerscke W. and Jansen-Durr P., 2000, Advances in cancer Res. 78:1-29]. Аналогічно до цього показано, що пари Ser31/Ser32 в білці Е7 є субстратом для ферменту СКІІ [Hashida Т., Yasumoto S., 1990, Biochem. Biophys. Res. Comm., 172:958-964] і що цей домен істотний для трансформуючої здатності даного онкогенного білка [Barbosa M.S., Edmonds C, Fisher С, Schiller J.T., Lowy D.R., Vousden К., 1990, EMBO J. 9:153160] [Chien W.-M., Parker J.N., Schmidt-Grimminger D.-C, Broker T.R., Chow L.T., 2000, Cell Growth & Differentiation 11:425-435], а також для інгібування сигнального каскаду ІФН [Perea S.E., Lopez-Ocejo О., Garcia Millan R., Banks L., Arana M.J., 1996, Eur. Cytokine Net. 7:503]. Виходячи з ролі фосфорилювального сайту СКІІ для резистентності HPV до ІФН і розвитку злоякісної пухлини, можна вважати, що розробка лікарських засобів, що блокують такий домен, могла б стати корисною в терапії злоякісних пухлин. Молекули, що інгібують СКПфосфорилювальну ділянку в Е7 або в інших клітинних субстратах, досі не описані. Відносно онкогенного білка Е7, описані лише пептиди, що блокують Rb-зв'язуючий сайт (Cys24) [Webster K.R., Koleman K.G., 1997, US5625031] [Oliff A.I., Riemen M.W., EP0412762 A2 910213] і інші С-кінцеві ділянки (39-98) [Pidder J.-D., Zwerschkie W, 2000, EP09699013]. У клінічних або в доклінічних випробуваннях до теперішнього часу описані декілька вакцинкандидатів, які представляють інтерес для створення CTL-відповіді, специфічної у відношенні 81403 6 Е7 HPV [Chen С, Wang C.C., Hung C, Pardoll D.M., Wu Т., 2000, Vaccine 18:2015-2022] [Chen C.H., Ji H., Sun K.W., Chotl M.A., Pardoll D.M., Wu T.C., 1999, Gene Ther. 12:1972-1981]. Однак спроби, зосереджені на отриманні СТХ-відповіді, зустрічають різні ускладнення, пов'язані з біологією HPV. Наприклад, онкогенні типи HPV придушують антигенні МНС класу І, які істотні для CTL-відповіді [Connor M.E., Stern P.L., 1990, Int. J. Cancer 46:1029-1034]. Крім того, експресія Е7 асоціюється з локальною імуносупресією в оточенні даної злоякісної пухлини, і це могло б також впливати на відповідний вияв CTL-відповіді [Le Buanec Η., D'Anna R., Lachgar Α., Zagury J.F., Bernard J., Ittlele D., d'Alessio P., Hallez S., Giannouli C, Burny Α., Bizzini В., Gallo R.C., Zagury D., 1999, Biomed. Pharmacother. 53:424-431] [Lee S.J., Cho Y.S., Shim J.H., Lee K.A., Ко K.K., Choe Y.K., Park S.N., Hoshino Т., Kirn S., Dinarello C.A., Yoon F.U., 2001, J. Immunol. 167:497-504]. Відповідно до вищезгаданих міркувань, очевидно, що об'єднання CTL-вакцин і фармацевтичних препаратів, направлених на Е7, могло б мати великі перспективи. Крім того, даний підхід до отримання превентивних HPV-вакцин приносить велику користь, а ціновий ризик зумовлений різними біологічними і соціальними аспектами, включаючи: 1) тривалий латентний період після первинної інфекції HPV, 2) слабке розуміння механізму HPVінфекції, З) відсутність тваринної моделі для відповідного розмноження HPV, 4) видову специфічність і 5) оцінку соціального впливу превентивної HPV-вакцини, яка може прийматися дуже довго. Тому використання фармацевтичних препаратів, специфічно направлених на вірусні онкогенні білки, могло б створити переваги перед підходами, зосередженими на управлінні імунною системою. Суть і новизна даного винаходу основані на описі вперше циклічних пептидів, що дозволяють прямо інгібувати фосфорилювальну ділянку СКП, а також цитотоксично впливати in vivo на клітини карциноми шийки матки HPV-16. Крім того, дані пептиди підвищують чутливість вказаних клітин до цитостатичної діїІФН. Даний винахід відноситься головним чином до пептидів, здатних зв'язувати фосфорилювальну ділянку СКІІ, в якій виявлені наступні послідовності: (a) CSVRQGPVQKC (Id. Sec. No. I) (b) CSSCQNSPALC (Id. Sec. No. 2) (c) CQIPQRTATRC (Id. Sec. No. 3) (d) CAKQRTDPGYC (Id. Sec. No. 4) (e) CWMSPRHLGTC (Id. Sec. No. 5) (f) CRNCTVIQFSC (Id. Sec. No. 6) (g) CHYIAGTVQGC (Id. Sec. No. 7) (h) CPLVSLRDHSC (Id. Sec. No. 8) (i) CKQSYLHHLLC (Id. Sec. No. 9) (j) CFQPLTPLCRC (Id. Sec. No. 10) (k) CQSYHELLLQS (Id. Sec. No. 11) Даний винахід включає в себе також будь-який гомологічний варіант або міметик з вищезгаданих пептидів, які отримують шляхом синтезу або рекомбінантним способом, а також будь-який злитий пептид, що містить пептиди, описані в 7 приведеному списку. Будь-який пептид, структура якого дозволяє блокувати фосфорилювальну ділянку СКІІ для відповідного субстрату, вважається гомологічним варіантом. Крім того, будь-яку хімічну молекулу (не пептидну), структура якої дозволяє блокувати таку фосфорилювальну ділянку, вважають варіантом міметика. Інша мета даного винаходу полягає в створенні фармацевтичної композиції, яка включає в себе один або декілька пептидів, описаних в даному винаході, а також відповідний носій. Крім того, даний винахід включає в себе застосування вищезгаданих пептидів окремо або в поєднанні з будь-якою іншою відповідною молекулою, такою як цитокіни і інтерферони для 1) інгібування проліферації пухлинних клітин, 2) обробки HPV-асоційованої і не асоційованої злоякісної пухлини і 3) обробки HPV-асоційованих осередків ураження на передпухлинних стадіях. Крім того, пептиди згідно з винаходом можна було б використати для лікування HPVінфікованих пацієнтів, не чутливих до лікування інтерфероном. В іншому відношенні даний винахід включає в себе певний експресуючий вектор для клітин ссавця, що містить ДНК-послідовність, яка кодує будь-який з вищезгаданих пептидів. Пептиди згідно з винаходом володіють циклічною структурою і в основному характеризуються здатністю зв'язувати фосфорилювальну ділянку СКІІ і анулювати таку біохімічну подію. Дані пептиди описані в прикладеному списку. З іншого боку, показані також ефекти in vivo, що здійснюються пептидами на HPV-трансформовані клітини. Описані пептиди характеризують їх здатністю інгібувати фосфорилювання послідовності RRREEETEEE, раніше описаної як оптимальний консенсусний домен для СКІІ-фосфорилювання (Promega Cat:V5661), і ділянки фосфорилювання, що знаходиться в ділянці 28-38 онкогенного білка Е7 HPV-16. Щоб охарактеризувати пептиди, описані в даному винаході, сконструювали єдину бібліотеку 11-амінокислотого циклічного пептиду, яка експресується в Р8-ділянці ниткоподібних фагів. Скринінг даної бібліотеки здійснюють з використанням синтетичної 28-38-ділянки Е7 як мішені, якою також кон'югують з біотином для її фіксації на твердій поверхні. Селекцію фагів, що зв'язалися з 28-38-ділянкою Е7, здійснюють шляхом імунодетекції з використанням специфічного антитіла до Р8-ділянки в даному фагу. У кінцевому результаті, ДНК, відповідну відібраним одинадцяти фагам з високою здатністю зв'язування з 2 8-3 8-ділянкою Е7, секвенують, і відповідні пептиди хімічно синтезують твердофазним методом. Потім отримані синтетичні пептиди виділяють, піддаючи очищенню з допомогою ВЕРХ, аналізують за допомогою мас-спектрометрії, і, нарешті, оцінюють отриману in vitro- і in vivo-ефективність. Згідно з даним винаходом, незважаючи на відмінність амінокислотних послідовностей описаних тут циклічних пептидів, вони однаково 81403 8 інгібують СКІІ-фосфорилювання. Даний факт означає, що взаємодія цих пептидів з фосфорилювальною ділянкою СКП визначається переважно їх структурою, а не самою послідовністю. У даному винаході також показано, що лінійні пептиди виявляють більш низьку здатність до інгібування фосфорилювальної ділянки СКП. Даний факт посилює значення структури для зв'язувальної здатності пептидів, що розглядаються, з таким доменом. Крім того, даний факт передбачає ефективність інших міметичних молекул, які зв'язуються з фосфорилювальною ділянкою СКІІ. Для того щоб досягти здійснення внутрішньоклітинної дії CKJI на ендогенні субстрати, описані пептиди можна хімічно кон'югувати або генетично виростити з проникаючими в клітину пептидами, що відносяться до білків, подібних, в числі інших, до Tat 1 вірусу імунодефіциту людини (ВІЛ-1) [Schwarze S.R., Dowdy S.F., 2000, Trends Pharmacol. 21:45-48], транскрипційного фактора, що кодується геном Drosophila Antenapedia (Derossi D., і співавт., 1996, J. Biol. Chem. 271:18188-18193), білка VP22 вірусу простого герпесу (HSV) [Lindgreen M., і співавт., 2000, Trends Pharmacol. Sci. 21:99-103], пенетратину (penetratin) і транспортану (transportan) [Gariepy J., Kawamura K., 2001, Trends Biotech. 19:21-28]. Для перевірки in vivo гіпотези даного винаходу дані циклічні пептиди синтетично зливали з проникаючим в клітину пептидом, приведеним для білка Tat 1 ВІЛ-1 (GRKKRRQRRRPPQC), і з пептидом для локалізованого в ядрі сигналу, що належить великому антигену Τ (KKKRKVE) SV40. Представлені в даному винаході дані ясно свідчать про те, що циклічні пептиди виявляють дозозалежну цитотоксичність відносно трансформованих HPV-16 (CaSki) клітин карциноми шийки матки. Ці результати передбачають використання даних пептидів як терапевтичного засобу для обробки злоякісних пухлин одного і того ж гістологічного походження, а також передпухлинних стадій інтраепітеліальної неоплазії шийки матки. Крім того, експериментальні дані in vivo свідчать, що циклічні пептиди виявляються більш ефективними, ніж їх відповідна лінійна форма, підкріплюючи тим самим положення про істотне значення структури пептидів для їх дії. Крім того, циклічні пептиди, описані в даному винаході, ефективні відносно клітин HeLa, що містять HPV-18, а також відносно клітин Н-82, отриманих з клітин недрібноклітинного раку легеня, негативних по HPV. Ці результати корелюють з результатами, отриманими in vitro в даному винаході і свідчать про те, що пептиди блокують не тільки ділянку СКП, що фосфорилює Е7 HPV-16, але вони блокують його також і в інших білках, що містять таку ділянку. Той факт, що описані тут пептиди ефективні відносно HPVнегативних пухлинних клітин, є аргументом на користь їх можливого використання для інших епітеліальних пухлин. Інші результати даного 9 винаходу свідчать про те, що обробка клітин CaSki описаними тут циклічними пептидами підвищує чутливість клітин до цитостатичної дії альфа-ІФН. З урахуванням попередніх доказів, що свідчать про те, що ділянка СКІІ, яка фосфорилює Е7 HPV16, необхідна для блокування сигнального каскаду ІФН [Perea S.E., Lopez-Ocejo О., Garcia Millan R., Banks L., Arana M.J., 1996, Eur. Cytokine Net. 7:503], описані тут пептиди можна використати, щоб компенсувати звичайну ІФН-резистентність, яка спостерігається при HPV-інфекдії. Даний винахід можна віднести також до ДНК, що кодує кожний з описаних тут пептидів. Дану ДНК можна вводити в- експресуючий вектор ссавця і потім трансфікувати і в трансформовані HPV-16 клітини і в нетрансформовані клітини. Даний вектор, що містить олігонуклеотид, який кодує кожний пептид, можна також використати як альтернативу генній терапії HPV-асоційованої злоякісної пухлини. У принципі, описані тут пептиди можна використати при HPV-асоційованих захворюваннях разом з іншими агентами, а також з терапевтичними вакцинами, створеними на основі клітинної відповіді проти HPV. Даний винахід ілюструється нижченаведеними прикладами: Приклад 1: Вплив пептидів на фосфорилювальну ділянку СКІІ: Даний аналіз оснований на in vitro реакції фосфорилювання з використанням субстратно!" послідовності RRREEETEEE, яка являє собою оптимізований консенсусний домен СКІІ-фосфорилювання. Дану реакцію здійснюють в 50мкл 25мМ рН 7,5 Тріс:НС1, 1мкКі 32Ρ-γΑΤΦ, 100мкМ АТФ, 2мг/мл субстратного пептиду, 0,2Μ NaCl, 10мМ MgCl і 1 одиниці ферменту СКІІ (Promega). Реакцію інкубують при 37°С протягом 10 хвилин. Потім на хроматографічний папір РЕ-81 (Whatmann) наносять 5мкл реакційної суміші у вигляді плями і здійснюють чотири промивання за допомогою 10мМ Н3РО4. На закінчення, вимірюють пов'язану з фільтрами радіоактивність, і по рівнях срт визначають ферментативну активність СКІІ в кожному зразку. Одночасно в кожний аналіз як внутрішній контроль включають специфічний інгібітор СКІІ, подібний до гепарину. Представлені на Фігурі 1 дані показують, що циклічні пептиди інгібують СКІІ-фосфорилювання на 80%. Лінійні пептиди також інгібують СКІІ-фосфорилювання ділянки 28-38 в Е7, хоч і в меншій мірі в порівнянні з циклічною формою. Ці дані вказують, що описані тут пептиди інгібують фосфорилювальну ділянку СКІІ і дають підставу вважати, що їх структура грає істотну роль в їх взаємодії з послідовностямимішенями. Приклад 2: Вплив пептидів на фосфорилювання Е7 HPV-16: Даний аналіз оснований на in vitro реакції фосфорилювання онкогенного білка Е7 HPV-16, який експресується в Е.соіі у вигляді злитого білка з глутатіон-Sтрансферазою (GST). Перед проведенням ферментативної реакції злитий білок Е7-GST виділяють шляхом очищення за допомогою хроматографії по спорідненості з використанням 81403 10 гранул глутатіон-сефарози (Pharmacia). Дану реакцію здійснюють в 50мкл 25мМ рН 7,5 Тріс:НСlбуфера, 1 мкКі 32Ρ-γΑΤΦ, 100мкМ АТФ, 40 мкл вказаних гранул, що містить E7-GST, 0,2Μ NaCl, 10мМ MgCl і 1 одиниці СКІІ (Promega). Вказану реакційну суміш інкубують при 37°С протягом 40хв. Після чого гранули промивають три рази за допомогою 0,5мл буфера, і в кінцевому результаті рівень фосфорилювання E7-GST аналізують за допомогою 10%-го SDS-ПААГ-електрофорезу. Візуалізацію фосфорильованих білків здійснюють шляхом вияву рентгенівської плівки, експонованої раніше з висушеними гелями. Кількість фосфорильованого білка Е7 визначають денситометруванням. Дані на Фігурі 2 вказують, що описані тут пептиди однаково ефективні в межах інгібування ділянки СКІІ, яка фосфорилює Е7 HPV-16. Приклад 3: Вплив пептидів на проліферацію клітин, трансформованих HPV-16 і HPV-18 (відповідно. CaSki і HeLa): У даному аналізі клітини CaSki або HeLa в концентрації 2х104 клітин/мл висівають в 96-ямкові планшети (Costar) з використанням DMEM з доданням 10% навколоплідної сироватки теляти (FCS) (Gibco). Через 24 години в культуральне середовище вносять пептиди в дозах, що варіюють між 15мкМ і 500мкМ. Інкубацію здійснюють протягом 96 годин в 5% СО2, після чого в кожну ямку підливають по 20мкл розчину MTS (1,90мг/мл) (Promega). Планшети послідовно витримують протягом однієї години в одних і тих же інкубаційних умовах, і на закінчення розраховують поглинання при 490нм. Результати виражають у вигляді процента зростання відносно контролю без пептидів. З цією метою і циклічні, і лінійні пептиди зливають шляхом хімічного синтезу з проникаючим в клітину пептидом Tat-Ι ВІЛ-1, який здатний проникати в цитоплазму і ядро [Schwarze S.R., Dowdy S.F., 2000, Trends Pharmacol. 21:45-48]. Отримані в даному експерименті дані показують, що описані тут пептиди надають залежний від дози ефект і на клітини CaSki (HPV-16) і на клітини HeLa (HPV-18) (Фігури ЗА і ЗВ). Даний приклад показує, що пептиди згідно з винаходом ефективні не тільки у відношенні HPV-16, але також і у відношенні HPV18. Приклад 4: Вплив пептидів на проліферацію НРУ-негативних пухлинних клітин: У даному аналізі клітини Н-82 (дрібноклітинний рак легеня) в концентрації 2x104 клітин/мл висівають в 96-ямкові планшети (Costar) з використанням DMEM з доданням 10% навколоплідної сироватки теляти (Gibco). Через 24 години в дане культуральне середовище вносять пептиди в дозах, що варіюють між 15мкМ і 500мкМ. Інкубацію здійснюють протягом 96 годин в 5% СО2, після чого в кожну ямку підливають 20мкл розчину MTS (1,90мг/мл) (Promega). Планшети послідовно витримують протягом однієї години в одних і тих же інкубаційних умовах, і на закінчення розраховують поглинання при 490нм. Результати виражають у вигляді процента зростання відносно контролю без пептидів. У даному аналізі описані в 11 даному винаході циклічні пептиди, злиті з проникаючим в клітину пептидом Tat-1 ВІЛ-1, використовують, як вказано вище. Отримані в даному експерименті результати показують, що пептиди згідно з винаходом надають залежний від дози ефект на проліферацію клітин Н-82. На Фігурі 4 показано, що пептиди згідно з винаходом ефективні не тільки відносно HPVтрансформованих клітин, але також і відносно пухлинних клітин іншої локалізації і гістологічних типів, подібних до дрібноклітинного раку легеня. Приклад 5: Вплив пептидів на HPV-16відповідь на обробку ІФН в клітинах CaSki: У даному аналізі клітини CaSki висівають в концентрації 2x104 клітин/мл в 96-ямкові планшети (Costar) з використанням DMEM з доданням 10% FCS (Gibco). Через 24 години в дане культуральне середовище вносять 120мкМ кожного пептиду. Через двадцять чотири години додають ІФН в кількості між 1000 і 31,5Од/мл. Інкубацію здійснюють протягом 96 годин в 5% СО2, після чого підливають 20мкл MTS, 1,90мг/мл. Крім того, планшети витримують протягом однієї години в одних і тих же умовах, і на закінчення зчитують поглинання при 490нм. Дані представлені у вигляді процента зростання відносно контролю. У даних експериментах описані в даному винаході пептиди використовують в їх циклічному варіанті, злитими з проникаючим в клітину пептидом, що належить Tat-1-білку ВІЛ, як указано вище. Представлені на Фігурі 5 результати показують, що попередня інкубація клітин CaSki з описаними в даному винаході пептидами, робить ці клітини чутливими до антипроліферативного впливу альфа-ІФН. Ці дані дають підставу вважати, що описані в даному винаході пептиди корисні; для лікування HPV-інфікованих пацієнтів, стійких до ІФН-терапії. Приклад 6: Протипухлинна дія пептиду, який інгібує СКІІ-фосфорилювання в людських пухлинах, імплантованих моделям голих мишей: У цих експериментах використовують 6-8тижневих самиць голих мишей BalbC. Імплантацію злоякісної пухлини здійснюють з використанням клітин Н-125 (недрібноклітинний рак легеня) в концентрації 1000000 клітин/мл, які ресуспендують в сольовому розчині (PBS). Клітинну суспензію інокулюють підшкірно в черево. Введення пептиду (послідовність 1 в приведеному списку) здійснюють разом з даними клітинами і продовжують здійснювати через день до завершення одномісячної обробки. У даному аналізі дози варіюють між 1 і 10мг/кг маси тіла. Для дослідження протипухлинної дії послідовно міняють параметри. Ці дані демонструють протипухлинну ефективність пептиду, якій інгібує СКІІ-фосфорилювання в моделі злоякісної пухлини людини, імплантованій піддослідним тваринам. Переваги даного винаходу: 1. Створені фармацевтичні засоби з широким спектром застосування, які не тільки використовують при HPV-асоційованих захворюваннях, але також і при солідних пухлинах з високим рівнем ендогенної активності СКП. 81403 12 2. Той факт, що 28-38-ділянка консервативна у HPV, дає можливість використати даний фармацевтичний засіб при захворюваннях, асоційованих з різними HPV-типами. 3. Пептиди у вигляді терапевтичних молекул виявляють низьку антигенність при введенні людині. 4. Терапевтичний засіб, що розглядається, є легким у виготовленні. Короткий опис фігур: Фігура 1: Вплив пептидів на СКПфосфорилювання. Фігура 2: Вплив пептидів на НРУЕ7-СК11фосфорилювання. Фігура ЗА: Вплив пептидів на проліферацію CaSki-клітин. Фігура ЗВ: Вплив пептидів на проліферацію HeLa-клітин. Фігура 4: Вплив пептидів на проліферацію клітин пухлини легеня. Фігура 5: Вплив пептидів на відповідь HPV-16трансформованих клітин до дії ІФН. 13 81403 14 15 81403 16 17 81403 18
ДивитисяДодаткова інформація
Назва патенту англійськоюPeptide capable to bind casein kinase ii (ckii) phosphorylating site and to inhibit phosphorylation and use thereof
Автори англійськоюReyes Acosta Osvaldo, Puchades Izaguirre Yaquelin, Silva Rodriguez Ricardo, Moro Soria Alejandro, Santos Savio Alicia, Gonzalez Lopez Luis Javier, Gonzalez Barrios Belkis
Назва патенту російськоюПептид, способный связываться и ингибировать фосфолирирующий участок казеинкиназы ii (скіі), и его применение
Автори російськоюРеес Акоста Освальдо, Пучадес Исагирре Якелин, Сильва Родригес Рикардо, Моро Сория Алехандро, Сантос Савио Алисия, Гонсалес Лопес Луис Хавьер, Гонсалес Барриос Белькис
МПК / Мітки
МПК: A61K 38/55, A61P 43/00, C07K 14/025, C07K 7/06, A61P 35/00, C07K 7/64, A61K 38/00, A61K 38/12
Мітки: ділянку, пептид, застосування, скіі, казеїнкінази, зв'язуватися, фосфорилювальну, здатний, інгібувати
Код посилання
<a href="https://ua.patents.su/9-81403-peptid-shho-zdatnijj-zvyazuvatisya-ta-ingibuvati-fosforilyuvalnu-dilyanku-kazenkinazi-ii-skii-ta-jjogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Пептид, що здатний зв’язуватися та інгібувати фосфорилювальну ділянку казеїнкінази ii (скіі), та його застосування</a>
Попередній патент: Пристрій для керування стрілковим електроприводом
Наступний патент: Спосіб профілактики остеомієлітів при переломах нижньої щелепи
Випадковий патент: Пристрій для відбирання води