Спосіб одержання 4-амінометил-3-алкоксіімінопіролідин метансульфонату та його похідних (варіанти), а також проміжні сполуки
Номер патенту: 82504
Опубліковано: 25.04.2008
Автори: Лі Кьюнг-Хі, Шин Хьюн-Ік, Лі Дже-Сунг, Нам Хьюн, Кім Йеонг-Де, Кім Янг-Кеун, Хванг Гіо-Хьюн, Чанг Джей-Хіок, Нох Хьюн-Кук
Формула / Реферат
1. Спосіб одержання сполуки (І)
 , (І)
, (І)
де R є C1-4-алкіл або C1-4-галоїдалкіл, який відрізняється тим, що включає у себе стадії:
a) реакцію сполуки (II)
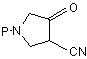 , (II)
, (II)
де Р є захисною групою, з алкоксіаміном або галоїдалкоксіаміном, або з сіллю того чи іншого при наявності основи з одержанням сполуки (III)
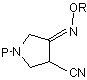 , (III)
, (III)
де R і Р є такими, як визначено вище;
b) реакцію сполуки (III) з метансульфокислотою з одержанням сполуки (IV)
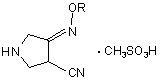 , (IV)
, (IV)
де R є таким, як визначено вище; і
c) додавання метансульфокислоти і каталізатора гідрування до сполуки (IV) і піддавання цієї сполуки реакції гідрування з одержанням сполуки (І).
2. Спосіб за п. 1, який відрізняється тим, що R є метил.
3. Спосіб за п. 1, який відрізняється тим, що Р є трет-бутоксикарбоніл (ВОС).
4. Спосіб за п. 1, який відрізняється тим, що основою на стадії (а) є триетиламін, три-н-бутиламін, діізопропілетиламін, піридин, 4-метиламінопіридин, 4-(4-метилпіперидин-1-іл)піридин або ацетат натрію.
5. Спосіб за п. 1, який відрізняється тим, що кількість основи, що використовується на стадії (а), складає від 0,01 до 10 екв. по відношенню до сполуки (II).
6. Спосіб за п. 1, який відрізняється тим, що кількість використовуваної на стадіях (b) і (с) метансульфокислоти складає від 0,5 до 3 екв. у відношенні до сполуки (III).
7. Спосіб за п. 1, який відрізняється тим, що реакцію на стадії (с) проводять в одному чи більше розчинниках, вибраних із групи, що складається із метанолу, етанолу, н-пропанолу, ізопропанолу, тетрагідрофурану, диметоксіетану, діоксану, етилацетату і дихлорметану.
8. Спосіб за п. 1, який відрізняється тим, що каталізатором гідрування на стадії (с) є Pd-каталізатор, який не тільки має від 1 до 20 % (мас.) Pd, але також вбудований в основу, вибрану із групи, що складається із вуглецю, кремнезему і глинозему.
9. Спосіб за п. 1, який відрізняється тим, що каталізатор на стадії (с) використовують у кількості від 0,01 до 10 % (мас.) відносно маси сполуки (IV) в розрахунку на металевий компонент.
10. Спосіб за п. 1, який відрізняється тим, що реакцію гідрування на стадії (с) проводять при температурі в діапазоні від 0 до 50 °С і тиску водню від 1 до 100 атм.
11. Спосіб за п. 1, який відрізняється тим, що в ньому використовують алкоксіамінгідрохлорид або галоїдалкоксіамінгідрохлорид.
12. Спосіб одержання сполуки (І)
 , (I)
, (I)
де R є С1-4-алкіл або С1-4-галоїдалкіл, який відрізняється тим, що включає у себе стадії:
a) реакцію сполуки (II)
 , (II)
, (II)
де Р є захисною групою, з алкоксіаміном або галоїдалкоксіаміном, або сіллю того чи іншого при наявності основи з одержанням сполуки (III)
 , (III)
, (III)
де R і Р є такими, як визначено вище; і
b) додавання метансульфокислоти і каталізатора гідрування до сполуки (III) і піддавання цієї сполуки реакції гідрування з одержанням сполуки (І).
13. Спосіб за п. 12, який відрізняється тим, що R є метил.
14. Спосіб за п. 12, який відрізняється тим, що Р є трет-бутоксикарбоніл (ВОС).
15. Спосіб за п. 12, який відрізняється тим, що основою на стадії (а) є триетиламін, три-н-бутиламін, діізопропілетиламін, піридин, 4-метиламінопіридин, 4-(4-метилпіперидин-1-іл)піридин або ацетат натрію.
16. Спосіб за п. 12, який відрізняється тим, що кількість основи, що використовується на стадії (а), складає від 0,01 до 10 екв. у відношенні до сполуки (II).
17. Спосіб за п. 12, який відрізняється тим, що реакцію на стадії (b) проводять в органічному розчиннику, вибраному із групи, що складається із метанолу, етанолу, н-пропанолу, ізопропанолу, тетрагідрофурану, диметоксіетану, діоксану, етилацетату і дихлорметану, або в суміші цього органічного розчинника з водою.
18. Спосіб за п. 17, який відрізняється тим, що реакцію на стадії (b) проводять в суміші органічного розчинника з водою.
19. Спосіб за п. 12, який відрізняється тим, що кількість використовуваної на стадії (b) метансульфокислоти складає від 1 до 6 екв. у відношенні до сполуки (III).
20. Спосіб за п. 12, який відрізняється тим, що каталізатором гідрування на стадії (b) є Pd-каталізатор, який не тільки має від 1 до 20 % (мас.) Pd, але також вбудований в основу, вибрану із групи, що складається із вуглецю, кремнезему і глинозему.
21. Спосіб за п. 12, який відрізняється тим, що каталізатор на стадії (b) використовують у кількості від 0,01 до 10 % (мас.) відносно маси сполуки (III) в розрахунку на металевий компонент.
22. Спосіб за п. 12, який відрізняється тим, що реакцію гідрування на стадії (b) проводять при температурі в діапазоні від 0 до 50 °С і тиску водню від 1 до 100 атм.
23. Спосіб за п. 12, який відрізняється тим, що в ньому використовують алкоксіамінгідрохлорид або галоїдалкоксіамінгідрохлорид.
24. Спосіб одержання сполуки (VI)
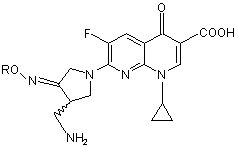 , (VI)
, (VI)
де R є С1-4-алкіл або С1-4-галоїдалкіл, або її солі, або гідрату її солі, який відрізняється тим, що він включає в себе стадію одержання сполуки (І)
 , (I)
, (I)
де R є такий, як визначено вище, згідно зі способом, який включає у себе стадії:
a) реакцію сполуки (II)
 , (II)
, (II)
де Р є захисною групою, з алкоксіаміном або галоїдалкоксіаміном, або з сіллю того чи іншого при наявності основи з одержанням сполуки (III)
 , (III)
, (III)
де R і Р є такими, як визначено вище;
b) реакцію сполуки (III) з метансульфокислотою з одержанням сполуки (IV)
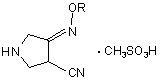 , (IV)
, (IV)
де R є таким, як визначено вище; і
c) додавання метансульфокислоти і каталізатора гідрування до сполуки (IV) і піддавання цієї сполуки реакції гідрування з одержанням сполуки (І); та
реакцію одержаної сполуки (І) зі сполукою (V)
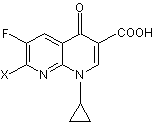 , (V)
, (V)
де X є відхідною групою.
25. Спосіб за п. 24, який відрізняється тим, що реакцію сполуки (І) зі сполукою (V) проводять при наявності основи в розчиннику.
26. Спосіб за п. 24 або 25, який відрізняється тим, що сполукою (VI) є метансульфонат (R,S)-7-(3-амінометил-4-син-метоксіімінопіролідин-1-іл)-1-циклопропіл-6-фтор-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбонової кислоти або його гідрат.
27. Сполука (III)
 , (III)
, (III)
де R є C1-4-алкіл або C1-4-галоїдалкіл і Р є захисною групою, вибраною з групи, що складається з формілу, ацетилу, трифторацетилу, бензоїлу, п-толуолсульфонілу, метоксикарбонілу, етоксикарбонілу, трет-бутоксикарбонілу, пара-метоксибензилу, тритилу, тетрагідропіранілу та півалоїлу.
28. Сполука (IV)
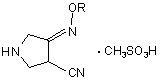 , (IV)
, (IV)
де R є C1-4-алкіл або C1-4-галоїдалкіл.
29. Спосіб одержання сполуки (VI)
 , (VI)
, (VI)
де R є С1-4-алкіл або С1-4-галоїдалкіл, або її солі, або гідрату її солі, який відрізняється тим, що він включає в себе стадію одержання сполуки (І)
 , (I)
, (I)
де R є такий, як визначено вище, згідно зі способом, який включає у себе стадії:
a) реакцію сполуки (II)
 , (II)
, (II)
де Р є захисною групою, з алкоксіаміном або галоїдалкоксіаміном, або сіллю того чи іншого при наявності основи з одержанням сполуки (III)
 , (III)
, (III)
де R і Р є такими, як визначено вище; і
b) додавання метансульфокислоти і каталізатора гідрування до сполуки (III) і піддавання цієї сполуки реакції гідрування з одержанням сполуки (І); та
реакцію одержаної сполуки (І) зі сполукою (V)
 , (V)
, (V)
де X є відхідною групою.
Текст
1. Спосіб одержання сполуки (І) 3 82504 4 від 0,01 до 10 % (мас.) відносно маси сполуки (IV) групи, що складається із вуглецю, кремнезему і в розрахунку на металевий компонент. глинозему. 10. Спосіб за п. 1, який відрізняється тим, що 21. Спосіб за п. 12, який відрізняється тим, що реакцію гідрування на стадії (с) проводять при текаталізатор на стадії (b) використовують у кількості мпературі в діапазоні від 0 до 50 °С і тиску водню від 0,01 до 10 % (мас.) відносно маси сполуки (III) від 1 до 100 атм. в розрахунку на металевий компонент. 11. Спосіб за п. 1, який відрізняється тим, що в 22. Спосіб за п. 12, який відрізняється тим, що ньому використовують алкоксіамінгідрохлорид або реакцію гідрування на стадії (b) проводять при галоїдалкоксіамінгідрохлорид. температурі в діапазоні від 0 до 50 °С і тиску вод12. Спосіб одержання сполуки (І) ню від 1 до 100 атм. OR 23. Спосіб за п. 12, який відрізняється тим, що в ньому використовують алкоксіамінгідрохлорид або N галоїдалкоксіамінгідрохлорид. HN (I) 24. Спосіб одержання сполуки (VI) NH2 . 2CH3 SO 3H O , де R є С1-4-алкіл або С1-4-галоїдалкіл, який відрізняється тим, що включає у себе стадії: a) реакцію сполуки (II) COOH F RO N N N N (VI) O (II) PN CN , де Р є захисною групою, з алкоксіаміном або галоїдалкоксіаміном, або сіллю того чи іншого при наявності основи з одержанням сполуки (III) NH2 , де R є С1-4-алкіл або С1-4-галоїдалкіл, або її солі, або гідрату її солі, який відрізняється тим, що він включає в себе стадію одержання сполуки (І) OR OR N PN (III) CN , де R і Р є такими, як визначено вище; і b) додавання метансульфокислоти і каталізатора гідрування до сполуки (III) і піддавання цієї сполуки реакції гідрування з одержанням сполуки (І). 13. Спосіб за п. 12, який відрізняється тим, що R є метил. 14. Спосіб за п. 12, який відрізняється тим, що Р є трет-бутоксикарбоніл (ВОС). 15. Спосіб за п. 12, який відрізняється тим, що основою на стадії (а) є триетиламін, три-нбутиламін, діізопропілетиламін, піридин, 4метиламінопіридин, 4-(4-метилпіперидин-1іл)піридин або ацетат натрію. 16. Спосіб за п. 12, який відрізняється тим, що кількість основи, що використовується на стадії (а), складає від 0,01 до 10 екв. у відношенні до сполуки (II). 17. Спосіб за п. 12, який відрізняється тим, що реакцію на стадії (b) проводять в органічному розчиннику, вибраному із групи, що складається із метанолу, етанолу, н-пропанолу, ізопропанолу, тетрагідрофурану, диметоксіетану, діоксану, етилацетату і дихлорметану, або в суміші цього органічного розчинника з водою. 18. Спосіб за п. 17, який відрізняється тим, що реакцію на стадії (b) проводять в суміші органічного розчинника з водою. 19. Спосіб за п. 12, який відрізняється тим, що кількість використовуваної на стадії (b) метансульфокислоти складає від 1 до 6 екв. у відношенні до сполуки (III). 20. Спосіб за п. 12, який відрізняється тим, що каталізатором гідрування на стадії (b) є Pdкаталізатор, який не тільки має від 1 до 20 % (мас.) Pd, але також вбудований в основу, вибрану із HN N NH2 . 2CH3SO 3H (I) , де R є такий, як визначено вище, згідно зі способом, який включає у себе стадії: a) реакцію сполуки (II) O (II) PN CN , де Р є захисною групою, з алкоксіаміном або галоїдалкоксіаміном, або з сіллю того чи іншого при наявності основи з одержанням сполуки (III) OR N (III) PN CN , де R і Р є такими, як визначено вище; b) реакцію сполуки (III) з метансульфокислотою з одержанням сполуки (IV) OR N HN . CH SO H 3 CN (IV) 3 , де R є таким, як визначено вище; і c) додавання метансульфокислоти і каталізатора гідрування до сполуки (IV) і піддавання цієї сполуки реакції гідрування з одержанням сполуки (І); та реакцію одержаної сполуки (І) зі сполукою (V) 5 82504 6 де R є С1-4-алкіл або С1-4-галоїдалкіл, або її солі, або гідрату її солі, який відрізняється тим, що він включає в себе стадію одержання сполуки (І) O COOH F X N де X є відхідною групою. 25. Спосіб за п. 24, який відрізняється тим, що реакцію сполуки (І) зі сполукою (V) проводять при наявності основи в розчиннику. 26. Спосіб за п. 24 або 25, який відрізняється тим, що сполукою (VI) є метансульфонат (R,S)-7(3-амінометил-4-син-метоксіімінопіролідин-1-іл)-1циклопропіл-6-фтор-4-оксо-1,4-дигідро-1,8нафтиридин-3-карбонової кислоти або його гідрат. 27. Сполука (III) OR N (III) PN NH2 . 2CH3SO 3H де R є C1-4-алкіл або C1-4-галоїдалкіл і Р є захисною групою, вибраною з групи, що складається з формілу, ацетилу, трифторацетилу, бензоїлу, птолуолсульфонілу, метоксикарбонілу, етоксикарбонілу, трет-бутоксикарбонілу, параметоксибензилу, тритилу, тетрагідропіранілу та півалоїлу. 28. Сполука (IV) OR O PN (II) CN , де Р є захисною групою, з алкоксіаміном або галоїдалкоксіаміном, або сіллю того чи іншого при наявності основи з одержанням сполуки (III) OR 3 (IV) 3 (III) PN CN , де R і Р є такими, як визначено вище; і b) додавання метансульфокислоти і каталізатора гідрування до сполуки (III) і піддавання цієї сполуки реакції гідрування з одержанням сполуки (І); та реакцію одержаної сполуки (І) зі сполукою (V) O COOH F . CH SO H (I) , де R є такий, як визначено вище, згідно зі способом, який включає у себе стадії: a) реакцію сполуки (II) N CN , HN N HN , N OR (V) N X N (V) N CN , де R є C1-4-алкіл або C1-4-галоїдалкіл. 29. Спосіб одержання сполуки (VI) де X є відхідною групою. , O COOH F RO N N NH2 N (VI) N , Даний винахід стосується процесу виготовлення 4-амінометил-3алкоксіімінопіролідинметансульфонату, що описується формулою: де R є С1-4 алкіл або С1-4 галоїдалкіл, який являє собою корисний проміжний продукт для виготовлення хінолінових антибіотиків і, зокрема, (R,S)-7-(3-амінометил-4-син-алкоксіімінопіролідин1-іл)-1-цикпопропіл-6-фтор-4-оксо-1,4-дигідро-1,8 нафтиридин-3-карбонової кислоти, що виражається формулою: де R є такий, як визначено вище, її солі або гідрату солі, як описано в [патенті США №5,633,262 і ЕР 0688 772 А1]. Процес згідно з даним винаходом має меншу кількість стадій виготовлення сполуки (І) порівняно 7 82504 з відомими процесами, що дають високий вихід сполуки (І). Отже, даний винахід дозволяє зменшити виробничі витрати і, кінець кінцем, підвищити економічність процесу виготовлення сполуки (VI). У публікаціях WO99/44991 і WO01/17961 описаний процес виготовлення сполуки (І) у відповідності зі Схемою 1. де R є C1-4 алкіл або С1-4 галоїдалкіл, а Р і Р2 є однаковими або різними захисними групами. Зокрема, в WO99/44991 описаний процес виготовлення сполуки (3) зі сполуки (II) (Схема 1), який складається з двох стадій відновлення нітрильної групи і однієї стадії захисту аміногрупи. Сполуку (І) одержують зі сполуки (II) шляхом гідрування при наявності каталізатора, наприклад, Ra-Ni на першій стадії відновлення нітрильної групи. Як розчинник використовується суміш води з ізопропіловим спиртом у кількості від 2 до 20екв. по відношенню до сполуки (II). Сполуку (2) одержують зі сполуки (І) шляхом захисту аміногрупи. При цьому захисну групу вибирають серед формілу, ацетилу, трифторацетилу, бензоїлу, р-толуолсульфонілу, метоксикарбонілу, етоксикарбонілу, t-бутоксикарбонілу, бензилоксикарбонілу, р-метоксибензилу, тритилу, тетрагідропіранілу, півалоїлу та ін. Серед цих захисних груп кращою є t-бутоксикарбонільна група. Проте (ВОС)2О, використовуваний для введення tбутоксикарбонільної групи, є дорогим реагентом, на який припадає близько 1/3 загальних витрат на виготовлення сполуки (2) зі сполуки (І). Крім того, температуру цієї реакції важко контролювати через високу екзотермічність і швидкість останньої. Поганий контроль температури реакції призводить до утворення димеру сполуки (2). Сполука (2) може відокремлюватися за допомогою завершальних операцій екстрагування і твердіння. Ці завершальні операції значно ускладнюють даний процес. Сполуку (3) отримують зі сполуки (2) за допомогою другого гідрування з Pd/C-каталізатором. Каталізатор використовують у кількості 0,520%(мас), а для запобігання відновленню карбонільної групи у 3-положенні піролідинового кільця застосовують амінний або буферний розчин. Процес одержання сполуки (І) зі сполуки (4) описаний у WO01/17961, де захисну групу видаляють за допомогою метансульфокислоти з утворенням солі. Але цей процес потребує для одержання високоякісного продукту проведення двох операцій рекристалізації. Ці операції рекристалізації знижують продуктивність і, отже, вихід продукту. У публікації ЕР О 688 772 А1 описаний процес виготовлення сполуки (4) зі сполуки (II), де використовується реакція, відображена нижче на Схемі 2, що відрізняється від наведеної вище Схеми 1. 8 де R є C1-4 алкіл або С1-4 галоїдалкіл, а Р і Р' є однаковими або різними захисними групами. В ЕР 0 688 772 А1 описаний процес виготовлення сполуки (4) зі сполуки (II), де карбонільна і нітрильна групи відновлюються одночасно з утворенням проміжного амінового спирту, а спиртова група піддається селективному окисленню з утворенням знов карбонільної групи. Цей процес потребує використання реагентів, які важко застосовувати в промислових умовах, і, таким чином, має небагато переваг над процесом WO99/44991. Зокрема, в цьому процесі для гідрування нітрильної групи використовується гомогенний каталізатор. Але приготування гомогенного каталізатора, його відновлення і відтворення після реакції є досить складною справою. Отже, із вищевикладеного видно, що відомі процеси виготовлення сполуки (І) є складними, пов'язані з великими виробничими витратами, мають погану відтворність, а також інші недоліки, що зумовлює необхідність у розробці нового, поліпшеного процесу. У результаті проведених авторами широких досліджень був створений новий процес, в якому дві стадії гідрування, що застосовувалися в WO99/44991, замінені однією стадією гідрування, і в якому не використовуються такі дорогі органічні реагенти, як (ВОС)2О, а також різноманітні органічні розчинники та інші реагенти. Таким чином, даним винаходом пропонується новий, ефективний процес виготовлення сполуки (І). Винаходом пропонується також процес виготовлення сполуки (VI) зі сполуки (І), одержаної за допомогою зазначеного нового процесу. Крім того, винаходом пропонуються нові проміжні продукти, що використовуються у процесі одержання сполуки (І). Відповідно до першого аспекту даного винаходу пропонується процес виготовлення сполуки (І) де R є С1-4 алкіл або С1-4 галоїдалкіл, який включає у себе стадії: а) реакції сполуки (II) де Ρ є захисна група, з алкосіаміном або галоїдалкоксіаміном, або з сіллю того чи іншого при наявності основи з одержанням сполуки (III) 9 де R і Ρ є такі, як визначено вище; b) реакції сполуки (III) з метансульфокислотою з одержанням сполуки (IV) де R є такий, як визначено вище, і с) додавання метансульфокислоти і каталізатора гідрування у сполуку (IV) і піддавання цієї сполуки реакції гідрування з одержанням сполуки (І). У цьому процесі захисною групою Ρ можуть бути форміл, ацетил, трифторацетил, бензоїл, ртолуолсульфоніл, метоксикарбоніл, етоксикарбоніл, t-бутоксикарбоніл, бензилоксикарбоніл, рметоксибензил, тритил, тетрагідропіраніл, півалоїл, тощо, серед яких найкращим є tбутоксикарбоніл (ВОС). Крім того, кращим R є метил. Описаний процес виготовлення сполуки (І) може бути відображений такою схемою: де R є C1-4 алкіл або С1-4 галоїдалкіл, а Р є захисна група. Стадія (а) Стадія перетворення сполуки (II) на сполуку (III) здійснюється при наявності основи. Кращими основами для цього є триетиламін, три-nбутиламін, діізопропілетиламін, піридин, 4метиламінопіридин, 4-(4-метилпіперидин-1іл)піридин і ацетат натрію. Кількість основи на цій стадії в кращому випадку лежить у межах від 0,01 до 10екв. по відношенню до сполуки (II). Реагенти, алкосіамін і галоїдалкосіамін, бажано використовувати у формі солі приєднання кислоти і, особливо, у формі гідрохлориду. Алкоксіамін, галоїдалкосіамін або сіль того чи іншого використовуються в кількості від 1 до 2 екв. по відношенню до сполуки (II). Як розчинник на стадії (а) можуть використовуватися вода, органічний розчинник або їх суміш і, зокрема, прямолінійний або розгалужений С^е спирт, де кращими є МеОН, ЕЮН або ІРА (ізопропіловий спирт). Температура і тривалість реакції на стадії (а) можуть бути різними залежно від використовуваних основи і розчинника. Наприклад, температура реакції може бути у межах від кімнатної до 200°С. У загальному випадку визначити відповідні температуру і тривалість реакції можна, виходячи з використовуваних основи і розчинника. 82504 10 У кращому варіанті здійснення винаходу як основу використовують триетиламін. У цьому випадку сполуку (II) піддають кип'ятінню зі зворотним холодильником з алкоксіамінгідрохлоридом при наявності триетиламіну і метанолу протягом 22год. В іншому кращому варіанті як основу використовують ацетат натрію. При цьому сполуку (II) додають у розчин гідрохлориду алкоксіаміну й ацетату натрію в етанолі або метанолі, і суміш кип'ятять протягом приблизно 18год. У ще одному кращому варіанті здійснення винаходу як основу використовують піридин. У цьому випадку сполуку (II) додають у розчин гідрохлориду алкоксіаміну і піридину в ізопропіловому спирті або метанолі, де суміш реагує в умовах перемішування протягом приблизно 5год. Цей варіант відрізняється особливою вигідністю завдяки тому, що реакцію в ньому проводять при кімнатній температурі. У кращому варіанті виконання цієї стадії сполука (III) може бути одержана без утворення побічного продукту, наявність якого може бути виявлена з допомогою HPLC-хроматографії (рідинної хроматографії з високою розрізнювальною спроможністю). Стадія (b) На цій стадії здійснюється перетворення сполуки (III) на сполуку (IV) для видалення захисної групи метансульфокислотою. Метансульфокислоту використовують у кількості приблизно від 0,5 до 3екв., а в кращому варіанті - приблизно від 1 до 1,2екв. по відношенню до сполуки (III). При цьому метансульфокислота дозволяє дуже легко видалити захисну групу. Як буде показано нижче на прикладах здійснення винаходу, аналізи методами ядерного магнітного резонансу (ЯМР) і HPLCхроматографії отримуваного в цих умовах продукту показують, що захисна група видаляється при приблизно 30хв. кип'ятінні зі зворотним холодильником. Стадія (с) На цій стадії сполуку (IV) перетворюють на цільову сполуку (І) за допомогою реакції селективного гідрування з металевим каталізатором Ренея, наприклад, нікелевим сплавом Ренея, кобальтовим сплавом Ренея і т.п., або з металевими каталізаторами, вбудованими в основу із активованого вугілля, глинозему, кремнезему і т.п. Як активний компонент каталізатора при цьому можуть використовуватися такі метали, як Ni, Co, Pt, Pd, Ru, Rh, Ir, Cu, тощо та сполуки паладію на зразок хлориду паладію, нітрату паладію, ацетату паладію, тощо, серед яких чистий паладієвий каталізатор є найкращим. У загальному випадку активність каталізатора може регулюватися шляхом добавляння інших металів у малій кількості у формі співкаталізатора або шляхом регулювання умов реакції, наприклад, температури, тиску і т.п., і таким чином може легко регулюватися селективність до цільового продукту. Каталізатором гідрування, особливо прийнятним для цілей даного винаходу, є паладієвий каталізатор не тільки у формі чистого паладію, взятого в кількості від 1 до 20%(мас), але також паладію, вбудованого в основу, матеріал якої може бути вибраний із сукупності, що склада 11 82504 12 ється із вуглецю, кремнезему і глинозему. Каталіде R є С1-4 алкіл або С1-4 галоїдалкіл, а Р є зазатор гідрування цього типу використовується в хисна група. Другий з цих процесів має ті самі пекількості від 0,01 до 10%(мас.) відносно маси спореваги, що і перший процес, але до того ж є більш луки (IV) у розрахунку від її металевого компоненефективним, оскільки кількість стадій у ньому скота. рочена від 3 до 2. Реакцію гідрування проводять у кращому варіСтадія (а) анті при температурі в інтервалі від 0 до 50°С і Стадію (а) другого процесу проводять так сатиску водню від 1 до 100атм. мо, як стадію (а) першого процесу. Метансульфокислоту додають у реакційний Стадія (b) розчин у кількості, приблизно, від 0,5 до 3екв., На стадії (b) другого процесу здійснюють водкраще - приблизно від 1 до 1,2екв. по відношенню ночас стадії (b) і (с) першого процесу. до сполуки (III). При цьому метансульфокислоту використовуЯк розчинник на цій стадії можуть використоють у кількості, що складає загальну кількість її на вуватися один або більше органічних розчинників, стадіях (b) і (с) першого варіанту процесу, тобто вибраних із групи, що складається із метанолу, приблизно від 1 до 6екв., а в ще кращому випадку етанолу, n-пропанолу, ізопропанолу, тетрагідро- приблизно від 1,5 до 2,5екв. по відношенню до фурану, диметоксіетану, діоксану, етилацетату і сполуки (III). Каталізатор гідрування вводять у кідихлорметану, серед яких кращим є метанол. лькості від 0,01 до 10%(мас.) по відношенню до Реакція на стадії (с) також може проводитися маси сполуки (III) в розрахунку на її металевий при наявності ще однієї добавки -кислоти. Такою компонент. добавкою може бути, наприклад, соляна кислота, На стадії (b) другого процесу використовують азотна кислота, сірчана кислота, оцтова кислота, органічний розчинник, вибраний із групи, що скламетансульфокислота та ін., серед яких найкращою дається із метанолу, етанолу, n-пропанолу, ізоє метансульфокислота. Для підвищення виходу пропанолу, тетрагідрофурану, диметоксіетану, корисного продукту цю кислоту оажано додавати в діоксану, етилацетату і дихлорметану, а також такій кількості, щоб pH реакційного розчину встасуміші цього органічного розчинника з водою. новлювати на рівень 2,5 під час реакції гідрування, Кращим серед них варіантом є суміш цього органіа додавати кислоту в реакційний розчин можна під чного розчинника з водою. При застосуванні цієї час ініціації цієї реакції або безперервно у середисуміші об'ємне співвідношення її компонентів лені періоду реакції. жить в інтервалі від 0,2 до 50 об'ємів органічного Відповідно до другого аспекту даного винахорозчинника до 1 об'єму води. В особливо кращому ду пропонується процес виготовлення сполуки (І) варіанті таким розчинником є суміш метанолу з водою. Крім того, на цій стадії можуть використовуватися такі самі умови реакції, що й на стадії (с) першого процесу. У відповідності з третім аспектом даного винаде R є С1-4 алкіл або С1-4 галоїдалкіл, який ходу пропонується процес виготовлення сполуки включає у себе стадії: а) реакції сполуки (II) (VI) де Ρ є захисна група, з алкосіаміном або галоїдалкоксіаміном, або з сіллю того чи іншого при наявності основи з одержанням сполуки (III) де R і Ρ є такі, як визначено вище, і (b) додавання метансульфокислоти і каталізатора гідрування в сполуку (III), і піддавання цієї сполуки реакції гідрування з одержанням сполуки (І).У кращому варіанті виконання описаного вище процесу R є метил, а Р є t-бутоксикарбоніл (ВОС). Запропонований процес виготовлення сполуки (І) може здійснюватися за наведеною нижче Схемою 4. де R є С1-4 алкіл, С1-4 галоїдалкіл або сіль того чи іншого, який включає у себе стадію реакції сполуки (І) де R є таким, як визначено вище, яку одержують у відповідності з описаними вище першим або другим процесами, зі сполукою (V) де X є група, що відходить, якою в кращому варіанті є галоген. У цьому процесі реакцію сполуки (І) зі сполукою (V) в кращому варіанті проводять у розчиннику при наявності основи. Специфічні умови цієї реак 13 82504 14 1 ції можуть легко регулюватися фахівцем у даній Н ЯМР (400МГц, CDCI 3) δ (х10-6мас.ч.): 1,47(s, галузі у відповідності з описом, поданим у 9H), 3,69(dd, 1H), 3,95(s, 3H), 3,98-4,06(m, 2Н), PCT/GBOO/03358. 4,10-4,22(m, 2Н). Сполукою (VI) у кращому варіанті є метансульфонат (R,S)-7-(3-амінометил-4-синметоксіімінопіролідин-1-іл)-1-циклопропіл-6-фтор4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбонової кислоти або його гідрат. У відповідності з четвертим аспектом даного min:хвилини винаходу пропонується нова сполука (III), що опиRef Іих:зворотній холодильник сується формулою: Еqиіv:евківалент До розчину сполуки (III) (3,0г, 0,0125 моль) у 25мл метанолу по краплях при перемішуванні додали метансульфокислоту (0,91мл, 1,1екв., 98%), і суміш гріли зі зворотним холодильником протягом де R є C1-4 алкіл або С1-4 галоїдалкіл, а Р є за30хв. Після цього реакційну суміш охолодили до хисна група. кімнатної температури, концентрували під знижеУ кращому варіанті захисною групою Ρ є tним тиском і рекристалізували, одержавши сполубутоксикарбоніл (ВОС). ку (IV) (4,14г, вихід 98,8%). У відповідності з п'ятим аспектом даного вина1 Н ЯМР (400МГц, D2O) δ (х10-6мас.ч.): 2,69 (s, ходу пропонується нова сполука (IV), що описуєть3Н), 3,76-3,82 (dd, 1Н), 3,88 (s, 3Н). ся формулою: (3) Синтез сполуки (І) де R є С1-4 алкіл або С1-4 галоїдалкіл. Зазначені вище сполуки (III) і (IV) можуть використовуватися як проміжні продукти в процесі виготовлення сполуки (І). Нижче розглянуто деякі конкретні приклади здійснення даного винаходу. Цілком зрозуміло, що наведені приклади жодним чином не обмежують даного винаходу. Приклад 1 (1) Синтез сполуки (III) До розчину сполуки (II) (10,5г, 0,05моль) у 100мл метанолу при наявності піридину (4,84мл, 1,2екв.) в умовах перемішування при кімнатній температурі додали метоксиламінгідрохлорид (5,0г, 1,2екв.). Через 5год. HPLC-хроматографія, що проводилася в таких умовах: показала завершення реакції. Леткі речовини були ретельно видалені у вакуумі, а до залишку додали етилацетат (50мл). Органічний шар двічі промили насиченим водним розчином NaHCO3 (100мл) і двічі соляним розчином (100мл). Для видалення вологи до органічного шару додали безводний сульфат магнію, і суміш концентрували у вакуумі, одержавши сполуку (III) (11,09г, вихід 92,8%). hоurs:години psl: фунт/кв.дюйм Еquiv:евківалент До розчину сполуки (IV) (4,19г, 0,0125 моль) у 80мл метанолу при перемішуванні додали Pd/Cкаталізатор (0,3г, у мокрому стані) і метансульфокислоту (1,0мл, 1,1екв., 98%), і провели реакцію гідрування протягом 24 годин при температурі 25°С і тиску водню 500 фунт/кв.дюйм (манометричний). По завершенні реакції суміш перепустили через целіт, видаливши таким чином каталізатор, а фільтрат концентрували у вакуумі. До залишку додали метанол (50мл) і як зародковий матеріал сполуку (І) (1мг). Суміш перемішали при кімнатній температурі протягом 1 години і відфільтрували. Одержану в результаті тверду речовину розчинили у водяній бані при температурі приблизно 50°С, рекристалізували при -20°С і відфільтрували, одержавши сполуку (І) (0,99г, вихід 23,1%). 1 Н ЯМР (400МГц, DMSO) δ (x10-6мас.ч): 2,39 (s, 6H), 3,07 (dd, 1H), 3,16 (dd, 1H), 3,24-3,30 (m, 2Н), 3,66-3,73 (m, 1Н), 3,87 (s, ЗН), 3,97 (dd, 2H). hours:години Ref Іих:зворотний холодильник До суспензії сполуки (II) (10,5г, 0,05 моль) у 100мл метанолу при перемішуванні додали метоксиламінгідрохлорид (5,0г, 1,2екв.) і триетиламін (8,4мл, 1,2екв.), і суміш гріли зі зворотним холодильником протягом 22 годин. Після цього реакційну суміш охолодили до кімнатної температури, концентрували під вакуумом, і до залишку додали етилацетат (50мл). Органічний шар двічі промили 15 82504 16 насиченим водним розчином NaHCO3 (100мл) і розчинили в метанолі (10мл), і до нього додали двічі соляним розчином (100мл). Після цього досполуку (І) (1мг) як зародковий матеріал для утводали безводний сульфат магнію, суміш відфільтрення кристалу при 5°С. Утворений кристал охорували, і фільтрат концентрували під вакуумом, лодили до -10°С і відфільтрували, одержавши меотримавши сполук; (III) (11,35г, вихід 95,0%). тансульфонат 3-амінометил-4-Z(2) Синтез сполуки (IV) метилоксіімінопіролідину (3,15г, вихід 45%). Сполука (IV) була одержана у відповідності з Приклад 6 процесом, описаним у Прикладі 1 (2). Синтез (R,S)-7-(3-амінометил-4-син(3) Синтез сполуки (І) метоксіімінопіролідин-1-іл)-1-циклопропіл-6-фторСполука (І) була одержана у відповідності з 4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбонової процесом, описаним у Прикладі 1 (3). кислоти. Приклад 3 До 7-хлорциклопропіл-6-фтор-4-оксо-1,4(1) Синтез сполуки (3) дигідро-1,8-нафтиридин-3-карбонової кислоти (3,05г) у воді (25мл) при 15-20°С додали триетиламін (5,1мл), і суміш перемішали протягом 20 хвилин. До суміші додали сполуку (І) (3,86г), одержану так, як описано в Прикладі 1, і воду (5мл), і утворену суміш перемішували при 20-25°С протягом 18 годин. Одержаний таким чином продукт hours:години відфільтрували, і фільтрат промили водою (30мл) Ref Іuх:зворотний холодильник й етанолом (30мл). Після просушування при 50°С До суспензії сполуки (II) (10,5г, 0,05 моль) у під вакуумом отримали зазначену в заголовку 100мл метанолу при перемішуванні додали метоксполуку (4,23г) у вигляді твердої речовини білого силамінгідрохлорид (5,0г, 1,2екв.) і ацетат натрію кольору. Дані ідентифікації продукту були такі са(4,92мл, 1,2екв.), і суміш гріли зі зворотним холомі, що мав автентичний зразок. дильником протягом 18 годин. Після цього реакПриклад 7 ційну суміш охолодили до кімнатної температури, Синтез метансульфонату (R,S)-7-(3концентрували під вакуумом, і до залишку додали амінометил-4-син-метоксіімінопіролідин-1-іл)-1етилацетат (50мл). Органічний шар двічі промили циклопропіл-6-фтор-4-оксо-1,4-дигідро-1,8насиченим водним розчином NaHCO3 (100мл) і нафтиридин-3-карбонової кислоти. двічі соляним розчином (100мл). Після цього доДо суспензії (R,S)-7-(3-амінометил-4-синдали безводний сульфат магнію, суміш відфільтметоксіімінопіролідин-1-іл)-1-циклопропіл-6-фторрували, і фільтрат концентрували під вакуумом, 4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбонової отримавши сполуку (III) (11,35г, вихід 95,0%). кислоти (1,5г, чистота 89,9%, 3,46 ммоль) у суміші (2) Синтез сполуки (IV) дихлорметану (23,2мл) й етанолу (2,7мл) при 30°С Сполука (IV) була одержана у відповідності з додали розчин метансульфокислоти (0,33г, 3,43 процесом, описаним у Прикладі 1 (2). ммоль) у дихлорметані (1мл). Суміш перемішува(3) Синтез сполуки (І) ли при 30°С протягом 3 годин, а потім охолодили Сполука (І) була одержана у відповідності з до 20°С і профільтрували. Фільтрат промили дихпроцесом, описаним у Прикладі 1 (3). лорметаном (20мл) і просушили при температурі Приклад 4 50°С під вакуумом, одержавши зазначену в назві (1) Синтез сполуки (III) сполуку (1,71г). Дані ідентифікації продукту були Сполука (III) була одержана у відповідності з такі самі, що мав автентичний зразок. процесом, описаним у Прикладі 1 (1). Приклад 8 (2) Синтез сполуки (IV) Синтез полуторного гідрату метансульфонату Сполука (IV) була одержана у відповідності з (R,S)-7-(3-амінометил-4-син-метоксіімінопіролідинпроцесом, описаним у Прикладі 1 (2). 1-іл)-1-циклопропіл-6-фтор-4-оксо-1,4-дигідро-1,8(3) Синтез сполуки (І) нафтиридин-3-карбонової кислоти. Сполуку (І) (0,72г, вихід 16,8%) було виготовМетансульфонат (R,S)-7-(3-амінометил-4-синлено у відповідності з процесом, описаним у Приметоксіімінопіролідин-1-іл)-1-циклопропіл-6-фторкладі 1 (3), за винятком того, що реакцію гідруван4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбонової ня проводили під тиском, зниженим від 500 кислоти (27,5г, чистота 91%, 51,4 ммоль) переміфунт./кв.дюйм до 200 фунт./кв.дюйм. шали в суміші ізопропанолу (150мл) з водою Приклад 5 (75мл) і після цього гріли (52°С) до утворення світ(1) Синтез сполуки (III) лого розчину. Розчин охолодили до 34°С, i до ньоСполука (III) була одержана у відповідності з го додали як зародковий кристал полуторний гідпроцесом, описаним у Прикладі 1(1). рат метансульфонату (R,S)-7-(3-амінометил-4-син(2) Синтез сполуки (І) метоксіімінопіролідин-1-іл)-1-циклопропіл-6-фторДо 100мл реактора високого тиску додали 4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбонової сполуку (III) (5г), метанол (40мл) і воду (10мл). До кислоти. Утворену суспензію залишили охолоджуутвореного розчину додали 10% Pd/C (0,18г) і меватися протягом 1год. до 25°С і потім перемішуватансульфокислоту (2,2мл). Суміш перемішали при ли протягом 18 годин. Далі суспензію охолодили температурі 30°С під тиском водню 100 до 0-4°С, перемішали протягом 2год. і відфільтруфунт./кв.дюйм (манометричний) протягом 1 годивали. Фільтрат промили ізопропанолом (30мл). ни. Каталізатор відфільтрували, i фільтрат конценПродукт просушили відсмоктуванням протягом трували повністю під зниженим тиском. Залишок 2год., а потім у вакуумі при 50°С. Висушений про 17 82504 18 заявником, і результати HPLC-аналізу домішок дукт зволожили вологим азотом, отримавши занаведені нижче в Табл. 1. значений у заголовку полуторний гідрат (22,9г, 92%). Дані ідентифікації продукту були такі самі, що мав автентичний зразок. Експеримент 1 Для визначення того, чи можна виготовлену згідно з даним винаходом сполуку (І) використовувати як матеріал для антибіотиків, сполуку (І), одержану в Прикладі 1, піддали HPLCхроматографічному аналізу в таких умовах: Проведений аналіз не показав наявності в Колонка: Shodex ODP-50 6Е (4,6´250мм, продуктах сполук (1), (2), (3), (4) і т.д., що утворю5мкм, Asahipak) валися в попередніх процесах при виготовленні Розчинник: AN/H2O (включаючи 5мМ 1сполуки (І). гексансульфокислоти)TFА=5/95/0,1 Усі сполуки (І), одержані згідно з Прикладами Довжина 207нм 2-5, також задовольняли вимогам стандарту якосхвилі: ті. Витрата: 1 мл/хв. Промислова придатність Температура: 40°С Даним винаходом поліпшені деякі аспекти віВміст домішок та ізомерів був визначений за домих процесів одержання 4-амінометил-3відношенням площі піків PAR (Peak Area Ratio) алкоксіімінопіролідинметансульфонату, викорисзгідно з формулою: товуваного як проміжний продукт для виготовленPAR(%)=A/B´100 ня хінолінових антибіотиків. Загальна кількість де А є площа піку кожної домішки, а В - сума стадій процесу зменшена до 2-3, що дозволило площ піків усіх домішок за винятком піків, ідентивиключити такі операції, як фільтрація й екстрагуфікованих у холостому розчині (тобто в розчині, вання, а також уникнути необхідності використанщо не містив зразка). ня дорогого реагенту (ВОС)2О, як і інших дорогих Стандарт якості щодо вмісту домішок та ізоорганічних розчинників і реагентів. мерів у величинах PAR, прийнятий компанією Комп’ютерна верстка В. Мацело Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparing 4-aminomethyl-3-alkoxyiminopyrrolidine methanesulfonate and derivatives thereof (variants), intermediates
Автори англійськоюHwang Gyo-Hyun, Kim Yeong-Dae, Nam Hyun, Chang Jay-Hyok, Shin Hyun-Ik, Kim Young-Keun, Lee Kyung-Hee, Lee Jae-Sung, Noh Hyun-Kuk
Назва патенту російськоюСпособ получения 4-аминометил-3-алкоксииминопирролидин метансульфоната и его производных (варианты), а также промежуточные соединения
Автори російськоюХванг Гио-Хьюн, Ким Йеонг-Де, Нам Хьюн, Чанг Джей-Хиок, Шин Хьюн-Ик, Ким Янг-Кеун, Ли Кьюнг-Хи, Ли Дже-Сунг, Нох Хьюн-Кук
МПК / Мітки
МПК: A61K 31/435, C07D 207/22, C07D 207/46, C07D 401/04
Мітки: спосіб, одержання, проміжні, також, варіанти, сполуки, похідних, 4-амінометил-3-алкоксіімінопіролідин, метансульфонату
Код посилання
<a href="https://ua.patents.su/9-82504-sposib-oderzhannya-4-aminometil-3-alkoksiiminopirolidin-metansulfonatu-ta-jjogo-pokhidnikh-varianti-a-takozh-promizhni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 4-амінометил-3-алкоксіімінопіролідин метансульфонату та його похідних (варіанти), а також проміжні сполуки</a>
Попередній патент: Рідка композиція білка, що зв’язує фактор некрозу пухлин
Наступний патент: Гідроударний буровий снаряд
Випадковий патент: Барабанний апарат












