Наночастинки гетерокристалічного мінералу sio2 для застосування як лікарського засобу
Формула / Реферат
1. Наночастинки гетерокристалічного мінералу, вибрані з групи, що включає гетерокристалічні мінерали SiO2: кварцит, сфен, лейкоксен і рутильований кварц для застосування як лікарського засібу.
2. Наночастинки за п. 1 для застосування як лікарського засобу, де лікарський засіб додатково містить наночастинки щонайменше одного мінералу, вибраного з групи, що включає лопарит, перовскіт, ільменіт, ферит, анатаз, рутил, барит, аргірит, графіт, оксид кальцію, фосфоритмонооксиди, фосфоритдіоксиди і оксид срібла.
3. Наночастинки за будь-яким з попередніх пп. 1 або 2, у яких наночастинки включають молекулу ДНК.
4. Наночастинки за пп. 1-3, у яких наночастинки включають антиметаболічний протипухлинний засіб.
5. Композиція, що містить наночастинки, як визначено в будь-якому з попередніх пп. 1-3, і рідину, переважно воду або повітря.
6. Застосування наночастинок гетерокристалічного мінералу за будь-яким з попередніх пп. 1-4 для приготування лікарського засобу для лікування інфекційних захворювань, переважно бактеріальної або вірусної інфекції.
7. Застосування наночастинок гетерокристалічного мінералу за будь-яким з попередніх пп. 1-4 для приготування лікарського засобу для лікування раку.
8. Застосування наночастинок гетерокристалічного мінералу за пп. 1-4 для приготування лікарського засобу для загоєння ран.
9. Застосування наночастинок гетерокристалічного мінералу за пп. 1-4 для приготування лікарського засобу для лікування анемії.
10. Застосування наночастинок гетерокристалічного мінералу за пп. 1-4 для приготування лікарського засобу для детоксикації суб'єкта.
Текст
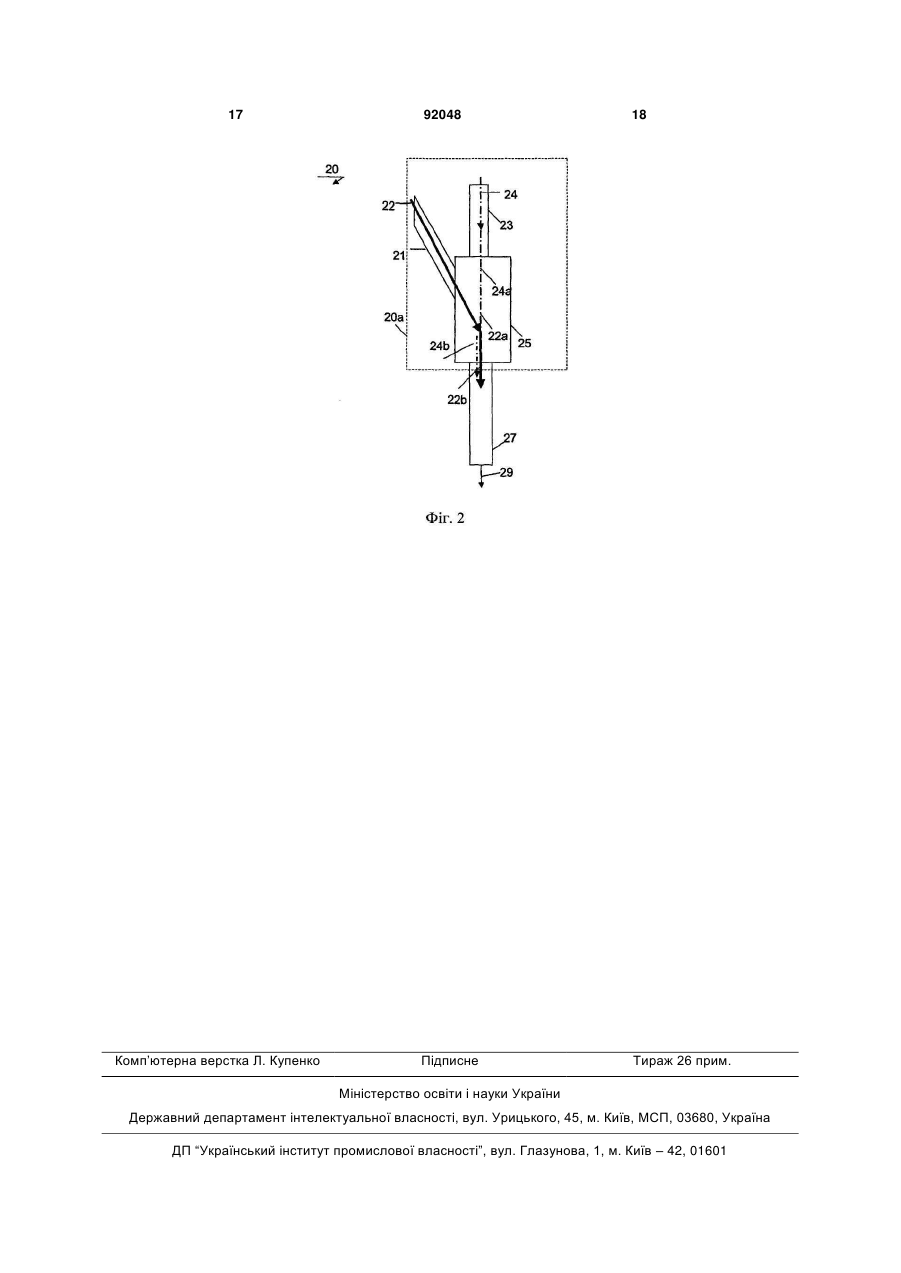
1. Наночастинки гетерокристалічного мінералу, вибрані з групи, що включає гетерокристалічні мінерали SiO2: кварцит, сфен, лейкоксен і рутильований кварц для застосування як лікарського засобу. 2. Наночастинки за п. 1 для застосування як лікарського засобу, де лікарський засіб додатково містить наночастинки щонайменше одного мінералу, вибраного з групи, що включає лопарит, перовскіт, ільменіт, ферит, анатаз, рутил, барит, аргірит, C2 2 UA 1 3 Недолік відомої субстанції полягає у тому, що її хімічна активність досить сильно залежить від ступеню кислотності тканини, яка повинна штучно підтримуватися на деякому рівні за допомогою, наприклад, застосування гіпо- або гіпертермії. Метою винаходу є представлення субстанції для застосування як лікарський засіб, який проявляє власну високу хімічну і біологічну активність. З цією метою, відповідно до винаходу, наночастинки гетерокристалічного мінералу надаються для застосування як лікарський засіб. У визначеннях за даним винаходом, наночастинки, зокрема, стосуються розмірів 0,5-200нм, більш переважно розмірів 0,5-100нм, ще більш переважно розмірів 0,5-50нм. Наночастинки можуть мати сферичні і/або стрижнеподібні форми, при вимірюванні їх розмірів за допомогою загальновідомих атомно-силового мікроскопа (AFM) або сканувальної тунельної мікроскопії (STM). Потрібно зазначити, що наночастинки можуть включати різноманітні суміші наночастинок зі змінними розмірами, завдяки чому відносна процентна частка наночастинок з конкретними розмірами також може варіювати. Поняття «розмір» стосується всіх розмірів наночастинок. Під поняттям «гетерокристалічний мінерал» потрібно розуміти по суті хімічно однорідну субстанцію, що утворилася у кристалі з відмінними решітками, які відрізняються в плані їх типів і структур, що утворюють поліморфний матеріал, який може бути визначений загальновідомим методом диференціальної сканувальної калориметрії (DSC). Наночастинки відповідно до винаходу можуть бути, зокрема, застосовані в одній або більше з наведених далі галузей: лікування інфекційних захворювань, особливо бактеріальної і/або вірусної інфекції; лікування раку; загоєння ран; лікування анемії; детоксифікація. У технології вважається, що наночастинки мають розміри, порівнянні з розмірами молекули глюкози, і тим самим вони є у тисячі разів дрібнішими, ніж людська клітина середньої величини. Тому наночастинки можуть брати участь у хімічних реакціях і біологічних процесах шляхом, порівнянним з поведінкою молекул, причому їх властивості залежать від властивостей матеріалу, з якого вони зроблені. Варіант виконання мінералу (графіту), диспергованого до наночастинок, відомий з російського патенту RU 1263840. Відомий матеріал застосовується як фільтр для очищення води. Технічна галузь винаходу базується на розумінні, що наночастинки відповідають вимогам, які висуваються відносно їх медичного вживання, завдяки тому факту, що їх висока хімічна активність властива їм початково, і по суті ніяких додаткових заходів не потрібно вживати для підвищення їх специфічної хімічної або біологічної активності у реципієнта, будь то людина або тварина. Винахід базується на подальшому розумінні, що наночастинки володіють здатністю десорбувати у водному середовищі багато раніше поглинутих матеріалів, що особливо привабливо для медичних цілей. У цьому відношенні наночастинки кремнезему SiO2 представляють особливий інтерес. Також розглядаються наночастинки як такі, особливо ті, що 92048 4 включають біосумісну композицію, для застосування як лікарський засіб. Переважно для приготування наночастинок використовуються мінерали з гетерокристалічною структурою, особливо рутил (ТіО2; (Ті, Nb, Fe)O2), титаніт (CaO SiO2, TiO2), лопарит (Ті, Nb)2(Na, Ca, Се)2О6), перовскіт (СаТiO3), анатаз (ТіО2,(Ті, Nb, Fe)O2), ільменіт (Fel 10Ti90O3; FeTiO3; Fe+2TiO3; (Fe, Mg)(Ti, Fe)O3, Fe+2TiO3, (Fe, Mg)TiO3; Fe+2TiO3/Fe+2O TiO2)), лейкоксен (TiO2Fe2O3+nH2O/Cr, Al, Si, P, Nb, Zr, Tr, Та) ферит (Fe2O3, FeO2), кварцит (SiO2). Ці мінерали широко поширені у природі і можуть бути легко дисперговані до частинок з нанорозмірами. Тому при виборі цих мінералів для одержання наночастинок, призначених для використання як лікарський засіб, забезпечене ефективне і відносно недороге джерело корисних лікарських засобів. Під назвою «гетерокристалічний мінерал» потрібно розуміти по суті хімічно однорідну субстанцію, що утворилася у кристалі з відмінними решітками, які відрізняються у плані їх типів і структур, що утворюють поліморфний матеріал, який може бути визначений загальновідомим методом диференціальної сканувальноїкалориметрії (DSC). Переважні приклади гетерокристалічних мінералів включають рутил, титаніт, лопарит, перовскіт, анатаз, ільменіт, лейкоксен, ферит, кварцит, барит, аргірит, графіт, оксид кальцію, фосфоритмонооксиди, фосфоритдіоксиди і оксид срібла. Ферити належать до класу матеріалів, що включають діоксид заліза, більша частина якого є феромагнітною. Ферити можуть стосуватися як природного мінералу, так і хімічно одержаного матеріалу з використанням Fe2O3. Рутил являє собою природний мінерал, являючись головною титановою рудою як джерелом металу, який застосовується для високотехнологічних сплавів завдяки його низькій щільності, високій міцності і корозійній стійкості. Мікроскопічні включення рутилу можуть бути знайдені у кварці, турмаліні, рубіні, сапфірі. Кварц, що містить голчаті включення рутилу, також може бути вибраний як мінеральне джерело для одержання наночастинок. Цей камінь у процесі формування при високих температурах і тиску утворюється у стабільній у цих умовах формі n(SiO2)-n(TiO2), але при зниженні температури і зменшенні тиску ці два компоненти розділяються з утворенням кристалів рутилу, захоплених кристалами кварцу. Інші гетерокристалічні мінерали, застосовні як джерела наночастинок, особливо ті, які містять ТіО2, включають титаніт, лопарит, перовскіт, анатаз, ільменіт, лейкоксен. Кварцит являє собою природний мінерал, що складається майже повністю з кристалів кварцу, утворених з пісковику або з крем'янистого сланцю. Пісковики перетворюються у кварцит двома різними шляхами. Перший шлях реалізовується при низьких тиску і температурі, де циркулюючі рідини заповнюють проміжки між зернами піску, цементуючи їх кремнеземом. Коли ця гірська порода руйнується, тріщини проходять безпосередньо по вихідних зернах, але не повз них. Цей тип кварциту, ортокварцит, власне кажучи, не є метаморфною породою, оскільки оригінальні мінеральні зерна залишаються такими як були, і як і раніше очевид 5 ні площини нашарування та інші осадові структури. При високих тисках і температурах в умовах глибокого залягання мінеральні зерна піддаються перекристалізації, і всі сліди початкових відкладень стираються. Результатом є справжня метаморфна порода, яку називають метакварцитом. Технічна галузь винаходу базується на розумінні, що, коли гетерокристалічний мінерал руйнується з утворенням наночастинок, одержані наночастинки включають фрагменти кристалічної решітки з ненасиченими зв'язками, тим самим створюючи частинки з підвищеною хімічною активністю, оскільки активні групи, здатні ініціювати ковалентні та іонні зв'язки, особливо формуються по місцях розриву міжмолекулярних взаємодій. Технічна галузь винаходу базується на подальшому розумінні того, що практично всі токсини, а також індуктори або медіатори патологічних процесів в організмі належать до агресивних хімічних сполук, що мають підвищену реакційну здатність для участі у хімічних реакціях різноманітних типів. Енергетична нейтралізація вільних хімічних зв'язків таких токсичних матеріалів шляхом їх насичення за допомогою комплементарних наночастинок може припинити практично всі екзогенні і ендогенні інтоксикації. У випадку, коли наночастинки самі по собі не проявляють якої-небудь токсичної дії і можуть бути легко виведені з організму, такий клас матеріалів є особливо переважним для застосування як засобів знешкодження отруйних речовин. Тому наночастинки як такі можуть бути використані як лікарські засоби. Широкий клас мінералів, наприклад, рутилів, феритів, кварцитів і тому подібних, стосується матеріалів, придатних для застосування як лікарські засоби для знешкодження отруйних речовин, будучи роздробленим до наночастинок. Ці матеріали мають гетерокристалічну структуру, в якій фрагменти кристалічної решітки зв'язані за допомогою гідроксидного іону (ОН-). Переважно ці матеріали піддаються термічному розкладанню з метою формування наночастинок, при якому режим охолоджування чергується з режимом нагрівання. У ході фази охолоджування хімічні зв'язки гідроксидного іона піддаються кристалізації, тим самим руйнуючи кристалічну решітку. Поперемінний вплив режимів охолоджування/нагрівання може виглядати як внутрішні вибухи, що викликають скорочення розмірів матеріалу до нанометрів, тим самим формуючи наночастинки. Подальші подробиці способу термічного диспергування будуть обговорені з посиланням на Фіг.1. Поряд зі своєю детоксифікуючою дією, наночастинки рутилу, титаніту, лопариту, перовскіту, анатазу, ільменіту, лейкоксену, фериту, кварциту як додатковий ефект проявляють антибактеріальну і противірусну дію і придатні для застосування як лікарський засіб з антибактеріальною і противірусною дією. Вони застосовні або для системного введення, або для місцевого застосування. Переважно наночастинки можуть бути використані для цілей санітарії, гігієни, включаючи радіаційний захист і радіаційну гігієну. Антибактеріальна і противірусна дія наночастинок, сформованих з рутилу, титаніту, лопариту, перовскіту, анатазу, ільменіту, лейкоксену, фериту і кварциту, базується на їх 92048 6 здатності дезактивувати ненасичені хімічні зв'язки пептидів, глікозидів і тому подібних. Крім того, вони можуть бути застосовані як покриття або включення на хірургічних нитках, перев'язувальних матеріалах. Альтернативно, такі наночастинки можуть бути використані для покриттів при внутрішньотканинному протезуванні, наприклад, типу штучних серцевих клапанів, шунтів і т.д. Тому такі наночастинки самі по собі придатні для вживання як антибактеріальний і противірусний матеріал. Переважним є застосування мінералів, що включають діоксиди металів, типу рутилу, титаніту, лопариту, перовскіту, анатазу, ільменіту, лейкоксену і феритів, як джерела наночастинок, оскільки одержані наночастинки можуть бути використані як лікарський засіб для лікування раку завдяки їх додатковим фотосенсибілізуючим властивостям, що дозволяють генерувати активний кисень, особливо у синглетній формі, при опроміненні світлом. Технічна галузь винаходу базується на розумінні, що наночастинки діоксиду біологічно сумісного металу проявляють множину переважних ефектів, коли використовуються як фотосенсибілізатор. Наночастинки мають максимальну поверхню контакту, тим самим збільшуючи ефективність процесу активації, який являє собою по суті процес масообміну, що залежить від площі реагуючих поверхонь. Переважно одержують наночастинки з розмірами 0,5-200нм, більш переважно з розмірами 0,5-100нм, ще більш переважно з розмірами 0,5-50нм, оскільки вони порівнянні за розміром з молекулою глюкози, ще більше збільшуючи свою хімічну активність. Наночастинки можуть мати сферичні і/або стрижнеподібні форми, при вимірюванні їх розмірів за допомогою загальновідомих атомно-силового мікроскопа (AFM) або сканувальної тунельної мікроскопії (STM). Потрібно зазначити, що фотосенсибілізатор відповідно до винаходу може включати різноманітні суміші наночастинок зі змінними розмірами, завдяки чому відносна процентна частка наночастинок з конкретними розмірами також може варіювати. Поняття «розмір» стосується всіх розмірів наночастинок. Наночастинки металевого каталізатора мають подвійну дію, по-перше, завдяки вихідним властивостям наночастинок, як вказано вище, і, по-друге, завдяки властивостям фотосенсибілізатора, оскільки вони каталізують утворення активного кисню у відповідь на опромінення світлом, переважно у широкому діапазоні довжин хвиль, від ультрафіолетової до інфрачервоної області. Крім того, приготування фотосенсибілізатора у формі наночастинок має додатковий переважний ефект у тому, що матеріал є прозорим у широкому діапазоні довжин хвиль, тим самим підвищуючи ефективність відгуку матеріалу на опромінення світлом. Потрібно далі зазначити, що фотосенсибілізатор, що включає наночастинки діоксиду титану і діоксиду заліза, являючись по суті прозорим середовищем, може бути активований видимим світлом. Тому такі матеріали виключно придатні для застосування у формі порошку, що наноситься локально на поверхневі об'єкти. Наприклад, придатна кількість порошку з наночастинок, що включає діоксид титану або діоксид заліза, може бути 7 нанесена на область мішені і може бути піддана впливу природного світла, або, альтернативно, вона може бути піддана впливу іншого джерела активації, наприклад, від лазера, перед відповідною клінічною або косметичною процедурою або під час такої. Потрібно зазначити, що для поверхневого впливу активний кисень формується з атмосферного кисню, і дія фотосенсибілізатора для каталізування утворення активного кисню повинна бути ефективною. Активний кисень потрібно розуміти як кисень з підвищеною реакційною здатністю, головним чином (ε, Δ) синглетний кисень. Альтернативно, є можливість одержувати придатну концентровану суспензію з наночастинок, приготованих з рутилу, титаніту, лопариту, перовскіту, анатазу, ільменіту, лейкоксену або фериту, яка дозволяє вводити фотосенсибілізатор реципієнту системно, внутрішньопорожнинним або ін'єкційним шляхом. Переважні варіанти виконання рідини, придатної для застосування відповідно до винаходу, включають воду, розчин або колоїд, рідину, що містить білок, наприклад, альбумін, або фізіологічний сольовий розчин. Переважно одержана суспензія готується з використанням співвідношення щонайменше 0,5мг наночастинок, особливо діоксиду титану або діоксиду заліза, на 1 літр рідини. Потрібно зазначити, що мінерали типу рутилу, титаніту, лопариту, перовскіту, анатазу, ільменіту, лейкоксену або фериту загалом включають масову частку 10%-30% відповідних діоксидів металів. Тому для цих мінералів загальна маса приготованих наночастинок повинна вибиратися на рівні щонайменше 5 мг на 1 літр рідини. Потрібно далі зазначити, що, коли наночастинки використовуються як фотосенсибілізатор, вони можуть діяти як каталізатори утворення активних форм кисню, тим самим не беручи участь у хімічних реакціях. Тому загальна кількість фотосенсибілізатора не є критично важливим параметром для продукування активного кисню, за умови, що готується мінімальна кількість 0,5мг ТіО2 або FeO2 або їх суміші на літр рідини. Оскільки поверхневої взаємодії рідини з оточуючим киснем може виявитися недостатньо для досягнення необхідного рівня оксигенування суспензії, кисень може бути введений в одержану суспензію з придатного балона за допомогою насоса. Переважно парціальний тиск кисню всередині суспензії складає близько 40-100мм ртутного стовпчика, більш переважно близько 70мм ртутного стовпчика. Переважно фотосенсибілізатор активується дією опромінення з використанням світла лазера з довжиною хвилі у діапазоні 0,8-0,9 мікрометра, яка відповідає максимальному ступеню поглинання киснем і області оптичної прозорості тканин для світла. Ще більш переважно фотосенсибілізатор активується у пристрої, пристосованому для опромінення суспензії фотосенсибілізатора джерелом світла, переважно у проточному режимі для зазначеної суспензії. При опроміненні потоку суспензії фотосенсибілізатора генерування активного кисню забезпечується по суті у всьому об'ємі суспензії, що містить фотосенсибілізатор. Ця стадія переважно проводиться поза організмом (ex vivo), наприклад, як стадія приготування для фотодинамічного 92048 8 лікування відповідного розладу здоров'я. Переважно інтенсивність застосовуваного світла складає щонайменше 1Дж/мл суспензії, що включає фотосенсибілізатор. Ще більш переважно інтенсивність світла вибирається у діапазоні 2-3Дж/мл суспензії фотосенсибілізатора. Далі переважно, що швидкість течії суспензії, що містить фотосенсибілізатор, вибирається у діапазоні 1-2мл/с. Переважно для пристрою використовується Y-подібний корпус, в якому перше плече Y-подібного корпусу використовується для подачі потоку суспензії фотосенсибілізатора у головний канал пристрою, і друге плече Y-подібного корпусу використовується для надходження світла у головний канал Yподібного корпусу, переважно, за допомогою належно вибраного і приєднаного оптоволоконного кабелю. Переважно швидкість течії суспензії фотосенсибілізатора вибирається відповідно до інтенсивності світла, що подається по оптоволоконному кабелю. Загалом, переважне співвідношення між швидкістю течії та інтенсивністю світла варіює у діапазоні 2-5 ват світлової енергії на 1мл суспензії. Ще більш переважно головний канал Yподібного корпусу приєднується до нагромаджувальної камери для зберігання активованого фотосенсибілізатора перед його вживанням. Переважно камера готується у стерильному виконанні, так що необхідний об'єм активованого фотосенсибілізатора може бути витягнутий, наприклад, ін'єкційною голкою у процесі медичної і косметичної процедури. Переважний варіант виконання пристрою буде описаний більш детально з посиланням на Фіг.2. Альтернативно, пристрій може бути скомпонований для переведення активованого фотосенсибілізатора у живильний блок, який використовується для введення активованого фотосенсибілізатора у цільову область. У цьому випадку потік фотосенсибілізатора переважно служить як оптичний провідник для світлових хвиль, тим самим далі фокусуючи введення активного кисню у цільову область. Ще більш переважно суспензія піддається озонуванню, для такої обробки може бути використана загальновідома апаратура для озонування рідин. Перевага цієї стадії полягає у створенні збільшеної концентрації кисню у середовищі, що включає фотосенсибілізатор, і у продукуванні різноманітних типів активного кисню (ε, Δ) у реакції з активованим фотосенсибілізатором. Переважно рівень озонування підтримується у межах діапазону 5-10мг озону на 1 літр суспензії, що включає фотосенсибілізатор. Процес озонування є переважним, оскільки він забезпечує різноманітність форм активного кисню у суспензії, таких як синглетний кисень і озон, які взаємно доповнюють один одного у своїй хімічній і біологічній активності. При взаємодії з іншими елементами навколишнього середовища активний кисень і його вторинні похідні стають джерелом пошкодження багатьох біологічних об'єктів, які забезпечують підведення поживних речовин у клітини. У результаті у біологічній тканині, підданій впливу сполук відповідно до винаходу, ініціюються процеси фіброзу, а також процеси кров'яної і лімфатичної блокади, діючи як механічний бар'єр для циркуляції крові і 9 лімфи, тим самим ізолюючи, наприклад, пухлину від джерел живлення. У результаті метаболічна активність та інвазивні властивості пухлинних клітин значно знижуються, і пухлина не може проявляти свою інвазивну і метастатичну активність. Альтернативний варіант здійснення стосується мінералу, що включає ферит, диспергованого до наночастинок і використовуваного як лікарський засіб для лікування анемій. Нарівні з перевагами наночастинок у плані їх специфічної хімічної активності, присутність заліза використовується для лікування анемій різноманітного генезису, особливо залізодефіцитного походження. Ця технічна галузь базується на розумінні, що доставка заліза всередину клітин позитивно впливає на механізми синтезу білків, в якому залізовмісні ферменти грають активну роль. Завдяки тому факту, що наночастинки є у тисячі разів меншими за розміром, ніж середня величина клітини живого організму, вони можуть легко мігрувати всередину клітини і брати участь у хімічних реакціях подібним до молекул чином. Переважно для ін'єкцій загальна доза FeO2 вибирається на рівні близько 10мг, причому для зовнішнього вживання обмежень дозування немає. У подальшому альтернативному варіанті здійснення мінерал, диспергований до наночастинок для застосування як лікарський засіб, включає кварцит. Кварцити характеризуються наявністю оксиду кремнію SiO2, який у формі наночастинок має корисний ефект ініціювання росту сполучної тканини. Цей корисний ефект, що загалом проявляється у кров'яній і лімфатичній блокаді, може бути використаний для локалізації ракової тканини, тим самим усуваючи будь-яке джерело живлення клітин злоякісного новоутворення. Для введення наночастинок SiO2 з використанням ін'єкції переважна доза SiO2 складає близько 10мг, для зовнішнього застосування без обмеження. Далі потрібно зазначити, що наночастинки SiO2 можуть бути використані як транспортні засоби, являючись хімічно зв'язаними з придатною молекулою. Наприклад, наночастинки SiO2 можуть бути хімічно зв'язані з оксидами або діоксидами срібла, які можуть доповнювати дію SiO2 завдяки своїм фотосенсибілізуючим властивостям. Альтернативно, зв'язаний з SiO2 діоксид срібла AgO2 може бути доданий до наночастинок, що включають діоксид титану або діоксид заліза, тим самим взаємно доповнюючи їх дію як металевих каталізаторів для продукування активних форм кисню. У ще одному варіанті здійснення наночастинки гетерокристалічного мінералу, що включають молекулу ДНК, застосовуються як лікарський засіб. Переважно наночастинки зв'язуються з молекулою ДНК головним чином електростатичними силами або ковалентними зв'язками. Потрібно зазначити, що передбачений ряд варіантів виконання такого зв'язування, а саме, по-перше, коли окрема наночастинка зв'язується з окремою молекулою ДНК, по-друге, коли декілька наночастинок зв'язуються з окремою молекулою ДНК, і, по-третє, коли декілька молекул ДНК зв'язуються з наночастинкою. Це технічне завдання може бути виконане введенням, наприклад, натрієвої солі ДНК-молекули, відомої на ринку під назвою "Derinat", у суспензію, 92048 10 що включає зазначені наночастинки, переважно з розрахунку на співвідношення 1 частина 1,5%-ного розчину натрієвої солі на 1 частину наночастинок, що включають щонайменше дозу 0,5мг діоксиду титану, діоксиду заліза або діоксиду кремнію. Коли наночастинки, одержані з SiO2, зв'язуються з молекулою ДНК і додатково з придатним антиметаболітом, забезпечується технічний ефект поліпшення відкладення фіброгенного матеріалу (SiO2) всередині клітини в одному випадку, і подальшого пошкодження клітини дією антиметаболіту, в іншому випадку. Коли як молекула ДНК, так і антиметаболіт зв'язуються з наночастинками, може виникати ефект синергізму двох дій, викладених вище, ще більше поліпшуючи терапевтичний вплив наночастинок на реципієнта. Цей варіант здійснення проявляє технічний ефект ще більшого підвищення селективності біохімічної дії зазначених наночастинок завдяки тому факту, що вони транспортуються всередину клітини за допомогою молекули ДНК. Ще більш переважно наночастинки, переважно щонайменше з рутилу, титаніту, лопариту, перовскіту, анатазу, ільменіту, лейкоксену, фериту, кварциту, бариту, аргіриту, графіту, оксиду кальцію, фосфоритмонооксидів, фосфоритдіоксидів і срібла, включають антиметаболіт. Зокрема, такі засоби включають протипухлинні препарати з антиметаболічною дією, цитостатичні засоби з антиметаболічною дією і протиракові засоби з антиметаболічною дією. Антиметаболіти загалом відомі у технології. Дана технічна галузь базується на розумінні, що сполука нанометричного масштабу може бути використана як транспортний засіб для перенесення інших лікарських препаратів всередину клітини. Зазначене зв'язування може бути досягнуте простим додаванням антиметаболіту до наночастинок. Зв'язування антиметаболіту із зазначеними наночастинками створює лікарський засіб з кумулятивною цитотоксичною дією на клітину, тим самим ще більше підвищуючи ефективність приготованої таким чином субстанції. Наприклад, антиметаболіт може включати придатний хіміотерапевтичний матеріал, загальновідомий у технології. Потрібно зазначити, що, хоча конкретні технічні ефекти пояснюються з посиланням на окремі варіанти виконання наночастинок, які формуються шляхом диспергування гетерокристалічного мінералу, розглядаються також різноманітні модифікації варіантів здійснення, зокрема, застосування суміші наведених мінералів як джерела наночастинок. Розглядаються також наночастинки для застосування як лікарський засіб, особливо наночастинки, що містять молекулу ДНК і/або антиметаболіт. Далі потрібно зазначити, що приготування наночастинок з наведених мінералів відкриває простий і економічний шлях до ефективного виробництва лікарських засобів, оскільки ці мінерали є у великій кількості у природі. Деякі ілюстрації розкритих наночастинок для застосування як лікарські засоби обговорюються з використанням прикладів. 11 Приклад 1: наночастинки з рутилу або фериту для застосування як лікарський засіб для лікування раку. Дана галузь застосування базується на фотосенсибілізуючій властивості діоксидів металів, яка сприяє генеруванню активних форм кисню при опроміненні світлом. Для ракової маси з поверхневою локалізацією активуючий фотосенсибілізатор у формі наночастинок наноситься поверхово і навколо маси, наприклад, з використанням придатної ін'єкційної голки. Об'єм суспензії, що включає активовані наночастинки фотосенсибілізатора, повинен бути щонайменше у декілька разів більшим, ніж об'єм маси. Переважно він є у 5-10 разів більшим, ніж об'єм маси. Потрібно зазначити, що є можливість оснастити ін'єкційну голку Y-подібним пристроєм, одне плече якого являє собою канал подачі суспензії, що включає фотосенсибілізатор, та інше плече являє собою оптичний канал, що підводить світло. Переважно інтенсивність світла складає не менш ніж 1 Вт/см2. Ще більш переважно світло підводиться у напрямі течії суспензії і додатково впливає на тканину, призначену для лікування. Коли як джерело світла вибирають лазер і забезпечують можливість його впливу всередині тканини, яка піддається фотодинамічному лікуванню, це надає додатковий ефект, що викликає локальну гіпертермію, ще більше посилюючи терапевтичну дію процедури. Швидкість течії рідини переважно складає не менш ніж 1мл на 1 Джоуль світлової енергії. Для зменшення больових відчуттів у реципієнта більш переважно вводити у суспензію придатний анестетик перед проведенням процедури. Переважно використовують 0,2% лідокаїну і 10 мг/л озону. Випадок 1. Пацієнт В., вік 18 років (карта хворого №212/01) у 2001 році був підданий лікуванню рецидивної м'якотканинної саркоми у правій половині грудної клітки. Гістологічно підтверджений рецидив з'явився через три місяці після резекції пухлини. Під час обстеження було виявлене сферичне потовщення приблизно 4см у діаметрі в області післяопераційного рубця, причому зазначене потовщення було статичним, щільно пророслим у надкісницю передньої поверхні ІІ-llІ ребер. Віддалені метастази не були виявлені з використанням ультразвукових і рентгенівських обстежень, однак пахвові лімфатичні вузли були збільшені. Пацієнт одержав інтерстиціально 200мл суспензії, що містить 1мг наночастинок, приготованих термічним диспергуванням рутилу, опроміненої світлом лазера з довжиною хвилі 0,56 мікрометра та інтенсивністю 5 Вт протягом 6 і 8 хвилин. Процедура була повторена двічі з тижневим інтервалом. Температура тканини у ході лікування не підвищувалася більш ніж на 1,4 градуси Цельсія. Біопсія, проведена через три дні після другої процедури, показала, що пухлина належить до сарком. Через 1 рік подальшого спостереження росту пухлини не спостерігалося, і на місці рецидиву діаметром 4см знайдений наріст сполучної тканини розміром 1см. У ході подальшого спостереження обстеження не виявили ознак пухлини. Випадок 2. 92048 12 Для пухлин, що глибоко знаходяться, які не можуть бути локалізовані простим обстеженням, у наш час для виявлення просторового розташування цільової області, що включає пухлину і її розміри, застосовуються діагностичні засоби. Крім того, у даному варіанті здійснення належним чином орієнтована ін'єкційна голка може бути використана для введення активованого фотосенсибілізатора у пухлину і/або навколо неї. Пацієнт К., вік 64 роки (карта хворого №923) у листопаді 2000 року був госпіталізований в урологічну клініку з діагнозом дизурія. У процесі обстеження була виявлена аденокарцинома верхньої частини лівої частки передміхурової залози (4 і 4 за показником Глісона). Додатково до катетеризації сечового міхура, з 12.07.2001 року було проведене лікування введенням наночастинок, приготованих з рутилу. Обидві частки передміхурової залози одержали 250мл суспензії, що містить 1,5мг діоксиду титану у розчині діоксиду срібла, опроміненої світлом лазера з довжиною хвилі 0,84 мікрометра та інтенсивністю 16Вт/см2 протягом 8 хвилин. Температура тканини контролювалася і не підвищувалася більш ніж на 1,2 градуси Цельсія у процесі лікування. Симптоми дизурії були усунені, і діагностичний скринінг показав тільки сполучну тканину на місці вихідної пухлини. Цей стан був підтверджений у ході подальшого спостереження через три роки після лікування відповідно до винаходу. Біопсія (8 точок), проведена у вересні 2004 року, показала відсутність пухлинних клітин і підтвердила фіброз тканин залози. У січні 2005 року внаслідок наростаючої дизурії була проведена трансуретральна резекція. Деякі фрагменти тканин, видалених при хірургічній процедурі, виявили «острівці» пухлини, оточені тканиною, що стійко зажила. Ніяких подальших проявів неопластичного процесу не було виявлено. У квітні 2006 року концентрація простатичного антигену становила 2,1мг/мл. Випадок 3. Пацієнтка L., вік 59 років (карта хворої №176/32) була включена у групу пацієнтівдобровольців для одержання лікування за допомогою введення наночастинок, приготованих з мінералу відповідно до винаходу. У пацієнтки була діагностована карцинома дуктального типу у лівій молочній залозі на стадії Т3N2Мх. Радіотерапія, одержана пацієнткою, була безуспішною. У ході її обстеження перед лікуванням відповідно до винаходу була виявлена пухлинна маса значних розмірів (10см3), яка також утворила виразку площею 30см2. У процесі лікування пацієнтка одержала 10кратні інтрапаратуморальні ін'єкції з активованим фотосенсибілізатором, що включає 20% діоксиду титану, 30% оксиду кальцію і щонайменше 15% діоксиду кремнію. 5мг фотосенсибілізатора були застосовані для приготування суспензії об'ємом близько 1 літра з використанням стерильної води, до якої були додані 5мл 1,5%-ного Derinat і 5 мг антиметаболіту у формі доксорубіцину. Після інтратуморальних ін'єкцій та ін'єкцій навколо пухлини припухлі лімфатичні залози також одержали суспензію активованого фотосенсибілізатора. У процесі подальшого спостереження яких-небудь ознак ракових клітин у лікованому об'ємі виявлено 13 не було, що було підтверджено ґрунтовним гістологічним аналізом. Площа виразки була скорочена приблизно у 5 разів, і також не було помітно ніяких ознак ракового процесу. Порушення шкіри в області виразки було усунене за допомогою пластичної хірургії. Приклад 2: застосування наночастинок, приготованих з гетероструктурного матеріалу для використання як лікарський засіб для загоєння ран. Випадок 4. Пацієнтка 76 років (випадок №318/А) після того, як вона була пацієнткою декількох онкологічних клінік протягом періоду понад чотири роки у зв'язку з наявністю значної (18см ) ракової виразки у лівій частині її грудної клітки. Спроби застосування загальновживаних підходів для усунення порушення шкірного покриву були безуспішними. Тоді вона прийняла місячний курс лікування наночастинками, приготованими з використанням суміші фериту і кварциту, причому наночастинки були введені у вигляді сухого порошку. При нанесенні порошку на виразку вона була опромінена світлом галогенної лампи з інтенсивністю 3 Вт/см2 у дозі 1,3 кДж. Після лікування дефект шкіри зник, причому відбитки виразки показали утворення клітин сполучної тканини у фазах апоптозу. Потрібно зазначити, що хоча даний приклад показує кумулятивну дію наночастинок з фериту і кварциту, перший з них був застосований для лікування раку і другий був використаний як допоміжний терапевтичний засіб для стимулювання фіброзу, щоб усунути шкірний дефект. Потрібно розуміти, що клінічне застосування наночастинок, приготованих з кварциту для загоєння ран, тим самим також розглядається як таке. Випадок 5. Пацієнт чоловічої статі 60 років, після складної операції з приводу раку підшлункової залози, що проявився у фістулі тонкої кишки, закрити яку загальновживаним шляхом не вдалося. Через один місяць шар сухого порошку, приготованого з 60% SiO2 і 70% ТіО2, був нанесений на область фістули і передню ділянку тонкого кишечнику під час перев'язки. Після цього протягом 5 хвилин область була опромінена за допомогою приладу для світлотерапії «Біотрон» (20мВт/дм2). Через тиждень рана, що гноїться, стала підсихати і скорочуватися. Протягом другого тижня фістула була закрита постійною перев'язкою. Приклад 3: наночастинки з гетероструктурного мінералу (фериту) як лікарський засіб для лікування анемії. Випадок 6. Пацієнт чоловічої статі, вік 31 рік (випадок №1272/А) у 2003 році був прооперований з приводу меланоми на лівій половині його спини, пройшов курс додаткової хіміотерапії і радіотерапії, і тому проявилися симптоми гострої анемії (рівень гемоглобіну 6,8г/літр). Він був підданий лікуванню наночастинками, приготованими з фериту, лікування проводилося на фоні рани, що не заживає, на місці оперативного втручання. Лікування включало 10 сеансів введення 10мг наночастинок (22% за масою діоксиду заліза), приготованих у загальному об'ємі 150мл водної суспензії. Під час ін'єкції 92048 14 приготованої таким чином суспензії вона була опромінена світлом лазера з довжиною хвилі 0,88 мікрометра при загальній дозі 1,4кДж. Вже після третьої ін'єкції концентрація гемоглобіну у крові підвищилася на 50% до рівня 9г/л, і був показаний процес грануляції рани, що веде до повного загоєння рани. Ці та інші аспекти винаходу будуть обговорені більш детально з посиланнями на фігури. Фігура 1 схематично показує варіант виконання установки для приготування наночастинок з використанням способу термічного диспергування. Фігура 2 схематично показує варіант виконання Y-подібного корпусу пристрою для активації наночастинок, що застосовуються як фотосенсибілізатор. Фігура 1 представляє схематичну ілюстрацію варіанту виконання установки 10 для приготування наночастинок з використанням способу термічного диспергування. Для цієї мети шар 12 з гетерокристалічного мінералу розмішується на придатному носії 12а для забезпечення термічного контакту з придатним джерелом 14а, 14b, 14c, 14d. Переважно товщина шару 12 у z-напрямі, схематично показаному на Фіг.1, складає величину близько декількох міліметрів, ще більш переважно вона вибирається за величиною близько одного міліметра, відповідно до розміру кристалічної решітки рутилів, титанітів, лопаритів, анатазів, ільменітів, лейкоксенів, феритів, кварцитів. Розмір шару в хнапрямі, схематично показаному на Фіг.1, може бути більшим одного метру. Переважно для носія 12а вибирається керамічний матеріал, який може проводити енергію у діапазоні 9-15Вт/см2. Джерела 14а, 14b, 14c, 14d включають термоелементи, електрично з'єднані з джерелом енергопостачання 16. Переважно джерело енергопостачання керується процесором 18, який переважно працює за придатною комп'ютерною програмою 18а. Ще більш переважно блок енергопостачання 16 і контрольний блок 18 виконуються як інтегральний пристрій 17. Відповідно до способу згідно з винаходом, джерело енергопостачання виробляє пульсуючий постійний струм з амплітудою щонайменше 10 А/мм2, який подається на термоелементи 14а, 14b, 14с, 14d. Термоелемент, призначений для роботи відповідно до загальновідомого термоелектричного ефекту Пельтьє-Зеєбека, може бути використаний у способі відповідно до винаходу, причому при підведенні струму відповідної полярності паяні з'єднання термоелемента можуть діяти як охолоджувачі або як нагрівачі. Потрібно зазначити, що розглядається застосування одиночного термоелемента або декількох термоелементів. У варіанті виконання способу відповідно до винаходу імпульс струму прямої полярності подається протягом, наприклад, періоду від 10-4 до 1 секунди, внаслідок чого температура поверхні термоелемента, повернутої до шару 12, вмить знижується щонайменше до -50 градусів Цельсія, переважно до -73 градусів Цельсія. Це викликає значне охолоджування матеріалу шару 12, завдяки чому гідроксильні групи молекул води кристалізуються, тим самим ініціюючи появу крихітних ударних хвиль у матеріалі шару 12. Після цього 15 імпульс струму прямої полярності змінюється на імпульс струму зворотної полярності, тим самим викликаючи миттєве підвищення температури поверхні термоелемента, повернутої до шару 12, щонайменше до +80 градусів Цельсія, переважно до +95 градусів Цельсія, розплавляючи при цьому водний компонент у кристалі і розриваючи структуру кристалічної решітки внаслідок термічних коливань у решітці. Після цього полярність блоку енергопостачання 16 знову змінюється, обумовлюючи кристалізацію водного компонента. Переважно це перемикання повторюється щонайменше декілька разів протягом періоду, наприклад, від 1 секунди до 1 хвилини. Після повторення режимів охолоджування і нагрівання шар 12 руйнується на наночастинки. Кількість повторень може бути вибрана відповідно до бажаного розміру наночастинок. Загалом, відповідно до способу згідно з винаходом можуть бути приготовані наночастинки з розмірами 0,5-200нм. Можливо також одержувати суміш наночастинок, які мають різноманітні розміри у діапазоні 0,5-200нм. Далі можливо варіювати відносні процентні частки наночастинок з конкретними розмірами у суміші. Фігура 2 схематично представляє варіант виконання 20 пристрою для активації потоку фотосенсибілізатора. Блок змішування 20а включає Yподібний корпус, з одним плечем 21, призначеним для прийняття переважно потоку суспензії фотосенсибілізатора 21, та іншим плечем 23, призначеним для підведення світлових хвиль 24 від джерела світла (не показано), переважно з використанням придатного оптоволоконного кабелю. Y-подібний корпус блоку 20а скомпонований так, щоб рідкий фотосенсибілізатор 22а повністю опромінювався світловим пучком 24а. Це компонування забезпечує повну активацію фотосенсибі 92048 16 лізатора у всьому об'ємі, що опромінюється. Частина 25 Y-подібного корпусу може бути виготовлена зі значними розмірами, щоб вмістити весь об'єм фотосенсибілізатора, призначеного для вживання під час лікувальної процедури. Показано, що достатнім для формування частини 25 є об'єм 10500мл. Переважно об'єм частини 25 вибирається таким, що дорівнює приблизно 50мл. Коли фотосенсибілізатор активується і зберігається у відсіку 25, блок подачі 27 може бути приєднаний до його віддаленої частини. Блок подачі може включати катетер, ін'єкційну голку або розпилювальний пристрій, що застосовується для введення фотосенсибілізатора 29 у цільову область реципієнта. У випадку, коли застосовуються ін'єкційна голка або катетер, може бути переважним не переривати потік 22b активованого фотосенсибілізатора, дозволяючи йому служити провідником оптичного випромінювання у тканину реципієнта. На цьому шляху введення активованого фотосенсибілізатора виконується по суті у режимі реального часу одночасно з активацією, причому рідкий фотосенсибілізатор діє як оптичний провідник світлового пучка у тканину. Ця процедура має перевагу клінічного ефекту, оскільки фотосенсибілізатор нанометричного розміру вмить вводить дозу активованого кисню і оптичну дозу на мікрорівні. У випадку, коли використовується світло лазера, оптична доза викликає додаткове пошкодження тканини через локальне вирізання внаслідок гіпертермії, що викликавикликається лазером. Переважно застосовується світло лазера з довжиною хвилі 0,8-0,9 мікрометра, яка відповідає максимальному ступеню поглинання киснем і області оптичної прозорості тканини. 17 Комп’ютерна верстка Л. Купенко 92048 18 Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNanoparticles of a heterocrystal mineral for use as a medicament
Автори англійськоюKurkaiev Abdula
Назва патенту російськоюНаночастички гетерокристаллического минерала sio2 для применения в качестве лекарственного средства
Автори російськоюКуркайев Абдула
МПК / Мітки
МПК: A61P 31/00, A61K 33/00, A61K 9/14, A61P 17/02, A61P 39/00, A61P 35/00, A61P 7/06
Мітки: гетерокристалічного, застосування, лікарського, засобу, мінералу, наночастинки
Код посилання
<a href="https://ua.patents.su/9-92048-nanochastinki-geterokristalichnogo-mineralu-sio2-dlya-zastosuvannya-yak-likarskogo-zasobu.html" target="_blank" rel="follow" title="База патентів України">Наночастинки гетерокристалічного мінералу sio2 для застосування як лікарського засобу</a>
Попередній патент: Карбоніламінопіролпіразоли – потужні інгібітори кінази
Наступний патент: Спосіб безперервного розливання тонких металевих штаб і установка безперервного розливання
Випадковий патент: Спосіб лікування хворих на гіпертонічну хворобу в поєднанні з хронічним обструктивним захворюванням легень