Спосіб активації фотосенсибілізатора
Формула / Реферат
1. Спосіб активації фотосенсибілізатора, що включає:
- вибір наночастинок фотосенсибілізатора-каталізатора, який здатний каталізувати індукцію активних форм кисню і
- опромінення наночастинок світловим випромінюванням, де наночастинки являють собою наночастинки гетерокристалічного мінералу.
2. Спосіб за п. 1, де активацію здійснюють ех vivo.
3. Спосіб за п. 1 або 2, де спосіб включає:
- додавання фотосенсибілізатора до рідини з одержанням його суспензії;
- додавання кисню до суспензії, що отримується таким чином.
4. Спосіб за п. 3, де стадію опромінення фотосенсибілізатора проводять у пристрої, що призначений для опромінення суспензії фотосенсибілізатора вказаним cвiтловим випромінюванням.
5. Спосіб за п. 3 або 4, що включає стадію озонування суспензії.
6. Спосіб за п. 5, де наночастинки складаються з гетерокристалічного мінералу, вибраного з кварцу, рутилу, сфену, лопариту, перовскіту, анатазу, ільменіту, лейкоксену, фериту, бариту, аргіриту, графіту, оксиду кальцію, фосфоритмонооксидів і фосфоритдіоксидів.
7. Спосіб за будь-яким з попередніх пунктів, де наночастинки містять молекулу ДНК.
8. Спосіб за будь-яким з попередніх пунктів, де наночастинки містять протиметаболічний, протипухлинний засіб.
9. Спосіб за будь-яким з попередніх пунктів, де світлове випромінювання знаходиться в інфрачервоному діапазоні.
10. Спосіб за будь-яким з попередніх пунктів, де світлове випромінювання є лазерним випромінюванням з довжиною хвилі в діапазоні 0,8-0,9 мікрометра.
11. Спосіб лікування захворювання у реципієнта, що включає введення реципієнту активованого фотосенсибілізатора за п. 1 у вигляді суспензії наночастинок гетерокристалічного мінералу.
12. Спосіб за п. 11, де фотосенсибілізатор був активований способом за будь-яким з попередніх пунктів.
13. Спосіб за будь-яким з пп. 11-12, де фотосенсибілізатор вводять в ділянку-мішень у реципієнта з використанням пристрою для нанесення, де спосіб додатково включає:
- визначення просторового розташування ділянки-мішені;
- установлення пристрою для нанесення відповідно до певного просторового розташування.
14. Фотосенсибілізатор, одержаний згідно зі способом за будь-яким з пп. 1-10, для медичного застосування.
15. Застосування фотосенсибілізатора, одержаного згідно зі способом за будь-яким з пп. 1-10 для одержання лікарського засобу для лікування раку, зокрема, раку, вибраного з групи, що складається з карциноми, аденокарциноми, карциноми протокового типу і/або засобу для загоювання ран.
Текст
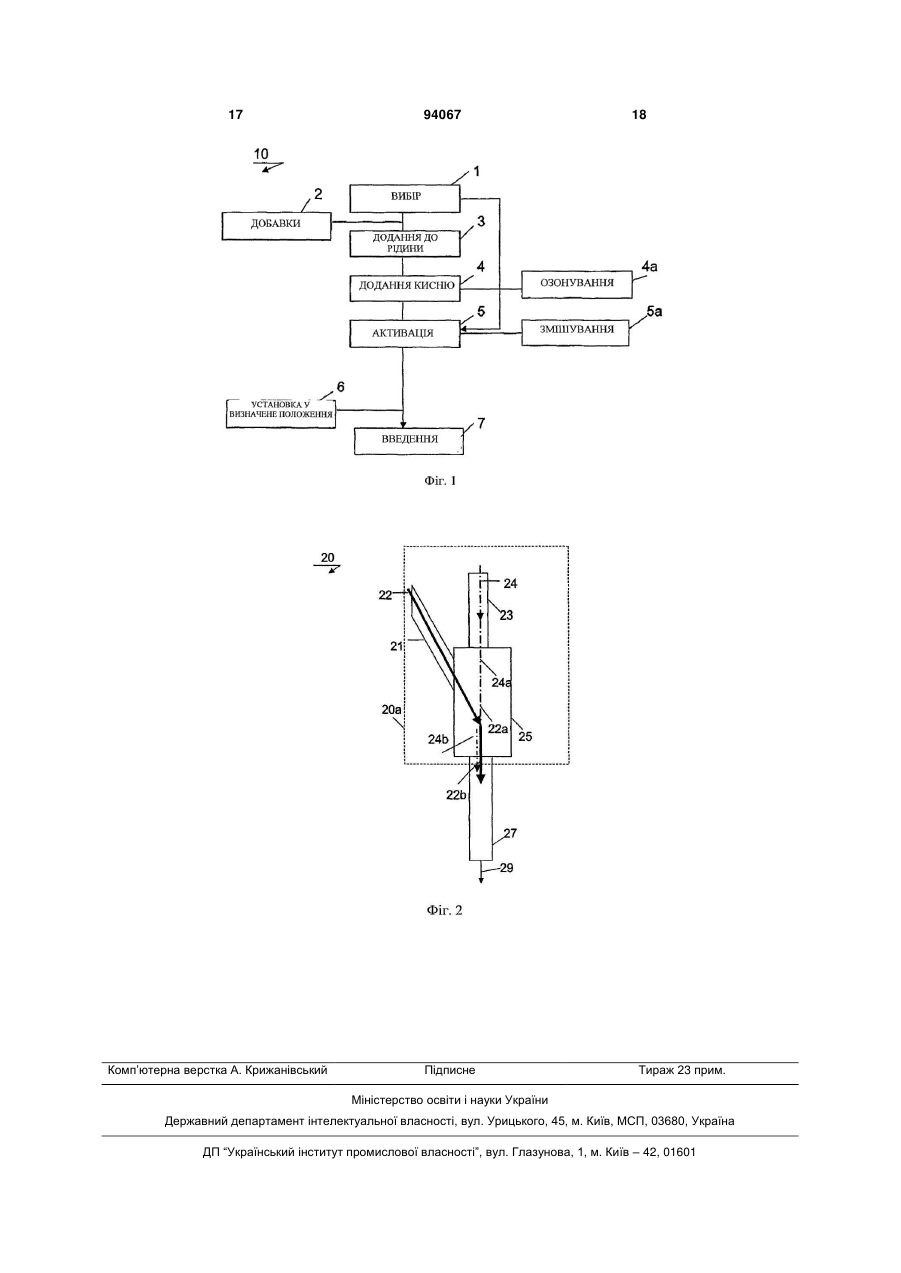
1. Спосіб активації фотосенсибілізатора, що включає: вибір наночастинок фотосенсибілізаторакаталізатора, який здатний каталізувати індукцію активних форм кисню і - опромінення наночастинок світловим випромінюванням, де наночастинки являють собою наночастинки гетерокристалічного мінералу. 2. Спосіб за п. 1, де активацію здійснюють ех vivo. 3. Спосіб за п. 1 або 2, де спосіб включає: - додавання фотосенсибілізатора до рідини з одержанням його суспензії; - додавання кисню до суспензії, що отримується таким чином. 4. Спосіб за п. 3, де стадію опромінення фотосенсибілізатора проводять у пристрої, що призначений для опромінення суспензії фотосенсибілізатора вказаним cвiтловим випромінюванням. 5. Спосіб за п. 3 або 4, що включає стадію озонування суспензії. 6. Спосіб за п. 5, де наночастинки складаються з гетерокристалічного мінералу, вибраного з кварцу, рутилу, сфену, лопариту, перовскіту, анатазу, ільменіту, лейкоксену, фериту, бариту, аргіриту, гра 2 (19) 1 3 Винахід стосується способу активації фотосенсибілізатора. Фотосенсибілізатори належать до класів речовин, що каталізують продукцію активних форм кисню в кисневмісному середовищі, зокрема синглетного кисню, при впливі світлового випромінювання. Як правило, як фотосенсибілізатор використовують такі пігменти, як гематопорфірин і хлорофіл. У цей час ці речовини використовують для інгібування росту клітин, зокрема для лікування таких захворювань, як рак, вірусні інфекції, внутрішньоклітинні паразитичні інфекції, фіброз легень, гепатит, цироз печінки, хронічний нефрит, артеріосклероз та інші порушення функцій. Загальноприйнята практика при лікуванні захворювання реципієнта полягає в початковому введенні реципієнту прийнятного фотосенсибілізуючого пігменту, а потім очікуванні протягом певного періоду часу, поки рівень фотосенсибілізатора не підвищиться до прийнятної величини у ділянцімішені, яку мають намір лікувати, і, нарешті, в опроміненні ділянки-мішені світловим випромінюванням з прийнятного джерела світлового випромінювання. Недолік загальноприйнятої практики полягає в досягненні обмеженої вибірності, оскільки фотосенсибілізатори, що вводяться, також досягають секреторних органів, таких як печінка, в такій же мірі представляють ризик відносно цих органів. Потім необхідно вибрати джерело світлового випромінювання належно до вибраного як фотосенсибілізатора конкретного пігменту, де джерело відповідає вузькому діапазону спектра видимого світлового випромінювання і має дуже невелику глибину проникнення в тканину, близько 1-2 мм. Таким чином, внаслідок поглинання світлового випромінювання в тканині, загальноприйнята практика може забезпечувати прийнятні результати тільки для ділянок-мішеней, які розташовані неглибоко. Крім того, ще один недолік загальноприйнятої практики полягає в тому, що пацієнт повинен чекати від 9 до 16 годин, поки у ділянці-мішені не буде досягнутий прийнятний рівень фотосенсибілізатора. Варіант здійснення способу, як представлено у вступному розділі, відомий з ЕР1362598. У відомому способі при розгляді недоліків попередньої області, передбачені засоби для заміни джерела світлового випромінювання на ультразвукові хвилі, вибираючи, таким чином, клас фотосенсибілізаторів, які також можуть бути активовані за допомогою ультразвукових хвиль. Таким чином, відомий спосіб значно обмежує об'єм прийнятних речовин, які можна вибирати для лікування глибоко розташованих мішеней. Недолік відомого способу полягає в тому, що для даного способу необхідне додаткове апаратне забезпечення для активації фотосенсибілізатора і те, що фотосенсибілізатор застосовується для обмеженого діапазону відомих фотосенсибілізаторів. Мета винаходу полягає в забезпеченні способу активації фотосенсибілізатора, який легко здійснювати і який прийнятний для глибоко розташованих мішеней. 94067 4 З цією метою спосіб, згідно з винаходом, включає: - вибір фотосенсибілізуючих наночастинок каталізатора, який здатний каталізувати продукцію активної форми кисню; - опромінення фотосенсибілізатора світловим випромінюванням. Зокрема, активацію можна здійснювати ex vivo, хоча в принципі, фотосенсибілізатор можна активувати, зокрема опромінювати in vivo. Крім того, винахід стосується фотосенсибілізатору, що одержується способом, згідно з винаходом, для використання в медицині. Крім того, винахід стосується фотосенсибілізатору, що одержується способом згідно з винаходом, для виробництва лікарського засобу для лікування раку, зокрема раку, вибраного з групи, яка складається з карциноми, аденокарциноми, карциноми протокового типу; і/або лікарського засобу для загоєння ран. Рівень техніки винаходу оснований на уявленні, що наночастинки прийнятного каталізатора, здатного каталізувати продукцію активної форми кисню, забезпечують множину сприятливих ефектів при використанні для фотосенсибілізатора. Термін "активний кисень" належить до кисню з підвищеним потенціалом активації, наприклад, синглетного кисню (, ). Переважно, використовують наночастинки з розміром 0,5-200 нм, ще переважніше - з розміром 0,5-100 нм, ще переважніше - з розміром 0,5-50 нм. Наночастинки можуть мати шароподібну і/або паличкоподібну форму, їх розміри визначають з використанням відомого для цих цілей атомно-силового мікроскопа (AFH) або тунелю Stonnich (ST). Зазначено, що фотосенсибілізатор, згідно з винаходом, може містити суміші наночастинок з різними розмірами, внаслідок чого відносний процентний вміст наночастинок з конкретними розмірами також може розрізнюватися. Термін "розмір" стосується всіх розмірів наночастинок. По-перше, відкрита ефективність використання фотосенсибілізатора як металевого каталізатора, особливо каталізаторів з діоксиду біологічно сумісного металу, оскільки він каталізує утворення активного кисню у відповідь на опромінення світловим випромінюванням в широкому діапазоні довжин хвиль, від ультрафіолетового до інфрачервоного діапазону. Переважно, фотосенсибілізатор опромінюють заздалегідь (ex vivo), таким чином, коли активований фотосенсибілізатор вводять реципієнту, впливу активованого фотосенсибілізатора піддається тільки ділянка-мішень реципієнта, залишаючи без впливу здорові ділянки. Крім того, пацієнту не потрібно чекати, поки фотосенсибілізатор нагромадиться у ділянцімішені. Переважно, для металевих каталізаторів використовують діоксиди срібла, заліза і/або титану. При зменшенні розміру металевого каталізатора до частинок нанометрових розмірів каталізатор здійснює додатковий сприятливий ефект, який полягає в тому, що речовина, яка одержується - є прозорою для широкого діапазону довжин хвиль світлового випромінювання, тим самим поліпшує ефективність відповіді речовини на опромінення 5 світловим випромінюванням. Крім того, така речовина здатна брати участь в хімічних реакціях подібно до поведінки молекул, що складають, наприклад, організм людини. Таким чином, виходячи з порівняння розмірів наноструктур і розмірів клітин людини виходить, що наноструктури можна ефективно перенести навіть через клітинні мембрани, що ще більш поліпшує їх вплив на ділянку-мішень. Крім того, наноструктури мають велику поверхню контакту, тим самим поліпшуючи ефективність процесу активації, що являє собою по суті процес обміну мас, який залежить від площі реагуючих поверхонь. Крім того, металеві каталізатори на основі срібла, заліза і титану, будучи за природою біосумісними, не спричиняють несприятливого ефекту на біологічного реципієнта. Являючи собою практично прозоре середовище, фотосенсибілізатор, який містить наночастинки діоксиду біологічно сумісного металу, може бути активований видимим світловим випромінюванням. Тому такі речовини чудово підходять для використання у вигляді порошку, що доставляється місцево на поверхневі мішені. Наприклад, на ділянку-мішень можна наносити прийнятну кількість порошку з наночастинок і його можна піддавати впливу світлового випромінювання навколишнього середовища або, альтернативно, його можна піддавати іншій активації, наприклад, за допомогою лазера, до або в процесі прийнятної клінічної або косметичної процедури. Зазначено, що у випадку поверхневого нанесення активний кисень утворюється з атмосферного кисню і що дія фотосенсибілізатора є такою ж ефективною. У певному варіанті здійснення способу, згідно з винаходом, спосіб додатково включає додання фотосенсибілізатора в рідину з одержанням його суспензії, і, переважно, додаткове додання кисню до суспензії. Рівень техніки винаходу оснований на уявленні, що для одержання активованого фотосенсибілізатора для введення реципієнту, зручно використовувати рідкі форми. Переважні варіанти здійснення для рідин, ефективних для використання, згідно з винаходом, включають воду, розчин колоїдного рідкого білка, наприклад, альбуміну, або фізіологічний сольовий розчин. Переважно, підсумкову суспензію одержують з використанням співвідношення щонайменше 0,5 мг прийнятного діоксиду металу на 1 літр рідини. Зазначено, що якщо вибирають мінерали як джерело наночастинок, вони звичайно містять фракцію 10%-30% мас. відповідних дюксидів металів. Тому у випадку цих мінералів необхідно вибирати спільну масу наночастинок, які складають щонайменше 5 мг на 1 літр рідини. Крім того, зазначено, що якщо наночастинки використовують як фотосенсибілізатор, вони діють як каталізатори для продукції активних форм кисню, тим самим не беручи участь в хімічних реакціях. Отже, загальна кількість фотосенсибілізатора не є основним параметром для продукції активного кисню за умови, що на літр рідини одержують ТіО2 або FeO2, або їх суміш в кількості як мінімум 0,5 мг. Оскільки поверхнева взаємодія рідини з киснем навколишнього середовища не достатня для одержання необхідного рівня наси 94067 6 чення суспензії киснем, спосіб, згідно з винаходом, включає стадію додання кисню. Кисень можна забезпечувати з прийнятної місткості з використанням помпи. Переважно, парціальний тиск кисню в суспензії становить близько 40-100 мм рт.ст., ще переважніше - близько 70 мм рт.ст. Переважно, фотосенсибілізатор опромінюють лазерним випромінюванням з довжиною хвилі в діапазоні 0,80,9 мікрометра, яка відповідає максимальній інтенсивності поглинання для кисню і області оптичної прозорості тканин для лазерного випромінювання. В іншому варіанті здійснення способу, згідно з винаходом, спосіб включає активацію фотосенсибілізатора в пристрої, який призначений для опромінення суспензії фотосенсибілізатора світловим випромінюванням. Переважно, опромінюють потік суспензії, яка містить фотосенсибілізатор При опроміненні потоку суспензії фотосенсибілізатора продукція активного кисню можлива практично в повному об'ємі фотосенсибілізатора. Цю стадію переважно проводять ex vivo, тобто поза реципієнтом, наприклад, у вигляді попередньої стадії для фотодинамічного лікування відповідного захворювання. Переважно, використовують інтенсивність світлового випромінювання, що складає щонайменше 1 Дж/мл суспензії, що містить фотосенсибілізатор. Ще переважніше, інтенсивність світлового випромінювання вибирають з діапазону 2-3 Дж/мл суспензії фотосенсибілізатора. Крім того, переважно, величину потоку суспензії, яка містить фотосенсибілізатор, вибирають в діапазоні 1-2 мл/сек. Переважно, для пристрою використовують прийнятний Y-подібний корпус, при цьому перше плече Yподібного корпусу використовують для забезпечення потоку суспензії фотосенсибілізатора в головний канал пристрою, а друге плече Y-подібного корпусу використовують для подачі світлового випромінювання в головний канал Y-подібного корпусу, переважно, з використанням належним чином вибраного і приєднаного оптичного волокна. Переважно, об'ємну швидкість потоку суспензії фотосенсибілізатора вибирають відповідно до інтенсивності світлового випромінювання, яке забезпечується оптичним волокном. Загалом, переважне співвідношення об'ємної швидкості потоку і інтенсивність світлового випромінювання знаходиться в діапазоні 2-5 Вт енергії світлового випромінювання на 1 мл суспензії. Ще переважніше, головний канал Y-подібного корпусу приєднаний до накопичувальної порожнини для зберігання активованого фотосенсибілізатора перед його використанням. Переважно, порожнину одержують стерильним способом так, щоб необхідний об'єм активованого фотосенсибілізатора міг бути витягнутий, наприклад, за допомогою голки для ін'єкції в процесі медичного лікування. Переважний варіант здійснення пристрою більш детально описаний з посиланням на фіг. 2. Альтернативно, пристрій може бути зібраний для проведення активованого фотосенсибілізатора до джерела, яке використовують для введення активованого фотосенсибілізатора на ділянку-мішень. У цьому випадку потік фотосенсибілізатора переважно служить як оптичний провідник для світлових 7 хвиль, тим самим додатково концентруючи відкладення активного кисню на ділянці-мішені і проводячи світлове випромінювання до тканини, яка підлягає лікуванню. У випадку, коли для активації фотосенсибілізатора вибирають лазерне випромінювання, його поширення в тканині викликає місцеву гіпертермію, яку можна розглядати як допоміжну терапію в режимі реального часу, яка додатково підвищує медичну ефективність способу згідно з винаходом. У ще одному варіанті здійснення способу, згідно з винаходом, суспензію озонують. Цю процедуру можна здійснювати з використанням відомого для цих цілей пристрою для озонування рідин. Перевага цієї стадії полягає в забезпеченні підвищеної концентрації кисню в середовищі, що містить фотосенсибілізатор. Переважно, рівень озонування зберігають в межах діапазону 5-Ю мг озону на 1 літр суспензії, яка містить фотосенсибілізатор. Процес озонування має перевагу, оскільки він забезпечує різноманітність активних форм кисню в суспензії, таких як синглетний кисень і озон, які доповнюють один одного в своїй хімічній і біологічній активності. У ще одному варіанті здійснення винаходу для фотосенсибілізатора вибирають наночастинки з гетерокристалічного мінералу. Переважні варіанти здійснення для вказаного мінералу включають рутил, сфен, лопарит, перовськіт, анатаз, ільменіт, лейкоксен, ферит, барит, аргірит, графіт, оксид кальцію, фосфоритмонооксиди і фосфоритдіоксиди. Під терміном "гетерокристалічний мінерал" мають на увазі практично хімічно гомогенну речовина, яка одержується у вигляді кристала в межах решіток, що розрізнюються відносно їх типів і форм, утворюючи поліморфну речовину, яку можна виявляти відомим для цих цілей способом DSC. Ферити належать до класу речовин, що містять діоксид заліза, де більшість з них є феромагнетиками. Ферити можуть належати до мінералу або до речовини, хімічно отриманої з використанням Fe2O3. Рутил (ТiO2) природний мінерал, що є основною рудою титану, металу, який використовують для високотехнологічних сплавів внаслідок його невеликої маси, високої міцності і стійкості до корозії. Мікроскопічні вміщення рутилу можуть бути знайдені в кварці, турмаліні, рубіні, сапфірі. Як мінеральне джерело для одержання наночастинок також можна вибирати рутилований кварц. Цей камінь одержують внаслідок того, що при високих температурі і тиску n(SiO2)-n(TiO2) знаходиться в стабільному стані, однак зниження температури і ослаблення тиску приводить до двох окремих речовин з кристалами рутилу, що містяться в кристалах кварцу. Також для одержання фотосенсибілізаторів у вигляді наночастинок прийнятні мінерали, що містять сфен (CaO-SiO2-TiO2), лопарит (Са, Се, Na)(Nb, Ti))3 або (Ті, Nb)2(Na, Ca, Се)2О6, перовськіт (СаТіО3), анатаз (ТіО2) або (Ті, Nb, Fe)O2, ільменіт (FeTiO3 та інші модифікації), лейкоксен (ТіО2Fе2О3+nН2О). Ці речовини мають гетерокристалічну структуру, в якій фрагменти решітки сполучені за допомогою гідроксильного іона (ОН-). Переважно, з метою одержання наночастинок ці речовини піддають тепловому руйну 94067 8 ванню, при цьому охолоджування замінюють нагріванням. В процесі стадії охолоджування хімічні зв'язки гідроксильного іона піддають кристалізації, руйнуючи таким чином решітку. Дія режиму поперемінних охолоджування/нагрівання можна розглядати як нанесення внутрішніх ударів, які спричиняють зменшення розміру речовини до нанометрів, одержуючи таким чином наночастинки. З цією метою шар гетерокристалічного мінералу надають на прийнятному носії для забезпечення теплового контакту з прийнятним джерелом, зокрема, з термоелементом, сполученим з прийнятним джерелом живлення. Переважно, порядок величини товщини шару становить декілька міліметрів, ще переважніше, вибирають товщину близько одного міліметра, відповідно до розміру решітки рутилу, сфену, лопариту, перовськіту, анатазу, ільменіту, лейкоксену і фериту. Розмір шару в подовжньому напрямку може досягати одного метра. Переважно, для носія вибирають керамічний матеріал, який здатний проводити енергію в діапазоні 9-15 Вт/см2. Переважно, джерело живлення контролюється процесором, який, переважно, керується відповідною комп'ютерною програмою, яка призначена для контролювання тривалістю режимів охолоджування і нагрівання. Відповідно до способу, згідно з винаходом, джерело живлення виробляє імпульси постійного струму з амплітудою щонайменше 10 А/мм2, які передаються на термоелемент. Для протяжних шарів можна використати велику кількість термоелементів. Передбачають, що термоелементи діють згідно з відомим для цього термоелектричного ефекту Пельтьє-Зеєбека, згідно з яким при подачі струму з відповідною полярністю спаяні з'єднання термоелементів діють як охолоджуючий пристрій або як нагріваючий пристрій. В способі, згідно з винаходом, подають імпульс з прямою полярністю протягом періоду 10-4-1 секунди, що приводить до миттєвого зниження температури, яка направлена до шару поверхні термоелемента до -50° Цельсія, переважно до -73° Цельсія. Це обумовлює значне охолоджування речовини шару, при цьому гідроксильні групи молекул води кристалізуються, тим самим індукуючи в речовині шару мініатюрні удари. Після цього імпульс з прямою полярністю змінюють на імпульс зі зворотною полярністю, тим самим спричиняючи миттєве підвищення температури, яка направлена до шару поверхні термоелементів щонайменше до +80° Цельсію, переважно до +95° Цельсію, розплавляючи, таким чином, водний компонент в кристалі і руйнуючи структури решітки внаслідок теплових коливань решітки. Після цього полярність джерела живлення знову змінюють, викликаючи кристалізацію водного компонента. Переважно, таку зміну викликають протягом періоду від 1 секунди до 1 хвилини. Після повторення режимів охолоджування і нагрівання шар руйнують до наночастинок. Число повторень можна вибирати відповідно до бажаного розміру наночастинок. Як правило, відповідно до способу, згідно з винаходом, можна отримувати наночастинки з розміром 0,5-200 нм. Наночастинки, згідно з винаходом, мають високу хімічну активність, оскільки активні групи, що 9 спричиняють утворення ковалентних і іонних зв'язків, сформовані на ділянках міжмолекулярних розривів. Крім того, всі діоксиди металів, які утворюють основу з'єднання, додатково посилюють їх каталітичну дію відносно продукції активного кисню. Під впливом фотонів світла кисень потім перетворюється в свої синглетні форми (, ), у яких значно підвищений окислювальний потенціал. Після взаємодії з іншими елементами з навколишнього середовища, активний кисень і його вторинні похідні стають джерелом пошкодження ряду біологічних об'єктів, що забезпечують підтримку життєдіяльності клітин. У результаті, в біологічній речовині, що піддається взаємодії зі сполукою згідно з винаходом, викликаються фіброзні процеси, а також процеси закупорення кровотоку і лімфотечії, що діє як механічний бар'єр для циркуляції крові і лімфи, тим самим відділяючи пухлину від джерел живлення. У результаті, значно знижуються метаболічна активність і інвазивні властивості клітин пухлини, а пухлина переводиться, таким чином, в метаболічно стабільний стан. У ще одному варіанті здійснення способу, згідно з винаходом, наночастинки містять молекулу ДНК. Переважно, наночастинки зв'язані з молекулою ДНК. Необхідно розуміти, що термін "зв'язувати" стосується електростатичного зв'язування або зв'язування, яке обумовлене ковалентними зв'язками. Молекули ДНК піддаються зв'язуванню після простого додання їх до наночастинок. Передбачені різні варіанти здійснення зв'язування, по-перше, окрему наночастинку можна зв'язувати з окремою молекулою ДНК, по-друге, одну наночастинку можна зв'язувати з множиною молекул ДНК, потретє, одну молекулу ДНК можна зв'язувати з множиною наночастинок. Переважно, натрієву сіль молекул ДНК, комерційно відому як "деринат", вводять в суспензію, яка містить наночастинки, які одержують способом руйнування гетерокристалічного мінералу, переважно, на основі співвідношення 1 частини 1,5% розчини натрієвої солі до 1 частини наночастинок, що містять щонайменше 0,5 мг прийнятного діоксиду металу. Цей варіант здійснення має технічний ефект, який полягає в додатковому підвищенні вибірності наночастинок відносно до їх біомедичної дії внаслідок того, що внаслідок дії молекули ДНК вони переносяться всередину клітини, в якій наночастинки діють як фотосенсибілізатор. У ще одному варіанті здійснення способу, згідно з винаходом, наночастинки містять протиметаболічний засіб. Зокрема, такі засоби включають протипухлинні засоби з протиметаболічним ефектом, цитостатичні засоби з протиметаболічним ефектом і протиракові засоби з протиметаболічним ефектом. Такі засоби добре відомі в даній галузі. Цей рівень техніки заснований на уявленні, що поєднання з нанометровими розмірами можна використати як носій для переміщення додаткового лікарського засобу всередину клітини. Переважно, наночастинки зв'язують з протиметаболічним засобом, наприклад, за допомогою електростатичних сил або ковалентних зв'язків. Зв'язування 94067 10 протиметаболічного засобу з наночастинками може забезпечувати сукупний цитотоксичний вплив на клітину, додатково підвищуючи ефективність речовини, що одержується таким чином. Наприклад, протиметаболічний засіб може містити відому для цієї мети хіміотерапевтичну речовину. Спосіб лікування захворювання у реципієнта, згідно з винаходом, включає забезпечення реципієнта активованим фотосенсибілізатором у вигляді наночастинок, переважно, наночастинок гетерокристалічного мінералу. Переважно, фотосенсибілізатор активують способом, згідно з винаходом, представленим з посиланням на описане вище. Спосіб лікування, згідно з винаходом, заснований на уявленні, що опромінюваний фотосенсибілізатор, що одержується таким чином, має кращі характеристиками відносно до біологічного ефекту і ефективності способу лікування. Утворення цитотоксичного засобу -активного кисню, наприклад, у вигляді синглетного кисню, відбувається ex vivo, a після цього на ділянку-мішень вводять активне середовище. Цей спосіб знижує можливий ризик для здорової тканини внаслідок того, що активна речовина переноситься місцево і не поглинається здоровими тканинами, розташованими далеко від ділянкимішені. Переважно, використовують інтенсивність світлового випромінювання, яка складає щонайменше 1 джоуль на 1 мл рідини, що містить фотосенсибілізатор. Передбачені декілька способів введення активованого фотосенсибілізатора. По-перше, активований фотосенсибілізатор ефективний для лікування ракового захворювання. У цьому випадку активований фотосенсибілізатор, що одержується, можна додавати в рідину і перенести в голку для ін'єкції, яку потім можна використати для введення в пухлину утвореної таким чином суспензії, яка містить активний кисень. Переважно, об'єм суспензії, що підлягає введенню в або близько до пухлини, вибирають так, щоб він являв собою величину, яка перевищує об'єм пухлини в 5-10 разів. Об'єм пухлини можна оцінювати заздалегідь або в режимі реального часу з використанням прийнятних медичних способів одержання зображення, відомих в даній галузі для цієї мети. У випадку поверхневого розташування пухлини, наприклад, раку шкіри, можна використати прийнятний розпилюючий пристрій для розбризкування активованої суспензії, що містить фотосенсибілізатор, над бажаною ділянкою. У випадку лікування глибоко розташованої пухлини, необхідний об'єм активованої суспензії, що містить фотосенсибілізатор, вводять ін'єкцією в пухлину або поблизу від неї. Сприятливі ефекти лікування варіантів раку додатково пояснені з посиланням на приклади, які описані з посиланням на фіг. 1. Переважно, фотосенсибілізатор зв'язують з молекулою ДНК. Ще переважніше, фотосенсибілізатор додатково зв'язують з протиметаболічним засобом для додаткового поліпшення його цитотоксичної дії. По-друге, активований фотосенсибілізатор можна використати для лікування ран, виразок і для забезпечення загального антисептичного ефекту на ділянці, що обробляється. Для цієї мети 11 активований фотосенсибілізатор можна вводити з використанням спрею, нанесення порошку або т.п. на ділянку, яка підлягає лікуванню. Використання фотосенсибілізаторів безпосередньо для лікування ран відомо з патенту США №6107466. У відомому способі прийнятний фотосенсибілізатор вводять реципієнту місцево або системно, після чого він чекає, поки рівень фотосенсибілізатора на ділянці рани не досягне ефективної тканинної концентрації, після чого здійснюють фотоактивацію. З метою забезпечення можливості фотоактивації використовують заздалегідь визначене джерело світлового випромінювання, що залежить від типу фотосенсибілізатора, що використовується. Крім того, зазначено, що відповідно до описаного вище, рутили, сфени, допарити, перовськіти, анатази, ільменіти, лейкоксени і ферити містять діоксид кремнію (SiO2), який сам по собі надає сприятливий ефект, що викликає фіброз тканин. Цей сприятливий ефект, що виявляє себе головним чином у вигляді блокування кровотоку і лімфотечії, можна використати для визначення розташування ракової тканини і, тим самим, для усунення будь-якого джерела живлення злоякісних клітин. Крім того, зазначено, що при хімічному зв'язуванні з прийнятною молекулою наночастинки SiO2 можна використати як носії. Наприклад, наночастинки SiO2 можна хімічно зв'язувати з колоїдним діоксидом срібла, який може доповнювати дію SiO2 внаслідок своїх фотосенсибілізуючих властивостей. Альтернативно, AgO2, зв'язаний з SiO2, можна додавати до наночастинок, що містить діоксид титану або діоксид заліза, тим самим доповнюючи їх дію як металевих каталізаторів для продукції активних форм кисню. Спосіб, згідно з винаходом, перевершує спосіб лікування ран, відомий з попереднього рівня техніки, особливо, якщо використовують наночастинки фотосенсибілізаторів на основі біосумісних металів, розміри яких зменшені до наночастинок, що забезпечує можливість активації фотосенсибілізатора з використанням широкого діапазону доступних джерел світлового випромінювання, від ультрафіолетового до інфрачервоного діапазону, для активації фотосенсибілізаторів. Спосіб, згідно з винаходом, легко здійснити і не вимагає латентної фази для забезпечення досягнення певної концентрації фотосенсибілізатора у ділянці-мішені. Передбачені різні способи вміщення активованого фотосенсибілізатора в рану. Можна використати фотосенсибілізатор у вигляді порошку. При розгляді внутрішнього хірургічного втручання переважно додавати фотосенсибілізатор до рідини, одержуючи таким чином суспензію, яку потім можна вміщувати у ділянку-мішень з використанням розпилюючого пристрою, голки для ін'єкції, тампона або матеріалу для перев'язки, зволоженого активованою суспензією, або за допомогою прийнятного катетера. Спосіб, згідно з винаходом, забезпечує не тільки ефект загоєння ран, але крім того, для нього також показана антисептична дія фотосенсибілізатора, зумовлена характерними для нанометрових речовин противірусними і протибактеріальними властивостями. 94067 12 Ці і інші аспекти винаходу описані з посиланням на фігури. На фіг. 1 представлений в короткому вигляді варіант здійснення технологічної схеми способу згідно з винаходом. На фіг. 2 схематично представлений варіант здійснення пристрою для активації потоку фотосенсибілізатора. На фіг. 1 представлений в короткому вигляді варіант здійснення технологічної схеми способу 10 згідно з винаходом. На стадії 1 способу, згідно з винаходом, вибирають фотосенсибілізатор, який наприклад складається з наночастинок діоксиду біологічно інертного металу, наприклад, титану, срібла або т.п. Переважно, фотосенсибілізатор представляють у вигляді порошку. У випадку, коли передбачене використання фотосенсибілізатора на поверхні, його активують на стадії 5 з використанням прийнятного джерела світлового випромінювання. Зазначено, що перевага нанометрових речовин полягає в тому, що їх можна активувати з використанням широкого діапазону джерел світлового випромінювання, включаючи світлове випромінювання навколишнього середовища. Таким чином, для лікування поверхневого порушення, такого як рана, може буди достатнім забезпечити прийнятний шар порошку, що містить фотосенсибілізатор, і активувати його за допомогою сонячного випромінювання. Крім того, в цих умовах порошок активує присутній в атмосфері кисень з навколишнього середовища. Переважно, якщо порошок активується за допомогою інфрачервоного лазерного випромінювання з довжиною хвилі в діапазоні 0,8-0,9 мікрометра, оскільки цей діапазон довжин хвиль відповідає максимальній величині поглинання для кисню і області оптичної прозорості для тканини. Після здійснення активації фотосенсибілізатора його можна використати на стадії 7 за допомогою введення фотосенсибілізатора у відповідну ділянку-мішень у реципієнта. Альтернативно, у випадку розгляду лікування глибоко розташованої мішені в способі, згідно з винаходом, переходять до стадії 3, де нанометровий фотосенсибілізатор додають до відповідної рідини для одержання суспензії. Прийнятні приклади рідини включають воду, розчин колоїдного рідкого білка, такого як альбумін або т.п., фізіологічний сольовий розчин. Переважно, перед переходом на стадію способу 3 до фотосенсибілізатору додають важливі добавки, наприклад, молекули ДНК і протиметаболічні засоби. Коли фотосенсибілізатор утворить зв'язки з відповідними ділянками молекул ДНК і, необов'язково, з протиметаболічним засобом, каталізований фотосенсибілізатором цитотоксичний ефект активного кисню може значно підвищуватися. На стадії 4 способу, згідно з винаходом, суспензію, що одержується на стадії З, забезпечують киснем. Кисень можна доставляти з прийнятної місткості з використанням помпи. Переважно, досягають величини парціального тиску кисню в утвореній таким чином суспензії, що складає близько 70 мм рт.ст. Ще переважніше, на стадії 4а проводять процес озонування для додаткового підвищення концентрації кисню в просторі, що 13 оточує фотосенсибілізатор. Процес озонування можна здійснювати з використанням будь-якого відомого для цієї мети обладнання для озонування. Також внаслідок озонування забезпечують множину активних форм кисню. Після досягнення достатньої концентрації кисню в рідині в способі, згідно з винаходом, переходять на стадію 5, де одержують активний кисень, зокрема синглетний кисень, за допомогою опромінення рідини відповідним джерелом світлового випромінювання. Як було зазначено вище, для цієї мети прийнятні всі джерела світлового випромінювання, однак переважне використання інфрачервоного лазерного випромінювання з довжиною хвилі 0,8-0,9 мікрометра, практично відповідає максимальній величині поглинання для кисню і області оптичної прозорості для тканини. Ще переважніше, активацію забезпечують з використанням змішуючого пристрою, який детально описаний з посиланням на фіг.2. Після одержання синглетного кисню рідина готова до використання, і її можна зберігати, переважно, в стерильному контейнері. Альтернативно, її можна перенести за допомогою прийнятного провідника до ділянки для лікування, де її можна вводити реципієнту. У випадку глибокого розташування ділянки-мішені у реципієнта в способі, згідно з винаходом, переходять до стадії 6, де використовують прийнятні способи медичної діагностики для визначення просторового розташування ділянки-мішені. Переважно, використовують ультразвуковий пристрій. Альтернативно, можна використати рентгенівський апарат, пристрій для магнітнорезонансного одержання зображення або рентгенівський комп'ютерний томограф. Після визначення розташування ділянки-мішені прийнятний медичний керуючий пристрій може доставляти активовану рідину в прийнятний пристрій для нанесення, наприклад, в голку для ін'єкції, катетер або т.п. Потім на стадії 7 винаходу активовану рідину вводять реципієнту. Спосіб і його клінічний ефект описані з посиланням на приклади. Приклад 1 У випадку поверхово розташованої ракового утворення активований фотосенсибілізатор вводять на поверхню і навколо утворення, наприклад, з використанням прийнятної голки для ін'єкції. Об'єм суспензії, що містить активований фотосенсибілізатор, повинен бути щонайменше в декілька разів більше, ніж об'єм утворення. Переважно, він в 5-10 разів більший, ніж об'єм утворення. Зазначено, що можна забезпечувати голку для ін'єкції Yподібним корпусом, де одне плече являє собою канал доставки для суспензії, яка містить сенсибілізатор, а інше плече є оптичним каналом для забезпечення світлового випромінювання. Переважно, інтенсивність світлового випромінювання складає не менше ніж 1 Вт/см2. Ще переважніше, світлове випромінювання забезпечують в напрямку потоку суспензії, і воно зазнає додаткового поширення в тканині, яка підлягає лікуванню. Переважно, об'ємна швидкість потоку складає не менше ніж 1 мл на 1 джоуль енергії світлового випромінювання. Переважно, для зниження больової чутливості реципієнта в суспензію перед 94067 14 процедурою впливу вводять прийнятний знеболюючий засіб. Переважно, використовують 0,2% лідокаїн і 10 мг/л озону. Випадок 1. Пацієнту В., у віці 18 років, (карта хворого №212/01) в 2001 році проводили лікування на предмет рецидиву саркоми м'яких тканин в правій половині грудної клітини. Гістологічно підтверджений рецидив трапився через три місяці після вирізання пухлини. У процесі дослідження в області післяопераційного рубця, було виявлено шароподібне потовщення діаметром близько 4 см, де вказане потовщення було нерухомим, міцно прикріплене до надкісниці передньої поверхні ребер ІІ-ІII. Віддалених метастаз способами ультразвукового і рентгенівського дослідження виявлено не було, однак пахвові лімфатичні вузли були потовщені. Пацієнту інтерстиціально вводили 200 мл суспензії, що містить 1 мг наночастинок, які отримували тепловим руйнуванням рутилу, і опромінювали протягом 6 і 8 хвилин лазерним випромінюванням з довжиною хвилі 0,56 мікрометра з інтенсивністю 5 Вт. Процедуру повторювали двічі з тижневим інтервалом. Температура тканини в процесі лікування не підвищувалася більш ніж на 1,4 градуси Цельсія. При біопсії, проведеної через три доби після другої процедури, було показано, що пухлина належить до виду сарком. Через один рік спостережень, зростання пухлини виявлено не було, а на місці рецидивного утворення діаметром 4 см знаходять потовщення фіброзної тканини величиною 1 см. У процесі наступних процедур обстеження виявів пухлини виявлено не було. Приклад 2. У випадку глибоко розташованих пухлин, місцеположення яких не можна визначити простим оглядом, використовують діагностичні способи для представлення даних за просторовим розташуванням, що містить пухлину ділянки-мішені і її розмірів. Також в цьому варіанті здійснення для вміщення активованого фотосенсибілізатора в пухлину і/або навколо пухлини можна використати належним чином влаштовану голку для ін'єкції. Випадок 2. Пацієнт К, у віці 64 років, (карта хворого №923) в листопаді 2000 року був госпіталізований в урологічну клініку внаслідок дизурії. У процесі дослідження була виявлена аденокарцинома верхньої частини лівої частки передміхурової залози (4 і 4 за Глісоном). У доповнення до катетеризації сечового міхура з 12 липня 2001 року проводили лікування згідно з винаходом. В обидві частки передміхурової залози вводили 250 мл суспензії, що містить 1,5 мг діоксиду титану в розчині колоїдного срібла, що опромінюється протягом 8 хвилин лазерним випромінюванням з довжиною хвилі 0,84 мікрометра, інтенсивністю 16 Вт/см2. Контролювали температуру тканини і вона в процесі лікування не підвищувалася більш ніж на 1,2 градуси Цельсія. Явище дизурії припинилося, а при діагностичному обстеженні в області вихідної пухлини спостерігали тільки фіброзну тканину. Цей стан був підтверджений додатковим обстеженням через три року після лікування згідно з винаходом. При біопсії (8 балів), проведеної літом 2004 року, була 15 показана відсутність пухлинних клітин і підтверджений фіброз тканин залози. У січні 2005 року внаслідок дизурії, яка посилилася була проведена трансуретральна резекція. У деяких фрагментах тканини, вирізаних в процесі процедури хірургічного втручання, були виявлені "острівці" пухлини, оточені міцною рубцевою тканиною. Додаткових ознак пухлинного процесу виявлено не було. У квітні 2006 року концентрація антигену передміхурової залози становить 2,1 мг/мл. Випадок 3. Пацієнт L., жіночої статі, у віці 59 років, (карта хворого №176/32) була включена в травні 2004 року до групи пацієнтів-добровольців для одержання лікування згідно з винаходом. У пацієнта діагностували карциному лівої молочної залози протокового типу на стадії T3N2Mx. Променева терапія, що проводиться пацієнту була неефективною. У процесі обстеження пацієнта перед лікуванням, згідно з винаходом, було виявлене пухлинне утворення значних розмірів (10 см3), яке також призвело до розвитку виразки. У процесі лікування пацієнту 10 разів проводили всередині- і навколопухлинні ін'єкції активованого фотосенсибілізатора, що містить 20% діоксиду титану, 30% діоксиду кальцію і щонайменше 15% діоксиду кремнію. Для одержання суспензії об'ємом приблизно 1 літр використали 5 мг фотосенсибілізатора із застосуванням стерильної води і до цього додавали 5 мл 1,5% деринату і 5 мг протиметаболічного засоби у вигляді доксорубіцину. Після всередині- і навколопухлинних ін'єкцій суспензію активованого фотосенсибілізатора також вводили в лімфатичні вузли. У процесі курсу обстеження в листопаді 2004 року виявів ракових клітин в обробленому об'ємі виявлено не було, що було підтверджено масштабним гістологічним аналізом. Ділянка виразкового дефекту зменшилась приблизно в 5 разів і крім того, не спостерігались ознаки будь-якого запального процесу. У березні 2005 року виразковий дефект шкіри був закритий за допомогою пластичної хірургії. Приклад 3. Допоміжний ефект загоєння ран для наночастинок фотосенсибілізатора, що містять стимулюючу фіброз речовину. Випадок 4. Пацієнт жіночої статі, у віці 76 років, (випадок захворювання 318/А), після того, як вона була пацієнтом багатьох онкологічних клінік протягом більш ніж чотирьох років внаслідок наявності значної (18 см3) ракової виразки на її лівій щоці. Звичайні спроби закрити шкірний дефект були неефективні. Після цього її піддали місячному курсу лікування наночастинками, які були одержані з використанням суміші 10 мг фериту і 10 мг SiO2, де наночастинки вводили у вигляді сухого порошку. Після нанесення порошку на виразку, його опромінювали з використанням галогенної лампи з інтенсивністю 3 Вт/см2 при дозі 1,3 кДж. Після ліку 94067 16 вання шкірний дефект зник, при цьому у сліді виразки спостерігали різновиди фіброзних клітин в фазах апоптозу. Зазначено, що хоча в даному прикладі представлена сукупна дія наночастинок діоксиду заліза і діоксиду кремнію, перші використали для лікування раку, а останні використали як допоміжний терапевтичний засіб для стимуляції фіброзу для закриття дефекту шкіри. Необхідно розуміти, що, як таке, в даній заявці передбачене клінічне використання наночастинок, що одержують з кварциту, для загоєння ран. На фіг.2 представлена схема варіанту здійснення 20 для пристрою активації фотосенсибілізатора, зокрема, текучого фотосенсибілізатора. Пристрій 20а містить Y-подібний корпус, де одне плече 21 призначене для прийому текучого фотосенсибілізатора 21, а інше плече 23 призначене для забезпечення світлових хвиль 24 з джерела світлового випромінювання (не представлено), переважно, з використанням прийнятного оптичного волокна. Y-подібний корпус пристрою 20а складений таким чином, щоб потік рідкого фотосенсибілізатора 22а повністю опромінювався світловим променем 24а. Такий пристрій забезпечує повну активацію фотосенсибілізатора по всьому об'єму, що опромінюється. Ділянку 25 Y-подібного корпусу можна одержати значних розмірів, щоб він вміщував весь об'єм фотосенсибілізатора, який призначений для використання в процесі процедури лікування. Відкрито, що є достатнім надавати ділянку 25 з об'ємом 10-500 мл. Переважно, вибирають об'єм ділянки 25, що становить приблизно 50 мл. Коли фотосенсибілізатор активований і зберігається у відділенні 25, до його віддаленої ділянки можна приєднувати джерело 27. Джерело може включати катетер, голку для ін'єкції, розпилюючий пристрій, які використовують для введення фотосенсибілізатора 29 в ділянку-мішень у реципієнта. У випадку використання голки для ін'єкції або катетера може бути перевалено не переривати потік 22b активованого фотосенсибілізатора, дозволяючи йому проводити світлове випромінювання в тканині реципієнта. Таким чином, введення активованого фотосенсибілізатора здійснюють практично одночасно з його активацією, внаслідок чого рідкий фотосенсибілізатор діє як оптичний провідник для світлового променя в тканину. Цей спосіб має сприятливий клінічний ефект, оскільки нанометровий фотосенсибілізатор вмить забезпечує на мікрорівні дозу активованого кисню, а також дозу випромінювання. У випадку використання лазерного випромінювання доза випромінювання, що доставляється таким чином, обумовлює додаткове пошкодження тканини внаслідок місцевого руйнування, яке викликається індукованою лазером гіпертермією. Переважно, використовують лазерне випромінювання з довжиною хвилі 0,8-0,9 мікрометра, яка відповідає максимальній величині поглинання для кисню і області оптичної прозорості для тканини. 17 Комп’ютерна верстка А. Крижанівський 94067 Підписне 18 Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of activating a photosensitizer
Автори англійськоюKurkaiev Abdula
Назва патенту російськоюСпособ активации фотосенсибилизатора
Автори російськоюКуркайев Абдула
МПК / Мітки
МПК: A61K 33/00, A61K 41/00, A61P 35/00, A61N 5/06
Мітки: спосіб, фотосенсибілізатора, активації
Код посилання
<a href="https://ua.patents.su/9-94067-sposib-aktivaci-fotosensibilizatora.html" target="_blank" rel="follow" title="База патентів України">Спосіб активації фотосенсибілізатора</a>
Попередній патент: Призначення шаблона контрольного сигналу, адаптоване до характеристик каналу для системи зв’язку множинного доступу з ортогональним частотним розділенням
Наступний патент: Пристрій для вимірювання натягнення металевої штаби
Випадковий патент: Спосіб розміщення волосини в ювелірних виробах