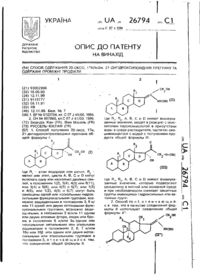
Спосіб одержання 20-оксо, 17альфа, 21-дигідроксипохідних прегнану та одержані проміжні продукти
Формула / Реферат
1. Способ получения 20-оксо, 17a, 21-дигидроксипроизводных прегнана общей формулы I:
где R1 - атом водорода или метил, R2 -метил или этил, циклы A, B, C и D могут включать одну или несколько двойных связей, в положениях 1(2), 3(4), 4(5) или 9(11), или 3(4) и 5(6), или 4(5) и 6(7), или 1(2) и 4(5), или 1(2), 4(5) и 6(7) могут быть замещены одной или несколькими гидроксильными функциональными группами, возможно защищенными в положениях 3, 9 и/или 11 одной или двумя кетоновыми функциональными группами, возможно защищенными, в положении 3 и/или 11 одним или двумя атомами фтора, хлора или брома в положении 6 и/или 9a одним или несколькими метильными или этильными радикалами в положениях 2, 6, 7 и/или 16a или 16b или одним или двумя метоксильными или этоксильными группами в положении 3, отличающийся тем, что соединение общей формулы II:
где R1, R2, A, B, C и D имеют вышеуказанные значения, вводят в реакцию с окислителем пероксикислотой в присутствии воды в среде растворителя, частично смешивающегося с водой с получением продукта общей формулы III:
где R1, R2, A, B, C и D имеют вышеуказанные значения, которые подвергают сольволизу в кислой или основной среде и при необходимости снимают защитные группы имеющихся гидроксильных или кетонных групп.
2. Способ по п.1, отличающийся тем, что в качестве соединения формулы II используют соединение общей формулы II":
где линия --- представляет вторую углерод-углеродную связь, R3 и R4 - атомы водорода или линия --- не представляет вторую связь, R3 - атом водорода, b - гидроксил, оксо, a R4 - атом водорода или R3 - атом водорода, a R4 - a-гидроксил.
3. Способ по пп.1, 2, отличающийся тем, что в качестве соединения формулы II используют соединение формулы:
4. Способ по пп.1, 2, отличающийся тем, что в качестве соединения формулы II используют соединение формулы:
5. Способ по пп.1, 2, отличающийся тем, что в качестве соединения формулы II используют соединение формулы
6. Способ по пп.1, 2, отличающийся тем, что в качестве соединения формулы II используют соединение формулы:
7. Способ по пп.1, 2, отличающийся тем, в качестве соединения формулы II используют соединение формулы:
8. Способ по п.1, отличающийся тем, что пероксикислотой является надфталевая кислота.
9. Способ по пп.1 - 8, отличающийся тем, что процесс проводят в среде предельного спирта жирного ряда.
10. Способ по пп.1 - 9, отличающийся тем, что сольволизом соединения формулы III является алкоголиз, протекающий в присутствии основания гидроокиси или щелочного карбоната.
11. Способ по пп.1 - 9, отличающийся тем, что сольволизом соединения формулы III является алкоголиз, протекающий в присутствии водного раствора сильной кислоты.
12. Способ по пп.1 - 9, отличающийся тем, что процесс проводят без промежуточного выделения соединения формулы III.
13. Соединения общей формулы III:
где R1, R2, A, B, C и D имеют значения, указанные в п.1 формулы изобретения, за исключением R2 - метил и/или R1 - метил, а в положениях 1 и 4 имеются две двойные связи,в положении 3 - радикал оксо, в положении 11 - гидроксил или оксо, или гидроксил в положении 11 и метил - в положении 16b, или R1 представляет метил, в положении 4 имеется двойная связь, в положении 3 - кетонная группа, а в положении 11 - водород, гидроксил или оксо, или R1 представляет метил, в положении 3 - гидроксил, а в положении 11 - оксо, или R1 представляет водород, в положении 4 имеется двойная связь, в положении 3 - кетонная группа, в качестве промышленных промежуточных продуктов в синтезе соединений формулы 1.
14. Соединения по п.13 общей формулы:
в качестве промышленного промежуточного продукта в синтезе соединений формулы I.
15. Соединения по п.13 общей формулы:
в качестве промышленного промежуточного продукта в синтезе соединений формулы I.
Текст
1. Способ получения 20-оксо, 17а, 21-дигидроксипроизводных прегнана общей формулы І: где Rt, R2, А, В, С и D имеют вышеуказанные значения, вводят в реакцию с окислителем пероксикислотой в присутствии воды в среде растворителя, частично смешивающегося с водой с получением продукта общей формулы III: он сн2он (і) сн -о-сно с > ОН где R, - атом водорода или метил, R2 метил или этил, циклы А, В, С и D могут включать одну или несколько двойных связей, в положениях 1(2), 3(4), 4(5) или 9(11), или 3(4) и 5(6), или 4(5) и 6(7), или 1(2) и 4(5), или 1(2), 4(5) и 6(7) могут быть замещены одной или носколькими гидроксильными функциональными группами, возможно защищенными в положениях 3, 9 и/ или 11 одной или двумя кетоновыми функциональными группами, возможно защищенными, в положении 3 и/или 11 одним или двумя атомами фтора, хлора или брома в положении 6 и/или 9а одним или несколькими метильными или этильными радикалами в положениях 2, 6, 7 и/или 16а или 16(3 или одним или двумя метоксильными или этоксильными группами в положении 3, о т л и ч а ю щ и й с я тем, что соединение общей формулы II: (Ш) Os где R,, R2, А, В, С и D имеют вышеуказанные значения, которые подвергают сольволизу в кислой или основной среде и при необходимости снимают защитные группы имеющихся гидроксильных или кетонных групп. 2. Способ п о п . 1 , о т л и ч а ю щ и й с я тем, что в качестве соединения формулы II используют соединение общей формулы И": в СН. эшсно о 26794 где линия представляет вторую углерод-углеродную связь, R3 и R4 - атомы водорода или линия не представляет вторую связь, R3 - атом водорода, р гидроксил, оксо, a R4 - атом водорода или R3 - атом водорода, a R4 - а-гидроксил. 3. Способ по пп. 1, 2, о т л и ч а гащ и й с я тем, что в качестве соединения формулы II используют соединение формулы: сно 4. Способ по пп. 1,2, о т л и ч а ю щ и й с я тем, что в качестве соединения формулы II используют соединение формулы: СМзРН •доено 5. Способ по пп.1, 2, о т л и ч а ющ и й с я тем, что в качестве соединения формулы И используют соединение формулы: СН. 7. Способ по пп. 1,2, о т л и ч а гащ и й с я тем, в качестве соединения формулы II используют соединение формулы: NHCHO 8. Способ по п. 1, о т л и ч а гащи й с я тем, что пероксикислотой является надфталевая кислота. 9. Способ по пп. 1-8, о т л и ч а ю щийся тем, что процесс проводят в среде предельного спирта жирного ряда. 10. Способ по пп. 1-9, о т л и ч а ю щийся тем, что сольврлизом соединения формулы III является алкоголиз, протекающий в присутствии основания гидроокиси или щелочного карбоната. 11. Способ по пп, 1-9, о т л и ч а гащ и й с я тем, что сольволизом соединения формулы III является алкоголиз, протекающий в присутствии водного раствора сильной кислоты. 12. Способ по пп. 1-9, о т л и ч а гощ и й с я тем, что процесс проводят без промежуточного выделения соединения формулы III. 13. Соединения общей формулы III: сн,-о-аю NHCHO 6. Способ по пп.1 ( 2, о т л и ч а гащ и й с я тем, что в качестве соединения формулы II используют соединение формулы; где R|t R2, А, В, С и D имеют значения, указанные в п.1 формулы изобретения, за исключением R2 - метил и/или R, - метил, а в положениях 1 и 4 имеются две двойные связи, в положении 3 - радикал оксо, в положении 11 - гидроксил или оксо, или гидроксил в положении 11 и метил - в положении 16Ь, или R, представляет метил, в положении 4 имеется двойная связь, в положении 3 - кетонная группа, а в положении 11 - водород, гидроксил или оксо, или R( представляет метил, в положении 3 - гидроксил, а в положении 1 1 - оксо, или R, представляет водород, в положении 4 имеется двойная связь, в положении 3 - кетон 26794 15. Соединения по п.13 общей формулы: ная группа, в качестве промышленных промежуточных продуктов в синтезе соединений формулы 1. 14. Соединения по п. 13 общей формулы: СН. О сн. ч 'он. сн,-о-сно ОН сн 2 ~°-сно 2 в качестве промышленного промежуточного продукта в синтезе соединений формулы I. в качестве промышленного промежуточного продукта в синтезе соединений формулы І. Предметом настоящего изобретения являются новый метод получения 20 оксо 17а, 21-дигидроксипроизводных прегнана и полученные новые промежуточные продукты. Таким образом предметом настоящего изобретения является метод получения соединений формулы (I): ми атомами, одним или несколькими алкильными или алкилоксильными радикалами, включающими от 1 до 4 атомов, углерода, или одним или несколькими алкенильными или алкинильными радикалами, включающими от 2 до 4 атомов углерода, отличающийся тем, что соединение формулы (II): о 10 15 где R2 представляет собой атом водорода, 20 в которой R,, R2, А, В, С и D такие, как алкильный радикал, включающий от 1 до определено выше, вводится в реакцию с 4 атомов углерода, с возможным замеокислителем в присутствии воды и в срещением кислород- или азотсодержащей де растворителя, хотя бы частично смефункциональной группой или галогенным шивающегося с водой, для получения проатомом, или R, представляет собой алке- 25 дукта формулы (III): нильный или алкинильный радикал, включающий от 2 до 4 атомов углерода, R2 представляет собой алкильный радикал, включающий от 1 до 4 атомов углерода, циклы А, В, С и D могут включать одну 30 (Hi) или несколько двойных связей и могут замещаться одной или несколькими гидроксильными или кетоновыми функциональными группами с возможностью защиты, одним или несколькими галогенны 26794 в которой R1f R3, А, В, С и D такие, как определено выше, который подвергается сольволизу в кислой или основной среде и, при необходимости, реакции аннулирования защиты защищенных гидроксильных или кетоновых функциональных групп, которые могут иметься в наличии. Когда R, представляет собой алкильный радикал, речь, в первую очередь, идет о метиловом или этиловом радикале. Когда R, представляет собой алкильный радикал, замещенный кислородсодержащей функциональной группой, речь, в первую очередь, идет о гидроксиметильном или гидроксиэти льном радикале, о формильном радикале или ацетильном радикале. Когда R, представляет собой алкильный радикал, замещенный азотсодержащей функциональной группой, речь, в первую очередь, идет о цианильном радикале или таком радикале, как аминометильный или аминоэтильный. Когда R, представляет собой алкильный радикал, замещенный галогеном, речь, в первую очередь, идет о радикале СНгНаІ, в котором Hal представляет собой атом хлора, фтора или брома. Когда R, представляет собой алкенильный радикал, речь, в первую очередь, идет о винильном или аллильном радикале. Когда R, представляет собой аякинильный радикал, речь, в первую очередь, идет об этинильном радикале. R2 представляет собой, в первую очередь, метильный или этильный радикал. Когда циклы А, В, С и D включают одну или несколько двойных связей, речь, в первую очередь, идет о двойной связи в положении 1(2), 3(4), 4(5) или 9(10) или о системе двойных связей, конъюгированных в положении 3(4) и 5(6) или 4(5) и 6{7) или 1(2) и 4(5), или же об арома' тической системе из трех двойных связей 1, 3, 5, или о системе из трех двойных связей 1(2), 4(5), 6(7). Когда циклы А, В, С и D замещены одной или несколькими гидроксильными функциональными группами, речь, в первую очередь, идет о гидроксильной группе в положении 3, 9 или 11. Когда гидроксильная функциональная группа (гидроксильные функциональные группы) защищена (защищены), речь, в первую очередь, идет о защите в виде сложных эфиров органических кислот, таких как, например, уксусная кислота или муравьиная, или эфиров низшего алкила, например, метила или этила, силиловых эфиров, нап 5 10 15 20 25 30 35 40 45 8 ример, триалкилсилила, такого как триметил или диметил-трет-бутилсилил, триарилсилила, такого как трифенилсилил, или диарилалкилсилила, такого как дифенилтрет-бутилсилил, или же эфира тетрагидропиранила. Когда циклы А, В, С и D замещены одной или несколькими кетоновыми функциональными группами, речь, в первую очередь, идет о кетоновой группе в положении 3 или 11. Когда кетоновая группа в положении 3 защищена, речь, в первую очередь, идет о защите в виде кеталя, циклического или нециклического тиоацеталя, эфира енола или же оксилла. Когда кетоновая функциональная группа в положении 11 защищена, речь, в первую очередь, идет о защите в виде эфира енола. Когда циклы А, В, С и D замещены одним или несколькими галогенными атомами, речь, в первую очередь, идет об атоме фтора, хлора или брома в положении 6 или 9а. Когда циклы А, В, С и D замещены одним или несколькими алкильными радикалами, речь, в первую очередь, идет о метильном или этильном радикале в положении 2, 6, 7 или 16а или 16р. Когда циклы А, В, С и D замещены одним или несколькими алкилоксильными радикалами, речь, в первую очередь, идет о метоксильном или этоксильном радикале в положении 3 или 11£і. Когда циклы А, В, С и D замещены одним или несколькими алкенильными радикалами, речь, в первую очередь, идет о винильном или алк-ильном радикале в положении, например, 11(3 Когда циклы А, В, С и D замещены одним или несколькими алкинильными радикалами, речь, в первую очередь, идет об этинильном радикале в положении, например, 11$ Предметом настоящего изобретения, в частности, является определенный выше метод, отличающийся тем, что на первом этапе используется соединение формулы (II), отвечающее формуле (ІГ): 50 сн он 55 (IIі) \ NHCHO 26794 в которой R," представляет собой атом водорода или метильный радикал, Ra' представляет собой метильный или этильный-радикал, циклы А, В, С и D могут включать одну или несколько двойных связей в положении 1(2), 3(4), 4(5) или 9(11) или 3(4) и 5(6) или 4(5) и 6(7) или 1(2) и 4(5) или 1, 3, 5 или 1(2), 4(5) и 6(7) и могут быть замещены одной или несколькими гидроксильными функциональными группами в положении 3, 9 и/или 11, одной или двумя кетоновыми функциональными группами в положении 3, и/или 11, одним или двумя атомами фтора, хлора или брома в положении 6 и/или 9а, одним или несколькими метильными или этильными радикалами а положении 2, 6, 7 и/или 16а или 16Ьр, одним или двумя метоксильными или этоксильными радикалами в положении 3 и/ или 11р винильным или алкильным радикалом в положении 11Ь или этинильным радикалом в положении 11р. Предметом настоящего изобретения, в частности, является определенный выше метод, отличающийся тем, что на первом этапе используется соединение формулы (II), отвечающее формуле (II"): 10 соединение формулы ННСНО 10 соединение формулы 15 20 25 соединение формулы 30 NHCHO NHCHO on 35 в которой либо пунктирная линия в полоили соединение формулы жении 9(11) представляет собой вторую 1 связь, a R3 и R4 являются атомом водоро- 40 да, либо пунктирная линия не представсн сн он ляет собой вторую связь, и R3 является атомом водорода, b-гидроксильным раNHCHO дикалом или радикалом оксо, a R4 является атомом водорода, либо R3 являет- 45 ся атомом водорода, a R4 представляет собой а-гидроксильный радикал. Таким образом, предметом настоящего изобретения, в первую очередь, является определенный выше метод, на 50 первом этапе используется: Окислитель, используемый в методе, являющемся предметом настоящего изобсоединение формулы ретения, может быть выбран в группе, состоящей из перкислот, например из над55 бензойной, метахлорнадбензойной, надуксусной, надянтарной, надфталевой, надсно муравьиной или надвольфрамовой кислоты, перекиси водорода, используемой самостоятельно или в присутствии гексахлорацетона или гексафторацетона, или 11 26794 гидроперекисей, например гидроперекиси трет-бутила, используемой в присутствии ацетилацетоната ванадия в каталитическом количестве. Предпочтение отдается перкислотам, в первую очередь, надфталевой кислоте. Само собой разумеется, что можно использовать, не выходя за рамки изобретения, перкислоту, полученную перед самым ее использованием, путем воздействия перекиси водорода на соответствующую кислоту или на соответствующий ангидрид. Используемым растворителем может быть спирт, например, метанол, этанол, изопропанол; эфир, например, тетрагидрофуран, диоксан; сложный эфир, например, этилацетат; кетон, например, ацетон, метилэтилкетон; амид, например, диметилформамид. Этим растворителем может также быть, например, ацетонитрил или уксусная кислота. Предпочтение следует отдавать, в первую очередь, предельным спиртам жирного ряда. При необходимости, операции можно производить в присутствии фазопереносчика, которым может быть, например, хлористый триэтилбензиламмоний или бромид тетрабутиламмония. Сольволизом соединения формулы (111) является, в первую очередь, алкоголиз, протекающий в присутствии основания, такого как шапочный гидроксид, например, едкий натр или едкое кали, или щелочной карбонат, например, карбонат натрия или калия, или в присутствии водного раствора сильной кислоты, которой может быть неорганическая или органическая кислота, такая как хлористоводородная, бромистоводородная, серная, уксусная. Основание может быть использовано в каталитическом количестве. В качестве спирта используется, в первую очередь, метанол или этанол. Сольволизом может также являться гидролиз, производимый с использованием вышеуказанных оснований. Как указано выше, на первом этапе метода, являющегося предметом изобретения, может использоваться соединение формулы (П), в которой гидроксильные и кетоновые функциональные группы, s случае их присутствия, защищены. Само собой разумеется, что в зависимости от типа защитной группы или защитных групп (то есть от их чувствительности или нечувствительности в кислой или щелочной среде), полученные соединения формулы (II!) и (I) могут содержать функциональные группы с аннулированной защитой, и 5 10 15 20 25 30 35 40 45 50 55 12 что во избежание этого следует выбрзть подходящую защиту. Специалистам будет нетрудно произвести подобный выбор. Предметом настоящего изобретения также является описанный выше метод, отличающийся тем, что операция выполняется без промежуточного выделения соединения формулы (til). До выполнения сольволиза формиата формулы (I) может оказаться предпочтительным нейтрализовать окисляющую способность среды. Соединения формулы (И), как правило, известны и описаны, в частности, в патенте ЕЭС ЕР 023856. Некоторые из указанных соединений, включающие гидроксильные или кетоновые функциональные группы, могут быть описаны только в защищенной форме или в форме с аннулированной защитой. Специалисту будет нетрудно получить из известного соединения ту или другую форму. Окисление енамидов формулы (II) надкислотами уже испытывалось ранее с целью получения соединения формулы (I). Рекомендуем, в частности, ознакомиться со статьей Неделека (Nedelec) и др. [J. Chem. Soc. Chem. Comm. (1981), с. 775]. В этой статье указывается, что опыты с соединением, содержащим ароматический цикл А, не дали положительных результатов, поскольку они привели к разрыву цепи в положении 17 с получением соответствующего 17-оксопроизводного. Другой опыт подобного типа в отношении прегна 4, 17(20)-диен-3-она описан в нижеследующей экспериментальной части. Согласно вышеуказанной статье, введение кислородсодержащей функциональной группы в цепь в положении 17 оказалось возможным только при использовании особого реактива: тетрауксусн о кислого свинца, в соответствии с методом, описанным Бартоном (Barton) и др. [J. Chem. Soc. Perkin. Trans. 1, (1975), с. 1242]. Указанный метод привел к промежуточному получению диацетата в положении 17а, 21. Именно этот частный метод был также использован для окисления 9а-ОН производного в патентной заявке ЕЭС 0336521, при этом указывается, что реактив преимущественно используется в безводной среде. При этом удалось сделать вывод, что особая енамидная цепь в положении 17 чрезвычайно непрочна при контакте с окислителями, в частности, с надкислотами. На основании информации, приведенных Неделеком и др., сделан вывод, что указанные енамиды, являющиеся ценны 13 26794 ми промежуточными звеньями при восстановлении цепи кортизоном в положении 17, требовали использования особого реактива, который, в первую очередь, является реактивом для гидроксилирования, а не для окисления. Метод, являющийся предметом настоящей заявки, позволил преодолеть указанное заблуждение, доказав, что в не слишком явных условиях реакции данного типа, а именно в присутствии воды, имеется возможность производить эффективное окисление енамидов формулы (II), в частности надкислотами, то есть а промышленных условиях, для получения соот- 15 ветствующих 17а, 21-дигидроксипроизводных. В качестве промежуточного продукта настоящего метода получают в положении 21 моноформиат [соединение (III)], который чрезвычайно легко поддается 20 гидролизу, в частности, путем алкоголизма в щелочной или кислой среде. В качестве новых промышленных продуктов и, в частности, в качестве промежуточных продуктов, необходимых для 25 внедрения метода изобретения, являются соединения формулы (IIP): о 30 R он сн 2 -о-сно . (Ill') 35 в которой R',, R'2 и циклы А, В, С и D такие, как определено выше, за исключением соединений, в которых R'2 представляет собой метильный радикал и либо R', представляет собой метильный радикал, в положениях 1 и 4 имеются две двойные связи, в положении 3 имеется радикал оксо, в положении 1 і - гидроксильный радикал или радикал оксо, или гидроксильный радикал в положении 11 и метильный радикал в положении 16р, либо R't представляет собой метильный радикал, в положении 4 имеется двойная связь, в положении 3 имеется кетоновая функциональная группа, а в положении 11 - атом водорода, гидроксильный радикал или радикал оксо, либо R', представляет собой метильный радикал, в положении 3 имеется гидроксильнай функциональная группа, а в положении 11 функциональная группа оксо, либо R', представляет собой атом водорода, в положении 4 имеется двойная связь, в по 40 45 50 55 14 ложении 3 имеется кетоновая функциональная группа и, в частности, соединение формулы: он сн -о-сно и соединение формулы: сн. сн -о-сно Соединения формулы (1), полученные в соответствии с методом настоящего изобретения, являются либо соединениями, известными своими терапевтическими свойствами, либо известными промежуточными продуктами, которые могут использоваться при приготовлении активных терапевтических соединений. Приводимые далее примеры иллюстрируют изобретению, вместе с тем не ограничивая его. П р и м е р 1. 11Р, 17а, 21Тригидрокси прегн-4-ен-3,20-дион (гидрокортизон). Этап А. 21-Формилокси 11р, 17адигидрокси прегн-4-ен-3,20-дион. В среде инертного газа смешивают 0,81 г 20-формамидо 11р, 21-дигидрокси прегна-4,17(20)-диен-3-она, 6,4 см 3 воды 3 и 6,4 см метанола. После этого при температуре 22-23°С, взбалтывая, добавляют 0,8 см 3 50-процентного раствора надфталевой кислоты (полученной на основе 2 г фталевого ангидрида, который за 15 мин растворяют при температуре 40°С в сме3 си 1 см 50-процентной перекиси водоро3 да и 2 см метанола), а затем, после взбалтывания в течение 1 ч 30 мин, еще 0,8 см 3 надфталевой кислоты и, через 4 3 ч, еще 0,5 см надфталевой кислоты. После взбалтывания в течение 3 ч смесь охлаждают до температуры 5°С, кристаллы обезвоживают и промывают водой и водным раствором бикарбоната натрия, после че 15 26794 го высушивают Таким образом получают 0,586 г искомого продукта. Инфракрасный спектр (вазелиновое масло): поглощение: 3420 и 3315" см"1 (ОН), 1735, 1715 и 1625 с м и (С = О формиат, 20-кето и Д4-3-кето). Спектр ЯМР (дим етил сульфоксид): 18СН3:0,77 (s); 19-CH 3 : 1,37 (s); Н„:4,27 (m); 1H (мобильн.):4,36 (d) и 5,44(s); COСН2-О:4Р83 (d) и 5,18 (d); H4 : 5,56 (s); ~СНО : 8,33 (s). Этап Б. 11р, 17а, 21-Тригидрокси прегн-4-ен-3,20-дион (гидрокортизон). В среде инертного газа смешивают 0,575 г продукта, полученного на этапе А, и 10 см 3 метанола, после чего добавляют 0,05 г карбоната калия. Полученную смесь взбалтывают в течение 30 мин и добавляют 0,7 см 3 1 н. серной кислоты. Затем выполняют концентрацию при пониженном давлении и остаток подвергают хроматографии на двуокиси кремния (элюант: трихлорметан-метанол (95:5)). В результате получают 0,502 г гидрокортизона, Пл, 210°С. вают водой, высушивают и доводят до сухого состояния. Таким образом получают 8,1 г целевого продукта, который можно подвергнуть очистке путем хроматографии 5 на двуокиси кремния (элюант: трихлорметан-метанол (95:5)). Пл. =238°С. [al D = +91° + 2,5° (с = 0,5% этанола). 10 15 20 25 [ а ] 0 = +151,6° (с = 1% ЕЮН). П р и м е р 2. Испытание в безводной среде. 8 среде инертного газа смешивают 0,05 г 20-формамидо 11р, 21-дигидрокси прегна-4,17(20)-диен-3-она и 0,5 см 3 метанола. При комнатной температуре добавляют 0,05 г надфталевой кислоты и взбалтывают в течение 20 ч. Хроматография реакционной среды в растворяющей системе метйленхлорид-метанол (95:5) выявляет отсутствие исходного продукта, з также полное отсутствие 21-формиата гидрокортизона и наличие значительного количества 11р-гидрокси андрост-4-ен3,17-диона, идентифицируемого путем сравнения с этанолом R,=0,39. Спектр ЯМР: (CDCL, 300 МГц): 1,17 (s) : 18-СН3 1,47 (s) : 19-СН3; 4,47 (д) : Н п (экваториальн.); 5,70 (d) : Н4. Приготовление 20-формамидо 11р, 21дигидрокси прегна-4,17 (20-диен-З-она. 9 г 3-этокси 11р, 21-дигидрокси 20формамидо прегна-3,5, 17(20)-триена (описанного в патенте ЕЭС ЕР 023856) растворяют в 90 см 3 уксусной кислоты с 5% воды и взбалтывают в течение 30 мин при комнатной температуре в среде инертного газа. Затем охлаждают примерно до 0°С, медленно добавляют 140 см 3 гидрата окиси аммония при 22°Боме и экстрагируют с использованием трихлорметэна. После этого органическую фазу промы 16 30 35 40 45 50 55 Инфракрасный спектр (вазелиновое масло): поглощение: 3435-3242 с м ' : (NH/OH); 1665-1655 с м 1 (С=О); 16101523 см ' (С=С сопряж. - NH деформ.). П р и м е р 3. 17а, 21-Дигидрокси прегн-4-ен-3,20-дион. Этап А: 21-Формилокси 17ос-гидрокси прегн-4-ен-3,20-дион. При комнатной температуре взбалтывают 2 г 20-формамидо 21-гидрокси прегна 4,17(20)-диен-3-она в 20 см 3 воды и 20 см 3 метанола. Затем при температуре 23°С медленно добавляют за 3 ч 30 мин 7 см 3 перкислоты, полученной из 2,66 г нафталевого ангидрида, 4 см 3 метанола и 1,9 см 3 50-процентной перекиси водорода, при 2-часовом взбалтывании. Реакционную среду взбалтывают и добавляют за 1 ч 20 см 3 , полученную взвесь взбалтывают, центрифугируют, промывают смесью метанола и воды (1:1), высушивают при пониженном давлении и получают 1,4 г сырого продукта, который подвергают хроматографии на двуокиси кремния (элюант : метиленхлорид-метанол (85:15), а затем (80:20)). В результате получают 0,9 г искомого продукта Пл. 186°С. Инфракрасный спектр: поглощение: 3615 см-1 ОН С+ассоцииров.); 1739 с м 1 ОН ] С=О; 1722 с м 1 20-кето; 1661 с м 1 3-кето Д4; 1615 с м 1 С=С. Этап Б: 17а, 21-Дигидрокси прегн-4ен-3,20-дион. В среде инертного газа в течение 30 мин смешивают 0,27 г продукта, полученного на этапе А, и 5 см 3 метанола, после чего добавляют 20 мг карбоната калия, взбалтывают в течение 10 мин, центрифугируют осадок, промывают его водой, высушивают при пониженном давлении и получают 0,204 г искомого продукта. Инфракрасный спектр (СНС1Э): поглощение: 3615 см-1 (ОН); 1708-1661 см-1 (С=О); 1615 см-1 (С=С). Приготовление 20-формамидо 21-гидрокси прегна-4,17(20) диен-3-она. Этап А: З-Этокси 3,5-андростадиен17-он. 17 26794 В среде инертного газа при температуре 65°С взбалтывают 50 г андрост-4-ен3,17-диона в 150 см 3 этанола в присутствии 50 см 3 этилортоформиата. После полного растворения добавляют 2,5 см 3 этанолового раствора серной кислоты (0,2 см 3 / 100 см 3 ). По истечении 1 ч после начала реакции, охладив до 60°С, а затем до 50°С, вызывают кристаллизацию, охлаждают до 25°С за 1 ч 30 мин, добавляют 10 см 3 воды, взбалтывают в течение 1 ч 30 мин, вновь добавляют 10 см 3 воды, взбалтывают в течение 40 мин, центрифугируют образовавшийся осадок, промывают его смесью воды и спирта (в соотношении (25:75), а затем (50:50)) и высушивают при пониженном давлении. Таким образом получают 46,5 г искомого продукта. Инфракрасный спектр (CHCI3): поглощение: 1732 см-1 (17-кето); 1652-1626 см"1 3(ЕЮ) 3,5-диен. Этап Б: З-Этокси 20-формамидо прегна 3,5,17(20)-триен-21-оат этила. 7 г трет-Бутилата калия растворяют в 38 См3 тетрагидрофурана, охлаждают до 0° /+5°С, добавляют за 20 мин 6,8 см 3 изоцианоацетата этила, растворенного в 38 см 3 тетрагидрофурана, взбалтывают в течение 15 мин, добавляют за 30 мин 15 г продукта, полученного на этапе А, в 75 см 3 тетрагидрофурана. Затем в течение 4 ч выдерживают при температуре от 0°С до +5°С, добавляют водный раствор хлорида аммония (7,5 г / 75 см 3 ), частично концентрируют при пониженном давлении при комнатной температуре. Затем в образовавшуюся взвесь добавляют 80 см 3 воды, осадок центрифугируют, промывают его водой, высушивают при пониженном давлении при температуре 35°С и получают 20,7 г искомого продукта. 5 10 15 20 25 30 35 40 Инфракрасный спектр (СНС13): поглощение: 3415 и 3390 см-1 (NH); 1695 см"1 ( О О ) ; 1652 и 1626 С У ( О С ) . 45 Этап В. 20-Формамидо 21-гидрокси прегна 4,17(20)-диен-3-он. 8 среде инертного газа охлаждают до температуры -5°С 10 см 3 алюмогидрида 3 лития в 100 см тетрагидрофурана, добав- 50 ляют 10 г продукта, полученного на этапе Б, а затем взбалтывают в течение 1 ч 30 мин при температуре 0°С. После этого добавляют 2 г хлорида аамония, а затем, дав температуре подняться до +10°С, до- 55 бавляют за 50 мин 40 см 3 раствора с 25% хлорида аммония. Взбалтывают в течение 15 мин, осадок центрифугируют, промывают смесью метиленхлорида и метанола (1*1), растворитель выпаривают и полу1 18 чают 10 г сырого продукта, который забирают 50 см 3 трихлорметана, добавляют 5 см 3 воды и 5 см 3 уксусной кислоты, взбалтывают в течение 1 ч, вновь добавляют 5 см 3 уксусной кислоты и взбалтывают в течение 5 ч. После этого выполняют нейтрализацию путем добавления 2 н. едкого натра, отстаивают, экстрагируют водную фазу с использованием метиленхлорида, высушивают и удаляют растворитель при пониженном давлении. После хроматографии на двуокиси кремния (элюант:метиленхлорид-изопропанол (от 3 до 12%)) получают 2,75 г целевого продукта. Инфракрасный спектр (СНСІ3): поглощение: 3610 см-1 (ОН); 3440 см ! (NH); 1672 см-1 (сопряж. кетон+формил.); 1616 см1 (ОС). П р и м е р 4. 17а, 21-дигидрокси прегна 4,9(11)-диен-3,20-дион. Этап А. 21-Формилокси 17а-гидрокси прегна 4,9(11)-диен-3,20-дион. При комнатной температуре взбалтывают 0,4 г 20-формамидо 21-гидрокси прегна 4,9(11), 17(20)-триен-3-она в 4 см 3 воды и 2 см 3 метанола. Затем при температуре 23°С медленно добавляют за 4 ч 30 мин 1,2 см 3 перкислоты, полученной из 0,532 г надфталевого ангидрида, 0,8 см 3 метанола и 0,4 см 3 50-процентной перекиси водорода, при взбалтывании при температуре 45°С. Реакционную среду продолжают взбалтывать и добавляют за 1 ч 4 см 3 воды, полученную взвесь взбалтывают в течение 30 мин, центрифугируют, промывают смесью метанола и воды (75:25), высушивают при пониженном давлении и получают 0,18 г сырого продукта, содержащего смесь искомого продукта и соответствующего эпоксида а 9,11. Инфракрасный спектр: поглощение. 1 1 3614 см- ОН (+ассоцииров.); 1740 с м ; 1 1 1722 см- 20-кето- 1666 см- 3-кето Д4; 1616 см-1 С=С. Этап Б. 17а, 21-Дигидрокси прегна 4,9( 11 )-диен-3,20-дион. В среде инертного газа в течение 30 мин смешивают 100 мг продукта, полу3 ченного на этапе А, и 1,9 см метанола, после чего добавляют 7,2 мг карбоната калия, взбалтывают в течение 30 мин, до3 бавляют 5 см воды, взбалтывают в течение 15 мин, центрифугируют осадок, лромывают его водой и высушивают при пониженном давлении. После хроматографии на двуокиси кремния (элюант:трихлорметан-изопропанол (95:5)) получают 43 мг искомого продукта и 35 мг соответствующего эпоксида «9(10). 19 26794 Инфракрасный спектр (CHCI3) кортинена: поглощение: 3520-3480 см ' (ОН); 1710-1660 с м 1 (С=О); 1610 с м 1 ( О С ) . Приготовление 20-формамидо 21-гидрокси прегна-4,9(11), 17(20)-триен-3-она Этап А. З-Этокси 3,5,9(11)-андростатриен-17-он. Операции выполняются, как на этапе А приготовления 3 с использованием, на начальной стадии, 50 г андрост 4,9(11)диен-3,17-она. В результате получают 37,4 г искомого продукта. Инфракрасный спектр (СНС13): поглощение: 1732 см-1 (17-кето); 1656-1629 с м 1 (3{ЕЮ) 3,5-диен. Этап Б. З-Этокси 20-формамидо прегна 3,5,9(11), 17(20)-тетраен-21-оат этила. Операции выполняются, как на этапе Б приготовления 3 с использованием 15 г продукта, полученного на вышеприведенном этапе А, в результате чего получают 20,1 г искомого продукта. Инфракрасный спектр (CHCI3): поглощение: 3417 и 3389 с м 1 (NH); 1697 с м ' ( О О ) ; 1656 и 1629 с м 1 ( О С ) . Этап В. З-Этокси 20-формамидо 21гидрокси прегна 3,5,9(11), 17(20)-тетраен. 2,5 г енамида, полученного на этапе Б, добавляют за 30 мин в 2,8 см 3 алюмогидрида лития в 25 см 3 тетрагидрофурана, охлажденного до 0° / 5°С. Затем смесь взбалтывают в течение 15 мин, добавляют за 45 мин 1,6 см 3 30-процентного водного Упорядник Замовлення 530 5 10 15 20 25 30 20 раствора первичного фосфата натрия, а затем 10 см 3 тетрагидрофурана и взбалтывают в течение 1 ч 30 мин, давая температуре подняться до комнатной. После этого производят фильтрацию, промывают смесью тетрагидрофурана и трихлорметана (1:1), а затем смесью трихлорметана и этанола (2:1). Растворители фильтрата выпаривают, остаток подвергают хроматографии на двуокиси кремния {элюант: метиленхлорид-изопропанол) (92,5:7,5 при 2%о триэтиламина) и получают 1,49 г искомого продукта. Инфракрасный спектр (CHCI3): поглощение: 3437 см 3 (NH); 1608 ом 1 ( О О ) ; 3612 с м 1 (ОН); 1657 и 1629 с м ' (ЕЮ)3,5диен. Этап Г. 20-Формамидо 21-гидрокси прегна 4,9(11), 17(20)-триен-3~он. В течение 3 ч 30 мин в среде инертного газа взбалтывают 1 г продукта, полученного на этапе В, в 5 см 3 воды с добавлением 5 см 3 99,5-процентной уксусной кислоты. Затем полученную смесь вливают в смесь воды и льда, добавляют 2,9 г бикарбоната натрия, экстрагируют водную фазу с использованием метиленхлорида, высушивают, выпаривают растворитель, остаток подвергают хроматографии на двуокиси кремния (элюант: метиленхлорид-изопропанол (92:8), и получают 0,55 г целевого продукта. Техред М. Келемеш Коректор О. Обручар Тираж Підписне Державне патентне відомство України, 254655 ГСП, Киів-53, Львівська пл., 8 Відкрите акціонерне товариство "Патент", м. Ужгород, вул. Гагаріна. 101
ДивитисяДодаткова інформація
Автори англійськоюViva Mechel
Автори російськоюВива Мишель
МПК / Мітки
МПК: A61K 31/57, C07J 5/00, C07J 7/00, C07J 41/00
Мітки: продукти, 17альфа, прегнану, 20-оксо, одержання, 21-дигідроксипохідних, одержані, проміжні, спосіб
Код посилання
<a href="https://ua.patents.su/10-26794-sposib-oderzhannya-20-okso-17alfa-21-digidroksipokhidnikh-pregnanu-ta-oderzhani-promizhni-produkti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 20-оксо, 17альфа, 21-дигідроксипохідних прегнану та одержані проміжні продукти</a>
Попередній патент: Спосіб безперервної магнітної сепарації слабомагнітних матеріалів та пристрій для його здійснення
Наступний патент: Хелатні комплекси азитроміцину, які мають антацидну дію
Випадковий патент: Синергічна гербіцидна/інсектицидна композиція, що містить певні піридинкарбонові кислоти і деякі інсектициди