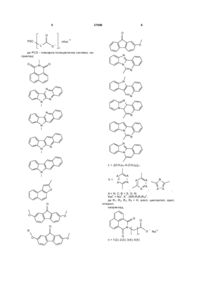
Карбоксипохідні планарних поліциклічних сполук як індукуючі інтерферон противірусні агенти
Номер патенту: 37680
Опубліковано: 10.12.2008
Автори: Андронаті Сергій Андрійович, Ляхова Олена Анатоліївна, Ляхов Сергій Анатолійович, Доровських Ірина Вікторівна, Жолобак Надія Михайлівна, Співак Микола Якович, Погосова Юлія Олексіївна, Мальцев Георгій Володимирович, Шибінська Марина Олегівна, Карпенко Олександр Сергійович
Формула / Реферат
Карбоксипохідні планарних поліциклічних сполук загальної формули:
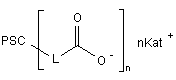 ,
,
де:
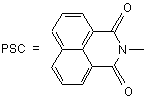 ;
;
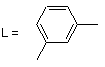 ;
;
aбo L = -(CH2)m-, m = 1, 2, 3, 5;
або
 ; де L = -(CH2)m-; m = 2, 3;
; де L = -(CH2)m-; m = 2, 3;
або
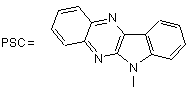 ; де L = -(CH2)- ;
; де L = -(CH2)- ;
або
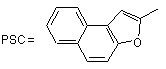 ;
;
або
 ; де L = -ОСН2-;
; де L = -ОСН2-;
де R - С2Н5, -ООССН2;
дe Kat+ = Na+, n = 1, 2;
як противірусні агенти та індуктори інтерферону.
Текст
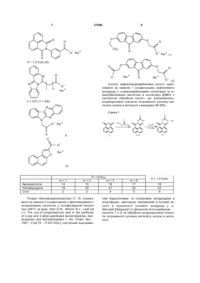
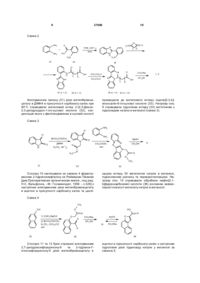
Карбоксипохідні планарних поліциклічних сполук загальної формули: Сьогодні вже очевидним є те, що індуктори ендогенного інтерферону є одним з найперспективніших класів противірусних агентів [див. Співак М.Я, Карпов О.В., Жолобак Н.М., Назаренко Л.М., 3 37680 Тимошок Н.О., Зощенко В.М., Грабченко Н.І., Ганова Л.О., Ми хайленко О.М. Індуктори інтерферону - від теорії до практики// Мікробіологичний Журнал. - 2003 - Т.65 - №1-2 - С.191-204.]. Ілюстрацією тому є широке й успішне застосування в клінічній практиці таких препаратів як аміксин, циклоферон, неовір, арбідол, амізон. Але проблему не можна вважати вирішеною з огляду на те, що достатньо значна частина пацієнтів відрізняється гіпореактивністю відносно індукторів, різною є й їх ефективність при різних захворюваннях інфекціоного походження. Тому пошук нових низько токсичних та ефективних індукторів все ще залишається актуальним завданням. Найближчий аналог за структурою та дією до сполук, що заявляються, є карбоксиметилакридон - СМА, 2-(9,10-дигідроакридин-10-іл)оцтової кислоти (1, де X = Н) - неовір (1, де X = Na) і циклоферон (1, де X = МГА) - є представником численної групи поліциклічних планарних карбо- і гетероциклічних сполук, більшість з яких здатна інгібувати вірусну репродукцію й індукувати інтерферон [див. Співак М.Я., Андронаті С.А., Ляхов С.А., Карпов О.В., Жолобак Н.М., Литвинова Л.О., Шай Д.Р. Індуктори інтерферону як противірусні агенти: нові аспекти старої проблеми// Журнал органічної та фармацевтичної хімії. - 2007. - Т.5. - №1. - С.4-20], для якого запропоновано взаємодію зі спеціальними рецепторами клітинної поверхні [див. Piasecki E., Inglot A.D., Czyrski J. A. et al. Interaction of sodium salt of 9-oxo-10-acrideneacetic acid (CMA) and its analogs with serum albumin. A model for study on binding of the interferon inducer with receptor// Arch. Immunol. Ther Exp. - 1985. - Vol.33. P.299-310.]. O 4 Поставлена задача вирішена синтезом сполук загальної формули: O PSC O L nKat + n де: O PSC = N O ; L= де ; aбo L = -(CH 2)m-, m = 1, 2, 3, 5; або N PSC = N N ; де L = -(CH2)m-; m = 2, 3; або N PSC = N N ; де L = -(CH2)- ; або N O O+ + X = H , Na+, HO HO HO PSC = ; або O HO O X+ (МГА) NH+ 2 H3C Однак, до сьогодення такі рецептори ще не знайдені і механізм реалізації його інтерфероногенної та противірусної активності все ще невідомий. В основу корисної моделі поставлено задачу знайти противірусні агенти та індуктори інтерферону серед карбоксипохідних планарних поліциклічних сполук. PSC = O R O ; де L = -ОСН2-; де R - С2Н5, -ООССН2; дe Kat+ = Na+, n = l, 2; яки проявили себе противірусними агентами та індукторами інтерферону. Причинно-наслідковий зв’язок між структурою об’єктів, що заявляються, і їх біологічною дією полягає, очевидно, у здатності планарних поліциклічних сполук до взаємодії із системою регуляції експресії генів, у тому числі інтерферона. Були синтезовані сполуки загальної структури 5 37680 6 O O PSC O L nKat + O n де PCS - планарна полициклична система, наприклад: O N O N N N N N N N N N N N N N N N N N N N L = -[(CH 2)m-X-(CH2)p ]q -, N A X= A A O O O O O N R n O B A A A A A A ; ; , A = N, С; В = S, О, N; Kat+ = Na+, K+, (NR 1R2R3R4)+, де R1, R2, R3, R4 = H, алкіл, циклоалкіл, арил, гетерил; наприклад, O O A O O n = 1(2); 2(3); 3(4); 5(5) O Na + 7 37680 O 8 O O N O CH3 O Na + O X = 1,3-C 6H4 (6) O N O O - Na + 11 O Na + O N n O O O N O O Na + O O - 12 Синтез нафталімідокарбонових кислот здійснювали за схемою 1 конденсацією нафталевого ангідриду з w-амінокарбоновими кислотами та мамінобензойною кислотою в киплячому ДМФА з наступною обробкою кислот, що утворювались, розрахунковою кількістю титрованого розчину метилату натрію в метанолі з виходами 80-95%. Na + n = 2(7); n = 3(8) N Схема 1 N O O N O O - Na + O O O X O H2 N X OH N O X OH O N CH 3OH OO Na + CH3 ONa O O 9 O O 13 2-6 14-18 Na + 10 X = (СН2)m Амінокислоти: Напівпродукти Солі m =1 14 19 2 m =2 15 20 3 Похідні бензоімідазохіназоліну (7, 8) отримували за схемою 2 конденсацією о-фенілендіаміну з антраніловою кислотою у поліфосфорній кислоті при 250°С за [див. Hein D.W., Alheim R.J., LeaГцitt J.J. The use of polyphosphoric asid in the synthesis of 2-aryl and 2-alkyl-substituted benzimidazoles, benzo xazoles and benzothiazoles// J. Am. Chem. Soc. 1957. -Гцol.79. - P.427-429.], наступним ацилюван m =3 16 21 4 m =5 17 22 5 Х = 1,3-С6Н4 18 23 6 ням бурштиновим та глутаровим ангідридами в хлороформі, циклізацію нагріванням в оцтовій кислоті в присутності оцтового ангідриду у w(бензо[4,5]імідазо[1,2-с]хіназолін-6-іл)-карбонові кислоти 7 и 8 та обробкою розрахунковою кількістю ти трованого розчину метилату натрію в метанолі. 9 37680 10 Схема 2 O NH2 O ПФК, 250 С + 60% HO NH2 N H H2N 24 25 n H2 N 26 O O N H N O O N 0 N CH 3CO 2H NH O N (CH3 CO)2 O OH n CH3ONa N 7, 8 CH 3OH OH n 27 (n = 2) 29 (n = 2) 28 (n = 3) Алкілуванням ізатину (31) дією метилбромоацетату в ДМФА в присутності карбонату калію при 80°С отримували метиловий естер 2-(2,3-Дюксо2,3-дигідрошдол-1-іл)-оцтової кислоти (32), конденсація якого з фенілендіаміном в оцтовій кислоті 30 (n = 23 призводила до метилового естеру індоло[2,3-b]хіноксалін-6-іл-оцтової кислоти (33). Натрієву сіль 9 отримували гідролізом естеру (33) кип’ятінням з гідроксидом натрію в метанолі (схема 3). Схема 3 NH2 O O NH2 BrCH 2COOCH3 N H O ДМФА 0 K2CO3, 80 C N NaOH O CH 3COOH, кип. O N N 9 N O H 3C CH3 OH O O CH3 31 32 33 Сполуку 10 синтезували за схемою 4 формілуванням 2-гідроксинафталіну за Реймером-Тіманом [див.Препаративная органическая химия., под ред. Н.С. Вульфсона. –М.: Госхимиздат, 1959. - с.326] з наступним алкілуванням дією метилбромоацетату в ацетоні в присутності карбонату калію та циклі зацією естеру 35 метилатом натрію в метанолі, підкисленням розчину та перекристалізацією. Натрієву сіль 10 отримували обробкою нафто[2,1b]фуранкарбонової кислоти (36) розчином еквімолярної кількості метилату натрію в метанолі. Схема 4 CH3 OH O 1) CHCl3/NaOH 2) BrCH2 COOCH 3 K2 CO 3, (CH3 )2CO кип. 34 HO O O O O AcOH CH 3ONa CH 3 OH 10 O CH 3ONa H 35 Сполуки 11 та 12 були отримані алкілуванням 2,7-дигідроксифлуоренону-9 та 2-гідрокси-7етоксифлуоренону-9 дією метилбромоацетату в 36 ацетоні в присутності карбонату калію з наступним гідролізом дією гідроксиду натрію у метанолі за схемою 5. 11 37680 12 Схема 5 N O N OH BrCH 2COOCH 3 K2 CO3 , (CH3 )2 CO кип. R O O O NaOH O R O H3 C R = C 2H 5 (37) O 11, 12 CH 3 OH R = C 2H 5 (38) R = CH3 OOCCH2 ( 39) R = CH 3OOCCH 2 (40) Сполуки 2-12, синтезовані нами як аналоги циклоферону за ознакою наявності водночас поліциклічної системи та аніоногенної карбоксильної групи, в цілому виявились аналогами циклоферону за дією. Цитотоксичність синтезованих сполук виявилась дуже низькою. Для усіх сполук діапазон про яву цитотоксичних ефектів знаходиться у мілімолярному діапазоні концентрацій. Найменша токсична концентрація (див.таблиця 1) становить близько 1,3мМ для сполуки 9, а найменш токсичні сполуки (2 та 6) практично однакові за токсичністю з циклофероном. Таблиця 1 Цитотоксичність синтезованих сполук Сполука 2 3 4 5 LC50, mM >36 3,1 16.4 15 Сполука 6 7 8 9 Інтерфероніндукуючі властивості синтезованих сполук, за винятком сполуки 2, на клітинах L929, аналогічно циклоферону, індукували інтерферон у мікромолярному діапазоні концентрацій LC50, mM >30,5 >1,5 >1,4 >1,3 Сполука 10 11 12 Циклоферон LC50, mМ 2,4 >2,6 >1,4 34 (див. таблиця 2), причому сполука 11 виявилась більш активна за циклоферон, індукуючи синтез тих же титрів, але при меншій концентрації. Таблиця 2 Інтерфероніндукуючі властивості на клітинах L929 Сполука 2 3 4 5 6 7 ТІФН Н.в. 1:12 1:10 1:24 1:16 1:32 С, mМ 0.5 1 0,9 0,9 2,3 Сполука 8 9 10 11 12 Циклоферон ТІФН 1:32 1:28 1:8 1:32 1:8 1:32 С, mМ 2,3 1 25,6 0,9 0,5 1,2 Примітка: Н.в. - інтерферон у культуральному середовищі не визначається; титр інтерферону у контролі становив 2-4 Ступінь противірусної дії синтезованих сполук при одночасному їх введенні із вірусом (див. таблиця 3), в цілому, виявилась дещо нижчою за дію циклоферону, хоча для більшості сполук вона проявлялась при концентраціях менших, ніж для останнього. Сполуки 9 та 12 справляли противірусну дії однакову за циклоферон при концентраціях у 30 разів менших, a 11 - у 15 разів. На клітинах L929, які є значно кращими продуцентами за перевивних тестикул поросяти (ПТП) , противірусна активність аніонних індукторів виявилась значно вищою та, здебільшого, не поступалася активності циклоферону. 13 37680 14 Таблиця 3 Противірусна активність сполук 2-12 (клітини ПТП, 100 LD50 ВВС, введення одночасне з вірусом) Сполука 2 3 4 5 6 7 ІС50, мМ 1,13 1 1 0,23 0,23 Н.в. Еmax,% 50 50 50 70 80 С, мМ 1,13 1,07 1,02 0,94 0,92 Сполука 8 9 10 11 12 Циклоферон ІС50, mМ Н.в. 0,26 13,2 0,5 – Еmax,% 80 50 80 50 100 С, мМ 0,04 13,2 0,09 0,04 1,30 Таблиця 4 Противірусна активність сполук 2-12 (клітини L929, 100LD50 BBC, введення за 24г перед внесенням вірусу) Сполука 2 3 4 5 6 7 ІС50, mМ 1.13 4.3 1.0 Н.в. Н.в. Emax,% 100 50 100 100 С, mМ 18 4,3 2 1,9 Сполука 8 9 10 11 12 Циклоферон Досліджені нами карбоксилвмісні поліциклічні планарні сполуки, що складають досить структурно широку гр упу, в цілому проявили себе як індуктори інтерферону та противірусні агенти з цілком зрозумілими, з огляду на різноманітність будови, відхиленнями у ступені прояву активності та концентраційних діапазонах дії. Важко собі уявити будь-який, окрім ДНК, загальний для всієї групи рецептор. Таким чином,смА (в його різних формах) не є, якоюсь унікальною сполукою - індуктором інтерферону та противірусним засобом, а є лише одним з представників загальної широкої групи сполук, суттєвими структурними дескрипторами якої є наявність планарної поліциклічної системи та карбоксильної групи. Тонкі особливості зв’язку структура-активність та механізми реалізації інтерфероніндукуючої та противірусної дії цих сполук безумовно підлягають подальшому дослідженню так само, як і механізм їхньої взаємодії з ДНК. Отримання сполук, що заявляються, підтверджено наступними прикладами: Приклад 1. 2-Оксі-7-етоксіфлуоренон-9 (37). Суміш 2.12г (0.01 моль) 2,7-діоксіфлуоринону-9, 0.95см (0.015 моль) йодистого етилу та 2.4г (0.018 моль) тонко розтертого безводного карбонату калію кип’ятили в 50см 3 ацетону при перемішуванні до закінчення реакції (приблизно 16год.). Реакційну суміш фільтрували, осад на фільтрі промивали гарячим ацетоном (2x10см), об’єднаний фільтрат випарювали досуха, твердий залишок перекристалізовували з етанолу. Осад, отриманий після фільтрування реакційної суміші, суспендували у воді, ретельно перемішували та підкислювали до рН 340°С. Аналогічно одержують сполуки 3-6, 10. Приклад 12. 4-(1,3-діоксо-1Н,3Нбензо[dе]ізохшолін-2-іл)-пропанової кислоти натрієва сіль (3). Вихід: 88%. C 15H10NO4Na. M.W. 291.24. Т пл. > 300°С. Приклад 13. 4-(1,3-діоксо-1Н,3Нбензо[dе]ізохінолш-2-іл)-бутанової кислоти натрієва сіль (4). Вихід: 92%. C 16H12NO4Na. M.W. 305.35. Т пл. > 250°С. Приклад 14. 6-(1,3-діоксо-1Н,3Нбензо[dе]ізохінолш-2-іл)-гексанової кислоти натрієва сіль (5). Вихід: 95%. C 18H16NO4Na. M.W. 333.32. Т пл. > 250°С. Приклад 15. 3-(1,3-діоксо-1Н,3Нбензо[dе]ізохінолін-2-іл)-бензойної кислоти натрієва сіль (6). Вихід: 96%. C 19H10NO4Na. M.W. 339.28. Т пл. > 340°С. Приклад 16. Нафто[2,1-b]фуран-2-карбонової кислоти натрієва сіль (10). Вихід: 94%. C13H9O 3Na. M.W. 334.26. Т пл. > 250°С. Приклад 17. 2-(2-Амінофеніл)бензімідазол (26) В 400см 3 поліфосфорної кислоти, вносили суху суміш, що складалася з тонко розтертої 28.1г (0.2 моль) 25 і 21.6г (0.2 моль) 24 і нагрівали при інтенсивному перемішуванні до 250 - 260°С протягом 2.5год. Реакційну суміш охолоджували до 100°С, при інтенсивному перемішуванні виливали в 4000см 3 дистильованої води, доводили рН розчину до 9 додаванням 50%-ого розчину NaOH. Осад, який випав, відфільтровували, промивали на фільтрі водою до нейтрального рН промивної води та перекристалізовували з етанолу. Вихід 13.2г (31%). C13H11N3. M.W. 209.25. Т.пл. = 214.5 215.0°С. (Літ. Т. пл. = 213 - 214°С [Hem D.W., Alheim R.J., Leavitt J.J. The use of polyphosphoric asid in the synthesis of 2-aryl and 2-alkyl-substituted benzimidazoles, benzoxazoles and benzothiazoles// J. Am. Chem. Soc. - 1957. - Vol. 79. - P. 427 - 429]). Rf = 0.36 (хлороформ : ацетон (10 : 1)), Rf = 0.55 (бензол : триетиламін (10:1), в UV-254 пляма флуоресцує. Мас-спектр (електронний удар), m/z (%): 209 (100) [М]+,182 (12), 118 (7), 104 (17). Приклад 18. 3-[2-(1Н-бензімідазол-2іл)фенілкарбамоїл]пропіонова кислота (27). До гарячої суспензії 2г (0.01 моль) 26 в 150см 3 хлороформу додавали гарячий розчин 3г бурштинового ангідриду в 20см 3 хлороформі, кип’ятили 2хв., після чого нагрівання припиняли. Випадав осад продукту. Реакційну суміш знову доводили до кипіння та кип’ятили ще 5хв. після чого нагрівання знову припиняли. Операцію повторювали 6 разів, після чого відфільтровували реакційну суміш гаря 17 37680 чою. Осад з фільтру переносили у стакан, додавали 20см 3 хлороформу, доводили до кипіння та відфільтровували. Операцію повторювали 3 рази. Продукт використовували на наступній стадії без додаткового очищення. Вихід 2.8г (91%) M.W. 309.33 C17H15N3O3 . Т.пл. > 220°С (разл.). Rf = 0.02 (елюент - бензол : триетиламин : метанол, 10:1:1). Приклад 19. 3-Бензімідазо[1,2-с]хіназолін-6ілпропанова кислота (29). Розчиняли 6.2г (0.02 моль) 27 у суміші 30см крижаної оцтової кислоти та 60см оцтового ангідриду, відфільтровували через паперовий фільтр та охолоджували. Осад, що випав, відфільтровували, промивали на фільтрі оцтовою кислотою, дистильованою водою до нейтрального рН промивної води та висушували. Вихід 4.8г (82%). M.W. 291.31 C 17H13N3O 2. Приклад 22. 3-Бензімідазо[1,2-с]хіназолін-6ілпропанової кислоти натрієва сіль (7). Суспендували 1.46г (0.005 моль) 29 в 5см 3 абсолютного метанолу й додавали за один раз розчин 0.32г (0.006 моль) метилату натрію в 0.5см метанолу. Суспензія гомогенізувалася. До отриманого розчину додавали 15см 3 діетилового етеру, осад, що випав, відфільтровували, промивали на фільтрі діетиловим етером (3x5см 3). Вихід 1 .3г (83%). M.W. 313.29 C17H12N3NaO2. Приклад 23. 4-[2-(1Н-бензімідазол-2іл)фенілкарбамоїл]бутанова кислота (28). Вихід 3.4г (53%). M.W. 323.35. C18H17N3O 3. Т. пл. = 315 316°С (с розкл.). Спектр -Н ЯМР: аліфатичні протони: м. 1.95 - 2.04 м.ч. (2Н), т. 2.35 м.ч. (2Н), т. 2.54 м.ч. (2Н); ароматичні протони: м. 7.22 -7.31 м.ч. (3Н); м. 7.45 - 7.50 м.ч. (1Н); д. 7.58 м.ч. (1Н); д. 7.76 (1H); д. 8.10 м.ч. (1Н); д. 8.69 м.ч. (1Н); протони, що обмінюються: д.ш.с. 12.15 м.ч. (1Н); с 13.01 м.ч. (1H); ш. с 13.15 м.ч. (1Н). Приклад 24. 4-Бензімідазо[1,2-с]хіназолін-6ілбутанова кислота (30). Вихід 4.7г (77%). M.W. 305.34 C18H15N3O2. Т. пл. > 315°С (возг. з розкл.).Спектр 1Н ЯМР: аліфатичні протони: м. 2.18 2.28 м.ч. (2Н), т. 2.56 м.ч. (2Н), т. 3.52 м.ч. (2Н); ароматичні протони: м. 7.48 - 7.53 м.ч. (1Н); м. 7.56 - 7.61 м.ч. (1Н); м. 7.67 - 7.73 м.ч. (1H); м. 7.80 7.92 м.ч. (2Н); д. 7.95 м.ч. (1Н); д. 8.25 м.ч. (1Н); д. 8.54 м.ч. (1H). Приклад 25. 4-Бензімідазо[1,2-с]хіназолін-6ілбутанової кислоти натрієва сіль (8). Вихід 1.1г (83%). M.W. 328.33 C18H15N3NaO2. Т. пл. > 350°С (розкл.). Приклад 26. 2-(2,3-Діоксо-2,3-дигідроіндол-1іл)-оцтової кислоти метиловий естер (32). До розчину 10г (0.068 моль) 31 в диметилформаміді додавали 13.8г (0.1 моль) карбонату калію і 7.6см (12.2г, 0.08 моль) метилбромоацетату. Суміш нагрівали до 70°С, включали перемішування й підтримували таку температуру 10год., о холоджували, осад відфільтровували, промивали на фільтрі ДМФА (3х15см 3). Фільтрат випаровували, сухий залишок розчиняли у воді (500см 3), екстрагували хлороформом (4х150см 3). Хлороформ висушували сульфатом натрію та випарювали. Сухий залишок перекристалізовували з бензолу. Вихід: 11.7г (78%). С11Н9NO4; M.W. 219.20. Т пл.= 119 - 120°С. Спектр 1Н ЯМР: аліфатичні протони: с 3.755 м.ч. (3Н), с 4.480 м.ч. (2Н); ароматичні протони: д. 18 6.790 м.ч. (1Н); т. 7.130 м.ч. (1Н); м. 7.523 - 7.643 м.ч. (2Н). Приклад 27. Індоло[2,3-b]-хіноксалін-6-ш оцтової кислоти метиловий естер (33) Суміш 24.5г (0.112 моль) 32 і 14.5г (0.134 моль) офенілендіаміну розчиняли в оцтовій кислоті і кип’ятили при перемішуванні протягом 6год. Реакційну суміш о холоджували. Осад, що при цьому випав, відфільтровували, промивали на фільтрі оцтовою кислотою (3х15см 3), висушували та перекристалізовували з діоксану. Вихід: 20г (61%). C17H13N3 O2; M.W. 291.31. Т пл. = 210 - 211°С. Масспектр, m/z (%): 291 (31), 232 (100), 129 (6), 102 (6). Спектр ‘Н ЯМР: аліфатичні протони: с. 3.747 м.ч. (3Н), с. 5.222 м.ч. (2Н); ароматичні протони: д. 7.332 м.ч. (1Н), т. 7.392 м.ч. (1Н); м. 7.595 - 7.788 м.ч. (3Н); д.д. 8.110 м.ч. (1Н); д.д. 8.340 м.ч. (1H); д. 8.519 м.ч. (1H). Приклад 28. Індоло[2,3-b]-хіноксалін-6-іл оцтової кислоти натрієва сіль (9). У розчин 5.1г (0.0175 моль) 33 у 200см 3 метанолу додавали розчин 0.876г (0.0219 моль) NaOH у 10см 3 води. Реакційну суміш кип’ятили при перемішуванні протягом 2год., потім охолоджували. Осад, що при цьому випав, відфільтровували, промивали на фільтрі метанолом (3x5см ). Вихід: 5г (95%). C 16H10N3Na02; M.W. 299.27. Т пл. > 250°С. Приклад 29. Метиловий естер (1формілнафталін-2-оксі)оцтової кислоти (35) До конічної колби об’ємом 300см 3 вносили 17.2г (0.1 моль) 2-гидроксинафтальдегіду, 20.7г (0.15 моль) карбонату калію, 150см 3 ацетону, 14.2см 3 (23г, 0.15 моль) метилбромоацетату та кип’ятили з зворотнім холодильником при ефективному перемішуванні 8год. Контролювали хід синтезу за ТШХ (елюент - суміш хлороформу з ацетоном 10:1), обробляючи хроматограму розчином хлористого заліза. Реакційну суміш охолоджували, відфільтрували, осад на фільтрі промивали ацетоном. Фільтрат впаровували досуха. Сухий залишок промивали гарячою водою (4х50см) та перекристалізовували з метанолу й висушували. Вихід 72%. С14Н12О 4. M.W. 244.25. Тпл = 112.5 114.0°С. Спектр 1Н ЯМР: аліфатичні протони: с 3.804 м.ч. (6Н); с 4.866 м.ч. (2Н); ароматичні протони: д. 7.119 м.ч. (1H), м. 7.456 м.ч. (1Н); м. 7.648 м.д. (1H); д. 7.773 м.ч. (1Н), д. 8.025 м.ч. (1Н), д. 9.281 м.ч. (1Н). с 10.971 м.ч. (1Н). Приклад 30. Нафто[2,1-b]фуран-2-карбонова кислота (36). В конічній плоскодонній колбі розчиняли 12.2г (0.05 моль) альдегіду 35 у 150см 3 теплого (45°С) метанолу. При перемішуванні повільно додавали 57см 3 розчину метилату натрію в метанолі (6г натрію в 250см 3 метанолу) та кип’ятятили при перемішуванні 4год. Після закінчення реакції синтез охолоджували, випаровували 200см 3 метанолу та розбавляли п’ятикратним об’ємом 10%-го розчину оцтової кислоти. Осад відфільтровували та промивали водою. Вихід 76%. С13Н8О3 . M.W. 212.21. Тпл > 335°С. Спектр 1Н ЯМР: м. 7.52 - 7.47 м.д. (1H); м. 7.62 - 7.68 м.д. (1Н); д. 7.83 м.д. (1Н); д. 7.95 м.д. (1Н); д. 8.06 м.д. (1Н); с 8.08 (1H); д. 8.39 м.д. (1Н). 19 37680 Приклад 31. Визначення цитотоксичності препаратів в умовах in vitro клітин за дією на моношар клітин та пригніченням їх життєздатності. Перещеплювану культур у клітин фібробластів свиней - перевивних тестикул поросяти (ПТП) вирощували у 96-лункових мікроплатах (в атмосфері, що містить 5% СО2). Через 24год з лунок, де сформувався суцільний моношар клітин видаляли середовище росту і вносили підтримуюче середовище та розчинені препарати в діапазоні концентрацій від 5 до 500мкг/см 3 (на одне розведення не менше 4 лунок). Контроль - лунки, в які було внесене тільки середовище для підтримання росту. Плати поміщали в термостат. Через 24 та 48год після інкубації плат при 36°С в умовах 5% СО2 клітини проглядали за допомогою інвертованого мікроскопу при малому збільшенні з метою виявлення цитопатичної дії (ЦПД) препаратів, яку оцінювали за порушенням цілісності моношару, появою осередків дегенерованих клітин та визначали за чотириплюсовою системою. Визначали: ТЦД100 - тканинну цитотоксичну дозу (мкг/см 3), що викликає повну деструкцію клітин, ТЦД50 - тканинну цитотоксичну дозу (мкг/см 3), що викликає зміну 50% моношару клітин; МВК - максимально витримувану концентрацію - максимальну із досліджених доз речовини (мкг/см 3), що не викликає незворотніх змін у морфології та життєздатності клітин у порівнянні з контролем (фактично вона відповідає ТЦД0). Розрахунок ТЦД50 проводили за методом Ріда і Менча за формулами: log2 ТЦЦ50 = log 2 A - (50 - b) log 2d / (а - b) чи log2 ТЦЦ50 = log 2 В + (a - 50) log 2d / (a - b), де Iog2 А і log2 В - логарифми концентрацій за основою 2, що викликали ефекти відповідно більше чи менше 50%, але найближчі до 50%: а і b ефект, викликаний концентраціями А і В,%: Iog2d логарифм за основою 2 співвідношення між досліджуваними концентраціями. Другим параметром, за яким оцінювали токсичність доз препаратів було пригнічення їх життєздатності, [див. Методы испытания и оценки противовирусной активности химических соединений в отношении вируса гриппа. Методические указания. Сост. проф. В.И. Ильенко. -Л.: - 1977. - 35с]. Підрахунок клітин та визначення їх життєздатності через 24 та 48 годин інкубації проводили після фарбування клітин водним розчином вітального фарбника трипанового синього. При відсутності токсичного ефекту клітини засвоювали вітальний барвник. Забарвлення контрольних культур приймали за 100%. Розведення препарату, що викликало засвоєння фарбника на 50% вважали токсичним. Комп’ютерна в ерстка Д. Шев ерун 20 Приклад 32. Вивчення інтерфероніндукуючи х властивостей. Інтерфероніндукуючу активність синтезованих сполук вивчали як описано [див. Доклінічні дослідження лікарських засобів. Методичні рекомендації. За редакцією член-кореспондента АМН України О.В. Стефанова.// Міністерство охорони здоров’я України. Державний фармакологічний центр., Київ, 2001. С.392]. Інтерфероніндукуючу активність препаратів в умовах in vitro вивчали в культурі клітин ПТП. Препарати в різних дозах (30 - 250мкг/см 3) додавали до сформованого моношару клітин і культивували при 37°С на протязі 24 та 48год, після чого надосадову рідину збирали і в ній визначали активність інтерферону за раніше опублікованою методикою, [див. Доклінічні дослідження лікарських засобів. Методичні рекомендації. За редакцією членкореспондента АМН України О.В. Стефанова.// Міністерство охорони здоров’я України. Державний фармакологічний центр., Київ, 2001. С.392] (пригнічення цитопатогенної дії вірусу везикулярного стоматиту). Визначення активності інтерферону здійснювали через 24 - 48 годин, коли доза внесеного вірусу везикулярного стоматиту (ВВС) 100 ТЦД50 викликає повну дегенерацію клітин у контролі вірусу (KB) за відсутністю дегенерації у неінфікованій культурі. За титр інтерферону в одиницях дії (ОД) приймали величину, зворотну розведенню препарату, при якому культура клітин в 50% лунок була повністю захищена від цитопатогенної дії індикаторного вірусу. Титр індукованого інтерферону (максимальне розведення супернатанту, при якому в 50% лунок цілком запобігалася дегенерація клітинного моношару) визначали в трьох паралельних експериментах. Приклад 33. Вивчення противірусної активності. Дослідження противірусної дії сполук основане на вивченні цитопатичної дії вірусу везікулярного стоматиту (ВВС). Розчини досліджуваних сполук (0.125 - 250мкг/мл) у відповідному середовищі додають (0.2мл в кожну лунку) до моношару клітин вирощеному у 96-лункових мікроплатах (Falcon) при 37°С у атмосфері, вміщуючій 5% СО2 за 24 години до (попереднє застосування) або одразу після інфікування вірусом (одночасне застосування). Цитопатична дія вірусу вивчається через 24 години після інфікування. Як видно з наведених даних, сполуки, що заявляються, є індукуючі інтерферон противірусні агенти. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCarboxyderivatives of planar polycyclic compounds as interferon inducing antiviral agents
Автори англійськоюKarpenko Oleksandr Serhiiovych, Dorovskykh Iryna Viktorivna, Maltsev Heorhii Volodymyrovych, Shybinska Maryna Olehivna, Liakhova Olena Anatoliivna, Pohosova Yulia Oleksiivna, Liakhov Serhii Anatoliiovych, Andronati Serhii Andriiovych, Zholobak Nadia Mykhailivna, Spivak Mykola Yakovych
Назва патенту російськоюКарбоксипроизводные планарных полициклических соединений как индуцирующие интерферон противовирусные агенты
Автори російськоюКарпенко Александр Сергеевич, Доровских Ирина Викторовна, Мальцев Георгий Владимирович, Шибинская Марина Олеговна, Ляхова Елена Анатольевна, Погосова Юлия Алексеевна, Ляхов Сергей Анатольевич, Андронати Сергей Андреевич, Жолобак Надежда Михайловна, Спивак Николай Яковлевич
МПК / Мітки
МПК: C07C 209/00, C07D 213/00
Мітки: противірусні, індукуючі, карбоксипохідні, інтерферон, сполук, агенти, планарних, поліциклічних
Код посилання
<a href="https://ua.patents.su/10-37680-karboksipokhidni-planarnikh-policiklichnikh-spoluk-yak-indukuyuchi-interferon-protivirusni-agenti.html" target="_blank" rel="follow" title="База патентів України">Карбоксипохідні планарних поліциклічних сполук як індукуючі інтерферон противірусні агенти</a>
Попередній патент: Спосіб виробництва біфідовмісного молочного напою з оздоровчими властивостями
Наступний патент: Композиція інгредієнтів для приготування бісквітного напівфабрикату
Випадковий патент: Дерматом для зрізування тонкого повношарового, сітчастого епідермотранслокалізаційного аутодермотрансплантата з кратністю збільшення площі від 1 до 2