Оптично чисті солі (-)-5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1н-бензімідазолу, спосіб їх одержання, проміжні сполуки та фармацевтична композиція
Формула / Реферат
1. Оптически чистые Na+, Мg2+, Li+, Κ+ или Са2+ соли (-)-5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]сульфинил]-1Н-бензимидазола.
2. Соединение по пункту 1, представляющее собой Na+, Мg2+ или Са2+ соль (-)-5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]сульфинил]-1Н-бензимидазола.
3. Соединение по пункту 1, представляющее собой Мg2+ соль (-)-5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]сульфинил]-1Н-бензимидазола.
4. Соединение по пункту 1, представляющее собой Na+ соль (-)-5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]сульфинил]-1Н-бензимидазола в ее кристаллической форме.
5. Способ получения оптически чистого соединения по пункту 1, отличающийся тем, что диастереоизомерную смесь эфира формулы (IV):
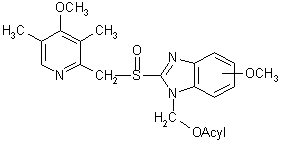 ,(IV)
,(IV)
где ацил означает хиральную ацильную группу, имеющую R или S конфигурацию, разделяют для получения отдельных диастереоизомеров, после чего диастереоизомер, состоящий из ацилоксиметильного производного (-)-5-мeтокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]сульфинил]-1Н-бензимидазола, растворяют в щелочном растворе, где ацилоксиметильная группа гидролизуется с образованием (-)-5-метокси-2-(4-метокси-3,5-диметил-2-пиридинил)метилсульфинил-1Н-бензимидазола, который затем превращают в Na+, Мg2+, Li+ или Са2+ соль.
6. Способ по пункту 5, отличающийся тем, что хиральная ацильная группа является манделоилом.
7. Способ по пункту 5, отличающийся тем, что диастереоизомеры разделяют хроматографией или фракционной кристаллизацией.
8. Способ по пункту 5, отличающийся тем, что сольволиз проводят в щелочном растворе, состоящем из основания в протонном растворителе, таком, как спирты или вода, или основания в апротонном растворителе таком, как диметилсульфоксид или диметилформамид.
9. Способ по пункту 5, отличающийся тем, что соли получают обработкой (-)-5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]сульфинил]-1Н-бензимидазола основанием, включающим Na+, Мg2+, Li+ или Са2+ в неводном растворителе.
10. Способ по пункту 9 получения натриевой соли (-)-5-метокси-2-(4-метокси-3,5-диметил-2-пиридинил)метилсульфинил-1Н-бензимидазола в ее кристаллической форме, отличающийся тем, что неочищенный продукт натриевой соли нейтрализуют с последующей обработкой NaOH в неводной среде.
11. Фармацевтическая композиция, обладающая ингибирующей желудочную кислотную секрецию активностью, содержащая активный ингредиент и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного ингредиента она содержит соединение по любому из пунктов 1-4 в эффективном количестве.
12. Оптически чистые соединения по одному из пунктов 1-4, обладающие ингибирующей желудочную кислотную секрецию активностью.
13. Оптически чистое соединение по одному из пунктов 1-4 для приготовления фармацевтической композиции для ингибирования секреции желудочной кислоты.
14. Оптически чистое соединение по одному из пунктов 1-4 для приготовления фармацевтической композиции для лечения желудочно-кишечных воспалительных заболеваний.
15. Оптически чистое соединение по одному из пунктов 1-4, применимое в производстве лекарственного средства с низкой степенью внутрииндивидуальной изменчивости уровня в плазме крови при лечении заболеваний, связанных с желудочной кислотой.
16. Оптически чистое соединение по одному из пунктов 1-4 для получения лекарственного средства с улучшенным терапевтическим профилем для лечения заболеваний, связанных с желудочной кислотой.
17. 6-мeтoкcи-2-[[(4-мeтoкcи-3,5-димeтил-2-пиpидинил)мeтил]сульфинил]-l-[мaндeлoилoкcимeтил]-1Н-бензимидазол.
18. Соединение по п. 17, представляющее собой 6-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]-(R/S)-сульфинил]-1-[(R)-манделоилоксиметил]-1Н-бензамидазол.
19. Соединение по п. 17, представляющее собой 6-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]-(R/S)-сульфинил]-1-[(S)-манделоилоксиметил]-1Н-бензимидазол.
Текст
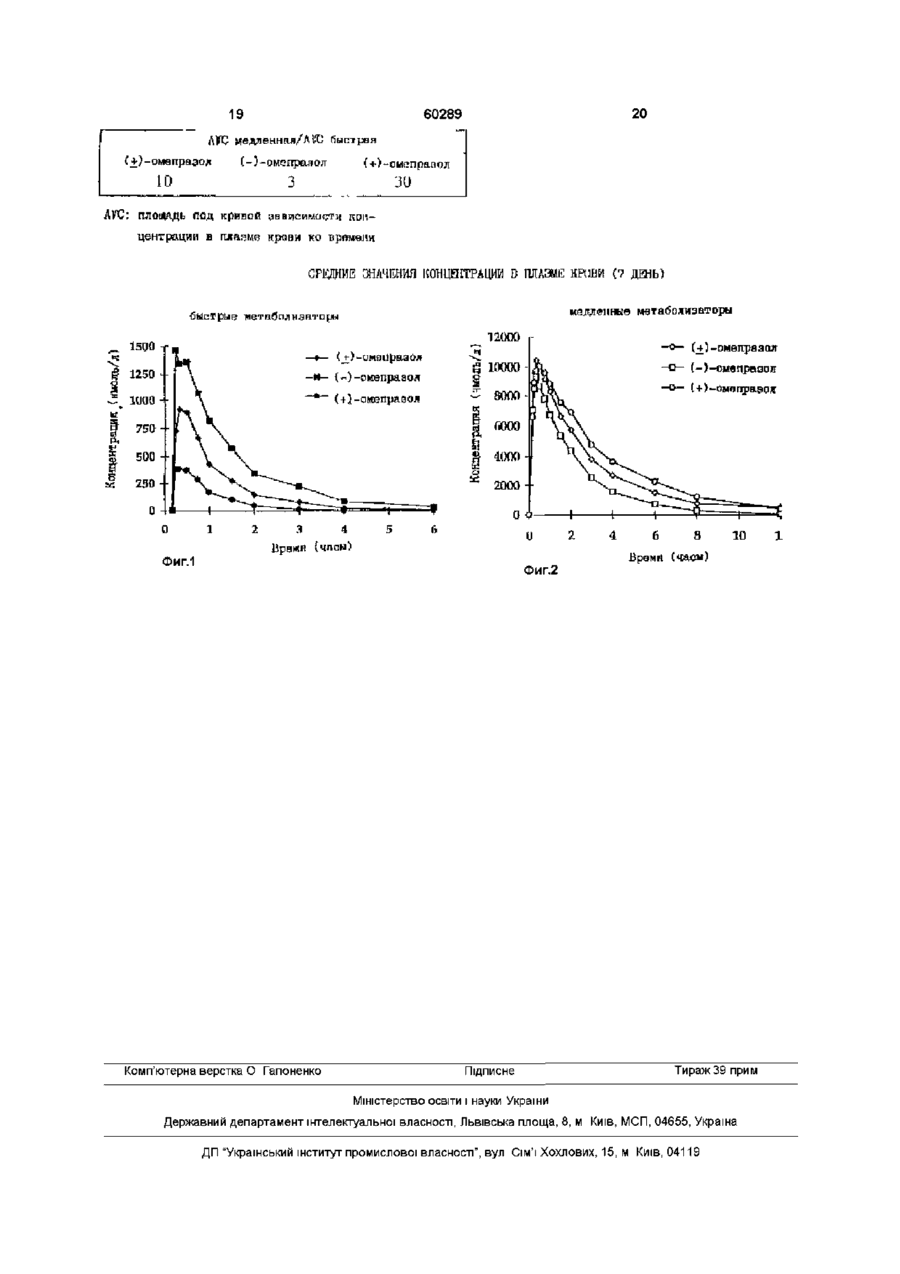
1 Оптически чистые Na+, Mg 2+ , Li+, K+ или Ca + соли (-)-5-метокси-2-[[(4-метокси-3,5-диметил2-пиридинил)метил]сульфинил]-1Нбензимидазола 2 Соединение по пункту 1, представляющее собой Na+, Mg 2+ или Са 2+ соль (-)-5-метокси-2-[[(4метокси-3,5-диметил-2пиридинил)метил]сульфинил]-1Н-бензимидазола 3 Соединение по пункту 1, представляющее собой Мд2+ соль (-)-5-мето кс и-2-[[(4-мето кс и-3,5диметил-2-пиридинил)метил]сульфинил)-1Нбензимидазола 4 Соединение по пункту 1, представляющее собой Na+ соль (-)-5-мето кс и-2-[[(4-мето кс и-3,5диметил-2-пиридинил)метил]сульфинил]-1Нбензимидазола в ее кристаллической форме 5 Способ получения оптически чистого соединения по пункту 1, отличающийся тем, что диастереоизомерную смесь эфира формулы (IV) ОСН, ОСН, OAcyl .(IV) где ацил означает хиральную ацильную группу, имеющую R или S конфигурацию, разделяют для получения отдельных диастереоизомеров, после чего диастереоизомер, состоящий из ацилоксиме тильного производного (-)-5-метокси-2-[[(4метокси-3,5-диметил-2пиридинил)метил]сульфинил]-1Н-бензимидазола, растворяют в щелочном растворе, где ацилоксиметильная группа гидролизуется с образованием (-)-5-метокси-2-(4-метокси-3,5-диметил-2пиридинил)метилсульфинил-1Н-бензимидазола, который затем превращают в Na+, Mg 2+ , Li+ или Са 2+ соль 6 Способ по пункту 5, отличающийся тем, что хиральная ацильная группа является манделоилом 7 Способ по пункту 5, отличающийся тем, что диастереоизомеры разделяют хроматографией или фракционной кристаллизацией 8 Способ по пункту 5, отличающийся тем, что сольволиз проводят в щелочном растворе, состоящем из основания в протонном растворителе, таком, как спирты или вода, или основания в апротонном растворителе таком, как диметилсульфоксид или диметилформамид 9 Способ по пункту 5, отличающийся тем, что соли получают обработкой (-)-5-метокси-2-[[(4метокси-3,5-диметил-2пиридинил)метил]сульфинил]-1Н-бензимидазола основанием, включающим Na+, Mg 2+ , Li+ или Са 2+ в неводном растворителе 10 Способ по пункту 9 получения натриевой соли (-)-5-метокси-2-(4-метокси-3,5-диметил-2пиридинил)метилсульфинил-1Н-бензимидазола в ее кристаллической форме, отличающийся тем, что неочищенный продукт натриевой соли нейтрализуют с последующей обработкой NaOH в неводной среде 11 Фармацевтическая композиция, обладающая ингибирующей желудочную кислотную секрецию активностью, содержащая активный ингредиент и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного ингредиента она содержит соединение по любому из пунктов 1-4 в эффективном количестве 12 Оптически чистые соединения по одному из пунктов 1-4, обладающие ингибирующей желудочную кислотную секрецию активностью 13 Оптически чистое соединение по одному из пунктов 1-4 для приготовления фармацевтической о 0 0 о (О 60289 композиции для ингибирования секреции желудочной кислоты 14 Оптически чистое соединение по одному из пунктов 1-4 для приготовления фармацевтической композиции для лечения желудочно-кишечных воспалительных заболеваний 15 Оптически чистое соединение по одному из пунктов 1-4, применимое в производстве лекарственного средства с низкой степенью внутрииндивидуальной изменчивости уровня в плазме крови при лечении заболеваний, связанных с желудочной кислотой 16 Оптически чистое соединение по одному из пунктов 1-4 для получения лекарственного сред ства с улучшенным терапевтическим профилем для лечения заболеваний, связанных с желудочной кислотой 17 6-метокси-2-[[(4-метокси-3,5-диметил-2пиридинил)метил]сульфинил]-І[манделоилоксиметил]-1Н-бензимидазол 18 Соединение по п 17, представляющее собой 6-метокси-2-[[(4-метокси-3,5-диметил-2пиридинил)метил]-(Р/3)-сульфинил]-1-[(Р)манделоилоксиметил]-1Н-бензамидазол 19 Соединение по п 17, представляющее собой 6метокси-2-[[(4-метокси-3,5-диметил-2пиридинил)метил]-(Р/3)-сульфинил]-1-[(3)манделоилоксиметил]-1Н-бензимидазол Настоящее изобретение направлено на новые соединения с высокой оптической чистотой, их использование в медицине, способ их приготовления и их использование в производстве фармацевтического препарата Изобретение относится также к новым промежуточным продуктам для получения соединений данного изобретения Соединение 5-метокси-2-[[(4-метокси-3,5диметил-2-пиридинил)метил]сульфинил]-1Нбензимидазол, имеющее общее название омепразол, и его терапевтически приемлемые щелочные соли описаны в ЕР 5129 и ЕР 124 495, соответственно Омепразол и его щелочные соли являются эффективными ингибиторами желудочной кислотной секреции и полезными в качестве противоязвенных средств Соединения, являющееся сульфоксидами, имеют центр асимметрии при атоме серы, то есть существуют в виде двух оптических изомеров (энантиомеров) Желательно получить соединения с улучшенными фармакокинетическими и метаболическими свойствами, которые будут давать улучшенную терапевтическую характеристику такую как пониженная степень внутрииндивидуальной изменчивости Настоящее изобретение дает такие соединения, которые являются новыми солями (-)-энантиомера омепразола нагрев, которым будет трудно управлять при производстве в больших масштабах В дальнейшем аспекте данное изобретение дает новый метод получения новых соединений изобретения в крупных масштабах Этот способ может также быть использован для крупномасштабного производства отдельных энантиомеров омепразола в нейтральной форме На известном уровне техники не существует никакого примера выделенной или идентифицированной соли оптически чистого омепразола, то есть отдельных энантиомеров омепразола или любой выделенной или идентифицированной соли любого оптически чистого аналога омепразола Настоящее изобретение относится к новым Na+, Mg 2+ , Li+, K+ и Са 2+ солям (-)-энантиомера омепразола, то есть Na+, Mg 2+ , Li+, K+ и Са 2+ соли (-)-5-метокси-2-[[(4-метокси-3,5-диметил-2пиридинил)метил]сульфинил]-1Н-бензимидазола Особенно предпочтительными солями согласно изобретению являются Na+, Ca2 и Мд2+ соли, то есть натриевая соль (-)-5-метокси-2-[[(4-метокси3,5-диметил-2-пиридинил)метил]-сульфинил]-1Нбензимидазола, магниевая соль (-)-5-метокси-2[[(4-метокси-3,5-диметил-2пиридинил)метил]сульфинил]-1Н-бензимидазола и кальциевая соль (-)-5-метокси-2-[[(4-метокси-3,5диметил-2-пиридинил)метил]сульфинил]-1Нбензимидазола Согласно изобретению, наиболее предпочтительными солями являются оптически чистые Na+ соли (-)-омепразола формулы (I) ОСК Разделение энантиомеров омепразола на аналитическом уровне описано, например, в J Chromatography, 532 (1990), 305-19 и на препаративном уровне в DE 4035455 Последнее выполнено использованием диастереомерного простого эфира, который выделяется и после этого гидролизуется в кислом растворе В кислых условиях, необходимых для гидролиза связанной группы, омепразол является довольно чувствительным и кислота должна быть быстро нейтрализована основанием во избежание разложения чувствительного к кислотам соединения Применительно к вышеупомянутому случаю, это осуществляется добавлением реакционной смеси, содержащей концентрированную серную кислоту к концентрированному раствору NaOH Это неблагоприятно, так как существует большой риск локального достижения значений рН в интервале 1-6, что может оказаться разрушительным для вещества Кроме того, мгновенная нейтрализация будет создавать осн, (I) и оптически чистые омепразола формулы II магниевые соли (-) 60289 (II) Выражение "оптически чистые Na соли омепразола" подразумевает 1Ча-соль(-)-энантиомера омелразола, в значительной степени свободную от Na-соли (+)-энантиомера омепразола Отдельные энантиомеры омепразола до сих пор были получены только в виде сиропов, но не в виде кристаллических продуктов Соли, определенные данным изобретением, легко могут быть получены посредством нового специфического метода, согласно одному из аспектов изобретения по получению отдельных энантиомеров омепразола К тому же соли, однако не в нейтральных формах, получаются в виде кристаллических продуктов Поскольку оптически загрязненные соли энантиомеров омепразола возможно очистить кристаллизацией, они могут быть получены с очень высокой оптической чистотой, а именно с >99,8% энантиомерным избытком ( е е ) даже из оптически загрязненного препарата Кроме того, оптические чистые соли являются стабильными по отношению к рацемизации как в нейтральной рН так и в щелочной рН, что было неожиданно, поскольку предполагалось, что известная депротонизация на углеродном атоме между пиридиновым циклом и хиральным атомом серы вызовет рацемизацию в щелочных условиях Эта высокая стабильность по отношению к рацемизации делает возможным применение соли (-)-энантиомера омепразола в терапии Как упомянуто выше, специфический способ приготовления отдельных энантиомеров омепразола составляет дальнейший аспект изобретения, и этот метод может быть использован для получения отдельных энантиомеров омепразола в нейтральной форме, равно как и их солей Соединения согласно изобретению могут быть использованы для ингибирования желудочной кислотной секреции у млекопитающих животных и человека В более общем значении, соединения изобретения могут использоваться для лечения заболеваний желудка, связанных с нарушением кислотности, и желудочно-кишечных воспалительных заболеваний у млекопитающих и человека, таких как язва желудка, язва двенадцатиперстной кишки, рефлюкс-эзофагит и гастрит Кроме того, соединения могут использоваться для лечения других желудочно-кишечных нарушений, при которых желателен желудочный антисекреторный эффект, например, для пациентов, находящихся на NSAID терапии, пациентов с ульцероаденомой поджелудочной железы и пациентов с острым желудочно-кишечным кровотечением Они могут также использоваться на пациентах в случаях интенсивной терапии, и до- и послеоперационно для предотвращения кислотной аспирации и стрессовой язвы Соединения изобретения могут также использоваться для лечения или профилактики воспалительных состоянии у млекопитающих, включая человека, особенно таких, при которых вовлекаются в патологический процесс лизоцимальные энзимы Особенно могут быть упомянуты такие состояния как артрит и подагра Соединения изобретения могут также быть полезными в лечении псориаза, а также в лечении Hehcobacter инфекций Кроме того, дальнейший аспект соединения составляет соединение III, которое является промежуточным продуктом, используемым в специфическом способе получения осн, н„с (III) Получение Оптически чистые соединения изобретения, то есть соли (-)-энантиомера приготавливают разделением двух стереоизомеров диастереоизомерной смеси следующего типа, 5- или 6-метокси2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]сульфинил]-1-[ацилоксиметил]-1Н-бензимидазол формулы IV ОСН 3 н 3 сА^с сно OAcy! где метокси заместитель в бензимидазольной составляющей находится в положении 5 или 6, и Acyl радикал является таким, как определено ниже, с последующим сольволизом выделенного диастереомера, содержащего (-)-энантиомер омепразола в щелочном растворе Образовавшийся (-)-энантиомер омепразола затем выделяют нейтрализацией водных растворов солей (-)энантиомеров омепразола нейтрализующим агентом, которым может быть кислота или сложный эфир такой как метилформиат Ацил (Acyl) составляющая в диастереомерном эфире может быть хиральной ацильной группой, такой, как манделоил, и центр асимметрии в хиральной ацильной группе может иметь как R так и S конфигурацию Диастереомерные сложные эфиры могут быть разделены либо хроматографически либо фракционированной кристаллизацией Сольволиз обычно протекает в присутствии основания в протонном растворителе, таком как спирты или вода, но ацильная группа может также быть снята гидролизом с помощью основания в протонном растворителе, таком как диметилсульфоксид или диметилформамид Реагирующей основой может быть ОН или R 1 O, где R может представлять любую алкильную или арильную группу 60289 Для получения оптически чистых Na солей изобретения, то есть Na+ солей (-)-энантиомера омепразола, полученное соединение обрабатывают основанием, таким как NaOH, в водной или неводной среде, или с NaOR2, в котором R2 представляет алкильную группу, содержащую 1-4 атомов углерода или с NaNbb Кроме того, щелочные соли, в которых катионы являются І_Ґ или К+ могут быть приготовлены с использованием литиевых или калиевых солей вышеупомянутых соединений Для того, чтобы получить кристаллическую форму Na+ соли, желательно добавление NaOH в неводную среду, такую как смесь 2-бутанона и толуола Для получения оптически чистой Мд2+ соли изобретения, оптически чистую Na+ соль (-)энантиомера обрабатывают водным раствором неорганической магниевой соли, такой как МдСЬ, в результате чего Мд2+ соль выпадает в осадок Оптически чистая Мд2+ соль может также быть приготовлена обработкой (-)-энантиомера омепразола основанием, таким как Mg(OR3)2, в котором R3 представляет алкильнуго группу, содержащую 1-4 атомов углерода, в неводном растворителе, таком как спирт (только для алкоголятов), например ROH, или в простом эфире, таком, как тетрагидрофуран Аналогичным образом может быть приготовлена также щелочная соль, в которой катионом является Са2+, с использованием водного раствора неорганической соли кальция, такой как СаСЬ Примерами щелочных солей отдельных энантиомеров изобретения служат, как упомянуто выше, кроме соли натрия (соединение I) и соли магния (соединение II), служат также соли с Li+, K+ и Са 2+ Для клинического применения (-)энантиомеры, то есть оптически чистые соединения, изобретения составляются в виде фармацевтических форм для орального, ректального, парентерального или других способов введения Фармацевтические составы содержат (-)энантиомер изобретения обычно в комбинации с фармацевтически приемлемым носителем Носитель может быть в форме твердого продукта, полутвердого продукта или жидкого растворителя, или капсулы Эти фармацевтические препараты представляют дальнейшую цель изобретения Обычно количество активного соединения составляет между 0,1-95вес% препарата между 0,220вес % в препаратах для парентерального применения и между 1-50вес% в препаратах для орального применения При приготовлении фармацевтических составов в форме стандартной дозы для орального применения оптически чистое соединение может быть смешано с твердым порошкообразным носителем, таким как лактоза, сахароза, сорбитол, маннитол, крахмал, амилопектин, производные целлюлозы, желатин или другие подходящие носители, стабилизирующими веществами, такими как щелочные соединения, например карбонаты, гидроокиси или окиси натрия, калия, кальция, магния и тому подобные, равно как со смазывающими веществами, такими как стеарат магния, стеарат кальция, натрий стеарил фумарат и полиэтиленг 8 ликолевые парафины Затем смесь перерабатывается в гранулы или прессуется в таблетки Гранулы и таблетки могут быть покрыты энтеросолюбильнои оболочкой, которая защищает активное соединение от катализируемого кислотами разложения пока дозированная форма остается в желудке Энтеросолюбильное покрытие выбирается из фармацевтически приемлемых материалов для энтеросолюбильных оболочек, например воска, шеллака или анионных пленкообразующих полимеров и тому подобного, при желании с подходящим пластификатором К оболочке могут добавляться различные красители для отличия таблеток или гранул с различными количествами данного активного соединения Мягкие желатиновые капсулы могут быть приготовлены в виде капсул, содержащих смесь активного соединения, растительного масла, жира или другого подходящего наполнителя для мягких желатиновых капсул Мягкие желатиновые капсулы могут также быть покрыты энтеросолюбильнои оболочкой как описано выше Твердые желатиновые капсулы могут содержать гранулы или покрытые энтеросолюбильнои оболочкой гранулы активного соединения Твердые желатиновые капсулы могут также содержать активное соединение в комбинации с твердым порошкообразным носителем, таким как лактоза, сахароза, сорбитол, маннитол, картофельный крахмал, амилопектин, производные целлюлозы или желатин Капсулы могут быть покрыты энтеросолюбильнои оболочкой, как описано выше Стандартные дозы для ректального введения могут быть приготовлены в форме суппозиториев, содержащих в себе активное вещество, смешанное с нейтральным насыщенным основанием, или они могут быть приготовлены в форме желатиновой ректальной капсулы, которая содержат активное вещество в смеси с растительным маслом, парафиновым маслом или другим подходящим наполнителем для желатиновых ректальных капсул, или они могут быть приготовлены в форме готовой микроклизмы, или они могут быть приготовлены в форме состава для сухой микроклизмы для получения нужного состава в подходящем растворителе непосредственно перед введением Жидкий препарат для орального введения может быть приготовлен в форме сиропов или суспензий, например растворов или суспензий, содержащих от 0,2% до 20% по весу активного ингредиента и в остальном содержащих сахарозу или спирты Сахаров и смесь этанола, воды, глицерина, пропиленгликоля и/или полиэтиленгликоля При желании, такие жидкие препараты могут содержать красители, корригенты, сахарин и карбоксиметилцеллюлозу или другие уплотняющие агенты Жидкие препараты для орального введения могут также быть приготовлены в форме сухого порошка для получения нужного состава в подходящем растворителе непосредственно перед использованием Растворы для парентерального введения могут быть приготовлены как растворы оптически чистых соединений изобретения в фармацевтически приемлемых растворителях, предпочтительно в концентрации от 0,1 до 10% по весу Эти рас творы могут также содержать стабилизирующие агенты и/или буферы и могут выпускаться в ампулах или флаконах, содержащих стандартную дозу Растворы для парентерального введения могут также быть приготовлены в виде сухих препаратов для получения импровизированного состава в подходящем растворителе перед употреблением Типичная суточная доза активного соединения будет зависеть от различных факторов, например таких, как индивидуальная потребность каждого пациента, путь введения к заболеванию Вообще, оральная и парентеральная дозы будут в интервале от 5 до 500мг в сутки активного вещества Настоящее изобретение иллюстрируется следующими примерами Направление оптического вращения энантиомеров омепразола будет меняться от (-) до (+), когда из несолевой формы получают натриевую соль, и наоборот, когда получают соль магния из натриевой соли Пример 1 Получение натриевой соли (+)-5-метокси-2[[(4-метокси-3,5-диметил-2пиридинил)метил]сульфинил]-1Н-бензимидазола 100мг (О.Зммоля) (-)-5-метокси-2-[[(4-метокси3,5-диметил-2-пиридинил)метил]сульфинил]-1Нбензимидазола (загрязненного 3% (+)-изомера) растворили при перемешивании в 1мл 2-бутанона Добавили бОмкл водного раствора 5,ОМ гидроокиси натрия и 2мл толуола Образовавшаяся смесь была негомогенной Для получения истинного раствора дополнительно добавили 2-бутанон (около 1мл) и смесь перемешивали при температуре окружающей среды в течение ночи Образовавшийся осадок отфильтровали и промыли диэтиловыми эфиром Получили 51мг (46%) названного в заглавии соединения в виде белых кристаллов т пл (разложен) 246-248°С Оптическая чистота (ее), которая анализировалась методом хиральной колоночной хроматографии, составила >99,8% 60289 10 хиральной колоночной хроматографии составила 20 >99,8% [a] D = -44,1° (с=0,5%, вода) ЯМР-данные приведены ниже Пример 3 Получение магниевой соли (+)-5-метокси-2[[(4-метокси-3,5-диметил-2пиридинил)метил]сульфинил]-1 Н-бензимидазола 2,9мл 0,1 М раствора НаОН добавили к 0,1 Ог (0,29ммоля) (+)-5-метокси-2-[[(4-метокси-3,5диметил-2-пиридинил)-метил]сульфинил]-1Нбензимидазола К этой смеси добавили 2мл метиленхлорида и после смешивания в делительной воронке отделили водный раствор Добавили по каплям раствор 14мг (0,145ммоля) МдСЬ в воде Образовавшийся осадок отделили центрифугированием и выделили 52мг (50%) продукта в виде аморфного порошка Оптическая частота (е е) составила 98%, и, таким образом, оказалась такой же, как у исходного материала Оптическую чистоту определили методом хроматографии на аналитической хиральной колонке [а]о ° = +101,2° (с=1%, метанол) Содержание Мд в образце, определенное методом атомной абсорбционной спектроскопии, составило 3,0% [a] D 2 0 = +42,8° (с=0,5%, вода) ЯМР-данные приведены ниже Пример 2 Получение натриевой соли (-)-5-метокси-2-[[(4метокси-3,5-диметил-2пиридинид)метил]сульфинил]-1Н-бензимидазола 100мг (О.Зммоля) (+)-5-мето кс и-2-[[(4-мето кс и3,5-диметил-2-пиридинил)метил]сульфонил]-1Нбензимидазола (загрязненного 3% (-)-изомера) растворили при перемешивании в 1мл 2-бутанона Добавили бОмкл водного раствора 5,ОМ гидроокиси натрия и 2мл толуола Образовавшаяся смесь была негомогенной Для получения истинного раствора дополнительно добавили 2-бутанон (около 1мл) и смесь перемешивали при температуре окружающей среды в течение ночи Образовавшийся осадок отфильтровали и промыли диэтиловым эфиром Получили 56мг (51%) названного в заглавии соединения в виде белых кристаллов т пл (разложен) 247-249°С Оптическая частота (ее), которая анализировалась методом Пример 4 Получение магниевой соли (+)-5-метокси-2[[(4-метокси-3,5-диметил-2пиридинил)метил]сульфинил]-1 Н-бензимидазола Натриевую соль (-)-5-метокси-2-[[(4-метокси3,5-диметил-2-пиридинил)метил]сульфинил]-1Нбензимидазола (0,500г, 1,36ммоля) растворили в воде (10мл) К этой смеси добавили по каплям 10мл водного раствора MgCb x НгО (138мг, О.бОммоля) и образовавшийся осадок отделяли центрифугированием Получили 418мг (86%) продукта в виде белого порошка Оптическая чистота (е е ) продукта составила 99,8%, и, таким образом, оказалась такой же, как и у исходного продукта Оптическую чистоту определили методом хроматографии на аналитической хиральной колонке [a] D = +129,9° (с=1%, метанол) Пример 5 Получение магниевой соли (-)-5-метокси-2-[[(4метокси-3,5-диметил-2пиридинил)метил]сульфинил]-1 Н-бензимидазола Натриевую соль (+)-5-метокси-2-[[(4-метокси3,5-диметил-2-пиридинил)метил]сульфинил]-1Нбензимидазола (0,165г, 0,5ммоля) растворили в воде (Змл) К этой смеси добавили по каплям 2мл водного раствора МдСЬ х НгО (46мг, 0,23ммоля) и образовавшийся осадок отделили центрифугированием Получили 85мг (51%) продукта в виде белого порошка Оптическая чистота (е е ) продукта составила 99,9%, что оказалось таким же или лучшим значением по сравнению с оптической чистотой исходного материала Оптическую частоту определили хроматографически на аналитической хиральной колонке [a] D = -128,2° (с=1%, метанол) 11 60289 12 Таблица 1 Пример 1 2 Растворитель DMSO-d6 500МГц DMSO-d6 500МГц ЯМР-данные 5 м д 2,20 (s, 3H), 2,22 (s, 3H), 3,69 (s, 3H), 3,72 (s, 3H), 4,37 (d, 1H), 4,75 (d, 1H), 6,54 (dd, 1Н) 6,96 (d, 1Н), 7,30 (d, 1Н) 1Н), 8,21 (s, 1H), 2,20 (s, 3H), 2,22 (s, 3H), 3,69 (s, 3H), 3,72 (s, 3H), 4,38 (d, 1H), 4,73 (d, 1H), 6,54 (dd, 1H), 6,96 (d, 1H), 7,31 (d, 1H), 8,21 (s, 1H) Здесь и далее в тексте s - син глет, d - дублет, dd - двойной дублет Пример 6 Увеличение оптической чистоты путем приготовления магниевой соли (-)-5-метокси-2-[[(4метокси-3,5-диметил-2-пиридинил)метил]сульфинил]-1Н-бензимидазола в неводном растворе с последующей кристаллизацией указанной соли Магний (0,11г, 4,5ммоля) растворяют и вводят в реакцию с метанолом (50мл) при 40°С с каталитическим количеством метиленхлорида Реакцию проводят под азотом и заканчивают через пять часов К раствору метоксида магния добавляют при комнатной температуре смесь двух энантиомеров (90% (-)-изомера и 10% (+)-изомера) 5метокси-2-[[(4-метокси-3,5-диметил-2пиридинил)метил]сульфинил]-1Н-бензимидазола (2,84г, 8,2ммоля) Смесь перемешивают в течение 12 часов, после чего добавляют небольшое количество воды (0,1мл), чтобы осадить неорганические соли магния После 30 минут перемешивания эти неорганические соли отфильтровывают и раствор концентрируют на ротавейпоре Остаток теперь представляет собой концентрированный метанол ьный раствор энантиомерной смеси (т е целевого соединения, загрязненного (+)изомером), с оптической чистотой (энантиомерный избыток, е е ) 80% Эту смесь разбавляют ацетоном (100мл) и после перемешивания при комнатной температуре в течение 15 минут получают белый осадок Дополнительное перемешивание в течение 15 минут и, затем, фильтрация дают 1,3г (50%) целевого соединения в виде белых кристаллов Хиральный анализ кристаллов и маточника осуществляют хроматографически на аналитической хиральной колонке Найдено, что оптическая чистота кристаллов и маточного раствора составляет 98,4 е е и 64,4% е е соответственно Таким образом, оптическая чистота ( е е ) увеличена с 80% до 98,4% просто путем кристаллизации соли магния из смеси ацетона и метанола Продукт кристаллический, как показывает порошковая рентгеновская дифракция, а содержание магния составляет 3,44%, как показано атомной абсорбционной спектроскопией [a] D 2 0 = -131,5° (см=0,5%, метанол) Пример 7 Увеличение оптической чистоты путем приготовления магниевой соли (+)-5-метокси-2-[[(4метокси-3,5-диметил-2-пиридинил)метил]сульфинил]-1Н-бензимидазола в неводном растворе с последующей кристаллизацией указанной соли Магний (0,11г, 4,5ммоля) растворяют и вводят в реакцию с метанолом (50мл) при 40°С с каталитическим количеством метиленхлорида Реакцию проводят под азотом и оканчивают через пять часов При комнатной температуре к раствору метоксида магния прибавляют смесь двух энантиомеров (90% (+)-изомера и 10% (-)-изомера) 5метокси-2-[[(4-метокси-3,5-диметил-2пиридинил)метил]сульфинил]-1Н-бензимидазола (2,84г, 8,2ммоля) Смесь перемешивают в течение 12 часов, после чего добавляют небольшое количество воды (0,1мл), чтобы осадить неорганические соли магния После 30 минут перемешивания неорганические соли отфильтровывают и раствор концентрируют на ротавейпоре Остаток теперь представляет собой метанольный раствор энантиомерной смеси (те целевого соединения, загрязненного (+)-изомером), с оптической чистотой (е е) 80% Эту смесь разбавляют ацетоном (100мл) и после перемешивания при комнатной температуре в течение одного часа получают белый осадок Дополнительное перемешивание в течение 30 минут и затем фильтрация дают 0,35г целевого соединения в виде белых кристаллов Дополнительное перемешивание маточной жидкости в течение 24 часов при комнатной температуре дает еще 1,0г (общий выход = 52%) Хиральный анализ кристаллов и второй маточной жидкости проводят хроматографически на аналитической хиральной колонке Оптическая чистота первых кристаллов составляет 98,8% е е и 99,5% е е соответственно Оптическая чистота маточной жидкости найдена равной 57% е е Таким образом, оптическая чистота (е е ) увеличена с 80% до прибл 99% просто путем кристаллизации магниевой соли из смеси ацетона и метанола Первый осадок кристаллический, как показано порошковой рентгеновской дифракцией, и содержание магния составляет 3,49%, как показано атомной адсорб2 0 ционной спектроскопией [а]о = +135,6° (с=0,5%, метанол) В следующих далее примерах описано получение промежуточных продуктов синтеза согласно изобретению Пример 8 Получение 6-метокси-2-[[(4-метокси-3,5диметил-2-пиридинил)метил]-(Р/3)-сульфинил]-1[(Р)-манделоилоксиметил]-1Н-бензимидазола Раствор 3,4 гидроокиси натрия в 40мл воды добавили к смеси 14,4г (42ммоля) кислого сульфата тетрабутиламмония и 6,4г (42ммоля) (R)-(-)миндальной кислоты Смесь экстрагировали 400мл хлороформа После разделения органический экстракт нагревали до кипения с обратным холодильником с 16,6г (42ммоля) рацемата 6метокси-2-[[(4-метокси-3,5-диметил-2пиридинил)метил]сульфинил]-1-[хлорометил]-1Н 14 13 60289 бензимидазола После упаривания растворителя обращенно-фазовой хроматографии (ВДЖХ) тем остаток растворили в 100мл дихлорметана и же способом, что и в Примере 9, но использова700мл этилацетата Смесь промыли Зх200мл вонием диастереомерной смеси 6-мето кс и-2-[[4ды и органический раствор высушили над MgSC^ метокси-3,5-диметил-2-пиридинил)метил]-(Р/3)и упарили Сырой продукт очистили перекристалсульфинил]-1-[(3)-манделоилоксиметил]-1Нлизацией из 100мл ацетонитрила, получив 8,1 г бензимидазола вместо сложного эфира (R)названного в заглавии соединения (38%) в виде миндальной кислоты использованного в Примере диастереомерной смеси 9 Использованием 2,1 г диастереомерной смеси получили более гидрофильный изомер, 760мг, в ЯМР-данные приведены ниже чистом виде, представляющий бесцветный сироп Пример 9 Выделение более гидрофильного диастереоЯМР-данные приведены ниже мера 6-метокси-2-[[(4-метокси-3,5-диметил-2Пример 12 пиридинил)метил]-(Р/3)-сульфинил]-1-[(Р)Получение (-)-5-метокси-2-[[(4-метокси-3,5манделоилоксиметил]-1Н-бензимидазола диметил-2-пиридинил)метил]-сульфинил]-1Нбензимидазола Диастереомеры названного в заглавии соединения в Примере 8 разделили использованием 0,23г (0,45ммоля) более гидрофильного диаобращенно-фазовой хроматографии (ВДЖХ) стереомера 6-метокси-2-[[4-метокси-3,5-диметилПриблизительно 300мг диастереомерной смеси 2-пиридинил)метил]-сульфинил]-1-[(Р)растворили в 10мл горячего ацетонитрила, разманделоилоксиметил]-1Н-бензимидазола раствобавленного 10мл смеси водного 0,1М ацетата амрили в 15мл метанола Добавили раствор 36мг мония и ацетонитрила (70/30) Раствор вводили в (0,9ммоля) гидроокиси натрия в 0,45мл воды, и колонку и элюировали смесью водного 0,1 М ацеспустя 10 минут смесь упарили на роторном испатата аммония и ацетонитрила (70/30) Более гидрителе Остаток распределили между 15мл воды рофильный изомер было легче получить чистым, и 15мл дихлорметана Органический раствор эксчем менее гидрофильный изомер Разработана трагировали 15мл воды и к объединенным водследующая методика для фракции, содержащей ным растворам добавили 85мкл (1,4ммоля) мечистый изомер экстракция дихлорметаном, протилформиата Через 15мин смесь экстрагировали мывка органического раствора 5% водным рас3x10мл дихлорметана Органический раствор вытвором бикарбоната натрия, высушивание над сушили над Na2SO4 и затем упарили Получили Na2SO4 и упаривание растворителя на роторном 0,1 Зг (77%) названного в заглавии соединения в испарителе (в конце упаривания удаление ацетовиде бесцветного сиропа Оптическая чистота нитрила облегчалось дополнительным добавле(е е), которую анализировали хиральной колонием дихлорметана) Использованием в привеночной хроматографией составила 94% денной выше методике 1,2г диастереомерной [а]р2 = -155° (с=0,5%, хлороформ) смеси получили более гидрофильный изомер, ЯМР-данные приведены ниже 410мг, в чистом виде, представляющий бесцветПример 13 ный сироп, ЯМР-данные приведены ниже Получение (+)-5-метокси-2-[[(4-метокси-3,5Пример 10 диметил-2-пиридинил)метил]-сульфинил]-1НПолучение 6-метокси-2-[[(4-метокси-3,5бензимидазола диметил-2-пиридинил)метил]-(Р/3)-сульфинил]-10,76г (1,5ммоля) более гидрофильного диа[(3)-манделоилоксиметил]-1Н-бензимидазола стереомера 6-метокси-2-[[(4-метокси-3,5-диметилПродукт получили из 0,1 г (202ммоля) гидро2-пиридинил)метил]-сульфинил]-1-[(3)окиси натрия в 100мл воды, 34,4г (101ммоля) киманделоилоксиметил-1Н-бензимидазола раствослого сульфата тетрабутиламмония, 15,4г рили в 50мл метанола Добавили раствор 0,12мг (101ммоля) (3)-(+)-миндальной кислоты и 39,9г (З.Оммоля) гидроокиси натрия в 1,5мл воды, и (101ммоля) рацемата 6-метокси-2-[[4-метокси-3,5спустя 10 минут смесь упарили на роторном испадиметил-2-пиридинил)метил]-сульфинил]-1рителе Остаток распределили между 25мл воды [хлорометил]-1Н-бензимидазола использованием и 25мл дихлорметана Органический раствор экстой же методики, что и в Примере 6 Перекритрагировали 25мл воды и к объединенным водсталлизация из 100мл ацетонитрила дала 21,Зг, ным растворам добавили 200мкл (3,2ммоля) мето есть 4 1 % названного в заглавии соединения в тилформиата Через 15 минут смесь экстрагировиде диастереомерной смеси вали Зх25мл дихлорметана Органический раствор высушили над Na2SO4 и затем упарили ЯМР-данные приведены ниже Получили 0,42г (81%) названного в заглавии соПример 11 единения в виде бесцветного сиропа Оптическая Выделение более гидрофильного диастереочистота, (ее), которую анализировали хиральной мера 6-метокси-2-[[(4-метокси-3,5-диметил-2колоночной хроматографией, составила 98% пиридинил)метил]-(Р/3)-сульфинил]-1-[(3)манделоилоксиметил]-1Н-бензимидазола [a] D = +157° (с=0,5%, хлороформ) Диастереомеры названного в заглавии соедиЯМР-данные приведены ниже нения в Примере 10 разделили использованием 15 60289 16 Таблица 2 Пример Растворитель 8 CDCI3 500МГц 9 CDCI3 500МГц 10 CDCI3 500МГц 11 CDCI3 500МГц 12 CDCI3 300МГц 13 CDCI3 ЯМР-данные 5 м д 2,18 (s, 3H), 2,20 (s,3H), 2,36 (s, 3H), 2,39 (s, 3H), 3,77 (s, 3H), 3,78 (s, 3H), 3,82 (s, 3H), 3,87 (s, 3H), 4,80 (d, 1H), 4,88 (d, 1H), 5,0 (m, 2H), 5,34 (s, 2H), 6,43 (d, 1Н), 6,54 (d, 1Н), 6,6-6,7 ( т , 2Н), 6,90 (d, 1Н), 6,95-6,98 (т, 2Н), 7,01 (d, 1H), 7,27,3 (т, 6Н), 7,37 (т, 2Н), 7,44 (т, 2Н), 7,58 (d, 1H), 7,62 (d, 1H), 7,95 (s, 1H), 7,97 (s, 1H) 2,20 (s, 3H), 2,36 (s, 3H), 3,78 (s, 3H), 3,82 (s, 3H), 4,80 (d, 1H), 5,00 (d, 1H), 5,35 (d, 1H), 6,43 (d, 1H), 6,63 (d, 1H), 6,90 (d, 1H), 6,97 (dd, 1H), 7,2-7,3 ( т , ЗН), 7,37 ( т , 2Н), 7,62 (d, 1H), 7,97 (s, 1H) 2,19 (s, ЗН), 2,20 (s, ЗН), 2,36 (s, ЗН), 2,39 (s, ЗН), 3,77 (s, ЗН), 3,78 (s, ЗН), 3,83 (s, ЗН), 3,87 (s, ЗН), 4,80 (d, 1Н), 4,88 (d, 1Н), 5,0 (т, 2Н), 5,34 (s, 2H), 6,43 (d, 1Н), 6,54 (d, 1Н), 6,6-6,7 ( т , 2Н), 6,90 (d, 1Н), 6,96-6,98 (т, 2Н), 7,01 (d, 1H), 7,27,3 (т, 6Н), 7,37 (т, 2Н), 7,44 (т, 2Н), 7,58 (d, 1H), 7,62 (d, 1H), 7,95 (s, 1H), 7,97 (s, 1H) 2,20 (s, ЗН), 2,36 (s, ЗН), 3,78 (s, ЗН), 3,82 (s, ЗН), 4,80 (d, 1H), 5,00 (d, 1H), 5,35 (d, 1H), 6,43 (d, 1H), 6,63 (d, 1H), 6,90 (d, 1H), 6,97 (dd, 1H), 7,2-7,3 ( т , ЗН), 7,37 ( т , 2Н), 7,62 (d, 1H), 7,97 (s, 1H) 2,18, (s, ЗН), 2,22 (s, ЗН), 3,68 (s, ЗН), 3,83 (s, ЗН), 4,77 (т, 2Н), 6,93 (dd, 1H), «7,0 (b, 1H), «7,5 (b, 1H), 8,19 (s, 1H) 2,21 (s, ЗН), 2,23 (s, ЗН), 3,69 (s, ЗН), 3,84 (s, ЗН), 4,76 ( т , 2Н), 6,94 (dd, 1H), «7,0 (b, 1H), «7,5 (b, 1H), 8,20 (s, 1H) В приведенной выше Таблице 2 s - синглет, d - дуплет m - мультиплет b - уширенный сигнал Лучшим способом воплощения изобретения, известным в настоящее время, является использование натриевых солей оптически чистых соединений изобретения, т е соединений, описанных в Примере 1 и Примере 2 Фармацевтические препараты, включающие соединения изобретения в качестве активного ингредиента, иллюстрируются следующими составами Сироп Сироп, содержащий 1% (вес на объем) активного вещества, приготовлен из следующих ингредиентов Соединение настоящего изобретения 1,0г Сахар, порошок 30,0г Сахарин 0,6г Глицерин 5,0г Корригент 0,05г Этанол 96% 5,0г Дистиллированная вода q s (в нужном кол-ве) до общего объема 100 мл Сахар и сахарин растворили в 60г теплой воды После охлаждения добавили к раствору сахара активное соединение и также добавили глицерин и раствор корригентов, растворенных в этаноле Смесь разбавили водой до конечного объема 100мл Таблетки, покрытые энтеросолюбильной оболочкой Таблетка, покрытая энтеросолюбильной оболочкой, содержащая 50мг активного соединения приготовлена из следующих ингредиентов I Соединение изобретения в виде Мд соли 500г Лактоза Метил целлюлоза Сшитый поливинилпирро 700г 6г 50г 15г 6г (требуемое количество) q s 200г II Фталат ацетат целлюлозы 15г Цетиловый спирт 2000г Изопропанол 2000г Метиленхлорид I Соединение по изобретению, порошкообразное, смешали с лактозой и гранулировали с водным раствором метилцеллюлозы и карбоната натрия Влажную массу пропустили под давлением через сито и гранулят высушили в печи После высушивания гранулят смешали с поливинилпирролидоном и стеаратом магния Сухую смесь спрессовали в таблеточные стержни (10000 таблеток), каждая таблетка содержала 50мг активного вещества, в машине для изготовления таблеток, используя перфораторы с диаметром 7мм II Раствор фталата ацетат целлюлозы и цетилового спирта в изопропанол/метиленхлориде напыляли на таблетки І в Accela Cota®, Manesty оборудовании для нанесения покрытия Получили таблетки с конечным весом 110мг Раствор для внутривенного введения Парентеральный состав для внутривенного применения, содержащий 4мг активного соединения на мл, приготовили из следующих ингредиентов Соединение изобретения 4г Стерильная вода до конечного объема 1000мл Активное соединение растворили в воде до конечного объема 1000мл Раствор профильтровали через 0,22мкм фильтр и немедленно расфаЛИДОН Стеарат магния Карбонат натрия Дистиллированная вода 18 17 60289 совали в 10мл стерильные ампулы Ампулы задаже спустя 21 день при рН 11,2 не наблюдается паяли рацемизация испытуемого соединения При рН 8, 9,3 и 10 более явно проявляется химическое разКапсулы ложение соединения, что значительно затрудняет Капсулы, содержащиеЗОмг, приготовили из выполнение измерений по рацемизации, однако в следующих ингредиентов отсутствие этих значений рН заметная рацемизаСоединение изобретения ЗООг ция наблюдалась после 16 дней Лактоза 700г Микрокристаллическая целлюлоза 40г В другом эксперименте по рацемизации с опГидроксипропилцеллюлоза с низкой тически чистыми соединениями изобретения, состепенью замещения 62г держащий фосфатный буфер водный раствор (рН=11) натриевой соли (4-)-изомера 5-метокси-2Динатриевая кислая (ор[[(4-метокси-3,5-диметил-2то)фосфорнокислая соль 2г пиридинил)метил]сульфинил]-1Н-бензимидазола Очищенная вода qs 5 (с=10 М) нагревался в течение 26 часов при 37°С Активное соединение смешали с сухими инбез какой-либо рацемизации за все время наблюгредиентами и гранулировали с раствором динатдения риевой кислой (орто)фосфорнокислой соли Влажную массу пропустили под давлением через Клиническое сравнение фармакокинетики наэкструдер и превратили в шарики, высушили в триевой соли (-)-энантиомера омепразола, насушилке во флюидизированном слое триевой соли (+)-энантиомера омепразола и наРаствор для нанесения покрытия триевой соли омепразола Фталат гидроксипропил метилцелНа прилагаемых фигурах 1 и 2 представлены люлозы 70г данные двух исследований Цетиловый спирт 4г На фигуре 1 представлены средние уровни в Ацетон 200г плазме крови рацемического омепразола, (-)Этанол 600г энантиомера омепразола и (+)-энантиомера Готовыми таблетками, покрытыми оболочкой, омепразола (здесь и далее обозначение (-)заполнены капсулы омепразол и (+)-омепразол) в стационарном соСуппозитории стоянии (7 день) у быстрых метаболизаторов после назначения 15мг доз натриевой соли каждого Суппозитории приготовлены из следующих соединения Среднее значение AUC (-)ингредиентов использованием способа сварки омепразола в стационарном состоянии было почКаждый суппозиторий содержал 40мг активного ти на 90% выше, чем таковое для рацемического соединения омепразола, в то время как этот показатель для Соединение изобретения 4г (+)-омепразола составил примерно одну треть от ВитепсолН-15 180г такового для рацемического омепразола Активное соединение гомогенно смешивают с Витепсолом Н-15 при температуре 41 °С РасплавНа фигуре 2 представлены средние уровни ленной массой заполняют по объему предвариомепразола рацемата, (+)-омепразола и (-)тельно изготовленные оболочки для суппозиториомепразола в плазме крови в стационарном соев до чистого веса 1,84г После охлаждения обостоянии (7 день) у медленных метаболизаторов лочки заплавляют путем нагрева Каждый суппопосле назначения 60мг натриевых солей каждого зиторий содержит 40мг активного соединения соединения У медленных метаболизаторов среднее значение AUC в стационарном состоянии (-)Устойчивость к рацемизации при различных омепразола было примерно на 30% ниже по сравзначениях рН нению с рацемическим омепразолом, в то время Стабильность оптически чистых соединений как AUC для (+)-омепразола было выше изобретения по отношению к рацемизации определяли при низких концентрациях в холодильнике После корректировки в отношении различных в водных буферных растворах при рН 8, 9,3, 10 и доз, было обнаружено, что AUC (-)-омепразола 11,2 Стереохимическую стабильность определябыла примерно в 3 раза выше у медленных метали путем сравнения оптической чистоты (-)болизаторов по сравнению с быстрыми ("норизомера 5-метокси-2-[[4-метокси-3,5-диметил-2мальными") метаболизаторами С другой стороны, пиридинил)метил]сульфинил]-1Н-бензимидазола для (+)-омепразола различие в AUC между медв буферном растворе сразу после растворения и ленными и быстрыми метаболизаторами было спустя несколько дней Измерения осуществляли более значительным (примерно в 30 раз) Рацехроматографически на аналитической хиральной мический омепразол, будучи смесью двух энанколонке Удивительно высокая стереохимическая тиомеров, проявляет примерно 10-кратное разлистабильность в щелочных средах для соединений чие в AUC между медленными и быстрыми метаизобретения подтверждается тем фактом, что болизаторами 19 20 60289 ) Гшстрая ю з :ю ПЛОЩАДЬ под кривой анвисиглостч к о н центрации в гтлаямз крави ко примени ЗНАЧЕНИЯ КОНЦШТРАЦИИ В Ш1АЭМЁ (7 ДЕНЬ) мядлепныв матаболиэйторы (4)-ометграапл (-)-оивпрааоп 3 4 (чппн) Комп'ютерна верстка О Гапоненко Підписне Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ДП "Український інститут промислової власності", вул Сім'ї Хохлових, 15, м Київ, 04119
ДивитисяДодаткова інформація
Назва патенту англійськоюOptically pure salts (-)-5-methoxy-2-[[(4- methoxy -3,5-dimethyl-2-pyridinyl)methyl]sulfinyl]-1h-benzimidazole, process for preparation thereof, intermediary compounds and pharmaceutical composition
Назва патенту російськоюОптически чистые соли (-)-5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]сульфинил]-1н-бензимидазолу, способ их получения, промежуточные соединения и фармацевтическая композиция
МПК / Мітки
МПК: A61P 31/04, A61P 17/06, A61P 1/00, A61K 31/4427, A61K 31/44, A61P 1/04, A61P 19/06, A61K 31/4439, C07D 401/12, A61P 29/00
Мітки: сполуки, солі, оптично, композиція, проміжні, спосіб, чисті, 5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1н-бензімідазолу, фармацевтична, одержання
Код посилання
<a href="https://ua.patents.su/10-60289-optichno-chisti-soli-5-metoksi-2-4-metoksi-35-dimetil-2-piridinilmetilsulfinil-1n-benzimidazolu-sposib-kh-oderzhannya-promizhni-spoluki-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Оптично чисті солі (-)-5-метокси-2-[[(4-метокси-3,5-диметил-2-піридиніл)метил]сульфініл]-1н-бензімідазолу, спосіб їх одержання, проміжні сполуки та фармацевтична композиція</a>
Попередній патент: Клапан керований
Наступний патент: Твердий компонент каталізатора, каталізатор (варіанти) та спосіб полімеризації олефінів
Випадковий патент: Централізована автоматизована система змащення підшипникових вузлів валкових опор прокатної кліті мастилоповітряною плівкою і спосіб здійснення змащення