Похідні хіноліну, спосіб їх одержання (варіанти) та спосіб лікування ссавців
Номер патенту: 60354
Опубліковано: 15.10.2003
Автори: Фекс Томас, Хедлунд Гунар, Йонсон Стіг, Бьйорк Андерс
Формула / Реферат
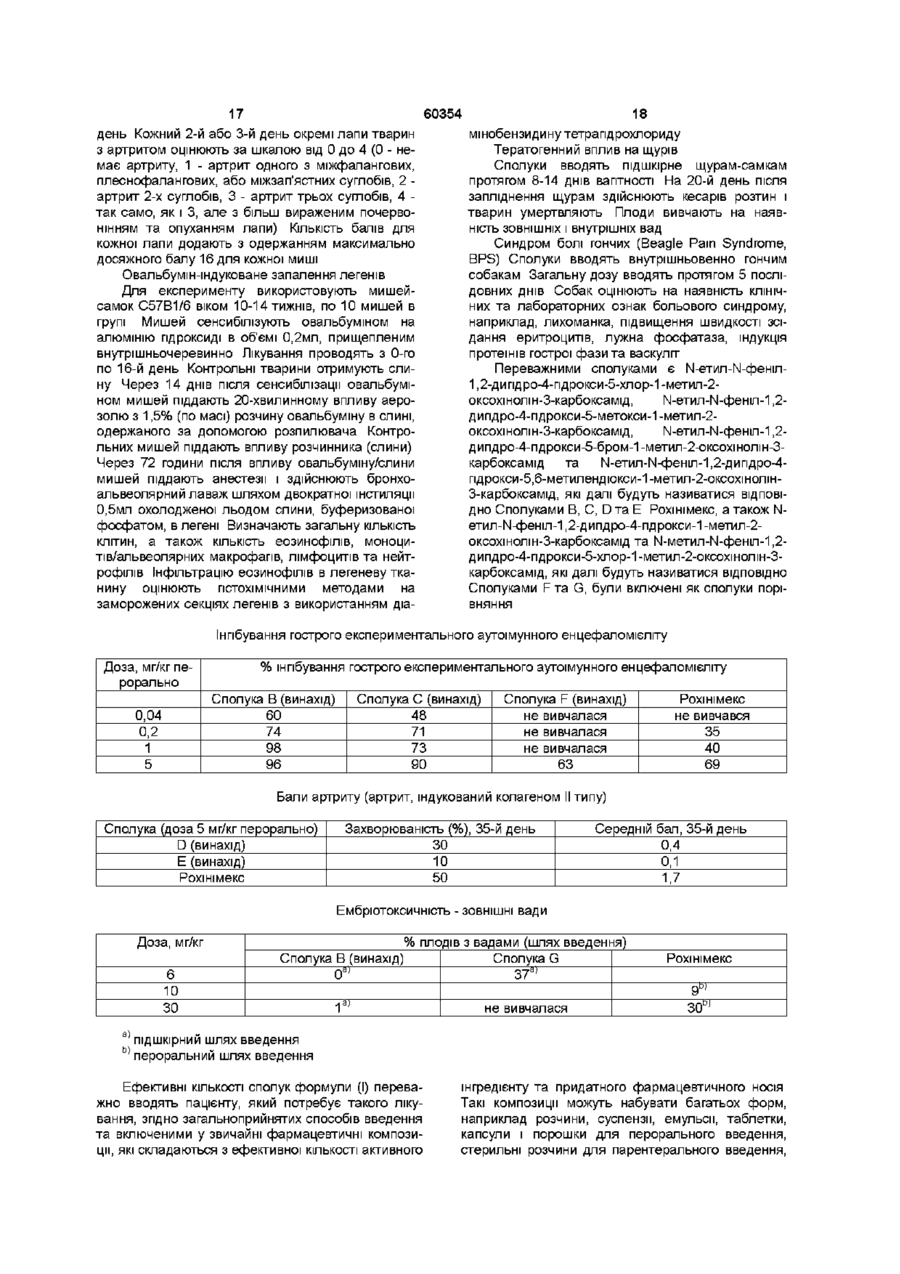
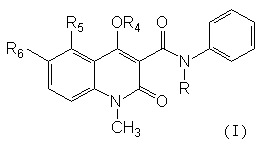
1. Похідні хіноліну загальної формули (І)
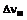 ,
,
де
R вибирають з групи: етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор(sec)-бутил та аліл;
R4 вибирають з групи: водень або фармацевтично прийнятні неорганічні або органічні катіони;
R5 вибирають з групи: метил, етил, н-пропіл, ізопропіл, метокси, етокси, хлор, бром, CF3 та OCHxFy,
де x = 0-2;
y = 1-3 за умови, що
x + y = 3;
R6 - це водень; або
R5 та R6 є однаковими і являють собою метилендіокси;
і будь-які їх таутомери.
2. Похідні хіноліну за п. 1, які відрізняються тим, що фармацевтично прийнятні неорганічні катіони являють собою натрій, калій та кальцій, а органічні катіони являють собою моноетаноламін, діетаноламін, диметиламіноетанол, морфолін та подібні до них.
3. Похідні хіноліну за пп. 1 або 2, які відрізняються тим, що R5 являє собою метил, етил, метокси, хлор, бром.
4. Похідні хіноліну за п. 3, які відрізняються тим, що R являє собою етил та н-пропіл.
5. Похідні хіноліну за п. 4, які відрізняються тим, що R4 вибирають з водню та натрію.
6. Похідна хіноліну за пп. 1 або 2, яка відрізняється тим, що являє собою N-етил-N-феніл-1,2-дигідро-4-гідрокси-5-метил-1-метил-2-оксохінолін-3-карбоксамід.
7. Похідна хіноліну за пп. 1 або 2, яка відрізняється тим, що являє собою N-етил-N-феніл-1,2-дигідро-4-гідрокси-5-етил-1-метил-2-оксохінолін-3-карбоксамід.
8. Похідна хіноліну за пп. 1 або 2, яка відрізняється тим, що являє собою N-етил-N-феніл-1,2-дигідро-4-гідрокси-5-метокси-1-метил-2-оксохінолін-3-карбоксамід.
9. Похідна хіноліну за пп. 1 або 2, яка відрізняється тим, що являє собою N-етил-N-феніл-1,2-дигідро-4-гідрокси-5-хлор-1-метил-2-оксохінолін-3-карбоксамід або його натрієву сіль.
10. Похідна хіноліну за пп. 1 або 2, яка відрізняється тим, що являє собою N-етил-N-феніл-1,2-дигідро-4-гідрокси-5-бром-1-метил-2-оксохінолін-3-карбоксамід.
11. Похідна хіноліну за пп. 1 або 2, яка відрізняється тим, що являє собою N-етил-N-феніл-1,2-дигідро-4-гідрокси-5,6-метилендіокси-1-метил-2-оксохінолін-3-карбоксамід.
12. Похідна хіноліну за будь-яким з попередніх пунктів, яка використовується як лікарський засіб.
13. Фармацевтична композиція, яка містить як активний інгредієнт похідну хіноліну, що має загальну формулу (І), разом з фармацевтично прийнятним носієм.
14. Фармацевтична композиція за п. 13, яка відрізняється тим, що містить інші фармакологічно активні субстанції (речовини).
15. Фармацевтична композиція за п. 13 або 14, яка використовується як лікарський засіб у денній (добовій) дозі активного інгредієнта від 0,0005 мг/кг до приблизно 10 мг/кг ваги тіла, зокрема від 0,005 мг/кг до 1 мг/кг ваги тіла.
16. Спосіб одержання похідної хіноліну загальної формули (І) шляхом взаємодії ефірної похідної хінолінкарбоксильної кислоти формули (ІІ)
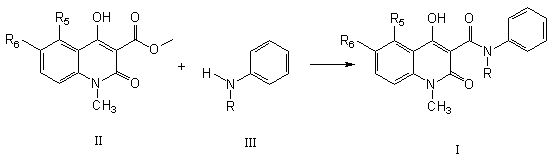
переважно метилового або етилового ефіру, з аніліном формули (ІІІ) в придатному розчиннику, такому як толуол, ксилол та подібні до них.
17. Спосіб одержання похідної хіноліну загальної формули (І) шляхом взаємодії ізатоєвого ангідриду формули (IV) з алкільним ефіром N-алкіл-N-фенілкарбамоїлоцтової кислоти формули (V),
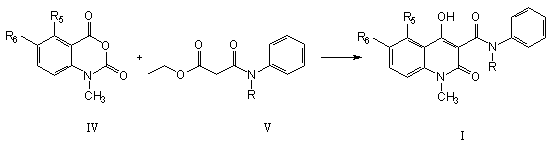
переважно метиловим або етиловим ефіром, з використанням сильного лугу, наприклад натрію гідриду, в придатному розчиннику, такому як N,N-диметилацетамід.
18. Спосіб одержання похідної хіноліну загальної формули (І) шляхом взаємодії хінолінкарбоксильної кислоти формули (VI) з аніліном формули (ІІІ),
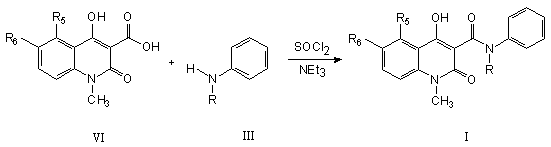
з використанням придатного зв’язуючого реагенту, переважно карбодііміду або хлористого тіонілу в присутності триетиламіну і придатного розчинника, такого як дихлорметан.
19. Спосіб за п. 19, який відрізняється тим, що R являє собою етил та н-пропіл.
20. Спосіб за п. 20, який відрізняється тим, що R4 вибирають з водню та натрію.
21. Спосіб лікування ссавця, що страждає на захворювання, які виникають внаслідок аутоімунітету або патологічного запалення, при якому названому ссавцеві вводять похідну хіноліну формули (І)
 ,
,
де
R вибирають з групи: етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор(sec)-бутил та аліл;
R4 вибирають з групи: водень або фармацевтично прийнятні неорганічні або органічні катіони;
R5 вибирають з групи: метил, етил, н-пропіл, ізопропіл, метокси, етокси, хлор, бром, CF3 та OCHxFy,
де x = 0-2;
y = 1-3 за умови, що
x + y = 3;
R6 - це водень; або
R5 та R6 є однаковими і являють собою метилендіокси;
і будь-які їх таутомери.
22. Спосіб за п. 21, який відрізняється тим, що фармацевтично прийнятні неорганічні катіони являють собою натрій, калій та кальцій, а органічні катіони являють собою моноетаноламін, діетаноламін, диметиламіноетанол, морфолін та подібні до них.
23. Спосіб за будь яким з пп. 21-22, який відрізняється тим, що R5 являє собою метил, етил, метокси, хлор, бром.
24. Спосіб за п. 21, який відрізняється тим, що R5 являє собою метил, етил, метокси, хлор, бром.
25. Спосіб за п. 24, який відрізняється тим, що R4 вибирають з групи: водень та натрій.
26. Спосіб за п. 21, який відрізняється тим, що похідна хіноліну, яку вводять, являє собою N-етил-N-феніл-1,2-дигідро-4-гідрокси-5-хлор-1-метил-2-оксохінолін-3-карбоксамід або його натрієву сіль.
27. Спосіб за будь-яким з пп. 21-26, який відрізняється тим, що лікують ссавців, які страждають на розсіяний склероз.
28. Спосіб за будь-яким з пп. 21-26, який відрізняється тим, що лікують ссавців, які страждають на інсулінзалежний цукровий діабет.
29. Спосіб за будь-яким з пп. 21-26, який відрізняється тим, що лікують ссавців, які страждають на системний червоний вовчак.
30. Спосіб за будь-яким з пп. 21-26, який відрізняється тим, що лікують ссавців, які страждають на ревматоїдний артрит.
31. Спосіб за будь-яким з пп. 21-26, який відрізняється тим, що лікують ссавців, які страждають на запальне захворювання кишечнику.
32. Спосіб за будь-яким з пп. 21-26, який відрізняється тим, що лікують ссавців, які страждають на псоріаз.
33. Спосіб за будь-яким з пп. 21-26, який відрізняється тим, що лікують ссавців, які страждають на запальне респіраторне захворювання, таке як астма.
34. Спосіб за будь-яким з пп. 21-26, який відрізняється тим, що лікують ссавців, які страждають на атеросклероз.
35. Спосіб за будь-яким з пп. 21-26, який відрізняється тим, що лікують ссавців, які страждають на удар.
36. Спосіб за будь-яким з пп. 21-26, який відрізняється тим, що лікують ссавців, які страждають на хворобу Альцгеймера.
Текст
1 ПОХІДНІ хіноліну загальної формули (І) O R , о 6 Похідна хіноліну за пп 1 або 2, яка відрізняється тим, що являє собою г\І-етил-г\І-феніл-1,2-дипдро-4пдрокси-5-метил-1-метил-2-оксохінолш-3карбоксамід 7 Похідна хіноліну за пп 1 або 2, яка відрізняється тим, що являє собою г\І-етил-г\І-феніл-1,2-дипдро-4пдрокси-5-етил-1-метил-2-оксохінолш-3карбоксамід 8 Похідна хіноліну за пп 1 або 2, яка відрізняється тим, що являє собою г\І-етил-г\І-феніл-1,2-дипдро-4пдрокси-5-метокси-1-метил-2-оксохінолш-3карбоксамід 9 Похідна хіноліну за пп 1 або 2, яка відрізняється тим, що являє собою г\І-етил-г\І-феніл-1,2-дипдро-4пдрокси-5-хлор-1-метил-2-оксохінолш-3карбоксамід або його натрієву сіль 10 Похідна хіноліну за пп 1 або 2, яка відрізняється тим, що являє собою г\І-етил-г\І-феніл-1,2-дипдро-4ПДРОКСИ-5-6РОМ-1-МЄТИЛ-2-ОКСОХІНОЛІН-3 R вибирають з групи етил, н-пропіл, ізопропіл, нбутил, ізобутил, втор (sec)-бутил та аліл, F?4 вибирають з групи водень або фармацевтично прийнятні неорганічні або органічні катіони, Rs вибирають з групи метил, етил, н-пропіл, ізопропіл, метокси, етокси, хлор, бром, CF3TaOCH x F y , де х = 0-2, у = 1-3 за умови, що х + у = З, F?6 - це водень, або Rs та F 6 є однаковими і являють собою мети? лендюкси, і будь-які іхтаутомери 2 ПОХІДНІ хіноліну за п 1, які відрізняються тим, що фармацевтично прийнятні неорганічні катіони являють собою натрій, калій та кальцій, а органічні катіони являють собою моноетаноламш, діетаноламін, диметиламшоетанол, морфолшта подібні до них 3 ПОХІДНІ хіноліну за пп 1 або 2, які відрізняються тим, що R5 являє собою метил, етил, метокси, хлор, бром 4 ПОХІДНІ хіноліну за п 3, які відрізняються тим, що R являє собою етил та н-пропіл 5 ПОХІДНІ хіноліну за п 4, які відрізняються тим, що F?4 вибирають з водню та натрію карбоксамід 11 Похідна хіноліну за пп 1 або 2, яка відрізняється тим, що являє собою г\І-етил-г\І-феніл-1,2-дипдро-4пдрокси-5,6-метилендюкси-1-метил-2-оксохінолін-3карбоксамід 12 Похідна хіноліну за будь-яким з попередніх пунктів, яка використовується як лікарський засіб 13 Фармацевтична композиція, яка містить як активний інгредієнт похідну хіноліну, що має загальну формулу (І), разом з фармацевтично прийнятним носієм 14 Фармацевтична композиція за п 1 3 , яка відрізняється тим, що містить ІНШІ фармакологічно активні субстанції (речовини) 15 Фармацевтична композиція за п 13 або 14, яка використовується як лікарський засіб у денній (добовій) дозі активного інгредієнта від 0,0005 мг/кг до приблизно 10 мг/кг ваги тіла, зокрема від 0,005 мг/кг до 1 мг/кг ваги тіла 16 Спосіб одержання похідної хіноліну загальної формули (І) шляхом взаємодії ефірної похідної хінолінкарбоксильної кислоти формули переважно метилового або етилового ефіру, з О ю со о (О 60354 4 R6 - це водень, або Rs та R6 є однаковими і являють собою метилендюкси, і будь-які іхтаутомери 22 Спосіб за п 21, який відрізняється тим, що фармацевтично прийнятні неорганічні катіони являють собою натрій, калій та кальцій, а органічні катіони являють собою моноетаноламш, діетаноламін, диметиламшоетанол, морфолін та подібні до них 23 Спосіб за будь яким з пп 21-22, який відрізняється тим, що Rs являє собою метил, етил, метокси, хлор, бром переважно метиловим або етиловим ефіром, з ви24 Спосіб за п21, який відрізняється тим, що Rs користанням сильного лугу, наприклад натрію являє собою метил, етил, метокси, хлор, бром гідриду, в придатному розчиннику, такому як N,N25 Спосіб за п 24, який відрізняється тим, що R4 диметилацетамід вибирають з групи водень та натрій 18 Спосіб одержання похідної хіноліну загальної 26 Спосіб за п 21, який відрізняється тим, що похіформули (І) шляхом взаємодії хінолінкарбоксильної дна хіноліну, яку вводять, являє собою г\І-етил-І\Ікислоти формули (VI) з аніліном формули феніл-1,2-дипдро-4-пдрокси-5-хлор-1-метил-2оксохінолш-3-карбоксамід або його натрієву сіль 27 Спосіб за будь-яким з пп 21-26, який відрізняється тим, що лікують ссавців, які страждають на розсіяний склероз 28 Спосіб за будь-яким з пп 21-26, який відрізняється тим, що лікують ссавців, які страждають на з використанням придатного звязуючого реагенту, інсулінзалежний цукровий діабет переважно карбодиміду або хлористого тіонілу в 29 Спосіб за будь-яким з пп 21-26, який присутності триетиламіну і придатного розчинника, відрізняється тим, що лікують ссавців, які страждатакого як дихлорметан ють на системний червоний вовчак 19 Спосіб за п19, який відрізняється тим, що R 30 Спосіб за будь-яким з пп 21-26, який являє собою етил та н-пропіл відрізняється тим, що лікують ссавців, які стражда20 Спосіб за п 20, який відрізняється тим, що R4 ють на ревматоїдний артрит вибирають з водню та натрію 21 Спосіб лікування ссавця, що страждає на захво31 Спосіб за будь-яким з пп 21-26, який рювання, які виникають внаслідок аутоімунітету або відрізняється тим, що лікують ссавців, які страждапатологічного запалення, при якому названому ссають на запальне захворювання кишечнику вцеві вводять похідну хіноліну формули (І) 32 Спосіб за будь-яким з пп 21-26, який відрізняється тим, що лікують ссавців, які страждаOR, О R ють на псоріаз 33 Спосіб за будь-яким з пп 21-26, який відрізняється тим, що лікують ссавців, які страждають на запальне респіраторне захворювання, таке як астма 34 Спосіб за будь-яким з пп 21-26, який відрізняється тим, що лікують ссавців, які страждаR вибирають з групи етил, н-пропіл, ізопропіл, нють на атеросклероз бутил, ізобутил, втор (sec)-бутил та аліл, 35 Спосіб за будь-яким з пп 21-26, який R4 вибирають з групи водень або фармацевтично відрізняється тим, що лікують ссавців, які страждаприйнятні неорганічні або органічні катіони, ють на удар Rs вибирають з групи метил, етил, н-пропіл, ізопро36 Спосіб за будь-яким з пп 21-26, який піл, метокси, етокси, хлор, бром, CF3TaOCHxFy, відрізняється тим, що лікують ссавців, які страждаде х = 0-2, ють на хворобу Альцгеймера у = 1-3 за умови, що х + у = З, аніліном формули (III) в придатному розчиннику, такомуяктолуол, ксилол та подібні до них 17 Спосіб одержання похідної хіноліну загальної формули (І) шляхом взаємодії ізатоєвого ангідриду формули (IV) з алкільним ефіром N-anKin-Nфенілкарбамоілоцтової кислоти формули (V), Винахід стосується нових похідних хіноліну, способів їх одержання, фармацевтичних композицій на їх основі, а також їх використання для КЛІНІЧНОГО лікування аутоімунних захворювань, таких як розсіяний склероз, інсулінзалежний цукровий діабет, системний червоний вовчак, ревматоїдний артрит, запальне захворювання кишечнику та псоріаз і, крім того, захворювань, в яких головну роль відіграє патологічне запалення, таких як астма, атеросклероз, удар та хвороба Альцгеймера Особливо даний винахід стосується нових похідних хіноліну, які придатні для лікування, наприклад розсіяного склерозу та його проявів Аутоімунні захворювання, наприклад розсіяний склероз, інсулінзалежний цукровий діабет (діабет І типу), системний червоний -вовчак, ревматоїдний артрит, запальне захворювання кишечнику та псоріаз являють собою напади імун 60354 ноі системи організму, які за своєю природою можуть бути системними або спрямованими на окремі органи тіла Вважається, що це захворювання, в ході яких імунна система робить помилки і замість того, щоб виконувати захисні функції, стає агресором (1) Розсіяний склероз - це найбільш розповсюджене набуте неврологічне захворювання дорослих молодих людей в Західній Європі та ПІВНІЧНІЙ Америці Це захворювання є причиною більшої КІЛЬКОСТІ випадків інвалідності та фінансових втрат, як за рахунок втрати доходів, так і за рахунок витрат на медичне обслуговування, ніж будьяке інше неврологічне захворювання в цій ВІКОВІЙ групі В Сполучених Штатах Америки зареєстровано приблизно 250 000 випадків розсіяного склерозу Хоча причина розсіяного склерозу лишається невідомою, досягнення у візуалізацм головного мозку, імунологи та молекулярній біологи розширили розуміння цього захворювання дослідниками На СЬОГОДНІШНІЙ день використовуються певні засоби лікування розсіяного склерозу, але немає єдиного засобу, який демонстрував би драматичну ефективність лікування Існуючі засоби лікування розсіяного склерозу можуть бути поділені на три категорії лікування гострих проявів, модуляція прогресу захворювання та лікування специфічних симптомів Розсіяний склероз вражає центральну нервову систему і включає в себе процес деміелінізацп, тобто втрату мієлінової оболонки, яка захищає аксони МІЄЛІН відіграє роль ІЗОЛЯЦІЙНОГО матеріалу, який робить можливим швидке проведення нервових імпульсів Без сумніву, при демієлінізацп ця властивість втрачається Хоча патогенетичний механізм розсіяного склерозу ще незрозумілий, деякі сери доказів показують, що демієлінізація ґрунтується на імунопатолопчній основі Патологічні пошкодження — бляшки — характеризуються інфільтрацією імунологічне активних клітин, таких як макрофаги та активовані Тклітини (2) В Патенті США №4 547 511, Патенті США №4 738 971 та ЕР 59 698 деякі ПОХІДНІ ІЧ-арил-1,2дипдро-4-заміщеного 1-алкіл-2-оксохінолш-3карбоксаміду заявлені як підсилювачі клітинного імунітету До вказаної сери сполук належить сполука формули Рохінімекс JRcquinimex) яка відома як рохшімекс (roqumimex, Merck Index 12th Ed, №8418, Linomide®, LS2616, N-метил-Мфеніл-І,2-дипдро-4-пдрокси-1-метил-2-оксохінолін3-карбоксамід) Рохшімекс виявив численні імуномодулюючі властивості, які не супроводжувалися загальною імуносупресіею (3-12) Крім того, в Патенті США №5 580 882 ПОХІДНІ ХІНОЛІН-3 карбоксаміду заявлені як сполуки, корисні в лікуванні станів, асоційованих з розсіяним склерозом Особлива перевага надається рохшімексу В Патенті США №5 594 005 ПОХІДНІ ХІНОЛІН-3 карбоксаміду заявлені як сполуки, корисні в лікуванні діабету І типу, особлива перевага надається рохшімексу В заявці WO 95/24195 ПОХІДНІ ХІНОЛІН3-карбоксаміду заявлені як сполуки, корисні в лікуванні запального захворювання кишечнику (inflammatory bowel disease) Особлива перевага надається рохшімексу або його солі В заявці WO 95/24196 ПОХІДНІ хшолш-3-карбоксаміду заявлені як сполуки, корисні в лікуванні псоріазу Особлива перевага надається рохшімексу або його солі В КЛІНІЧНИХ випробуваннях, які порівнювали рохшімекс з плацебо, рохшімекс виправдав надії на лікування станів, асоційованих з розсіяним склерозом (13, 14) Однак рохшімекс має деякі серйозні негативні риси Зокрема він виявив тератогенні властивості на щурах і здатність викликати побічні ефекти у людей, які обмежують інтервал вживаних доз, наприклад грипоподібний синдром, який заважає повністю використовувати КЛІНІЧНИЙ потенціал сполуки Далі, в заявці WO 92/18483 заявлені ПОХІДНІ хіноліну, заміщені в положенні 6 групою RAS(O) R (де Рд=нижчий алкіл або арил, п=0-2), які виявляють імуномодулюючу, протизапальну та протиракову дію Вищевказане заміщення, тобто його тип і ПОСЛІДОВНІСТЬ у зазначених сполуках виносить їх за межі даного винаходу Опис винаходу Головною метою даного винаходу є створити структурно нові сполуки хіноліну, які завдяки перевагам їх фармакологічного профілю, високій ефективності на експериментальних моделях та низькому рівню побічних ефектів, розглядалися б як ЦІННІ в лікуванні захворювань, які є наслідком аутоімунітетута патологічного запалення Прикладами таких захворювань є розсіяний склероз, інсулшзалежний цукровий діабет, системний червоний вовчак, ревматоїдний артрит, запальне захворювання кишечнику (inflammatory bowel disease) та псоріаз, а також ІНШІ захворювання, в яких запалення відіграє головну роль, таких як астма, атеросклероз, удар (stroke) та хвороба Альцгеймера Особливо даний винахід стосується нових похідних хіноліну, придатних для лікування, наприклад розсіяного склерозу та його проявів Нами було несподівано виявлено, що нові сполуки загальної формули (І) Де R обирається з групи етил, н-пропіл, ізопропіл, н-бутил, ізо-бутил, втор (sec)-бутил та алліл, F 4 обирається з групи водень або фармацев? тично прийнятні неорганічні катіони, такі як натрій, калій та кальцій, або органічні катіони, такі як моноетаноламін, диетаноламін, диметиламіноетанол, морфолш та подібні до них, Rs обирається з групи метил, етил, н-пропіл, ізо-пропіл, метокси, етокси, хлор, бром, CF3 та OChU=u, 60354 Де х=0-2, у=1-3 за умови, що х+у=3, R6 це водень, або Rs та R6 є однаковими і являють собою метилендюкси, є несподівано ефективними та виявляють специфічну активність в лікуванні осіб, які страждають на аутоімунні та запальні захворювання Сполуки загальної формули (І) можуть існувати в різних таутомерних формах і всі ці форми включені в даний винахід В переважному втіленні винаходу R4 є водень або натрій та Rs є етил, метокси, хлор або бром та Rs і R6 є однаковими і являють собою метилендюкси, та R є етил або нпропіл, особливо етил Для декількох аутоімунних захворювань людини існують експериментальні моделі, які спонтанно виникають у деяких видів лабораторних тварин або можуть бути викликані у лабораторних тварин шляхом імунізації специфічним(й) антигеном(ами) з органу-мішені Експериментальний аутоімунний енцефаломієліт (ЕАЕ), як модель аутоімунного запального захворювання центральної нервової системи, являє собою найбільш широко розповсюджену модель для захворювання людини на розсіяний склероз Аутоімунітет по відношенню до колагену типу II може бути експериментальне викликаний у деяких видів мишей або щурів і може призвести до розвитку поліартриту Коллаген-індукований артрит має деякі характерні риси, СПІЛЬНІ ІЗ захворюванням на ревматоїдний артрит у людини ВІДМІННОЮ ознакою астми у людей є підвищена реактивність дихальних шляхів до ряду ХІМІЧНИХ та фізичних стимулів Вважається, що продукти, які вивільняються з клітин запалення, наприклад активованих еозинофілів, компрометують ЦІЛІСНІСТЬ епітелію і сприяють бронхіальній пперреактивності Домінує модель індукованого овальбуміном легеневого запалення у мишей завдяки скороминущому припливу лімфоцитів та еозинофілів в бронхіальний просвіт Виявлено, що рохшімекс викликає синдром болі гончих (Beagle Pain Syndrome) у різних порід гончих собак (15, 16) Це захворювання характеризується КЛІНІЧНИМИ та лабораторними проявами, які дозволяють розглядати його як модель грипоподібного синдрому, який рохшімекс викликає у людини Сполуки загальної формули (І) були випробувані на здатність інгібувати ЕАЕ у мишей Рохшімекс був використаний як контроль лікування і продемонстрував інгібування на 70% в дозі 5мг/кг Дивовижні та неочікувані результати були отримані при введенні ВІДПОВІДНОГО замісника в положення 5 ХІНОЛІНОВОГО кільця, наприклад 5хлор Порівняно з рохшімексом, ефективність зросла в 100 разів Заміщення в положеннях 6, 7 та 8 привело до менш активних сполук Загалом, активність ЕАЕ, яка оцінювалася за ступенем інгібування ЕАЕ, знижувалася в наступному порядку ВІДПОВІДНО положенню замісника 5>6»7=8 Вплив заміщення в положенні 5 може бути великою мірою прояснений на фізико-хімічному рівні Крім 8 того, заміщення метильної групи при карбоксамідному азоті на етильну або подальше подовження алькільної групи до пропільного або бутильного радикалу гасить тератогенний вплив рохшімексу на щурів і значно зменшує синдром болі гончих (Beagle Pain Syndrome) 3 іншого боку, заміна Rгрупи з алкілу на водень зменшує водорозчинність при фізіологічних значеннях рН більш ніж в 105 разів Заміна алкільної групи також вплинула на фармакокшетичні властивості Наприклад, порівняно з рохшімексом кліренс (СІ) сполуки А у собак був у 800 разів вищий Показники розчинності та фармакокінетичні параметри значно зменшують корисний ступінь активності цього класу (R=H) сполук Тож, сполуки формули (І) несподівано виявилися ХІМІЧНО та фармакологічно ВІДМІННИМИ від тих лікарських засобів, які раніше застосовувалися для лікування розсіяного склерозу та його проявів Сполуки загальної формули (І) одержані наступними способами Спосіб А ft 9Н Я СН, Сполуки формули (І) можуть бути одержані відомими методами, наприклад, реакцією ефірного похідного хшолінкарбоксильної кислоти (II) з аніліном (III) в придатному розчиннику, такому як толуол, ксилол і подібних до них Придатними ефірами є метилові та етилові ефіри Спосіб В СНз Сполуки формули (І) можуть також бути одержані реакцією ізатоєвого (isatoic) ангідриду (IV) з алкільним ефіром N-алкіл-ІЯфенілкарбамоілоцтової кислоти (V) з використанням сильного лугу, наприклад гідриду натрію в придатному розчиннику, такому як М,Мдиметилацетамід Придатними ефірами є метилові та етилові ефіри Спосіб С Сполуки формули (І) можуть також бути одержані реакцією хшолінкарбоксильної кислоти формули (VI) з аніліном формули (III) Можуть бути 60354 застосовані різні зв'язуючі (coupling) реагенти, ВІДОМІ з рівня техніки, наприклад, карбодиміди, описані в Патенті США №4 547 511 Один з придатних методів використовує хлористий ТІОНІЛ в присутності триетиламіну і придатного розчинника, такого як дихлорметан Цей метод може бути використаний в окремих випадках, коли прямої взаємодії між ефіром та аніліном не відбувається Хінолшкарбоксильні кислоти формули (VI) можуть бути одержані з ВІДПОВІДНИХ ефірів формули (II) шляхом кислотного гідролізу, як описано нижче Хінолшкарбоксильні ефіри (II)/ вказані вище, можуть бути одержані за способами, які наведені нижче у прикладах 5-8 Хінолшкарбоксильні кислоти (VI) можуть бути одержані за способом, який наведений нижче в прикладі 9 Всі втілення винаходу, які розкриті в формулі винаходу, при цьому включені в специфікацію Наступні приклади покликані ілюструвати винахід, без обмеження його меж Приклад 1 М-Етил-г\І-фен1л-1,2-дипдро-4-пдрокси-5метокси-1-метил-2-оксохінолш-3-карбоксамід (Спосіб А) N-Етиланілш (3,0г, 25ммоль) розчиняють у 80мл толуолу і приблизно ЗОмл розчинника випарюють для одержання сухого розчину До киплячого розчину додають етиловий ефір 1,2-дипдро-4пдрокси-5-метокси-1-метил-2-оксохінолш-3карбоксильної кислоти (2,7г, Юммоль) Етанол, який утворюється під час реакції, випарюють разом з певною КІЛЬКІСТЮ толуолу на протязі приблизно 4 годин Реакційну суміш охолоджують до кімнатної температури Осад збирають, промивають холодним толуолом та гексаном і висушують, одержуючи названу сполуку (2,8 г), вихід 80% 1Н NMR (CDCI3) 5 1,26 (ЗН, t), 3,50 (ЗН, s), 3,97 (2Н, q) , 4,03 (ЗН, S), 6,67 (1Н, d), 6,87 (1Н, d), 7,127,25 (ЗН, т ) , 7,36-7,44 (ЗН, т ) 13С NMR (CDCI3) 5 13,0 (СН3) , 29,6 (СН3), 43,8 (СН2) , 56,8 (СНз), 103,2 (СН), 104,2 (С), 108,3 (СН), 110,5 (С), 127,3 (2СН), 127,4 (СН), 128,5 (2СН), 131,2 (СН), 141,1 (С), 141,9 (С), 156,9 (С), 157,1 (С), 160,2 (С), 164,4 (С) + ESI MS/MS [M+H] 353, фрагменти 232 та 122 Практично в той самий спосіб одержані з ВІДПОВІДНИХ ВИХІДНИХ матеріалів наступні сполуки г\І-етил-г\І-феніл-1,2-дипдро-1,5-диметил-4пдрокси-2-оксохінолш-З-карбоксамід 1Н NMR (CDCI3) 5 1,21 (ЗН, t), 2,83 (ЗН, s), 3,23 (ЗН, s), 3,98 (2Н, q), 6,97 (1Н, d), 7,02 (1Н, d) , 7,107,25 (5Н, т ) , 7,39 (1H,t), 13,08 (1Н, s) 13С NMR (CDCI3) 5 12,9 (СНз) , 24,4 (СН3) , 29,5 (СНз) , 45,9 (СН2) , 102,8 (С), 112,2 (СН), 114,3 (С), 125,5 (СН), 126,4 (2СН), 126,4 (СН), 128,4 (2СН), 131,7 (СН), 139,6 (С), 142,0 (С), 142,4 (С), 158,1 (С), 169,7 (С), 170,1 (С) ESI MS/MS [M+H]+ 337, фрагменти 216та 122 М-етил-г\І-феніл-1,2-дипдро-4-пдрокси-5-хлор1-метил-2-оксохінолш-3-карбоксамід 1Н NMR (CDCI3) 5 1,20 (ЗН, t), 3,28 (ЗН, s), 3,97 (2Н, q), 7,08-7,25 (7Н, ш), 7,39 (1Н, t), 12,6 (1Н, s) 13С NMR (CDCI3) 5 12,9 (СНз) , 29,8 (СН3) , 45,7 (СН2) , 105,0 (С), 112,7 (С) , 113,3 (СН), 125,4 (СН), 126,7 (2СН), 126,8 (СН), 128,5 (2СН), 131,6 10 (СН), 132,7 (С) , 142,0 (С) , 142,6 (С), 157,9 (С), 165,6 (С), 168,7 (С) + ESI MS/MS [M+H] 357, фрагменти 236 та 122 М-етил-г\І-феніл-1,2-дипдро-4-пдрокси-5-фтор1-метил-2-оксохінолш-3-карбоксамід 1Н NMR (CDCI3+TFA) 5 1,28 (ЗН, t), 3,66 (ЗН, s), 3,93-4,05 (2Н, щ), 7,11 (1Н, q), 7,26-7,37 (6Н, ш), 7,68 (1Н, q), 11,42 (1H,s) 13С NMR (CDCI3+TFA) 5 12,6 (СНз), 31,4 (СН3), 46,4 (СН2), 104,4+104,5 (С), 108,7 (С), 110,4 + 110,5 (СН), 112,7+112,8 (СН), 126,8 (2СН), 129,7 (СН), 129,8 (2СН), 134,1+134,2 (СН), 139,9 (С), 141,0 (С), 158.0 (С), 159,3+161,3 (С), 161,4 (С), 166,8 (С) (деякі піки являють собою дублети внаслідок Fзчеплення) + ESI MS/MS [M+H] 341 фрагменти 220 та 122 М-етил-г\І-феніл-1,2-дипдро-4-пдрокси-5трифторметил-1-метил-2-оксохшолш-3карбоксамід 1Н NMR (CDCI3+TFA) 5 1,21 (ЗН, t), 3,30 (ЗН, s), 3,99 (2Н, q), 7,10-7,25 (5Н, ш), 7,42 (1Н, d), 7,60 (1H,t), 7,67(1 Н, d), 13,05 (1H,s) 13С NMR (CDCI3+TFA) 5 12,5 (СНз), 31,1 (CH3), 46,2 (СН2), 106,4 (С), 113,0 (С), 119,5 (СН), 120+122,2+124,4 (CF3), 123,4 (СН), 126,6 (2СН), 128.1 (СН), 128,1+128,3 (С), 129,1 (2СН), 132,1 (СН), 140,5 (С), 141,4 (С), 159,3 (С), 163,7 (С), 167,8 (С) ESI MS/MS [M+H]+ 391 фрагменти 270 та 122 М-етил-г\І-феніл-1,2-дипдро-4-пдрокси-5трифторметокси-і-метил-2-оксохшолін-Зкарбоксамід М-алл1л-г\1-фен1л-1,2-дипдро-4-пдрокси-5-хлор1-метил-2-оксохінолін-3-карбоксамід 1Н NMR (CDCI3) 5 3,33 (ЗН, s), 4,57 (2Н, ш), 5,22 (1Н, d), 5,38 (1Н, d), 6,0 (1Н, ш), 7,13-7,30 (7Н, ш), 7,44 (1H,t), 12,45 (1H,s) М-алліл-г\І-феніл-1,2-дипдро-4-пдрокси-5метокси-1-метил-2-оксохінолш-3-карбоксамід 1Н NMR (CDCI3) 5 3,52 (ЗН, s), 4,04 (ЗН, s), 4,52 (2Н, m), 5,20 (1Н, d), 5,37 (1Н, d), 6,02 (1Н, m), 6,67 (1Н, d), 6,88 (1Н, d), 7,10-7,23 (ЗН, m), 7,387,45 (ЗН, m), 9,82 (1H,s) М-феніл-г\І-п-пропіл-1,2-дипдро-4-пдрокси-5метокси-1-метил-2-оксохінолш-3-карбоксамід 1Н NMR (CDCI3) 5 1,0 (ЗН, t), 1,65 (2Н, ш), 3,48 (ЗН, s), 3,9 (2Н, t), 4,01 (ЗН, s), 6,65 (1Н, d), 6,83 (1Н, d), 7,1-7,25 (ЗН, ш), 7,3-7,45 (ЗН, ш), 9,8 (1Н, s) Приклад 2 М-етил-г\І-феніл-1,2-дипдро-4-пдрокси-5-хлор1-метил-2-оксохінолш-3-карбоксамід (Спосіб В) 5-Хлорізатоєвий (5-Chloro isatoic) ангідрид (5г, 25ммоль) розчиняють в 50мл N, Nдиметилацетаміду та охолоджують до 0°С Після цього додають натрію гідрид (75%) (0,94г, 1,1 еквівалент) і метилйодид (1,89мл, 1,2 еквівалент) щоб підтримати температуру нижче 5°С Реакційну суміш перемішують при 20°С на протязі 5 годин, після чого метилйодид, який залишився, видаляють під вакуумом Гідрид натрію (0,94г, 1,1 еквівалент) додають разом з етиловим ефіром N-етилN-фенілкарбамоілоцтовоі кислоти (6,3г, 1,1 еквівалент) Суміш нагрівають до 85°С і витримують протягом 5 годин Після охолодження до кімнатної 60354 12 11 температури додають 50 л метанолу та 50мл 1М (СН), 127,9 (2СН), 127,9 (СН), 129,6 (2СН), 131,1 хлористоводневої кислоти і після цього додають (СН), 131,6 (С), 137,9 (С широкий), 142,1 (С), 158,6 250мл води Утворюється емульсія, яка кристалі(С), 160,6 (С), 167,5 (С) зується при стоянні в холодильнику на протязі 72 М-феніл-г\І-(п-пропіл)-1,2-дипдро-4-пдрокси-5годин Кристалічну масу збирають шляхом фільтхлор-1-метил-2-оксохінолш-3-карбоксамід рації, промивають водою, сумішшю води з мета1Н NMR (CDCI3) 5 0,95 (ЗН, t), 1,58-1,59 (2Н, нолом (1 1) та гептаном і висушують, одержуючи т), 3,29 (ЗН, s широкий), 3,88 (2Н, широкий), 7,08названу сполуку (6,12г) Названу сполуку перекри7,26 (7Н, т ) , 7,41 (1Н, t), 12,5 (1Н, s широкий) сталізують з метанолу з чистотою > 95% Приклад 4 Приклад З М-етил-г\І-феніл-1,2-дипдро-4-пдрокси-5-хлорМ-етил-г\І-феніл-1,2-дипдро-4-пдрокси-5-бром1-метил-2-оксохінолш-3-карбоксаміду натрієва сіль 1-метил-2-оксохінолш-3-карбоксамід Розчин 5М натрію гідроксиду одержують шля(Спосіб С) хом розведення 50% (по масі) розчину натрію гідДо охолодженого льодом розчину 1,2-дипдророксиду (10,0г) стерильною водою до загального 4-пдрокси-5-бром-1-метил-2-оксохінолш-3об'єму 25мл г\І-Етил-г\І-феніл-1,2-дипдро-4карбоксильної кислоти (9,6г, 0,032моль), триетипдрокси-5-хлор-1-метил-2-оксохінолш-3ламіну (15,5мл, 0,11моль) та N-етиланіліну (4,2г, карбоксамід (10,0г) суспендують в етанолі (150мл) 0,035моль) у 150мл дихлорметану додають по та додають попередньо приготований 5М розчин краплях протягом 0,5 години розчин хлористого натрію гідроксиду до рН 8-12 (5,6мл) Реакційну тіонілу (3,0мл, 0,042моль) у Юмл дихлорметану суміш перемішують протягом ЗО хвилин при темПеремішування продовжують протягом 24 годин пературі навколишнього середовища Осад, що при 4°С Розчинники випарюють Залишок розчиутворюється, відфільтровують і ДВІЧІ швидко проняють в етилацетаті, фільтрують крізь броунмілмивають етанолом (2х150мл) Після цього осад лерит (cehte) та екстрагують 2М натрію гідроксивисушують під вакуумом над P2Os з одержанням дом Водну фазу промивають етилацетатом і названої сполуки (9,5г), вихід 90% потім підкислюють хлористоводневою кислотою 1Н NMR (D2O) Два ізомери в співвідношенні до рН 5 При стоянні утворюється кристалічний 1 4 5 1,90 (3H,t, менша форма), 1,10 (ЗН, t, більша осад, який відфільтровують, промивають водою та форма), 3,21 (ЗН, s, більша форма), 3,50 (ЗН, s, висушують з одержанням названої сполуки (8,5г), менша форма), 3,50-3,70 (2Н, т , менша форма), вихід 69% 3,70-3,85 (2Н, т , більша форма), 6,92-7,51 (8Н, т , обидві форми) 1Н NMR (СВСІз) 5 1,15-1,22 (ЗН, широкий сигнал), 3,25 (ЗН, s), 3,95 (2Н, s широкий), 7,08-7,31 Приклад 5 (7Н, т ) , 7,43-7,50 (1Н, т ) ЕТИЛОВИЙ ефір 1,2-дипдро-4-пдрокси-5-хлор-1Практично в той самий спосіб одержані з ВІДметил-2-оксохшолін-З-карбоксильноі кислоти ПОВІДНИХ ВИХІДНИХ матеріалів наступні сполуки Фосген (51г, 0,52моль), розчинений в діоксані М-етил-г\І-феніл-1,2-дипдро-4-пдрокси-5,6(150мл), додають порціями до механічно переміМЄТИЛЄНДІОКСИ-1-МЄТИЛ-2-ОКСОХІНОЛІН-3шуваної суспензії натрію бікарбонату (44г, 0,52моль) та 2-аміно-6-хлорбензойноі кислоти карбоксамід (30г, 0,175моль) в діоксані (ЗООмл) Відбувається 1Н NMR (CDCI3+TPA) 5 1,27 (ЗН, t), 3,57 (ЗН, бурна реакція з виділенням газу, після цього реакs), 3,98 (2Н, q), 6,23 (2Н, s), 6,86 (1Н, d), 7,19 (1Н, ційну суміш охолоджують до температури нижче d), 7,25-7,35 (5Н, т ) , 10,3 (1Н, s широкий) 50°С і витримують протягом ЗО хвилин Після цьо13С NMR (CDCI3+TFA) 5 12,4 (СН3), 30,9 (СН3), го реакційну суміш витримують протягом 1 години 46,0 (СН2), 101,6 (С), 103,7 (СН2), 107,4 (С), 108,4 при 50°С Після охолодження до 15°С утворюється (СН), 113,7 (СН), 126,7 (2СН), 128,8 (СН), 129,3 осад, який збирають, змішують з 50мл льодяної (2СН), 134,1 (С), 140,1 (С), 143,1+143,2 (2С), 157,3 оцтової кислоти в 500мл води, знову збирають і (С), 160,9 (С), 166,3 (С) + висушують, одержуючи ізатоєвий (isatoic) ангідрид ESI MS/MS [M+H] 367, фрагменти 246 та 122 (30,3г, 0,15моль) М-етил-г\І-феніл-1,2-дипдро-4-пдрокси-5-етилАнгідрид повільно додають порціями до суміші 1-метил-2-оксохінолш-3-карбоксамід натрію гідриду (5,5г, 0,18моль) в ЗООмл N,N1Н NMR (CDCI3) 5 1,26 (ЗН, t), 1,31 (ЗН, t), 3,20диметилформаміду Після перемішування протя3,34 (5Н, т ) , 4,0 (2Н, q) , 7,02-7,07 (2Н, т ) , 7,13гом 1 години при кімнатній температурі по краплях 7,28 (5Н, т ) , 7,44 (1H,t), 13,2 (1Н, s широкий) додають метилйодид (26г, 0,18моль) і продовжу13С NMR (CDCI3) 5 13,2 (СН3), 16,8 (СН3), ють перемішування протягом 2,5 годин Після цьо29,8+30,2 (СН2+СН2), 46,1 (СН2), 103,3 (С), 112,5 го суміш додають до Зл суміші лід/вода і осад зби(СН), 113,9 (С), 124,6 (СН), 126,7+126,7 (ЗСН), рають та висушують, одержуючи N-метильований 128,6 (2СН), 132,1 (СН), 142,3 (С), 142,6 (С), 146,2 ізатоєвий (isatoic) ангідрид (24,9г, 0,118моль) (С), 158,3 (С), 169,3 (С), 170,4 (С) N-Метильований ангідрид нагрівають до 65°С ESI MS/MS [M+H]* 351, фрагменти 230 та 122 з натрію метилатом (6,3г, 0,117моль) в 130мл меІ\І-феніл-М-ізопропіл-1,2-дипдро-4-пдрокси-5танолу протягом 1 години Розчинник випарюють хлор-1-метил-2-оксохінолш-3-карбоксамід Додають воду та дихлорметан і відокремлюють 1Н NMR (CDC1 з) 5 1,24 (6Н, d), 3,38 (ЗН, s шиорганічний шар, висушують та концентрують до рокий), 5,09 (1Н, широкий сигнал), 7,08 (1Н, d), отримання маслянистого залишку (22,7г, 7,15 (1H,d), 7,15-7,34 (5Н, m), 7,34 (1H,t), 11,1 (1Н, 0,114моль) s широкий) Вищезазначений залишок розчиняють в ЗООмл 13С NMR (CDCI3) 5 21,0 (2СН3), 29,9 (СН3), дихлорметану разом з 4-амінопіридином (0,2г) та 48,2 (СН), 109,4 (С), 112,4 (С), 113,5 (СН), 125,1 60354 14 13 триетиламшом (7,1 мл) Розчин охолоджують і кип'ятять із зворотнім холодильником на протязі 4 повільно додають етилмалонілхлорид (18,9г, днів Після охолодження утворюється білий осад, 0,125моль) Суміш перемішують при кімнатній теякий збирають шляхом фільтрації Тверду речовимпературі протягом 4 годин і продовжують перену, 2-метокси-6-(метиламше)бензонітрил розчимішування (worked up) до одержання сиропу До няють у водному розчині етиленгліколю (500мл) та цього сиропу додають 450мл етанолу та метилат калію гідроксиду (14г) Розчин нагрівають із зворонатрію (18,5г, 0,342моль) і суміш перемішують тнім холодильником при 150°С протягом ночі, охопротягом 3 годин Розчинники випарюють і залилоджують до кімнатної температури и підкислюють шок розчиняють в 750мл води, промивають етиконцентрованою хлористоводневою кислотою до лацетатом і толуолом і після цього підкислюють рН 4 Осад збирають фільтрацією, промивають 5М хлористоводневою кислотою Одержаний осад водою (50мл) і висушують під вакуумом Білу твезбирають і висушують, одержуючи названу сполурду речовину, 5-метоксиантранілову кислоту (32г, ку у вигляді білого порошку (30г, О.Юбмоль), зага0,18моль) та натрію бікарбонат (38г, 0,45моль) льний вихід 60% суспендують в 1,4-дюксані (500мл) і потім повільно додають фосген (25мл, 0,45моль) за умов охоло1Н NMR (CDCI3) 5 1,46 (ЗН, t), 3,63 (ЗН, s), 4,49 дження в льодяній бані Суміш нагрівають до 40°С (2Н, q), 7,23 (1Н, d), 7,27 (1Н, d), 7,49 (1Н, t), 15,0 і витримують протягом 1 години, охолоджують до (1H,s) 15°С, додають воду (150мл) і після цього білу твеПрактично в той самий спосіб одержані з ВІДрду речовину збирають шляхом фільтрації Після ПОВІДНИХ ВИХІДНИХ матеріалів наступні сполуки обережного висушування тверду речовину (20,7г, етиловий ефір 1,2-дипдро-4-пдрокси-5-фтор0,1 моль) додають при кімнатній температурі до 1-метил-2-оксохшолш-3-карбоксильноі кислоти розчину натрію диетилмалонату (0,17моль) у безетиловий ефір 1,2-дипдро-4-пдрокси-1,5водному N.N-диметилформаміді (250мл) Розчин диметил-2-оксохшолін-З-карбоксильноі кислоти нагрівають до 100°С і витримують при цій темпеПриклад 6 ратурі 3 години, охолоджують до кімнатної темпеЕтиловий ефір 1,2-дипдро-4-пдрокси-5ратури, додають воду (250мл) і підкислюють контрифторметил-1-метил-2-оксохшолш-3центрованою хлористоводневою кислотою до рН карбоксильної кислоти 4 Осад збирають шляхом фільтрації і висушують 2-Фто р-6-(трифтор метил) бен зо нітрил (10г, під вакуумом, одержуючи названу сполуку у ви53ммоль) нагрівають до 40°С у безводному мегляді чистих білих кристалів (22г) тиламіні (200мл) в автоклаві протягом 2 днів Надлишку метиламіну дають випаритися і одержану 1Н NMR (CDCI3) 5 1,43 (t, ЗН) , 3,62 (s, ЗН), сіру тверду речовину розчиняють в дихлорметані 3,96 (s, ЗН), 4,45 (q, 2H), 6,70 (d, 1H), 6,92 (d, 1H), (200мл) разом з 4-амшопіридином (0,1г) і триети7f55(t, 1H), 13,5 (s, 1H) ламшом (3,3мл, 26ммоль) До цього охолодженого Приклад 8 розчину повільно додають етилмалонілхлорид Етиловий ефір 1,2-дипдро-4-пдрокси-1-метил(8,8г, бОммоль) Розчин перемішують протягом 4 2-оксо-5,6-метилендюкси-хшолін-3-карбоксильноі годин і після цього продовжують перемішування кислоти (worked up) до одержання жовтуватого сиропу Ди-трет-бутилдикарбонат (36г, 0,17моль) доСироп розчиняють в ЮОмл безводного етанолу і дають порціями до розчину 3,4додають метоксид натрію (5,4г, 0,1 моль) Через 1 (метилендюкси)аніліну (20,6г, 0,15моль) у безводгодину розчинник видаляють і залишок обробляному тетрапдрофурані (150мл) Розчин нагрівають ють дихлорметаном та водою Похідне хіноліну, із зворотнім холодильником протягом 2 годин, пояке утворюється, обережно висушують і потім сутім концентрують під вакуумом з одержанням спендують в охолодженому безводному тетрапдтвердого залишку чорного кольору Цей залишок рофурані (250мл) Повільно додають гідрид натрію розчиняють у безводному тетрапдрофурані (600 (4г, 0,125моль) і потім метил йодид (Юмл, мл) і охолоджують до -40°С По краплях додають 0,15моль) Суміш нагрівають із зворотнім холоди1,ЗМ розчин втор(5ес)-бутиллтю (265мл, льником протягом 6 годин, охолоджують водою і 0,35моль) в гексані обробляють диетиловим ефіром Розчинники виПісля перемішування розчину протягом 0,5 годаляють і залишок (17,3г) розчиняють в суміші дини при -40°С додають гранули сухого льоду (са етанолу (50 мл) та концентрованої хлористовод40г) Суміші дозволяють нагрітися до 0°С і доданевої кислоти (Юмл) Розчин витримують протяють воду (са 700мл) Водний розчин підкислюють гом ночі при температурі 45°С, охолоджують і осад хлористоводневою кислотою до рН 3 і екстрагують збирають, одержуючи названу сполуку (8г) ефіром Екстракти висушують і концентрують до одержання N-tBoc захищеної 5,61Н NMR (CDCI3) 5 1,46 (ЗН, t), 3,68 (ЗН, s), 4,50 (метилендюкси)антраніловоі кислоти у вигляді (2Н, q), 7,58 (1Н, т ) , 7,71 (2Н, т ) , 15,0 (1Н, s) твердого залишку (45г) Цю кислоту додають до Приклад 7 охолодженої льодом суспензії натрію гідриду (80% ЕТИЛОВИЙ ефір 1/2-дипдро-4-пдрокси-5в олії, 9,0г, О.ЗОмоль) у N.N-диметилформаміді метокси-1-метил-2-оксохшолш-3-карбоксильноі (200мл) Суміш перемішують протягом 0,5 години кислоти і додають метилйодид (22мл, 0,35моль) Суміш До розчину 2,6-дифторбензонітрилу (42г, перемішують при кімнатній температурі протягом О.Змоль) в 150мл безводного метанолу повільно ночі, охолоджують водою (600мл) і тричі екстрагудодають при 30°С метилат натрію (17,9г, ють ефіром Органічний шар промивають насичеО.ЗЗмоль) Після початкового нагрівання протягом ним розсолом, висушують і концентрують під ваку1 години із зворотнім холодильником додають умом до одержання темно-коричневої олії Олію водний 40% метиламін (133мл, 1,2моль) і розчин 60354 16 15 розчиняють в метанолі (400мл) і додають конценбані і виливають на подрібнений лід, КІЛЬКІСТЬ якотровану хлористоводневу кислоту (80мл) Розчин го в 10-12 разів перевищує об'єм реакційної суміперемішують протягом ночі при кімнатній темпеші Суміш залишають стояти приблизно на 1 годиратурі, нейтралізують 5М натрію гідроксидом і трину Водну суспензію екстрагують дихлорметаном, чі екстрагують ефіром Комбіновані екстракти фіякий далі висушують і випарюють з одержанням льтрують крізь колонку з S1O2 і елюат суміші двох ізомерів - 4-етил- та 6-етилізатинів у концентрують під вакуумом з одержанням метилспіввідношенні приблизно 0,68 1 (7,6г), вихід 84% ьованого ефіру антранілової кислоти (20 г) Ефір Суміш двох ізомерів розчиняють у водному розчиняють в дихлорметані (400мл) та охолоджунатрію гідроксиді, розчин фільтрують крізь броунють на льодяній бані Додають етилмалонілхлорид міллерит (cehte) і після цього підкислюють до рН 4 (21г, 0,14моль) і через ЗО хвилин після цього до4-Ізомер при цьому значенні рН екстрагують в дидають триетиламін (22мл, 0,16моль) Після перехлорметан, який потім висушують і випарюють, мішування протягом 1 години при кімнатній темпеодержуючи чистий 4-етилізатин (3,1г), вихід 34% ратурі мутну суміш промивають 0,5М 4-Етилізатин (3,1г, 0,018моль) додають до суміші хлористоводневою кислотою і після цього бікарбоконцентрованої сірчаної кислоти (45л) та оцтової натом Органічну фазу обережно висушують і конкислоти (14мл) Суспензію нагрівають до 30°С, центрують під вакуумом Після цього залишок роздодають пероксид водню 35% (2,2мл) і після дочиняють в сухому етанолі (200мл) і додають давання піднімають температуру до 65°С Після натрію метилат (17г, 0,32моль) Суміш перемішунагрівання на протязі 3 годин суміш охолоджують і ють протягом 1 години і додають воду (300 мл) осад відфільтровують, промивають водою і висуРозчин промивають етилацетатом і після цього шують, одержуючи названу сполуку (1,7г), вихід водний розчин підкислюють концентрованою хло48% ристоводневою кислотою Осад збирають шляхом 1Н NMR (DMSO-d6) 5 1,12 (ЗН, t), 3,02 (2Н, q), фільтрації і висушують під вакуумом, одержуючи 6,98 (1Н, d), 7,05 (1Н, d), 7,58 (1Н, t), 11,6 (1Н, шиназвану сполуку у вигляді сірих кристалів (17г), рокий) загальний вихід 41% Фармакологічні методи 1Н NMR (CDCI3) 5 1,45 (ЗН, t), 3,58 (ЗН, s), 4,48 Гострий експериментальний аутоімунний ен(2Н, д), 6,17 (2Н, s), 6,71 (1Н, d), 7,14 (1Н, d) цефаломієліт Приклад 9 Для експерименту використовують мишейсамок SJL/N, віком 8 тижнів Гомогенат спинного 1,2-Дипдро-4-пдрокси-5-метокси-1-метил-2мозку миші отримують від мишей-самок С57В1/6 оксохінолш-3-карбоксильна кислота віком 8-12 тижнів Тканину гомогенізують на льоді і 10мл концентрованої хлористоводневої кисрозводять, в холодній слині, буферизованій фослоти додають при охолодженні до ЗОмл оцтового фатом (PBS) Неповний ад'ювант Фрейнда, що ангідриду До цього розчину додають етиловий містить 1мг/мл М tuberculosis homims H37Ra емуефір 1,2-дипдро-4-пдрокси-5-метокси-1-метил-2льгують з рівним об'ємом гомогенату спинного оксохінолш-3-карбоксильноі кислоти (Ю,5г, мозку миші з одержанням кінцевої концентрації 38ммоль), суміш нагрівають до 80°С і витримують гомогенату спинного мозку миші 10мг/мл Прищепри цій температурі протягом 14 годин Далі суміш пний матеріал в об'ємі 0,1 мл ІН'ЄКЦІЙНИМ ШЛЯХОМ охолоджують до кімнатної температури і відфільтвводять мишам внутрішньошкірно біля основи ровують кристалічний продукт, промивають холохвосту Токсин коклюшу вводять внутрішньочередним метанолом і висушують з одержанням навинно на 0-й та 3-й день після імунізації Лікування званої сполуки (7,2г), вихід 77% проводять перорально щоденно з 3-го по 12-й 1Н NMR (CDCI3) 5 3,73 (ЗН, s), 4,02 (ЗН, s), день після імунізації або з 3-го по 7-й день, та з 106,82 (1Н, d), 7,02 (1Н, d), 7,62 (1Н, t) го по 12-й Контрольні тварини отримують слину Приклад 10 Тварин, в групах по 8 на кожну дозу, обстежують 5-Етилізатоєвий (5-Ethyl isatoic) ангідрид на наявність КЛІНІЧНИХ ознак паралічу за шкалою Суміш хлоралгідрату (59,3г, О.Збмоль), води від 0 до 5 наступним чином 0 - норма, 1 - слабкий (700мл) і натрію сульфату (85,8г, О.бОмоль) нагріхвіст, 2 - парез задніх КІНЦІВОК, 3 - параліч задніх вають до 50°С Коли температура 50°С досягнута, КІНЦІВОК і слабкі передні ноги, 4 - білатеральний послідовно додають суміш 3-етиланіліну (40,8г, параліч передніх і задніх КІНЦІВОК, 5 - смерть КЛІНІО.ЗЗмоль), води (700мл) і концентрованої хлорисЧНІ ознаки оцінюють на 7-й день і щоденно, почитоводневої кислоти (33,6мл) та суміш пдроксиланаючи з 9-го дня і до кінця експерименту на 14-й міну пдрохлориду (74,8г, 1,04моль) і води (ЗЗОмл) день Ефект лікування розраховують як відсоток Отриману суміш нагрівають до 80°С протягом ЗО інгібування КЛІНІЧНИХ балів, порівняно з контрольхвилин і витримують при цій температурі ще 10 ними тваринами, які отримували слину хвилин перед тим, як охолодити реакційну суміш у льодяній бані Одержаний осад відфільтровують, Коллаген-індукований артрит промивають водою і висушують під вакуумом над Для експерименту використовують мишейР2О5 з одержанням ізонітрозоацетаніліду (36,6г), самців DBA/1 віком 8-10 тижнів В 0-й день мишей вихід 58% Ізонітрозоацетанілід (10,0г, 0,05моль) імунізують внутрішньошкірно біля основи хвоста порціями додають до попередньо нагрітої до 50°С бичачим колагеном типу II (ЮОмкг/мишу) в повносуміші води (9мл) і концентрованої сірчаної кислому ад'юванті Фрейнда Лікування проводять пероти (60мл), підтримуючи температуру 50-55°С По рально, з 3-го дня по 7-й, з 10-го по 14-й, з 17-го по закінченні додавання суміш нагрівають до 80°С і 21-й, з 24-го по 28-й і з 31-го по 35-й Через 15 днів витримують при цій температурі 10 хвилин Після після імунізації мишей оглядають на предмет цього реакційну суміш охолоджують на льодяній ознак артриту Тварин оглядають 3 рази на тиж 60354 18 17 день Кожний 2-й або 3-й день окремі лапи тварин мшобензидинутетрапдрохлориду з артритом оцінюють за шкалою від 0 до 4 (0 - неТератогенний вплив на щурів має артриту, 1 - артрит одного з міжфалангових, Сполуки вводять підшкірне щурам-самкам плеснофалангових, або міжзап'ястних суглобів, 2 протягом 8-14 днів вагітності На 20-й день після артрит 2-х суглобів, 3 - артрит трьох суглобів, 4 запліднення щурам здійснюють кесарів розтин і так само, як і 3, але з більш вираженим почервотварин умертвляють Плоди вивчають на наявнінням та опуханням лапи) КІЛЬКІСТЬ балів для ність ЗОВНІШНІХ і внутрішніх вад кожної лапи додають з одержанням максимально Синдром болі гончих (Beagle Pain Syndrome, досяжного балу 16 для кожної миші BPS) Сполуки вводять внутрішньовенно гончим собакам Загальну дозу вводять протягом 5 посліОвальбумін-індуковане запалення легенів довних днів Собак оцінюють на наявність КЛІНІЧДля експерименту використовують мишейНИХ та лабораторних ознак больового синдрому, самок С57В1/6 віком 10-14 тижнів, по 10 мишей в наприклад, лихоманка, підвищення швидкості зсігрупі Мишей сенсибілізують овальбуміном на дання еритроцитів, лужна фосфатаза, індукція алюмінію гідроксиді в об'ємі 0,2мл, прищепленим протеїнів гострої фази та васкуліт внутрішньочеревинно Лікування проводять з 0-го по 16-й день Контрольні тварини отримують слиПереважними сполуками є N-етил-N-фенілну Через 14 днів після сенсибілізації овальбумі1,2-дипдро-4-пдрокси-5-хлор-1-метил-2ном мишей піддають 20-хвилинному впливу аерооксохінолш-3-карбоксамід, г\І-етил-г\І-феніл-1,2золю з 1,5% (по масі) розчину овальбуміну в слині, ДИПДРО-4-ПДРОКСИ-5-МЄТОКСИ-1-МЄТИЛ-2одержаного за допомогою розпилювача Контрооксохінолін-3-карбоксамід, г\І-етил-г\І-феніл-1,2льних мишей піддають впливу розчинника (слини) дипдро-4-пдрокси-5-бром-1-метил-2-оксохінолін-3Через 72 години після впливу овальбуміну/слини карбоксамід та г\І-етил-г\І-феніл-1,2-дипдро-4мишей піддають анестезії і здійснюють бронхопдрокси-5,6-метилендюкси-1-метил-2-оксохінолінальвеолярний лаваж шляхом двократної інстиляції 3-карбоксамід, які далі будуть називатися ВІДПОВІ0,5мл охолодженої льодом слини, буферизованої ДНО Сполуками В, С, Ота Е Рохшімекс, а також Nфосфатом, в легені Визначають загальну КІЛЬКІСТЬ етил-г\І-феніл-1,2-дипдро-4-пдрокси-1-метил-2КЛІТИН, а також КІЛЬКІСТЬ еозинофілів, моноциоксохінолш-3-карбоксамід та г\І-метил-г\І-феніл-1,2тів/альвеолярних макрофагів, лімфоцитів та нейтдипдро^-пдрокси-б-хлор-і-метил^-оксохшолін-Зрофілів Інфільтрацію еозинофілів в легеневу ткакарбоксамід, які далі будуть називатися ВІДПОВІДНО нину оцінюють ГІСТОХІМІЧНИМИ методами на Сполуками F та G, були включені як сполуки порізаморожених секціях легенів з використанням діавняння Інгібування гострого експериментального аутоімунного енцефаломієліту Доза, мг/кг перо рально % інгібування гострого експериментального аутоімунного енцефаломієліту Сполука В (винахід) 60 74 98 96 0,04 0,2 1 5 Сполука С (винахід) 48 71 73 90 Сполука F (винахід) не вивчалася не вивчалася не вивчалася 63 Рохшімекс не вивчався 35 40 69 Бали артриту (артрит, індукований колагеном II типу) Сполука (доза 5 мг/кг перорально) D (винахід) Е (винахід) Рохшімекс Захворюваність (%), 35-й день ЗО 10 50 Середній бал, 35-й день 0,4 0,1 1,7 Ембрютоксичність - ЗОВНІШНІ вади Доза, мг/кг 6 10 ЗО Ь| Сполука В (винахід) 0а' % плодів з вадами (шлях введення) Сполука G 37 а ' 1а' не вивчалася Рохшімекс 9°' 30°' підшкірний шлях введення пероральний шлях введення Ефективні КІЛЬКОСТІ сполук формули (І) переважно вводять пацієнту, який потребує такого лікування, згідно загальноприйнятих способів введення та включеними у звичайні фармацевтичні композиції, які складаються з ефективної КІЛЬКОСТІ активного інгредієнту та придатного фармацевтичного носія Такі композиції можуть набувати багатьох форм, наприклад розчини, суспензії, емульсії, таблетки, капсули і порошки для перорального введення, стерильні розчини для парентерального введення, 19 60354 супозиторії для реісгального введення або придатні рецептури для місцевого застосування Загальноприйняті процедури вибору та виготовлення придатної фармацевтичної рецептури (формули) описані, наприклад, в "Pharmaceuticals - The Science of Dosage Form Design", M B A u l t o n , Churchill Livingstone, 1988 Під придатною денною (добовою) доза для використання в лікуванні розсіяного склерозу мається на увазі доза, яка знаходиться в межах від 0,0005мг/кг до приблизно 10мг/кг маси тіла, особливо між 0,005мг/кг та 1мг/кг маси тіла, в залежності від специфічних умов лікування, віку та ваги окремого пацієнта і індивідуальної ВІДПОВІДІ (реакції") пацієнта на лікування Точна індивідуальна доза, так само як і денна (добова) доза, визначається ВІДПОВІДНО стандартних медичних принципів за призначенням лікаря Мається на увазі використання різних добавок, які збільшують стабільність або полегшують введення лікарського засобу Фармацевтична композиція може також містити додаткові терапевтичне корисні субстанції, ІНШІ, НІЖ сполуки формули (І) Посилання 1 Talal, N Autoimmune diseases In Roitt, I M and Delves, P J (eds) Encyclopedia of Immunology, pp 195-198 Academic Press, 1992 2 Pnneas J W The neuropathology of multiple sclerosis In Koetsier, J С (ed ) Handbook of Clinical Neurology, pp 213-257 Elsevier Science Publ , Amsterdam, 1985 3 Tarkowski, A , Gunnarsson, K, Nilsson, L-A, Lmdholm, L and Stalhandske, T Successful treatment of autoimmunity in MRL/1 mice with LS2616, a new immunomodulator Arthritis Rheum 29(11) 14051409, 1986 4 Larsson, E-L , Joki, A-L and Stalhandske, T Mechanism of action of the new immunomodulator LS2616 on T-cell responses Int J Immunopharmacol 9(4) 425-31, 1987 5 Wanders, A , Larsson, E , Gerdm, В and Tufveson, G Abolition of the effect of cyclosponne on rat cardiac allograft rejection by the new immunomodulator LS-2616 (Lmomide) Transplantation 47(2) 216-217, Комп'ютерна верстка Т Чепелєва 20 1989 6 Kalland, T Regulation of natural killer progenitors studies with a novel immunomodulator with distinct effects at the precursor level J Immunol 144(11) 4472-4476, 1990 7 Gonzalo, J A , Gonzalez-Garcia, A , Kalland, T , Hedlund, G , Martinez, С and Kroemer, G Lmomide, a novel immunomodulator that prevents death in four models of septic shock Eur Jlmmunol 23 2372-2374, 1993 8 Karussis, D M , Lehmann, D, Slavm, S et al Treatment of chronic-relapsing experimental autoimmune encephalomyehtis with the synthetic immunomodulator Lmomide (quinohne-3-carboxamide) Proc Natl Acad Sei USA 90 6400-6404,1993 9 Gonzalo, J A , Gonzalez-Garcia, A , Kalland, T et al Lmomide inhibits programmed cell death of peripheral T-cells in vivo Eur Jlmmunol 24 48-52,1994 10 Gross, D J , Sidi, H , Weiss, L, Kalland, T , Rosenmann, E and Slavm, S Prevention of diabetes melhtus in non-obese diabetic mice by Lmomide, a novel immunomodulatmg drug Diabetologia 37 11951201, 1994 11 Karussis, D M , Lehmann, D , Brenner, T et al Immonumodulation of experimental autoimmune myasthenia gravis with Lmomide J Neuroimmunol 55(2) 187-193, 1994 12 Bai, X F , Shi, F D , Zhu, J , Ziao, B G , Hedlund, G and Link, H Linomide-mduced suppression of experimental autoimmune neuritis is associated with down-regulated macrophage functions J Neuroimmunol 76 177-184,1997 13 Karussis, D M , Memer, Z , Lehmann, D et al Treatment of secondary progressive multiple sclerosis with the immunomodulator Lmomide Neurology 47 341-346,1996 14 Andersen, 0 , Lycke, J , Tollesson, P О et al Lmomide reduces the rate of active lesions in relapsmg-remitting multiple sclerosis Neurology 47 895900,1996 15 Kelly, D F , Gnmsell, C S G and Kenyon, CJ Polyartentis in the dog A case report Vet Record 92 363-366,1973 16 Harcourt, R A Polyartentes in a colony of beagles Vet Recors 102 519-522,1978 Підписне Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ДП "Український інститут промислової власності", вул Сім'ї Хохлових, 15, м Київ, 04119
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinoline derivatives, a method for preparing thereof (variants) and a method for treatment of mammals
Автори англійськоюBjoerk Anders
Назва патенту російськоюПоизводные хинолина, способ их получения (варианты) и способ лечения млекопитающих
Автори російськоюБйорк Андерс
МПК / Мітки
МПК: A61P 43/00, A61P 17/06, C07D 215/22, A61P 3/10, C07D 215/56, A61P 9/10, A61P 29/00, A61K 31/4704, A61P 25/00, A61P 1/00, A61P 11/00, A61P 11/06, A61P 25/28
Мітки: ссавців, хіноліну, одержання, спосіб, похідні, лікування, варіанти
Код посилання
<a href="https://ua.patents.su/10-60354-pokhidni-khinolinu-sposib-kh-oderzhannya-varianti-ta-sposib-likuvannya-ssavciv.html" target="_blank" rel="follow" title="База патентів України">Похідні хіноліну, спосіб їх одержання (варіанти) та спосіб лікування ссавців</a>
Попередній патент: Шихта для плавки феронікелю
Наступний патент: Спосіб біологічного очищення рідкого середовища та пристрій для його здійснення
Випадковий патент: Пристрій для усунення коливань вантажу, закріпленого на гнучкому підвісі до кранового візка