Застосування інгібіторів міостатика (gdf8) в поєднанні з кортикостероїдами для лікування нервово-м’язових захворювань
Формула / Реферат
1. Спосіб лікування ссавця з послабленою функцією м'язів, що передбачає введення ссавцеві терапевтично ефективної кількості щонайменше одного інгібітора фактора росту та диференціювання 8 (GDF-8) і терапевтично ефективної кількості щонайменше одного кортикостероїду протягом періоду часу, достатнього для лікування зниженої функції м'язів.
2. Спосіб за п. 1, де функцію м'язів, щонайменше одного м'яза, оцінюють щонайменше по одному параметру, вибраному з м'язової маси, сили скорочення м'яза, концентрації креатинкінази (КК) в сироватці або морфології м'яза.
3. Спосіб за п. 1, де м'яз, на функцію якого спрямоване лікування, вибраний щонайменше з одного з наступних м'язів: ікроножного м'яза, переднього великогомілкового м'яза, чотириглавого м'яза стегна, довгого розгинача пальців стопи, серцевого м'яза і м'яза діафрагми.
4. Спосіб за п. 1, де лікування вказаного ссавця приводить до підвищення маси тіла вказаного ссавця.
5. Спосіб за п. 1, де лікування вказаного ссавця приводить до підвищення сили схоплювання.
6. Спосіб за п. 1, де спосіб приводить до лікування кардіоміопатії вказаного ссавця.
7. Спосіб лікування м'язової слабкості, що передбачає введення ссавцеві терапевтично ефективної кількості щонайменше одного інгібітора GDF-8 і терапевтично ефективної кількості щонайменше одного кортикостероїду протягом часу, достатнього для лікування послаблення функції м'язів.
8. Спосіб профілактики і/або лікування індукованої кортикостероїдом м'язової атрофії ссавця, який отримує терапію кортикостероїдами, що передбачає введення ссавцеві терапевтично ефективної кількості щонайменше одного інгібітора GDF-8.
9. Спосіб лікування нервово-м'язового порушення, що передбачає введення ссавцеві, що страждає нервово-м'язовим порушенням або що має ризик розвитку нервово-м'язового порушення, терапевтично ефективної кількості щонайменше одного інгібітора GDF-8 і терапевтично ефективної кількості щонайменше одного кортикостероїду протягом часу, достатнього для лікування цього нервово-м'язового порушення.
10. Спосіб за п. 9, де нервово-м'язовим порушенням є м'язова дистрофія.
11. Спосіб за п. 10, де м'язовою дистрофією є м'язова дистрофія Дюшена.
12. Спосіб за п. 10, де м'язовою дистрофією є м'язова дистрофія Беккера.
13. Спосіб за будь-яким з пп. 1-12, де ссавцем є людина.
14. Спосіб за будь-яким з пп. 1-12, де кортикостероїд вибраний з щонайменше одного з:
(a) щонайменше одного з беклометазону дипропіонату, будесоніду, кортизолу, дексаметазону, флутиказону пропіонату, мометазону фуроату, преднізону або триамцинолону ацетоніду;
(b) похідного щонайменше одного з беклометазону дипропіонату, будесоніду, кортизолу, дексаметазону, флутиказону пропіонату, мометазону фуроату, преднізону або триамцинолону ацетоніду;
(c) фармацевтично прийнятної солі щонайменше одного з беклометазону дипропіонату, будесоніду, кортизолу, дексаметазону, флутиказону пропіонату, мометазону фуроату, преднізону або триамцинолону ацетоніду.
15. Спосіб за будь-яким з пп. 1-12, де кортикостероїдом є преднізон або преднізолон.
16. Спосіб за будь-яким з пп. 1-12, де кортикостероїд вводять в дозі між 0,1 і 2,0 мг/кг/день.
17. Спосіб за будь-яким з пп. 1-12, де кортикостероїд вводять перорально.
18. Спосіб за будь-яким з пп. 1-12, де інгібітор GDF-8 вибраний з антитіла до GDF-8, антитіла до рецептора GDF-8, розчинного рецептора GDF-8, пропептиду GDF-8, інгібітора GDF-8 з малою молекулою, фолістатину або білка, що містить домен фолістатину.
19. Спосіб за п. 18, де антитіло до GDF-8 вибране з JA-16, Муо29, Муо28 або Муо22.
20. Спосіб за п. 18, де пропептид GDF-8 мутований за залишком аспартату.
21. Спосіб за п. 18, де пропептид GDF-8 приєднаний до Fc-частини імуноглобуліну.
22. Спосіб за п. 18, де рецептором GDF-8 є ActRIIB.
23. Спосіб за п. 18, де рецептор GDF-8 приєднаний до Fc-частини імуноглобуліну.
24. Спосіб за п. 18, де інгібітором GDF-8 є фолістатин.
25. Спосіб за п. 18, де білком, що містить домен фолістатину, є GASP-1.
26. Спосіб за п. 18, де інгібітором GDF-8 є інгібітор з малою молекулою.
27. Спосіб за будь-яким з пп. 1-12, де введення інгібітора GDF-8 і кортикостероїду проводять одночасно.
28. Спосіб за будь-яким з пп. 1-12, де введення інгібітора GDF-8 і кортикостероїду проводять послідовно.
Текст
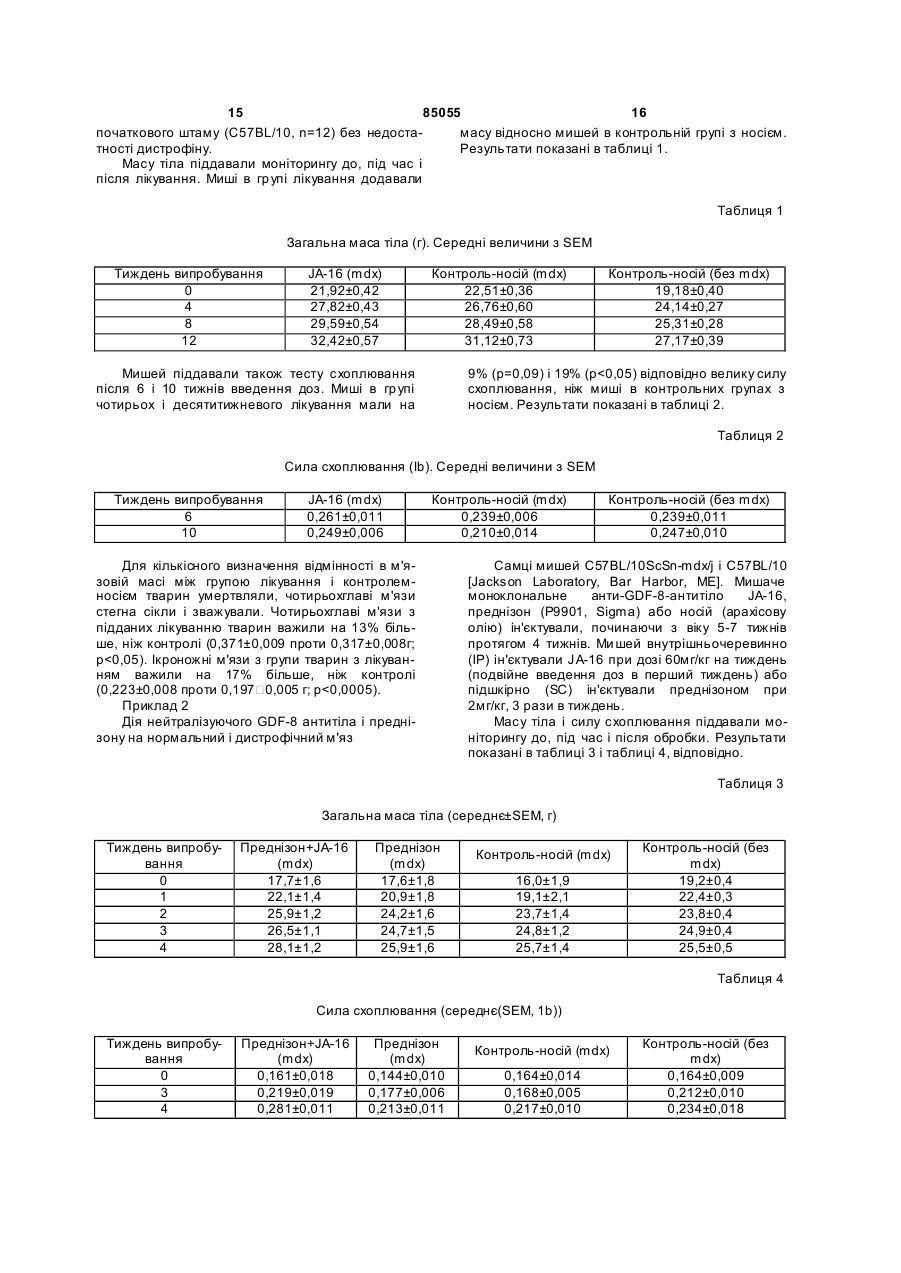
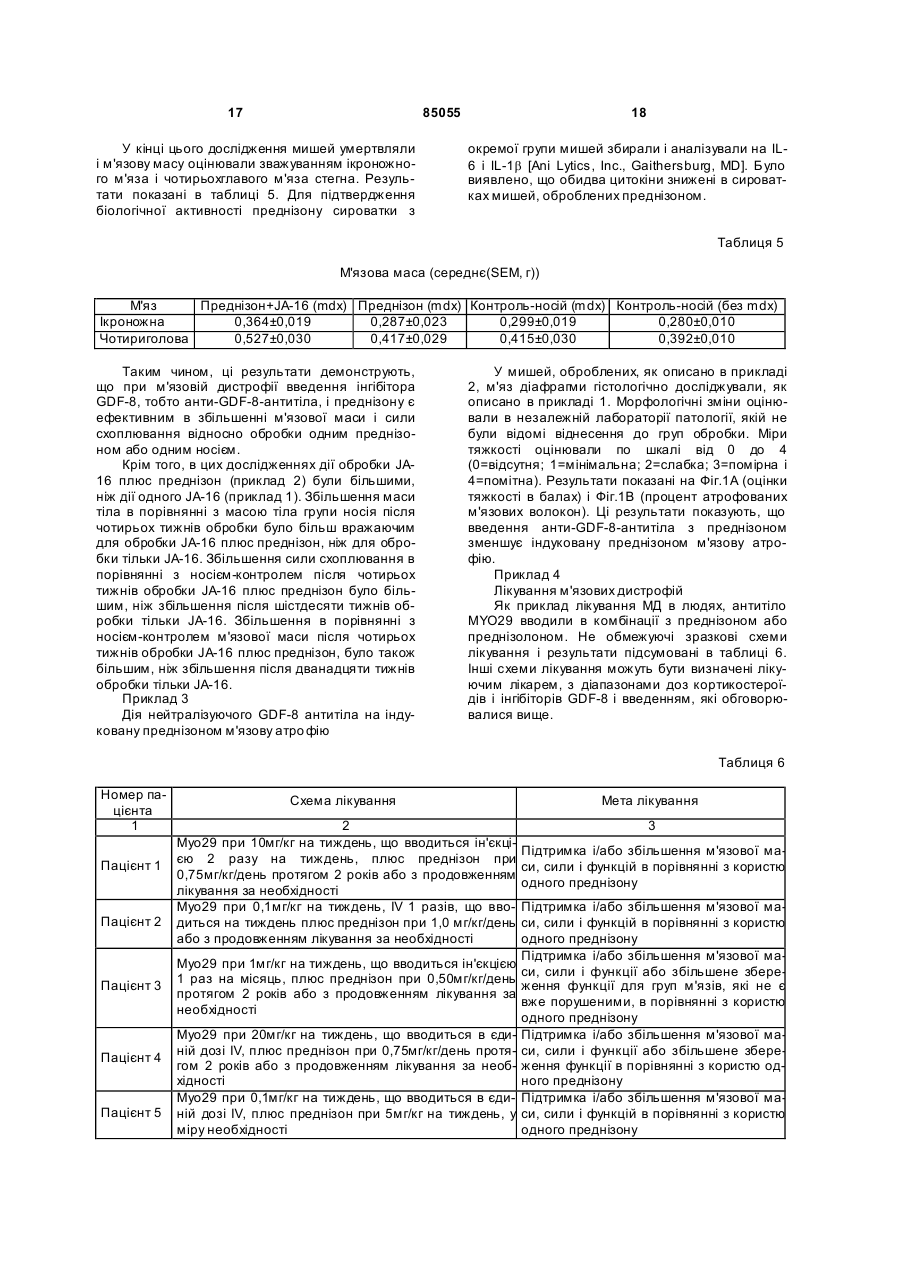
1. Спосіб лікування ссавця з послабленою функцією м'язів, що передбачає введення ссавцеві терапевтично ефективної кількості щонайменше одного інгібітора фактора росту та диференціювання 8 (GDF-8) і терапевтично ефективної кількості щонайменше одного кортикостероїду протягом періоду часу, доста тнього для лікування зниженої функції м'язів. 2. Спосіб за п. 1, де функцію м'язів, щонайменше одного м'яза, оцінюють щонайменше по одному параметру, вибраному з м'язової маси, сили скорочення м'яза, концентрації креатинкінази (КК) в сироватці або морфології м'яза. 3. Спосіб за п. 1, де м'яз, на функцію якого спрямоване лікування, вибраний щонайменше з одного з наступних м'язів: ікроножного м'яза, переднього великогомілкового м'яза, чотириглавого м'яза стегна, довгого розгинача пальців стопи, серцевого м'яза і м'яза діафрагми. 4. Спосіб за п. 1, де лікування вказаного ссавця приводить до підвищення маси тіла вказаного ссавця. 5. Спосіб за п. 1, де лікування вказаного ссавця приводить до підвищення сили схоплювання. UA (21) a200512673 (22) 01.06.2004 (24) 25.12.2008 (86) PCT/US2004/017049, 01.06.2004 (31) 60/474,603 (32) 02.06.2003 (33) US (46) 25.12.2008, Бюл.№ 24, 2008 р. (72) УІТТМОР ЛАЙЗ-ЕНН, ЛІ СЯНПІН (73) УАЙТ (56) WO 02/029105 A1, 11.04.2002 WO 03/027248 A2, 03.04.2003 US 2002/0150577 A1, 17.10.2002 KHURANA TEJVIR S ET AL: "Pharmacological strategies for muscular dystrophy." N ATURE REVIEWS. DRUG DISCOVERY. MAY 2003, vol. 2, no. 5, Ma y 2003 (2003-05), pages 379-390 WAGNER KATHRYN R ET AL: "Loss of myostatin attenuates severity of muscular dystrophy in mdx mice." ANNALS OF NEUROLOGY, vol. 52, no. 6, December 2002 (2002-12), pages 832-836 WHITTEMORE LISA-ANNE ET AL : "Inhibition of myostatin in adult mice increases skeletal muscle mass and strength." BIOCHEMICAL AND BIOPHYSICAL RESEARCH COMMUNICATIONS, vol. 300, no. 4, 24 January 2003 (2003-01-24), pages 965-971 HILL JENNIFER J ET AL: "The myostatin propeptide and the follistatin-related gene are inhibitory binding proteins of myostatin in normal serum" JOURNAL OF BIOLOGIC AL CHEMISTR Y, vol. 277, no. 43, 25 October 2002 (2002-10-25), pages 40735-40741 LEE SE-JIN ET AL: "Regulation of myostatin activity and muscle growth" PROCEEDINGS OF THE NATIONAL AC ADEMY OF SCIENCES OF THE UNITED STATES OF AMERICA, vol. 98, no. 16, 31 July 2001 (2001-07-31), pages 9306-9311 HUDECKI M S ET AL: "Strength and endurance in the therapeutic evaluation of prednisolone-treated MD X mice." RESEARCH COMMUNICATIONS IN CHEMICAL PATHOLOGY AND PHAR MACOLOGY. JAN 1993, vol. 79, no. 1, January 1993 (1993-01), pages 45-60 MERLINI LUCIANO ET AL: "Earl y prednisone treatment in Duchenne muscular dystrophy." 2 (19) 1 3 85055 4 6. Спосіб за п. 1, де спосіб приводить до лікування (c) фармацевтично прийнятної солі щонайменше кардіоміопатії вказаного ссавця. одного з беклометазону дипропіонату, будесоніду, 7. Спосіб лікування м'язової слабкості, що передкортизолу, дексаметазону, флутиказону пропіонабачає введення ссавцеві терапевтично ефективної ту, мометазону фуроату, преднізону або триамцикількості щонайменше одного інгібітора GDF-8 і нолону ацетоніду. терапевтично ефективної кількості щонайменше 15. Спосіб за будь-яким з пп. 1-12, де кортикостеодного кортикостероїду протягом часу, достатньороїдом є преднізон або преднізолон. го для лікування послаблення функції м'язів. 16. Спосіб за будь-яким з пп. 1-12, де кортикосте8. Спосіб профілактики і/або лікування індукованої роїд вводять в дозі між 0,1 і 2,0 мг/кг/день. кортикостероїдом м'язової атрофії ссавця, який 17. Спосіб за будь-яким з пп. 1-12, де кортикостеотримує терапію кортикостероїдами, що передбароїд вводять перорально. чає введення ссавцеві терапевтично ефективної 18. Спосіб за будь-яким з пп. 1-12, де інгібітор кількості щонайменше одного інгібітора GDF-8. GDF-8 вибраний з антитіла до GDF-8, антитіла до 9. Спосіб лікування нервово-м'язового порушення, рецептора GDF-8, розчинного рецептора GDF-8, що передбачає введення ссавцеві, що страждає пропептиду GDF-8, інгібітора GDF-8 з малою монервово-м'язовим порушенням або що має ризик лекулою, фолістатину або білка, що містить домен розвитку нервово-м'язового порушення, терапевфолістатину. тично ефективної кількості щонайменше одного 19. Спосіб за п. 18, де антитіло до GDF-8 вибране інгібітора GDF-8 і терапевтично ефективної кількоз JA-16, Муо29, Муо28 або Муо22. сті щонайменше одного кортикостероїду протягом 20. Спосіб за п. 18, де пропептид GDF-8 мутовачасу, достатнього для лікування цього нервовоний за залишком аспартату. м'язового порушення. 21. Спосіб за п. 18, де пропептид GDF-8 приєдна10. Спосіб за п. 9, де нервово-м'язовим порушенний до Fc-частини імуноглобуліну. ням є м'язова дистрофія. 22. Спосіб за п. 18, де рецептором GDF-8 є 11. Спосіб за п. 10, де м'язовою дистрофією є м'яActRIIB. зова дистрофія Дюшена. 23. Спосіб за п. 18, де рецептор GDF-8 приєдна12. Спосіб за п. 10, де м'язовою дистрофією є м'яний до Fc-частини імуноглобуліну. зова дистрофія Беккера. 24. Спосіб за п. 18, де інгібітором GDF-8 є фоліс13. Спосіб за будь-яким з пп. 1-12, де ссавцем є татин. людина. 25. Спосіб за п. 18, де білком, що містить домен 14. Спосіб за будь-яким з пп. 1-12, де кортикостефолістатину, є GASP-1. роїд вибраний з щонайменше одного з: 26. Спосіб за п. 18, де інгібітором GDF-8 є інгібітор (a) щонайменше одного з беклометазону дипропіз малою молекулою. онату, будесоніду, кортизолу, дексаметазону, 27. Спосіб за будь-яким з пп. 1-12, де введення флутиказону пропіонату, мометазону фуроату, інгібітора GDF-8 і кортикостероїду проводять одпреднізону або триамцинолону ацетоніду; ночасно. (b) похідного щонайменше одного з беклометазону 28. Спосіб за будь-яким з пп. 1-12, де введення дипропіонату, будесоніду, кортизолу, дексаметаінгібітора GDF-8 і кортикостероїду проводять позону, флутиказону пропіонату, мометазону фуроаслідовно. ту, преднізону або триамцинолону ацетоніду; Дана заявка вимагає пріоритет попередньої заявки Сполучених Штатів №60/474603, поданої 2 червня 2003 року, яка приведена тут як посилання в повному об'ємі. Винахід відноситься до галузі клінічної патофізіології і, більш конкретно, до способів лікування нервово-м'язових порушень, таких як м'язова дистрофія. Винахід відноситься також до фармацевтичних композицій, що містять кортикостероїди і інгібітори росту і ди ференціювання. М'язові дистрофії (МД) є прогресуючими спадковими нервово-м'язовими порушеннями, які характеризуються м'язовою атрофією і слабкістю [Emery (2002) The Lancet, 358: 687-695]. Більшість форм м'язових дистрофії є летальними і в цей час невиліковними. Найбільш поширеним захворюванням є м'язова дистрофія Дюшена (ДМД), X-пов'язане нервово-м'язове захворювання. Ця хвороба зумовлена мутаціями в гені ДМД, що кодує дистрофін. Зміна або відсутність цього білка приводить до патологі чного розриву плазматичної мембрани м'язового волокна сарколеми. Відмітними ознаками даного захворювання є патологічна зміна діаметра м'язових волокон (атрофічні і гіпертрофічні волокна) в проксимальних м'язах і прогресуюче пошкодження м'язів. Пошкоджений м'яз виділяє внутрішньоклітинний фермент креатинкіназу (КК). У результаті сироваткові рівні КК у пацієнтів з ДМД є особливо високими (до десятиразового рівня в порівнянні з нормальним). Цей патофізіологічний каскад ускладнюється запаленням тканини, некрозом м'язового волокна і заміною м'яза фіброзно-жировою тканиною. Інший алельний варіант гена ДМД викликає більш м'яку форму МД, відому як м'язова дистрофія Бекера (БМД). БМД клінічно схожа з ДМД, але виникнення симптомів відбувається в більш пізньому віці. Багато які фармакологічні агенти були випробувані в МД, але жоден з них не був ефективним в зупинці ходу цього захворювання. Існуючий режим 5 85055 6 лікування все ще знаходиться в галузі фізичної підтримувати бажані рівні цілісності м'язів або фумедицини і реабілітації. нкції, що оцінюються, наприклад, по сироватковій Ряд випробувань з використанням кортикостеконцентрації креатинкінази (КК), гістології м'язів, роїдів (наприклад, преднізону і/або його похідних) томографії м'язів, активності повсякденного життя, продемонстрували поліпшення в індивідуумів з м'язовій силі і/або масі. Популяції, що піддаються МД, зокрема, в межах короткого терміну. Хоча толікуванню способами даного винаходу, включачний механізм, за допомогою якого кортикостероїють, але не обмежуються ними, пацієнтів, що мади ослабляють фенотип захворювання, є неясним, ють м'язову дистрофію або мають ризик розвитку передбачається, що кортикостероїди діють за дом'язової дистрофії, такий як, наприклад, ДМД або помогою зменшення запалення, супресії імунної БМД, і суб'єктів, що піддаються кортикостероїдній системи, поліпшення гомеостазу кальцію, підвитерапії відносно цих або інших порушень. щуючої регуляції експресії компенсаторних білків і Даний винахід відноситься також до способів збільшення проліферації міобластів [Khurana et al. лікування м'язової слабкості і способів лікування (2003) Nat. Rev. Drug Discovery 2:279-386]. Однак індукованої кортикостероїдами м'язової атрофії. кортикостероїди, що вводяться протягом часу, Винахід включає в себе способи лікування кардіоможуть індукувати м'язову атрофію, яка діє, переміопатії. дусім, на проксимальні м'язи саме ті м'язи, які Представлені способи введення і композиції, вражаються в ДМД і БМД. Індукований кортикощо використовуються в способах даного винаходу. стероїдам м'яз і інші побічні ефекти можуть обмеВ описаних способах інгібітор GDF-8 і кортикостежувати довгострокову ефективність кортикостеророїд вводять одночасно або через інтервали, що їдної терапії. перекриваються, або чергуються, або не перекриваються. GDF-8 є членом суперсімейства TGF-b і функціонує як негативний регулятор м'язового росту. Інгібітори GDF-8, що використовуються в способах даного винаходу, включають в себе, але не Подібно до інших членів цього суперсімейства, обмежуються ними, антитіла до GDF-8; антитіла GDF-8 синтезується у вигляді молекулидо рецепторів GDF-8; розчинні рецептори GDF-8 і попередника, але перед секрецією він розщеплюїх фрагменти (наприклад, злиті поліпептиди ється на N-кінцевий інгібіторний пропептид і Скінцевий активний зрілий GDF-8. Пропептид може ActRIIB, описані в [заявці на патент США №10/689677], що включають в себе розчинні резалишатися пов'язаним з GDF-8, інгібуючи тим цептори ActRIIB, в яких ActRIIB сполучений з Fcсамим біологічну активність зрілого GDF-8. Пропечастиною імуноглобуліну); пропептид GDF-8 і його птид повинен дисоціюватися з цього комплексу, модифіковані форми [наприклад, описані в WO щоб GDF-8 зв'язувався з рецептором активіну типу II (ActRIIB). При скріпленні, ActRIIB ініціює каскад 02/068650 або заявці на патент США №10/071499], включаючи форми, в яких пропептид GDF-8 припередачі сигналу, приводячи, зрештою, до інгібуєднаний в Fc-частині імуноглобуліну, і/або форму, вання прогресування міобластів. Було показано, в якій GDF-8 є мутованим при залишку аспартату що опосередковане антитілами інгібування GDF-8 (asp), наприклад, asp-99 в мишачому пропептиді in vivo значно збільшує розмір скелетних м'язів у здорової дорослої миші [Whittemore et al. (2003) GDF-8 і asp-100 в пропептиді GDF-8 людину); інгібітор GDF-8 з малою молекулою; фолістатин [наBBRC, 300:965-971] і ослаблює дистрофічний феприклад, описаний в патенті США №6004937] або нотип на mdx-мишачій моделі ДМД [Bogdanovich et утримуючі домен фолістатину білки [наприклад, al. (2002) Nature, 420(28):418-421]. GASP-1 або інші білки, описані в заявках на патент Однією з цілей даного винаходу є способи і композиції для лікування порушень, що характериСША 10/369736 і 10/369738]; і модулятори металопротеазної активності, які впливають на активазуються або асоційованих з ризиком зменшення цію GDF-8, описані в [заявці на патент США функції м'язів. Додаткові об'єкти винаходу пред№10/662438]. ставлені в подальшому описі і частково будуть У деяких варіантах здійснення, інгібітором зрозумілі з опису або можуть бути виявлені при застосуванні на практиці винаходу. GDF-8 є моноклональне антитіло або його фрагмент, який блокує зв'язування GDF-8 з його рецепДаний винахід оснований, частково, на виявтором. Не обмежуючі ілюстративні варіанти вклюленні і демонстрації того, що на мишачій моделі чають в себе моноклональне анти-GDF-8-антитіло ДМД лікування введенням нейтралізуючого антине людини, наприклад, мишаче моноклональне GDF-8-антитіла і преднізону є більш ефективним для збільшення маси і сили м'язів відносно лікуантитіло JA-16 [описане в заявці на патент США №10/253532; номер депозиту в ATCC РТА-4236]; вання тільки преднізоном. Далі, даний винахід осйого похідні, наприклад, гуманізоване антитіло; і нований, частково, на виявленні і демонстрації повністю людські моноклональні анти-GDF-8того, що введення анти -GDF-8-антитіла з предніантитіла [наприклад, Муо29, Муо28 і Муо22, опизоном зменшує індуковану преднізоном атрофію м'язів. сані в заявці на патент США №10/688925; номери депозитів в ATCC РТА-4741, РТА-4740 і PTA-4739, Таким чином, даний винахід відноситься до відповідно] або їх по хідні. способів лікування нервово-м'язових порушень у Кортикостероїди, що використовуються в споссавців. Описані способи передбачають введення собі даного винаходу, включають в себе, але не суб'єкту, що має ризик розвитку нервово-м'язового захворювання або страждаючому нервовообмежуються ними, беклометазону дипропіонат, будесонід, кортизол, дексаметазон, флутиказону м'язовим захворюванням, терапевтично ефективпропіонат, мометазону фуроат, преднізон, триамних кількостей щонайменше одного інгібітору GDFцинолону ацетонід і їх похідні. 8 і щонайменше одного кортикостероїду, так щоб 7 85055 8 Повинно бути зрозуміло, що як попередній заТермін «анти-GDF-8-антитіла» або «антитіло гальний опис, так і подальший докладний опис є до GDF-8» відноситься до будь-якого антитіла, яке тільки ілюстративними і пояснюють і не обмежуспецифічно зв'язується щонайменше з одним епіють даний винахід, як він заявлений в формулі топом GDF-8. Терміни «GDF-8-рецептор-антитіло» винаходу. і «антитіло до рецептора GDF-8» відноситься до Фіг.1A і 1B зображають результати гістологічбудь-якого антитіла, яке специфічно зв'язується ного аналізу м'яза діафрагми від мишей mdx, підщонайменше з одним епітопом GDF-8-рецептора, даних лікуванню протягом чотирьох тижнів нейттакого як ActRIIB. Термін «нейтралізуюче антитіралізуючим анти-GDF-8-антитілом JA-16 (60мг/кг, ло» відноситься до антитіла, яке є інгібітором один раз на тиждень) і преднізоном (2мг/кг, 3 рази GDF-8. на тиждень), одним преднізоном або одним контТермін "специфічна взаємодія", або "специфірольним носієм. Фіг.1A показує тяжкість атрофії чно зв'язується" або т.п. означає, що дві молекули м'язових волокон по шкалі 0-4 в кінці цього випроутворюють комплекс, який є відносно стабільним в бування. Фіг.1B показує процент уражених (атрофізіологічних умовах. Цей термін застосовний тафованих) м'язових волокон в кінці випробування. кож, коли, наприклад, антигензв'язувальний домен Кожний стовпчик являє собою єдину мишу. є специфічним у відношенні конкретного епітопу, І. Визначення який може бути присутнім на ряді антигенів. СпеДля більш легкого розуміння даного винаходу цифічне зв'язування характеризується високою спочатку даються визначення деяким термінам. афінністю з помірно високою місткістю. НеспециДодаткові визначення приведені протягом цього фічне зв'язування звичайно має низьку афінність з докладного опису. помірно високою місткістю. Звичайно, зв'язування Термін «антитіло», як використано в даному вважається специфічним при константі афінності описі, відноситься до імуноглобуліну або його часКа, більшій, ніж 106M-1, ніж 107M-1 або переважно тини і включає в себе будь-який поліпептид, що більшій, ніж 108M-1. Якщо необхідно, неспецифічне містить антигензвзувальний сайт, незалежно від зв'язування може бути зменшене по суті без вплиджерела, способу отримання і інших характерисву на специфічне зв'язування зміною умов зв'язутик. Як необмежувальний приклад, термін «антитівання. Такі умови відомі в даній галузі і фахівець з ло» включає антитіла людини, орангутану, миші, кваліфікацією в даній галузі може з використанням щура, кози, вівці і курки. Цей термін включає, але рутинних способів вибрати відповідні умови. Ці не обмежується ними, поліклональні, моноклонаумови звичайно визначаються в термінах концентльні, моноспецифічні, поліспецифічні, неспецифічрації антитіл, іонної сили розчину, температури, ні, гуманізовані, одноланцюжкові, химерні, синтечасу, що надається для зв'язування, концентрації тичні, рекомбінанті, гібридні, мутовані і CDRсторонніх молекул (наприклад, сироваткового трансплантовані антитіла. Для цілей даного винаальбуміну, казеїну молока) і т.д. ходу він включає, якщо не вказане інше, фрагменТермін "функція м'язів" відноситься до здатноти антитіл, такі як Fab, F(ab')2, Fv, scFv, Fd, d Ab і сті м'яза виконувати фізіологічну функцію, таку як інші фрагменти антитіл, які зберігають антигензскорочення, що вимірюється кількістю сили, яка в'язувальну функцію. генерується під час або судорожного скорочення, Антитіла можуть бути отримані, наприклад, за або титанічного скорочення. Інші способи для оцідопомогою традиційних гібридомних способів нки функції м'язів добре відомі в даній галузі і [Kohler and Milstein (1975) Nature, 256:495-499], включають в себе, але не обмежуються ними, виспособів рекомбінантних ДНК [патент США мірювання м'я зової маси, сили стискання (схоплю№4816567] або способів фагового дисплея, що вання), рівня КК в сироватці, активності повсяквикористовують бібліотеки антитіл [Clackson et al. денного життя, тести руху або сили, гістологію (1991) Nature, 352:624-628; Marks et al. (1991) J. тканини (наприклад, Е&А-фарбування або фарбуMol. Biol., 222:581-597]. Відносно різних інших сповання колагеном III) або томографію тканин. Несобів отримання антитіл [див. Antibodies: A обмежуючі ілюстративні способи оцінки функції Laboratory Manual, eds. Harlow et al. Cold Spring м'язів приведені в прикладах. Harbor Laboratory, 1988]. Термін «GDF-8» відноситься до специфічного Термін «антигензв'язувальний домен» віднофактора-8 росту і диференціювання і, за необхідситься до частини молекули антитіла, яка містить ності, факторів, які структурно або функціонально зону, специфічно зв'язуючу частину антигена або родинні GDF-8, наприклад, BMP-11 і іншим фактовесь антиген або комплементарну частині антигерам, що належать до суперсімейству TGF-b. Цей на або всьому антигену. Якщо антиген є великим, термін відноситься до повнорозмірній непроцесоантитіло може зв'язуватися тільки з конкретною ваній форми попередника GDF-8, а також до зрілої частиною цього антигена. Епітоп або антигенна форми і форми пропептиду, що утворюються внадетермінанта є частиною молекули антигена, яка слідок посттрансляційного розщеплення. Цей тервідповідальна за специфічні взаємодії з антигензмін відноситься також до будь-яких фрагментів і в'язувальним доменом антитіла. Антигензв'язуваваріантів GDF-8, які зберігають щонайменше деяку льний домен може бути забезпечений одним або біологічну активність, асоційовану зі зрілим GDF-8, декількома варіабельними доменами антитіла як обговорювалося вище, в тому числі послідовно(наприклад, так званим Fd-фрагментом антитіла, стей, які були модифіковані. Даний винахід віднощо складається з VH-домена). Антигензв'язувальситься до GDF-8 від всіх видів хребетних, включаний домен містить варіабельний район (VL) легкоючи, але, не обмежуючись ними, людини, корови, го ланцюга антитіл і варіабельний район (VH) важкурки, миші, щура, свині, вівці, індички, павіана і кого ланцюга антитіла. риби [відносно інформації про послідовності див., 9 85055 10 наприклад, McPherron et al. (1997) Ргос. Natl. Acad. (2003) BBRC, 300:965-87; або заявці на патент Sci. USA, 94:12457-12461]. США №10/253532] і RGA-аналізів [описаних в Термін «зрілий GDF-8» відноситься до білка, Thies (2001) Growth Factors, 18: 251-259 або заявці який віщеплюється від карбокси-кінцевого домену на патент США №10/253532]. білка-попередника GDF-8. Зрілий GDF-8 може буТермін «терапевтично ефективна доза» або ти присутнім у вигляді мономеру, гомодимеру або «терапевтично ефективна кількість» відноситься у вигляді латентного комплексу GDF-8. B залежнодо такої кількості сполуки, яка приводить до попесті від умов, зрілий GDF-8 може встановлювати редження, зменшення ризику виникнення або порівновагу між будь-якими або всіма цими різними слаблення симптомів у пацієнта, або до бажаного формами. У його біологічно активній формі зрілий біологічного результату, наприклад, поліпшеної GDF-8 називають також «активним GDF-8». функції м'язів, затриманому виникненню клінічних Термін «пропептид GDF-8» відноситься до посимптомів і т.д. Ефективна кількість може бути ліпептиду, який віщеплюється від амінокінцевого визначена, як описано в подальших розділах. домену білка-попередника GDF-8. Пропептид Термін "лікування", "терапевтичний спосіб" і GDF-8 здатний зв'язуватися з пропептидзв'язуваблизькі до них терміни відносяться до лікування льним доменом на зрілому GDF-8. або профілактичних/превентивних заходів. До суТермін «латентний комплекс GDF-8» відноб'єктів, потребуючих лікування, можуть відноситиситься до комплексу білків, утвореного між гомося індивідууми, що вже мають конкретне медичне димером зрілого GDF-8 і пропептидом GDF-8. порушення, а також індивідуумів, які можуть, зреВважають, що два пропептиди GDF-8 асоціюються штою, придбати це порушення. Лікування включає з двома молекулами зрілого GDF-8 в гомодимері з в себе будь-яке зменшення в будь-якому симптомі утворенням тетрамерного комплексу. Цей латентописаного в даній заявці порушення. Крім зменний комплекс може включати в себе інші інгібітори шення або ослаблення симптомів, лікування GDF замість одного або декількох пропептидів включає також підтримку існуючого стану пацієнта GDF-8 або в доповнення до одного або декількох при очікуванні погіршення або запобігання виникпропептидів GDF-8. ненню симптому у суб'єкта, в якого очікується виТермін "активність GDF-8" відноситься до одникнення симптому, порушення або захворюваннієї або декількох фізіологічно регулюючи х ріст ня. Лікування може полягати в зменшенні або або морфогенетичним активностям, асоційованим зниженні однієї або декількох фізіологічних функз білком GDF-8. Наприклад, активний GDF-8 є нецій відносно нормальної функції. Воно може також гативним регулятором маси скелетних м'язів. Аквключати зменшення в порівнянні з очікуваними тивний GDF-8 може також модулювати утворення симптомами або очікуваним прогресуванням стаспецифічних для м'язів ферментів (наприклад, ну, порушення або захворювання. креатинкінази), стимулювати проліферацію міобII. Компоненти для застосування в способах ластів і модулювати диференціювання преадиповинаходу цитів в адипоцити. Зразкові методики для вимірюУ способах даного винаходу використовують вання активності GDF-8 in vivo і in vitro описані, один або декілька інгібіторів GDF-8 в комбінації з наприклад, в заявці на [патент США №10/688925]. одним або декількома кортикостероїдами. Як використано в даному описі, "інгібітор GDFА. Інгибітори GDF-8 8" відноситься звичайно до будь-якої сполуки, яке Інгібітори GDF-8, що використовуються в спознижувальним чином регулює активність GDF-8 і собах даного винаходу, включають, але не обмевключає будь-який агент, здатний інгібувати актижуються ними, антитіла до GDF-8; антитіла до вність, експресію, процесинг або секрецію GDF-8. GDF-8-рецепторів; розчинні рецептори GDF-8 і їх Інгібітор GDF-8 може, наприклад, впливати на стафрагменти [наприклад, злиті поліпептиди ActRIIB, більність або перетворення молекули попередника описані в заявці на патент США №10/689677, в в активну зрілу форму; заважати зв'язуванню GDFтому числі розчинні рецептори ActRIIB, в яких 8 з одним або декількома рецепторами; або заваActRIIB приєднаний до Fc-частини імуноглобуліну]; жати внутрішньоклітинній передачі сигналів рецепропептид GDF-8 і його модифіковані форми [наптора GDF-8 ActRIIB. Такі інгібітори включають в приклад, описані в WO 02/068650 або заявці на себе білки, антитіла, пептиди, пептидоміметики, патент США №10/071499, в тому числі форми, в рибозими, антисмислові олігонуклеотиди, двохлаяких пропептид GDF-8 приєднаний до Fc-частини нцюжкову PHK і інші малі молекули, які специфічімуноглобуліну, і/або форми, в яких GDF-8 мутоно інгібують GDF-8. Кажуть, що такі інгібітори "інгіваний при залишку аспартату (asp), наприклад, бують", "нейтралізують" або «зменшують» asp-99, в мишачому пропептиді GDF-8, і asp-100 в біологічну активність GDF-8. пропептиді GDF-8 людину]; фолістатин [наприТерміни «нейтралізували», «нейтралізуючі», клад, описаний в патенті США №6004937] або «інгібуючі» і родинні ним терміни відносяться до утримуючі домен фолістатину білки [наприклад, зменшення активності GDF-8 інгібітором GDF-8, GASP-1 або інші білки, описані в заявках на патент відносно активності GDF-8 за відсутності того ж США 10/369736 і 10/369738]; і модулятори метаінгібітора. Зменшення активності дорівнює перелопротеазної активності, які впливають на активаважно щонайменше на 10%, 20%, 30%, 40%, 50%, цію GDF-8, описані в [заявці на патент США 60%, 70%, 80%, 90% або більш. Способи оцінки №10/662438]. нейтралізуючої або інгібуючої біологічної активноУ деяких варіантах здійснення, інгібітором сті інгібіторів GDF-8 відомі в даній галузі і можуть GDF-8 є моноклональне антитіло або його фрагбути виконані, наприклад, з використанням аналізу мент, який блокує зв'язування GDF-8 з його рецепActRIIB [наприклад, як описано в Whittemore et al. тором. Необмежуючі ілюстративні варіанти вклю 11 85055 12 чають моноклональне анти-GDF-8-антитіло не м'язів поліпшується відносно такого ж лікування за людини, наприклад, мишаче моноклональне антивідсутності або інгібітора GDF-8, або кортикостеротіло JA-16 [описане в заявці на патент США їда. М'язи, які можуть бути піддані лікуванню, №10/253532; номер депозиту в ATCC РТА-4236]; включають, але не обмежуються ними, ікроножний його похідні, наприклад, гуманізовані антитіла; і м'яз, передній великогомілковий м'яз, чотирьохповністю людські моноклональні анти-GDF-8главий м'яз стегна, довгий розгинач пальців стопи, антитіла [наприклад, Муо29, Муо28 і Муо22, описерцевий м'яз або м'яз діафрагми. сані в заявці на патент США №10/688925; номери Нервово-м'язові порушення включають, але не депозитів в ATCC РТА-4741, РТА-4740 і PTA-4739, обмежуються ними, будь-яке гостре або хронічне відповідно], або їх похідні. захворювання або порушення, яке погіршує функУ деяких варіантах здійснення, інгібітор GDF-8 цію м'язів, викликає пошкодження м'яза або іншим блокує GDF-8 від зв'язування з його рецептором, способом спричиняє зменшення м'язової маси за допомогою зв'язування з GDF-8 або з рецептоі/або функції. Відома велика різноманітність заром GDF-8. У різних варіантах здійснення інгібітохворювань або порушень, і вони включають, наром GDF-8 є анти-GDF-8- антитілo, яке має афінприклад, м'язову дистрофію, таку як м'язова дисність у відношенні GDF-8, виражену у вигляді трофія Дюшена, м'язова дистрофія Бекера, константи афінності (Ка), де Ка дорівнює щонаймем'язова дистрофія Емері-Дрейфуса, тазовонше 105M-1, 106 M-1 , 107M- 1, 108 M-1, 109 M-1 , 1010 M-1, плечова м'язова дистрофія, синдром ригідної спи1011M-1 або 1012 M-1. Розглядається також застосуни, синдром Ульріха, м'язова дистрофія Фукуяма, вання на людях інгібіторів, які є гуманізованими синдром Уокера-Варбурга, м'язова хвороба очей, формами і похідними антитіл не людини, отримапов'язана з головним мозком, плече-лопатковоних з будь-якого вигляду хребетних тварин, описалицьова м'язова дистрофія, природжена м'язова ними в заявках, що цитуються в даному описі на дистрофія, міотонічна дистрофія (хвороба Стейпатент, або в [Antibody Engineering, ed. Borrebaeck, нерта), недистрофічна міотонія, спінальна м'язова 2nd ed., Oxford University Press, 1995; і Antibodies: атрофія з періодичними паралічами, сімейний бічA Laboratory Manual, eds. Harlow et al. Cold Spring ний аміотрофічний склероз, спадкова рухова і сенHarbor Laboratory, 1988]. сорна невропатія, хвороба Шарко-Марі-Тутс, хроВ. Кортикостероїди нічна запальна невропатія, дистальна міопатія, Кортикостероїди, що використовуються в споміотубулярна/центронуклеарна міопатія, немалисобах даного винаходу, включають, але не обменова міопатія, mini core disease, природжена міожуються ними, беклометазону дипропіонат, будепатія з ураженням серцевини м'язових волокон, сонід, кортизол, дексаметазон, флутиказону десмінопатія, міозит з тельцями включення, мітопропіонат, преднізон, мометазону фуроат, триамхондріальна міопатія, природжений міастенічний цинолону ацетонід і їх похідні. синдром, дисфункція м'язів після поліомієліту і Можуть бути також використані фармацевтичпорушення, описаний в [Emery (2002) The Lancet, но прийнятні солі сполук, що описуються. 359:687-695 і Khurana et al. (2003) Nat. Rev. Drug Кортикостероїди комерційно доступні в різних Disc, 2:379-386]. Пацієнти можуть виявляти слабфармацевтичних готових формах [Physician's Desk ку, помірну або важку м'язову слабкість, атрофію Reference (PDR) 2003, 57th ed., Medical Economics м'язів і впливу на незалежне пересування, пов'яCompany, 2002]. Наприклад, в пероральних форзані з таким порушенням. Пацієнти, що мають римах комерційно доступні кортизон, гідрокортизон зик розвитку подібних порушень, будуть отримувати користь від інгібітора GDF-8 і кортикостероїда. (CortefÒ), преднізон (DeltasoneÒ, MeticortenÒ, Звичайно, пацієнтом, який буде отримувати OrasoneÒ), преднізолон (Delta-CortefÒ, користь від спільного введення інгїбітора GDF-8 і PediapredÒ, PreloneÒ), триамцинолон (AristocortÒ, кортикостероїда, є пацієнт, який виявляє 2-10KenacortÒ), метилпреднізолон (MedrolÒ), дексамекратне або більш високе збільшення активності КК тазон (DecadronÒ, DexoneÒ, HexadrolÒ), бетамев сироватці, позитивний сімейний анамнез, атипічтазон (CelestoneÒ) і дефлазакорт (CalcortÒ). Інші ну варіацію діаметра м'язових волокон, недостатформи цих і інших кортикостероїдів можуть бути ність дистрофіну або мутацію в гені дистрофіну, використані в способах даного винаходу. втрату м'язової маси, слабкість м'язів, кардіоміоC. Терапевтичні і профілактичні способи патію і/або втрату сили м'язів. Діагностичні процеДаний винахід відноситься до способів лікудури, в тому числі відповідне генетичне тестуванвання суб'єктів ссавців, включаючи способи лікуня, описані в [Diagnostic Criteria for Neuromuscular вання втрати функції м'язів, м'язової слабкості Disorders, ed. Emery, 2nd ed., Royal Society of і/або індукованої кортикостероїдом м'язової атроMedicine Press, 1997]. Це комбіноване лікування фії. може бути також корисним для суб'єктів, які підСпособи даного винаходу передбачають введаються кортикостероїдній терапії відносно порудення ссавцеві терапевтично ефективної кількості шень, інших, ніж нервово-м'язові порушення, і/або щонайменше одного інгібітора GDF-8 і терапевтисуб'єктів з анамнезом довгострокового застосучно ефективної кількості щонайменше одного корвання кортикостероїда, поки ці суб'єкти виявляють тикостероїду в кількостях і протягом періоду часу, зменшення функції м'язів, що характеризується достатніх для лікування щонайменше одного симм'язової слабкістю, втратою м'язової маси і/або птому з втрати функції м'язів, м'язової маси, м'язом'язовою атрофією і т.д. або мають ризик такого вої слабкості, м'язової атрофії або кардіоміопатії. зменшення функції м'язів. Приклади порушень, Ці способи можуть бути використані для лікування для яких часто застосовують кортикостероїдну нервово-м'язових порушень, таких як м'язова дистерапію, включають, але не обмежуються ними, трофія. У деяких варіантах здійснення, функція 13 85055 14 астму, алергію, артрит, дерматологічні порушення вводитися у випадку амбулаторного пацієнта один (наприклад, запальні дерматози, екзему, псоріаз і раз на тиждень при дозі приблизно 0,1-10мг/кг т.д.), системний червоний вовчак і інші хронічні внутрішньовенною (IV) інфузією, вн утрішньочерезапальні стани. винною або підшкірною ін'єкцією. Звичайно, відпоНадані способи введення і композиції, що вивідна терапевтично ефективна доза інгібітора користовуються в способах даного винаходу. ВвеGDF-8 вибирається лікуючим лікарем і може складення не обмежується якою-небудь конкретною дати діапазон приблизно від 1мкг/кг до 20мкг/кг, системою доставки і може включати, без обмевід 1мкг до 10мг/кг, від 1мкг/кг до 1мг/кг, від ження, парентеральне (в тому числі підшкірну, 10мкг/кг до 1мг/кг, від 10мкг/кг до 100мкг/кг, від внутрішньовенну, інтрамедулярну, вн утрішньосуг100мкг/кг до 1мг/кг і від 500мкг/кг до 5мг/кг. Зразколобну, вн утрішньом'язову або внутрішньочеревинві ефективні дози інгібітора GDF-8 становлять ну ін'єкцію), ректальне, місцеве, трансдермальне приблизно 0,1, 0,3, 0,5, 1, 5 10 або 20мг/кг на тижабо пероральне (наприклад, в капсулах, суспензідень. Крім того, можуть бути використані конкретні ях або таблетках) введення. Введення суб'єкту дози, вказані в прикладах або в [Physician's Desk може виконуватися в єдиній дозі або у введениях, Reference (PDR) 2003, 57th ed., Medical Economics що повторюються і в будь-якій з різних фізіологічCompany, 2002]. но прийнятних форм солей, і/або з прийнятними D. Способи тестування сполук на терапевтичфармацевтичним носієм і/або домішкою у вигляді ну е фективність частини фармацевтичної композиції. Фізіологічно Далі даний винахід відноситься до способів прийнятні сольові форми і стандартні способи і для тестування на тваринах, наприклад, гризунах ексципієнти для фармацевтичних композицій добабо приматах, чи є терапевтична сполука ефектире відомі фахівцям в даній галузі [наприклад, опивною при введенні в комбінації щонайменше з одсані в Physician's Desk Reference (PDR) 2003, 57th ним інгібітором GDF-8 і щонайменше одним кортиed., Medical Economics Company, 2002 і Remington: костероїдам. У деяких варіантах здійснення, The Science and Practice of Pharmacy, eds. спосіб оцінки ефективності сполуки передбачає: Gennado et al. 20th ed., Lippincott, Williams & введення сполуки першій тварині в комбінації з Wilkins, 2000]. інгібітором GDF-8 і кортикостероїдом; введення Інгібітор GDF-8 і кортикостероїд вводять одноінгібітора GDF-8 і кортикостероїда другій тварині; часно або послідовно через інтервали, що перевизначення рівня функції м'язів у першої і у др угої криваються або не перекриваються. При послідотварини після цих введень; і порівняння цих рівнів вному введенні інгібітор GDF-8 і кортикостероїд функції м'язів. Якщо рівень у першої тварини є можуть вводитися в будь-якому порядку. У деяких більш низьким, ніж рівень у другої тварини, це свіваріантах здійснення, довжина інтервалу, що педчить про те, що дана сполука або дана комбінарекривається або не перекривається, складає біція є ефективною. льше ніж 2, 4, 6, 12, 24 або 48 тижнів. В інших варіантах здійснення, сполука може Для кортикостероїдів практикуючий лікар руоцінюватися на ефективність в лікуванні м'язової тинним чином вибирає дозу і схему введення. Надистрофії при введенні в комбінації з інгібітором приклад, преднізон використовують при приблизно GDF-8 і/або кортикостероїдом. 0,1-2мг на кілограм маси тіла в день і, звичніше, Для таких цілей оцінювання доступні декілька при 0,5-1мг/кг/день, наприклад, 0,75мг/кг/день. моделей тварин. Наприклад, була описана модель Кортикостероїд може вводитися при середніх тижmdx, наприклад, [Torres et al. (1987) Brain, 110:269невих дозах приблизно 1-14мг/кг маси тіла, вклю299 і Hoffman et al. (1987) Science, 238:347-350]. чаючи приблизно 1, 2, 5, 7, 10, 12 або 15мг/кг маси Надзвичайно високі рівні КК постійно відмічаються тіла на тиждень, і практикуючий лікар може вибраз недостатністю дистрофіну у мишей mdx і у люти відповідну частоту введення. Можуть бути вибдей з ДМД внаслідок пошкодження сарколеми рані єдина доза, безперервне або періодичне вве[Bulfield et al. (1984) Proc. Natl. Acad. Sci. USA, дення кортикостероїда, включаючи часові, денні 81:1189-1192 і Matsuda et al. (1995) J. Biochem. інтервали, два рази на тиждень, один раз на тиж(Tokyo), 118:959-64]. Як інший приклад, можуть день або інші періодичні інтервали. Переважно, бути використані дві інші моделі тварин: миші mdx кортикостероїди вводять перорально або ін'єкцією utr-/- [Gillis (2002) Neuromuscul. Disord., 12(1): 90-84 1-4 рази на день. Доза кортикостероїдів може бути і Deconick et al. (1997) Cell, 90: 729-738) і миші mdx оптимізована у вигляді комбінованої терапії, і доза nu-/- (Morrison et al. (2000) Lab. Invest., 80:881-891]. може бути знижена для зменшення значущи х поПриклади бічних ефектів введення. Приклад 1 Інгібітори GDF-8 можуть вводитися окремо або Дія нейтралізуючого GDF-8 антитіла на дисв суміші з кортикостероїдом або іншою сполукою. трофічний м'яз Інгібітори GDF-8 можуть вводитися в дозі приблиМожливість інгібвання in vivo GDF-8 для ослазно від 1мкг/кг до 25мг/кг, в залежності від фізіолоблення м'язової дистрофії тестували на моделі гії, тяжкості симптомів і прогресування захворюДМД миші mdx. П'яти-семитижневих самців мишей вання. Можуть бути вибрані єдина доза, C57BL/10ScSn-mdx/j (Jackson Laboratory, Bar безперервне або періодичне введення, з інтерваHarbor, ME) лікували щотижневими внутрішньочелами між дозами інгібітора GDF-8, вибраними з ревинними ін'єкціями нейтралізуючого GDF-8 мичасових, денних інтервалів, два рази на тиждень, шачого антитіла JA-16 (60мг/кг, подвійне введення один раз на тиждень, два рази на місяць, один раз дози в перший тиждень, n=11) і одного носія (контна місяць або інших відповідних інтервалів. Нарольна група, n=10) протягом 12 тижнів. Цих миприклад, інгібітори GDF-8, такі як антитіла, можуть шей порівнювали також з мишами того ж самого 15 85055 16 початкового штаму (C57BL/10, n=12) без недостамасу відносно мишей в контрольній групі з носієм. тності дистрофіну. Результати показані в таблиці 1. Масу тіла піддавали моніторингу до, під час і після лікування. Миші в гр упі лікування додавали Таблиця 1 Загальна маса тіла (г). Середні величини з SEM Тиждень випробування 0 4 8 12 JA-16 (mdx) 21,92±0,42 27,82±0,43 29,59±0,54 32,42±0,57 Контроль-носій (mdx) 22,51±0,36 26,76±0,60 28,49±0,58 31,12±0,73 Мишей піддавали також тесту схоплювання після 6 і 10 тижнів введення доз. Миші в гр упі чотирьох і десятитижневого лікування мали на Контроль-носій (без mdx) 19,18±0,40 24,14±0,27 25,31±0,28 27,17±0,39 9% (р=0,09) і 19% (р
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of myostatin (gdf8) inhibitor in conjunction with corticosteroid for treating neuromuscular disorder
Автори англійськоюWhittemore Lise-Anne, Li Xiangping
Назва патенту російськоюПрименение ингибиторов миостатика (gdf8) в сочетании с кортикостероидами для лечения нервно-мышечных заболеваний
Автори російськоюУиттмор Лайз-Енн, Ли Сянпин
МПК / Мітки
МПК: A61K 39/395, A61P 21/00, A61K 31/573
Мітки: поєднанні, кортикостероїдами, застосування, gdf8, інгібіторів, захворювань, нервово-м'язових, лікування, міостатика
Код посилання
<a href="https://ua.patents.su/10-85055-zastosuvannya-ingibitoriv-miostatika-gdf8-v-poehdnanni-z-kortikosterodami-dlya-likuvannya-nervovo-myazovikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Застосування інгібіторів міостатика (gdf8) в поєднанні з кортикостероїдами для лікування нервово-м’язових захворювань</a>
Попередній патент: Спосіб визначення критичного індекса параметра порядку фазового переходу у твердих тілах
Наступний патент: Таблетка у формі краплини
Випадковий патент: Чайник scorovar