5-гетероарилзаміщені 7-арил-1,2,4-триазоло[1,5-а]піримідини та спосіб їх одержання
Номер патенту: 97553
Опубліковано: 27.02.2012
Автори: Десенко Сергій Михайлович, Афанасіаді Людмила Михайлівна, Руденко Роман Володимирович, Комихов Сергій Олександрович
Формула / Реферат
1. 5-Гетарилзаміщенний 7-арил-1,2,4-триазоло[1,5-а]піримідин загальної формули І
 ,
,
в якій Ar = C6H5; 4-Cl-C6H4; 4-F-C5H4; 4-Br-C6H4; 4-OH-C6H4; 4-CH3-C6H4; 4-C2H5-C6H4; 4-i-C3H7-C6H4; 3-Cl-C6H4; 3-Br-C6H4; 3-F-C6H4; 3-CH3O-C6H4; 3-OH-C6H4; 2-Cl-C6H4; 2-F-C6H4; 2-CH3O-C6H4; 4-OH-3-CH3O-C6H3; 2,4-диCl-C6H3; 2,4-диCH3O-C6H3; 2,5-диCH3O-C6H3; 3,4-диCH3O-C6H3;
r є

2. Спосіб одержання сполуки формули І
 ,
,
в якій Ar = C6H5; 4-Cl-C6H4; 4-F-C5H4; 4-Br-C6H4; 4-OH-C6H4; 4-CH3-C6H4; 4-C2H5-C6H4; 4-i-C3H7-C6H4; 3-Cl-C6H4; 3-Br-C6H4; 3-F-C6H4; 3-CH3O-C6H4; 3-OH-C6H4; 2-Cl-C6H4; 2-F-C6H4; 2-CH3O-C6H4; 4-OH-3-CH3O-C6H3; 2,4-диCl-C6H3; 2,4-диCH3O-C6H3; 2,5-диCH3O-C6H3; 3,4-диCH3O-C6H3;
r є
 ,
,
який відрізняється тим, що синтез проводять конденсацією рівномолярних кількостей 3-аміно-1,2,4-триазолу і відповідного заміщеного a,b-ненасиченого кетону у середовищі н-бутилового спирту в присутності каталітичних кількостей основного агента при кипінні протягом 1,5-2,5 годин до утворення цільового продукту.
3. Спосіб за п. 2, який відрізняється тим, що як a,b-ненасичений кетон використовують 4-гідрокси-6-метил-3-[3-арилпроп-2-еноїл]-2Н-піран-2-он, 6-гідроксі-5-[3-арилпроп-2-еноїл]піримідин-2,4-діон, 6-гідрокси-1,3-диметил-5-[3-арилпроп-2-еноїл]піримідин-2,4-діон, 1-(5-гідрокси-3-метил-1-феніл-1Н-піразол-4-іл)-3-арилпроп-2-ен-1-он.
4. Спосіб за п. 2, який відрізняється тим, що як основний агент використовують піперидин, морфолін, триетиламін.
Текст
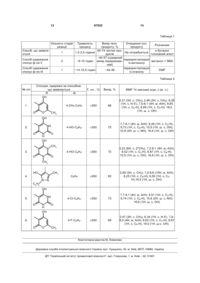
1. 5-Гетероарилзаміщений 7-арил-1,2,4триазоло[1,5-а]піримідин загальної формули І 3 97553 OH OH OH O CH3 N NH , O 4 CH3 , , O N H O O HO N CH3 N O . N C6H5 CH3 , який відрізняється тим, що синтез проводять конденсацією рівномолярних кількостей 3-аміно1,2,4-триазолу і відповідного заміщеного ,ненасиченого кетону у середовищі н-бутилового спирту в присутності каталітичних кількостей основного агента при кипінні протягом 1,5-2,5 годин до утворення цільового продукту. 3. Спосіб за п. 2, який відрізняється тим, що як ,-ненасичений кетон використовують 4-гідрокси6-метил-3-[3-арилпроп-2-еноїл]-2Н-піран-2-он, 6гідроксі-5-[3-арилпроп-2-еноїл]піримідин-2,4-діон, 6-гідрокси-1,3-диметил-5-[3-арилпроп-2еноїл]піримідин-2,4-діон, 1-(5-гідрокси-3-метил-1феніл-1Н-піразол-4-іл)-3-арилпроп-2-ен-1-он. 4. Спосіб за п. 2, який відрізняється тим, що як основний агент використовують піперидин, морфолін, триетиламін. Винахід стосується галузі органічної хімії, а саме складних азотовмісних гетероциклічних сполук 5-гетарилзаміщенних 7-арил-1,2,4 триазоло[1,5-а]піримідинів загальної формули І і способу їх одержання Ar = C6H5; 4-Cl-C6H4; 4-F-C5H4; 4-Br-C6H4; 4-OH-C6H4; 4-CH3-C6H4; 4-C2H5-C6H4; 4-i-C3H7-C6H4; 3-Cl-C6H4; 3-Br-C6H4; 3-F-C6H4; 3-CH3O-C6H4; 3-OH-C6H4; 2-Cl-C6H4; 2-F-C6H4; 2-CH3O-C6H4; 4-OH-3-CH3O-C6H3; 2,4-диCl-C6H3; 2,4-диCH3O-C6H3; 2,5-диCH3O-C6H3; 3,4-диCH3O-C6H3; Ar N N N N R I OH R= O CH3 N NH , O OH OH CH3 , , O N H Наявність фармакофорних фрагментів обумовлює перспективність пошуку у низці сполук формули І речовин з різними видами біологічної активності, що робить їх дуже корисними і привабливими для медичної і фармакологічної хімії. Так, різні гетероциклічні похідні піразолів і піримідинів використовуються як терапевтичні засоби при гострих і хронічних запаленнях, ішемічних процесах, призначенні для лікування патологічних станів - ревматоїдного артриту, розсіяного склерозу, астми, запалення кишечнику [Пат. РФ № 2266901, C07D 239/54; А61K 31/513]. Крім того, похідні піримідину є основною субстанцією багатьох лікарських препаратів для лікування захво O HO O N O CH3 N N . C6H5 CH3 рювань, що викликані вірусом ВІЛ, ендокринної і серцево-судинної систем [заявка ЕР № 203721, C07D 473/06; заявка ЕР № 267607, C07D 473/06]; вони проявляють гіпнотичну, антиалергічну активності [Baziard-Mongsset G. et al., Eur. J. Med. Chem., 30, №3, 253, (1995)]; мають антидепресивні властивості, виявляють діуретичний ефект [US Patent №5.290.782, C07D 473/02]. Сполуки, що заявляються, можуть бути застосовані при створенні нових лікарських засобів і біологічно активних речовин. Відомий структурний аналог сполук, що заявляються, -5,7-діарил-1,2,4-триазоло[1,5а]піримідин загальної формули II 5 97553 6 R R= H, CH3, Cl4 R1 = H, Cl, CH3O, NO2, N(CH3)2. N N N N R1 II і спосіб його одержання [Орлов В.Д., Десенко С.М. и др… Химия гетероциклических соедин., 1988, №2, с. 229]. Спосіб одержання сполук формули II складається з двох стадій і здійснюється за схемою: ДМФ -H2O NBS, CH3OH -HBr II На першій стадії одержують дигідропродукт кип'ятінням 3-аміно-1,2,4-триазолу (невеликий надлишок) і халкону (еквімолярна кількість) у диметилформаміді протягом 1 години. Розчин розбавляють бензолом, охолоджують, відфільтровують кристали, що випали в осад. Вихід технічних продуктів становить 65-70 %. Технічний продукт перекристалізовують із суміші бензолдиметилформамід (3:1). Одержаний дигідропродукт суспендують у метанолі при 50-60 °C, додають невеликий надлишок N-бромсукциніміду, кип'ятять 2 години. Фільтрат концентрують до 1/3 об'єму, охолоджують, відфільтровують триазоло[1,5-а]піримідин. Вихід складає 62-82 %. Технічний продукт перекристалізовують з метанолу. Сумарний вихід технічних продуктів після двох послідовних стадій складає . близько 40-57 %. Загальний час тривалості реакції становить близько 9-10 годин. Недоліками способу одержання сполук формули II є його двостадійність, використання як розчинників вогненебезпечного бензолу і метанолу отрути смертельно небезпечної для життя навіть у незначних кількостях. N-бромсукцинімід викликає дерматити. До недоліків способу одержання слід також віднести невисокі виходи кінцевих продуктів, необхідність очищення речовин на кожній стадії реакції, що робить значно дорожчим відомий спосіб одержання сполук формули II. Після додаткових перекристалізацій вихід цільових продуктів складає близько 30-35 %. Відомий структурний аналог сполук, що заявляються, -1,2,4-триазоло[1,5-а]піримідин загальної формули III 7 97553 8 Ar = 4-CH3O-C6H4; OH Ar N N N R= N R O CH3 N NH , O OH OH , O N H O O N O . CH3 III і спосіб його одержання [Rudenko R., Komykhov S., et al., J. Heterocyclic Chem., 46, 285 (2009)]. У відомому джерелі інформації автори не вказують на можливість модифікації арильного ради CH3 кала, та одержано лише три сполуки з Аr=4-СН3ОС6Н4-радикалом. Спосіб одержання сполук формули III складається з однієї стадії і реалізується за схемою: ДМФ III Суміш 3-аміно-1,2,4-триазолу (невеликий надлишок) і 6-гідрокси-5-[3-(4-метоксифеніл)пропенон-1-іл]-1,3-диметилпіримідин-2,4-діону кип'ятять у диметилформаміді протягом 30 хвилин і після охолодження до кімнатної температури розбавляють бензолом. Реакційну масу залишають на 24 години. Осад відфільтровують і сушать. Вихід технічного 5-(6-гідрокси-1,3-диметилпіримідин2,4-діон-5-іл)-7-(4-метоксифеніл)-1,2,4-триазоло[1,5-а]піримідину складає 47 % (після очищення з етанолу 35 %.). Т.пл. > 270 °C. Час проведення реакції становить близько 1415,5 годин. Недоліками способу одержання сполуки формули III є низький вихід цільових сполук, використання вогненебезпечних і отруйних речовин, необхідність очищення кінцевих продуктів, що значно знижує їх вихід. Крім того, відсутність можливості модифікувати арильний радикал (у джерелі використано лише 4-метоксибензальдегід) обмежує використання відомого способу одержання сполуки формули III для одержання великого асортименту гетероцик . лічних сполук з корисними властивостями для медичної і фармацевтичної хімії. При використанні висококиплячого розчинника - диметилформаміду як середовища для проведення реакції можливо утворення смолистих продуктів або навіть часткова деструкція компонентів реакції і кінцевих продуктів. Як результат спостерігається значне зменшення виходу основного продукту. В зв'язку з цим виникає необхідність проведення очищення кінцевого продукту з етанолу, що також слід віднести до недоліків способу одержання відомого аналога. В основу винаходу поставлена задача розробки нових сполук у низці триазолопіримідинів з варіацією замісників у всіх фрагментах молекули, а також універсального і доступного способу їх одержання, що дозволить підвищити вихід і якість кінцевих продуктів за рахунок зміни структури компонентів реагуючої суміші і умов проведення синтезу. Поставлена задача досягається розробкою нових 5-гетарилзаміщенних 7-арил-1,2,4триазоло[1,5-а]піримідинів загальної формули І 9 97553 Ar = C6H5; 4-Cl-C6H4; 4-F-C5H4; 4-Br-C6H4; 4-OH-C6H4; 4-CH3-C6H4; 4-C2H5-C6H4; 4-i-C3H7-C6H4; 3-Cl-C6H4; 3-Br-C6H4; 3-F-C6H4; 3-CH3O-C6H4; 3-OH-C6H4; 2-Cl-C6H4; 2-F-C6H4; 2-CH3O-C6H4; 4-OH-3-CH3O-C6H3; 2,4-диCl-C6H3; 2,4-диCH3O-C6H3; 2,5-диCH3O-C6H3; 3,4-диCH3O-C6H3; Ar N N N N 10 R I OH R= O N NH , O OH OH CH3 HO , , CH3 O N H O O N O CH3 N . N C6H5 CH3 і способу їх одержання. У способі одержання сполуки формули І Ar = C6H5; 4-Cl-C6H4; 4-F-C5H4; 4-Br-C6H4; 4-OH-C6H4; 4-CH3-C6H4; 4-C2H5-C6H4; 4-i-C3H7-C6H4; 3-Cl-C6H4; 3-Br-C6H4; 3-F-C6H4; 3-CH3O-C6H4; 3-OH-C6H4; 2-Cl-C6H4; 2-F-C6H4; 2-CH3O-C6H4; 4-OH-3-CH3O-C6H3; 2,4-диCl-C6H3; 2,4-диCH3O-C6H3; 2,5-диCH3O-C6H3; 3,4-диCH3O-C6H3; Ar N N N N R I OH R= O CH3 N NH , O OH OH CH3 , , O N H згідно з винаходом, синтез проводять конденсацією рівномолярних кількостей 3-аміно-1,2,4триазолу і відповідного заміщеного , ненасиченого кетону у середовищі н-бутилового спирту в присутності каталітичних кількостей основного агента при кипінні протягом 1,5-2,5 годин до утворення цільового продукту. Як , -ненасичені кетони використовують 4гідрокси-6-метил-3-[3-арилпроп-2-еноїл]-2Н-піран2-он, 6-гідроксі-5-[3-арилпроп-2-еноїл]піримідин2,4-діон, 6-гідрокси-1,3-диметил-5-[3-арилпроп-2еноїл]піримідин-2,4-діон, 1-(5-гідрокси-3-метил-1феніл-1Н-піразол-4-іл)-3-арилпроп-2-ен-1-он. Як основний агент використовують піперидин, морфолін, триетиламін. Експериментальним шляхом встановлено, що використання як розчинника н-бутилового спирту у процесі синтезу сполук, що заявляються, сприяє м'якому проходженню реакції і дозволяє одержувати кінцеві продукти без домішок смолистих побічних речовин. Крім того, повністю виключена часткова деструкція як вихідних, так і кінцевих сполук. Це дає можливість виділяти з реакційної маси відразу чисті продукти без додаткових перекристалізацій, що, в свою чергу, дозволяє підвищити вихід і якість цільових сполук і знизити витрати робочого часу і енерговитрати. До такого позитивного ефекту привела вдала заміна розчинника для реакції: у відомому способі за статтею [Rudenko R., Komykhov S., et al., J. Heterocyclic Chem., 46, 285 O HO O N O CH3 N N . C6H5 CH3 (2009)] - диметилфорамід, у способі, що заявляється, - н-бутиловий спирт, а також проведення реакції в умовах основного каталізу. Сполуки, що заявляються, являють собою високоплавкі (т. пл.>270 °C) кристалічні, складні азотовмісні гетероциклічні речовини, що інтенсивно забарвлені від жовтого до жовто-оранжевого кольору, добре розчиняються у полярних розчинниках, малорозчинні у неполярних (бензол, толуол), не розчиняються у воді. Інтенсивне забарвлення сполук формули І є наслідком наявності двох фрагментів різної електронної природи - електроноакцепторної і електронодонорної. Можливість модифікації хімічної структури сполук, що заявляються, шляхом варіювання ароматичних замісників Аr у піримідиновому фрагменті дозволяє одержувати широкий асортимент нових сполук і потенційних біологічно активних речовин у низці 5-гетероарилзаміщенних 7-арил1,2,4-триазоло[1,5-а]піримідинів. Слід відзначити, що структура сполук формули І, що заявляються, представляє інтерес як з точки зору застосування їх як потенційно життєво важливих біологічно активних речовин, так і для практичного застосування як барвників, препаратів у біологічних дослідженнях і медичній діагностиці. Спосіб одержання сполук формули І, що заявляється, здійснюється за схемою: 11 97553 Ar O H N N N 12 + R NH2 Експериментальним шляхом встановлено, що рівномолярні кількості 3-аміно-1,2,4-триазолу і відповідного заміщеного , -ненасиченого кетону кип'ятять у середовищі н-бутилового спирту 1,5-2,5 години в присутності каталітичних кількостей основного агента - піперидину, морфоліну або триетиламіну. Продукт, що випадає в осад при охолодженні, відфільтровують, промивають етанолом, сушать. Використання будь-якого з компонентів реакції в більшому або меншому співвідношенні ніж еквімолярні, приводить до утворення суміші відповідних вихідних речовин і кінцевих продуктів реакції. Час протікання реакції встановлено експериментально і складає близько 1,5-2,5 годин. Збільшення часу кип'ятіння реакційної маси не доцільне, тому що за цей проміжок часу реакція утворення цільових продуктів проходить повністю. Після виділення їх з реакційної суміші і промиван1 ня етанолом, даними H ЯМР спектроскопії підтверджено їх будову і чистоту. Вибір компонентів суміші, що реагує, їх мольні співвідношення, середовище для проведення реакції конденсації в умовах основного каталізу, вдала композиція основного агента і відповідного розчинника, час проходження процесу - все це відбивається на чистоті і високих виходах кінцевих сполук. У таблиці 1 наведено порівняльні дані способу, що заявляється, і способів одержання відомих аналогів. У таблиці 2 наведено характеристики сполук формули І, що заявляються. Нижче наведено приклади конкретного виконання. Приклад 1. Одержання 4-гідрокси-6-метил-3[7-(4-метилфеніл)-1,2,4-триазоло-[1,5-а]піримідин5-іл]-2Н-піран-2-ону Суміш 0,08 г (1 ммоль) 3-аміно-1,2,4-триазолу і 0,25 г (1 ммоль) 4-гідрокси-6-метил-3-[3-толілпроп2-еноїл]-2Н-піран-2-ону розчиняють у 3 мл нбутилового спирту і додають 0,1 мл піперидину. Одержаний розчин кип'ятять протягом 1,5 години. Після охолодження осад, що випав, відфільтровують, промивають 5 мл етанолом. Сушать на повітрі. Вихід 0,21 г (68 %); т. пл. >300 °C. 1 Спектр Н ЯМР (, м.ч.): 2,31 (3Н, с, СН3), 2,46 (3Н, с, СН3), 6,35 (1Н, с, Н-5'), 7,5-8,1 (4Н, м, АrН), 8,65 (1Н, с, C2-H), 8,69 (1Н, с, С6-Н), 18,0 (1Н, ш. с, ОН). Ar n-BuOH N осн. агент N N N I R . Приклад 2. Одержання 6-гідрокси-1,3диметил-5-(7-(4-гідроксифеніл)[1,2,4]триазоло[1,5а]піримідин-5-іл)піримідин-2,4(1H, 3H)-діону Одержують аналогічно прикладу 1. Для реакції беруть: 3-аміно-1,2,4-триазол 0,08 г (1 ммоль), 6гідрокси-1,3-диметил-5-[3-арилпроп-2еноїл]піримідин-2,4-діон 0,29 г (1 ммоль), основний каталізатор морфолін 0,1 мл. Час кип'ятіння 2 години. Вихід 0,25 г (72 %); т. пл. >300 °C. 1 Спектр Н ЯМР (, м.ч.): 3,23 (6Н, с, 2*СН3), 7,2-8,1 (4Н, м, АrН), 8,52 (1Н, с, C2-H), 8,87 (1Н, с, С6-Н), 10,5 (1Н, ш. с, ОН), 16,6 (1Н, ш. с, ОН). Приклад 3. Одержання 3-метил-1-феніл-4-(7феніл[1,2,4]триазоло[1,5-а]піримідин-5-іл)-1Нпіразол-5-олу. Одержують аналогічно прикладу 1. Для реакції беруть: 3-аміно-1,2,4-триазол 0,08 г (1 ммоль), 1(5-гідрокси-3-метил-1-феніл-1Н-піразол-4-іл)-3арилпроп-2-ен-1-он 0,3 г (1 ммоль), основний каталізатор триетиламін 0,1 мл. Час кип'ятіння 2,5 години. Вихід 0,23г (63 %); т. пл. >300 °C. 1 Спектр H ЯМР (, м.ч.): 2,69 (3Н, с, СН3), 7,28,6 (10Н, м, АrН), 8,25 (1Н, с, С6-Н), 8,50 (1Н, с, С2Н),16,5 (1Н, ш. с, ОН). Спектри ядерного магнітного резонансу записано на спектрометрі VARIAN Mercury VX-200 (200 МГц) у розчинах дейтеродиметилсульфоксиду (DMSO-d6), внутрішній стандарт тетраметилсилан. Решту прикладів наведено в таблиці 2. Як видно з тексту опису матеріалів заявки і даних таблиць 1 і 2, технічні рішення, що пропонуються, мають наступні переваги у порівнянні з відомими аналогами: - сполука формули (І), що заявляється, забезпечує одержання більш широкого асортименту похідних триазолопіримідинів з покращеними властивостями; - дозволяє широко варіювати арильні радикали у піримідиновому фрагменті. Спосіб одержаних сполук формули І, що заявляється, дозволяє: - значно підвищити вихід і якість кінцевих продуктів; - виключити очищення цільових сполук; - зменшити тривалість технологічного процесу. Всі ці переваги нових сполук і способу їх одержання розширюють можливості використання їх в зазначених галузях застосування. 13 97553 14 Таблиця 1 Кількість стадій реакції Спосіб, що заявляється 1 Спосіб одержання сполук ф-ли II 2 Спосіб одержання сполук ф-ли III 1 Тривалість процесу Вихід техн. Очищення осн. Розчинник продукту, % продукту 60-74 чистих прон-бутанол 1,5-2,5 години Не потребується дуктів +основний агент ~40-57 (сумарний перекристалізація ~9-10 годин вихід перераховаметанол + NBS із метанолу ний) перекристалізація ~14-15,5 годин ~44-48 DMF із етанолу Таблиця 2 Сполуки, одержані за способом, що заявляється R Ar OH № п/п Т. пл., C Вихід, % ЯМР Н хімічний зсув, (м. ч.) 1 4-СН3-С6Н4 >300 75 7,7-8,1 (4H, м, ArH), 8,49 (1H, с, C2-H), 8,73 (1H, с, С6-Н), 10,5 (1H, ш. с, ОН), 10,8 (2Н, ш. с, NH), 16.6 (1H, ш. с, ОН) 4-НО-С6Н4 O 68 >300 72 3,23 (6Н, с, 2*СН3), 7,2-8.1 (4H, м, ArH), 8,52 (1H, с, C2-Н), 8,87 (1H, с, С6-Н), 10,5 (1H, ш. с, OH), 16,6 (1H, ш. с, ОН) С6Н5 >300 63 2,69 (3Н, с, СН3), 7,2-8,6 (10Н, м, ArH), 8,25 (1H, с, С6-H), 8,50 (1H, с, C2H),16,5 (1H, ш. с, OH). 4-Сl-С6Н4 >300 70 7,7-8,1 (4H, м, ArH), 8,51 (1H, с, С2-Н), 8,74 (1H, с, С6-H), 10,8 (2Н, ш. с, NH), 16,6 (1H, ш. с, OH) 4-F-С6Н4 O >300 4-НО-СбН4 1. 2,31 (3Н, с, СН3), 2,46 (3Н, с, СН3), 6,35 (1H, с, H-5'), 7,5-8,1 (4H, м, ArH), 8,65 (1H, с, С2-Н), 8,69 (1H, с, С6-Н), 18,0 (1H, ш. с, OH) >300 69 2.47 (3Н, с, СН3), 6,34 (1H, с, H-5'), 7,68,0 (4H, м, ArH), 8.63 (1H, с, С2-Н), 8.67 (1H, с, С6-Н), 18.0 (1H, ш.с, OH). CH3 OH NH 2. O N H O OH CH3 N 3. O N O CH3 HO CH3 4. N N C6 H5 OH NH 5. O N H O OH 6. O O CH3 Комп’ютерна верстка М. Ломалова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською5-heterosubstituted 7-aryl-1,2,4-triazolo[1,5-a]pyrimidines and a process for the preparation thereof
Автори англійськоюRudenko Roman Volodymyrovych, Komikhov Serhii Oleksandrovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російською5-гетероарилзамещенные 7-арил-1,2,4-триазоло[1,5-а]пиримидины и способ их получения
Автори російськоюРуденко Роман Владимирович, Комихов Сергей Александрович, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 239/00
Мітки: одержання, спосіб, 5-гетероарилзаміщені, 7-арил-1,2,4-триазоло[1,5-а]піримідини
Код посилання
<a href="https://ua.patents.su/7-97553-5-geteroarilzamishheni-7-aril-124-triazolo15-apirimidini-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">5-гетероарилзаміщені 7-арил-1,2,4-триазоло[1,5-а]піримідини та спосіб їх одержання</a>
Попередній патент: Ініціалізація вузлів зв’язку
Наступний патент: Спосіб кріплення паралельних розтяжок рухомої частини вимірювального приладу
Випадковий патент: Запірно-пускова голівка вогнегасника