Спосіб приготування і очищення гемцитабін-гідрохлориду
Формула / Реферат
1. Спосіб поліпшення складу (кількості) ![]() -аномера сполуки за формулою І
-аномера сполуки за формулою І
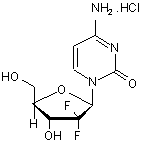 (I),
(I),
який включає операції, при яких:
забезпечують розчинення вказаної сполуки в розчиннику, що складається, в основному, з води;
підвищують концентрацію вказаної сполуки в даному розчині для ініціації процесу осадження;
виділяють вказану сполуку в чистому вигляді, поліпшену в частині ![]() -аномера.
-аномера.
2. Спосіб за п. 1, який відрізняється тим, що при здійсненні операції підвищення концентрації видаляють частину розчинника.
3. Спосіб за п. 1, який відрізняється тим, що відношення розчинника до початкової сполуки змінюють від 3:1 до 12:1.
4. Спосіб за п. 1, який відрізняється тим, що початковий розчин обробляють активованим вугіллям.
5. Спосіб за п. 1, який відрізняється тим, що операцію підвищення концентрації продовжують, поки відношення розчинника до початкової сполуки не стане нижче 3:1.
6. Спосіб за п. 1, який відрізняється тим, що сполуку, поліпшену в частині ![]() -аномера, виділяють при температурі приблизно від 0 °С до 10 °С.
-аномера, виділяють при температурі приблизно від 0 °С до 10 °С.
7. Спосіб за п. 6, який відрізняється тим, що сполука, поліпшена в частині ![]() -аномера, містить не менше 99,7 % даного
-аномера, містить не менше 99,7 % даного ![]() -аномера за результатами вимірювання методом рідинної хроматографії високого тиску (розрізняння) (HPLC).
-аномера за результатами вимірювання методом рідинної хроматографії високого тиску (розрізняння) (HPLC).
8. Спосіб за п. 6, який відрізняється тим, що сполука, поліпшена в частині ![]() -аномера, містить не менше 99,9% даного
-аномера, містить не менше 99,9% даного ![]() -аномера за результатами вимірювання методом рідинної хроматографії високого тиску (розрізняння) (HPLC).
-аномера за результатами вимірювання методом рідинної хроматографії високого тиску (розрізняння) (HPLC).
9. Спосіб приготування Гемцитабін-гідрохлориду за п. 1, який відрізняється тим, що включає операцію, при якій здійснюють реакцію 2-дезокси-2,2-дифторо-1-оксорибози по формулі VB з t-бутил-дифенілсиліл-хлоридом для формування
3,5-біс(t-бутилдифенілсилілокси)-2-дезокси-2,2-дифторорибози по формулі VIB.
10. Спосіб за п. 9, який відрізняється тим, що 2-дезокси-2, 2-дифторо-1-оксорибозу по формулі VB готують за допомогою проведення реакції етил-2,2-дифторо-3-окси(гідрокси)-3-(2,2-диметилдіоксалан-4-іл)пропіонату з іодином в низькому спирту з подальшою азеотропною дистиляцією.
11. Спосіб за п. 9, який відрізняється тим, що він додатково містить операцію, при якій забезпечують захист гідроксильної групи в 3,5-біс(t-бутилдифенілсилілокси)-2-дезокси-2,2-дифторорибозі по формулі VIB для отримання 3,5-біс(третинний бутилдифенілсилілокси)-1-метансульфонілокси-2-деокси-2,2-дифторорибози по формулі VIIB шляхом використовування метансульфонілхлориду.
12. Спосіб за п. 9, який відрізняється тим, що він додатково містить операцію, при якій забезпечують конденсацію 3,5-біс(третинний бутил-дифенілсилілокси)-1-метансульфонілокси-2-деокси-2,2-дифторорибози по формулі VIIB із сполукою дислілу по формулі VIII для отримання 1-[2’-деокси-2,2’-дифторо-3’,5’-рибофураноза-3,5-біс(третинний бутил-дифенілсилілокси)-n-ацетилтоцину по формулі IX.
13. Спосіб за п. 9, який відрізняється тим, що він додатково містить операцію, при якій забезпечують конверсію 1-[2’-деокси-2’,2’-дифторо-3’,5’-рибофураноза-3,5-біс(третинний бутилдифенілсилілокси)-n-ацетилцитоцину по формулі IX в Гемцитабін-гідрохлорид по формулі І.
Текст
1. Спосіб поліпшення складу (кількості) аномера сполуки за формулою І 2 (19) 1 3 18156 Дана корисна модель відноситься до процесу покращення аномерного складу гемцитабінгідрохлорида. Гемцитабін-гідрохлорид відомий як хімічне з’єднання під назвою 2–деокси-2-, 2дифтороцитидин-моногідрохлорид ( -аномер) (далі по тексту - гемцитабін-гідрохлорид) і має структурну формулу І наступного вигляду: ної речовини (freebase). З рівня техніки добре відомі способи збільшення кількості -аномера. Наприклад, патент США №5,945,547 розкриває спосіб очищення гемцитабін-гідрохлориду відносно специфіки його аномерної чистоти. Спосіб включає операції розчинення із співвідношенням 1:1 / аномерної сполуки в гарячій воді/ацетоні при зворотному стоці і охолоджування розчину від -10 до 50°С для осадження необхідного продукту. Гемцитабін-гідрохлорид, що випав в осадок збирається і підлягає подальшим технологічним операціям повторення вказаного вище процесу для отримання гемцитабін-гідрохлориду з чистотою, приблизно, 99%. Спосіб виробництва гемцитабіна також добре відомий з рівня техніки. Наприклад, патент США №4,808,614 описує спосіб приготування гемцитабін-гідрохлориду по приведеній нижче схемі 1. NH2 .HCl N HO O F H N 4 O OH F Формула І Гемцитабін-гідрохлорид є нуклеозидним аналогом, що проявляє протипухлинну активність, і відомий на ринку під брендовим найменуванням GEMZAR® у вигляді ін’єкційного розчину. Ампула Gemzar містить еквівалент гемцитабінгідрохлориду в кількості до 200мг або 1г безосновСхема 1: O F O Br F Formula IIA O O H O F O O O acidic ion exchange resin HO O F H F HO Formula IV F O HO Formula III Formula II O Ttifluoromethanesul fonyloxyt-butyldimet hylsilane / 2,6-lutidine Si O O Diisobutylaluminum hydride Si O F Si OH O H O H O F F Formula V F Si O H Formula VI methanesulfonyl choride Si Si OMs O F O N Formula VIII F H O Si NH2 .HCl CH3 N O Si O N N HO O O F H Formula VII В описі способу згідно з патентом США №4,808,614 розкрито використовування реактивів гідролізу, наприклад, слабо кислотних іонообмінних смол (слабо кислотних іонітів), для здійснення процесу перетворення (конверсії) сполуки по формулі III у сполуку по формулі IV. Крім того, патент США №5,223,608 розкриває H OH F N H Formula I спосіб одержання гемцитабін-гідрохлориду шляхом використовування таких реагентів гідролізу, як сильні кислоти, для приготування 2-деокси-2, 2дифторо-D-еритро-пентофураноза-1-улоз-3, 5дибензоата по формулі VA. Процес представлено на схемі II. 5 18156 6 ня способу приготування гемцитабін-гідрохлориду, O F поліпшеного в частині його -аномера. Крім того, O Br O F Benzoyl chloride дана корисна модель направлена на створення O O F O Formula IIA O F O O O H O O ефективного продуктивного способу приготування F F BzO Formula IIIB O HO гемцитабін-гідрохлориду і його проміжних речовин Formula II Formula III необхідної чистоти. Спосіб за даною корисною trifluoroaceticacid OH BzO моделлю відрізняється простотою, екологічністю, diisobutylaluminum O HO F hydride BzO O Benzoyl chloride економічністю, надійністю і технологічністю. H H O O F O F O F BzO H Formula VIA F H Таким чином, створений спосіб приготування BzO F BzO Formula VA Formula IVA гемцитабін-гідрохлориду, поліпшеного в частині methanesulfonyl O choride Si N його -аномера, що включає операції, при яких: NH .HCl CH N a) забезпечують розчин гемцитабінOMs BzO Si N O N O F гідрохлориду в розчиннику, який складається, в H H Formula VIII HO O N F O BzO основному, з води; O F Formula VIIA H H b) підвищують концентрацію гемцитабінOH F Formula I гідрохлориду в даному розчині для ініціації процеЗаявка РСТ, № публікації 2005/095430 А1, росу осадження; зкриває спосіб одержання гемцитабінc) виділяють в чистому вигляді вказану сполугідрохлориду. У вказаній заявці описано викориску, поліпшену в згаданій її частині -аномера; товування реагентів гідролізу, подібних сильним В іншому аспекті дана корисна модель віднокислотам, для приготування 2-деокси-2, 2ситься до способу приготування гемцитабіндифторо-D-еритро-пентофураноза-1-улоз-3, 5гідрохлориду і його проміжних речовин. дибензоата по формулі VA. Крім того, в заявці В одному з прикладів здійснення спосіб пригоописаний процес очищення сполуки по формулі тування гемцитабін-гідрохлориду по формулі І VA. Дана заявка також розкриває спосіб очищення включає операції, при яких виконують: гемцитабін-гідрохлориду шляхом розчинення 95% і. конверсію сполуки по формулі III в сполуку поліпшеного -аномера гемцитабін-гідрохлориду у по формулі IV, використовуючи реагенти децикліводі, який виділено (отримано в чистому вигляді) зації, у присутності відповідного органічного розшляхом використовування розчинників, подібних чинника з подальшою азеотропною дистиляцією; ізопропіловому спирту, ацетонітрилу або ацетону. іі. захист оксигруп сполуки по формулі IV, виПроцес показано на схемі III. користовуючи відповідні окси-захисні реагенти, у Схема III: присутності відповідного органічного розчинника Benzoyl chloride CF COOH HO BzO при заданій температурі, з метою забезпечення O CH CN/H O O O O O F F O F O O сполуки по формулі VB; H H F BzO F F HO HO ііі. відновлення речовини по формулі VB, викоFormula VA Formula IV Formula III ристовуючи відповідний вiдновлюючий реагент, у Purification присутності відповідного органічного розчинника, з methanesulfonyl BzO OMs choride OH BzO O BzO Vitride O метою забезпечення сполуки по формулі VIB; F O F O H H F H H F O F BzO H iv. захист сполуки по формулі VIB, використоO BzO F Formula VIA BzO Formula VIIA вуючи алкіл-або арил-сульфоніл-хлориди, у присуFormula VA тності відповідної основи і відповідного органічного O Si N розчинника, з метою забезпечення сполуки по фоCH N NH .HCl рмулі VIIB; Si O N N v. конденсацію сполуки по формулі VIIB із споFormula VIII HO O N лукою по формулі VIII у присутності відповідного O F органічного розчинника і відповідних основ, з меH H OH F тою забезпечення сполуки по формулі IX; і Formula I vi. зняття захисту зі сполуки по формулі IX, виОписані способи відображають основні напрямки в користовуючи відповідний реагент, з подальшим розвитку технології приготування гемцитабінпроведенням реакції з хлористоводородною (согідрохлориду. При здійсненні даних способів виколяною) кислотою у присутності відповідного оргаристані слабо кислотні іонообмінні смоли і сильні нічного розчинника, з метою забезпечення гемцикислоти як засоби гідролізу в процесі формування табін-гідрохлориду по формулі І. незахищеного і захищеного лактону. Обидва засоЩе один аспект даної корисної моделі забезби гідролізу страждають недоліком, який полягає у печує одержання кристалічного гемцитабінвиникненні проблем при формуванні лактонового гідрохлориду, відмінного системою ліній порошкокільця. При цьому існує небезпека утворення невої дифракції рентгенівського проміння («XRPD»), бажаних продуктів реакції, які можуть зіграти роль графіком диференціальної скануючої калориметрії забруднюючих речовин, що часто приводить до («DSC») та/або спектром поглинання інфрачервоповернення лактону в стан його прекурсору з відкного випромінювання («IR»). ритим ланцюгом через його (лактону) чутливість Ще один аспект даної корисної моделі забездо дії сильних кислот і смол. печує одержання гемцитабін-гідрохлориду, в осноПродовжує існувати насущна необхідність у вному, вільного від залишкових розчинників. вдосконаленні технологій одержання продукту Фіг.1 - система ліній порошкової дифракції резаданої аномерной чистоти і приготування гемцинтгенівського випромінювання, що відноситься до табін-гідрохлориду. гемцитабін-гідрохлориду, приготованого по техноДана корисна модель направлена на створенСхема II: 2 3 3 3 3 2 2 7 18156 8 логії, описаній в прикладі 8. ний активованим вугіллям, з метою посилення Фіг.2 - диференціальна скануюча калориметрія інтенсивності кольору сполуки, з подальшою фільзразка гемцитабін- гідрохлориду, приготованого по трацією через яке-небудь середовище, наприклад, технології, описаній в прикладі 8. через прожарений розжареним потоком шар диаФіг.3 - інфрачервоний спектр зразка гемцитатомовой землі (Hyflow) для видалення вуглецю. бін- гідрохлориду, приготованого по технології, Переважна кількість активованого вугілля, виописаній в прикладі 8. користаного при виділенні бета-аномера з поліпФіг.4 - термогравіметрична графічна характешеним кольором, складає, приблизно, від 0,1 до ристика зразка гемцитабін- гідрохлориду, пригото10 (вага/вага) активованого вугілля на 1 грам анованого по технології, описаній в прикладі 8. мерної / -суміші. Фіг.5 - рідинна хроматографія високого тиску Обробка вуглецем може здійснюватися або (розрізняння) зразка гемцитабін- гідрохлориду, при температурі розчинення, або після охолоджуприготованого по технології, описаній в прикладі 8. вання розчину до більш низької температури. В способі по [патенту США №5,945,547] викоЯк альтернатива, розчин може бути відфільтристовують ацетон/воду. Винахідники із здивуванрований шляхом проходження через папір, склоням відкрили, що використовування води без ацеволокно або інший мембранний матеріал, або тону веде до забезпечення більш високої крізь освітлюючий засіб, наприклад, целіт. аномерной чистоти. Залежно від використовуваного устаткування, Таким чином, дана корисна модель забезпеконцентрації і температури розчину, пристрій фічує спосіб очищення гемцитабін-гідрохлориду, з льтрації може вимагати попереднього підігріву, метою отримання гемцитабін-гідрохлориду, пощоб уникнути передчасної кристалізації. ліпшеного в частині його -аномера. Концентрація розчину може складати, приблиВ одному з прикладів здійснення даної корисзно, від 1г/мл до 20г/мл розчинника, або може коної моделі, спосіб очищення гемцитабінливатися від 1g/ml до 5g/ml. Операція b) включає підвищення концентрації гідрохлориду, поліпшеного в частині його гемцитабін-гідрохлориду у вказаному розчині, з аномера, включає операції, при яких: метою ініціації осадження згаданого -аномера. а) забезпечують розчин гемцитабінгидрохлориду в розчиннику, що складається, в Операція концентрації може виконуватися відосновному, з води; повідним методом випаровування, методом дисb) підвищують концентрацію гемцитабінтиляції в атмосфері або у вакуумі. гідрохлориду в даному розчині для ініціації процеДистиляція розчинника може проводитися у су осадження; вакуумі від 100мм ртутного стовпа до 600мм ртутc) виділяють в чистому вигляді вказану сполуного стовпа при температурі, приблизно, від 40°С до 70°С. Поки концентрація відбувається без зроску, поліпшену в згаданій її частині -аномера; тання рівнів домішок, може бути використана Операція а) включає забезпечення розчину будь-яка температура і будь-які умови вакууму. гемцитабін-гідрохлориду в розчиннику, що складаКонцентрація розчину може відбуватися до ється, в основному, з води. тих пір, поки не почнеться осадження гемцитабінРозчин гемцитабін-гідрохлориду може бути гідрохлориду з розчину, що перетворює розчин на отриманий шляхом розчинення гемцитабіншлам. В основному, процес концентрації припинигідрохлориду у воді. Прийнятна будь-яка форма тися, коли відношення розчинника до гемцитабінгемцитабін-гідрохлориду для утворення такого гідрохлориду досягне значення від 1:1 до 1:5. розчину, наприклад будь-яка кристалічна або амоДалі реактивна маса може утримуватися при рфна форма гемцитабін-гідрохлориду. температурі, нижчій за температуру, при якій здійГемцитабін-гідрохлорид може бути приготоваснюється концентрація, наприклад, нижче за проний для використовування в операції забезпеченміжок температур, приблизно, від 40°С до 45°С ня розчину по будь-якому із способів, відомих з протягом періоду часу, який потрібний для більш рівня техніки, або відповідно до згаданих вище повного виділення продукту. Точна температура технологій. охолоджування і тривалість часу, необхідні для Концентрація аномерної сольової суміші у воді повної кристалізації, можуть бути легко визначені не є критичною до тих пір, поки використовується кваліфікованим фахівцем в даній області техніки і така кількість води, якої достатньо для забезпебудуть також залежати від таких параметрів, як чення повного розчинення. Кількість вживаної вовид концентрації і температура розчину або ди зберігається невеликою, щоб уникнути надміршламу. ної втрати продукту під час кристалізації і Операція с) включає виділення -аномера. виділення продукту в чистому вигляді. Кількість води, використаної для виділення бета-аномера, Виділення твердої фракції може здійснюватискладає, приблизно, від 3-до12-кратної вагося з використанням звичайних технологій, напривої/об’ємної кількості гемцитабін-гідрохлориду. клад, шляхом фільтрації, декантування, центрифуРозчин може бути приготований при темперагування і іншими подібними методами або шляхом турі, приблизно, від 25°С до 100°С. Залежно від фільтрування в атмосфері інертних газів з викорикількості узятого розчинника, процес розчинення станням таких газів, як азот і інші інертні гази. може відбуватися при температурах від 25°С до Вологий коржик, отриманий в результаті вико100°С. В деяких випадках для здійснення процесу нання операції с), може бути згодом осушений в розчинення необхідний підігрів, і розчинення може лотковій сушарці, вакуумній печі, повітряній печі, відбуватися при температурах від 50°С до 100°С. сушарці з псевдозрідженим шаром, випарній суЯк альтернатива, розчин може бути оброблешарці і в інших подібних пристроях. Сушка може 9 18156 10 здійснюватися при температурі, приблизно, від які можуть повторюватися невизначену кількість 35°С до 70°С. Сушка може здійснюватися протяразів, забезпечуючи відповідність процесу по когом будь-якого заданого періоду часу від 1 години рисної моделі до безперервного процесу. При до 20 годин. цьому очевидне досягнення реальної комерційної В окремих прикладах здійснення корисної мовигоди. делі описаний вище спосіб по даній корисній моОчищений гемцитабін-гідрохлорид, отриманий делі може бути пристосований до процесу формуз використанням способу, що заявляється, містить вання бази для безперервної кристалізації. менше 0,1% або менше 0,01% будь-якої домішки Чистота продукту, отриманого в результаті операцитозина і -аномера. ції с), перевіряється на визначення процентного Гемцитабін-гідрохлорід, отриманий з викорисвмісту домішок альфа-аномера. Якщо за наслідтанням способу, що заявляється, був перевірений ками рідинної хроматографії високого тиску (розріпо методу рідинної хроматографії високого тиску знення) вміст домішок не знижується до заданих (розрізнення) (HPLC) за способом, описаним у рівнів нижче 0,1%, то операції від а) до с) повтофармакопеї США (USP) 29; NF 24; 2006; стр. No. рюються на вологому матеріалі, отриманому в 990-991. Результати перевірочних досліджень нарезультаті операції с). Якщо в результаті операції дані в Таблиці 1. с) досягається задана чистота, цикл припиняється. Таким чином, встановлюється цикл операцій, Таблиця 1 Колонка і Насадка Буфер: Рухома фаза А: Рухома фаза В Градієнт: Спосіб HPLC Зорбакс (Zorbax) Rx С8 250Х4,6мм, 5 13,8г NaH2PО4.H2О i 2,5мл фосфорної кислоти було розчинено у 1000мл milli Q води і розчин профільтровано через мембранний фільтр з розміром пори 0,45 ,. Коефіцієнт рН розчину: 2.4-2.6. Буферний розчин використано як рухому фазу. Використано відфільтрований та дегазований метанол. Час (в хвилинах) розчин A (%v/v) розчин В (5v/v) Елюювання 0-8 97 3 Ізокритія (Isocratic) 8-13 97-50 3-50 Лінейний градієнт 13-20 50 50 Ізократія (Іsосrаtіс) 20-25 50-97 50-3 Ре-урівноваження (повторне урівноваження) 25-30 97 3 Урівноваження 1,2мл/хвил Витрата Довжина хвилі визначення (вияв275нм при UV (ультрафіолетовому) дослідженні лення): Температура: 25±20С Об’єм ін’єкції: 20 L Розріджувач (розчинник): Milli Q (Милі кількість) води Робочий час (тривалість операції): 30 хвилин Назва домішки Домішка -аномера Домішка цитозину RRT 0,67 0,37 11 18156 В одному з аспектів дана корисна модель відноситься до способу приготування гемцитабінгідрохлориду і його проміжних речовин. В одному з прикладів здійснення спосіб приготування гемцитабін-гідрохлориду по формулі І включає операції, при яких виконують: і. конверсію сполуки по формулі III в сполуку по формулі IV, використовуючи реагенти дециклізації, у присутності відповідного органічного розчинника з подальшою азеотропною дистиляцією; іі. захист оксигруп сполуки по формулі IV, використовуючи відповідні окси-захисні реагенти, у присутності відповідного органічного розчинника при заданій температурі, з метою забезпечення сполуки по формулі VB; ііі. відновлення речовини по формулі VB, використовуючи відповідний відновлюючий реагент, у присутності відповідного органічного розчинника, з метою забезпечення сполуки по формулі VIB; iv, захист сполуки по формулі VIB, використовуючи алкіл-або арил-сульфоніл-хлориди, у присутності відповідної основи і відповідного органічного розчинника, з метою забезпечення сполуки по формулі VIIB; v. конденсацію сполуки по формулі VIIB із сполукою по формулі VIII у присутності відповідного органічного розчинника і відповідних основ, з метою забезпечення сполуки по формулі IX; vi. зняття захисту із сполуки по формулі IX, використовуючи відповідний реагент, з подальшим проведенням реакції з хлористоводородною (соляною) кислотою у присутності відповідного органічного розчинника, з метою забезпечення гемцитабін-гідрохлориду по формулі І. Операція і. включає конверсію сполуки по формулі III в сполуку по формулі IV, використовуючи реагенти дециклізації, у присутності відповідного органічного розчинника з подальшою азеотропною дистиляцією O F O F O HO O Formula III HO O O HO F F Formula IV Прийнятний діапазон температур для проведення цієї реакції складає, приблизно, від 20°С to 70°С. Додатково, реакційна маса піддається азеотропній дистиляції після додавання іодину і спиртового розчину. Дистиляція може проводитися при температурі, приблизно, від 50°С до 150°С. Перелік відповідних розчинників, які можуть бути використані для проведення реакції, включає, але не обмежується такими спиртовими розчинниками, як метанол, етанол, n-пропанол, ізопропанол, n-бутанол і подібні ним речовини; такими вуглеводнями, як n-гексан, циклогексан, n-гептан, толуол, хлоробензол, 1, 2 12 дихлоробензол, ксилоли і інші подібні речовини; Операція іі. включає захист оксигруп сполуки по формулі IV, використовуючи відповідні оксизахисні реагенти, у присутності відповідного органічного розчинника при заданій температурі, з метою забезпечення сполуки по формулі VB. В прикладі здійснення даної корисної моделі із захисною групою, що використовується для захисту оксигрупи сполуки по формулі IV, є третинний бутил-дифенілсиліл-хлорид, що забезпечує сполуку по формулі VB. Si O O O O F F Si Formula VB Перелік відповідних окси-захисних груп, які можуть бути використані в згаданій вище реакції, включає, але не обмежується такими оксизахисними групами, як, силілові окси-захисні групи, наприклад, третинний бутил-дифенілсиліл, триметилсилілхлорид, ізопропілдиметилсілил, метилдиізопропілсиліл, триізопропілсиліл і подібні їм речовини, форміл, 2-хлорацетил, бензил, дифенілметил, трифенілметил, 4-нітробеніл, феноксикарбоніл, t-бутил, метоксиметил, феноксиацетил, изобутирил, зтоксикарбоніл, бензилоксикарбоніл та інші подібні їм речовини. Прийнятними, але не обмежуючими об’єм захисту сновами, які можуть бути використані в даному випадку, є: органічні основи, наприклад, піридин, тризтиламін, імідазол, 2,6-лутидин, 2,3лутидин, 3,5-лутидин і подібні ним речовини. Перелік прийнятних розчинників, які можуть бути використані у вказаній вище реакції, включає але не обмежується такими ефірами, як тетрагідрофуран, 1,4-диоксан, диэтиловий ефір, і 1,2- диметоксиэтан і інші подібні речовини; такими вуглеводнями, як n-гексан, циклогексан, nгептан, толуол, хлоробензол, 1, 2дихлоробензол, ксилолы і інші подібні їм речовини; такими апротонними полярними розчинниками, як N,N-диметил-формамід (DMF), диметилсульфоксид, диметил-ацетамід, ацетонітрил і інші подібні їм речовини; таким кетоном, як ацетон, метил-ізобутил-кетон, метилтерт(третинний)-бутил-кетон і інші подібні їм речовини, або їх сумішами. Прийнятними температурами для проведення даної операції є температури в діапазоні, приблизно, від 5°С до 50°С. Операція ііі забезпечує відновлення речовини по формулі VB з використанням відповідного відновлюючого реагенту у присутності відповідного органічного розчинника, з метою забезпечення сполуки по формулі VIB; 13 Si OH O O F F O Si Formula VIB Відповідними, але не обмежуючими об’єм захисту відновлюючими реагентами, які можуть бути використані в даній операції, є натрій-біс(2метоксизтокси)алюмінійгідрид (вітрид), натрійборогідрид (NaBH4), літійалюмінійгідрид (LiAlH4), диізобутилалюмінійгідрид (DIBAL-H). Перелік прийнятних розчинників, які можуть бути використані у вказаній вище реакції, включає але не обмежується такими спиртами, як метанол, етанол, n-пропанол, ізопропіловий спирт, n-бутанол і іншими подібними речовинами, такими ефірами, як тетрагідрофуран, 1,4-діоксан, діэтиловый ефір, і 1,2- диметоксиэтан і інші подібні речовини; такими вуглеводнями, як n-гексан, циклогексан, n-гептан, толуол, хлоробензол, 1, 2дихлоробензол, ксилолы і інші подібні їм речовини; або їх сумішами. Прийнятними температурами для проведення даної операції є температури в діапазоні, приблизно, від - 50°С до 100°С. Операція iv. забезпечує захист сполуки по формулі VIB, використовуючи алкіл-або арилсульфоніл-хлориди, у присутності відповідної основи і відповідного органічного розчинника, з метою забезпечення сполуки по формулі VIIB; В одному з прикладів здійснення корисної моделі, з метою забезпечення умов для сполуки по формулі VIIB, захисною групою, використовуваною для захисту гідроксильної групи сполуки по формулі VIB, є метан-сульфонілхлорид. Si O O O OMs F F Si Formula VIIB Відповідними, але не обмежуючими об’єм захисту захисними групами, які можуть бути використані для захисту гідроксильної групи, є алкілта-арил-сульфонілхлориды, наприклад, метансульфонілхлорид, бензол-сульфонілхлорид і подібні їм речовини. Перелік прийнятних розчинників, які можуть бути використані у вказаній вище реакції, включає але не обмежується такими ефірами, як тетрагідрофуран, 1,4-диоксан, діэтиловий ефір, і 1,2диметоксиэтан і інші подібні речовини; такими вуглеводнями, як n-гексан, циклогексан, n-гептан, толуол, хлоробензол, 1, 2-дихлоробензол, ксилолы і інші подібні їм речовини; такими апротонними полярними розчинниками, як N,N-диметилформамід (DMF), диметил-сульфоксид, диметилацетамід, ацетонітрил і інші подібні їм речовини; такими складними ефірами, як этилацетат, ізоп 18156 14 ропілацетат і інші подібні їм речовини, таким кетоном, як ацетон, метил-ізобутил-кетон, метилтерт(третинний)-бутил-кетон і інші подібні їм речовини, або їх сумішами. Відповідними температурами для проведення подібної реакції є температури в діапазоні від 0°С до 50°С. Операція v. полягає в здійсненні конденсації сполуки по формулі VIIB із сполукою по формулі VIII у присутності відповідного органічного розчинника і відповідних основ, з метою забезпечення сполуки по формулі IX; O Si N CH3 N Si O N Formula NH VIII O N Si O O O O N F F Si Formula IX Перелік прийнятних розчинників, які можуть бути використані у вказаній вище реакції, включає але не обмежується такими ефірами, як тетрагідрофуран, 1,4-диоксан, дієтиловий ефір, і 1,2диметоксиетан і інші подібні речовини; такими вуглеводнями, як n-гексан, циклогексан, n-гептан, толуол, хлоробензол, 1, 2-дихлоробензол, ксилолы і інші подібні їм речовини; такими складними ефірами, як етилацетат, ізопропілацетат і інші подібні їм речовини, таким кетоном, як ацетон, метил-ізобутил-кетон, метил-терт(третинний)бутил-кетон і інші подібні їм речовини, або їх сумішами. Відповідними, але не обмежуючими об’єм захисту основами, які можуть бути використані для ведення даної операції, є такі органічні основи, як піридин, триетиламін, гексаметилдизилазан, триметилсилілтрифлат і подібні їм речовини. Відповідними температурами для проведення подібної реакції є температури в діапазоні від 20°С до 100°С. Операція vi. включає зняття захисту із сполуки по формулі IX, використовуючи відповідний реагент, з подальшим проведенням реакції з хлористоводородною (соляною) кислотою у присутності відповідного органічного розчинника, з метою забезпечення гемцитабін-гідрохлорида по формулі І. Відповідні реагенти, які можуть бути використані для зняття захисту, вибирають з групи речовин, що включають терт-бутил-амоній, аміак, ацетилхлорид, розбавлення (розчин) хлористоводородної кислоти (соляної кислоти) і подібні їм речовини. Перелік прийнятних розчинників, які можуть бути використані у вказаних вище реакціях, включає але не обмежується таким осаджувачем, 15 18156 16 як вода; такими спиртами, як метанол, етанол, кової дифракції рентгенівського випромінювання этанол-гідрохлорид, n-пропанол, изопропанол, («XRPD»), графіком диференціальної скануючої ізопропіловьій спирт, n-бутанол і інші подібні рекалориметрії («DSC») та/або спектром поглинанчовини; такими галогенізованими розчинниками, ня інфрачервоного випромінювання («IR»). як дихлорометан, дихлороетан, хлороформ і інші, Кристалічний гемцитабін-гідрохлорид, отриподібні їм речовини; такими ефірами, як тетрагідманий відповідно до даної корисної моделі, відрірофуран, 1,4-діоксан, діетиловый ефір, і 1,2зняється своєю власною системою XRPD. Усі диметоксиетан і інші подібні речовини; такими дані XRPD, наведені в даному описі, були одервуглеводнями, як n-гексан, циклогексан, n-гептан, жані, використовуючи Сu Кб - випромінювання з толуол, хлоробензол, 1,2-дихлоробензол, ксилодовжиною хвилі 1,541 А на дифрактометрі, принлы і інші подібні їм речовини; такими апротонницип роботи якого заснований на порошковій дифми полярними розчинниками, як N,N-диметилракції рентгенівського випромінювання [Bruker формамід (DMF), диметил-сульфоксид, диметилAxe D8 Advance Powder X-ray Diffractometer.]. ацетамід, ацетонітрил і інші подібні їм речовини; Кристалічний гемцитабін-гідрохлорид відрізтакими складними ефірами, як этилацетат, ізопняється системою ліній порошкової дифракції ропилацетат і інші подібні їм речовини, таким рентгенівського випромінювання (XRPD) з хараккетоном, як ацетон, метил-ізобутил-кетон, метилтеристичними піками, приблизно в 9,57; 11,35; терт(третинний)-бутил-кетон і інші подібні їм ре13,74; 14,38; 15,29; 19,09; 20,36; 21,15; 22,755; човини, або їх сумішами. 22,98; 23,36; 24,02; 26,58; 27,56; 28,29; 29,19; Як альтернатива, одна або декілька опера30,74; 31,66; 34..45; 35,42; 37,1; 37,96; 41,99; цій, від і) до iv), в технологічному ряді процесу 44,023±0,2 градусів, дві тета. можуть здійснюватися без виділення проміжних Диференціальні скануючі калориметричні досполук. В одному з прикладів здійснення операслідження проводилися на моделі DSC Q1000 ТА цію і) проводять без виділення проміжної сполуприладів з ухилом 5°С/мин., часом модуляції 60 ки, при цьому за даною операцією слідує видісекунд і температурою модуляції ±1°С. Початколення сполуки по формулі VB. ва температура - 0°С, кінцева температура Відповідною температурою для проведення 200°С. реакції є температура в діапазоні, приблизно, від Кристалічний гемцитабін-гідрохлорид має ха-10°С до 70°С. рактеристичну криву диференціальної скануючої Вологий коржик, отриманий на різних стадіях калориметрії яка, в основному, відповідає Фіг.2, обробки, може бути в подальшому висушений. де зображена ендометрична крива при 259Сушку можуть здійснювати в лотковій сушарці, у 274°С. вакуумній печі, повітряної печі, в сушарці з псевІнфрачервоний спектр (IR) гемцитабіндозрідженим шаром, в розпилювальних сушаргідрохлорида був зареєстрований на спектрофоках, в сушарках-випарниках і інших пристроях. тометрі моделі Perkin Elmer System Spectrum, між Сушка може виконуватися при температурі, при450см-1 і 4000см-1, з роздільною спроможністю близно, від 35°С до 70°С. Сушка може виконува4см-1 в гранулі броміду калія, концентрація спотися протягом будь-якого заданого періоду часу в луки, що піддається випробуванню, складає 1% діапазоні від 1 до 20 годин. по масі. Весь процес може бути відображений схеКристалічний гемцитабін-гідрохлорид харакмою IV. теризується інфрачервоним спектром з характеСхема IV ристичними піками, які описані приблизними значеннями 3392, 3259, 3117, 3078, 1679, 1535,1283, HO 1199, 1065, 856, 814±1см-1. O O O O Si O F F O O F Ще в одному прикладі здійснення даної кориO F HO F O F HO сної моделі забезпечується гемцитабінO Si Formula III гідрохлорид, в основному, вільний від залишкоFormula IV Formula VB вих розчинників. Гемцитабін-гідрохлорид, отриманий з використанням даної корисної моделі, має процентний вміст залишкового розчинника в межах міжO OMs Si OH народних норм, визначених Міжнародною O O Si O F F O Конференцією по Гармонізації Технічних Вимог F F O Si до реєстрації фармацевтичних засобів, признаSi чених для лікування людей. Рівень вмісту розO Formula VIIB Si Formula VIB N CH чинників залежить від типу розчинника, але не O NH N перевищує 5000 частинок на 1млн. (ppm) або O N N Si NH .HCl 4000 частин на 1млн. (ppm), або 3000 частин на O Formula VIII O N Si O 1млн. (ppm) N F O F HO Гемцитабін-гідрохлорид, отриманий відповідN O O Si F но до дана корисна модель, містить менше H OH F 100ppm або менше 500ppm ацетону, менше Formula I Formula IX 100ppm або менше 500ppm ізопропола, менше 100ppm або менше 500ppm дихлорометану. Ще один аспект даної корисної моделі забезПевні специфічні аспекти і приклади здійспечує отримання кристалічного гемцитабіннення даної корисної моделі можуть бути більш гідрохлорида, відмінного системою ліній порош3 2 17 18156 18 детально пояснені з посиланнями на наступні гом, приблизно, 5-10 хвилин з подальшим струприклади, які приведені тільки з метою ілюстрації шуванням під тиском. Факт завершення реакції і жодною мірою не обмежують об’єм захисту дана був перевірений, використовуючи тонкошарову корисна модель. хроматографію. Після завершення реакції 200мл Приклад 1. насиченого розчину хлориду амонія додавали до Спосіб приготування 3,5-біс (третичныйотриманої реактивної маси при температурі, прибутил-дифеніл-силілокси)-2-деокси-2, 2-дифтороблизно, -45°С з подальшим розділенням на два 1-оксорибози (формула VB) шари. Отриманий водний шар екстрагували за 100,3г етил 2, 2-дифторо-3-окси-3(2, 2допомогою 3х500мл етилацетату, після чого посдиметилдіоксалан-4-іл) пропіонату по формулі III, лідувала сепарація органічних і водних шарів. 2000мл метанолу і 10,02г лодину були завантаОрганічний шар піддавали повній дистиляції для жені в чисту і суху з круглим дном пробірку з поотримання 103,5г заданої сполуки. дальшим негайним струшуванням протягом 12 Мас: 664,4 (M+NH4) атомних одиниць маси годин. Розчин 22,5г натрий-тіосульфату в 225мл (a.m.u.) і 1Н NMR: 0,9ppm (9Н), 1,1 (9Н), 5.1ppm води був доданий до вказаної вище реактивної (lH) значення. маси при температурі, приблизно, 25-35°С протяПриклад 3 гом, приблизно, 30 хвилин з подальшою дистиСпосіб приготування 3,5-біс (третичныйляцією 1000мл метанолу, узятого з реактивної бутил-дифеніл-силілокси)-1-метан-силокси-2суміші при температурі, приблизно, 80-95°С. Оддеокси-2, 2-дифторорибозы (формула VIIB) ночасно 500мл толуолу завантажували в отрима103г 3,5-біс (третичный-бутил-дифенілну реактивну масу, а 500мл розчинника відділяли силілокси)-2-деокси-2, 2-дифторорибозы (форметодом дистиляції під атмосферним тиском при мула VIB), 1030мл дихлорометану і 55,5мл трие95°С. Вказану вище операцію повторювали 5 тиламину завантажували в пробірку з круглим разів при температурі 120°С і забезпечували вадном в атмосфері азоту при одночасному перекуум від 650 до 750мм для повного видалення мішуванні. Реактивну масу охолоджували до 0толуолу, з метою отримання сполуки 2-деокси-2, 5°С з подальшим додаванням 18,6мл метан2-дифторо-1-оксорибози по формулі IV. сульфоніл-хлориду до згаданої вище маси при Отриманий залишок розчиняли в 1325мл N, 0°С протягом 10 хвилин. Реактивній масі давали N-диметил-формаміду (DMF) в атмосфері азоту можливість нагрітися до температури 25-35°С і при температурі, приблизно, 25-35°С. 80,5г імідаструшували під тиском протягом, приблизно, 3-4 золу і 303мл третинного-бутил-дифеніл-силілгодин до тих пір, поки не був витрачений вихідний хлориду (TBDPSi-Cl) завантажували в отриману матеріал. Факт завершення реакції перевіряли, реактивну суміш при 25-35°С з подальшим невикористовуючи тонкошарову хроматографію. До гайним струшуванням при температурі, приблизотриманої реактивної маси додавали 300мл води но, 25-35°С протягом 12 годин (over night). Факт і виділяли шляхом сепарації два шари з подальзавершення реакції був перевірений, використошим екстрагуванням водяного шара знову до вуючи метод тонкошарової хроматографії, і суміш 300ml дихлорометану. Отримані органічні шари охолоджували, приблизно, до 10-15°С. 2600мл піддавали повній дистиляції у вакуумі, з метою води додавали при температурі 10° при одночасотримання 111,0г заданої сполуки. ному перемішуванні з подальшим екстрагуванМас.: 742,2(M+NH4) атомных одиниць маси ням за допомогою 2х500мл дихлорометану. Ор(a.m.u.) и 1Н NMR: 5,9ppm (1Н), 0,8 (9Н), 1,1ppm ганічні і водні шари розділяли (відділяли один від (9Н), 3,1ppm (3Н) значення. одного), після чого органічний шар промивали Приклад 4 500мл води, а потім органічний шар дистилювали Спосіб приготування [2’-деокси-2’, 2’в умовах вакууму при температурі 50°С. Отримадифторо-3’, 5’-рибофураноза 3,5-біс (третиннийний сировинний матеріал очищали колонковою бутил-дифеніл-силілокси)-N-ацетилцитоцину хроматографією з використанням петролейного (формула IX) ефіру і етил-ацетатных розчинних систем, з ме92,98г N-ацетилцитозина і 1925мл толуолу тою отримання 100г чистої заданої сполуки. завантажували в пробірку з круглим дном в атмоМас.: 662,4(M+NH4) атомних одиниць маси сфері азоту. 204,6мл гексаметил-дизилазана (a.m.u.) і 1Н NMR: 0,8 частинок на млн. (ppm) (HMDS) також додавали у згадану вище пробірку (9H), 1,1 ppm (9H), 4,5 ppm (2H), 3,4 ppm (1H), 3,7 протягом 5 хвилин при 25-35°С з подальшою диppm (9H) значення. стиляцією 20% розчину у вакуумі при температуПриклад 2 рі, приблизно, 65°С, і реактивній масі давали моСпосіб приготування 3,5-біс (третичныйжливість остигнути до температури, приблизно, бутил-дифеніл-силілокси)-2-деокси-2, 250°С. 41мл триметил-силіл-хлориду додавали до дифторорибози (формула VIB) згаданої вище реактивної суміші з подальшим 100г 3,5-біс (третичный-бутил-дифенілпідігрівом реактивної маси, з метою забезпеченсилілокси)-2-деокси-2, 2-дифторо-1-оксорибози ня зворотного стоку, і підтримували реактивну (формула VB) і 1000мл тетрагідрофурану (THF) масу в стані зворотного стоку протягом 2-3 годин були завантажені в пробірку з круглим дном в під тиском. 585мл толуолу шляхом дистиляції атмосфері азоту при температурі, приблизно, 25витягували з реактивної суміші з подальшим до35°С з одночасним перемішуванням. Реактивну даванням 1375мл толуолу, і реактивну масу охосуміш охолоджували до температурі від -45 до лоджували до 25-35 оЗ. 102,3мл триметилсилілт50°С після чого додавали 75,4мл натрій-біс (2рифлата (TMS трифлата) додавали до згаданої метоксиетокси) гідриду алюмінія (вітриду) протявище реактивної маси протягом 5-10 хвилин і 19 18156 20 реактивну масу струшували протягом, приблизно, (qty) і завантажували активоване вугілля, з пода20-30 хвилин. Розчин сполуки, підданої дії метилльшим перемішуванням протягом 30-45 хвилин. сульфонілу (mesylated), по формулі VIIB, в 550мл Отриману реактивну масу фільтрували, а отритолуолу додавали до згаданої вище отриманої маний фільтрат концентрували до мінімальної силілированої реактивної маси при температурі кількості, з метою отримання 700мг заданої спо25-35°С, після чого реактивну масу нагрівали до луки. Чистота по HPLC: 95% чистота по температури утворення зворотного стоку і утрианомеру. мували реактивну масу під тиском протягом 15 Приклад 6 годин. Реактивну масу охолоджували до темпеОчищення гемцитабін-гідрохлориду ратури, приблизно, 25-35°С з одночасним пере6,4л (3 об’єми) демінералізованої води помімішуванням, після чого протягом 10 хвилин до щали в реактор і нагрівали до температури, принеї додавали 40мл метанолу. З отриманої реакблизно, 80-85°С. 6,6кг сировинного гемцитабінтивної маси виділяли методом дистиляції розгідрохлориду, що містить в співвідношенні 1:1 чинник в кількості до 50% від його повного об’єму суміш / - аномерної солі, приготованої HPLC при температурі, приблизно, 50°С в умовах вакуметодом, додавали у вище згаданий реактор при уму з подальшим охолоджуванням реактивної одночасному перемішуванні до утворення прозомаси до 0-5°С протягом 15-20 хвилин. Отримана рого розчину. Реактивний розчин охолоджували, смоляниста реактивна маса була декантована, приблизно, до 20-25°С з подальшою фільтрацією органічний шар був промитий 700мл насиченого відокремленого твердого продукту в атмосфері розчину NaHCO3 і розділеній на два шари. Оргаазоту. Тверду речовину промивали 5л ацетону. нічний шар бло піддано дистиляції в умовах вакуОтриманий твердий продукт висушували метоуму, з метою отримання 134г заданого продукту. дом відсмоктування вологи протягом, приблизно, Приклад 5 1 години під тиском в атмосфері азоту, з метою Спосіб приготування гемцитабін-гідрохлориду отримання 2,7кг гемцитабін-гідрохлориду. по формулі І Чистота по HPLC: 98,1%. 133г 1-[2’-деокси-2’, 2’-дифторо-3’, 5’% -аномера: 1,7%. рибофураноза-3, 5-біс (третинний -бутил Приклад 7 дифеніл-силілокси)-N-ацетилцитоцину по форОчищення гемцитабін-гідрохлориду мулі IX, який був приготований, при здійсненні 860мл очищеної води поміщали в реактор прикладу 4, завантажували в пробірку з круглим разом з 86г сировинного гемцитабіндном в атмосфері азоту. Додавали 7,5 літрів мегідрохлориду, що містить в співвідношенні 1:1 танолу, і реактивний розчин охолоджували до 0суміш / - аномерной солі. Суміш нагрівали до 5°С з подальшим додаванням до реактивного температури, приблизно, 35-40°С при одночасрозчину 1330мл аміаку. Отриманий розчин конному перемішуванні до утворення прозорого розцентрували при 50°С до мінімальної кількості і чину. До реактивної маси додавали 0,1 об’єму реактивну масу екстрагували за допомогою 12 активованого вугілля при 35-40°С з перемішуванлітрів этилацетата з подальшою концентрацією ням протягом, приблизно, 30 хвилин. Реактивну органічного шара при 50°С. 1180мл тетрагідромасу фільтрували через Hyflow з подальшою фурану (THF) і 79,8мл TBAF (гетра nпромивкою 3х30мл демінералізованої води при бутиламмонійфториду) вводили у вказану вище кімнатній температурі. Отриманий фільтрат конотриману реактивну масу при 25-30 С і переміцентрували до 3 об’ємів реактивної маси при 45шували протягом, приблизно, 1 години. Факт за50°С у вакуумі 600мм ртутного стовпа, після чого вершення реакції перевіряли, використовуючи охолоджували до 15-20°С з одночасним струшуметод тонкошарової хроматографії, після чого ванням/перемішуванням протягом 30 хвилин при реактивну масу концентрували у вакуумі при тетемпературі 15-20°С. Реактивну масу фільтрувампературі 50°С. До отриманої реактивної маси ли з подальшою промивкою 50мл ацетону при додавали демінералізовану воду, після чого вод15-20°С і висушували методом відсмоктування ний шар промивали дихлорометаном. вологи протягом 30 хвилин. Отриману тверду Отриманий водяний шар концентрували при масу висушували при температурі 35-40°С протятемпературі 55°С, з метою отримання 72% гом, приблизно, 4 годин у вакуумі 600-620мм ртуаномера і 24% -аномера. 190мл ізопропілового тного стовпа, з метою отримання 31г гемцитабінспирту додавали до отриманої сировинної маси, гідрохлориду. після чого реактивну масу нагрівали до 60°С і Чистота по HPLC: 95,6% додавали 25мл концентрованої соляної кислоти. % -аномера - 6,8%. Отриману реактивну масу охолоджували до 10Приклад 8 15°С і перемішували, приблизно, протягом 3 гоОчищення гемцитабін-гідрохлориду дин при 10°С. Отриманий твердий продукт філь342мл (12 об’ємів) очищеної води поміщали в трували, з ціллю отримання 69,9% -аномера and реактор разом з 28,5г гемцитабін-гідрохлориду, 28,48% -аномера, а отриманий фільтрат концещо має чистоту 95,6%, і нагрівали до температури 35-40°С при одночасному струшуваннтрували при 45 З. До отриманого сировинного ні/перемішуванні до формування прозорого розфільтрату додавали ацетон і перемішували прочину. 0,1 об’єму активованого вугілля додавали тягом однієї ночі. Отриманий твердий продукт до реактивної суміші при температурі 35-40°С з фільтрували, з ціллю отримання 2% -аномера і перемішуванням протягом 30 хвилин. Реактивну 71% -аномера. Отриманий твердий продукт розмасу фільтрували через Hyflow з подальшою чиняли (розбавляли) у деміниралізованій воді промивкою 3х25мл демінералізованої води при 21 18156 22 кімнатній температурі. Отриманий фільтрат конзно, 4 годин у вакуумі 600-620мм ртутного стовпа, центрували до 2 об’ємів реактивної маси при 45з метою отримання 24г гемцитабін-гідрохлориду. 50°С у вакуумі 600-620мм ртутного стовпа, після Чистота по HPLC: 99,96%. чого охолоджували до 25-30°С. Реактивну масу % -аномера – 0,01%. фільтрували з подальшою промивкою 31мл ацеОбертання площини поляризації світла: [ ]D20 тону при 25-30°С. Описаний процес повторювали (10мг/мл водного розчину): +47,1°. ще раз і під кінець отриману тверду масу висушували при температурі 35-40°С протягом, прибли Комп’ютерна верстка В. Мацело Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for the preparation and purification of hemcytabin-hydrochloride
Автори англійськоюRaju P.V.
Назва патенту російськоюСпособ приготовления и очистки гемцитабин-гидрохлорида
Автори російськоюРаджу П. В.
МПК / Мітки
МПК: C07H 19/06, C07H 19/16, A61P 31/12, A61K 31/17
Мітки: очищення, гемцитабін-гідрохлориду, приготування, спосіб
Код посилання
<a href="https://ua.patents.su/11-18156-sposib-prigotuvannya-i-ochishhennya-gemcitabin-gidrokhloridu.html" target="_blank" rel="follow" title="База патентів України">Спосіб приготування і очищення гемцитабін-гідрохлориду</a>
Попередній патент: Димовий пожежний сповіщувач
Наступний патент: Товстоплівковий резистивний елемент
Випадковий патент: Спосіб застосування композиційних мікроелементних препаратів












