Пероральна лікарська форма, яка містить розиглітазон та метформін
Номер патенту: 82537
Опубліковано: 25.04.2008
Автори: Коулз Пітер Джон, Мадд Пол Норман, мол., Маккензі Дональд Колін
Формула / Реферат
1. Пероральна лікарська форма, яка має ядро, що піддається ерозії, яке містить 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діон або його фармацевтично прийнятну сіль чи сольват та метформін або його фармацевтично прийнятну сіль чи сольват, причому ядро має непроникне покриття з одним або декількома отворами, що ведуть до ядра, яка відрізняється тим, що покриття є таким, що піддається ерозії при рН від 4,5 до 8.
2. Пероральна лікарська форма за п. 1, яка має:
(і) ядро, що піддається ерозії, причому ядро містить 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діон або його фармацевтично прийнятну сіль чи сольват та метформін або його фармацевтично прийнятну сіль чи сольват, та
(іі) покриття, що піддається ерозії, навколо вказаного ядра, причому покриття містить один або декілька отворів, що проходять по суті повністю крізь указане покриття, але по суті не проникають у вказане ядро і забезпечують сполучення між середовищем застосування і вказаним ядром;
яка відрізняється тим, що вивільнення 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону або його фармацевтично прийнятної солі чи сольвату та метформіну або його фармацевтично прийнятної солі чи сольвату з ядра, що піддається ерозії, відбувається по суті крізь указаний отвір (отвори) і шляхом ерозії вказаного покриття, що піддається ерозії, при рН від 4,5 до 8.
3. Пероральна лікарська форма за п. 1, яка відрізняється тим, що покриття, що піддається ерозії, складене для забезпечення негайного вивільнення 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону або його фармацевтично прийнятної солі чи сольвату й метформіну або його фармацевтично прийнятної солі чи сольвату.
4. Пероральна лікарська форма за будь-яким із попередніх пунктів, яка відрізняється тим, що вказана лікарська форма має форму таблетки.
5. Спосіб одержання пероральної лікарської форми за п. 1, який включає:
(а) одержання ядра таблетки, що піддається ерозії, яке містить 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діон або його фармацевтично прийнятну сіль чи сольват та метформін або його фармацевтично прийнятну сіль чи сольват;
(b) покриття ядра непроникним матеріалом, що має здатність до ерозії, залежну від рН; і
(c) створення одного або декількох отворів у покритті.
Текст
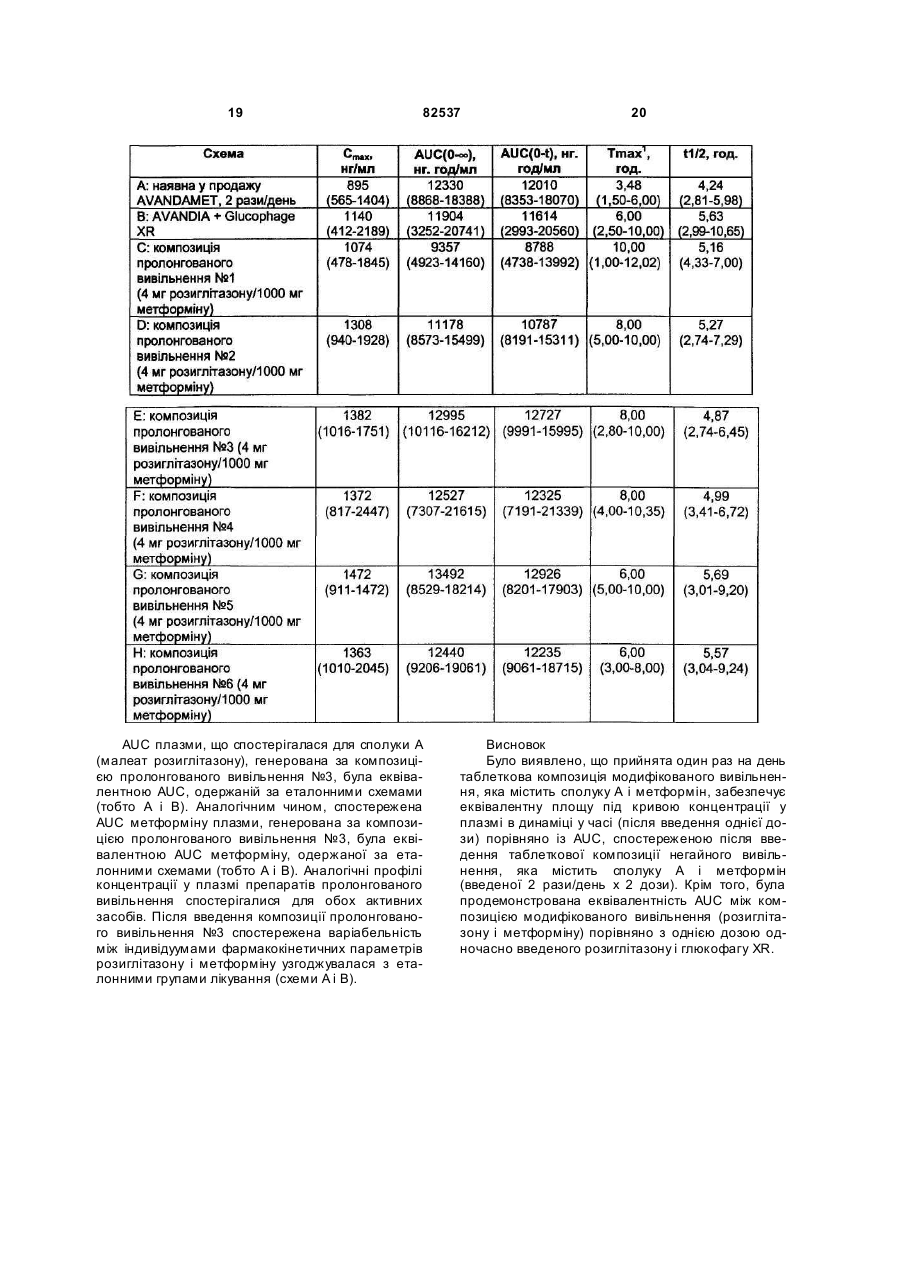
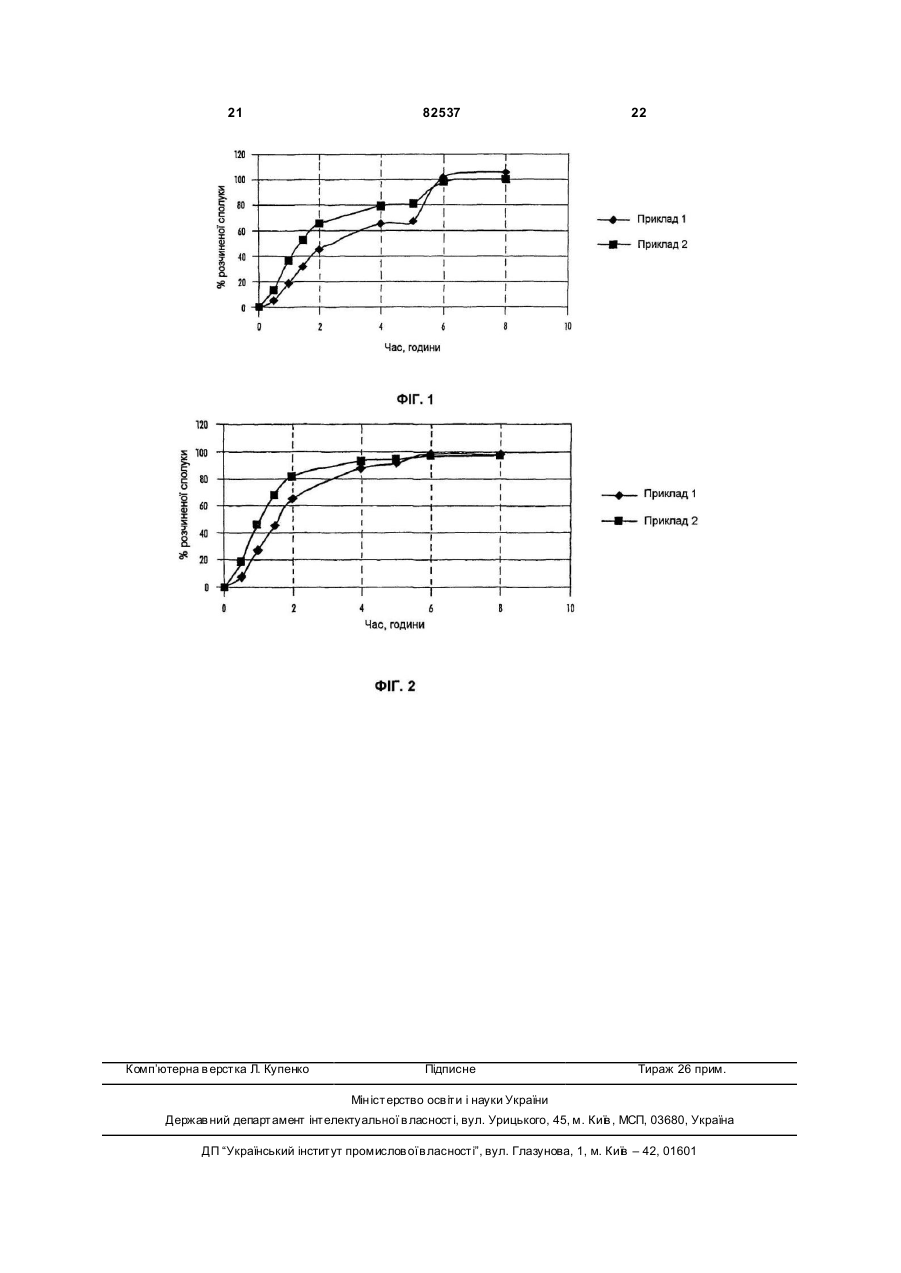
1. Пероральна лікарська форма, яка має ядро, що піддається ерозії, яке містить 5-[4-[2-(N-метилN-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4діон або його фармацевтично прийнятну сіль чи сольват та метформін або його фармацевтично прийнятну сіль чи сольват, причому ядро має непроникне покриття з одним або декількома отворами, що ведуть до ядра, яка відрізняється тим, що покриття є таким, що піддається ерозії при рН від 4,5 до 8. 2. Пероральна лікарська форма за п. 1, яка має: (і) ядро, що піддається ерозії, причому ядро містить 5-[4-[2-(N-метил-N-(2піридил)аміно)етокси]бензил]тіазолідин-2,4-діон або його фармацевтично прийнятну сіль чи сольват та метформін або його фармацевтично прийнятну сіль чи сольват, та (іі) покриття, що піддається ерозії, навколо вказаного ядра, причому покриття містить один або декілька отворів, що проходять по суті повністю крізь указане покриття, але по суті не проникають у вка C2 2 UA 1 3 82537 патентній заявці № WO 01/05430 описаний пристрій доставки лікарського засобу, який забезпечує можливість доставки лікарських речовин, які виявляють рН-залежну розчинність, зокрема, сполук, які є більш розчинними при низьких рівнях рН (менше ніж рН 2), ніж при рН, близькому до нейтрального рівня (більше ніж приблизно 5). Такі пристрої доставки відрізняються присутністю покриття, яке є непроникним і нерозчинним у рідині середовища застосування. У публікації міжнародної патентної заявки № WO 95/30422 описана низка лікарських форм азитроміцину контрольованого вивільнення. Зокрема, описана низка лікарських форм, які знижують вплив на верхні відділи шлунково-кишкового тракту (наприклад, шлунку) високих концентрацій азитроміцину використанням покриття, залежного від рН. Такі лікарські форми не відрізняються наявністю отворів, крізь які може відбуватись вивільнення лікарської речовини. У патенті США №6099859 описана таблетка контрольованого вивільнення для доставки антигіперглікемічного препарату, яка має осмотично активне ядро, що містить препарат, і напівпроникну мембрану, причому напівпроникна мембрана є проникною для проходження води і біологічних рідин і є непроникною для проходження лікарської речовини. Напівпроникна мембрана містить принаймні один канал для вивільнення антигіперглікемічного препарату. У патенті США №5543155 описана дифузійноосмотична фармацевтична композиція з контрольованим вивільненням лікарського препарату, яка має одно- або двошарове ядро таблетки, що містить гідроксипропіл метил целюлозу, причому вказане ядро має плівкове покриття, що містить співполімер метакрилату амонію. Додаткові пристрої, які використовують покриття для регулювання швидкості вивільнення активного засобу, обговорено у патенті США №5004614. У цьому патенті описане ядро таблетки, забезпечене зовнішнім покриттям, яке по суті є непроникним для рідини середовища. Вказане зовнішнє покриття можна одержати з матеріалів, які є або нерозчинними або розчинними у рідинах середовища. Коли використовують розчинний матеріал, покриття має достатню товщину для того, щоб ядро не контактувало з рідинами середовища до того, як не пройде період бажаного контрольованого вивільнення активного засобу. Крізь це непроникне зовнішнє покриття було створено один або декілька отворів з тим, щоб забезпечити шлях доступ у рідин середовища до ядра. Тому після прийому всередину покритої таблетки шлунковокишкова рідина може увійти в отвори і вступити в контакт або проникнути у ядро для вивільнення активного засобу. Результат полягає в тому, що активний засіб вивільнюється контрольованим чином тільки з отвору (отворів). Краща геометрія є такою, що є кільцевий отвір на верхній і нижній поверхнях покритої таблетки. Отвір (отвори), що розглядається, має площу від приблизно 10 до 60% лицьової поверхні покритої таблетки. Виявлено, що швидкість вивільнення препарату прямо залежить від діаметру отвору (отворів) і від роз 4 чинності матричного ядра й активного засобу, забезпечуючи можливість різноманітних профілів вивільнення препарату, незалежно від того, чи є воно вивільненням нульового порядку або вивільненням першого порядку. По суті непроникні покриття за патентом США №5004614 не підходять для контрольованого вивільнення активних засобів, особливо фармацевтично активних слабких основ або їх фармацевтично прийнятних солей і сольватів. Такі активні засоби виявляють виражену розчинність, залежну від рН, тобто вони є більш розчинними при рН біля 2, пов'язаному з ділянками, що їх виявляють у шлунку, порівняно з їхньою розчинністю у загалом нейтральних умовах тонкої кишки, біля рН7. У публікації міжнародної патентної заявки № WO 03/068195 описана пероральна лікарська форма, яка має ядро, що піддається ерозії, яке містить фармацевтично активну слабку основу або її фармацевтично прийнятну сіль чи сольват, таку як сполука А, причому ядро має покриття з одним або декількома отворами, що ведуть до ядра, і покриття є таким, що піддається ерозії у заданих умовах рН. Це забезпечує сприятливий засіб для введення фармацевтично активної слабкої основи або її фармацевтично прийнятної солі чи сольвату, такої як сполука А, коли бажано, щоб вивільнення активної сполуки відбувалося у середовищі з рН, що має більше одного значення, на підставі даних про те, що сприятливим є також те, щоб покриття було таким, що піддається ерозії, або розчинним рН-залежним чином. Авторами цього винаходу виявлено, що пероральну лікарську форму, описану у міжнародній патентній заявці № WO 03/068195, можна успішно використовува ти як платформу для доставляння декількох активних речовин, таких як, наприклад, сполука А або її фармацевтично прийнятна сіль чи сольват та інший протидіабетичний засіб. Для цього вказана пероральна лікарська форма забезпечує сприятливий засіб для доставляння іншого протидіабетичного засобу, де протидіабетичний засіб має вузьке вікно усмоктування. Європейська патентна заявка, публікація №0 306 228 А1, відноситься до певних похідних тіазолідиндіону, розкритих як такі, що мають антигіперглікемічну та гіполіпідемічну активність. Одним конкретним тіазолідиндіоном, розкритим у ЕР 0 306 228 А1, є сполука А. В міжнародній патентній заявці, публікація № WO 94/05659, розкриті певні солі сполуки А, у тому числі малеат, у її прикладі 1. Сполуку А або її фармацевтично прийнятну сіль чи її фармацевтично прийнятний сольват можна одержати, використовуючи відомі способи, наприклад, способи, розкриті у ЕР 0 306 228 і WO 94/05659. Розкриття у ЕР 0 306 228 і WO 94/05659 включені до цього опису як посилання. Сполука А являє собою фармацевтично прийнятну слабку основу. Сполука А або її фармацевтично прийнятні солі чи сольвати мають корисні фармацевтичні властивості. Зокрема, вказано, що сполуку А або її фармацевтично прийнятну сіль чи сольват можна застосовувати для лікування та/або профілактики цукрового діабету, станів, пов'язаних із цукровим 5 82537 діабетом, і його певних ускладнень, метаболічного синдрому, порушеної стійкості до глюкози і порушеного рівня глюкози натщесерце. У міжнародній патентній заявці, публікація № WO 01/35941, описані певні композиції з фіксованою дозою, які містять тіазолідиндіон, такі як сполука А або її фармацевтично прийнятна похідна, та інший протидіабетичний засіб, такий як гідрохлорид метформіну. В Європейській патентній заявці №0861666 описані фармацевтичні композиції, які містять сенсибілізатори до інсуліну, такі як піоглітазон або сполука А, і метформін. У міжнародній патентній заявці, публікація № WO 00/28989, описані різноманітні фармацевтичні композиції модифікованого вивільнення, які містять сполуку А або її фармацевтично прийнятну сіль чи сольват та інший протидіабетичний засіб. У заявці на патент США, публікація № US 2003/0187074, описана пероральна система доставляння, що містить бігуанід, такий як гідрохлорид метформіну, яка забезпечує контрольоване вивільнення бігуаніду незалежно від рН середовища. У патентах США №№6475521 і 6660300 описані системи доставляння контрольованого вивільнення для фармацевтичних засобів, що мають високу розчинність у воді, таких як гідрохлорид метформіну. Відомо, що сполука А і її фармацевтично прийнятні солі чи сольвати, зокрема малеат, виявляють виражену розчинність, залежну від рН, тобто вони є більш розчинними у кислотних умовах шлунку (рН біля 2), ніж у майже нейтральних умовах нижніх відділів кишечнику (рН біля 7). Відомо, що певні протидіабетичні засоби, такі як метформін, мають вузьке вікно усмоктування. Тому краще, щоб такі засоби доставлялись по суті виключно у певне фармакологічне середовище, таке як шлунок. Таким чином, задачею цього винаходу є забезпечення пероральної лікарської форми, яка компенсує рН-залежну розчинність сполуки А або її фармацевтично прийнятної солі чи сольвату і яка компенсує вузьке вікно усмоктування певних інших протидіабетичних засобів, таких як метформін, забезпеченням доставляння іншого протидіабетичного засобу по суті виключно у певному фармакологічному середовищі, такому як шлунок. Указано, що така лікарська форма забезпечує сприятливу дію на глікемічний контроль впродовж тривалого періоду часу. Вважається також, що така лікарська форма підходить для введення 1 раз/день. Відповідно, у найширшому аспекті цей винахід забезпечує пероральну лікарську форму, яка має ядро, що піддається ерозії, причому ядро містить сполуку А або її фармацевтично прийнятну сіль чи сольват та інший протидіабетичний засіб, причому ядро має покриття з одним або декількома отворами, яка відрізняється тим, що покриття є таким, що піддається ерозії у заданих умовах рН. Цей винахід, крім того, забезпечує пероральну лікарську форму, яка має: 6 (і) ядро, що піддається ерозії, причому ядро містить сполуку А або її фармацевтично прийнятну сіль чи сольват та інший протидіабетичний засіб; і (іі) покриття, що піддається ерозії, навколо вказаного ядра, причому покриття має один або декілька отворів, що проходять по суті повністю крізь вказане покриття, але по суті не проникають у вказане ядро і забезпечують сполучення між середовищем застосування і вказаним ядром; яка відрізняється тим, що вивільнення сполуки А або її фармацевтично прийнятної солі чи сольвату та іншого протидіабетичного засобу з ядра, що піддається ерозії, відбувається по суті крізь вказаний отвір (отвори) і шляхом ерозії вказаного покриття, що піддається ерозії, у заданих умовах рН. Лікарська форма може являти собою таблетку. Наведені вище посилання на ядро, яке є таким, що піддається ерозії, передбачають ситуацію, коли ядро руйнується частково чи повністю або розчиняється або стає пористим після контакту з рідиною середовища з тим, щоб забезпечити можливість контакту рідини з активним засобом. Ядро може руйнуватись частково. Ядро може руйнуватись повністю. Ядро може розчинятись. Ядро може ставати пористим. Хоча цей винахід забезпечує те, що ерозія покриття є залежною від рН, ядро може вивільнювати сполуку А або її фармацевтично прийнятну сіль чи сольват та інший протидіабетичний засіб ерозією рН-незалежним чином. Однак, для задоволення особливої потреби ядро може являти собою матеріал, який забезпечує можливість рНзалежної ерозії або руйнування ядра для вивільнення сполуки А або її фармацевтично прийнятної солі чи сольвату та іншого протидіабетичного засобу з матриці. В одному варіанті здійснення ядро складене так, щоб бути таким, що піддається ерозії, по суті однаковою мірою і у шлунку, і у кишечнику. Ядро, що піддається ерозії, може бути складене для забезпечення негайного або модифікованого вивільнення принаймні одного зі сполуки А або її фармацевтично прийнятної солі чи сольвату або іншого протидіабетичного засобу. Ядро може бути складене для забезпечення негайного вивільнення і сполуки А або її фармацевтично прийнятної солі чи сольвату, і іншого протидіабетичного засобу. Альтернативно, ядро складене для забезпечення модифікованого вивільнення і сполуки А або її фармацевтично прийнятної солі чи сольвату, й іншого протидіабетичного засобу. Придатними матеріалами для ядра є поліметилметакрилатні смоли, що еродуються, такі як серія Eudragit™, наприклад Eudragit™ L30D, сахарози, наприклад лактоза і мальтоза, і складні ефіри целюлози, наприклад метилцелюлоза, гідроксипропілметилцелюлоза (НРМС) і гідроксипропілцелюлоза, стеарат магнію, гліколяткрохмаль натрію і повідон (полівінілпіролідон). Ядро може являти собою переважно мікрокристалічну целюлозу, гідроксипропілметилцелюлозу, лактозу і повідон. Ще краще, щоб ядро складалось по суті з гідроксипропілметилцелюлози, лактози, 7 82537 мікрокристалічної целюлози, гліколят-крохмалю натрію, повідону і стеарату магнію. Наведене вище посилання на покриття, яке є таким, що піддається ерозії, передбачає ситуацію, коли покриття руйнується частково або повністю, або розчиняється, або стає пористим після контакту з рідиною середовища з тим, щоб забезпечити можливість рідини контактувати з ядром. Покриття може руйнуватись частково. Покриття може руйнуватись повністю. Покриття може розчинятись. Покриття може ставати пористим. Краще, покриття, що піддається ерозії, являє собою ентеросолюбільне покриття, тобто воно має визначений, заданий поріг рН, при якому воно розчиняється. Краще, покриття еродує при рН більше ніж 4,5. Ще краще, покриття еродує при діапазоні рН від 4,5 до 8. Найкраще, покриття еродує при діапазоні рН від 5 до 7. Краще, ентеросолюбільне покриття є непроникним. Було виявлено, що застосування покриття, яке швидко піддається ерозії після виходу зі шлункового середовища, є особливо сприятливим, коли інший протидіабетичний засіб, такий як метформін, має вузьке вікно усмоктування. За таких обставин будь-який активний засіб, який не вивільнюється у шлунку, швидко подається після входження у тонку кишку, зводячи до мінімуму, таким чином, будь-яку втрату усмоктування, пов'язану з доставлянням нижче по шлунковокишковому тракту. Матеріалами та їхніми сумішами, придатними для використання як рН-залежного покривального матеріалу, що піддається ерозії, у цьому винаході є різні полімери поліметакрилату, спільно перероблений полівінілацетатфталат, ацетаттримелітат целюлози, ацетатфталат целюлози, шелак, полімери фталат гідроксипропілметилцелюлози та їхні співполімери. Покривальний матеріал може бути вибраний з ацетату тримелітату целюлози (CAT), фталату полівінілацетату, фталату гідроксипропілметилцелюлози 50, фталату гідроксипропілметилцелюлози 55, Acryl-eze™, Aquateric™, ацетатфталату целюлози, Eudragit™ LD30 D, Eudragit™ L, Eudragit™ S і шелак. Краще за все, матеріалом покриття є Eudragit™ LD30 Da необхідності, покриття, що піддається ерозії, може бути модифіковане додаванням пластифікаторів або засобів проти злипання. Придатними матеріалами для цієї мети є воскоподібні матеріали, такі як гліцериди, наприклад, моностеарат гліцерилу. Типові розміри для отвору (отворів), що має круглу форму, який має бути сформований у покритті, перебувають у діапазоні діаметра від 0,5мм до 8мм, наприклад, він має діаметр 1, 2, 3, 4, 5 або 6мм залежно від загального розміру таблетки і бажаної швидкості вивільнення. Отвір (отвори) може мати будь-яку придатну геометричну форму, але у цілому кращою є округлена форма, наприклад, по суті кругла або еліптична. Можуть бути також сформовані більш складні форми, такі як символи у вигляді літер або графічних зображень, за умови, що в окремих лікарських формах можна забезпечити рівномірну швидкість вивільнення. Типові розміри не кругли х отворів дорівнюють за площею вказаним вище розмірам для круглих 8 отворів, і, таким чином, перебувають у діапазоні від приблизно 0,19 до приблизно 50,3мм 2. Для цілей цього винаходу термін "отвір" є синонімічним до дірки, щілини, проходу, каналу, випуску тощо. Отвір (отвори) може бути сформований способом, описаним у патенті США №5004614. Звичайно отвір (отвори) може бути сформований свердлінням, наприклад, із використанням бурів механічної дрилі або лазерних променів або пробійниками, які видаляють відсічену ділянку. Формування отвору (отворів) може за умовчанням видаляти невелику частину відкритого ядра. Можна також цілеспрямовано сформувати порожнину нижче отвору як пристрою, що регулює швидкість вивільнення, причому порожнина оголює велику вихідну площу поверхні, ніж плоска площа. Отвір (отвори) може проходити крізь усе покриття, що піддається ерозії, так, щоб був негайний контакт ядра з рідиною середовища, коли пристрій кладуть у бажане середовище застосування. Можна також формувати отвір (отвори) in situ, коли введена лікарська форма, формуванням покриття, яке містить пороутворювальні засоби, тобто матеріал, який розчиниться у шлунку для створення пор у покритті. Відповідно, забезпечується також пероральна лікарська форма, яка має: (і) ядро, що піддається ерозії, причому ядро містить сполуку А або її фармацевтично прийнятну сіль чи сольват та інший протидіабетичний засіб; і (іі) покриття, що піддається ерозії, яке оточує вказане ядро, причому покриття містить пороутворювальний засіб, який є таким, що піддається ерозії, у діапазоні рН від 1 до 3, для формування одного або декількох отворів, що проходять по суті повністю крізь вказане покриття, але по суті не проникають у вказане ядро, і є такими, що забезпечують сполучання між середовищем застосування і вказаним ядром; де вивільнення сполуки А або її фармацевтично прийнятної солі чи сольвату та іншого протидіабетичного засобу з лікарської форми відбувається крізь вказаний отвір (отвори) ерозією вказаного ядра, що піддається ерозії, і шляхом ерозії вказаного покриття, що піддається ерозії, у заданих умовах рН. У патенті США № 5004614 отвір (отвори) краще складає приблизно 10-60% загальної лицьової поверхні таблетки, тобто верхньої і нижньої поверхонь двовипуклої таблетки. У цьому винаході отвір (отвори) може складати від 0,25 до 50%, наприклад, 10-70% загальної лицьової поверхні. Альтернативно, може бути корисним охарактеризувати ефект, що контролює швидкість, отвору (отворів) зазначенням площі отвору (отворів) відносно загальної площі поверхні покритої таблетки. Крім того, особливо у випадках, коли ядро піддається ерозії підрізанням країв отвору (отворів), ефект, що контролює швидкість, може бути пов'язаний із загальною окружністю отвору (отворів). Несподіваною знахідкою є те, що 2 отвори, наприклад по одному на кожній первинній поверхні двовипуклої таблетки, вивільнюють активний засіб з ядра зі швидкістю, гранично більшою, ніж швид 9 82537 кість вивільнення з одного отвору такої самої загальної площі. Зазначено також, що варіабельність швидкості вивільнення з двох отворів є меншою, ніж варіабельність швидкості вивільнення з відповідного одного отвору. Відповідно, в одному варіанті здійснення винаходу покриття ядра оснащене двома або більше отворами. Краще, покриття, що піддається ерозії, яке оточує ядро, має два отвори, що проходять по суті повністю крізь вказане покриття, але по суті не проникаючи у вказане ядро і забезпечуючи сполучення між середовищем застосування і вказаним ядром. Коли є більше одного отвору, отвори можуть бути розташовані на одній і тій самій поверхні пероральної лікарської форми або на різних поверхнях. Пероральна лікарська форма може мати 2 отвори, по одному на кожній протилежній поверхні. Пероральна лікарська форма може являти собою таблетку, яка має 2 протилежні первинні поверхні, причому кожна поверхня має один отвір, що проходить крізь покриття. Як захист для матеріалу ядра для запобігання забруднення крізь отвір (отвори) перед введенням може бути бажаним забезпечення звичайного герметизувального покриття або для ядра, або для лікарської форми після формування отвору (отворів). Герметизувальне покриття може бути під покриттям, що піддається ерозії, або на покритті, що піддається ерозії. Коли пероральна лікарська форма містить протидіабетичний засіб, який, як відомо, має вузьке вікно усмоктування, такий як метформін, лікарська форма краще складена для забезпечення доставляння протидіабетичного засобу по суті виключно у визначене фармакологічне середовище, таке як шлунок. Коли потрібне по суті виключне доставляння іншого протидіабетичного засобу у шлунок, пероральна лікарська форма може складатись для перебування у шлунковому середовищі впродовж тривалого періоду часу. Збільшені періоди часу утримування у шлунку можуть бути досягнуті, наприклад, збільшенням розміру лікарської форми та/або введенням лікарської форми з їжею. Згідно зі ще одним аспектом цього винаходу забезпечено спосіб одержання пероральної лікарської форми відповідно до цього винаходу, причому спосіб вміщує в себе: (a) одержання ядра, що піддається ерозії, таблетки, яке містить сполуку А або її фармацевтично прийнятну сіль чи сольват та інший протидіабетичний засіб; (b) покриття ядра матеріалом, що має здатність до рН-залежної ерозії; і (c) створення одного або декількох отворів у покритті. Згідно зі ще одним аспектом цього винаходу забезпечено спосіб одержання пероральної лікарської форми відповідно до цього винаходу, причому спосіб вміщує в себе: (a) одержання ядра, що піддається ерозії, таблетки, яке містить сполуку А або її фармацевтично прийнятну сіль або сольват та інший протидіабетичний засіб; 10 (b) покриття ядра матеріалом, що має здатність до рН-залежної ерозії; і (c) створення одного або декількох отворів у покритті, причому вказаний отвір (отвори) проходить по суті повністю крізь вказане покриття, але по суті не проникає у вказане ядро і забезпечує сполучення між середовищем застосування і вказаним ядром. Ядро можна одержати пресуванням придатних інгредієнтів для формування ущільненої маси, яка містить ядро лікарської форми (яке також іменується у цьому описі "ядром таблетки"). її можна одержати, використовуючи звичайні таблеткові ексципієнти і способи пресування композицій. Так, ядро звичайно містить активні речовини поряд із ексципієнтами, які надають задовільних характеристик переробки та пресування, такими як розріджувачі, в'язівні речовини і мастильні речовини. Додаткові ексципієнти, які можуть формувати частину ядра пристрою, містять у собі розпушувачі, ароматизатори, барвники, засоби, що модифікують вивільнення та/або солюбілізуючі речовини, такі як поверхнево-активні речовини, модифікатори рН і носії утворення комплексів. Звичайно активні речовини та ексципієнти ретельно змішують перед пресуванням у тверде ядро. Ядро пристрою може бути сформоване способами вологого гранулювання, способами сухого гранулювання або прямим пресуванням. Ядро можна одержати відповідно до будь-якої бажаної попередньо вибраної форми, такої як двовипукла, напівсферична, майже напівсферична, кругла, овальна, у цілому еліпсоїдна, продовгувата, у цілому циліндрична або багатогранна, наприклад, форма трикутної призми. Термін "майже напівсферична" призначений для тлумачення відповідно до того, як описано у патенті США №5004614. Ядру може надаватися двовипукла форма, наприклад така, що має дві куполоподібні протилежні поверхні. Крім того, ядро може бути виготовлене у вигляді багатошарової (наприклад, дво- або тришарової) конструкції. Наприклад, ядро може бути складене у вигляді двошарової конструкції, в якій один шар містить сполуку А або її фармацевтично прийнятну сіль чи сольват, а інший шар містить інший протидіабетичний засіб. Ядро може бути покрите придатним матеріалом, що піддається ерозії залежно від рН, будьяким фармацевтично прийнятним способом покриття. До прикладів відносяться способи покриття, описані у патенті США №5004614, і плівкове покриття, цукрове покриття, покриття напилюванням, покриття зануренням, покриття пресуванням, електростатичне покриття. До типових способів відносяться напилювання покриття на таблетку у пристрої для покриття у вигляді чана, що обертається, або у пристрої для покриття у псевдозрідженому шарі до тих пір, доки не буде досягнута бажана товщина покриття. Покриття може бути забезпечене для додавання приблизно 4-8мг/см 2 або 5-7мг/см 2 сухо го полімеру навколо площі поверхні таблетки. Звичайно це призводить до збільшення маси (відносно ядра) від 3 до 10мас. % або від 5 до 10мас. %. Покриття може мати товщину у діапазоні від 0,05 до 0,5мм. 11 82537 Використаний у цьому описі термін "модифіковане вивільнення" означає композицію, яка була призначена для створення бажаного фармакокінетичного профілю вибором складу. Модифіковане вивільнення також містить композиції модифікованого вивільнення у комбінації з композиціями не модифікованого вивільнення. Наприклад, термін "модифіковане вивільнення" являє собою відстрочене, пульсуюче і тривале вивільнення або окремо, або у будь-якій комбінації. В одному аспекті композиція модифікованого вивільнення забезпечує відстрочене вивільнення принаймні одного зі сполуки А або її фармацевтично прийнятної солі чи сольвату та іншого протидіабетичного засобу. Відстрочене вивільнення може бути одержане використанням композиції, стійкої до шлункового середовища, такої як ентеросолюбільна композиція. Така ентеросолюбільна композиція може містити матеріал з безлічі часток, такий як сфери, які складаються з безлічі часток, покриті полімером, стійким до шлункового середовища. Придатними полімерами, стійкими до шлункового середовища, є полімери, одержані з метакрилатів, ацетатфталату целюлози, ацетатфталату полівінілу і фталату гідроксипропілметилцелюлози. Прикладами таких полімерів є Eudragit L100-55™ (полі(метакрилова кислота, етилакрилат) 1:1), наприклад Eudragit L30D-55™ або Eudragit FS 30D™, Aquateric™ (ацетатфталат целюлози), Sureteric™ (ацетатфталат полівінілу), HPMCP-HP-55S™ (фталат гідроксипропілметилцелюлози). Речовинами у вигляді безлічі часток є покриті лікарським препаратом кулькові субстрати, такі як сфери лактози, або кулькові субстрати, що містять лікарський препарат, такі як сфери лактози, що містять лікарський препарат. Такі речовини у вигляді безлічі часток покриті за необхідності відповідною ентеросолюбільною композицією, наприклад поліметакрилатним полімером. Прикладом придатного поліметакрилатного полімеру є Eudragit L100-55™ (полі(метакрилова кислота, етилакрилат) 1:1), наприклад Eudragit L30D-55™ або Eudragit FS 30D™. У ще одному аспекті композиція модифікованого вивільнення забезпечує пролонговане вивільнення принаймні одного зі сполуки А або її фармацевтично прийнятної солі чи сольвату та іншого протидіабетичного засобу, наприклад, забезпечуючи вивільнення активної речовини (речовин) впродовж періоду часу до 26год.; можливо, в діапазоні від 4 до 24год.; краще, у діапазоні від 12 до 24год. Пролонговане вивільнення звичайно забезпечується використанням матриці пролонгованого вивільнення, звичайно у формі таблетки, такої як матриці, що руйнуються, не руйнуються або піддаються ерозії. Пролонговане вивільнення може бути одержане використанням таблеткової матриці, що не руйнується. Придатні композиції з таблетковою матрицею, що не руйнується, забезпечуються включенням до таблетки метакрилатів, ацетатів целюлози, карбомерів і фталату гідроксипропілметилцелюлози. До прикладів придатних матеріа 12 лів відносяться Eudragit RS™ (полі(етилакрилат, метилметакрилат, хлорид триметиламоніоетилметакрилату) 1:2:0,1), Eudragit RL™ (полі(етилакрилат, метилметакрилат, хлорид триметиламоніоетилметакрилату) 1:2:0,2), Carbopol 971Р™ (карбомер), HPMCP-HP-55S™ (фталат гідроксипропілметилцелюлози). Пролонговане вивільнення, окрім того, одержують використанням таблеткової композиції з матрицею, що руйнується, наприклад, включенням до таблетки метакрилатів, метилцелюлози або гідроксипропілметилцелюлози. До прикладів придатних матеріалів відносяться Eudragit L™ (полі(метакрилова кислота, етилакрилат) 1:1) і Methocel K4M™ (гідроксипропілметилцелюлоза). Пролонговане вивільнення може бути також досягнуте використанням матеріалів у формі численних часток, покритих напівпроникними мембранами. Речовини у вигляді безлічі часток містять у собі покриті лікарським препаратом кулькові субстрати, такі як сфери лактози, або субстрати, що містять лікарський препарат, такі як сфери лактози, що містять лікарський препарат/Avicel™ (мікрокристалічну целюлозу). Такі речовини у вигляді безлічі часток покриті за необхідності відповідними напівпроникними мембранами, такими як полімер етилцелюлози. У ще одному аспекті композиція модифікованого вивільнення забезпечує пульсуюче вивільнення принаймні одного зі сполуки А або її фармацевтично прийнятної солі чи сольвату або іншого протидіабетичного засобу, наприклад, забезпечуючи до 4, наприклад 2, імпульси вивільнення активного засобу впродовж 24год. Придатними матеріали для композиції негайного вивільнення є сахарози, наприклад лактоза і мальтоза, і целюлози, наприклад мікрокристалічна целюлоза. Краще за все, композиція негайного вивільнення являє собою переважно мікрокристалічну целюлозу. Ще краще, композиція негайного вивільнення складається по суті з лактози, мікрокристалічної целюлози і стеарату магнію. Як вказано вище, пероральна лікарська форма за цим винаходом вважається придатною для введення 1 раз/день, і, як вказано, під час застосування забезпечує терапевтичний ефект впродовж тривалого періоду часу, наприклад, до 24год., наприклад, до 12,14,16,18, 20 і 24год. на стандартну дозу. Краще дозування сполуки А або її фармацевтично прийнятної солі чи сольвату при застосуванні відповідно до цього винаходу складає до 12мг, наприклад, від 1 до 12мг. Так, придатні лікарські форми містять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 або 12мг сполуки А або її фармацевтично прийнятної солі чи сольвату. Конкретні лікарські форми містять від 2 до 4мг сполуки А або її фармацевтично прийнятної солі чи сольвату. Конкретні лікарські форми містять від 4 до 8мг сполуки А або її фармацевтично прийнятної солі чи сольвату. Конкретні лікарські форми містять від 8 до 12мг сполуки А або її фармацевтично прийнятної солі чи сольвату. 13 82537 Одна лікарська форма містить 2мг сполуки А або її фармацевтично прийнятної солі чи сольвату. Кращі лікарські форми містять 4мг сполуки А або її фармацевтично прийнятної солі чи сольвату. Кращі лікарські форми містять 8мг сполуки А або її фармацевтично прийнятної солі чи сольвату. Інші придатні протидіабетичні засоби згідно з цим винаходом містять інгібітори альфаглюкозидази, бігуаніди і засоби, що стимулюють секрецію інсуліну. Придатний інгібітор альфа-глюкозидази являє собою акарбозу. Іншими придатними інгібіторами альфа-глюкозидази є еміглітат і міглітол. Ще одним придатним інгібітором альфа-глюкозидази є воглібоза. Придатними бігуанідами є метформін, буформін або фенформін, особливо метформін. Кращою фармацевтично прийнятною сіллю метформіну є гідрохлорид. Придатними засобами, що стимулюють секрецію інсуліну, є сульфонілсечовини. Придатними сульфонілсечовинами є глібенкламід, гліпізид, гліклазид, глімепірид, толазамід і толбутамід. Іншими сульфонілсечовинами є ацетогексамід, карбутамід, хлорпропамід, гліборнурид, гліквідон, глісентид, глісоламід, глісоксепід, гліклопіамід і гліциламід. Також до них відноситься сульфонілсечовина гліпентид. До інших придатних засобів, що стимулюють секрецію інсуліну, відноситься репаглінід. Додатковим засобом, що стимулює секрецію інсуліну, є натеглінід. До придатних дозувань, краще стандартних дозувань, іншого протидіабетичного засобу, такого як інгібітор альфа-глюкозидази, бігуанід або засіб, що стимулює секрецію інсуліну, відносяться відомі допустимі дози для цих сполук, як описано або вказано у довідкових джерелах, таких як Фармакопеї Великої Британії і США, Remington's Pharmaceutical Sciences (Mack Publishing Co.), Martindale The Extra Pharmacopoeia (London, The Pharmaceutical Press) (наприклад, див. 31-е видання, стор. 341 і наведені у ньому сторінки) або вказані вище публікації. Для інгібітору альфа-глюкозидази придатна кількість акарбози перебуває у діапазоні від 25 до 600мг, включаючи 50-600мг, наприклад 100мг або 200мг. Для бігуаніду придатне дозування метформіну складає від 100 до 3000мг, наприклад 250мг, 500мг, 850мг або 1000мг, зокрема 500мг і 1000мг. Для засобу, що стимулює секрецію інсуліну, придатна кількість глібенкламіду перебуває у діапазоні від 2,5 до 20мг, наприклад, 10мг або 20мг; придатна кількість гліпізиду перебуває у діапазоні від 2,5 до 40мг; придатна кількість гліклазиду перебуває у діапазоні від 40 до 320мг; придатна кількість толазаміду перебуває у діапазоні від 100 до 1000мг; придатна кількість толбутаміду перебуває у діапазоні від 1000 до 3000мг; придатна кількість хлорпропаміду перебуває у діапазоні від 100 до 500мг і придатна кількість гліквідону перебуває у 14 діапазоні від 15 до 180мг. Також придатна кількість глімепіриду складає від 1 до 6мг і придатна кількість гліпентиду складає від 2,5 до 20мг. Придатна кількість репаглініду перебуває у діапазоні від 0,5 до 20мг, наприклад 16мг. Також придатна кількість натеглініду складає від 90 до 360мг, наприклад 270мг. Коли лікарська форма містить сполуку А або її фармацевтично прийнятну сіль чи сольват і метформін, кращими фіксованими дозами є 2мг сполуки А і 500мг метформіну; 4мг сполуки А і 500мг метформіну; 2мг сполуки А і 1000мг метформіну; 4мг сполуки А і 1000мг метформіну; і 8мг сполуки А і 1000мг метформіну. Шляхом підбору вказаних вище змінних величин і площі поверхні оголеного ядра можна узгодити швидкості вивільнення в різних умовах середовища для одержання порівняльних швидкостей вивільнення в умовах різних середовищ організму і, таким чином, досягнути більш постійного введення пацієнтові. Краще швидкості розчинення пероральних лікарських форм за цим винаходом розташовуються по черзі, наприклад, шляхом звичайного підбору покриття, що піддається ерозії, і розмірів отвору (отворів) з тим, щоб швидкість вивільнення була по суті однаковою у середовищах з різним рН, в яких перебуває лікарська форма після введення. Швидкості розчинення можна оцінити тестуванням in vitro у розчинах з відповідними значеннями рН. Наприклад, при порівнянні розчинення у шлунку і кишечнику випробування можна провести спочатку при рН 1,5 з переходом на рН 6,8 через 2год. або 4год. як передбачуваного часу перебування у шлунку перед вивільненням у кишечник уявлюваного пацієнта відповідно у стані натщесерце і після прийняття їжі. Альтернативно, випробування можна проводити спочатку при рН 4,0 для імітації шлункового середовища після прийняття їжі з переходом через 5 годин до рН 6,8. Як згадано вище, сполуку А або її фармацевтично прийнятну сіль чи сольват при введенні у пероральній лікарській формі за цим винаходом можна, як вказано, використовувати для лікування та/або профілактики цукрового діабету, станів, пов'язаних із цукровим діабетом, і певних його ускладнень; метаболічного синдрому, порушень стійкості до глюкози і порушеного рівня глюкози натщесерце (що надалі названі "розлади за винаходом"). Сполука А або її фармацевтично прийнятна сіль чи сольват при введенні у пероральній лікарській формі за цим винаходом, як указано, можуть бути використані при лікуванні та/або профілактиці цукрового діабету, станів, пов'язаних із цукровим діабетом, і певних його ускладнень. Сполука А або її фармацевтично прийнятна сіль чи сольват при введенні у пероральній лікарській формі за цим винаходом, як указано, можуть бути використані при лікуванні та/або профілактиці метаболічного синдрому. Сполука А або її фармацевтично прийнятна сіль чи сольват при введенні у пероральній лікарській формі за цим винаходом, як указано, можуть бути використані при лікуванні та/або профілактиці порушеної стійкості до глюкози. Сполука А або її фармацевтично прийнятна 15 82537 сіль чи сольват при введенні у пероральній лікарській формі за цим винаходом, як указано, можуть бути використані при лікуванні та/або профілактиці порушеного рівня глюкози натщесерце. У кращому варіанті здійснення цей винахід забезпечує спосіб лікування та/або профілактики розладів за винаходом, причому спосіб вміщує в себе введення пероральної лікарської форми за цим винаходом, яка містить сполуку А або її фармацевтично прийнятну сіль чи сольват та інший протидіабетичний засіб, людині або ссавцеві, який відрізняється від людини, що цього потребує. У ще одному кращому варіанті здійснення цей винахід забезпечує пероральну лікарську форму за цим винаходом, яка містить сполуку А або її фармацевтично прийнятну сіль чи сольват та інший протидіабетичний засіб, для застосування при лікуванні та/або профілактиці розладів за винаходом. Придатні фармацевтично прийнятні форми іншого протидіабетичного засобу залежать від конкретного застосованого засобу, але включають відомі фармацевтично прийнятні форми конкретного вибраного засобу. Такі похідні можна виявити або вони вказані у стандартних довідкових публікаціях, таких як Фармакопеї Великої Британії і США, Remington's Pharmaceutical Sciences (Mack Publishing Co.), Martindale The Extra Pharmacopoeia (London, The Pharmaceutical Press) (наприклад, див. 31-е видання, стор. 341 і наведені у ньому сторінки) або вказані вище публікації. Наприклад, конкретною формою метформіну є гідрохлорид метформіну, конкретною формою репаглініду є форма солі бензойної кислоти і конкретною формою толбутаміду є форма натрієвої солі. Використаний у цьому описі термін "фармацевтично прийнятний" охоплює сполуки, композиції та інгредієнти для застосування і у людей, і у ветеринарії. Наприклад, термін "фармацевтично прийнятна сіль" охоплює ветеринарно прийнятну сіль. Зокрема, до придатних фармацевтично прийнятних сольових форм сполуки А відносяться форми, описані у Європейському патенті №0 308 228 і в міжнародній патентній заявці, публікація № WO 94/05659. Особливо кращою сіллю сполуки А є малеат. Кращою фармацевтично прийнятною сольватованою формою сполуки А є гідрат. Використаний у цьому описі термін "Стах" означає середній максимальний рівень концентрації у плазмі. Використаний у цьому описі термін "AUC" означає середню площу під кривою динаміки концентрації у плазмі впродовж інтервалу між введеннями у стаціонарному стані. При вказаних вище способах лікування не вказані побічні токсикологічні ефекти. Всі публікації, включаючи, але не обмежуючись, патенти і патентні заявки, наведені у цьому описі, вміщені до нього у вигляді посилання, так якби кожна окрема публікація була спеціально та індивідуально вказана як така, що вміщена до цього опису як посилання у повному викладі. У подальших прикладах ядра таблеток були складені звичайними засобами змішуванням разом активних інгредієнтів з ексципієнтами і пресу 16 ванням для формування ядра таблеток. Ці приклади призначені слугувати як ілюстрації, а не обмеження цього винаходу, а комбінація сполуки А і метформіну використовується суто як один приклад комбінації, придатної для застосування у цьому винаході. Приклад 1 Ядро формують з такої композиції: мас/мас. % Шар негайного вивільнення Сполука А (у вигляді малеату) 0,5 Сполука В (у вигляді гідрохлориду) 85,2 Моногідрат лактози 1,9 Мікрокристалічна целюлоза 5,6 Стеарат магнію 0,5 Гіпромелоза (НРМС) 3,6 Натрієва сіль простого 0,2 карбоксиметилового ефіру крохмалю Повідон 2,6 пресуванням для формування овальної таблетки розміром 19,0 мм x 9,2мм масою 1174мг. Ядра таблеток покривають нижнім покриттям на базі НРМС і поліметакрилатною смолою, розчинною при рН 5,5, до загальної маси 1246,5мг. Отвір діаметром 3,0мм свердлять крізь покриття у кожній з двох основних поверхонь покритих ядер для оголення поверхні ядра. Приклад 2 мас/мас. % Шар негайного вивільнення Сполука А (у ви гляді малеату) 0,5 Сполука В (у вигляді гідрохлориду) 85,2 Моногідрат лактози 1,9 Мікрокристалічна целюлоза 5,6 Стеарат магнію 0,5 Гіпромелоза (НРМС) 3,6 Натрієва сіль простого 0,2 карбоксиметилового ефіру крохмалю Повідон 2,6 пресуванням для формування овальної таблетки розміром 19,0мм x 9,2мм масою 1174мг. Ядра таблеток покривають нижнім покриттям на базі НРМС і поліметакрилатною смолою, розчинною при рН 5,5, до загальної маси 1246,5мг. Отвір діаметром 4,0мм свердлять крізь покриття у кожній з двох основних поверхонь покритих ядер для оголення поверхні ядра. Профілі розчинення для лікарських форм прикладів 1 і 2, для сполуки А і метформіну (сполука В) показані відповідно на Фіг.1 і 2 на супровідних кресленнях. Тести розчинення виконують спочатку при рН 4,0 з переходом до рН 6,8 через 5год. Дослідження для оцінки Фармакокінетики шести композицій пролонгованого вивільнення AVANDAMET™ (4мг малеату розиглітазону/1000мг метформіну НСП. порівняно із наявною у продажу 17 82537 композицією AVAND AMET™ (2мг малеату розиглітазону/500мг метформіну НСІ. які вводять 2 рази/день) і супутнім введенням Glucophaqet XR (метформін НСІ 2 х 500мг) з AVANDIA™ (4мг малеату розиглітазону) Основні цілі Порівняти фармакокінетику однократної дози шести композицій пролонгованого вивільнення AVANDAMET™ (4мг малеату розиглітазону/1000 мг метформіну НСІ) з фармакокінетикою наявної у продажі композиції AVANDAMET™ (2мг малеату розиглітазону/500мг метформіну НСІ, яку вводять 2 рази/день). Порівняти фармакокінетику однократної дози шести композицій пролонгованого вивільнення AVAND AMET™ (4мг малеату розиглітазону/1000мг метформіну НСІ) з фармакокінетикою одночасно введеного Glucophage XR (метформін НСІ 2 х 500мг) з AVANDIA™ (4мг малеату розиглітазону). Другорядні цілі Оцінити безпеку і прийнятність однократних пероральних доз кожної з шести композицій пролонгованого вивільнення AVANDAMET™ (4мг малеату розиглітазону/1000мг метформіну НСІ); наявної у цей час у продажі композиції AVANDAMET™ (2мг малеату розиглітазону/500мг метформіну НСІ, яку вводять 2 рази/день) і одночасного введення наявних у продажі таблеток Glucophage XR (метформін НСІ 2 х 500мг) з AVANDIA™ (4мг малеату розиглітазону). Порівняти фармакокінетику наявної у цей час у продажу композиції AVANDAMET™ (2мг малеату розиглітазону/500мг метформіну НСІ, яку вводять 2 рази/день) і одночасно введеного Glucophage XR (метформін НСІ 2 х 500мг) з AVANDIA™ (4мг малеату розиглітазону). Структура дослідження Це було рандомізоване, відкрите, яке складається з чотирьох періодів, збалансоване за періодами перехресне дослідження з трьома паралельними групами, проведене на здорових добровольцях. Кожний індивідуум брав участь у чотирьох циклах дослідження, розділених пері 18 одом очищення впродовж принаймні 7 днів. У кожному циклі дослідження індивідуумів методом випадкової вибірки включали до групи, яка увечері у стані ситості одержувала або одну пероральну дозу AVANDAMET™, AVANDIA™ плюс Glucophage XR, або 2 з б композицій пролонгованого вивільнення AVAND AMET™. Кількість та основні характеристики індивідуумів 51 індивідуум було включено у дослідження, і 39 індивідуумів завершили дослідження. Індивідууми являли собою здорових дорослих чоловіків і жінок у віці від 18 до 65 років включно з масою тіла >50кг (110 фунтів) та індексом маси тіла (ВМІ) від 19 до 30кг/м 2. Критерії для оцінювання Зразки плазми для аналізу фармакокінетики розиглітазону і метформіну одержували перед введенням досліджуваного лікарського препарату у кожний цикл і впродовж 24-годинного інтервалу. Аналізували дані вимірювання із часом концентрації у плазмі розиглітазону і метформіну. Якщо дозволяли дані, то визначали такі фармакокінетичні параметри: максимальну спостережену концентрацію у плазмі (Стах), час до досягнення Стах (tmax), площа під кривою зміни концентрації у плазмі у часі до останньої вимірюваної концентрації (AUC(O-t)), (AUC(0-36год.)) і екстрапольованої на безкінечність (AUC(O-inf)) і період напіввиведення (t1/2). Безпеку і прийнятність оцінювали за побічними явищами, клінічними лабораторними оцінками (гематологія, клінічна хімія і аналіз сечі), показниками життєвих функцій (артеріальний тиск, частота серцевих скорочень у положенні напівлежачі), ЕКГ у 12 відведеннях і одночасно вживаними лікарськими засобами. Всі індивідууми, які одержували принаймні одну дозу досліджуваного лікарського засобу, були включені до оцінювання клінічної безпеки і прийнятності. Результати дослідження Фармакокінетики Геометрична середня (діапазон) показників фармакокінетики метформіну: 19 82537 AUC плазми, що спостерігалася для сполуки А (малеат розиглітазону), генерована за композицією пролонгованого вивільнення №3, була еквівалентною AUC, одержаній за еталонними схемами (тобто А і В). Аналогічним чином, спостережена AUC метформіну плазми, генерована за композицією пролонгованого вивільнення №3, була еквівалентною AUC метформіну, одержаної за еталонними схемами (тобто А і В). Аналогічні профілі концентрації у плазмі препаратів пролонгованого вивільнення спостерігалися для обох активних засобів. Після введення композиції пролонгованого вивільнення №3 спостережена варіабельність між індивідуумами фармакокінетичних параметрів розиглітазону і метформіну узгоджувалася з еталонними групами лікування (схеми А і В). 20 Висновок Було виявлено, що прийнята один раз на день таблеткова композиція модифікованого вивільнення, яка містить сполуку А і метформін, забезпечує еквівалентну площу під кривою концентрації у плазмі в динаміці у часі (після введення однієї дози) порівняно із AUC, спостереженою після введення таблеткової композиції негайного вивільнення, яка містить сполуку А і метформін (введеної 2 рази/день х 2 дози). Крім того, була продемонстрована еквівалентність AUC між композицією модифікованого вивільнення (розиглітазону і метформіну) порівняно з однією дозою одночасно введеного розиглітазону і глюкофагу XR. 21 Комп’ютерна в ерстка Л. Купенко 82537 Підписне 22 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюOral dosage form comprising rosiglitazone and methformin
Автори англійськоюColes Peter John, Mackenzie Donald Colin, Jnr Paul Norman Mudd
Назва патенту російськоюПероральная лекарственная форма, которая содержит розиглитазон и метформин
Автори російськоюКоулз Питер Джон, Маккензи Дональд Колин, Мадд Пол Норман, мл.
МПК / Мітки
МПК: A61K 31/155, A61K 31/4439, A61P 3/10, A61K 9/28
Мітки: пероральна, форма, лікарська, містить, метформін, розиглітазон, яка
Код посилання
<a href="https://ua.patents.su/11-82537-peroralna-likarska-forma-yaka-mistit-roziglitazon-ta-metformin.html" target="_blank" rel="follow" title="База патентів України">Пероральна лікарська форма, яка містить розиглітазон та метформін</a>
Попередній патент: Спосіб виготовлення тонкостінних гнутих профілів (варіанти)
Наступний патент: Спосіб вимірювання стійкості електронного пристрою
Випадковий патент: Спосіб використання сонячної енергії для теплової обробки бетонних і залізобетонних виробів