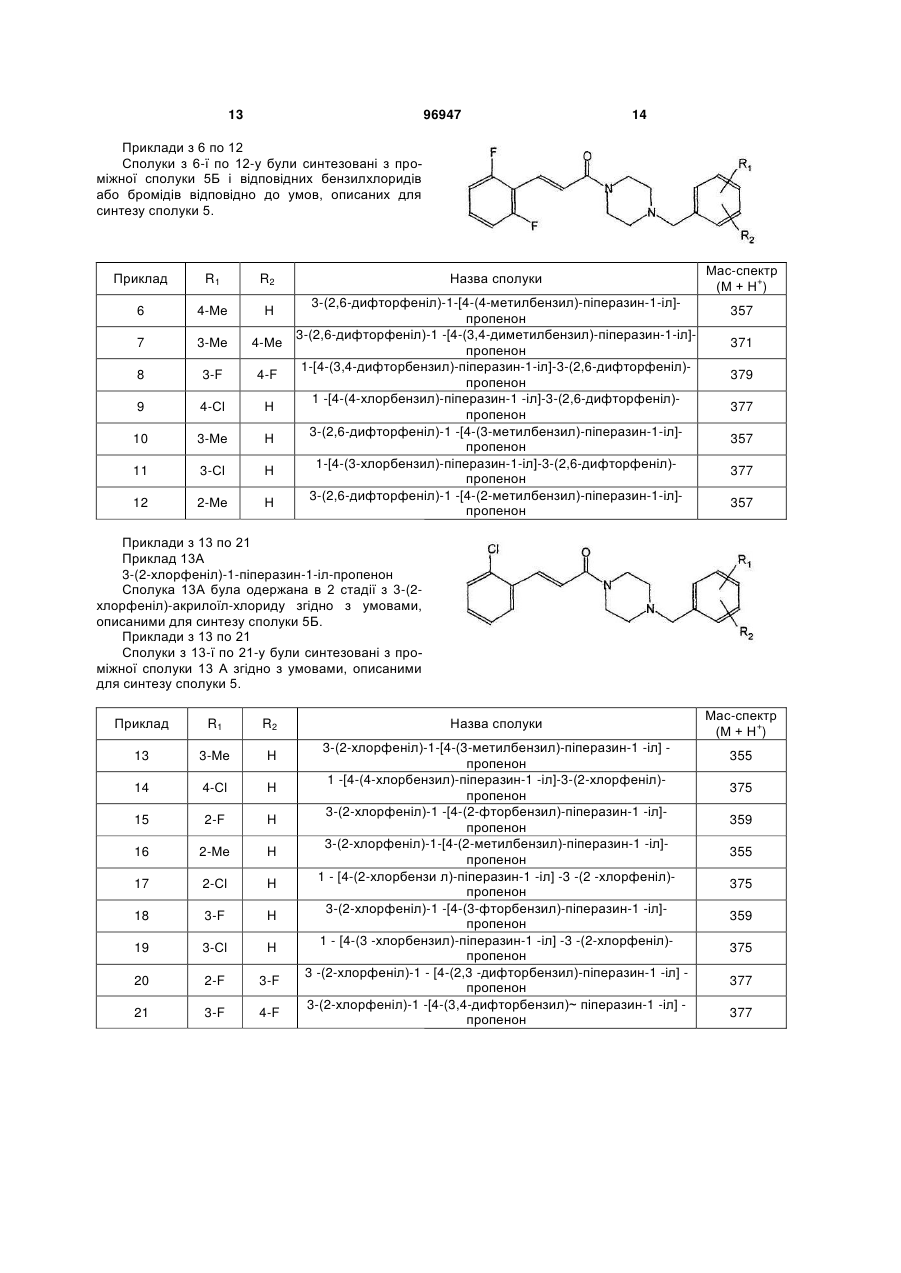
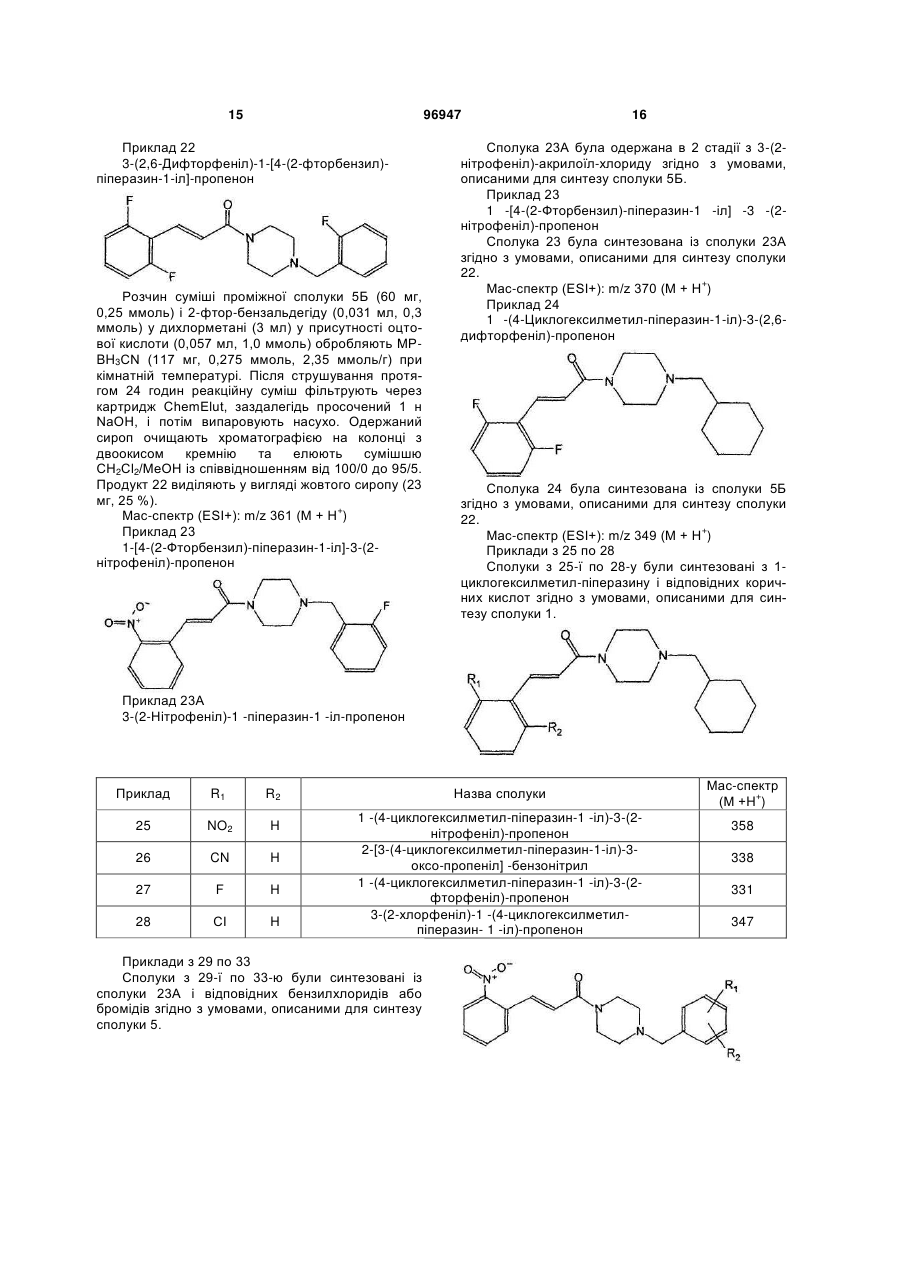
Похідні цинамоїл-піперазину та їх застосування як антагоністів par-1
Номер патенту: 96947
Опубліковано: 26.12.2011
Автори: Перес Мішель, Летьєн Робер, Ламот Марі, Ле Гран Бруно
Формула / Реферат
1. Сполуки загальної формули (І):
 , І
, І
де:
R1 являє собою галоген, CN або NO2;
R2 являє собою водень або галоген;
n дорівнює 1 або 2;
R3 являє собою феніл, заміщений одним або більше галогенами або С1-С6алкілами; або циклогексил;
та їх терапевтично прийнятні солі або сольвати.
2. Сполуки за п. 1, де R1 - галоген, R2 - водень, n дорівнює 1, a R3 - феніл, заміщений одним або більше галогенами або С1-С6алкілами.
3. Сполуки за п. 1, де R1 - ціаногрупа, R2 - водень, n дорівнює 1, а R3 - феніл, заміщений одним або більше галогенами або С1-С6алкілами.
4. Сполуки за п. 1, де R1 - галоген, R2 - водень, n дорівнює 1, a R3 - циклогексил.
5. Сполуки за п. 1, де R1 - ціаногрупа, R2 - водень, n дорівнює 1, a R3 - циклогексил.
6. Сполука за п. 1, вибрана з:
3-(2-хлорфеніл)-1-[4-(4-фторбензил)-піперазин-1-іл]-пропенону;
1-[4-(4-фторбензил)-піперазин-1-іл]-3-(2-фторфеніл)-пропенону;
3-(2-бромфеніл)-1-[4-(4-фторбензил)-піперазин-1-іл]-пропенону;
3-(2-хлорфеніл)-1-[4-(4-метилбензил)-піперазин-1-іл]-пропенону;
3-(2,6-дифторфеніл)-1-[4-(4-фторбензил)-піперазин-1-іл]-пропенону;
3-(2,6-дифторфеніл)-1-[4-(4-метилбензил)-піперазин-1-іл]-пропенону;
3-(2,6-дифторфеніл)-1-[4-(3,4-диметилбензил)-піперазин-1-іл]-пропенону;
1-[4-(3,4-дифторбензил)-піперазин-1-іл]-3-(2,6-дифторфеніл)-пропенону;
1-[4-(4-хлорбензил)-піперазин-1-іл]-3-(2,6-дифторфеніл)-пропенону;
3-(2,6-дифторфеніл)-1-[4-(3-метилбензил)-піперазин-1-іл]-пропенону;
1-[4-(3-хлорбензил)-піперазин-1-іл]-3-(2,6-дифторфеніл)-пропенону;
3-(2,6-дифторфеніл)-1-[4-(2-метилбензил)-піперазин-1-іл]-пропенону;
3-(2-хлорфеніл)-1-[4-(3-метилбензил)-піперазин-1-іл]-пропенону;
1-[4-(4-хлорбензил)-піперазин-1-іл]-3-(2-хлорфеніл)-пропенону;
3-(2-хлорфеніл)-1-[4-(2-фторбензил)-піперазин-1-іл]-пропенону;
3-(2-хлорфеніл)-1-[4-(2-метилбензил)-піперазин-1-іл]-пропенону;
1-[4-(2-хлорбензил)-піперазин-1-іл]-3-(2-хлорфеніл)-пропенону;
3-(2-хлорфеніл)-1-[4-(3-фторбензил)-піперазин-1-іл]-пропенону;
1-[4-(3-хлорбензил)-піперазин-1-іл]-3-(2-хлорфеніл)-пропенону;
3-(2-хлорфеніл)-1-[4-(2,3-дифторбензил)-піперазин-1-іл]-пропенону;
3-(2-хлорфеніл)-1-[4-(3,4-дифторбензил)-піперазин-1-іл]-пропенону;
3-(2,6-дифторфеніл)-1-[4-(2-фторбензил)-піперазин-1-іл]-пропенону;
1-[4-(2-фторбензил)-піперазин-1-іл]-3-(2-нітрофеніл)-пропенону;
1-(4-циклогексилметилпіперазин-1-іл)-3-(2,6-дифторфеніл)-пропенону;
2-[3-(4-циклогексилметилпіперазин-1-іл)-3-оксопропеніл]-бензонітрилу;
1-(4-циклогексилметилпіперазин-1-іл)-3-(2-нітрофеніл)-пропенону;
1-(4-циклогексилметилпіперазин-1-іл)-3-(2-фторфеніл)-пропенону;
3-(2-хлорфеніл)-1-(4-циклогексилметилпіперазин-1-іл)-пропенону;
1-[4-(4-фторбензил)-піперазин-1-іл]-3-(2-нітрофеніл)-пропенону;
1-[4-(4-метилбензил)-піперазин-1-іл]-3-(2-нітрофеніл)-пропенону;
1-[4-(3,4-дифторбензил)-піперазин-1-іл]-3-(2-нітрофеніл)-пропенону;
1-[4-(4-хлорбензил)-піперазин-1-іл]-3-(2-нітрофеніл)-пропенону;
1-[4-(3-метилбензил)-піперазин-1-іл]-3-(2-нітрофеніл)-пропенону;
1-[4-(2,6-диметилбензил)-піперазин-1-іл]-3-(2-нітрофеніл)-пропенону;
3(2,6-дифторфеніл)-1-(4-фенетилпіперазин-1-іл)-пропенону;
3-(2-хлорфеніл)-1-(4-фенетилпіперазин-1-іл)-пропенону;
3-(2-хлорфеніл)-1-{4-[2-(4-фторфеніл)-етил]-піперазин-1-іл}-пропенону;
а також їх терапевтично прийнятних солей і сольватів.
7. Сполуки за будь-яким з пп. 1-6 для застосування як ліків.
8. Спосіб одержання сполук загальної формули (І) за будь-яким з пп. 1-6, в якому здійснюють конденсацію проміжної сполуки загальної формули (II)
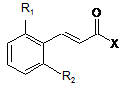 , II
, II
де R1 та R2 так, як в описі загальної формули (І) в п. 1, X може являти собою відхідну групу, таку як хлор, або X може являти собою гідроксил,
з аміном загальної формули (III)
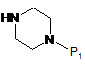 , III
, III
де Р1 являє собою захисну групу,
з одержаної проміжної сполуки загальної формули (IV)
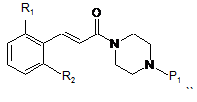 , IV
, IV
де R1, R2 та Р1 визначені вище,
одержують сполуки загальної формули (І) після зняття захисту і проведення реакції аміну або з реагентом загальної формули R3(CH2)nY, де R3 визначений вище, a Y являє собою відхідну групу, таку як, наприклад, Сl, Вr, І, OSO2CH3, OSO2CF3 або О-тозил, або з альдегідом формули R3 -(CH2)n-1-CHO, де R3 та n визначені вище.
9. Спосіб одержання сполук загальної формули (І) за будь-яким з пп. 1-6, в якому здійснюють конденсацію проміжної сполуки загальної формули (II)
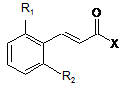 , II
, II
де R1, R2 та X визначені вище,
з аміном загальної формули (V)
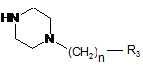 , V
, V
де n та R3 визначені вище,
з отриманням сполуки загальної формули (І).
10. Фармацевтична композиція, яка містить як активний інгредієнт щонайменше одну сполуку за будь-яким з пунктів з 1 по 6 в комбінації з фармацевтично прийнятним носієм.
11. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків, які є антагоністом тромбінового рецептора.
12. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків для лікування і/або профілактики розладів, пов'язаних з активацією рецептора PAR-1 (рецептора-1, що активується протеазою).
13. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків проти агрегації тромбоцитів.
14. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків для лікування і/або профілактики артеріального і/або венозного тромбозу.
15. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків для лікування і/або профілактики стабільної стенокардії, порушень серцевого ритму, інсультів, серцевої недостатності, гіпертензії або інфаркту міокарда.
16. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків для лікування і/або профілактики фібриляції передсердь і ремоделювання міокарда.
17. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків для лікування і/або профілактики гострих коронарних синдромів.
18. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків для інгібування проліферації клітин гладких м'язів (рестенозу).
19. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків для лікування і/або профілактики запальних розладів, легеневих захворювань, шлунково-кишкових захворювань, розвитку фіброзу у пацієнтів з хронічним захворюванням печінки або шкірних захворювань.
20. Застосування сполуки за будь-яким з пп.1-6 для виготовлення ліків для лікування і/або профілактики проліферації ендотеліальних, фібробластних, кардіофібробластних, гліальних клітин, клітин гладкої мускулатури або ракових клітин.
21. Продукт, який містить щонайменше одну сполуку за будь-яким з пп. 1-6 та інший серцево-судинний агент, у вигляді комбінованого продукту для одночасного, роздільного або відстроченого застосування при лікуванні серцево-судинних захворювань.
22. Продукт за п. 21, де інший серцево-судинний агент являє собою агент проти агрегації тромбоцитів, такий як аспірин, клопідогрел, тиклопідин, абциксимаб, тирофібан або ептифібатид.
Текст
1. Сполуки загальної формули (І): R1 O C2 2 (19) 1 3 96947 1-(4-циклогексилметилпіперазин-1-іл)-3-(2фторфеніл)-пропенону; 3-(2-хлорфеніл)-1-(4-циклогексилметилпіперазин1-іл)-пропенону; 1-[4-(4-фторбензил)-піперазин-1-іл]-3-(2нітрофеніл)-пропенону; 1-[4-(4-метилбензил)-піперазин-1-іл]-3-(2нітрофеніл)-пропенону; 1-[4-(3,4-дифторбензил)-піперазин-1-іл]-3-(2нітрофеніл)-пропенону; 1-[4-(4-хлорбензил)-піперазин-1-іл]-3-(2нітрофеніл)-пропенону; 1-[4-(3-метилбензил)-піперазин-1-іл]-3-(2нітрофеніл)-пропенону; 1-[4-(2,6-диметилбензил)-піперазин-1-іл]-3-(2нітрофеніл)-пропенону; 3(2,6-дифторфеніл)-1-(4-фенетилпіперазин-1-іл)пропенону; 3-(2-хлорфеніл)-1-(4-фенетилпіперазин-1-іл)пропенону; 3-(2-хлорфеніл)-1-{4-[2-(4-фторфеніл)-етил]піперазин-1-іл}-пропенону; а також їх терапевтично прийнятних солей і сольватів. 7. Сполуки за будь-яким з пп. 1-6 для застосування як ліків. 8. Спосіб одержання сполук загальної формули (І) за будь-яким з пп. 1-6, в якому здійснюють конденсацію проміжної сполуки загальної формули (II) R1 O X R2 , II де R1 та R2 так, як в описі загальної формули (І) в п. 1, X може являти собою відхідну групу, таку як хлор, або X може являти собою гідроксил, з аміном загальної формули (III) HN N P1 , III де Р1 являє собою захисну групу, з одержаної проміжної сполуки загальної формули (IV) R1 O N R2 N P1 `` , IV де R1, R2 та Р1 визначені вище, одержують сполуки загальної формули (І) після зняття захисту і проведення реакції аміну або з реагентом загальної формули R3(CH2)nY, де R3 визначений вище, a Y являє собою відхідну групу, таку як, наприклад, Сl, Вr, І, OSO2CH3, OSO2CF3 або О-тозил, або з альдегідом формули R3 -(CH2)n1-CHO, де R3 та n визначені вище. 4 9. Спосіб одержання сполук загальної формули (І) за будь-яким з пп. 1-6, в якому здійснюють конденсацію проміжної сполуки загальної формули (II) R1 O X R2 , II де R1, R2 та X визначені вище, з аміном загальної формули (V) HN N (CH2) n R3 ,V де n та R3 визначені вище, з отриманням сполуки загальної формули (І). 10. Фармацевтична композиція, яка містить як активний інгредієнт щонайменше одну сполуку за будь-яким з пунктів з 1 по 6 в комбінації з фармацевтично прийнятним носієм. 11. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків, які є антагоністом тромбінового рецептора. 12. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків для лікування і/або профілактики розладів, пов'язаних з активацією рецептора PAR-1 (рецептора-1, що активується протеазою). 13. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків проти агрегації тромбоцитів. 14. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків для лікування і/або профілактики артеріального і/або венозного тромбозу. 15. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків для лікування і/або профілактики стабільної стенокардії, порушень серцевого ритму, інсультів, серцевої недостатності, гіпертензії або інфаркту міокарда. 16. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків для лікування і/або профілактики фібриляції передсердь і ремоделювання міокарда. 17. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків для лікування і/або профілактики гострих коронарних синдромів. 18. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків для інгібування проліферації клітин гладких м'язів (рестенозу). 19. Застосування сполуки за будь-яким з пп. 1-6 для виготовлення ліків для лікування і/або профілактики запальних розладів, легеневих захворювань, шлунково-кишкових захворювань, розвитку фіброзу у пацієнтів з хронічним захворюванням печінки або шкірних захворювань. 20. Застосування сполуки за будь-яким з пп.1-6 для виготовлення ліків для лікування і/або профілактики проліферації ендотеліальних, фібробластних, кардіофібробластних, гліальних клітин, клітин гладкої мускулатури або ракових клітин. 21. Продукт, який містить щонайменше одну сполуку за будь-яким з пп. 1-6 та інший серцево 5 96947 6 судинний агент, у вигляді комбінованого продукту для одночасного, роздільного або відстроченого застосування при лікуванні серцево-судинних захворювань. 22. Продукт за п. 21, де інший серцево-судинний агент являє собою агент проти агрегації тромбоцитів, такий як аспірин, клопідогрел, тиклопідин, абциксимаб, тирофібан або ептифібатид. Даний винахід стосується похідних цинамоїлпіперазину, способу їх одержання, фармацевтичних композицій, які містять ці похідні, і застосування цих похідних як ліків для лікування і/або попередження артеріального і/або венозного тромбозу, гострих коронарних синдромів, рестенозу, стабільної стенокардії, порушень серцевого ритму, інфаркту міокарду, гіпертензії, серцевої недостатності, інсульту, запальних розладів, легеневих захворювань, захворювань шлунково-кишкового тракту, розвитку фіброзу у пацієнтів з хронічним захворюванням печінки, раку і захворювань шкіри. Даний винахід стосується також комбінацій сполук, які становлять суть даного винаходу, з іншими серцево-судинними агентами. Тромбоз вважається первинним фактором в закупорюванні судин, яке є причиною великої кількості патофізіологічних ускладнень. Тому протитромбозна терапія надзвичайно важлива, оскільки вона може знизити ризик смерті від серцевосудинних причин і серцевих порушень. Хоча було встановлено, що декілька типів молекул мають високу протитромбозну активність у людини, зберігається необхідність в пошуку нових молекул. Дійсно, можна удосконалити існуючі сполуки, деякі з яких негативно впливають на тривалість кровотечі або пов'язані з іншими небажаними побічними ефектами (такими, як, наприклад, ризик утворення виразки при застосуванні аспірину). Нещодавно був клонований рецептор-1, що активується протеазою, (protease-activated receptor-1, PAR-1) (Vu et al. II Cell. 1991. T. 64. C. 1057-1068), і був встановлений механізм його дії (Coughlin et al. II J. Clin. Invest. 1992. T. 89, № 2. C. 351-355). Цей рецептор, присутній, перш за все, на поверхні тромбоцитів, на поверхні клітин ендотелію (O'Brien et al. II J. Biol. Chem. 2000. T. 275. C. 13502-13509), клітин гладких м'язів (Hamilton et al. II Br. J. Pharmacol 2000. T. 130.C. 181-188) і фібробластів (Hung et al. Ill Cell. Biol. 1992. T. 116, № 3. C. 827-832), активується тромбіном і тому називається також тромбіновим рецептором. N-терміналь білка розщеплюється тромбіном між аргініном в положенні 41 і серином в положенні 42 з вивільненням нового кінця, який після фолдинга буде діяти на активний центр як агоніст рецептора (Vu et al. II Nature. 1991. T. 353. C. 674-677). Що стосується тромбоцитів, цей специфічний механізм активації рецептора PAR-1 призводить до агрегації тромбоцитів, яка направляється тромбіном. Блокування цієї активації, наприклад антагоністами рецептора PAR-1, може інгібувати опосередковану тромбіном агрегацію тромбоцитів (Ahn et al. II Drug of the Future. 2001. T. 26. C. 1065-1085). Тому блокування цих рецепторів може призвести до лікування або попередження тромбозу (Derian et al. II J. Pharmacol. Exp. Ther. 2003. C. 855-861), гострого коронарного синдрому (Ossovskaya et al. II Physiol. Rev. 2004. T. 84. C. 579-621) і рестенозу (Maryanoff et al. II Curr. Med. Chem. Cardiovasc. Hematol. Agents. 2003. C 13-36) і може зменшувати некроз міокарду при інфаркті або повторній перфузії (Steinberg et al II Molec. Pharmacol. 2005. T. 67. C. 2-11). Активність антагоністів PAR-1 може запобігати деяким запальним захворюванням легеневої системи (Moffatt et al. II Curr. Op. Pharmacol. 2004. C. 221-229) і шлунково-кишкової системи (Vergnolle et al. II J. Clin. Invest. 2004. C. 1444-1456). Антагоністи PAR-1 можуть бути також корисні в лікуванні фіброзів у пацієнтів з хронічним захворюванням печінки (Fiorucci et al. II Hepatology. 2004. T. 39. C. 365-375). Вони можуть бути також корисні як протиракові засоби, оскільки вони здатні контролювати проліферацію і метастазування (Evan-Ram et al. II Nat. Med. 1998. C. 909914; Boire et al. II Cell 2005. T. 120. C. 303-313). Нарешті, антагоністи PAR-1 можуть представляти інтерес в дерматології для лікування деяких шкірних захворювань (Schechter et al. // J. Cell. Physiol 1998. T. 176. C. 365-373; Algermissen et al. //Arch. Dermatol. Res. 2000. T. 292. C. 488-495; MeyerHoffert et al II Exp. Dermatol. 2004. T. 13. C. 234241). Даний винахід стосується нового класу антагоністів PAR-1, які відрізняються від антагоністів попереднього рівня техніки іншою хімічною структурою і своїми чудовими біологічними властивостями. Сполуки згідно з даним винаходом мають загальну формулу (І): де: R1 являє собою галоген, CN або NO2; R2 являє собою водень або галоген; n дорівнює 1 або 2; R3 являє собою феніл, заміщений одним або більше галогенами або С1-С6 алкілами, або циклогексил; або являють собою їх терапевтично прийнятні солі або сольвати. У попередніх визначеннях: Всі комбінації замісників або варіантів можливі остільки, оскільки вони дають стабільні сполуки. 7 96947 8 Термін "галоген" означає фтор, хлор, бром або йод. Термін "алкіл" означає лінійні або розгалужені, насичені або ненасичені аліфатичні вуглеводневі ланцюги, які містять визначене число атомів вуглецю. Терапевтично прийнятні солі сполук згідно з даним винаходом включають нетоксичні солі сполук згідно з даним винаходом, що звичайно застосовуються, - такі, як солі, що утворюються органічними або неорганічними кислотами. Як приклад можна вказати наступне: солі неорганічних кислот - таких, як соляна, бромистоводнева, фосфорна і сірчана кислоти, а також солі органічних кислот таких, як оцтова, трифтороцтова, пропіонова, бурштинова, фумарова, яблучна, винна, лимонна, аскорбінова, малеїновая, глутамінова, бензойна, саліцилова, толуолсульфонова, метансульфонова, стеаринова і молочна кислоти. Ці соліможуть бути синтезовані із сполук згідно з даним винаходом, які містять основну частину, і відповідних кислот з використанням стандартних хімічних способів. Терапевтично прийнятні сольвати сполук даного винаходу включають звичайні сольвати - такі, як сольвати, утворені в ході кінцевого етапу одержання сполук згідно з даним винаходом як результат присутності розчинників. Як приклад можуть бути згадані сольвати, що утворюються завдяки присутності води або етанолу. Серед сполук загальної формули (І) згідно з даним винаходом один особливо корисний клас сполук включає сполуки загальної формули (І), де R1 - галоген, R2 -водень, n дорівнює 1 або 2, R3 феніл, заміщений одним або більше галогенами або С1-С6 алкілами. Інший особливо корисний клас сполук згідно з даним винаходом включає сполуки загальної формули (І), де R1 - ціаногрупа, R2 - водень, n дорівнює 1, a R3 - феніл, заміщений одним або більше галогенами або С1-С6 алкілами. Інший особливо корисний клас сполук згідно з даним винаходом включає сполуки загальної формули (І), где R1 - галоген, R2 - водень, n дорівнює 1, a R3 - циклогексил. Інший особливо корисний клас сполук згідно з даним винаходом включає сполуки загальної формули (І), де R1 - ціаногрупа, R2 - водень, n дорівнює 1, a R3 - циклогексил. Даний винахід стосується також одержання сполук загальної формули (І) звичайними методами, описаними в наступних схемах синтезу, доповнених в потрібних випадках будь-якими стандартними методиками, описаними в літературі, відомими фахівцям в даній галузі або представленими в експериментальному розділі. Схема 1 ілюструє перший загальний метод, який може бути застосований для синтезу сполук загальної формули (І). У представлених вище загальних формулах R1, R2, R3 і n визначені так, як у попередньому описі загальної формули (І). Р1 - це захисна група. X може являти собою відхідну групу - таку, як хлор. В цьому випадку перший етап складається з реакції між кислотним хлором та аміном. Ця реакція може бути здійснена за допомогою методів та апаратури, відомих фахівцям в даній галузі. Особливо зручний метод полягає в здійсненні реакції двох учасників у присутності органічної або неорганічної основи - такої, як, наприклад, Et3N, iPr2NEt, піридин, NaH, CS2CO3 або К2СО3, в розчиннику - такому, як ТГФ, дихлорметан, ДМФ або ДМСО при температурі від -20C до 100C. X може також являти собою гідроксил. В цьому випадку перший етап полягає в реакції конденсації між карбоновою кислотою (II) та аміном (III). Ця реакція може бути здійснена за допомогою методів та апаратури, відомих фахівцям в даній галузі. Особливо зручний метод полягає в здійсненні реакції цих двох молекул у присутності 1-(3диметиламінопропіл)-3-етил-карбодііміду (EDC), 3окси-1,2,3-бензотриазин-4(3Н)-ону і третинного аміну - такого, як діізопропілтриетиламін, в полярному апротонному розчиннику - такому, як дихлорметан або ДМФ, при температурі від -15C до 40C. Після зняття захисту з проміжної сполуки (IV) за допомогою методів та апаратури, відомих досвідченим фахівцям в даній галузі [див. T.W. Greene "Protective Groups in Organic Synthesis" / John Wiley & Sons, 1981 та PJ. Kocienski "Protecting Groups" / Thieme Verlag, 1994], одержана проміжна сполука може прореагувати з реагентом формули R3(CH2)nY, де Y являє собою відхідну групу - таку, як СІ, Br, I, OSO2CH3, OSO2CF3 або О-тозил. В 9 96947 10 цьому випадку реакція може бути проведена у присутності органічної або неорганічної основи такої, як, наприклад, Et3N, iPr2NEt, NaH, CS2CO3 або К2СО3, які можуть бути прикріплені до смоли такої, як PS-DIEA або МР-карбонат, в полярному безводному розчиннику - такому, як дихлорметан, ТГФ, ДМФ або ДМСО, при температурі від -20C до 100C. Інший метод одержання полягає в проведенні реакції відновлювального амінування з використанням альдегіду формули R3-(CH2)n-1 CHO, в якій R3 та n такі, як вони визначені вище, з вивільненим від захисту аміном загальної формули (IV) і відновлювальним агентом - таким, як NaBH4, NaBH3CN або NaBH(OAc)3, які можуть бути прикріплені до смоли - такої, як MP-BH3CN, в полярному розчиннику -такому, як 1,2-дихлоретан, дихлорметан, ТГФ, ДМФ або МеОН, при рН, який можна встановлювати додаванням кислоти - такої, як оцтова кислота, при температурі від -20C до 100C. Схема 2 ілюструє другий загальний метод, який можна використовувати для одержання сполук загальної формули (І). У представлених вище загальних формулах R1, R2, R3 і n визначені так, як у попередньому описі загальної формули (І). X може являти собою відхідну групу - таку, як хлор. В цьому випадку синтез полягає в проведенні реакції між хлоридом кислоти та аміном. Ця реакція може бути здійснена за допомогою методів та апаратури, відомих фахівцям в даній галузі. Особливо зручний метод полягає в здійсненні реакції цих двох молекул у присутності органічної або неорганічної основи -такої, як, наприклад, Et3N, iPr2NEt, піридин, NaH, CS2CO3 або K2СО3, в розчиннику - такому, як ТГФ, дихлорметан, ДМФ або ДМСО, при температурі від -20C до 100C. X може являти собою також гідроксильну групу. В цьому випадку синтез полягає в проведенні реакції конденсації між карбоновою кислотою (II) та аміном (V). Реакція може бути здійснена за допомогою методів та апаратури, відомих фахівцям в даній галузі. Особливо зручний метод полягає в конденсуванні карбонової кислоти загальної формули (II) з аміном загальної формули (V) у присутності 1-(3-диметиламінопропіл)-3-етилкарбодііміду (EDC), 3-окси-1,2,3-бензотриазин4(3Н)-ону і третинного аміну - такого, як діізопропілтриетиламін, в полярному апротонному розчиннику - такому, як дихлорметан, при температурі від -15C до 40C. Якщо необхідно виділити сполуку загальної формули (І), яка містить, щонайменше, одну основну функціональну групу, в стані солі шляхом додавання кислоти, такий результат може бути досягнутий обробкою вільної основи загальної формули (І) (у якій присутня, щонайменше, одна основна функціональна група) підходящою кислотою, яка переважно додається в еквівалентній кількості. Наведені нижче приклади ілюструють даний винаходу, ніяким чином не обмежуючи його обсяг. Приклад 1 3-(2-Хлорфеніл)-1-[4-(4-фторбензил)піперазин-1-іл]-пропенон Приклад 1А Трет-бутиловий ефір 4-(4-фторбензил)піперазин-1-карбонової кислоти Розчин трет-бутилового ефіру піперазин-1карбонової кислоти (5,0 г, 26,8 ммоль) у дихлорметані (100 мл) у присутності діізопропілетиламіну (DIEA) (5,59 мл, 40,2 ммоль) обробляють 4фторбензилбромідом (3,68 мл, 29,5 ммоль) при кімнатній температурі. Після струшування протягом 16 годин реакційну суміш розбавляють дихлорметаном і промивають водою. Органічну фазу сушать над MgSO4, фільтрують та упарюють насухо. Одержаний сироп очищають хроматографією на колонці з двоокисом кремнію та елюють сумішшю СН2Сl2/МеОН із співвідношенням від 98/2 до 95/5. Продукт 1А виділяють у формі білої твердої речовини (вихід 7,03 г, 88 %). -1 1Н-ЯМР в ДМСО-d6 (млн ): 1,38 (s, 9H); 2,29 (t, 4H); 3,30 (розширений s, 4H); 3,45 (s, 2H); 7,14 (t, 2H); 7,32 (dd, 2H). Приклад1Б 4-(4-Фторбензил)-піперазин Розчин трет-бутилового ефіру 4-(4фторбензил)-піперазин-1-карбонової кислоти (7,03 г, 23,8 ммоль) у толуолі (300 мл) обробляють трифтороцтовою кислотою (53,2 мл, 716 ммоль) при кімнатній температурі. Після струшування протягом 2 годин реакційну суміш розбавляють дихлорметаном, промивають 1 н содою і потім водою. Органічну фазу сушать над MgSO4, фільтрують і випаровують насухо. Неочищений продукт виділяють для проведення подальшої реакції (4,2 г, 90 %). Приклад 1 3-(2-Хлорфеніл)-1 -[4-(4-фторбензил)піперазин-1 -іл]-пропенон Розчин суміші 2-хлор-коричної кислоти (2,43 г, 13,3 ммоль) та 4-(4-фторбензил)-піперазину (2,16 г, 11,1 ммоль) у дихлорметані (70 мл) обробляють 11 96947 гідрохлоридом 1-(3-диметиламінопропіл)-3етилкарбодііміду (EDCI) (2,55 г, 13,3 ммоль) та 3окси-1,2,3-бензотриазин-4(3Н)-оном (НООВТ) у присутності DIEA (3,86 мл, 22,2 ммоль) при кімнатній температурі. Після струшування протягом 48 годин реакційну суміш розбавляють етилацетатом і промивають 1 н содою, потім водою. Органічну фазу сушать над MgSO4, фільтрують і випаровують насухо. Одержаний сироп очищають хроматографією на колонці з двоокисом кремнію та елюють сумішшю CH2Cl2/MeOH/NH4OH із співвідношенням 97,75/2/0,25. Продукт 1 виділяють у формі жовтого масла (3,77 г, 95 %). Цей продукт переводять в етилацетат та одержують його сіль додаванням розчину НСl в ефірі, одержуючи відповідний гідрохлорид у вигляді жовтої твердої речовини (4,14 г). -1 1Н-ЯМР в ДМСО-d6 (млн ): 3,02 (m, 2H); 3,21 (t, 1H); 3,63 (t, 1H); 4,05 (розширений s, 2Н); 4,34 (s, 2Н); 4,52 (t, 2Н); 7,32 (m, 3Н); 7,43 (m, 2Н); 7,53 Приклад R1 R2 R3 2 F H 4-F 3 Вr H 4-F 4 СІ H 4-Ме 12 (m, 1Н); 7,66 (m, 2Н); 7,92 (d, 1Н); 8,00 (m, 1H); 11,49 (s, 1H). + Мас-спектр (ESI+): m/z 359 (М + Н ) Елементний аналіз: С20Н20N2О1 НСІ та 0,5 Н2О Розраховане співвідношення (в %): С - 59,41; Н - 5,48; N-6,93 Дійсне співвідношення (в %): С - 59,39; Н 5,56; N-6,92 Приклади з 2 по 4 Сполуки з 2-ї по 4-у були синтезовані з коричних кислот І відповідних амінів відповідно до умов, описаних для синтезу сполуки 1. Назва сполуки 1-[4-(4-фторбензил)-піперазин-1-іл]-3(2-фторфеніл)-пропенон 3 -(2-бромфеніл)-1- [4-(4-фторбензил)піперазин-1-іл]-пропенон 3-(2-хлорфеніл)-1-[4-(4-метилбензил)піперазин-1-іл] -пропенон Приклад 5 3-(2,6-Дифторфеніл)-1-[4-(4-фторбензил)піперазин-1-іл]-пропенон Приклад 5 А Трет-бутиловий ефір 4-[3-(2,6-дифторфеніл)акрилоїл]-піперазин-1-карбонової кислоти Розчин 3-(2,6-дифторфеніл)-акрилоїл-хлориду (3,0 г, 14,8 ммоль) у дихлорметані (70 мл) у присутності PS-DIEA (4,07 г, 13,5 ммоль, 3,33 ммоль/г) обробляють трет-бутиловим ефіром піперазин-1карбонової кислоти (2,3 г, 12,3 ммоль) при кімнатній температурі. Після струшування протягом 6 годин реакційну суміш фільтрують, переводять в дихлорметан і промивають 1 н содою і водою. Органічну фазу сушать над MgSO4, фільтрують і випаровують насухо. Одержаний сироп очищають хроматографією на колонці з двоокисом кремнію та елюють сумішшю СН2Сl2/МеОН/NH4ОН із співвідношенням від 95/4,5/0,5 до 90/9,5/0,5. Продукт 5А виділяють у вигляді забарвленої твердої речовини (3,87 г, 89 %). -1 1Н-ЯМР в ДМСО-d6 (млн ): 1,42 (s, 9H); 3,37 (розширений s, 4H); 3,58 (розширений s, 4Н); 7,22 (m, 2Н); 7,50 (m, 1Н). Мас-спектр + (М+H ) 343 403 355 Приклад 5Б 3-(2,6-Дифторфеніл)-1-піперазин-1-ілпропенон Розчин трет-бутилового ефіру 4-[3-(2,6дифторфеніл)-акрилоїл]-піперазин-1-карбонової кислоти (3,87 г, 10,97 ммоль) у толуолі (50 мл) обробляють трифтороцтовою кислотою (30 мл, 395 ммоль) при кімнатній температурі. Після струшування протягом 2 годин реакційну суміш випаровують насухо, переводять в дихлорметан і промивають 1 н содою і потім водою. Органічну фазу сушать над MgSO4, фільтрують і випаровують насухо. Неочищений продукт виділяють для проведення подальшої реакції (2,3 г, 88 %). Приклад 5 3-(2,6-Дифторфеніл)-1-[4-(4-фторбензил)піперазин-1 -іл]-пропенон Розчин сполуки 5Б (100 мг, 0,42 ммоль) у дихлорметані (5 мл) у присутності триетиламіну (Et3N) (0,088 мл, 0,63 ммоль) обробляють 4-фторбензилбромідом (0,078 мл, 0,63 ммоль) при кімнатній температурі. Після струшування протягом 15 годин реакційну суміш розбавляють дихлорметаном і промивають водою. Органічну фазу сушать над MgSO4, фільтрують і випаровують насухо. Одержаний сироп очищають хроматографією на колонці з двоокисом кремнію та елюють сумішшю СН2Сl2/МеОН із співвідношенням від 100/0 до 90/10. Продукт 5 виділяють у вигляді світлобежевої твердої речовини (72 мг, 48 %). + Мас-спектр (ESI+): m/z 361 (М + Н ) 13 96947 14 Приклади з 6 по 12 Сполуки з 6-ї по 12-у були синтезовані з проміжної сполуки 5Б і відповідних бензилхлоридів або бромідів відповідно до умов, описаних для синтезу сполуки 5. Приклад R1 6 4-Ме 7 3-Ме 8 3-F 9 4-Сl 10 3-Ме 11 3-Сl 12 2-Ме Назва сполуки R2 3-(2,6-дифторфеніл)-1-[4-(4-метилбензил)-піперазин-1-іл]пропенон 3-(2,6-дифторфеніл)-1 -[4-(3,4-диметилбензил)-піперазин-1-іл]4-Ме пропенон 1-[4-(3,4-дифторбензил)-піперазин-1-іл]-3-(2,6-дифторфеніл)4-F пропенон 1 -[4-(4-хлорбензил)-піперазин-1 -іл]-3-(2,6-дифторфеніл)Н пропенон 3-(2,6-дифторфеніл)-1 -[4-(3-метилбензил)-піперазин-1-іл]Н пропенон 1-[4-(3-хлорбензил)-піперазин-1-іл]-3-(2,6-дифторфеніл)Н пропенон 3-(2,6-дифторфеніл)-1 -[4-(2-метилбензил)-піперазин-1-іл]Н пропенон Н Мас-спектр + (М + Н ) 357 371 379 377 357 377 357 Приклади з 13 по 21 Приклад 13А 3-(2-хлорфеніл)-1-піперазин-1-іл-пропенон Сполука 13А була одержана в 2 стадії з 3-(2хлорфеніл)-акрилоїл-хлориду згідно з умовами, описаними для синтезу сполуки 5Б. Приклади з 13 по 21 Сполуки з 13-ї по 21-у були синтезовані з проміжної сполуки 13 А згідно з умовами, описаними для синтезу сполуки 5. Приклад R1 R2 13 3-Ме H 14 4-Сl H 15 2-F H 16 2-Ме H 17 2-Сl H 18 3-F H 19 3-Сl H 20 2-F 3-F 21 3-F 4-F Назва сполуки 3-(2-хлорфеніл)-1-[4-(3-метилбензил)-піперазин-1 -іл] пропенон 1 -[4-(4-хлорбензил)-піперазин-1 -іл]-3-(2-хлорфеніл)пропенон 3-(2-хлорфеніл)-1 -[4-(2-фторбензил)-піперазин-1 -іл]пропенон 3-(2-хлорфеніл)-1-[4-(2-метилбензил)-піперазин-1 -іл]пропенон 1 - [4-(2-хлорбензи л)-піперазин-1 -іл] -3 -(2 -хлорфеніл)пропенон 3-(2-хлорфеніл)-1 -[4-(3-фторбензил)-піперазин-1 -іл]пропенон 1 - [4-(3 -хлорбензил)-піперазин-1 -іл] -3 -(2-хлорфеніл)пропенон 3 -(2-хлорфеніл)-1 - [4-(2,3 -дифторбензил)-піперазин-1 -іл] пропенон 3-(2-хлорфеніл)-1 -[4-(3,4-дифторбензил)~ піперазин-1 -іл] пропенон Мас-спектр + (М + Н ) 355 375 359 355 375 359 375 377 377 15 96947 Приклад 22 3-(2,6-Дифторфеніл)-1-[4-(2-фторбензил)піперазин-1-іл]-пропенон Розчин суміші проміжної сполуки 5Б (60 мг, 0,25 ммоль) і 2-фтор-бензальдегіду (0,031 мл, 0,3 ммоль) у дихлорметані (3 мл) у присутності оцтової кислоти (0,057 мл, 1,0 ммоль) обробляють MPBH3CN (117 мг, 0,275 ммоль, 2,35 ммоль/г) при кімнатній температурі. Після струшування протягом 24 годин реакційну суміш фільтрують через картридж ChemElut, заздалегідь просочений 1 н NaOH, і потім випаровують насухо. Одержаний сироп очищають хроматографією на колонці з двоокисом кремнію та елюють сумішшю СН2Сl2/МеОН із співвідношенням від 100/0 до 95/5. Продукт 22 виділяють у вигляді жовтого сиропу (23 мг, 25 %). + Мас-спектр (ESI+): m/z 361 (М + Н ) Приклад 23 1-[4-(2-Фторбензил)-піперазин-1-іл]-3-(2нітрофеніл)-пропенон 16 Сполука 23А була одержана в 2 стадії з 3-(2нітрофеніл)-акрилоїл-хлориду згідно з умовами, описаними для синтезу сполуки 5Б. Приклад 23 1 -[4-(2-Фторбензил)-піперазин-1 -іл] -3 -(2нітрофеніл)-пропенон Сполука 23 була синтезована із сполуки 23А згідно з умовами, описаними для синтезу сполуки 22. + Мас-спектр (ESI+): m/z 370 (М + H ) Приклад 24 1 -(4-Циклогексилметил-піперазин-1-іл)-3-(2,6дифторфеніл)-пропенон Сполука 24 була синтезована із сполуки 5Б згідно з умовами, описаними для синтезу сполуки 22. + Мас-спектр (ESI+): m/z 349 (М + Н ) Приклади з 25 по 28 Сполуки з 25-ї по 28-у були синтезовані з 1циклогексилметил-піперазину і відповідних коричних кислот згідно з умовами, описаними для синтезу сполуки 1. Приклад 23А 3-(2-Нітрофеніл)-1 -піперазин-1 -іл-пропенон Приклад R1 R2 25 NO2 H 26 CN H 27 F H 28 СІ H Назва сполуки 1 -(4-циклогексилметил-піперазин-1 -іл)-3-(2нітрофеніл)-пропенон 2-[3-(4-циклогексилметил-піперазин-1-іл)-3оксо-пропеніл] -бензонітрил 1 -(4-циклогексилметил-піперазин-1 -іл)-3-(2фторфеніл)-пропенон 3-(2-хлорфеніл)-1 -(4-циклогексилметилпіперазин- 1 -іл)-пропенон Приклади з 29 по 33 Сполуки з 29-ї по 33-ю були синтезовані із сполуки 23А і відповідних бензилхлоридів або бромідів згідно з умовами, описаними для синтезу сполуки 5. Мас-спектр + (М +H ) 358 338 331 347 17 96947 Приклад R1 R2 29 4-F H 30 4-Ме Н 31 3-F 4-F 32 4-Сl Н 33 3-Ме Н 18 Назва сполуки 1 -[4-(4-фторбензил)-піперазин-1 -іл]-3-(2нітрофеніл)-пропенон 1 -[4-(4-метилбензил)-піперазин-1 -іл]-3-(2-нітрофеніл)пропенон 1-[4-(354-дифторбензил)-піперазин-1-іл]-3-(2-нітрофеніл)пропенон 1 - [4-(4-хлорбензил)-піперазин-1 -іл] -3 -(2-нітрофеніл)пропенон 1 -[4-(3 -метилбензил)-пшеразин-1 -іл] -3 -(2-нітрофеніл)пропенон Приклад 34 1 -[4-(2,6-Диметилбензил)-піперазин-1 -іл]-3-(2нітрофеніл)-пропенон Мас-спектр + (М +H ) 370 366 388 386 366 ють сумішшю СН2Сl2/МеOН із співвідношенням від 100/0 до 90/10 (+ 10 % NH4OH). Продукт 34 виділяють і потім одержують його сіль додаванням НСl в ефірі, що дає білу тверду речовину (40 мг, 40 %). + Мас-спектр (ESI+): m/z 380 (М + Н ) Приклади з 35 по 38 Сполуки з 35-ї по 38-у були синтезовані із сполук 5Б, 13А та 23А і відповідних фенетил-хлоридів або бромідів згідно з умовами, описаними для синтезу сполуки 5. Розчин суміші сполуки 23А (70 мг, 0,27 ммоль) і 2,5-диметил-бензальдегіду (40 мг, 0,32 ммоль) у дихлоретані (3 мл) у присутності оцтової кислоти (0,092 мл, 1,6 ммоль) обробляють NaBH(OAc)3 (63 мг, 0,297 ммоль) при кімнатній температурі. Після струшування протягом 24 годин реакційну суміш обробляють насиченим розчином NaHCO3 (2 мл), фільтрують через картридж ChemElut і випаровують насухо. Одержаний сироп очищають хроматографією на колонці з двоокисом кремнію та елюПриклад R1 R2 R3 35 F F H 36 NO2 H H 37 Cl H H 38 Cl H 4-F Назва сполуки 3-(2,6-дифторфеніл)-1 -(4-фенетилпіперазин-1 -іл)-пропенон 3-(2-нітрофеніл)-1 -(4-фенетил-піперазин1-іл)-пропенон 3-(2-хлорфеніл)-1 -(4-фенетил-піперазин1-іл)-пропенон 3-(2-хлорфеніл)-1 - {4-[2-(4-фторфеніл)етил] -піперазин-1 -іл} -пропенон Похідні згідно з даним винаходом є антагоністами рецепторів PAR-1, оскільки описані нижче результати дослідів на моделях показують наступне. У багатьох типах клітин активація рецепторів PAR-1 пептидом SFLLR (селективним агоністом PAR-1) запускає внутрішньоклітинний сигнальний каскад, що призводить до вивільнення кальцію ендоплазматичним ретикулумом. Клітини яєчників китайського хом'яка (СНО) стійко експресують рецептор PAR-1. У цій лінії клітин вивільнення кальцію слідом за активацією рецепторів PAR-1 пептидом SFLLR вимірюють методом флуориметричної методики (флуориметричний пристрій візуалізації для зчитування планшетів, або FLIPR) з використанням селективного датчика кальцію (Fluo-3АМ). Випромінювання флуоресценції з фармакологічної точки зору пропорційно ефективності PAR-1 агоні Мас-спектр + (М + Н ) 357 366 355 373 ста та його концентрації. Сполуки, описані в даному винаході, показали, що вони здатні виступати як антагоністи PAR-1 рецепторів і таким чином знижувати виділення кальцію, спричинене агоністом. Матеріали: Культуральне середовище: середовище Хема F-12 (Ham R.G. // Proc. Natl. Acad. Sci. 1965. Т. 53. С. 288) з домішкою 10 % сироватки коров'ячого плоду та антибіотика (пробенецид, 2,5 мМ). Флуоресцентний зонд: Fluo-3АМ 4 мкМ (Teflabs, Austin, Texas, USA). Агоніст: SFLLR-NH2 (серин, фенілаланін, лейцин, лейцин, аргінін). Методи: Клітини СНО інокулювали в планшети на 96 комірок (60 000 клітин в кожну комірку) у присутності 200 мкл культурального середовища та інкубу 19 96947 вали протягом 24 годин. Клітини інкубували з флуоресцентним зондом на кальцій протягом 1 години при 37C. Потім клітини промивали протягом 10 хв., після чого вимірювали сигнал. Після цього вводили антагоніст PAR-1 (концентрації від 0,01 мкМ до 10 мкМ). Планшети поміщали в FLIPR (Molecular Devices, UK) для вимірювання флуоресценції кальцію при двох довжинах хвиль (488 нм та 540 нм: Sullivan et al. II Calcium Signaling Protocols. 1999. C. 125-136). Вимірювання проводили за 5 хв. до додавання антагоніста і протягом 10 хв. після його введення. У 4 різних комірках вимірювали максимум флуоресценції, віднімаючи базову лінію. Тест проводили при двох повторюваностях. За цих умов похідні згідно з даним винаходом були ідентифіковані як антагоністи рецепторів PAR-1 (заглушення сигналу кальцію більше 60 % при 10 мкМ). Для агоніста SFLLR були одержані дозові залежності (у діапазоні від 0,01 мкМ до 32 мкМ), що дозволило визначити ефективну концентрацію, яка дає 50 % від максимального ефекту (EC50). Сила (рА2) деяких з антагоністів PAR-1, описаних у даному винаході, була розрахована за методом Arunlakshana and Schild (Brit. J. Pharmacol. 1959. T. 14. C. 48-58) по зсувах ЕС50, які спостерігаються при трьох концентраціях. Результати: Декілька наведених далі прикладів, вибраних із сполук згідно з даним винаходом, ілюструють повністю неочікувану здатність цих сполук виступати антагоністами рецепторів PAR-1. Приклади 1 2 3 4 8 10 15 25 28 29 рА2 6,42 6,50 6,36 6,05 6,32 6,46 6,39 6,78 6,12 6,98 Заглушення агрегації тромбоцитів in vivo і протитромбозна активність антагоністів PAR-1 була продемонстрована у морських свинок на моделі артеріального тромбозу, який дає дуже високий стрес внаслідок гемодинамічного зсуву. У вистілці судин пошкодження ендотелію викликає внутрішньосудинне утворення багатого на тромбоцити тромбу, який поступово перекриває весь просвіт судини. Процес агрегації тромбоцитів у сильному ступені активується тромбіном за участю рецепторів PAR-1. Було продемонстровано, що описані в даному винаході сполуки здатні бути антагоністами рецепторів PAR-1 і таким шляхом затримувати утворення тромбу. Матеріали: Дослідження проведені на морських свинках (їх рецептори PAR-1 подібні до рецепторів людини). Опромінення зеленим світлом лазера у присутності фотосенсибілізуючого агента (внутрішньовенно введений барвник Бенгальська троянда) 20 ушкоджує епітелій сонної артерії. Швидкість протікання крові через сонну артерію визначають кількісно за допомогою зонда Transonic flow. Вимірюється час, необхідний для повного перекриття сонної артерії (швидкість протікання дорівнює 0). Методи: Після усипляння тварини (фенобарбітал 60 мг/кг) висікають 5 мм ділянку сонної артерії і в 4 мм над артерією поміщають лазер. Зонд для визначення швидкості протікання, розміщений в напрямку вгору, дозволяє виміряти час перекриття судини. Бенгальську троянду (20 мг/кг) вводять внутрішньовенно, і судину опромінюють протягом 3 хв. при довжині хвилі 514 нм. Антагоністи PAR-1 вводять внутрішньовенно болюсно (протягом 2 хв. безпосередньо перед введенням Бенгальської троянди), за цим йде 15-хвилинна перфузія, яка починається при включенні лазера. Результати: Було встановлено, що деякі сполуки, описані в даному винаході, здатні після внутрішньовенного введення в дозах від 0,16 мг/кг до 2,5 мг/кг збільшувати час до утворення тромбу на величину від 5 % до 135 % в порівнянні з тваринами, яким вводили плацебо. Похідні згідно з даним винаходом корисні також для лікування фібриляції передсердь. В випадку постінфарктного переповнювання серцевої порожнини, праве і ліве вушко передсердя розширюються, і це створює основу для виникнення фібриляції передсердь. Порушення гомеостазу в порожнині розширеного вушка передсердя пацієнта, страждаючого на фібриляцією передсердь, призводить до підвищеної концентрації тромбіну. Заявники продемонстрували, що накопичення тромбіну відповідальне за регуляцію із стимуляцією PAR-1, які можуть запускати проліферацію фібробластів, а також утворення тромбоцитного тромбу. Тому, відповідно до механізму їх дії, антагоністи PAR-1 можуть запобігати розширенню передсердя, проліферації фібробластів та утворенню тромбів у вушку передсердя пацієнта, страждаючого на фібриляцією передсердь. В результаті антагоніст PAR-1 забезпечує ефективну профілактичну і/або лікувальну дію у випадку фібриляції передсердь. Описані в даному винаході сполуки показали, що вони здатні служити антагоністами рецепторів PAR-1 і запобігати розширенню передсердя. Матеріали: Дослідження проводять на шурах-самцях. Для дослідів були вибрані щури з вагою в діапазоні 180-200 г при надходженні, оскільки вони краще переносять хірургічну операцію. Вимірювання різних порожнин міокарду виконують за допомогою ехокардіографії у приспаної тварини. Методи: Тварин усипляють сумішшю 3,5 % ізофлурану в кисні (Aerrane, Baxter Laboratories). На рівні четвертого міжхребцевого просвіту у бік лівої передньої лапи проводять перпендикулярно грудині торакотомію розміром приблизно 2 см. Навколо лівої вінцевої артерії на відстані 1 мм від її початку накладають лігатуру (шовк 4-0, голка СС1). Хірургіч 21 ним способом навколо лівої вінцевої артерії зав'язують вузол, достатньо тугий для повного перекриття судини. Електрокардіограма, що безперервно реєструється, дозволяє перевіряти правильне розміщення лігатури. Через 2 місяці після операції тварин знову усипляють для вимірювання ехокардіографії методом імпульсної доплерографії серцевих порожнин і швидкості протікання крові в міокарді. На закінчення тварин умертвляють передозуванням фенобарбіталу натрію (160 мг/кг внутрішньобрюшинно) для проведення різних гістологічних досліджень. Тваринам насильно згодовували щодня продукти-антагоністи PAR-1, починаючи з 24 годин після утворення інфаркту і до сакрифікації. Результати: Було встановлено, що деякі сполуки, описані в даному винаході, здатні при пероральному введенні в дозах від 10 до 100 мг/кг/день протягом 60 днів знижувати на 20-90 % поверхню вушка передсердя в порівнянні з тваринами, що не піддавалися впливу. Даний винахід стосується також фармацевтичних композицій, які містять як активний інгредієнт сполуку загальної формули (І) або її фармацевтично прийнятну сіль, змішані або поєднані з підходящим наповнювачем. Такі композиції можуть, наприклад, мати форму твердих або рідких композицій, емульсій, лосьйонів або кремів. Як тверді композиції для перорального введення можуть бути використані таблетки, пілюлі, порошки (у желатинових капсулах або в пакетиках) або гранули. У таких композиціях активний інгредієнт згідно з даним винаходом змішують з одним або більше з інертних розріджувачів - таких, як крохмаль, целюлоза, сахароза, лактоза або окис кремнію, в потоці аргону. Такі композиції можуть також включати інші, ніж розріджувачі, речовини, наприклад: одну або більше із змащувальних речовин - таких, як стеарат магнію або тальк, барвник, покриття (для покритих цукром пілюль) або глазур. Як рідкі композиції для перорального введення можуть бути використані наступні: фармацевтично прийнятні розчини, суспензії, емульсії, сиропи та еліксири, які містять інертні розчинники - такі, як вода, етанол, гліцерин, рослинні олії або рідкий парафін. Такі композиції можуть включати інші, ніж розріджувачі, речовини, наприклад: зволожуючі, підсолоджуючі, загущаючі, ароматизуючі або стабілізуючі засоби. Стерильні композиції для парентерального введення можуть переважно бути водними або неводними розчинами, суспензіями або емульсіями. Як розчинник або носій може бути використане Комп’ютерна верстка А. Крижанівський 96947 22 наступне: вода, пропілен-гліколь, поліетиленгліколь, рослинні олії, зокрема оливкова олія, придатні для ін'єкції органічні ефіри, наприклад етилолеат, або інші підходящі органічні розчинники. Такі композиції можуть також містити домішки, зокрема зволожуючі засоби, ізотонічні засоби, емульгатори, диспергуючі засоби і стабілізатори. Стерилізацію можна також здійснювати різними шляхами, наприклад: стерилізуючою фільтрацією, введенням в композицію стерилізуючих засобів, опроміненням або нагріванням. Такі композиції можуть бути також приготовані у формі стерильних твердих композицій, які можуть бути безпосередньо перед застосуванням розчинені в стерильній воді або у будь-якому іншому придатному для ін'єкцій стерильному середовищі. Композиції для ректального введення являють собою супозіторії або ректальні капсули, які містять, окрім активного продукту, наповнювачі, такі як олія какао, напівсинтетичні гліцериди або поліетиленгліколі. Композиції для місцевого введення можуть являти собою, наприклад, креми, лосьйони, очні краплі, ополіскувачі для рота, краплі в ніс або аерозолі. Дози залежать від бажаного ефекту, тривалість лікування та шляху введення і звичайно лежать в діапазоні від 0,001 г до 1 г (переважно - від 0,005 г до 0,75 г) в день, переважно - при оральному шляху введення дорослим людям, при цьому разові дози варіюють від 0,1 мг до 500 мг активної речовини. Звичайно підходяще дозування визначає лікуючий лікар залежно від віку, ваги пацієнта та інших специфічних факторів у кожному конкретному випадку. Згідно з особливим варіантом здійснення даний винахід також стосується продуктів, які містять сполуку загальної формули (І) та інший серцевосудинний агент, тобто комбінованих продуктів для одночасного, роздільного або відстроченого за часом використання для лікування серцевосудинних захворювань, причому інший серцевосудинний агент може бути антитромбоцитарним засобом, таким як аспірин, клопідогрел, тиклопідин, абциксимаб, тирофібан або ептифібатид. Згідно з додатковими ознаками даного винаходу, сполуки загальної формули (І) придатні для застосування для виготовлення ліків, призначених для інгібування проліферації клітин гладких м'язів (рестенозу) і/або для лікувальної і/або профілактичної дії на проліферацію ендотеліальних, фібробластних, кардіофібробластних, гліальних клітин, клітин гладких м'язів або ракових клітин. Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCinnamoyl-piperazine derivatives and their use as par-1 antagonists
Автори англійськоюPerez Michel, Lamothe Marie, Grand Bruno Le, Letienne Robert
Назва патенту російськоюПроизводные циннамоил-пиперазина и их применение как антагонистов par-1
Автори російськоюПерес Мишель, Ламот Мари, Ле Гран Бруно, Летьен Робер
МПК / Мітки
МПК: A61K 31/4965, A61P 9/00, C07D 295/18
Мітки: антагоністів, цинамоїл-піперазину, par-1, застосування, похідні
Код посилання
<a href="https://ua.patents.su/11-96947-pokhidni-cinamol-piperazinu-ta-kh-zastosuvannya-yak-antagonistiv-par-1.html" target="_blank" rel="follow" title="База патентів України">Похідні цинамоїл-піперазину та їх застосування як антагоністів par-1</a>
Попередній патент: Спосіб створення багатовимірних градуювальних моделей
Наступний патент: Вакцина, яка містить бактерії, які є збудником верхніх дихальних шляхів і статевих шляхів курчат
Випадковий патент: Спосіб уловлювання відходів лакофарбових матеріалів