N-заміщені 3-карбоксамідо-9,9-циклогексил-4,5,6,7,8,9-гексагідро-1,2,3-триазоло[3,4-b]хіназоліни і спосіб їх одержання
Номер патенту: 97933
Опубліковано: 26.03.2012
Автори: Гладков Євгеній Станіславович, Афанасіаді Людмила Михайлівна, Десенко Сергій Михайлович, Сірко Світлана Миколаївна
Формула / Реферат
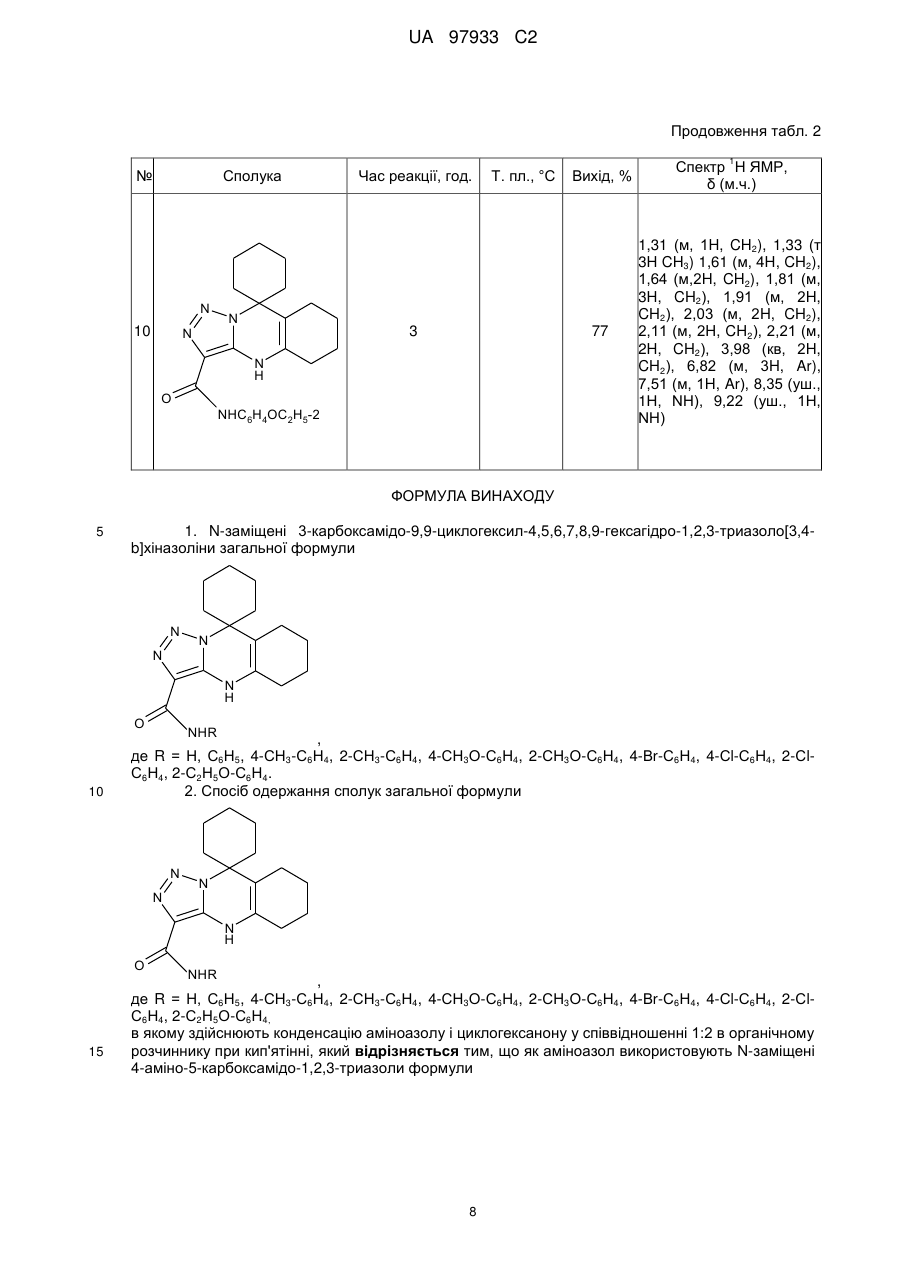
1. N-заміщені 3-карбоксамідо-9,9-циклогексил-4,5,6,7,8,9-гексагідро-1,2,3-триазоло[3,4-b]хіназоліни загальної формули
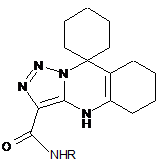 ,
,
де R = Н, С6Н5, 4-СН3-С6Н4, 2-СН3-С6Н4, 4-СН3О-С6Н4, 2-СН3О-С6Н4, 4-Вr-С6Н4, 4-Сl-С6Н4, 2-Сl-С6Н4, 2-С2Н5О-С6Н4.
2. Спосіб одержання сполук загальної формули
 ,
,
де R = Н, С6Н5, 4-СН3-С6Н4, 2-СН3-С6Н4, 4-СН3О-С6Н4, 2-СН3О-С6Н4, 4-Вr-С6Н4, 4-Сl-С6Н4, 2-Сl-С6Н4, 2-С2Н5О-С6Н4,
в якому здійснюють конденсацію аміноазолу і циклогексанону у співвідношенні 1:2 в органічному розчиннику при кип'ятінні, який відрізняється тим, що як аміноазол використовують N-заміщені 4-аміно-5-карбоксамідо-1,2,3-триазоли формули
 ,
,
як розчинник - етиловий спирт, конденсацію проводять протягом 2,5-3 годин до утворення цільового продукту.
Текст
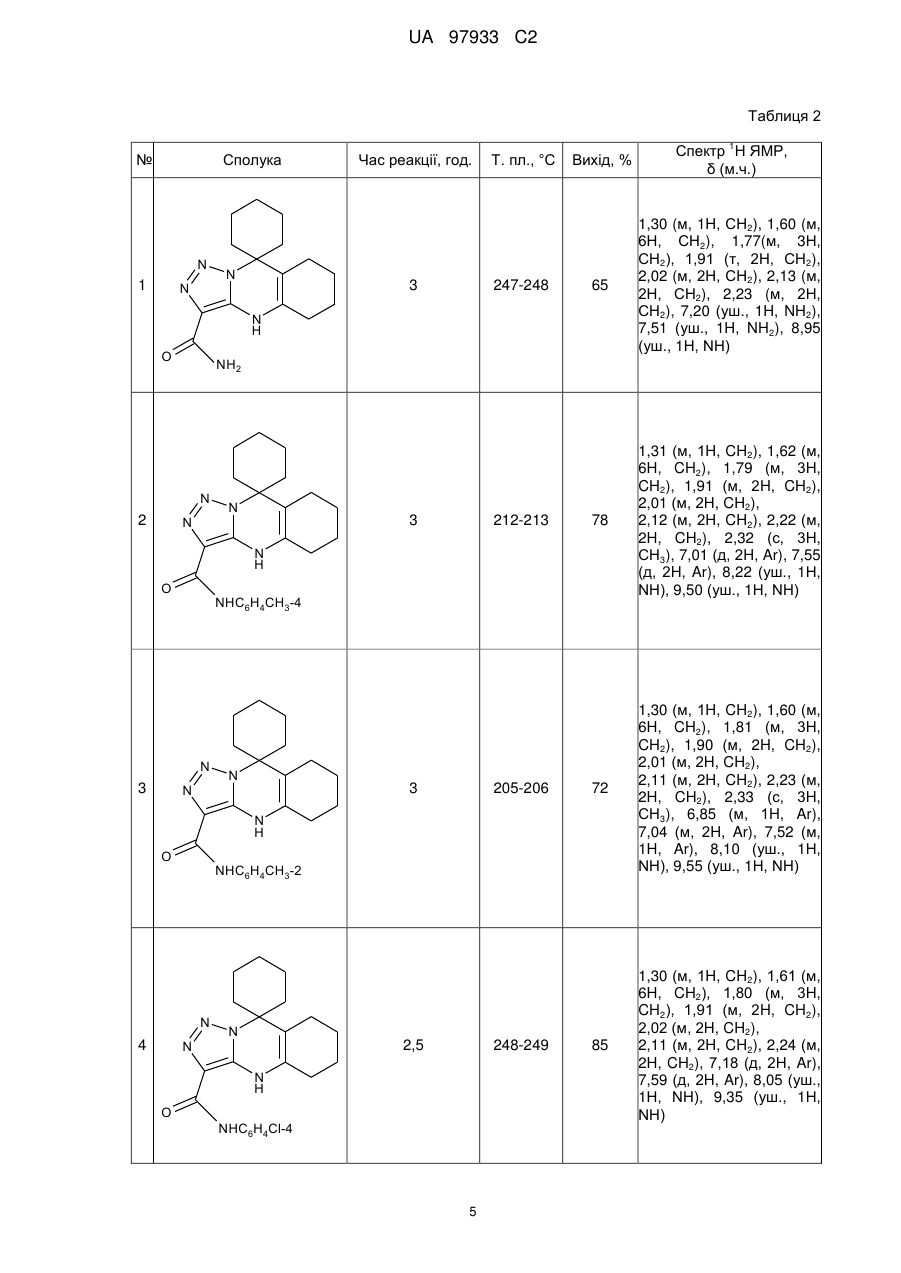
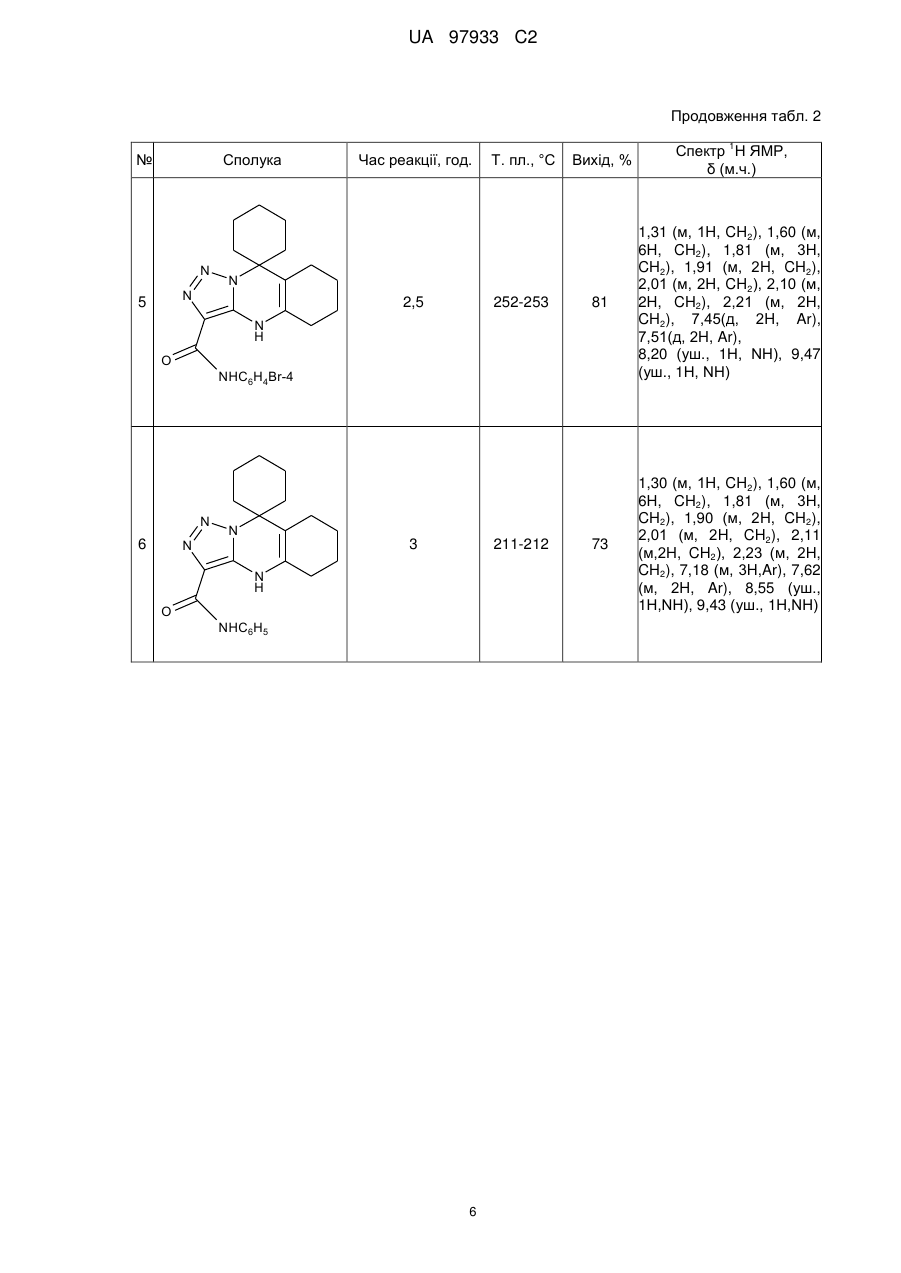
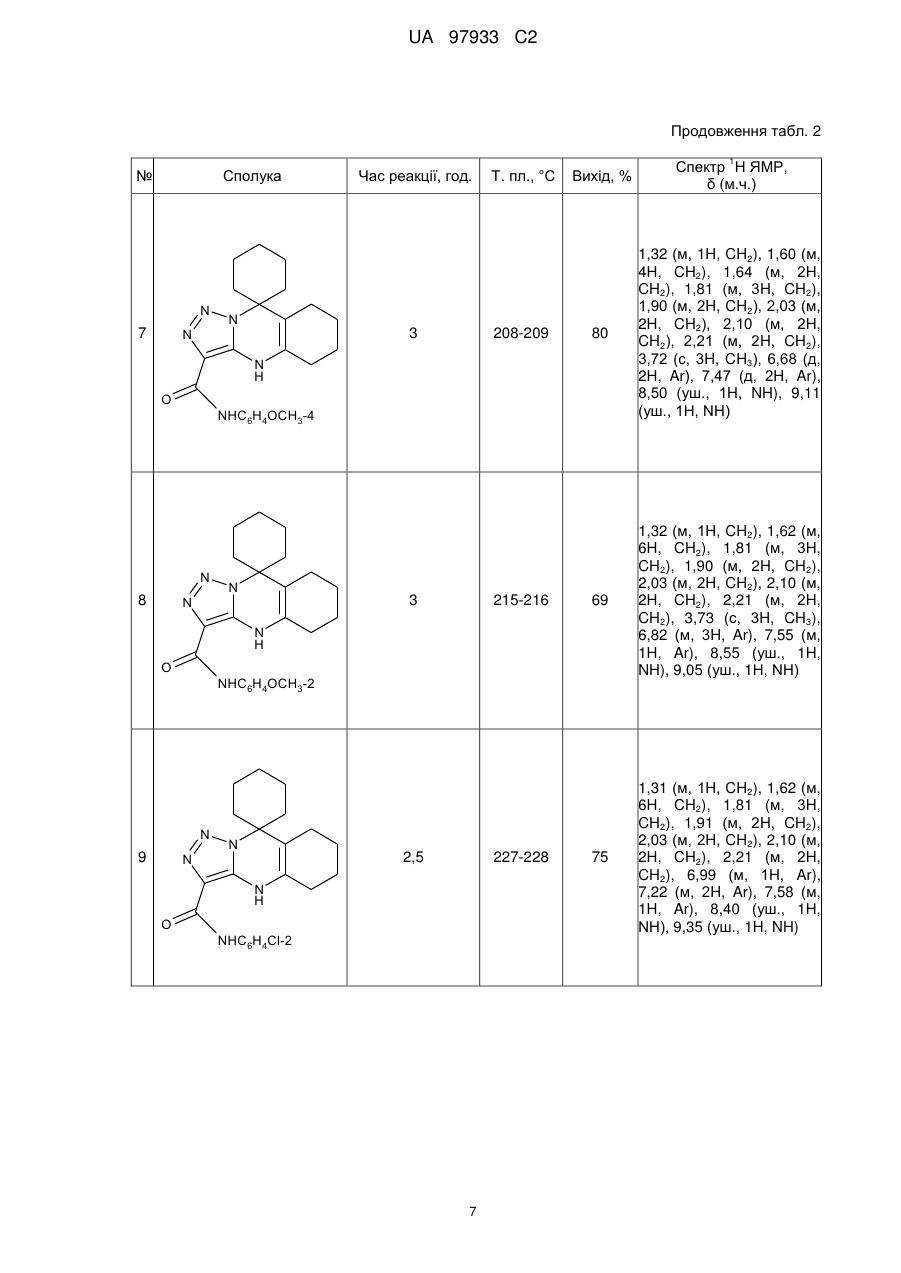
Реферат Пропонуються нові заміщені 3-карбоксамідо-9,9-циклогексил-4,5,6,7,8,9-гексагідро-1,2,3триазоло[3,4-6]хіназоліни формули N N N N H O NHR , де R = Н, С6Н5, 4-СН3-С6Н4, 2-СН3-С6Н4, 4-СН3О-С6Н4, 2-СН3О-С6Н4, 4-Вr-С6Н4, 4-Сl-С6Н4, 2-СlС6Н4, 2-С2Н5О-С6H4, і спосіб їх одержання, що включає конденсацію 4-аміно-5-карбоксамідо-1,2,3-триазолу і циклогексанону у співвідношенні 1:2 в етиловому спирті. Конденсацію проводять протягом 2,5-3 годин при кип'ятінні до утворення відповідного цільового продукту. Технічне рішення дозволяє зменшити тривалість процесу, підвищити якість сполук І і їх виходи реакції, забезпечує створення широкого набору похідних азолохіназолінів для медицини, біології, фармації, сільського господарства і т. ін. N N N N H O NHR UA 97933 C2 Винахід стосується галузі хімії і надає нові N-заміщені азолохіназоліни - 3-карбоксамідо-9,9циклогексил-4,5,6,7,8,9-гексагідро-1,2,3-триазоло[3,4-b]хіназоліни загальної формули І N N N N H O 5 10 15 NHR , I де R = Н, С6Н5, 4-СН3-С6Н4, 2-СН3-С6Н4, 4-СН3О-С6Н4, 2-СН3О-С6Н4, 4-Вr-С6Н4, 4-Сl-С6Н4, 2-СlС6Н4, 2-С2Н5О-С6Н4. Наявність фармакофорних фрагментів обумовлює перспективність пошуку у низці сполук формули І речовин з різними видами фізіологічної активності, що робить їх корисними з точки зору медичної і фармакологічної хімії. Крім того, сполуки формули І використовуються як модельні сполуки для вивчення структурних властивостей і синтетичних можливостей частково гідрованих гетероциклів. Вони діють як антагоністи аденозину [Burnstock G., Trends Pharmacol. Sci. 27, 166 (2006)], мають антигіпертензивну активність [Alagarsamy V., Pathak U., Bioorgan. Med. Chem., 15, 3457 (2007); Liu К., Hu М., Arch. Pharm. 319, 188 (1986)]; використовуються як больові рецептори, які беруть участь у регуляції поведінок мозку [Mustazza С., Borioni Α. et al., Chem. Pharm. Bull, 54, 611 (2006)]. Відомий структурний аналог сполук, що заявляються, 2-заміщений 5,6,7,8-тетрагідро-4'Нспіро[циклогексан-1,9'-[1,2,4]триазоло[5,1-b]хіназолін] формули II і спосіб його одержання [Chernishev V., Khoroshkin D. et al., J. Heterocycl. Chem., 45, 1419 (2008)] N N R N 20 25 N H , II де R = H, NH2, C6H5, морфолінілкарбоніл. Недоліком структури формули II є те, що замісники вводяться безпосередньо у триазольний фрагмент (3-R-заміщені). Залежно від електронної природи замісника видозмінюється не тільки хімічна структура сполук, але і її властивості. Так, вільна електронодонорна аміногрупа у триазолохіназоліні в агресивних середовищах може утворювати різні солі, що не дозволяє говорити не тільки про стабільність хімічної структури формули II, але і про постійність властивостей, які проявляє ця структура в таких умовах. Спосіб одержання відомого аналога формули II здійснюється за схемою: N N N R N N R + O N N H NH2 II 30 . Суміш рівномолярних кількостей 3-R-заміщених 5-аміно-1,2,4-триазолу і 2циклогексиліденциклогексанону нагрівають у диметилформаміді протягом 2 годин, розбавляють етанолом і охолоджують до кімнатної температури. Осад, що утворився, відфільтровують і перекристалізовують із етанолу або суміші диметилформаміду і етанолу. Виходи складають 5682 %. 1 UA 97933 C2 5 10 Одним із недоліків способу одержання відомого аналога формули II є використання 2циклогексиліденциклогексанону, який не є стабільним при зберіганні при кімнатній температурі і потребує перегонки під вакуумом перед введенням в реакцію. До недоліків способу одержання сполук формули II слід віднести також невисокі виходи реакції (56-60 %, лише одна сполука має вихід 82 %), необхідність очистки речовин, що здорожує відомий спосіб одержання. Після додаткової перекристалізації виходи цільових продуктів складатимуть ~ 45-59 %. Диметилформамід, що використовують для перекристалізації та як середовище для проведення реакції, має місцеву подразнювальну (на слизові оболонки верхніх дихальних шляхів, очей і шкіру) і загальну токсичну дію. Викликає порушення дихання і кровообігу. Крім того, спосіб одержання не екологічний - диметилформамід забруднює стічні води. Відомий структурний аналог сполук, що заявляються, - похідне триазолохіназоліну формули III, і спосіб його одержання [Десенко С. М., Орлов В. Д., Эстрада X., Химия гетероцикл. соедин., № 7, 999 (1990)]. N N R N 15 N H , III де R = H, NH2. Недоліком структури відомого аналога III є те, що замісники (як і у структурного аналога II) введено безпосередньо у триазольний фрагмент. Авторами одержано лише дві сполуки. Спосіб одержання сполуки формули III здійснюється в одну стадію за схемою: O N N N +2 R N 20 25 30 -H2O NH2 N N H . При кип'ятінні суміші одного моля 3-аміно-1,2,4-триазолу і 2-х молів циклогексанону у диметилформаміді протягом 4-6 годин утворюються сполуки відомого аналога формули III з виходами 54-57 %. До недоліків способу одержання сполук формули III слід віднести тривалість синтезу, що приводить до додаткових витрат робочого часу і енерговитрат; використання як середовища для проведення реакції диметилформаміду; низькі виходи цільових продуктів. Як прототип за технічною суттю до сполук, що заявляються, вибрано останній із наведених аналогів. В основу винаходу поставлено задачу пошуку нових сполук у низці похідних 3-карбоксамідо9,9-циклогексил-4,5,6,7,8,9-гексагідро-1,2,3-триазоло[3,4-b]хіназоліну з варіацією замісників у карбоксамідному угрупуванні, а також розробка простого способу їх одержання, що дозволяє скоротити час синтезу, підвищити вихід реакції, використовувати нетоксичний розчинник як середовище для проведення реакції. Рішення поставленої задачі забезпечується розробкою нових N-заміщених 3-карбоксамідо9,9-циклогексил-4,5,6,7,8,9-гексагідро-1,2,3-триазоло[3,4-b]хіназолінів - сполук формули І N N N N H O 35 N R NHR , I 2 UA 97933 C2 5 де R = Н, С6Н5, 4-СН3-С6Н4, 2-СН3-С6Н4, 4-СН3О-С6Н4, 2-СН3О-С6Н4, 4-Вr-С6Н4, 4-Сl-С6Н4, 2-СlС6Н4, 2-С2Н5О-С6Н4. Рішення поставленої задачі забезпечується також тим, що у способі одержання Nзаміщених 3-карбоксамідо-9,9-циклогексил-4,5,6,7,8,9-гексагідро-1,2,3-триазоло[3,4-b]хіназолінів загальної формули І, що включає конденсацію аміноазолу і циклогексанону у співвідношенні 1:2 в органічному розчиннику при кип'ятінні, згідно з винаходом, як аміноазол використовують Nзаміщені 4-аміно-5-карбоксіамідо-1,2,3-триазоли формули N N NH NH2 O 10 15 20 25 30 35 NHR , як розчинник - етиловий спирт, конденсацію проводять протягом 2,5-3 годин до утворення цільового продукту. Вибір компонентів реакції конденсації - N-заміщених 4-аміно-5-карбоксіамідо-1,2,3триазолів, і розчинника для реакції - етилового спирту, дозволяє скоротити синтез до 2,5-3 годин і одержувати чисті сполуки формули із високим виходом без застосування додаткової перекристалізації. Експериментальним шляхом встановлено, що використання як розчинника етилового спирту у процесі синтезу сполук, що заявляються, сприяє м'якому протіканню реакції і одержанню відразу чистих продуктів, що, в свою чергу, дозволяє підвищувати вихід і якість цільових продуктів, знизити виатрати робочого часу. До такого позитивного ефекту приводить вдала заміна диметилформаміду (як у способі-прототипі) етиловим спиртом (як у способі, що заявляється). Подовження ланцюга спряження у молекулах сполук формули І сприяє появі нових властивостей у сполук цієї структури. Так, введення пептидного фрагмента у 5-положення Nзаміщених 4-аміно-1,2,3-триазолів надає їм подібність до білкових структур, що може відбитися на появі нових фізіологічних властивостей у речовин. Карбоксамідне угрупування у сполуках, що заявляються, інертне до дії агресивних реагентів, що забезпечує стійкість в таких умовах. Можливість модифікації хімічної структури сполук І шляхом варіювання арильного радикала, зв'язаного безпосередньо з карбоксамідною групою (фрагмент CONH-R) дозволяє одержувати більш широкий асортимент нових перспективних фізіологічно активних речовин в ряді похідних азолохіназолінів. Проведення реакції у умовах, що заявляються, забезпечує високу швидкість її протікання, що приводить до зменшення тривалості технологічного процесу до 2,5-3 годин (у способіпрототипі 4-6 годин). Збільшення часу кип'ятіння реакційної маси недоцільне, оскільки за цей проміжок часу реакція утворення цільових продуктів проходить повністю. У таблиці 1 наведено порівняльні дані способу, що заявляється, і способів одержання відомих аналогів. У таблиці 2 надано характеристики сполук формули І, що заявляються. Спосіб одержання N-заміщених 3-карбоксамідо-9,9-циклогексил-4,5,6,7,8,9-гексагідро-1,2,3триазоло[3,4-6]хіназолінів здійснюється за схемою: O N N NH N +2 N NH2 O 40 N N H NHR O NHR . Суміш 0,1 моль 4-аміно-5-карбоксамідо-1,2,3-триазолу і 0,2 моль циклогексанону у 100 мл етанолу кип'ятять протягом 2,5-3 годин. Реакційну масу охолоджують до кімнатної температури, фільтрують, промивають осад етанолом. Вихід складає 65-85 %. 3 UA 97933 C2 5 10 15 20 25 30 35 40 45 Нижче наведено приклади конкретного виконання синтезу N-заміщених 3-карбоксамідо-9,9циклогексил-4,5,6,7,8,9-гексагідро-1,2,3-триазоло[3,4-b]хіназолінів. Приклад 1. Одержання 3-карбоксамідо-9,9-циклогексил-4,5,6,7,8,9-гексагідро-1,2,3триазоло[3,4-b]хіназоліну (табл. 2, поз. 1) 12,7 г (0,1 моль) 4-аміно-5-карбоксамідо-1,2,3-триазолу і 9,8 г (0,2 моль) циклогексанону у 100 мл етанолу кип'ятять протягом 3 годин. Реакційну суміш охолоджують до кімнатної температури, фільтрують та промивають спиртом осад, що випав. Вихід становить 10,6 г (65 % від теорії). Вихідні дані: вихід 18,7 г (65 %), т. пл. 247-248 °С. Елементний аналіз на вміст: С, %: обчислено 62,70; C15H21N5O; знайдено 62,82; N, %: обчислено 7,37; знайдено 7,28. 1 Спектр H ЯМР (DMSO-d6, м.ч.): 1,30 (м, 1Н, СН2), 1,60 (м, 6Н, СН2), 1,77 (м, 3Н, СН2), 1,91 (м, 2Н, СН2), 2,02 (м, 2Н, СН2), 2,13 (м, 2Н, СН2), 2,23 (м, 2Н, СН2), 7,20 (уш., Ш, NH2), 7,51 (уш., 1Н, NH2), 8,95 (уш., 1H, NH). Приклад 2. Одержання N-(4-метилфеніл)-3-карбоксамідо-9,9-циклогексил-4,5,6,7,8,9гексагідро-1,2,3-триазоло[3,4-b]хіназоліну (табл. 2, поз. 2) 21,7 г (0,1 моль) 4-аміно-5-N-(4-метилфеніл)карбоксамідо-1,2,3-триазолу і 9,8 г (0,2 моль) циклогексанону у 100 мл етанолу кип'ятять протягом 2,5 годин. Реакційну суміш охолоджують до кімнатної температури, фільтрують та промивають спиртом осад, що випав. Вихід становить 29,4 г (78 % від теорії). Вихідні дані: вихід 29,4 г (78 %), т. пл. 212-213 °С. Елементний аналіз на вміст: С, %: обчислено 70,01; C22H27N5O; знайдено 70,12; N, %: обчислено 18,55; знайдено 18,43. 1 Спектр Н ЯМР (DMSO-d6, м.ч.): 1,31 (м, 1H, СН2), 1,62 (м, 6Н, СН2), 1,79 (м, 3Н, СН2), 1,91 (м, 2Н, СН2), 2,01 (м, 2Н, СН2), 2,12 (м, 2Н, СН2), 2,22 (м, 2Н, СН2), 2,32 (с, 3Н, СН3), 7,01 (д, 2H, Аr), 7,55 (д, 2H, Аr), 8,22 (уш., 1Н, NH), 9,50 (уш., 1Η, ΝΗ). Решту прикладів зведено у таблиці 2. Як видно із тексту матеріалів, що заявляються, технічне рішення, що пропонується, має наступні переваги: - структура, що заявляється, забезпечує одержання широкого набору похідних 3карбоксамідо-9,9-циклогексил-4,5,6,7,8,9-гексагідро-1,2,3-триазоло[3,4-b]хіназоліну з покращеними характеристиками і високим ступенем чистоти, що не потребує додаткової очистки. Спосіб одержання сполук формули І, що пропонується, дозволяє: - зменшити у 2 рази тривалість процесу (порівняно із прототипом); - збільшити виходи і якість сполук формули І за рахунок проведення реакції у спиртовому середовищі; - широко варіювати R-замісник у карбоксамідному фрагменті; - зменшити шкідливі технологічні стоки етанолу шляхом утилізації його водою. Всі ці переваги нових сполук і способу їх одержання розширяють можливості їх потенційного використання як фізіологічно активних речовин у медицині (як лікарських препаратів), біології, фармації, у препаративному органічному синтезі, у сільському господарстві (як хімічних засобів захисту рослин) і т. ін. Спосіб одержання сполук формули І простий, здійснюється в одну стадію і легко відтворюється, що відкриває можливості його застосування в умовах як лабораторії, так і промисловості. Таблиця 1 Тривалість, годин Спосіб, заявляється що Спосіб-прототип Спосіб-аналог Вихід осн. прод., % Використання шкідливих розчинників 2,5-3 65-85 4-6 54-57 ДМФА 3 56-82 ДМФА 4 Очищення основного продукту Не потрібно Перекристалізація ДМФА, етанол Авторами не вказано із UA 97933 C2 Таблиця 2 1 № Сполука N 1 N N Час реакції, год. 3 Т. пл., °С 247-248 Вихід, % Спектр Н ЯМР, δ (м.ч.) 65 1,30 (м, 1H, СН2), 1,60 (м, 6Н, СН2), 1,77(м, 3Н, СН2), 1,91 (т, 2Н, СН2), 2,02 (м, 2Н, СН2), 2,13 (м, 2Н, СН2), 2,23 (м, 2Н, СН2), 7,20 (уш., 1H, NH2), 7,51 (уш., 1H, NH2), 8,95 (уш., 1Η, ΝΗ) 78 1,31 (м, 1H, CH2), 1,62 (м, 6H, CH2), 1,79 (м, 3H, CH2), 1,91 (м, 2H, CH2), 2,01 (м, 2H, CH2), 2,12 (м, 2H, CH2), 2,22 (м, 2H, CH2), 2,32 (с, 3H, СН3), 7,01 (д, 2H, Ar), 7,55 (д, 2H, Ar), 8,22 (уш., 1Η, ΝΗ), 9,50 (уш., 1Η, ΝΗ) 72 1,30 (м, 1H, CH2), 1,60 (м, 6H, CH2), 1,81 (м, 3H, CH2), 1,90 (м, 2H, CH2), 2,01 (м, 2H, CH2), 2,11 (м, 2H, CH2), 2,23 (м, 2H, CH2), 2,33 (с, 3H, СН3), 6,85 (м, 1H, Ar), 7,04 (м, 2H, Ar), 7,52 (м, 1H, Ar), 8,10 (уш., 1Η, ΝΗ), 9,55 (уш., 1Η, ΝΗ) 85 1,30 (м, 1H, CH2), 1,61 (м, 6H, CH2), 1,80 (м, 3H, CH2), 1,91 (м, 2H, CH2), 2,02 (м, 2H, CH2), 2,11 (м, 2H, CH2), 2,24 (м, 2H, CH2), 7,18 (д, 2H, Ar), 7,59 (д, 2H, Ar), 8,05 (уш., 1Η, ΝΗ), 9,35 (уш., 1Η, ΝΗ) N H O NH2 N 2 N N 3 212-213 N H O NHC6H4CH3-4 N 3 N N 3 205-206 N H O NHC6H4CH3-2 N N 4 N 2,5 248-249 N H O NHC6H4Cl-4 5 UA 97933 C2 Продовження табл. 2 1 № Сполука N N 5 Час реакції, год. Т. пл., °С Вихід, % Спектр Н ЯМР, δ (м.ч.) 81 1,31 (м, 1H, CH2), 1,60 (м, 6H, CH2), 1,81 (м, 3H, CH2), 1,91 (м, 2H, CH2), 2,01 (м, 2H, CH2), 2,10 (м, 2H, CH2), 2,21 (м, 2H, CH2), 7,45(д, 2H, Ar), 7,51(д, 2H, Ar), 8,20 (уш., 1Η, ΝΗ), 9,47 (уш., 1Η, ΝΗ) 73 1,30 (м, 1H, CH2), 1,60 (м, 6H, CH2), 1,81 (м, 3H, CH2), 1,90 (м, 2H, CH2), 2,01 (м, 2H, CH2), 2,11 (м,2H, CH2), 2,23 (м, 2H, CH2), 7,18 (м, 3H,Ar), 7,62 (м, 2H, Ar), 8,55 (уш., 1Η,ΝΗ), 9,43 (уш., 1Η,ΝΗ) N 2,5 252-253 N H O NHC6H4Br-4 N N 6 N 3 211-212 N H O NHC6H5 6 UA 97933 C2 Продовження табл. 2 1 № Сполука N N 7 N Час реакції, год. 3 Т. пл., °С 208-209 Вихід, % Спектр Н ЯМР, δ (м.ч.) 80 1,32 (м, 1H, CH2), 1,60 (м, 4H, CH2), 1,64 (м, 2H, CH2), 1,81 (м, 3H, CH2), 1,90 (м, 2H, CH2), 2,03 (м, 2H, CH2), 2,10 (м, 2H, CH2), 2,21 (м, 2H, CH2), 3,72 (с, 3H, CH3), 6,68 (д, 2H, Ar), 7,47 (д, 2H, Ar), 8,50 (уш., 1H, NH), 9,11 (уш., 1Η, ΝΗ) 69 1,32 (м, 1H, CH2), 1,62 (м, 6H, CH2), 1,81 (м, 3H, CH2), 1,90 (м, 2H, CH2), 2,03 (м, 2H, CH2), 2,10 (м, 2H, CH2), 2,21 (м, 2H, CH2), 3,73 (с, 3H, CH3), 6,82 (м, 3H, Ar), 7,55 (м, 1H, Ar), 8,55 (уш., 1H, NH), 9,05 (уш., 1Η, ΝΗ) 75 1,31 (м, 1H, CH2), 1,62 (м, 6H, CH2), 1,81 (м, 3H, CH2), 1,91 (м, 2H, CH2), 2,03 (м, 2H, CH2), 2,10 (м, 2H, CH2), 2,21 (м, 2H, CH2), 6,99 (м, 1H, Ar), 7,22 (м, 2H, Ar), 7,58 (м, 1H, Ar), 8,40 (уш., 1Η, ΝΗ), 9,35 (уш., 1H, NH) N H O NHC6H4OCH3-4 N N 8 N 3 215-216 N H O NHC6H4OCH3-2 N N 9 N 2,5 227-228 N H O NHC6H4Cl-2 7 UA 97933 C2 Продовження табл. 2 1 № Сполука N N 10 N Т. пл., °С 3 N H O NHC6H4OC2H5-2 Вихід, % Спектр Н ЯМР, δ (м.ч.) 77 Час реакції, год. 1,31 (м, 1H, CH2), 1,33 (т 3H CH3) 1,61 (м, 4H, CH2), 1,64 (м,2H, CH2), 1,81 (м, 3H, CH2), 1,91 (м, 2H, CH2), 2,03 (м, 2H, CH2), 2,11 (м, 2H, CH2), 2,21 (м, 2H, CH2), 3,98 (кв, 2H, CH2), 6,82 (м, 3H, Ar), 7,51 (м, 1H, Ar), 8,35 (уш., 1Η, ΝΗ), 9,22 (уш., 1Η, ΝΗ) ФОРМУЛА ВИНАХОДУ 5 1. N-заміщені 3-карбоксамідо-9,9-циклогексил-4,5,6,7,8,9-гексагідро-1,2,3-триазоло[3,4b]хіназоліни загальної формули N N N N H O 10 NHR , де R = Н, С6Н5, 4-СН3-С6Н4, 2-СН3-С6Н4, 4-СН3О-С6Н4, 2-СН3О-С6Н4, 4-Вr-С6Н4, 4-Сl-С6Н4, 2-СlС6Н4, 2-С2Н5О-С6Н4. 2. Спосіб одержання сполук загальної формули N N N N H O 15 NHR , де R = Н, С6Н5, 4-СН3-С6Н4, 2-СН3-С6Н4, 4-СН3О-С6Н4, 2-СН3О-С6Н4, 4-Вr-С6Н4, 4-Сl-С6Н4, 2-СlС6Н4, 2-С2Н5О-С6Н4, в якому здійснюють конденсацію аміноазолу і циклогексанону у співвідношенні 1:2 в органічному розчиннику при кип'ятінні, який відрізняється тим, що як аміноазол використовують N-заміщені 4-аміно-5-карбоксамідо-1,2,3-триазоли формули 8 UA 97933 C2 N N NH NH2 O NHR , як розчинник - етиловий спирт, конденсацію проводять протягом 2,5-3 годин до утворення цільового продукту. Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Назва патенту англійськоюN-substituted 3-carboxamido-9,9-cyclohexyl-4,5,6,7,8,9-hexahydro-1,2,3-triazolo[3,4-6]quinazolines and a process for the preparation thereof
Автори англійськоюHladkov Yevhenii Stanislavovych, Sirko Svitlana Mykolaivna, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюN-замещенные 3-карбоксамидо-9,9-циклогексил-4,5,6,7,8,9-гексагидро-1,2,3-триазоло[3,4-b]хиназолины и способ их получения
Автори російськоюГладков Евгений Станиславович, Сирко Светлана Николаевна, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 487/04
Мітки: 3-карбоксамідо-9,9-циклогексил-4,5,6,7,8,9-гексагідро-1,2,3-триазоло[3,4-b]хіназоліни, n-заміщені, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/11-97933-n-zamishheni-3-karboksamido-99-ciklogeksil-456789-geksagidro-123-triazolo34-bkhinazolini-i-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">N-заміщені 3-карбоксамідо-9,9-циклогексил-4,5,6,7,8,9-гексагідро-1,2,3-триазоло[3,4-b]хіназоліни і спосіб їх одержання</a>
Попередній патент: Пристрій для управління процесом росту монокристалів з розплаву в ампулі
Наступний патент: Спосіб виготовлення штампованих деталей з покриттям (варіанти) і деталь, одержана таким способом
Випадковий патент: Хірургічний гачок