Заміщені 4,7-дигідро-3-арилкарбоксамідо-1,2,3-триазоло[1,5-а]піримідинів і спосіб їх одержання
Номер патенту: 86913
Опубліковано: 25.05.2009
Автори: Десенко Сергій Михайлович, Сірко Світлана Миколаївна, Гладков Євгеній Станіславович, Афанасіаді Людмила Михайлівна
Формула / Реферат
1. Заміщені 4,7-дигідро-3-арилкарбоксамідо-1,2,3-триазоло[1,5-а]піримідинів загальної формули
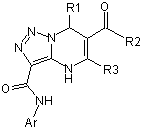 ,
,
де Аr = 4-СН3-С6Н4, 2-СН3-С6Н4;
R1 = С6Н5, 4-СН3О-С6Н4;
R2 = ОС2Н5, NHC6H4-OCH3-4, NHC6H4-Cl-4, NHC6H4-Br-4;
R3=СН3.
2. Спосіб одержання сполук загальної формули
 ,
,
де Аr = 4-СН3-С6Н4, 2-СН3-С6Н4,
R1 = С6Н5, 4-СН3О-С6Н4,
R2 = ОС2Н5, NHC6H4-OCH3-4, NHC6H4-Cl-4, NHC6H4-Br-4,
R3=СН3,
що включає конденсацію рівномолярних кількостей 5-аміно-1,2,3-триазоло-4-карбоксаміду з карбонільною сполукою в органічному розчиннику при кип'ятінні, який відрізняється тим, що як 5-аміно-1,2,3-триазоло-4-карбоксамід використовують 5-аміно-1,2,3-триазоло-4-арилкарбоксамід, як карбонільну сполуку використовують заміщені ацетооцтові ефіри R2COCH2COR3 і ароматичні альдегіди R1CHO, а як органічний розчинник використовують диметилформамід або ізобутиловий, або ізоаміловий спирт.
Текст
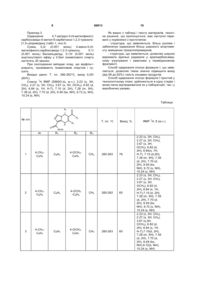
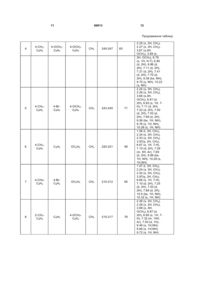
1. Заміщені 4,7-дигідро-3-арилкарбоксамідо1,2,3-триазоло[1,5-а]піримідинів загальної формули 3 86913 природного нуклеозиду, через що в теперішній час синтез нових похідних піримідину з різними фармакофорними угрупуваннями є дуже актуальним, оскільки вони грають дуже важливу роль у різних біопроцесах людини. З іншого боку, відомо, що похідні піримідину є основною субстанцією багатьох лікарських препаратів, які з успіхом використовуються для лікування захворювань, що викликані вірусом ВІЛ, і високоефективні при лікуванні захворювань ендокринної та серцево-судинної системи [В.Иванский. Химия гетероциклических соединений. Высшая школа, М., 1978; заявка ЕР №203721, C07D473/06; заявка ЕР №267607, C07D473/06]; проявляють гіпнотичну, антіалергічну активність [Baziard-Mongsset G., Rached A. Et al., Eur. J. Med. Chem., 30, N3, 253 (1995)] виявляють діуретичний ефект, мають антидепресивні властивості [Патент США №5290782, C07D473/02]. Використання складних азотовмісних гетероциклічних сполук в якості біологічно активних речовин потребує підвищення ступеня простоти і 4 доступності синтезу цих речовин, постійного удосконалення методів їх одержання. Відомий структурний аналог сполук, що заявляються, 3-(2-фторфенил)-6-фенил-4Н[1,2,3]тріазоло[1,5-a]піримідин-5-он формули II і спосіб його одержання [K.G.Bson, S. Thomas et al., Syn. Lett., N5, 712(2001)]. O N N N F II N H Сполука формули II була одержана авторами як проміжний продукт в синтезі сполуки більш складної будови. Недоліком структури сполуки формули II є відсутність можливості введення замісників як у 1,2,3тріазольний, так і у піримідиновий цикли. Спосіб одержання відомої сполуки формули II складається із 4-х стадій і здійснюється за схемою: PhS PhS F NC N PhSCH2N3 K2CO3, ДМСО N N F O PHCHClCOCl піридин, ДМФА, H2N N 0оС Ph N N F N H Cl Ph S O3 CH2Cl2 -78oC O Ph O O N N N N N H N КТМСА F ТГФ (-78o)-(-20oC) F N N H Cl На першій стадії до суспензії K2СО3 у сухому диметилсульфоксиді додають 2фторфенілацетонітрил у середовищі азоту, а потім азидометилфенілсульфід. Суміш перемішують 16 годин при кімнатній температурі, виливають у воду. Екстракцією етилацетатом після висушування над безводним Na2SO4 і видалення розчинника у вакуумі одержують 5-(2-фторфеніл)-3фенілсульфанілметил-3Н-[1,2,3]тріазол-4-іламін у вигляді масла, яке чистять хроматографічно і кристалізують із етилового ефіру. Вихід складає 29%, час протікання реакції - 20-25 годин. На другій стадії до розчину 5-(2-фторфеніл)-3фенілсульфанілметил-3Н-[1,2,3]тріазол-4-іламіну у диметилформаміді додають піридин у середовищі азоту при 0°С і хлорфенілацетилхлорид, суміш видержують 1 годину і виливають у воду. Водний розчин екстрагують етилацетатом. Після висушування над безводним Na2SO4 розчинник видаляють у вакуумі, кристалізують із ефіру. Одержують 2-хлор-N-[5-(2-фторфеніл)-3фенілсульфанілметил-3Н-[1,2,3]тріазол-4-іл]-2фенілацетамід з виходом 78%. Час реакції складає приблизно 6-7 годин. На третій стадії газоподібний озон пропускають у охолоджений до -78°С розчин 2-хлор-N-[5-(2фторфеніл)-3-фенілсульфанілметил-3Н[1,2,3]тріазол-4-іл]-2-фенілацетаміду у хлористому метилені упродовж 4 годин. Потім колбу наповнюють азотом, розчинник відганяють і одержують N[3-фенілсульфанілметил-5-(2-фторфеніл)-3Н[1,2,3]тріазол-4-іл]-2-хлор-2-фенілацетамід. Час реакції на третій стадії складає 5-6 годин. На четвертій стадії до розчину N-[3фенілсульфінілметил-5-(2-фторфеніл)-3Н[1,2,3]тріазол-4-іл]-2-хлор-2-фенілацетаміду у сухому тетрагідрофурані додають калій-бістриметилсилеламід (КТМСА) у толуолі при -78°С, суміш перемішують 90 хвилин. Потім температуру підвищують до 20°С, перемішують ще 15 хвилин, виливають у воду, екстрагують етилацетатом, сушать над безводним Na2SO4. Розчинник видаляють у вакуумі, відфільтровують 3-(2-фторофеніл)6-феніл-4Н-[1,2,3]тріазоло[1,5-a]піримідин-5-он, який не потребує додаткової очистки. Вихід складає 64%, час реакції - приблизно 10-12 годин. Загальний час синтезу сполуки формули II складає приблизно 40-50 годин. До недоліків способу одержання відомого аналога формули II відноситься багатостадійність і тривалість технологічного процесу. Крім того, синтез проходить у середовищі газоподібного азоту, з використанням сухих розчинників, для виділення і очистки проміжних продуктів майже на всіх стадіях використовують екстракції етилацетатом, вакуумну відгонку розчинника, сушіння над безводним 5 86913 Na2SO4, хроматографічну очистку, що значно ускладнює і удорожчує спосіб одержання. Використання у синтезі вогненебезпечних і легкозаймистих розчинників (наприклад - ефір), токсичних (піридин, диметилсульфоксид) і вибухових (тетрагідрофуран) речовин, лакриматорів (хлорфенілацетилхлорид), газоподібних (азот, озон) речовин, низкотемпературних хладагентів (синтез проводять при -78°С) також є недоліком способу одержання сполуки формули II. У зв'язку з викладеним технічне рішення має дуже обмежене використання, головним чином для наукових досліджень, де необхідні найчистіші продукти у незначних кількостях. Труднощі синтезу сполуки формули II, його дорожнеча, малодоступність реактивів, неваріабельність структури обмежують його застосування у якості фармакофорного фрагмента при одержанні речовин більш складної структури для медичної і фармакологічної хімії. Серед заміщених 1,2,3-тріазолопіримідинів відомий 4,7-дигідро-5,7-дифеніл - 1,2,3-тріазоло[1,5a]піримідин-3-карбоксамід - сполука формули III і спосіб її одержання [S. Desenko, E. Gladkov, S. Shoshkina et al., J. Heterocyclic Chem., 43, 1563 (2006)]. R N N N N H O III R1 NH2 де R=R1=C6H5 Сполука формули III розчиняється у полярних (диметилформамід, ацетонітрил) і гідроксилвмісних (метанол, бутиловий спирт) розчинниках, оцтовій кислоті, малорозчинна у гептані, декані, не розчиняється в ефірі, воді. Недоліком структури сполуки формули III є неможливість варіювання замісників в аміноазольному фрагменті. Наявність вільного карбамідного угрупування у тріазольному кільці також не дає можливість видозмінювати хімічну структуру. Сполуки такої структури мають два конденсованих цикли - азольний і піримідиновий і використовуються для одержання лікарських препаратів, які покращують загальну серцеву функцію, мозковий кровообіг, церебральну циркуляцію, виявляють м'яку гіпотензивну дію. Описано використання сполук подібної структури як антагоністів медіаторів кальцію [Патент США №4918074, C07D487/04; Патент Японії №63-107983, C09D 3/72]. Спосіб одержання сполуки формули III складається із однієї стадії і здійснюється за схемою: R N N N O N + NH2 O NH2 N R N R1 N H O R1 NH2 Суміш рівномолярних кількостей 5-аміно-1,2,3тріазоло-4-карбоксаміду і бензальацетофенону в диметилформаміді нагрівають 15 хвилин. Реакційну суміш охолоджують до 20°С, приливають метанол. Осад, що випав, фільтрують і перекристалі 6 зовують із метанолу. Вихід сполуки формули III складає 55%, Т. пл.. 235-237°С. Для одержання сполуки формули III автори використовують тільки один незаміщений 5-аміно1,2,3-тріазоло-4-карбоксамід і один бензальацетофенон. Описаний авторами лише один продукт 4,7дигідро-5,7-дифеніл-1,2,3-тріазоло[1,5-a]піримідин3-карбоксамід не несе інформацію про можливість використання такого метода синтезу для широкої низки сполук такої структури з високими виходами. До недоліків відомого способу слід віднести неможливість варіювання замісників в амінотріазольному компоненті, а варіація замісників у піримідиновому фрагменті обмежена тільки арильними замісниками у халконі з фіксованим їх положенням. Даний спосіб одержання сполуки формули III не дозволяє одержати великий асортимент гетероциклічних сполук з корисними властивостями фармацевтичними і медичними, використати сполуки відомої структури як біологічно активні добавки. Крім того, відомий спосіб одержання сполук формули III вимагає обов'язкову очистку цільового продукту із суміші диметилформаміду і метанолу, що не тільки зменшує вихід продукту, але і збільшує матеріальні і енергетичні витрати. У якості прототипу як найбільш близький за технічною суттю вибрано останній із наведених аналогів. В основу винаходу поставлено задачу пошуку нових сполук у низці заміщених 4,7-дигідро-3арилкарбоксамідо-1,2,3-тріазоло[1,5-a]піримідинів з широкою варіацією замісників у всіх фрагментах молекули, а також розробки простого і доступного способу їх одержання, що дозволяє підвищити вихід і якість кінцевих продуктів. Рішення поставленої задачі забезпечується розробкою заміщених 4,7-дигідро-3арилкарбоксамідо-1,2,3-тріазоло[1,5-]піримідинів формули І R1 N O O N H N R3 N R2 I NH Ar де Аr=4-СН3-С6Н4, 2-СН3-С6Н4; R1=С6Н5, 4-СН3О-С6Н4; R2=ОС2Н5, NHC6H4-OCH3-4, NHC6H4-Cl-4, NHC6H4-Br-4; R3=СН3 Рішення поставленої задачі забезпечується також тим, що у способі одержання сполук загальної формули І, що включає конденсацію рівномолярних кількостей 5-аміно-1,2,3-тріазоло-4карбоксаміду з карбонільною сполукою в органічному розчиннику - диметилформаміді при кип'ятінні, згідно винаходу, в якості 5-аміно-1,2,3-тріазоло4-карбоксаміду використовують 5-аміно-1,2,3тріазоло-4-арилкарбоксамід, в якості карбонільної сполуки використовують заміщені ацетооцтові 7 86913 ефіри R2COCH2COR3 і ароматичні альдегіди R1CHO. У якості органічного розчинника також використовують ізобутиловий або ізоаміловий спирти. Можливість модифікації хімічної структури сполук формули І шляхом варіювання замісників R1 R2, R3 і арильного радікала Аr, пов'язаного безпосередньо з карбоксамідним угрупуванням, дозволяє одержувати більш широкий асортимент нових перспективних біологічно активних речовин у низці тріазолопіримідинів. Подовження ланцюга спряження у молекулах сполук формули І сприяє появі нових властивостей у сполук цієї структури. Так, введення пептидного фрагменту Ar-NH-CO- у 3-положення тріазольного циклу надає їм подібність білкових структур, що сприяє появі нових фізіологічних властивостей. Наявність арилкарбоксамидного угрупування, яке є полярною функціональною групою, призводить до покращення розчинності в органічних розчинниках, що для даної структури є дуже суттєвим і водночас досить несподіваним. Крім того, це угрупування інертне до дії агресивних і водовід'ємних реагентів, що забезпечує стійкість сполук при роботі з ними. Сполуки, що заявляються, не розчиняються у воді і неполярних розчинниках (гексан, толуол), добре розчиняються у полярних розчинниках і спиртах (диметилформамід, диметилсульфоксид, етанол, бутанол). 8 Вибір заміщених ацетооцтових ефірів формули R2-CO-CH2-CO-R3 і ароматичних альдегідів формули R1CHO забезпечує гнучкість структури пропонованих сполук, що дозволяє широко варіювати замісники у піримідиновому фрагменті. Така можливість забезпечує одержання різноманітного асортименту продуктів - потенційних фізіологічно активних речовин. Вибір указаних компонентів і проведення синтезу в умовах, що заявляються, дозволяє одержати сполуки формули ї достатньо чистими (без виділення їх із реакційної маси), значно підвищити їх виходи, а також забезпечує високу швидкість протікання реакції. Використання в якості розчинника висококиплячих спиртів -ізобутилового і ізоамілового у процесі синтезу сполук І, що заявляються, дозволяє одержувати кінцеві продукти без домішок смолистих побічних речовин, що дає можливість виділяти чисті продукти при охолодженні без використання метанолу і без додаткової перекристалізації. Таким чином, удається підвищити вихід цільових продуктів від 58 до 92%. У таблиці представлено характеристики сполук, що заявляються, і їх спектральні данні і для порівняння - сполуки, одержані за способомпрототипом. Спосіб, що заявляється, є одностадійним, багатокомпонентним, що проходить в колбі шляхом хімічної взаємодії усіх реагентів одночасово. Спосіб, що заявляється, здійснюється за схемою: O N N Ar NH NH2 N H + R1 R2 O R3 N + N R1CHO O Суміш, що складається із рівномолярних кількостей 5-аміно-4-арилкарбоксамідо-1,2,3-тріазолу, зміщених ацетооцтового ефіру і ароматичного альдегіду, кип'ятять в диметилформаміді впродовж 5-10 хвилин. Реакційну масу охолоджують до кімнатної температури і відфільтровують сполуку формули І. У разі проведення реакції у середовищі висококиплячих спиртів (ізобутиловий або ізоаміловий спирт) час нагрівання суміші збільшують до 20-30 хвилин. Осад, що випав при охолодженні, відфільтровують. Нижче представлено приклади конкретного виконання. Приклад 1. Одержання 4,7-дигідро-3-(4-метилфеніл)карбоксамідо-5-метил-6-карбетокси-1,2,3-тріазоло[1,5-a]піримідину (табл.1, поз.1.) Суміш 0,2г (0,001 моль) 4-аміно-5-(4метилфеніл)-карбоксамідо-1,2,3-тріазолу, 0,1г (0,001 моль) бензальдегіду, 0,13г (0,001 моль) ацетооцтового ефіру у 0,2мл диметилфораміду кип'ятять 5 хвилин. Реакційну суміш охолоджують до 20°С, додають 5мл метанолу. Осад, що випав, відфільтровують, промивають спиртом і сушать. Ar N H N R2 N H O O R3 ,I Вихідні данні: Т. пл. 260-263°С, вихід 0,32г (76%). Спектр 1Н ЯМР (DMSO-d6, м.ч.): 2.23 (s, 3Н, СН3), 2.27 (s, 3Н, СН3), 3.67 (s, 3Н, ОСН3), 6.82 (d, 2H), 6.84 (s, 1H, Н-7), 7.10 (d, 2H), 7.28 (m, 5H), 7.39 (d, 2H), 7.70 (d, 2H), 9.49 (bs, NH), 9.72 (s, NH), 10.24 (s, NH). Приклад 2. Одержання 4,7-дигідро-3-(4-метилфеніл)карбоксамідо-5-метил-6-карбетокси-1,2,3-тріазоло[1,5-a]піримідину (табл.1, поз.2) Суміш 0,2г (0,001 моль) 4-аміно-5-(4метилфеніл)-карбоксамідо-1,2,3-тріазолу, 0,1г (0,001 моль) бензальдегіду, 0,13г (0,001 моль) ацетооцтового ефіру у 1,5мл ізобутилового спирту кип'ятять 25 хвилин. При охолодженні випадає осад, що відфільтровують, промивають ізобутиловим спиртом і сушать. Вихідні данні: Т. пл. 260-262°С, вихід 0,27г (65%). Спектр 1Н ЯМР (DMSO-d6, м.ч.): 2.23 (s, 3Н, СН3), 2.27 (s, 3Н, СН3), 3.67 (s, 3Н, ОСН3), 6.82 (d, 2Н), 6.84 (s, 1Н, Н-7), 7.10 (d, 2H), 7.28 (m, 5H), 7.39 (d, 2Н), 7.70 (d, 2Н), 9.49 (bs, NH), 9.72 (s, NH), 10.24 (s, NH). 9 86913 Приклад 3. Одержання 4,7-дигідро-3-(4-метилфеніл)карбоксамідо-5-метил-6-карбетокси-1,2,3-тріазоло[1,5-a]піримідину (табл.1, поз.3) Суміш 0,2г (0,001 моль) 4-аміно-5-(4метилфеніл)-карбоксамідо-1,2,3-тріазолу, 0,1г (0,001 моль) бензальдегіду, 0,13г (0,001 моль) ацетооцтового ефіру у 2,0мл ізоамілового спирту кип'ятять 20 хвилин. При охолодженні випадає осад, що відфільтровують, промивають ізоаміловим спиртом і сушать. Вихідні данні: Т. пл. 260-262°С, вихід 0,25г (60%). Спектр 1Н ЯМР (DMSO-d6, м.ч.): 2.23 (s, 3Н, СН3), 2.27 (s, 3Н, СН3), 3.67 (s, 3Н, ОСН3), 6.82 (d, 2H), 6.84 (s, 1Н, Н-7), 7.10 (d, 2H), 7.28 (m, 5H), 7.39 (d, 2H), 7.70 (d, 2H), 9.49 (bs, NH), 9.72 (s, NH), 10.24 (s, NH). 10 Як видно з таблиці і тексту матеріалів, технічне рішення, що пропонується, має наступні переваги у порівнянні з прототипом: - структура, що заявляється, більш рухома і забезпечує одержання більш широкого асортименту заміщених тріазолопіримідинів; - структура, що заявляється, дозволяє широко варіювати арильні радикали у арилкарбоксамідному угрупуванні і замісники у піримідиновому фрагменті. Спосіб одержання сполук формули І, що заявляється, дозволяє також значно підвищити вихід (від 58 до 92%) і якість кінцевих продуктів. Спосіб одержання сполук формули І простий у технологічному плані, здійснюється в одну стадію і може легко відтворюватися як у лабораторії, так і у виробничих умовах. Таблиця R1 N N № п/п N R2 N H O Аr O Т, пл. °С R3 Вихід, % ЯМР 1Н, δ (м.ч.) NHAr R1 R2 R3 1 4-СН3C6H4 С6Н5 4-ОСН3C6H4 СН3 260-263 76 2 4-СН3C6H4 С6Н5 4-ОСН3 -C6H4 СН3 260-262 65 3 4-СН3C6H4 С6Н5 4-ОСН3C6H4 СН3 260-263 60 2.23 (s, 3Н, СН3), 2.27 (s, 3Н, СН3), 3.67 (s, 3Н, ОСН3), 6.82 (d, 2H), 6.84(s, 1Н, Н-7), 7.10 (d,2H), 7.28 (m, 5H), 7.39 (d, 2H), 7.70 (d, 2H), 9.49 (bs, NH), 9.72 (s, NH), 10.24 (s, NH) 2.23 (s, 3H, CH3), 2.27 (s, 3H, CH3), 3.67 (s, 3H, ОСН3), 6.82 (d, 2H), 6.84 (s, 1H, H-7),7.10 (d, 2H), 7.28 (m, 5H), 7.39 (d, 2H), 7.70 (d, 2H), 9.49 (bs, NH), 9.72 (s, NH), 10.24 (s, NH) 2.23 (s, 3H, CH3), 2.27 (s, 3H, CH3), 3.67 (s,3H, ОСН3), 6.82 (d, 2H), 6.84 (s, 1H, H-7),7.10(d, 2H), 7.28 (m, 5H), 7.39 (d, 2H), 7.70 (d, 2H), 9.49 (bs, NH),9.72(s, NH), 10.24 (s, NH) 11 86913 12 Продовження таблиці 4 4-СН3C6H4 4-ОСН3C6H4 4-ОСН3C6H4 СН3 245-247 5 4-СН3C6H4 4-BrC6H4 4-ОСН3C6H4 СН3 243-245 71 6 4-СН3C6H4 С6Н5 ОС2Н5 СН3 220-221 58 7 4-СНзC6H4 4-BrC6H4 ОС2Н5 СН3 210-212 65 8 2-СН3C6H4 С6Н5 4-ОСН3C6H4 СН3 215-217 78 65 2.25 (s, 3H, CH3), 2.27 (s, 3H, CH3), 3.67 (s,3H, ОСН3), 3.69 (s, 3Н, ОСН3), 6.78 (s, 1H, Н-7), 6.80 (d, 2H), 6.86 (d, 2H), 7.11 (d, 2H), 7.21 (d, 2H), 7.41 (d, 2H), 7.70 (d, 2H), 9.38 (bs, NH), 9.70 (s, NH), 10.22 (s, NH) 2.24 (s, 3H, CH3), 2.26 (s, 3H, CH3), 3.68 (s,3H, ОСН3), 6.81 (d, 2H), 6.83 (s, 1H, 7H), 7.11 (d, 2H), 7.22 (d, 2H), 7.40 (d, 2H), 7.53 (d, 2H), 7.69 (d, 2H), 9.56 (bs, 1H, NH), 9.76 (s, 1H, NH), 10.26 (s, 1H, NH) 1.06 (t, 3H, CH3), 2.24 (s, 3H, CH3), 2.53 (s, 3H, CH3), 3.97(q, 2H, CH2), 6.67 (s, 1H, 7-H), 7.10 (d, 2H), 7.29 (m, 5H, Ar), 7.69 (d, 2H), 9.99 (bs, 1H, NH), 10.28 (s, 1H,NH) 1.07 (t, 3H, CH3), 2.24 (s, 3H, CH3), 2.52 (s, 3H, CH3), 3.97(q, 2H, CH2), 6.66 (s, 1H, 7-H), 7.10 (d, 2H), 7.25 (d, 2H), 7.53 (d, 2H), 7.68 (d, 2H), 10.0 (bs, 1H, NH), 10.32 (s, 1H, NH) 2.26 (s, 3H, CH3), 2.28 (s, 3H, CH3), 3.68 (s, ЗН, ОСН3), 6.87 (d, 2Н), 6.85 (s, 1Н, 7Н), 7.32 (m, 10H, Аr), 7.50 (d, 1H), 9.49 (s, 1H,NH), 9.69 (s, 1H,NH), 9.72 (s, 1H, NH) 13 86913 14 Продовження таблиці 9 2-СН3C6H4 4-ОСН3C6H4 4-ОСН3C6H4 СН3 221-222 82 235-237 2.24 (s, 3H, CH3), 2.26 (s, 3H, CH3), 3.67 (s, 3H, OCH3),3.69 (s, 3H, OCH3), 6.79 (s, 1H, 7-H),6.82 (d, 2H), 6.87 (d, 2H), 7.14 (m, 5H), 7.41 (d, 2H), 7.53 (dd, 1H), 9.44 (bs, 1H, NH), 9.67 (s, 1H, NH),9.70(s, 1H,NH) 55 Прототип C6 H5 N N N N H O C6 H5 NH2 Комп’ютерна верстка Н. Лисенко Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted 4,7-dihydro-3-arylcarboxamido-1,2,3-triazolo[1,5-a]pyrimidines and process for the preparation thereof
Автори англійськоюHladkov Yevhenii Stanislavovych, Sirko Svitlana Mykolaivna, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюЗамещенные 4,7-дигидро-3-арилкарбоксамидо-1,2,3-триазоло[1,5-а]пиримидинов и способ их получения
Автори російськоюГладков Евгений Станиславович, Сирко Светлана Николаевна, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 487/00
Мітки: заміщені, 4,7-дигідро-3-арилкарбоксамідо-1,2,3-триазоло[1,5-а]піримідинів, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/7-86913-zamishheni-47-digidro-3-arilkarboksamido-123-triazolo15-apirimidiniv-i-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Заміщені 4,7-дигідро-3-арилкарбоксамідо-1,2,3-триазоло[1,5-а]піримідинів і спосіб їх одержання</a>
Попередній патент: Низькошвидкісна електрична машина з кільцевим статором
Наступний патент: Пестицидна композиція, спосіб її одержання та застосування для боротьби з шкідниками, що живуть в ґрунті та на поверхні ґрунту
Випадковий патент: Стіновий модуль