Похідні 7-[(2-аміноетил)бензиламіно]-2-оксо-2н-хромен-3-карбоксімідамідів та їх солі
Номер патенту: 102608
Опубліковано: 25.07.2013
Автори: Максимюк Олександр Петрович, Кришталь Олег Олександрович, Бута Андрій Зеновійович, Вовк Михайло Володимирович, Ковальський Дмитро Борисович, Васькевич Руслан Іванович, Шоба Вероніка Михайлівна, Сукач Володимир Андрійович
Формула / Реферат
Похідна 7-[(2-аміноетил)бензиламіно]-2-оксо-2H-хромен-3-карбоксімідаміду загальної формули І:
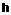
де
R1 та R2 незалежно означають гідроген, (С1-С6)алкіл, цикло(С1-С6)алкіл, (С1-С6)алкеніл, (С1-С6)алкініл, арил, арил(С1-С6)алкіл, гетарил, гетарил(С1-С6)алкіл, гало(С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси, цикло(С1-С6)алкокси, арил(С1-С6)алкокси, гетарил(С1-С6)алкокси, гало(С1-С6)алкокси, аміно, (С1-С6)алкіламіно, цикло(С1-С6)алкіламіно, ді(С1-С6)алкіламіно, дицикло(С1-С6)алкіламіно, аміно(С1-С6)алкіл, аміноцикло(С1-С6)алкіл, моно(С1-С6)алкіламіно(С1-С6)алкіл, моноцикло(С1-С6)алкіламіно(С1-С6)алкіл, ді(С1-С6)алкіламіно(С1-С6)алкіл, дицикло(С1-С6)алкіламіно(С1-С6)алкіл, (С1-С6)алкілкарбоніл, цикло(С1-С6)алкілкарбоніл, арилкарбоніл, гетарилкарбоніл, арил(С1-С6)алкілкарбоніл, гетарил(С1-С6)алкілкарбоніл, (С1-С6)алкілкарбоніламіно, цикло(Сг-С6)алкілкарбоніламіно, арилкарбоніламіно, гетарилкарбоніламіно, арил(С1-С6)алкілкарбоніламіно, гетарил(С1-С6)алкілкарбоніламіно, (С1-С6)алкоксикарбоніл, цикло(С1-С6)алкоксикарбоніл, арилоксикарбоніл, гетарилоксикарбоніл, арил(С1-С6)алкоксикарбоніл, гетарил(С1-С6)алкоксикарбоніл, гідроксикарбоніл, амінокарбоніл, (С1-С6)алкіламінокарбоніл, цикло(С1-С6)алкіламінокарбоніл, ді(С1-С6)алкіламінокарбоніл, дицикло(С1-С6)алкіламінокарбоніл, (С1-С6)алкілсульфоніл, цикло(С1-С6)алкілсульфоніл, арил(С1-С6)алкілсульфоніл, гетарил(С1-С6)алкілсульфоніл, арилсульфоніл, гетарилсульфоніл, гетарил(С1-С6)алкілсульфоніл, (С1-С6)алкіламіносульфоніл, цикло(С1-С6)алкіламіносульфоніл, ді(С1-С6)алкіламіносульфоніл, дицикло(С1-С6)алкіламіносульфоніл,
ариламіносульфоніл, гетариламіносульфоніл, аміносульфоніл, (С1-С6)алкілсульфоніламіно, цикло(С1-С6)алкілсульфоніламіно, ді(С1-С6)алкілсульфоніламіно, дицикло(С1-С6)алкілсульфоніламіно, арилсульфоніламіно, гетарилсульфоніламіно, арил(С1-С6)алкілсульфоніламіно, гетарил(С1-С6)алкілсульфоніламіно, галоген, ОН, CN, NO2;
n означає кількість незалежних різних або однакових замісників R1 та має значення 1, 2 або 3;
m означає кількість незалежних різних або однакових замісників R2 та має значення 1, 2, 3, 4, 5;
R3 та R4 незалежно означають (С1-С6)алкіл, цикло(С1-С6)алкіл, (С1-С6)алкеніл, (С1-С6)алкініл, арил, арил(С1-С6)алкіл, гетарил, гетарил(С1-С6)алкіл, гало(С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл,
або R3 та R4 разом з атомом нітрогену, до якого вони приєднані, утворюють цикл:
де k має значення 0, 1, 2, 3, 4;
або її стереоізомер, або її сіль з неорганічною або органічною кислотою або основою.
Текст
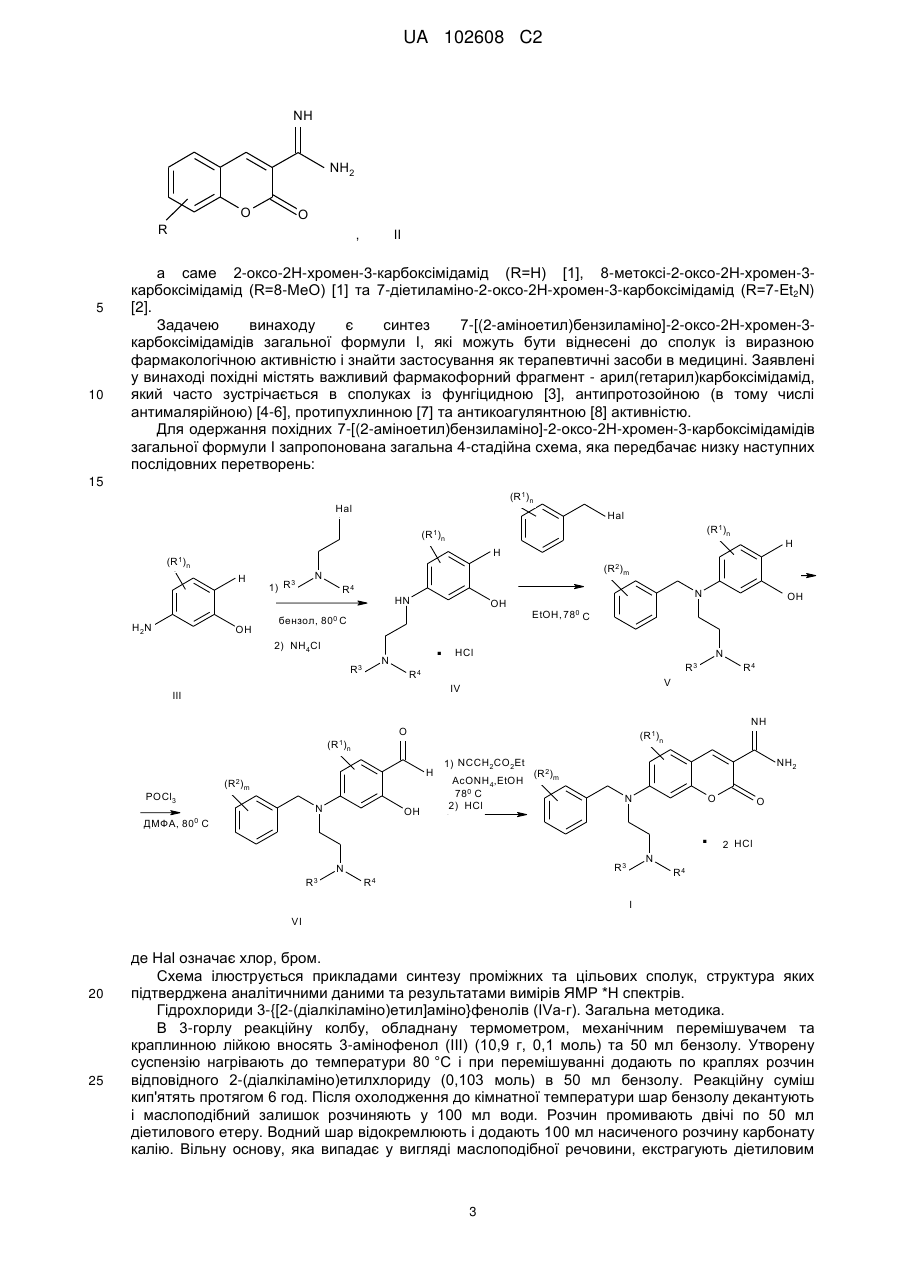
Реферат: Винахід належить до органічної хімії, а саме до нових похідних 7-[(2-аміноетил)бензиламіно]-2оксо-2Н-хромен-3-карбоксімідамідів загальної формули І, у тому числі їх оптичних та геометричних ізомерів та фармацевтично придатних солей. NH (R1)n NH2 (R2)m N R3 O O N R4 , I UA 102608 C2 (12) UA 102608 C2 де 1 2 R та R незалежно означають гідроген, (С1-С6)алкіл, цикло(С1-С6)алкіл, (С1-С6)алкеніл, (С1С6)алкініл, арил, арил(С1-С6)алкіл, гетарил, гетарил(С1-С6)алкіл, гало(С1-С6)алкіл, гідроксі(С1С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси, цикло(С1-С6)алкокси, арил(С1-С6)алкокси, гетарил(С1-С6)алкокси, гало(С1-С6)алкокси, аміно, (С1-С6)алкіламіно, цикло(С1-С6)алкіламіно, ді(С1-С6)алкіламіно, дицикло(С1-С6)алкіламіно, аміно(С1-С6)алкіл, аміноцикло(С1-С6)алкіл, моно(С1-С6)алкіламіно(С1-С6)алкіл, моноцикло(С1-С6)алкіламіно(С1-С6)алкіл, ді(С1С6)алкіламіно(С1-С6)алкіл, дицикло(С1-С6)алкіламіно(С1-С6)алкіл, (С1-С6)алкілкарбоніл, цикло(С1-С6)алкілкарбоніл, арилкарбоніл, гетарилкарбоніл, арил(С 1-С6)алкілкарбоніл, гетарил(С1-С6)алкілкарбоніл, (С1-С6)алкілкарбоніламіно, цикло(С1-С6)алкілкарбоніламіно, арилкарбоніламіно, гетарилкарбоніламіно, арил(С1- С6)алкілкарбоніламіно, гетарил(С1С6)алкілкарбоніламіно, (С1-С6)алкоксикарбоніл, цикло(С1 -С6)алкоксикарбоніл, арилоксикарбоніл, гетарилоксикарбоніл, арил(С 1-С6)алкоксикарбоніл, гетарил(С1С6)алкоксикарбоніл, гідроксикарбоніл, амінокарбоніл, (С1-С6)алкіламінокарбоніл, цикло(С1С6)алкіламінокарбоніл, ді(С1-С6)алкіламінокарбоніл, дицикло(С1-С6)алкіламінокарбоніл, (С1С6)алкілсульфоніл, цикло(С1-С6)алкілсульфоніл, арил(С1-С6)алкілсульфоніл, гетарил(С1С6)алкілсульфоніл, арилсульфоніл, гетарилсульфоніл, гетарил(С 1-С6)алкілсульфоніл, (С1С6)алкіламіносульфоніл, цикло(С1-С6)алкіламіносульфоніл, ді(С1-С6)алкіламіносульфоніл, дицикло(С1-С6)алкіламіносульфоніл, ариламіносульфоніл, гетариламіносульфоніл, аміносульфоніл, (С1-С6)алкілсульфоніламіно, цикло(С1-С6)алкілсульфоніламіно, ді(С1С6)алкілсульфоніламіно, дицикло(С1-С6)алкілсульфоніламіно, арилсульфоніламіно, гетарилсульфоніламіно, арил(С1-С6)алкілсульфоніламіно, гетарил(С1-С6)алкілсульфоніламіно, галоген, ОН, CN, NO2; 1 n означає кількість незалежних різних або однакових замісників R та має значення 1, 2 або 3; 2 m означає кількість незалежних різних або однакових замісників R та має значення 1, 2, 3, 4, 5; 3 4 R та R незалежно означають (С1-С6)алкіл, цикло(С1-С6)алкіл, (С1-С6)алкеніл, (С1-С6)алкініл, арил, арил(С1-С6)алкіл, гетарил, гетарил(С1-С6)алкіл, гало(С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1С6)алкоксі(С1-С6)алкіл; 3 4 або R та R разом з атомом нітрогену, до якого вони приєднані, утворюють цикл: N k , де k має значення 0, 1, 2, 3, 4; Сполуки даного типу можуть виявляти виразну фармакологічну активність і знайти застосування як терапевтичні засоби в медицині. Для одержання похідних 7-[(2аміноетил)бензиламіно]-2-оксо-2H-хромен-3-карбоксімідамідів загальної формули І запропонована загальна 4-стадійна схема. NH (R1)n NH2 (R2)m N R3 O O N R4 , I UA 102608 C2 5 Винахід належить до органічної хімії, а саме до нових похідних 7-[(2аміноетил)бензиламіно]-2-оксо-2H-хромен-3-карбоксімідамідів загальної формули І, у тому числі їх оптичних та геометричних ізомерів та фармацевтично придатних солей. 7-[(2Аміноетил)бензиламіно]-2-оксо-2H-хромен-3-карбоксімідаміди І можуть виявляти виразну фармакологічну активність і знайти застосування як терапевтичні засоби в медицині. Винахід відноситься до сполук загальної формули І NH (R1)n NH2 (R2)m N R3 10 15 20 25 30 35 O O N R4 , I де: 1 2 R та R незалежно означають гідроген, (С1-С6)алкіл, цикло(С1-С6)алкіл, (С1-С6)алкеніл, (С1С6)алкініл, арил, арил(С1-С6)алкіл, гетарил, гетарил(С1-С6)алкіл, гало(С1-С6)алкіл, гідроксі(С1С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси, цикло(С1-С6)алкокси, арил(С1-С6)алкокси, гетарил(С1-С6)алкокси, гало(С1-С6)алкокси, аміно, (С1-С6)алкіламіно, цикло(С1-С6)алкіламіно, ді(С1-С6)алкіламіно, дицикло(С1-С6)алкіламіно, аміно(С1-С6)алкіл, аміноцикло(С1-С6)алкіл, моно(С1-С6)алкіламіно(С1-С6)алкіл, моноцикло(С1-С6)алкіламіно(С1-С6)алкіл, ді(С1С6)алкіламіно(С1-С6)алкіл, дицикло(С1-С6)алкіламіно(С1-С6)алкіл, (С1-С6)алкілкарбоніл, цикло(С1С6)алкілкарбоніл, арилкарбоніл, гетарилкарбоніл, арил(С 1-С6)алкілкарбоніл, гетарил(С1С6)алкілкарбоніл, (С1-С6)алкілкарбоніламіно, цикло(С1-С6)алкілкарбоніламіно, арилкарбоніламіно, гетарилкарбоніламіно, арил(С 1-С6)алкілкарбоніламіно, гетарил(С1С6)алкілкарбоніламіно, (С1-С6)алкоксикарбоніл, цикло(С1-С6)алкоксикарбоніл, арилоксикарбоніл, гетарилоксикарбоніл, арил(С1-С6)алкоксикарбоніл, гетарил(С1-С6)алкоксикарбоніл, гідроксикарбоніл, амінокарбоніл, (С1-С6)алкіламінокарбоніл, цикло(С1-С6)алкіламінокарбоніл, ді(С1-С6)алкіламінокарбоніл, дицикло(С1-С6)алкіламінокарбоніл, (С1-С6)алкілсульфоніл, цикло(С1-С6)алкілсульфоніл, арил(С 1-С6)алкілсульфоніл, гетарил(С1-С6)алкілсульфоніл, арилсульфоніл, гетарилсульфоніл, гетарил(С 1-С6)алкілсульфоніл, (С1-С6)алкіламіносульфоніл, цикло(С1-С6)алкіламіносульфоніл, ді(С1-С6)алкіламіносульфоніл, дицикло(С1С6)алкіламіносульфоніл, ариламіносульфоніл, гетариламіносульфоніл, аміносульфоніл, (С 1С6)алкілсульфоніламіно, цикло(С1-С6)алкілсульфоніламіно, ді(С1-С6)алкілсульфоніламіно, дицикло(С1-С6)алкілсульфоніламіно, арилсульфоніламіно, гетарилсульфоніламіно, арил(С1С6)алкілсульфоніламіно, гетарил(С1-С6)алкілсульфоніламіно, галоген, ОН, CN, NO2; 1 n означає кількість незалежних різних або однакових замісників R та має значення 1, 2 або 3; 2 m означає кількість незалежних різних або однакових замісників R та має значення 1, 2, 3, 4, 5; 3 4 R та R незалежно означають (С1-С6)алкіл, цикло(С1-С6)алкіл, (С1-С6)алкеніл, (С1-С6)алкініл, арил, арил(С1-С6)алкіл, гетарил, гетарил(С1-С6)алкіл, гало(С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1С6)алкоксі(С1-С6)алкіл; 3 4 або R та R разом з атомом нітрогену, до якого вони приєднані, утворюють цикл: 40 N k 45 , де k має значення 0,1, 2, 3, 4; Для встановлення значення та ілюстрації використаних для опису винаходу термінів сформульовані наступні визначення. 1 UA 102608 C2 5 10 15 20 25 30 35 40 45 50 55 Термін "(С1-С6)алкіл", а також префікс "(С1-С6)алк", означає прямий або розгалужений насичений замісник, що складається з 1 до 6 атомів карбону. Прикладами групи "(С 1-С6)алкіл" є метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, трет-бутил, пентил, гексил та інші. Термін "гало(С1-С6)алкіл", а також префікс "гало(С1-С6)алк", означає прямий або розгалужений насичений замісник, що складається з 1 до 6 атомів карбону, в якому один, два, три та більше атомів водню заміщені на атом галогену. Прикладами групи "гало(С 1-С6)алкіл" є хлорометил, 2-хлороетил, фторометил, дифторометил, трифторометил, 2-фтороетил, 2,2дифтороетил, 2,2,2-трифтороетил та інші. Термін "гідроксі(С1-С6)алкіл" означає прямий або розгалужений насичений замісник, що складається з 1 до 6 атомів карбону, в якому один, два, три та більше атомів водню заміщені на гідроксигрупу. Прикладами групи "гідроксі(С 1-С6)алкіл" є гідроксиметил, 2-гідроксіетил, 2гідроксипропан-1-іл, 2,3-дигідроксипропан-1-іл та інші. Термін "(С1-С6)алкеніл" означає прямий або розгалужений замісник, що складається з 1 до 6 атомів карбону, та містить один, два або три подвійні зв'язки в будь-якому положенні. Прикладами групи " (С1-С6)алкеніл" є етеніл, З-пропен-1-іл, 3-пропен-2-іл та інші. Термін "(С1-С6)алкініл" означає прямий або розгалужений замісник, що складається з 1 до 6 атомів карбону, та містить один або два потрійні зв'язки в будь-якому положенні. Прикладами групи "(С1-С6)алкініл" є етиніл, 3-пропін-1-іл, 4-бутин-1-іл та інші. Термін "цикло(С1-С6)алкіл", а також префікс "цикло(С1-С6)алк", означає насичений карбоциклічний замісник, що складається з 1 до 6 атомів карбону, а також його конденсовані та заміщені аналоги. Термін "конденсовані аналоги" групи "цикло(С 1-С6)алкіл" означає насичений карбоциклічний замісник, до якого анельовані насичені карбоцикли, ароматичні карбоцикли або гетероцикли. Прикладами групи "цикло(С1-С6)алкіл", її конденсованих та заміщених аналогів є циклопропіл, циклобутил, циклопентил, циклогексил, 4-метилциклогексил, 4гідроксициклогексил, 1-тетрагідронафтил, 1-інданіл та інші. Термін "арил" означає ароматичний карбоциклічний замісник, а також його конденсовані та заміщені аналоги. Термін "конденсований аналог" групи "арил" означає ароматичний карбоциклічний замісник, до якого анельований насичений карбоцикл, ароматичний цикл або гетероцикл. Прикладами групи "арил", її конденсованих та заміщених аналогів є феніл, 4хлорфеніл, 4-метилфеніл, 4-трифторометилфеніл, 1-нафтил, 2-нафтил, 4-інданіл, 5тетрагідронафтил, 5-бензофураніл, 5-індоліл, 6-([1,4]-бензодіоксаніл) та інші. Термін "гетарил" означає ароматичний циклічний замісник, що містить хоча б один гетероатом (Ν, Ο або S), а також його конденсовані та заміщені аналоги. Термін "конденсований аналог" групи "гетарил" означає ароматичний циклічні замісник, що містить хоча б один гетероатом (Ν, Ο або S), до якого анельований насичений карбоцикл, ароматичний карбоцикл або гетероцикл. Прикладами групи "гетарил", її конденсованих та заміщених аналогів є 2піроліл, 4-метил-2-піроліл, 3-ізоксазоліл, 4-піразоліл, 1-метил-4-піразоліл, 2-піридил, 5-ціано-2піридил, 3-піридил, 4-піридил, 2-[1,3]оксазоліл, 4-[1,2,3]триазоліл, 1-метил-4-[1,2,3]триазоліл, 1[1,2,3]триазоліл, 1-імідазоліл, 2-метил-1-імідазоліл, 2-імідазоліл, 1-метил-2-імідазоліл, 2-тієніл, 2-піримідил, 3-піридазиніл, 2-піразиніл, 2-бензоксазоліл, 2-бензотіазоліл, 2-бензімідазоліл, фуро[2,3-b]піридил, 2-хінолініл, 2-індоліл, 3-індоліл, 1-ізохінолініл та інші. Термін "галоген" означає фтор, хлор, бром, йод. Сполуки загальної формули І можуть містити один або декілька хіральних центрів і можуть бути як рацематами, так і індивідуальними енантіомерами, як сумішами діастереомерів, так і індивідуальними діастереомерами. Сполуки загальної формули І можуть містити один або декілька подвійних зв'язків і можуть бути як Z- так і Е-ізомерами. Термін "фармацевтично придатні солі" означає солі, одержані з нетоксичних кислот або основ (неорганічних або органічних), які застосовуються в фармацевтиці. Прикладами таких кислот є хлороводнева, бромоводнева, оцтова, лимонна, метансульфонова, камфорсульфонова, глюконова, винна, молочна, малеїнова, фосфорна, сульфатна та інші. Прикладами таких основ є гідроксиди натрію, калію, кальцію, магнію, амонію, а також триетиламін, холін, етилендіамін, морфолін, етилморфолін, етаноламін, триетаноламін, піперазин, піперидин, глюкамін, гістидин, лізин та інші. Вказані у винаході сполуки, їх властивості та способи одержання в літературі не описані. Найближчими структурними аналогами сполук, які заявляються є 2-оксо-2H-хромен-3карбоксімідаміди загальної формули (II): 2 UA 102608 C2 NH NH2 O O R 5 10 , II а саме 2-оксо-2Н-хромен-3-карбоксімідамід (R=H) [1], 8-метоксі-2-оксо-2Н-хромен-3карбоксімідамід (R=8-MeO) [1] та 7-діетиламіно-2-оксо-2Н-хромен-3-карбоксімідамід (R=7-Et2N) [2]. Задачею винаходу є синтез 7-[(2-аміноетил)бензиламіно]-2-оксо-2Н-хромен-3карбоксімідамідів загальної формули І, які можуть бути віднесені до сполук із виразною фармакологічною активністю і знайти застосування як терапевтичні засоби в медицині. Заявлені у винаході похідні містять важливий фармакофорний фрагмент - арил(гетарил)карбоксімідамід, який часто зустрічається в сполуках із фунгіцидною [3], антипротозойною (в тому числі антималярійною) [4-6], протипухлинною [7] та антикоагулянтною [8] активністю. Для одержання похідних 7-[(2-аміноетил)бензиламіно]-2-оксо-2Н-хромен-3-карбоксімідамідів загальної формули І запропонована загальна 4-стадійна схема, яка передбачає низку наступних послідовних перетворень: 15 (R1)n Hal Hal (R1) (R1)n n H H2N OH 3 1) R (R2)m N R4 бензол, HN OH 800 С . 2) NH4Cl N R3 N EtOH, 780 HCl N V NH O (R1)n (R1)n H m N OH ДМФА, 800 С 1) NCCH2CO2Et AcONH4,EtOH 780 C 2) HCl NH2 (R2)m N O . O 2 HCl N R3 N R3 R4 R3 IV (R2) OH C R4 III POCl3 H H (R1)n R4 R4 I VI 20 25 де Hal означає хлор, бром. Схема ілюструється прикладами синтезу проміжних та цільових сполук, структура яких підтверджена аналітичними даними та результатами вимірів ЯМР *Н спектрів. Гідрохлориди 3-{[2-(діалкіламіно)етил]аміно}фенолів (IVa-г). Загальна методика. В 3-горлу реакційну колбу, обладнану термометром, механічним перемішувачем та краплинною лійкою вносять 3-амінофенол (III) (10,9 г, 0,1 моль) та 50 мл бензолу. Утворену суспензію нагрівають до температури 80 °C і при перемішуванні додають по краплях розчин відповідного 2-(діалкіламіно)етилхлориду (0,103 моль) в 50 мл бензолу. Реакційну суміш кип'ятять протягом 6 год. Після охолодження до кімнатної температури шар бензолу декантують і маслоподібний залишок розчиняють у 100 мл води. Розчин промивають двічі по 50 мл діетилового етеру. Водний шар відокремлюють і додають 100 мл насиченого розчину карбонату калію. Вільну основу, яка випадає у вигляді маслоподібної речовини, екстрагують діетиловим 3 UA 102608 C2 5 10 15 20 25 30 35 40 45 50 55 етером, органічний шар промивають водою, сушать над сульфатом натрію та упарюють. Залишок розчиняють в 50 мл метанолу, додають хлорид амонію (4.81 г, 0.09 моль) та кип'ятять протягом 1 год. Після охолодження розчинник упарюють, до залишку додають 20 мл ацетонітрилу та перемішують протягом 0.5 год. Осад відфільтровують, промивають ацетонітрилом та сушать на повітрі. Приклад 1 3-{[2-(Диметиламіно)етил]аміно}фенолгідрохлорид (IVa). Одержують відповідно до загальної методики, використовуючи 21 (диметиламіно)етилхлорид. Вихід 64 %. Т. плав. 145-147 °C. Спектр ЯМР Н, DMSO-d6, , м. ч.: 10,61 (с, 1Н), 9,06 (с, 1Н), 6,88 (т, J=8,5, 1H), 6,09 (м, 3Н), 3,38 (м, 2Н), 3,19 (т, J=7,5, 2Н), 2,77 (с, 6Н). Приклад 2 3-{[2-(Діетиламіно)етил]аміно}фенолгідрохлорид (IVб). Одержують відповідно до загальної методики, використовуючи 2-(діетиламіно)етилхлорид. Вихід 78 %. Т. плав. 138-140 °C. Спектр 1 ЯМР Н, DMSO-d6, , м. ч.: 10,58 (с, 1Н), 9,07 (с, 1H), 6,88 (τ, J=8,0, 1H), 6,06 (м, 3Н), 3,38 (м, 4Н), 3,14 (τ, J=7,5, 4Η), 1,22 (т, J=7,5, 6Η). Приклад 3 3-{(2-Піролідин-1-ілетил)аміно}фенолгідрохлорид (IVв). Одержують відповідно до загальної методики, використовуючи 2-(піролідин-1-іл)етилхлорид. Вихід 57 %. Т. плав. 148-150 °C. 1 Спектр ЯМР Н, OMSO-d6, , м. ч.: 9,07 (с, 1Н), 6,86 (т, J=7,5, 1H), 6,05 (м, 3Н), 3,33 (м, 6Н), 3,08 (т, J=7,5, 2H), 2,66 (м, 4Н). Приклад 4 3-{(2-Піперидин-1-ілетил)аміно}фенолгідрохлорид (IVг). Одержують відповідно до загальної методики, використовуючи 2-(піперидин-1-іл)етилхлорид. Вихід 65 %. Т. плав. 151-153 °C. 1 Спектр ЯМР Н, OUSO-d6, , м. ч.: 10,67 (с, 1Н), 9,07 (с, 1H), 6,86 (т, J=7,5, 1H), 6,05 (м, 3Н), 3,40 (м, 6Н), 3,14 (т, J=7,0, 2Н), 1,80 (м, 4Н), 1,55 (м, 2Н). 3-{Бензил[2-(діалкіламіно)етил]аміно}феноли (Va-л). Загальна методика. Суміш відповідного гідрохлориду 3-{[2-(діалкіламіно)етил]аміно}фенолу (IVa-г) (16,8 ммоль) та відповідного бензилгалогеніду (16,8 ммоль) в 30 мл етанолу кип'ятять протягом 6 год. Після охолодження до кімнатної температури розчинник упарюють. Залишок розчиняють в 50 мл води та змішують з 20 мл дихлорометану. Водний шар відокремлюють, промивають 20 мл дихлорометану та нейтралізують надлишком насиченого розчину гідрокарбонату натрію. Маслоподібну речовину екстрагують дихлорометаном, органічний шар промивають водою, сушать сульфатом натрію і упарюють розчинник. Продукт одержують у вигляді коричневої маслоподібної речовини і використовують у наступній стадії без додаткового очищення. Приклад 5 3-{Бензил[2-(діетиламіно)етил]аміно}фенол (Va). Одержують відповідно до загальної методики, використовуючи 3-{[2-(діетиламіно)етил]аміно}фенолгідрохлорид (IV6) та 1 бензилхлорид. Вихід 68 %. Спектр ЯМР Н, CDCl3, , м. ч.: 7,26 (д, J=7,0, 2H), 7,19 (д, J=7,0, 2H), 7,00 (м, J=2H, 1Н), 6,21 (м, 3Н), 4,46 (с, 2Н), 3,50 (т, J=7,1, 2Н), 2,57 (м, 6Н), 1,01 (t, J=7,1,6H). Приклад 6 3-{[2-(Диметиламіно)етил](4-хлоробензил)аміно}фенол (Vб). Одержують відповідно до загальної методики, використовуючи 3-{[2(диметиламіно)етил]аміно} фенол гідрохлорид (IVa) та 4-хлоробензилхлорид. 1 Вихід 73 %. Спектр ЯМР Н, CDCl3, , м. ч.: 7,24 (д, J=7,2, 2Н), 7,11 (д, J=7,2, 2Н), 7,00 (т, J=8,0, 1Н), 6,18 (м, 2Н), 6,10 (с, 1Н), 4,45 (с, 2Н), 3,49 (т, J=7,0, 2Н), 2,54 (т, J=7,0, 2Н), 2,26 (с, 6Н). Приклад 7 3-{[2-(Діетилтиламіно)етил](4-хлоробензил)аміно}фенол (Vв). Одержують відповідно до загальної методики, використовуючи 3-{[2(діетиламіно)етил]аміно} фенол гідрохлорид (IVб) та 4-хлоробензилхлорид. Вихід 72 %. Спектр 1 ЯМР Н, CDCl3, , м. ч.: 7,28 (д, J=7,5, 2Н), 7,14 (д, J=7,5, 2Н), 7,02 (т, J=8,0, 1Н), 6,22 (м, 2Н), 6,13 (с, 1Н), 4,48 (с, 2Н), 3,51 (т, J=7,2, 2Н), 2,69 (т, J=7,2, 2H), 2,58 (к, J=7,0, 4H), 1,04 (т, J=7,0, 6H). Приклад 8 3-[(2-Піролідин-1-ілетил)(4-хлоробензил)аміно]фенол (Vг). Одержують відповідно до загальної методики, використовуючи 3-{(2-піролідин-11 ілетил)аміно}фенолгідрохлорид (IVв) та 4-хлоробензилхлорид. Вихід 67 %. Спектр ЯМР Н, 4 UA 102608 C2 5 10 15 20 25 30 35 40 45 50 55 CDCl3, , м. ч.: 7,28 (д, J=7,0, 2H), 7,11 (д, J=7,0, 2Н), 7,02 (т, J=8,0, 1Н), 6,18 (м, 2Н), 6,07 (с, 1Н), 4,45 (с, 2Н), 3,53 (т, J=7,1, 2Н), 2,70 (т, J=7,1, 2Н), 2,64 (м, 4Н), 1,28 (м, 4Н). Приклад 9 3-[(2-Піперидин-1-ілетил)(4-хлоробензил)аміно]фенол (Vд). Одержують відповідно до загальної методики, використовуючи 3-{(2-піперидин-11 ілетил)аміно}фенолгідрохлорид (IVг) та 4-хлоробензилхлорид. Вихід 76 %. Спектр ЯМР Н CDCl3, , м. ч.: 7,25 (д, J=7,2, 2Н), 7,11 (д, J=7,2, 2Н), 7,00 (т, J=8,0, 1Н), 6,20 (м, 2Н), 6,12 (с, 1Н), 4,48 (с, 2Н), 3,51 (т, J=7,6, 2Н), 2,55 (т, J=7,6, 2Н), 2,43 (м, 4Н), 1,59 (м, 4Н), 1,44 (м, 2Н). Приклад 10 3-{[2-(Діетилтиламіно)етил](4-фторобензил)аміно}фенол (Ve). Одержують відповідно до загальної методики, використовуючи 3-{[2(діетиламіно)етил]аміно}фенолгідрохлорид (IVб) та 4-фторобензилхлорид. Вихід 75 %. Спектр 1 ЯМР Н, CDCl3, , м. ч.: 7,12 (м, 2Н), 6,96 (м, 3Н), 6,16 (м, 3Н), 4,42 (с, 2Н), 3,47 (т, J=7,0, 2Н), 2,67 (т, J=7,0, 2H), 2,57 (к, J=7,1, 4H), 1,04 (т, J=7,1, 6H). Приклад 11 3-{[2-(Діетилтиламіно)етил](4-метилбензил)аміно}фенол (Vє). Одержують відповідно до загальної методики, використовуючи 3-{[2(діетиламіно)етил]аміно}фенолгідрохлорид (IVб) та 4-метилбензилхлорид. Вихід 66 %. Спектр 1 ЯМР Н, CDCl3, , м. ч.: 7,07 (м, 4Н), 6,99 (т, J=8,0, 1H), 6,13 (м, 3Н), 4,44 (с, 2Н), 3,48 (т, J=7,2, 2H), 2,68 (т, J=7,2, 2H), 2,57 (к, J=7,0, 4H), 2,30 (с, 3Н), 1,04 (т, J=7,0, 6H). Приклад 12 3-{[2-(Діетилтиламіно)етил](3-трифторометилбензил)аміно}фенол (Vж). Одержують відповідно до загальної методики, використовуючи 3-{[2(діетиламіно)етил]аміно}фенолгідрохлорид (IVб) та 3-трифторометилбензилбромід. Вихід 62 %. 1 Спектр ЯМР Η, CDCl3, , м. ч.: 7,47 (м, 1Н), 7,36 (м, 2Н), 6,98 (т, J=8,0, 1Н), 6,10 (м, 3Н), 4,48 (с, 2Н), 3,50 (т, J=7,2, 2Н), 2,68 (т, J=7,2, 2H), 2,57 (к, J=7,0, 4H), 1,04 (т, J=7,0, 6H) Приклад 13 3-{[2-(Діетилтиламіно)етил](4-трифторометилбензил)аміно}фенол (Vз). Одержують відповідно до загальної методики, використовуючи 3-{[2(діетиламіно)етил]аміно}фенолгідрохлорид (IVб) та 4-трифторометилбензилбромід. Вихід 77 %. 1 Спектр ЯМР Н, CDCl3, , м. ч.: 7,53 (д, J=7,1, 2Н), 7,29 (д, J=7,1, 2Н), 7,01 (т, J=8,3, 1Н), 6,18 (м, 2Н), 6,10 (с, 1Н), 4,54 (с, 2Н), 3,50 (т, J=6,7, 2Н), 2,67 (т, J=6,7, 2Н), 2,55 (к, J=7,2, 4Н), 1,01 (т, J=7,2, 6H). Приклад 14 3-[(2-Піперидин-1-ілетил)(4-трифторометилбензил)аміно]фенол (Vи). Одержують відповідно до загальної методики, використовуючи 3-{(2-піперидин-1-ілетил)аміно}фенолгідрохлорид (ІVг) 1 та 4-трифторометилбензилбромід. Вихід 75 %. Спектр ЯМР Ή, CDCl3, , м. ч.: 7,55 (д, J=7,4, 2Н), 7,30 (д, J=7,4, 2Н), 7,00 (т, J=8,3, 1Н), 6,17 (м, 2Н), 6,11 (с, 1Н), 4,55 (с, 2Н), 3,50 (т, J=7,0, 2Н), 2,57 (т, J=7,0, 2H), 2,44 (м, 4Н), 1,63 (м, 4Н), 1,42 (м, 2Н). Приклад 15 3-{[2-(Діетилтиламіно)етил](4-ціанобензил)аміно}фенол (Vi). Одержують відповідно до загальної методики, використовуючи 3-{[2(діетиламіно)етил]аміно}фенолгідрохлорид (IVб) та 4-ціанобензилхлорид. Вихід 58 %. Спектр 1 ЯМР Н, CDCl3, , м. ч.: 7,56 (д, J=7,1, 2Н), 7,29 (д, J=7,1, 2Н), 7,03 (т, J=8,3, 1Н), 6,19 (м, 2Н), 6,09 (с, 1Н), 4,54 (с, 2Н), 3,50 (т, J=7,1, 2Н), 2,68 (т, J=7,1, 2Н), 2,58 (к, J=6,7, 4H), 1,02 (т, J=6,7, 6H). Приклад 16 3-{(4-Дифторометоксибензил)[2-(діетилтиламіно)етил]аміно}фенол (Vi). Одержують відповідно до загальної методики, використовуючи 3-{[2-(діетиламіно)етил]аміно} фенол 1 гідрохлорид (IVб) та 4-дифторометоксибензилбромід. Вихід 73 %. Спектр ЯМР Н, CDCl3, , м. ч.: 7,19 (д, J=8,1, 2Н), 7,03 (м, 3Н), 6,47 (т, J=74, 1Н), 6,14 (м, 3Н), 4,48 (с, 2Н), 3,51 (т, J=7,2, 2H), 2,68 (т, J=7,2, 2H), 2,59 (к, J=7,0, 4H), 1,04 (т, J=7,0, 6H). Приклад 17 3-{[2-(Діетилтиламіно)етил](4-трифторометоксибензил)аміно}фенол (Vк). Одержують відповідно до загальної методики, використовуючи 3-{[2(діетиламіно)етил]аміно}фенолгідрохлорид (IVб) та 4-трифторометоксибензилбромід. Вихід 1 71 %. Спектр ЯМР Н, CDCl3, , м. ч.: 7,24 (д, J=8,0, 2Н), 7,03 (м, 3Н), 6,14 (м, 3Н), 4,49 (с, 2Н), 3,52 (т, J=7,2, 2H), 2,69 (т, J=7,2, 2H), 2,59 (к, J=7,1, 4H), 1,04 (т, J=7,1, 6H). 5 UA 102608 C2 5 10 15 20 25 30 35 40 45 50 55 Приклад 18 3-{(3,4-Дихлоробензил)[2-(діетилтиламіно)етил]аміно}фенол (Vл). Одержують відповідно до загальної методики, використовуючи 3-{[2-(діетиламіно)етил]аміно} фенол гідрохлорид (IVб) та 1 3,4-дихлоробензилхлорид. Вихід 73 %. Спектр ЯМР Н, CDCl3, м. ч.: 7,32 (д, J=8,4, 2Н), 7,01 (м, 2Н), 6,17 (м, 2Н), 6,11 (с, 1Н), 4,40 (с, 2Н), 3,49 (т, J=7,2, 2Н), 2,68 (т, J=7,2, 2H), 2,56 (к, J=7,2, 4H), 1,02 (т, J=7,2, 6H). 4-{Бензил[2-(діалкіламіно)етил]аміно}-2-гідроксибензальдегіди (Vla-л). Загальна методика. До охолодженого сумішшю льоду та води сухого диметилформаміду (2,2 мл) при перемішуванні повільно по краплях додають перегнаний оксотрихлорид фосфору (1,1 мл) і суміш перемішують протягом 20 хв. До отриманого розчину при охолодженні сумішшю льоду та води по краплях додають розчин відповідного 3-{бензил[2-(діалкіламіно)етил]аміно}фенолу (Vaл) (7,88 ммоль) в сухому диметилформаміді (3 мл). Реакційну суміш нагрівають при температурі 80 °C протягом 2 год. Після охолодження суміш виливають у воду з льодом, додають активоване вугілля (0,5 г) та фільтрують. До одержаного фільтрату додають 100 мл насиченого розчину гідрокарбонату натрію, маслоподібну речовину екстрагують етилацетатом (50 мл). Органічний шар промивають водою, сушать сульфатом натрію і розчинник упарюють. Продукт одержують у вигляді коричневої маслоподібної речовини і використовують у наступній стадії без додаткового очищення. Приклад 19 4-{Бензил[2-(діетиламіно)етил]аміно}-2-гідроксибензальдегід (VІa). 1 Вихід 78 %. Спектр ЯМР Н, CDCl3, , м. ч.: 11,54 (с, 1Н), 9,45 (с, 1Н), 7,26 (м, 4Н), 7,14 (д, J=7,4, 2Н), 6,3 (д, J=8,4, 1Н), 6,11 (с, 1Н), 4,64 (с, 2Н), 3,53 (т, J=7,8, 2H), 2,66 (т, J=7,8, 2H), 2,52 (к, J=7,2, 4H), 1,00 (т, J=7,2, 6H). Приклад 20 4-{[2-(Диметиламіно)етил](4-хлоробензил)аміно}-2-гідроксибензальдегід (VIб). Вихід 63 %. 1 Спектр ЯМР Н, CDCl3, , м. ч.: 11,56 (с, 1Н), 9,52 (с, 1Н), 7,28 (м, 3Н), 7,10 (д, J=7,5, 2H), 6,29 (д, J=8,0, 1H), 6,12 (с, 1Н), 4,61 (с, 2Н), 3,56 (т, J=7,4, 2Н), 2,55 (т, J=7,4, 2Н), 2,28 (с, 6Н). Приклад 21 4-{[2-(Діетиламіно)етил](4-хлоробензил)аміно}-2-гідроксибензальдегід (VIв). Вихід 60 %. 1 Спектр ЯМР Н, CDCl3, , м. ч.: 11,57 (с, 1Н), 9,51 (с, 1Н), 7,28 (м, 3Н), 7,10 (д, J=7,4, 2H), 6,29 (д, J=9,0, 1H), 6,11 (с, 1Н), 4,63 (с, 2Н), 3,54 (т, J=7,1, 2H), 2,66 (т, J=7,1, 2H), 2,56 (к, J=6,9, 4H), 1,01 (т, J=6,9, 6H). Приклад 22 4-[(2-піролідин-1-ілетил)(4-хлоробензил)аміно]-2-гідроксибензальдегід (VIг). Вихід 73 %. 1 Спектр ЯМР Н, CDCl3, , м. ч.: 11,53 (с, 1Н), 9,50 (с, 1Н), 7,23 (м, 3Н), 7,09 (д, J=7,2, 2H), 6,30 (д, J=8,2, 1H), 6,10 (с, 1Н), 4,66 (с, 2Н), 3,56 (т, J=7,0, 2Н), 2,83 (т, J=7,0, 2Н), 2,72 (м, 4Н), 1,29 (м, 4Н). Приклад 23 4-[(2-Піперидин-1-ілетил)(4-хлоробензил)аміно]-2-гідроксибензальдегід (VІд). Вихід 73 %. 1 Спектр ЯМР Н, CDCl3, , м. ч.: 11,55 (с, 1Н), 9,52 (с, 1Н), 7,27 (м, 3Н), 7,10 (д, J=7,2, 2H), 6,29 (д, J=8,2, 1H), 6,12 (с, 1Н), 4,62 (с, 2Н), 3,59 (т, J=7,8, 2Н), 2,58 (т, J=7,8, 2Н), 2,44 (м, 4Н), 1,58 (м, 4Н), 1,44 (м, 2Н). Приклад 24 4-{[2-(Діетиламіно)етил](4-фторобензил)аміно}-2-гідроксибензальдегід (VІe). Вихід 68 %. 1 Спектр ЯМР Н, CDCl3, , м. ч.: 11,50 (с, 1Н), 9,49 (с, 1Н), 7,25 (д, J=7,4, 1H), 7,10 (т, J=7,0, 2H), 6,98 (т, J=8,8, 2H), 6,28 (д, J=9,0, 1Н), 6,10 (с, 1Н), 4,61 (с, 2Н), 3,51 (т, J=7,2, 2Н), 2,65 (т, J=7,1, 2Н), 2,53 (к, J=6,9, 4H), 0,99 (т, J=6,9, 6H). Приклад 25 4-{[2-(Діетиламіно)етил](4-метилбензил)аміно}-2-гідроксибензальдегід (VІe). Вихід 77 %. 1 Спектр ЯМР Н, CDCІ3, , м. ч.: 11,53 (с, 1Н), 9,46 (с, 1Н), 7,22 (д, J=8,4, 1Н), 7,10 (д, J=8,0, 2H), 7,00 (д, J=8,0, 2H), 6,28 (д, J=9,0, Ш), 6,11 (с, 1Н), 4,59 (с, 2Н), 3,51 (т, J=7,6, 2Н), 2,65 (т, J=7,6, 2Н), 2,51 (к, J=6,8, 4H), 2,29 (с, 3Н), 0,98 (т, J=6,8, 6H). Приклад 26 4-{[2-(Діетиламіно)етил](3-трифторометилбензил)аміно}-2-гідроксибензальдегід (VІж). Вихід 1 70 %. Спектр ЯМР Н, CDCl3, , м. ч.: 11,49 (с, 1Н), 9,47 (с, 1Н), 7,46 (д, J=8,0, 1Н), 7,37 (м, 2Н), 7,20 (м, 2Н), 6,22 (д, J=8,6, 1Н), 6,05 (с, 1Н), 4,68 (с, 2Н), 3,51 (т, J=7,2, 2H), 2,65 (т, J=7,2, 2H), 2,48 (к, J=6,8, 4H), 0,95 (т, J=6,8, 6H). Приклад 27 6 UA 102608 C2 5 10 15 20 25 30 35 40 45 50 55 4-{[2-(Діетилтиламіно)етил](4-трифторометилбензил)аміно}-2-гідроксибензальдегід (VІз). 1 Вихід 75 %. Спектр ЯМР Н, CDCl3, , м. ч.: 11,56 (с, 1Н), 9,52 (с, 1Н), 7,57 (д, J=6,3, 2H), 7,27 (м, 3Н), 6,25 (д, J=8,5, 1H), 6,10 (с, 1Н), 4,73 (с, 2Н), 3,56 (т, J=7,8, 2H), 2,69 (т, J=7,8, 2H), 2,54 (к, J=8,1, 4H), 1,01 (т, J=8,1, 6H). Приклад 28 4-[(2-Піперидин-1-ілетил)(4-трифторометилбензил)аміно]-2-гідроксибензальдегід (VІи). Вихід 1 65 %. Спектр ЯМР Н, CDCl3, , м. ч.: 11,55 (с, 1Н), 9,50 (с, 1Н), 7,52 (д, J=6,8, 2Н), 7,25 (м, 2Н), 6,30 (д, J=8,6, 1H), 6,09 (с, 1Н), 4,71 (с, 2Н), 3,72 (т, J=7,8, 2Н), 2,71 (т, J=7,8, 2Н), 2,58 (м, 4Н), 1,64 (м, 4Н), 1,46 (м, 2Н). Приклад 29 3-{[2-(Діетилтиламіно)етил](4-ціанобензил)аміно}-2-гідроксибензальдегід (Vli). Вихід 67 %. 1 Спектр ЯМР Н, CDCl3, , м. ч.: 11,54 (с, 1Н), 9,55 (с, 1Н), 7,64 (д, J=6,2, 2H), 7,30 (м, 3Н), 6,27 (д, J=8,2, 1Н), 6,10 (с, 1Н), 4,75 (с, 2Н), 3,57 (т, J=7,8, 2H), 2,70 (т, J=7,8, 2H), 2,57 (к, J=7,0, 4H), 1,02(t, J=7,0,6H). Приклад 30 4-{(4-Дифторометоксибензил)[2-(діетилтиламіно)етил]аміно}-2-гідроксибензальдегід (VІї). 1 Вихід 71 %. Спектр ЯМР Н, CDCl3, , м. ч.: 11,57 (с, 1Н), 9,52 (с, 1Н), 7,29 (д, J=7,0, 1Н), 7,17 (д, J=8,5, 2Н), 7,10 (д, J=8,5, 2Н), 6,64 (т, J=74, 1Н), 6,29 (д, J=8,5, 1Н), 6,13 (с, 1Н), 4,66 (с, 2Н), 3,55 (т, J=7,8, 2Н), 2,69 (т, J=7,8, 2H), 2,54 (к, J=8,1, 4H), 1,02 (т, J=8,1, 6H). Приклад 31 4-{[2-(Діетилтиламіно)етил](4-трифторометоксибензил)аміно}-2-гідроксибензальдегід (VІк). 1 Вихід 62 %. Спектр ЯМР H, CDCl3, , м. ч.: 11,56 (с, 1Н), 9,51 (с, 1Н), 7,30 (д, J=6,6, 1H), 7,23 (д, J=8,0, 2Н), 7,12 (д, J=8,0, 2H), 6,30 (д, J=8,5, 1Н), 6,12 (с, 1Н), 4,67 (с, 2Н), 3,57 (т, J=7,8, 2H), 2,65 (т, J=7,8, 2Н), 2,57 (к, J=8,0, 4H), 1,01 (т, J=8,0, 6H). Приклад 32 3-{(3,4-Дихлоробензил)[2-(діетилтиламіно)етил]-аміно}-2-гідроксибензальдегід(VІл). Вихід 1 74 %. Спектр ЯМР Н, CDCl3, , м. ч.: 11,58 (с, 1Н), 9,54 (с, 1Н), 7,41 (д, J=9,0 1Н), 7,28 (м, 2Н), 7,02 (д, J=9,0, 1H), 6,28 (д, J=8,8, 1Н), 6,11 (с, 1Н), 4,64 (с, 2Н), 3,55 (т, J=7,4, 2H), 2,70 (т, J=7,4, 2H), 2,57 (к, J=7,2, 4H), 1,03 (т, J=7,2, 6H). 7-{Бензил[2-(діалкіламіно)етил]аміно}-2-оксо-2Н-хромен-3-карбоксімідаміди дигідрохлориди (Іа-л). Загальна методика. Суміш відповідного 4-{бензил[2-(діалкіламіно)етил]аміно}-2-гідроксибензальдегіду (VIa-л) (2,5 ммоль), ацетату амонію (0,19 г, 2,5 ммоль) та етилціаноацетату (0,28 г, 2,5 ммоль) в 10 мл етанолу кип'ятять 10 хв. та охолоджують до кімнатної температури. Розчин розбавляють 100 мл діетилового етеру, осад відфільтровують, промивають діетиловим етером, водою та змішують з 10 мл води. До утвореної суспензії додають 1 мл концентрованої хлористоводневої кислоти і перемішують протягом 1 год. при кімнатній температурі. Розчин упарюють, залишок сушать при температурі 80 °C. Приклад 33 7-{Бензил[2-(діетиламіно)етил]аміно}-2-оксо-2Н-хромен-3-карбоксімідоаміду дигідрохлорид 1 (Іа). Вихід 85 %. Т. плав. 192-194 °C. Спектр ЯМР Н DMSO-d6, м. ч.: 11,38 (с, 1Н), 9,23 (с, 2Н), 9,10 (с, 2Н), 8,86 (с, 1Н), 7,60 (д, J=9,2, 1Н), 7,37 (м, 2Н), 7,27 (м, 3Н), 7,10 (д, J=8,0, 1H), 6,87 (с, 1Н), 4,88 (с, 2Н), 4,16 (т, J=7,3, 2H), 3,29 (т, J=7,3, 2H), 3,18 (к, J=7,0, 4H), 1,24 (т, J=7,0, 6Н). Розраховано для C23H30Cl2N4O2: С (59,35 %), Η (6,50 %), Сl (15,23 %), N (12,04 %); знайдено С (59,03 %), Η (6,61 %), Сl (15,15 %), N (12,00 %). Приклад 34 7-{[2-(Диметиламіно)етил](4-хлоробензил)аміно}-2-оксо-2Н-хромен-3-карбоксімідоаміду 1 дигідрохлорид (16). Вихід 73 %. Т. плав. 203-205 °C. Спектр ЯМР Н, DMSО-d6, , м. ч.: 11,42 (с, 1Н), 9,22 (с, 4Н), 8,90 (с, 1Н), 7,60 (д, J=9,0, 1H), 7,47 (д, J=8,0, 2H), 7,27 (д, J=8,0, 2Н), 7,05 (д, J=9,0, 1Н), 6,86 (с, 1Н), 4,86 (с, 2Н), 4,09 (т, J=8,7, 2Н), 3,38 (т, J=8,7, 2Н), 2,82 (с, 6Н). Розраховано для C21H25Cl3N4O2: С (53,46 %), Η (5,34 %), Сl (22,54 %), Ν (11,87 %); знайдено С (53,43 %), Η (5,27 %), Сl (22,65 %), Ν (11,88 %). Приклад 35 7-{[2-(Діетиламіно)етил](4-хлоробензил)аміно}-2-оксо-2Н-хромен-3-карбоксімідоаміду 1 дигідрохлорид (Ів). Вихід 75 %. Т. плав. 204-206 °C. Спектр ЯМР Η, DMSО-d6, , м. ч.: 11,40 (с, 1Н), 9,21 (с, 4Н), 8,91 (с, 1Н), 7,59 (д, J=9,0, 1Н), 7,42 (д, J=8,5, 2H), 7,27 (д, J=8,5, 2H), 7,08 (д, J=9,0, 1Н), 6,86 (с, 1Н), 4,87 (с, 2Н), 4,15 (т, J=7,4, 2H), 3,29 (т, J=7,4, 2H), 3,17 (к, J=7,0, 4H), 1,25 13 (т, J=7,0, 6Н). Спектр ЯМР С, DMSО-d6, , м. ч.: 161,37 (С), 158,72 (С), 157,08 (С), 148,22 (СН), 7 UA 102608 C2 5 10 15 20 25 30 35 40 45 50 55 135,99 (С), 131,96 (СН), 131,74 (С), 128,65 (СН), 128,38 (СН), 111,42 (СН), 108,09 (С), 104,99 (С), 97,71 (СН), 52,83 (СН2), 47,29 (СН2), 46,03 (СН2), 45,61 (СН2), 8,31 (СН3). LC/MS (М+1):427. Розраховано для С23Н29Сl3N4О2: С (55,26 %), Η (5,85 %), Сl (21,28 %), N (11,21 %); знайдено С (55,17 %), Η (5,82 %), Сl (21,30 %), N (11,25 %). Приклад 36 7-[(2-Піролідин-1-ілетил)(4-хлоробензил)аміно]-2-оксо-2H-хромен-3-карбоксімідоаміду 1 дигідрохлорид (Іг). Вихід 78 %. Т. плав. 203-205 °C. Спектр ЯМР Н, DMSO-d6, , м. ч.: 11,65 (с, 1Н), 9,20 (с, 2Н), 9,15 (с, 2Н), 8,90 (с, 1Н), 7,60 (д, J=9,0, 1Н), 7,43 (д, J=8,0, 2Н), 7,27 (д, J=8,0, 2Н), 7,06 (д, J=9,0, 1Н), 6,86 (с, 1Н), 4,88 (с, 2Н), 4,08 (т, J=7,7, 2H), 3,55 (т, J=7,7, 2H), 3,08 (м, 4Н), 2,01 (м, 4Н). Розраховано для C23H27Cl3N4O2: С (55,49 %), Η (5,47 %), Сl (21,36 %), N (11,25 %); знайдено С (55,39 %), Η (5,56 %), Сl (21,33 %), N (11,20 %). Приклад 37 7-[(2-Піперидин-1-ілетил)(4-хлоробензил)аміно]-2-оксо-2Н-хромен-3-карбоксімідоаміду 1 дигідрохлорид (Ід). Вихід 80 %. Т. плав. 206-208 °C. Спектр ЯМР Н, DMSО-d6, , м. ч.: 11,42 (с, 1Н), 9,22 (с, 2Н), 9,18 (с, 2Н), 8,90 (с, 1Н), 7,58 (д, J=8,8, 1Н), 7,42 (д, J=8,0, 2Н), 7,28 (д, J=8,0, 2Н), 7,07 (д, J=8,0, 1Н), 6,87 (с, 1Н), 4,86 (с, 2Н), 4,15 (т, J=7,3, 2H), 3,48 (т, J=7,3, 2H), 2,94 (т, J=6,8, 4Н), 1,81 (м, 4Н), 1,41 (м, 2Н). Розраховано для C 24H29Cl3N4O2: С (56,31 %), Η (5,71 %), Сl (20,78 %), N (10,95 %); знайдено С (55,40 %), Η (5,70 %), Сl (20,84 %), N (11,01 %). Приклад 38 7-{[2-(Діетиламіно)етил](4-фторобензил)аміно}-2-оксо-2Н-хромен-3-карбоксімідоаміду 1 дигідрохлорид (Іе). Вихід 76 %. Т. плав. 200-203 °C. Спектр ЯМР Н, DMSО-d6, м. ч.: 11,37 (с, 1Н), 9,20 (с, 1Н), 9,16 (с, 1Н), 8,87 (с, 1Н), 7,60 (д, J=9,0, 1Н), 7,29 (м, 2Н), 7,19 (д, J=8,8, 2H), 7,09 (д, J=9,0, 1H), 6,87 (с, 1Н), 4,85 (с, 2Н), 4,15 (т, J=7,0, 2H), 3,29 (т, J=7,0, 2H), 3,18 (к, J=7,0, 4Н), 1,25 (т, J=7,0, 6Н). Розраховано для C23H29Cl2FN4O2: С (57,15 %), Η (6,05 %), Сl (14,67 %), N (11,59 %); знайдено С (57,10 %), Η (6,09 %), Сl (14,61 %), N (11,59 %). Приклад 39 7-{[2-(Діетиламіно)етил](4-метилбензил)аміно}-2-оксо-2Н-хромен-3-карбоксімідоаміду 1 дигідрохлорид (Іє). Вихід 79 %. Т. плав. 199-203 °C. Спектр ЯМР Н, DMSО-d6, , м. ч.: 11,49 (с, 1Н), 9,19 (с, 1Н), 9,16 (с, 1Н), 8,88 (с, 1Н), 7,56 (д, J=9,0, 1Н), 7,14 (м, 4Н), 7,07 (д, J=9,0, 1Н), 6,87 (с, 1Н), 4,81 (с, 2Н), 4,11 (т, J=7,0, 2Н), 3,22 (т, J=7,0, 2Н), 3,12 (к, J=7,0, 4Н), 2,27 (с, 3Н), 1,21 (т, J=7,0, 6Н). Розраховано для C24H32Cl2N4O2: С (60,12 %), Η (6,73 %), Сl (14,79 %), N (11,69 %); знайдено С (60,10 %), Η (6,77 %), Сl (14,65 %), N (11,58 %). Приклад 40 7-{[2-(Діетиламіно)етил](3-трифторометилбешил)аміно}-2-оксо-2Н-хромен-31 карбоксімідоаміду дигідрохлорид (Іж). Вихід 75 %. Т. плав. 205-209 °C. Спектр ЯМР Н, DMSOd6, , м. ч.: 11,28 (с, 1Н), 9,17 (с, 1Н), 9,11 (с, 1Н), 8,82 (с, 1Н), 7,60 (м, 4Н), 7,52 (м, J=8,4, 4H), 7,09 (д, J=9,0, 1H), 6,90 (с, 1Н), 4,98 (с, 2Н), 4,17 (т, J=7,2, 2Н), 3,23 (т, J=7,2, 2H), 3,18 (к, J=7,0, 4H), 1,24 (т, J=7,0, 6Н). Розраховано для C 24H29Cl2F3N4О2: С (54,04 %), Η (5,48 %), Сl (13,29 %), Ν (10,50 %); знайдено С (54,00 %), Η (5,49 %), Сl (13,22 %), Ν (10,55 %). Приклад 41 7-{[2-(Діетиламіно)етил](4-трифторометилбензил)аміно}-2-оксо-2Н-хромен-3-карбоксімідамід 1 (Із). Вихід 74 %. Т. плав. 201-203 °C. Спектр ЯМР Н DMSO-d6, , м. ч.: 11,43 (с, 1Н), 9,19 (с, 4Н), 8,86 (с, 1Н), 7,74 (д, J=7,8, 2Н), 7,61 (д, J=9,0, 1Н), 7,46 (д, J=7,8, 2Н), 7,09 (д, J=9,0, 1Н), 6,88 (с, 1Н), 4,99 (с, 2Н), 4,17 (т, J=6,8, 2H), 3,57 (т, J=6,8, 2H), 3,17 (к, J=6,5, 4H), 1,26 (т, J=6,5, 6Н). Розраховано для C24H29Cl2F3N4O2: С (54,04 %), Η (5,48 %), СІ (13,29 %), Ν (10,50 %); знайдено С (54,02 %), Η (5,44 %), Cl (13,35 %), Ν (10,51 %). Приклад 42 7-[(2-Піперидин-1-ілетил)(4-трифторометилбензил)аміно]-2-оксо-2Н-хромен-31 карбоксімідоаміду дигідрохлорид (Ій). Вихід 81 %. Т. плав. 208-212 °C. Спектр ЯМР Н, DMSOd6, , м. ч.: 11,37 (с, 1Н), 9,21 (с, 4Н), 8,90 (с, 1Н), 7,74 (д, J=8,0, 1H), 7,60 (д, J=8,0, 1H), 7,45 (д, J=8,0, 2H), 7,08 (д, J=8,0, 1Н), 6,88 (с, 1Н), 4,98 (с, 2Н), 4,18 (т, J=7,3, 2Н), 3,51 (м, 2Н), 3,33 (м, 2Н), 2,93 (м, 2Н), 1,80 (м, 5Н), 1,40 (м, 1Н). Розраховано для C 25H29Cl2F3N4О2: С (55,05 %), Η (5,36 %), Cl (13,00 %), Ν (10,27 %); знайдено С (55,01 %), Η (5,40 %), Cl (12,87 %), Ν (10,33 %). Приклад 43 7-{[2-(Діетиламіно)етил](4-ціанобензил)аміно}-2-оксо-2Н-хромен-3-карбоксамідин (Іі). Вихід 1 72 %. Т. плав. 210-212 °C. Спектр ЯМР Н, DMSO-d6, , м. ч.: 11,43 (с, 1Н), 9,19 (с, 4H), 8,87 (с, 1Н), 7,84 (д, J=7,3, 2H), 7,58 (д, J=7,6, 1Н), 7,43 (д, J=7,3, 2Н), 7,06 (д, J=7,3, 1Н), 6,86 (с, 1Н), 4,99 (с, 2Н), 4,16 (т, J=6,8, 2H), 3,56 (т, J=6,8, 2H), 3,17 (к, J=6,4, 4H), 1,24 (т, J=6,4, 6H). 8 UA 102608 C2 5 10 15 20 25 30 35 40 45 Розраховано для C24Н29Cl2N5О2 С (58,78 %), Η (5,96 %), Сl (14,46 %), Ν (14,28 %); знайдено С (58,79 %), Η (5,99 %), Сl (14,22 %), Ν (14,43 %). Приклад 44 7-{(4-Дифторометоксибензил)[2-(діетиламіно)етил]аміно}-2-оксо-2Н-хромен-31 карбоксімідамід (Ії). Вихід 72 %. Т. плав. 203-206 °C. Спектр ЯМР Н, DMSO-d6, , м. ч.: 11,44 (с, 1Н), 9,20 (с, 4H), 8,89 (с, 1Н), 7,60 (д, J=8,4, 1Н), 7,30 (д, J=7,0, 2H), 7,24 (т, J=72, 1H), 7,19 (д, J=7,0, 2H), 7,08 (д, J=8,4, 1Н), 6,87 (с, 1Н), 4,87 (с, 2Н), 4,16 (т, J=6,8, 2H), 3,28 (т, J=6,8, 2H), 3,18 (к, J=6,5, 4H), 1,25 (т, J=6,5, 6H). Розраховано для C 24H30Cl2F2N4O3: С (54,24 %), Η (5,69 %), Сl (13,34 %), Ν (10,54 %); знайдено С (54,28 %), Η (5,64 %), Сl (13,33 %), Ν (10,61 %). Приклад 45 7-{[2-(Діетиламіно)етил](4-трифторометоксибензил)аміно}-2-оксо-2Н-хромен-31 карбоксімідамід (Ік). Вихід 70 %. Т. плав. 201-205 °C. Спектр ЯМР Η, DMSO-d6, , м. ч.: 11,43 (с, 1Н), 9,21 (с, 4Н), 8,89 (с, 1Н), 7,61 (д, J=8,0, 1H), 7,36 (д, J=7,0, 2H), 7,19 (д, J=7,0, 2H), 7,09 (д, J=8,4, 1H), 6,89 (с, 1Н), 4,89 (с, 2Н), 4,15 (т, J=7,0, 2H), 3,28 (т, J=7,0, 2H), 3,18 (к, J=7,0, 4H), 1,26 (т, J=7,0, 6Н). Розраховано для C24H29Cl2F3N4O3: С (52,47 %), Η (5,32 %), Сl (12,91 %), Ν (10,20 %); знайдено С (52,43 %), Η (5,33 %), Сl (12,99 %), Ν (10,27 %). Приклад 46 7-{(3,4-Дихлоробензил)[2-(діетилтиламіно)етил]-аміно}-2-оксо-2Н-хромен-3-карбоксімідамід 1 (Іл). Вихід 83 %. Т. плав. 218-222 °C. Спектр ЯМР Н, DMSO-c4, δ, м. ч.: 11,44 (с, 1Н), 9,20 (с, 4Н), 8,88 (с, 1Н), 7,64 (м, 2Н), 7,52 (с, 1Н), 7,24 (д, J=7,2, 2Н), 7,09 (д, J=6,4, 1Н), 6,89 (с, 1Н), 4,89 (с, 2Н), 4,17 (т, J=7,3, 2H), 3,42 (т, J=7,3, 2H), 3,18 (к, J=6,8, 4H), 1,25 (т, J=6,8, 6H). Розраховано для C23H28Cl4N4O2 С (51,70 %), Η (5,28 %), Сl (26,54 %), Ν (10,49 %); знайдено С (51,65 %), Η (5,30 %), Сl (26,33 %), Ν (10,62 %). Джерела інформації: 1. Sakurai Α., Midorikawa H. The Cyclization of Ethyl Cyanoacetate and Salicylaldehyde or 3Methoxysalicylaldehyde with Ketones by Means of Ammonium Acetate. // Bull. Chem. Soc. Japan.1970. Vol. 43, P. 2925-2933. 2. Pat. DE 2527792 (Al). 21 June 1976. Gertisser В., Henzi B. 7-Aminocoumarin or coumarinimide dyes free of sulfonic acid groups. 3. Laurent J., Stanicki D., Huang T.L., Dei-Cas E, Pottier M., Aliouat E., Vanden Eynde J.J. Bisbenzamidines as Antifungal Agents. // Molecules.-2010. Vol. 15, P. 4283-4293. 4. Salom-Roig X.J., Hamze Α., Calas M., Vial H.J. Dual Molecules as New Antimalarials. // Combinatorial Chemistry and High Throughput Screening.-2005. Vol. 8, P. 49-62. 5. Steck E.A., Kinnamon K.E., Rane D.S., Hanson W.L. Leishmania donovani, Plasmodium berghei, Trypanosoma rhodesiense: Antiprotozoal effects of some amidine types. // Experimental Parasitology.-1981. Vol. 52, p. 404-413. 6. Chen X., Orser B.A., MacDonald J.F. Design and screening of ASIC inhibitors based on aromatic diamidines for combating neurological disorders. // Eur. J. Pharmacol.-2010. Vol. 648, P. 1523. 7. Kennedy A.J., Mathews T.P., Kharel Y., Field S.D., Moyer M.L., East J.E., Houck J.D., Lynch K.R., Macdonald T.L. Development of amidine-based sphingosine kinase 1 nanomolar inhibitors and reduction of sphingosine 1-phosphate in human leukemia cells. // J. Med. Chem.-2011. Vol. 54, P. 3524-3548. 8. Aoyama Т., Okutome Т., Nakayama Т., Yaegashi Т., Matsui R., Nunomura S., Kurumi M., Sakurai Y., Fujii S. Synthesis and structure-activity study of protease inhibitors. IV. Amidinonaphthols and related acyl derivatives. // Chem. Pharm. Bull.-1985. Vol. 33, P. 1458-1471. 9 UA 102608 C2 ФОРМУЛА ВИНАХОДУ 5 Похідна 7-[(2-аміноетил)бензиламіно]-2-оксо-2H-хромен-3-карбоксімідаміду загальної формули І: NH (R1)n NH2 (R2)m N R3 10 15 20 25 30 35 O O N R4 , I де 1 2 R та R незалежно означають гідроген, (С1-С6)алкіл, цикло(С1-С6)алкіл, (С1-С6)алкеніл, (С1С6)алкініл, арил, арил(С1-С6)алкіл, гетарил, гетарил(С1-С6)алкіл, гало(С1-С6)алкіл, гідроксі(С1С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси, цикло(С1-С6)алкокси, арил(С1-С6)алкокси, гетарил(С1-С6)алкокси, гало(С1-С6)алкокси, аміно, (С1-С6)алкіламіно, цикло(С1-С6)алкіламіно, ді(С1-С6)алкіламіно, дицикло(С1-С6)алкіламіно, аміно(С1-С6)алкіл, аміноцикло(С1-С6)алкіл, моно(С1-С6)алкіламіно(С1-С6)алкіл, моноцикло(С1-С6)алкіламіно(С1-С6)алкіл, ді(С1С6)алкіламіно(С1-С6)алкіл, дицикло(С1-С6)алкіламіно(С1-С6)алкіл, (С1-С6)алкілкарбоніл, цикло(С1С6)алкілкарбоніл, арилкарбоніл, гетарилкарбоніл, арил(С 1-С6)алкілкарбоніл, гетарил(С1С6)алкілкарбоніл, (С1-С6)алкілкарбоніламіно, цикло(Сг-С6)алкілкарбоніламіно, арилкарбоніламіно, гетарилкарбоніламіно, арил(С 1-С6)алкілкарбоніламіно, гетарил(С1С6)алкілкарбоніламіно, (С1-С6)алкоксикарбоніл, цикло(С1-С6)алкоксикарбоніл, арилоксикарбоніл, гетарилоксикарбоніл, арил(С1-С6)алкоксикарбоніл, гетарил(С1-С6)алкоксикарбоніл, гідроксикарбоніл, амінокарбоніл, (С1-С6)алкіламінокарбоніл, цикло(С1-С6)алкіламінокарбоніл, ді(С1-С6)алкіламінокарбоніл, дицикло(С1-С6)алкіламінокарбоніл, (С1-С6)алкілсульфоніл, цикло(С1-С6)алкілсульфоніл, арил(С 1-С6)алкілсульфоніл, гетарил(С1-С6)алкілсульфоніл, арилсульфоніл, гетарилсульфоніл, гетарил(С 1-С6)алкілсульфоніл, (С1-С6)алкіламіносульфоніл, цикло(С1-С6)алкіламіносульфоніл, ді(С1-С6)алкіламіносульфоніл, дицикло(С1С6)алкіламіносульфоніл, ариламіносульфоніл, гетариламіносульфоніл, аміносульфоніл, (С 1-С6)алкілсульфоніламіно, цикло(С1-С6)алкілсульфоніламіно, ді(С1-С6)алкілсульфоніламіно, дицикло(С1С6)алкілсульфоніламіно, арилсульфоніламіно, гетарилсульфоніламіно, арил(С 1С6)алкілсульфоніламіно, гетарил(С1-С6)алкілсульфоніламіно, галоген, ОН, CN, NO2; 1 n означає кількість незалежних різних або однакових замісників R та має значення 1, 2 або 3; 2 m означає кількість незалежних різних або однакових замісників R та має значення 1, 2, 3, 4, 5; 3 4 R та R незалежно означають (С1-С6)алкіл, цикло(С1-С6)алкіл, (С1-С6)алкеніл, (С1-С6)алкініл, арил, арил(С1-С6)алкіл, гетарил, гетарил(С1-С6)алкіл, гало(С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1С6)алкоксі(С1-С6)алкіл, 3 4 або R та R разом з атомом нітрогену, до якого вони приєднані, утворюють цикл: N k , де k має значення 0, 1, 2, 3, 4; або її стереоізомер, або її сіль з неорганічною або органічною кислотою або основою. Комп’ютерна верстка М. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 10
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 7-[(2-aminoethyl)benzylamino]-2-oxo-2h-chromene-3-carboximidamides and salts thereof
Автори англійськоюSukach Volodymyr Andriiovych, Shoba Veronika Mykhailivna, Vaskevych Ruslan Ivanovych, Vovk Mykhailo Volodymyrovych, Maksymiuk Oleksandr Petrovych, Buta Andrii Zenoviiovych, Kryshtal Oleh Oleksandrovych, Kovalskyi Dmytro Borysovych
Назва патенту російськоюПроизводные 7-[(2-аминоэтил)бензиламино]-2-оксо-2н-хромен-3-карбоксимидамидов и их соли
Автори російськоюСукач Владимир Андреевич, Шоба Вероника Михайловна, Васькевич Руслан Иванович, Вовк Михаил Владимирович, Максимюк Александр Петрович, Бута Андрей Зиновьевич, Кришталь Олег Александрович, Ковальский Дмитрий Борисович
МПК / Мітки
МПК: C07D 311/16, C07D 311/06
Мітки: 7-[(2-аміноетил)бензиламіно]-2-оксо-2н-хромен-3-карбоксімідамідів, похідні, солі
Код посилання
<a href="https://ua.patents.su/12-102608-pokhidni-7-2-aminoetilbenzilamino-2-okso-2n-khromen-3-karboksimidamidiv-ta-kh-soli.html" target="_blank" rel="follow" title="База патентів України">Похідні 7-[(2-аміноетил)бензиламіно]-2-оксо-2н-хромен-3-карбоксімідамідів та їх солі</a>
Попередній патент: Пристрій для проведення трубок сонячної батареї через покрівлю
Наступний патент: Спосіб дегазації тари від фосфіну на борту судна
Випадковий патент: Спосіб діагностики гіпоксії головного мозку