Спосіб одержання 6-(4-хлорфеніл)-2,2-диметил-7-феніл-2,3-дигідро-1н-піролізин-5-іл-оцтової килоти
Номер патенту: 75702
Опубліковано: 15.05.2006
Автори: Даннхардт Герд, Каммермайєр Томас, Штрігель Ханс-Гюнтер, Меркле Філіпп, Лауфер Штефан
Формула / Реферат
1. Спосіб одержання сполуки формули (І):
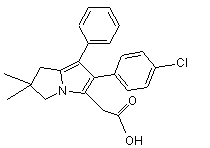 , (І)
, (І)
в якому
а) сполуку формули (IV):
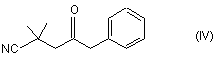
перетворюють в сполуку формули (III):
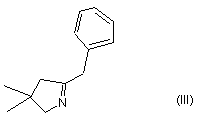
тим, що
а1) сполуку формули (IV) каталітично гідрують або
а2) сполуку формули (IV) перетворюють в кеталь формули (IVa):
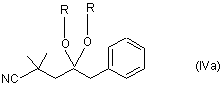 ,
,
де залишки R, які можуть бути однаковими або різними, означають (С1-С4)-алкіл або разом означають (С2-С3)-алкілен, і кеталь каталітично гідрують;
b) сполуку формули (III) вводять у взаємодію із ![]() -бром-4-хлорацетофеноном з одержанням сполуки формули (II):
-бром-4-хлорацетофеноном з одержанням сполуки формули (II):
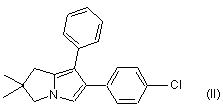 ,
,
с) в сполуку формули (II) вводять залишок оцтової кислоти.
2. Спосіб одержання сполуки формули (II):
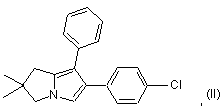
в якому сполуку формули (IV):

перетворюють в сполуку формули (III):

тим, що
а1) сполуку формули (IV) каталітично гідрують або
а2) сполуку формули (IV) перетворюють в кеталь формули (IVa):
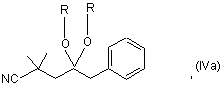
де залишки R, які можуть бути однаковими або різними, означають (С1-С4)-алкіл або разом означають (С2-С3)-алкілен, і кеталь каталітично гідрують; і
b) сполуку формули (III) вводять у взаємодію із ![]() -бром-4-хлорацетофеноном з одержанням сполуки формули (II).
-бром-4-хлорацетофеноном з одержанням сполуки формули (II).
3. Спосіб одержання сполуки формули (III):
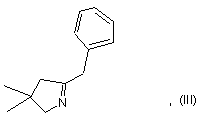
в якому сполуку формули (IV):

перетворюють в сполуку формули (III) тим, що
а1) сполуку формули (IV) каталітично гідрують або
а2) сполуку формули (IV) перетворюють в кеталь формули (IVa):
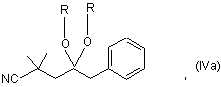
де залишки R, які можуть бути однаковими або різними, означають (С1-С4)-алкіл або разом означають (С2-С3)-алкілен, і кеталь каталітично гідрують.
4. Спосіб за будь-яким з пп.1-3, який відрізняється тим, що при каталітичному гідруванні застосовують безводний нікель Ренея як каталізатор.
5. Спосіб за будь-яким з пп.1-4, який відрізняється тим, що гідрування здійснюють в толуолі або суміші з толуолу і (С1-С4)-спирту як розчинника.
6. Спосіб за будь-яким з пп.1-5, який відрізняється тим, що використовують сполуку формули (IV) з чистотою щонайменше 95%.
7. Спосіб за будь-яким з пп.1-6, який відрізняється тим, що сполуку формули (IV) одержують шляхом реакції приєднання по Міхаелю ізобутиронітрилу до сполуки формули (V):
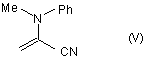 ,
,
бензилування продукту реакції приєднання по Міхаелю з одержанням 2-бензил-4,4-диметил-2-(N-метиланіліно)глутаронітрилу і гідролізу цього нітрилу.
8. Спосіб за п. 7, який відрізняється тим, що ізобутиронітрил депротонується за допомогою діізопропіламіду літію в толуолі.
9. Спосіб за п. 7 або 8, який відрізняється тим, що температура при реакції приєднання по Міхаелю знаходиться в діапазоні від приблизно -10°С до -20°С.
10. Спосіб за будь-яким з пп. 7-9, який відрізняється тим, що гідроліз нітрилу здійснюють в кислоті в двофазній системі при міжфазному каталізі.
11. Спосіб за будь-яким з пп.7-10, який відрізняється тим, що сполуку формули (V) одержують шляхом взаємодії хлорацетальдегіду, N-метиланіліну і
ціаніду лужного металу і подальшого основного елімінування.
12. Спосіб за п.11, який відрізняється тим, що до N-метиланіліну додають хлорацетальдегід і потім ціанід лужного металу.
13. Спосіб за п. 11 або 12, який відрізняється тим, що хлорацетальдегід, N-метиланілін і ціанід лужного металу використовують в молярному співвідношенні від приблизно 1,1 до 1,3:1:1,1-1,3.
14. Спосіб за будь-яким з пп. 11-13, який відрізняється тим, що основне елімінування здійснюють міжфазним каталізом в двофазній системі.
Текст
1. Спосіб одержання сполуки формули (І): 2 , (II) O (IV) O NC OH , (І) в якому а) сполуку формули (IV): перетворюють в сполуку формули (III): O (IV) NC перетворюють в сполуку формули (III): N (III) тим, що а1) сполуку формули (IV) каталітично гідрують або а2) сполуку формули (IV) перетворюють в кеталь формули (IVa): (19) N UA в якому сполуку формули (IV): Cl 3 R R O O , (IVa) NC де залишки R, які можуть бути однаковими або різними, означають (С1-С4)-алкіл або разом означають (С2-С3)-алкілен, і кеталь каталітично гідрують; і b) сполуку формули (III) вводять у взаємодію із бром-4-хлорацетофеноном з одержанням сполуки формули (II). 3. Спосіб одержання сполуки формули (III): , (III) N в якому сполуку формули (IV): O (IV) NC перетворюють в сполуку формули (III) тим, що а1) сполуку формули (IV) каталітично гідрують або а2) сполуку формули (IV) перетворюють в кеталь формули (IVa): R NC R O O , (IVa) де залишки R, які можуть бути однаковими або різними, означають (С1-С4)-алкіл або разом означають (С2-С3)-алкілен, і кеталь каталітично гідрують. 4. Спосіб за будь-яким з пп.1-3, який відрізняється тим, що при каталітичному гідруванні застосовують безводний нікель Ренея як каталізатор. 5. Спосіб за будь-яким з пп.1-4, який відрізняється тим, що гідрування здійснюють в толуолі або суміші з толуолу і (С1-С4)-спирту як розчинника. 6. Спосіб за будь-яким з пп.1-5, який відрізняється тим, що використовують сполуку формули (IV) з чистотою щонайменше 95%. Даний винахід відноситься до способу одержання 6-(4-хлорфеніл)-2,2-диметил-7-феніл-2,3дигідро-1Н-піролізин-5-іл-оцтової кислоти (ML 3000) і одержання проміжних продуктів, що використовуються в цьому способі. ML 3000 є перспективним інгібітором циклооксигенази і 5-ліпоксигенази і, таким чином, придатна для лікування ревматичних форм захворювань і для профілактичної обробки алергічно індукованих захворювань; [див., наприклад, Drugs of the Future, 20 (10), 1007-1009 (1995)]. У цій публікації вказується також можливий шлях одержання. Інші можливості одержання описуються [в заявці ЕР-А397175; заявках WO-95/32970, WO-95/32971, WO95/32972; Archiv der Pharmazie, 312, 896-907 (1979) і 321, 159-162 (1988); J. Med. Chem., (37), 18941897 (1994); Arch. Pharm. Med. Chem., 330, 307312 (1997)]. У випадку всіх цих синтезів структуру основного піролізинового фрагмента одержують згідно з представленим у вигляді реакційної схеми способом: 75702 4 7. Спосіб за будь-яким з пп.1-6, який відрізняється тим, що сполуку формули (IV) одержують шляхом реакції приєднання по Міхаелю ізобутиронітрилу до сполуки формули (V): Me N Ph (V) CN , бензилування продукту реакції приєднання по Міхаелю з одержанням 2-бензил-4,4-диметил-2-(Nметиланіліно)глутаронітрилу і гідролізу цього нітрилу. 8. Спосіб за п. 7, який відрізняється тим, що ізобутиронітрил депротонується за допомогою діізопропіламіду літію в толуолі. 9. Спосіб за п. 7 або 8, який відрізняється тим, що температура при реакції приєднання по Міхаелю знаходиться в діапазоні від приблизно -10°С до -20°С. 10. Спосіб за будь-яким з пп. 7-9, який відрізняється тим, що гідроліз нітрилу здійснюють в кислоті в двофазній системі при міжфазному каталізі. 11. Спосіб за будь-яким з пп.7-10, який відрізняється тим, що сполуку формули (V) одержують шляхом взаємодії хлорацетальдегіду, Nметиланіліну і ціаніду лужного металу і подальшого основного елімінування. 12. Спосіб за п.11, який відрізняється тим, що до N-метиланіліну додають хлорацетальдегід і потім ціанід лужного металу. 13. Спосіб за п. 11 або 12, який відрізняється тим, що хлорацетальдегід, N-метиланілін і ціанід лужного металу використовують в молярному співвідношенні від приблизно 1,1 до 1,3:1:1,1-1,3. 14. Спосіб за будь-яким з пп. 11-13, який відрізняється тим, що основне елімінування здійснюють міжфазним каталізом в двофазній системі. Взаємодію здійснюють в дихлорметані, етанолі або діетиловому ефірі. Бромоводень, що утворюється під час реакції, вловлюють шляхом додавання водного розчину гідрокарбонату натрію. Введення залишку оцтової кислоти в положення 5 можна здійснювати шляхом взаємодії з ефірами діазооцтової кислоти, хлорангідридом ефіру щавлевої кислоти або оксалілхлоридом і подальшого омилення, відповідно, омилення і відновлення кетогрупи з допомогою гідразину. [В Arch. Pharm., 312, 896-907 (1979)] описується наступне перетворення: 5 75702 6 Перетворення здійснюють в бензолі як розгається, вихід продукту на стадії 3 є незадовільчиннику. Угрупування СОСОСl потім, однак, не ним. переводять в залишок оцтової кислоти, а вводять Додаткові технічні проблеми виникають внау взаємодію з діетиламіном. слідок того, що сирі продукти зі стадій 1 і 3 внасліСира ML 3000, яку одержують за способом з док реакції виходять дуже кислими, що приводить використанням гідразину у вигляді калієвої солі і до явищ корозії в апаратурі. яку потім осаджують з підкисленою мінеральною Якщо 4-хлор-3,3-диметилбутиронітрил має кислотою реакційної суміші, поряд із складнорознеобхідну чистоту, то приєднання реактиву Грін'ячинними у воді калієвими солями містить також ра бензилмагнійхлориду на стадії 4 з утворенням гідразин, побічні продукти і продукти розкладання 5-бензил-3,3-диметил-3,4-дигідро-2Н-піролу і на(продукт декарбоксилювання, а також димер) у ступна за цим циклізація з ω-бром-4вигляді домішок. Це вимагає додаткових операцій хлорацетофеноном на стадії 5 приводять до одепо очищенню. ржання 6-(4-хлорфеніл)-2,2-диметил-7-феніл-2,3[У заявці РСТ/ЕР 01/00852] розкривається дигідро-1H-піролізину хорошої якості і з виходом спосіб одержання ML 3000 шляхом взаємодії 6-(4після закінчення обох стадій від 40% до 45%. хлорфеніл)-2,2-диметил-7-феніл-2,3-дигідро- 1НОдержаний на стадії 5 піролізин, потім шляхом піролізину з оксалілхлоридом і гідразином з подавзаємодії з оксалілхлоридом, подальшого відновльшим особливим способом обробки. При цьому, лення за допомогою гідразину в присутності гідропісля взаємодії піролізину з оксалілхлоридом, одексиду лужного металу і підкислення, перетворюржаний продукт обробляють гідразином і гідроксиють в 6-(4-хлорфеніл)-2,2-диметил-7-феніл-2,3дом лужного металу у водній фазі при підвищеній дигідро-1Н-піролізин-5-ілоцтову кислоту (ML 3000). температурі, після закінчення обробки за рахунок Вихід на цій стадії 6 становить, в залежності від додання незмішуваного або тільки обмежено змічистоти продукту, приблизно 62-86%. шуваного простого ефіру з водою одержують триВідомий спосіб приводить до одержання ML фазну систему і ML 3000 виділяють шляхом підки3000 з прийнятною чистотою і виходом, однак, має слення середньої фази. Одержують поліморфну деякі недоліки, як проблематичні хімічні реакції на ML 3000 з високим виходом і в чистій, визначеній другій і третій стадіях, вимогу необхідної чистоти кристалічній формі. проміжних продуктів перед подальшою реакцією, Загалом, синтез здійснюють за допомогою особливо перед реакцією Грін'яра, тривалі часи вказаних в наступній реакційній схемі стадій: здійснення і проблеми корозії в апаратурі при очищенні дуже кислих продуктів реакції, що одержуються на стадіях 1 і 3. Задачею даного винаходу тому є розробка способу одержання 6-(4-хлорфеніл)-2,2-диметил7-феніл-2,3-дигідро-1Н-піролізин-5-ілоцтової кислоти (ML 3000), при якому уникають цих недоліків рівня техніки. За допомогою способу, що пропонується згідно з винаходом, особливо долаються технічні ускладнення на стадіях 1-4 синтезу, що існував досі, виключаються "неприємні" хімічні реакції на другій і третій стадіях синтезу, уникають реакції Гріньяра, підвищуються загальні виходи, меншають часи здійснення і, таким чином, загалом досягається більш рентабельний загальний синСтадії 1 і 2 відомі [із заявки ЕР 0172371-А1]. Взаємодію 2,2-диметил-1,3-пропандіолу з тіонілхтез. Поставлена задача вирішується способом лоридом здійснюють в інертному органічному розчиннику, наприклад, в галогенованому вуглеводні одержання сполуки формули (І): або простому ефірі, переважно при температурі від 0°С до 60°С. Подальшу взаємодію утворюваного 5,5-диметил-1,3,2-діоксатіан-2-оксиду з ціанідом (I) натрію з одержанням 4-гідрокси-3,3диметилбутиронітрилу здійснюють в диметилсульфоксиді при температурі приблизно 80-120°С. причому На стадії 1 вихід складає від приблизно 93% до а) сполуку формули (IV): 99% і на стадії 2 досягають виходу від приблизно 55% до 60% при хорошій якості продукту. (IV) У випадку стадії 3, для взаємодії з тіонілхлоперетворюють в сполуку формули (III): ридом з утворенням 4-хлор-3,3диметилбутиронітрилу, необхідний форпродукт високої чистоти. Сирі продукти з стадій 1 і 2 перед (III) подальшим введенням у взаємодію треба піддавати перегонці. Також одержаний на стадії 3 4-хлор-3,3тим, що диметилбутиронітрил треба піддавати перегонці а1) сполуку формули (IV) каталітично гідрують через високу чистоту, що вимагається для подаабо льшої реакції Грін'яра. При чистоті 97%, що вимаа2) сполуку формули (IV) перетворюють в ке 7 75702 8 таль формули (IVa): (IVa) де залишки R, які можуть бути однаковими або різними, означають (С1-С4)-алкіл або разом означають (С2-С3)-алкілен, і кеталь каталітично гідрують; b) сполуку формули (III) вводять у взаємодію із ω-бром-4-хлорацетофеноном з одержанням сполуки формули (II): (II) і c) в сполуку формули (II) вводять залишок оцтової кислоти. Об'єктом даного винаходу є також спосіб одержання сполуки формули (III) шляхом гідрування сполуки формули (IV) і циклізації, а також відповідний спосіб одержання проміжного продукту формули (II). Введення залишку оцтової кислоти в сполуку формули (II) переважно здійснюють шляхом взаємодії з оксалілхлоридом і відновлення кетогрупи, переважно, за допомогою гідразину і гідроксиду лужного металу. Переважний, спосіб, що пропонується згідно з винаходом можна наочно пояснити за допомогою наступної реакційної схеми: Синтез сполуки формули (IV), згідно з винаходом, переважно здійснюють за допомогою наступних стадій: 1. одержання 2-(N-метиланіліно)акрилонітрилу формули (V) з хлорацетальдегіду, N-метиланіліну і ціаніду лужного металу, наприклад, ціаніду калію: 2. одержання 2,2-диметил-4-оксо-5фенілвалеронітрилу формули (IV) шляхом приєднання по Міхаелю нітрилу ізомасляної кислоти, який депротонований за допомогою сильної основи, до сполуки формули (V), бензилування продукту приєднання по Міхаелю і гідролізу одержаного в результаті 2-бензил-4,4-диметил-2-(Nметиланіліно)глутаронітрилу. Сполуки формули (IV) і (V), а також їх одержання відомі. Так, 2-(N-метиланіліно)акрилонітрил формули (V) одержують згідно з [Н. Ahlbrecht і К. Pfaff, Synthesis, 413 (1980)]. 2,2-Диметил-4-оксо-5фенілвалеронітрил формули (IV) можна одержувати згідно з [Н. Ahlbrecht і М. Ibe, Synthesis, 421 (1985)]. Спосіб одержання 2-(Nметиланіліно)акрилонітрилу формули (V) згідно з вказаною в літературі методикою, однак, володіє недоліками, що полягають в тому, що ні при взаємодії з ціанідом натрію або калію, ні при основному елимінуванні не досягають повного перетворення, для екстракції застосовують простий ефір і продукт для очищення треба піддавати перегонці, при цьому виникають сильні втрати за рахунок розкладання. Згідно з винаходом тому пропонується модифікувати і удосконалити вказані в літературі способи і комбінувати їх в багатостадійний синтез для одержання сполуки формули (III), відповідно, формули (II) або (І). Удосконалення, що пропонуються згідно з винаходом, пояснюються нижче, їх можна використати роздільно або, переважно, у вигляді комбінації. Згідно з винаходом, вказаних недоліків уникають за рахунок того, що використовуються початкові продукти в інших молярних співвідношеннях і/або застосовуються N-метиланілін замість хлорацетальдегіду і додаються компоненти реакції і/або елімінування здійснюється в двофазній системі вуглеводень/розчин гідроксиду натрію при додаванні міжфазного каталізатора (каталізатора фазового переходу), переважно бензилтриетиламонійхлориду. Переважні умови проведення способу вказуються нижче. Хлорацетальдегід, N-метиланілін і ціанід калію використовуються в молярному співвідношенні від 1,1 до 1,3:1:1,1 до 1,3, особливо, приблизно 1,2:1:1,2. Додання N-метиланіліну протікає екзотермічно і охолоджування і/або швидкість додавання треба вибирати так, щоб температура не перевищувала 25°С. З цією метою N-метиланілін можна додавати, наприклад, до суміші з льоду і концентрованої соляної кислоти. Хлорацетальдегід, переважно у вигляді водного розчину, додають до Nметиланілінгідрохлориду, причому за рахунок придатної швидкості додавання і, у разі необхідності, охолоджування температуру підтримують при максимально 20°С. Потім додають ціанід калію у вигляді водного розчину. У цьому випадку також за рахунок придатної швидкості додавання і, у разі необхідності, охолоджування підтримують верхню межу температури 20°С Додавання N-метиланіліну, хлорацетальдегіду і ціаніду калію можна здійснювати також при значно більш низьких температурах, наприклад, нижче 0°С. Однак, переважними є температури близько 9 75702 10 вказаної верхньої межі, оскільки дозволяють здійІзобутиронітрил додається до розчину сильної снювати більш швидке додавання і вимагають основи в інертному розчиннику. Як сильна основа незначних витрат на охолоджування, не впливаюпридатний, наприклад, амід натрію, нафталінід чи негативним чином на вихід і якість продукту. натрію і переважно діізопропіламід літію (LDA). Якщо вміст N-метиланіліну в суспензії, що Депротонування переважно здійснюють у вуглеутворюється, складає нижче приблизно 10%, то водні такому як етилбензол, як розчиннику і при додають розчинник, який не змішується з водою, температурах нижче 10°С. Потім додають сполуку переважно аліфатичний або ароматичний вуглеформули (V), переважно у вигляді розчину в толуводень, особливо толуол, і проміжний продукт 3олі, причому температуру також переважно підтхлор-2-(N-метиланіліно)пропіонітрил переходить в римують нижче 10°С. Треба відповідним чином органічну фазу. Потім здійснюють елімінування в вибирати швидкості додавання ізобутиронітрилу і двофазній системі толуол/розчин гідроксиду насполуки формули (V). трію. Для прискорення і досягнення повного еліміПереважна температура реакції при приєднування додають міжфазний каталізатор, перевананні по Міхаелю складає від приблизно -10°С до жно бензилтриетиламонійхлорид. Температура 20°С. при додаванні NaOH не повинна перевищувати Якщо вміст сполуки формули (V) в реакційній 15°С, по закінченні додавання її можна підвищувасуміші знижується до величини нижче приблизно ти до кімнатної температури. Застосування гідрок2%, додають бензилхлорид. Переважно дозування сиду калію замість гідроксиду натрію при елімінупочинають при низькій температурі (приблизно від вання ускладнює розділення фаз. -10°С до -20°С), пізніше нагрівають, наприклад, аж Якщо в реакційній суміші міститься 3-хлор-2до температури приблизно 50-55°С. (N-метиланіліно)пропіонітрилу в кількості менше Якщо вміст динітрилу 2,2-диметил-4-(N0,5%, то фазу з продуктом відділяють і, у разі неметиланіліно)-глутарової кислоти знижується до обхідності, промивають, наприклад, спочатку вовеличини нижче приблизно 2%, що займає декільдою і потім за допомогою лимоннокислої води. ка годин, здійснюють відщеплення ціаніду. Для Після цього органічну фазу сушать, наприклад, цього бензилований продукт приєднання по Міханад сульфатом магнію, і, у разі необхідності, фільелю, загалом, не виділяють, а шляхом кислотного трують, переважно через фільтр, працюючий під гідролізу при вивільненні ціановодню і метиланілітиском. Таким чином одержаний розчин 2-(Nну з утворенням знову карбонільної групи перетметиланіліно)акрилонітрилу в толуолі без проблем ворюють в 2,2-диметил-4-оксо-5можна зберігати при температурі від -15°С до фенілвалеронітрил формули (IV). Гідроліз пере20°С аж до подальшого використання. При цих важно проводять після додавання води переважно температурах не відбувається розкладання. Пров умовах міжфазного каталізу. Як міжфазний катадукт одержують з чудовим виходом, що становить лізатор застосовують переважно бензилтриетилаприблизно 95% в розрахунку на метиланілін. монійхлорид або бензилдиметилгексадециламоУтримуючі ціанід стічні води і промивні рідини, нійхлорид. Температура реакції, в основному, а також залишок на фільтрі спрямовують в процес складає від приблизно 20°С до приблизно 60°С. обробки стічних вод. Завдяки додаванню міжфазного каталізатора скоСпосіб одержання 2,2-диметил-5-феніл-4рочується час реакції до приблизно 15-18 годин. оксовалеронітрилу формули (IV) за відомою з ліМожна досягати подальшого скорочення часу реатератури методикою проводиться аж до бензилукції, якщо в толуольну фазу додавати аж до прибвання продукту приєднання по Міхаелю при темлизно 20% об'єми, метанолу і/або застосовувати пературі -78°С. Бензилування здійснюють за концентровану кислоту. Наприклад, можливий час допомогою бензилброміду, що дорого коштує, і реакції становитиме тільки одну годину приблизно гідроліз і відщеплення ціаніду проводять в ацетопри температурі 40°С. нітрилі і для проведення реакції потрібно від прибДля відщеплення ціаніду/гідролізу додають лизно 40 до 50 годин. Сирий продукт треба піддасильну мінеральну кислоту, як, наприклад, бромовати перегонці. воднева кислота або соляна кислота, і реакційну У випадку модифікації способу одержання, що суміш, переважно при підвищеній температурі, пропонується згідно з винаходом, сполуки формузалишають реагувати до зниження вмісту бензили (IV) можна відмовитися від перегонки сирого лованого продукту приєднання по Міхаелю до вепродукту. Очищення здійснюють виключно шляхом личини нижче приблизно 0,5%. Після цього органіперекристалізації. Відщеплення ціаніду здійснючну фазу звичайним чином обробляють, і толуол ють у водно/органічній системі при додаванні міжвідганяють. Температура при перегонці не повинфазного каталізатора, завдяки чому тривалість на перевищувати 50°С. Залишок після перегонки реакції можна значно скоротити. Крім того, спосіб, можна потім очищати шляхом перекристалізації що пропонується згідно з винаходом, є нескладабо до перекристалізації піддавати однократному ним, оскільки не потрібно здійснення депротонуабо багаторазовому спільному випаровуванню з вання і конденсації при температурі -78°С. Далі, не ізопропанолом з метою видалення залишків толупотрібне активування за допомогою канцерогенноолу. го триаміду гексаметилфосфорної кислоти (НМРТ) Перекристалізацію можна здійснювати з ізопі застосування тетрагідрофурану, що дорого кошропанолу, однак, також добре придатний толуол і тує і піддається висушуванню, яке також дорого суміші з ізопропанолу і толуолу. Продукт переважкоштує. Нарешті, можна застосовувати більш дено перекристалізовують з двох частин суміші ізопшевий бензилхлорид замість бензилброміду. Перопанолу і толуолу в співвідношенні 9:1. реважні умови способу вказуються нижче. Внаслідок хорошої розчинності сполуки фор 11 75702 12 мули (IV) в ізопропанолі, для викристалізовування полягає у введенні ацетальної(кетальної) захисної необхідно здійснювати охолоджування, переважно групи для кетогрупи нітрилкетону, при цьому одедо температур від -15°С до -20°С. ржують сполуку формули (IVa): Одержаний продукт, при відомих умовах, також після перекристалізації, може ще мати доміш(IVa) ку продукту приєднання по Міхаелю. Такого роду домішка, однак, не заважає, оскільки легко видаде залишки R, які можуть бути однаковими або ляється при подальших перетвореннях. Загалом, в різними, означають (С1-С4)-алкільний залишок або результаті перекристалізації досягають, однак, разом означають (С2-С3)-алкіленовий залишок. дуже високого ефекту очищення, так що одержуГідрування третинної нітрильної групи до утворенють продукт в дуже чистій формі. ня неопентиламіногрупи, таким чином, також можЯк найближча реакційна стадія, одержаний на здійснювати в менш селективних умовах, при 2,2-диметил-4-оксо-5-фенілвалеронітрил формули цьому одержують сполуку формули (IVb): (IV) каталітично гідрують до утворення 2-бензил4,4-диметил-1-піроліну формули (III). Як каталіза(IVb) тори придатні каталізатори на основі благородних металів, як Pt або Pd. Переважні, однак, каталізаде залишки R мають вказані значення. В умотори Ренея, особливо нікель Ренея і кобальт Ревах розщеплення кеталю, в кислих середовищах, нея. наприклад, в розбавлених мінеральних кислотах, [В Arch. Pharm., 299, 518 (1966)] описується одночасно також відбувається циклізація з утвоодержання 2-(4-гідроксифеніл)-4,4-дигідро-3Нренням піроліну. Після підлуговування кислих водпіролу шляхом гідрування нітрилу 4-оксо-(4них розчинів піролінієвих солей одержують вільну гідроксифеніл)бутанової кислоти при використанні піролінову основу, яку можна відділити за допомонікелю Ренея. Гідрування, що пропонується згідно гою органічних розчинників, які не змішуються з з винаходом, якщо його здійснюють аналогічно водою, і після видалення цих розчинників одержавідомому з літератури способу, тобто, при викорити з високою мірою чистоти. станні водовмісного нікелю Ренея в спиртах, протіПереважні реакційні умови для прямого одеркає, однак, тільки повільно, і при підвищеному тисжання сполуки формули (III) шляхом гідрування ку або підвищеній температурі спостерігається сполуки формули (IV) вказуються нижче. виразне надгідрування. Якщо використовують суміш з толуолу і метаТому робилися спроби відносно скорочення нолу як розчинник, переважно приблизно 8-12 тривалості реакції і зменшення утворення побічних об'єми, частин суміші толуолу і метанолу на одну продуктів, особливо за рахунок надгідрування до мас. частину сполуки формули (V), то температура піролідину. При цьому виявляється, що ні підвиреакції складає, загалом, приблизно 50-60°С. Якщення тиску водню, ні підвищення температури що гідрують в чистому толуолі, то температуру реакції значно не скорочують час реакції, а в цих вибирають трохи нижче, наприклад, 20-30°С, для більш "енергійних" умовах зростають частки побічзапобігання надгідруванню. Тиск водню становить, них продуктів, передусім продуктів часткового гідзагалом, приблизно 4-6 бар. рування, олігомерних продуктів конденсації і надПеред реакцією нікель Ренея, що використогідрованого піролідину. вується, висушують, наприклад, шляхом одно- або У цей час несподівано знайдено, що якість багаторазового суспендування в абсолютному (чистота) початкової сполуки формули (IV), що метанолі або шляхом азеотропної перегонки. використовується, впливає сильним чином як на Якщо реакцію припиняють до поглинання теопротікання процесу у часі, так і на розподіл побічретично розрахованої кількості водню, то реакційних продуктів гідрування. Чим чище виділена рену суміш можна піддавати азеотропній перегонці і човина, тим більш гладко і без проблем протікає додавати свіжий розчинник. Можна додавати тареакція. Переважно застосовують споулку формукож свіжий нікель Ренея і для видалення води підли (IV) з чистотою вище 90%, особливо вище 95% давати азеотропній перегонці. Реакція продовжу(мас./мас.). ється, в основному, протягом приблизно 3-4 годин. У випадку гідрування нітрилкетону формули Потім нікель Ренея можна осаджувати і відфі(IV) при використанні піроліну формули (III), трельтровувати надосадовий реакційний розчин. Катинна нітрильна група на другій стадії гідрування талізатор, у разі необхідності, можна використати відновлюється до неопентиламіногрупи, яка спондля подальшого гідрування. З реакційного розчину танно конденсується з кетогрупою при відщепленвидаляють шляхом відгонки розчинник. Продукт ні води з утворенням циклічної іміногрупи. Циклічможна очищати через солеутворення, наприклад, на іміногрупа піроліну може зазнавати подальшого шляхом утворення гідрохлориду і вивільнення гідрування до утворення вторинної циклічної амісполуки формули (IV) за допомогою основи, наногрупи в пірол і дині. Щоб уникнути цього як катаприклад, аміаку, і повторної екстракції. лізатор використовують нікель Ренея, однак, не у Альтернативно, можна також відганяти тільки водовмісній формі, як звичайно, а по суті у вільній частину розчинника, наприклад, метанол у випадвід води формі. Як розчинники найбільш придатку суміші розчинників з толуолу і метанолу. У цьоними виявляються толуол і, особливо, суміші з му випадку залишок після перегонки переважніше толуолу і (С1-С4)-спиртів таких, як метанол, етаспочатку промивають водою, і після відділення нол, ізопропанол, наприклад, толуол/метанол в водної фази продукт можна очищати, як описано об'ємному співвідношенні від 8:2 до 6:4. вище. Інша можливість перешкоджати надгідруванню У випадку проведення реакції, що пропонуєть 13 75702 14 ся згідно з винаходом, гідрування можна сильно тати в еквімолярних кількостях. Однак, переважно прискорювати, особливо, за рахунок застосування застосовувати ω-бром-4-хлорацетофенон в надбезводного нікелю Ренея як каталізатора і толуолу лишку, наприклад, в надлишку від 10% мол. до або суміші з толуолу і метанолу як розчинника і 40% мол. можна обмежувати побічні реакції. Для уловлювання бромоводню, що виділяєтьПереважні реакційні умови для одержання ся при взаємодії, реакцію здійснюють в присутноссполук формули (III) шляхом гідрування циклічних ті основи. Переважно застосовують неорганічну або ациклічних ацетальних (кетальних) проміжних основу, особливо гідрокарбонат або карбонат лупродуктів вказуються нижче. жного металу, причому особливо переважні натріНітрилкетон формули (IV) в розчиннику, який єві і калієві сполуки. Неорганічну основу можна утворює з водою азеотроп, за допомогою спирту в використати у вигляді водного розчину. Особливо присутності кислотного каталізатора перетворюпереважним, однак, виявляється використання ють в кеталь, або перетворення кетон в кеталь неорганічної основи в твердій формі. Це полегшує здійснюють в спирті в присутності еквівалентних відділення неорганічних продуктів реакції і зменкількостей ацеталю або кеталю низькокиплячого шує спектр побічних продуктів. Неорганічну основу альдегіду або кетону. Придатними спиртами для можна використати в еквімолярних кількостях, по утворення кеталю є (С1-С4)-алканоли такі як метавідношенню до бромоводню, що виділяється. нол, етанол або гліколь, 1,3-пропіленгліколь і т.д. Більш доцільно, однак, неорганічну основу застоРозчинниками, які утворюють з водою азеотроп, є, совувати в надлишку, наприклад, в надлишку, аж наприклад, толуол, ксилол, циклогексан і т.д. до 1,8 еквівалентів, переважно приблизно 1,4 еквіПереважним варіантом здійснення є, наприваленти. Крім того, взаємодію доцільно здійснюваклад, перетворення в оксоланове похідне в толуоти за відсутності світла. Температуру реакції можлі за допомогою етиленгліколю в присутності кисна змінювати в широкому діапазоні і вона лоти такої як толуолсульфокислота, в умовах переважно складає від 0°С до 50°С, особливо пекип'ятіння зі зворотним холодильником і при видареважно приблизно 18-25°С. Взаємодія закінчуленні води з реакційної суміші, наприклад, за доється через приблизно 17-20 годин. помогою водовідділення. Іншим переважним варіОдержаний сирий продукт формули (II) віддіантом здійснення є перетворення в диметилкеталь ляють, наприклад, шляхом центрифугування, і в метанолі при використанні 1,1-диметоксіетану в звичайним чином очищають шляхом видалення присутності піридинійтозилату при температурі мінеральних домішок. Для цього сирий продукт приблизно 40-60°С. Потім кеталі обробляють шляпереважно вносять в теплу воду, наприклад, при хом промивання лугом і гідрують в присутності температурі 40-45°С, і обробляють, протягом 1-2 каталізатора гідрування. Особливо переважним годин. Таким чином одержують сполуку формули варіантом здійснення є гідрування діоксоланового (II) з виходом в середньому 58% і чистотою щопохідного в присутності безводного нікелю Ренея найменше 97%. Вміст ізомеру з 4-хлорфенільною при тиску водню 5-50 бар і при температурі від групою в положенні 5 складає нижче 2%, вміст ωкімнатної до 70°С в спиртовому розчиннику такому бром-4-хлорацетофенону складає нижче 0,1% і як метанол або в ароматичному розчиннику таковміст мінеральних домішок складає нижче 0,5%. му як толуол. Одержання сполуки формули (III) Для одержання ML 3000 формули (І) в полоздійснюють, після відфільтровування каталізатора, ження 5 сполуки формули (II) вводять бічний ланшляхом перемішування амінокеталів, що утворицюг у вигляді залишку оцтової кислоти. Це здійслися як продукт гідрування, з органічної фази в нюють переважно шляхом введення у взаємодію розбавленій водній мінеральній кислоті. Як розщесполуки формули (II) з оксалілхлоридом і потім плення кеталів, так і утворення циклічного іміну відновлення за допомогою гідразину і гідроксиду повністю відбувається при кімнатній температурі, лужного металу. Реакція описується, [наприклад, в як правило, через проміжок часу від 30 хвилин до заявці WO-95/32971, приклад 5С, і в РСТ/ЕР 1 години. Циклічний імін формули (III) після підлу01/00852]. Для очищення продукту реакції описані говування водного розчину продукту до рН=9-11 різні способи. Згідно [із заявкою WO-95/32971], можна одержувати в дуже чистій формі. реакційну суміш змішують з водою, підкисляють і 2-Бензил-4,4-диметил-1-піролін формули (IV) карбонову кислоту, що випала в осад, витягують потім циклізують із ω-бром-4-хлорацетофеноном з за допомогою діетилового ефіру. Продукт очищаодержанням 6-(4-хлорфеніл)-2,2-диметил-7-фенілють тим, що ефірний розчин деякий час перемі2,3-дигідро-1H-піролізину формули (III). Реакція шують і витримують над осушувачем, таким як відома з вказаного спочатку рівня техніки, ω-Бромбезводний сульфат натрію або сульфат магнію, 4-хлорацетофенон можна одержувати способом, потім відфільтровують насичений водою сульфат описаним, [наприклад, в Bull. Soc. Chim. Fr., 21, 69 і, нарешті, діетиловий ефір відганяють при нагрі(1899)]. ванні. Речовину, що викристалізувалася з маточВведення у взаємодію сполуки формули (III) із ного розчину при концентруванні, збирають і виω-бром-4-хлорацетофеноном здійснюють, загасушують. У випадку цього способу виділення і лом, в полярному органічному розчиннику. Придаочищення ще на стадії очищення і під час висушутними полярними органічними розчинниками є, вання знов утвориться небагато продуктів розклаособливо, (С1-С4)-спирти такі, як метанол, етанол, дання, так що для досягнення фармацевтичної ізопропанол, або прості ефіри, такі як діетиловий якості необхідне подальше очищення ML 3000, що ефір, тетрагідрофуран (THF) або діоксан. Згідно з дорого коштує, наприклад, шляхом переданим винаходом, особливо переважний метанол кристалізації. як розчинник. Компоненти реакції можна викорисУ випадку альтернативного способу очищення, 15 75702 16 після відновлення за допомогою гідразину і гідрокційну суміш додають толуол (25,7кг) і після цього сиду лужного металу до реакційної суміші, у разі при перемішуванні концентровану соляну кислоту необхідності, при підвищеній температурі, дода(32%-на, 9,3кг) і перемішують ще 5-10 хвилин при ють простий ефір і воду. Переважно використовукімнатній температурі. ють простий ефір, що обмежено змішується з воСинильну кислоту, що виходить з апаратури, дою, наприклад, діетиловий ефір або метил-третвловлюють в абсорбері, заповненому концентробутиловий ефір. За рахунок додавання простого ваним розчином NaOH. ефіру відбувається утворення трифазної системи, При припиненні перемішування водну фазу причому середня фаза містить продукт і, по суті, (114кг, ціанідна стічна вода 1) відстоюють і перескладається з солі ML 3000 з діоксидом лужного водять в закриту систему в резервуар для знешметалу, що застосовується при взаємодії. Самою кодження. верхньою фазою є фаза простого ефіру, в якій До забарвленої в синій колір органічної фази знаходяться органічні домішки, і найнижчою фадодають бензилтриетиламонійхлорид (0,3кг) і охозою є сильно лужна водна фаза, яка містить неорлоджують до температури від -5°С до 0°С. Якщо ганічні компоненти. досягають цієї внутрішньої температури, то підлиФази розділяють і середню фазу змішують із вають розчин гідроксиду натрію (30%-ний, 32,6кг) сумішшю води і простого ефіру, що тільки обметаким чином, щоб внутрішня температура не пежено змішується з водою, потім підкисляють за ревищувала 15°С (30 хвилин). Після завершення допомогою неорганічної або органічної кислоти. додавання реакційну суміш залишають нагріватиML 3000 тоді розчиняється в фазі простого ефіру. ся до кімнатної температури і перемішують ще Одержання ML 3000 з фази простого ефіру протягом наступних 50-70 хвилин. можна здійснювати, наприклад, шляхом випаровуГазохроматографічний аналіз проби показує вання простого ефіру і кристалізації ML 3000 з вміст проміжного продукту 3-хлор-2-(Nетилацетату або ізопропанолу. При цьому одерметиланіліно)пропіонітрилу нижче 0,5%. Якщо дожують сольвати з 1 молекулою діетилового ефіру сягають цього значення, то здійснюють промиванна 2 молекули ML 3000, відповідно, з 1 молекулою ня водою (40,7кг): додають воду, двофазну суміш етилацетату на 2 молекули ML 3000. перемішують протягом 5-10 хвилин, потім водну По суті не утримуючу розчинника кристалічну фазу (70кг, ціанідна стічна вода 2) відстоюють і модифікацію ML 3000 одержують, якщо до фази переводять її в резервуар (до ціанідної стічної вопростого ефіру додають щонайменше один вугледи 1). водень, який кипить при більш високій температуОрганічну фазу таким же чином ще раз прорі, ніж простий ефір, простий ефір, у разі необхідмивають водою (40,7кг), яка підкислена лимонною ності, щонайменше частково відганяють, і ML кислотой (0,81кг). 3000, що виділилася в твердій кристалічній формі, Цю лимоннокислу водну фазу (45кг, ціанідна звичайним чином відділяють від маточного розчистічна вода 3) об'єднують з іншими ціанідними ну. Як вуглеводень придатний особливо лінійний стічними водами. Органічну фазу сушать при кімабо розгалужений аліфатичний (С6-С12)натній температурі над сульфатом магнію (3,8кг) вуглеводень, наприклад, н-гексан, н-гептан, циклопротягом 10-20 хвилин. Титрування по Карлугексан, циклогептан і т.д. Фішеру показує вміст води нижче 0,2%. Цей толуНижченаведені приклади пояснюють винахід, ольний розчин (50-52кг) фільтрують через працюне обмежуючи його об'єму охорони. ючий під тиском фільтр і завантажують в місткість Приклад 1 для застосування на найближчій стадії. Залишок А) 2-(N-Метиланіліно)акрилонітрил (приблизно на фільтрі (4,8кг) об'єднують з ціанідними стічними 50%-ний розчин в толуолі) водами. Ці ціанідні стічні води спрямовують в проВ емальований реактор місткістю 250 л ввоцес обробки стічних вод. Нестабільний при кімнатдять концентровану НСl (32%-на; 22,33кг) і лід ній температурі розчин 2-(N(32,6кг). При охолоджуванні водою додають Nметиланіліно)акрилонітрилу (53,86кг) зберігають в метиланілін (17,39кг, 162,2моль), не допускаючи атмосфері азоту при температурі від -15°С до підвищення температури вище за 25°С (30 хви20°С аж до подальшого використання. Для визналин). Розчин зелено-жовтого кольору перемішують чення вмісту відбирають зразок об'ємом 50мл. З протягом 5-10 хвилин при температурі 15-20°С. 30мл цього зразка визначають залишок після виПочинаючи з цієї температури додають водний сушування, з якого випаровують толуол у вакуумі розчин хлорацетальдегіду (45%-ний; 34,2кг, при температурі максимально 70°С. Для визна196,1моль) при охолоджуванні водою так, щоб чення вмісту використовують інтегральні площі 1Hвнутрішня температура підтримувалася нижче за ЯМР-спектра зразка в хлороформі і газохроматог20°С (30 хвилин). Реакційну суміш перемішують рафічний аналіз. Вміст 2-(Nдалі ще наступні 5-10 хвилин при температурі 15метиланіліно)акрилонітрилу в розчині згідно з 1Н20°С і потім при цій температурі змішують з розчиЯМР-спектром становить 45,54%. Таким чином, ном ціаніду калію (12,7кг, 195,1моль) у воді вихід становить 95,4%, по відношенню до викорис(19,5кг). При охолоджуванні водою при цьому дотаного метиланіліну. давання регулюють таким чином, що не перевиОбробку ціанідної стічної води здійснюють за щують температуру 20°С (1 година). При темперадопомогою концентрованої Н2О2 і 30%-ного розчитурі 18-23°С додатково перемішують протягом ну NaOH при значенні рН=10-12 аж до залишково110-130 хвилин. Утворюється рідкотекуча суспенго вмісту ціаніду нижче за 30мг/кг (
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 6-(4-chlorophenyl)-2,2-dimethyl-7-phenyl-2,3-dihydro-1h-pyrrolizin-5-ylacetic acid
Назва патенту російськоюСпособ получения 6-( 4-хлорфенил)-2, 2-диметил-7-фенил-2, 3-дигидро-1н-пиролизин-5-ил-уксусной кислоты
Автори російськоюStriegel, Hans-Gunter
МПК / Мітки
МПК: C07D 207/20, C07D 487/04
Мітки: спосіб, килоти, 6-(4-хлорфеніл)-2,2-диметил-7-феніл-2,3-дигідро-1н-піролізин-5-іл-оцтової, одержання
Код посилання
<a href="https://ua.patents.su/12-75702-sposib-oderzhannya-6-4-khlorfenil-22-dimetil-7-fenil-23-digidro-1n-pirolizin-5-il-octovo-kiloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 6-(4-хлорфеніл)-2,2-диметил-7-феніл-2,3-дигідро-1н-піролізин-5-іл-оцтової килоти</a>
Попередній патент: Рейкове скріплення на залізобетонних шпалах
Наступний патент: Установка для запуску феєрверка з дистанційним керуванням
Випадковий патент: Спосіб визначення днк бактерій родини chlamydiaceae у полімеразній ланцюговій реакції шляхом ампліфікації фрагмента гена головного білка мембрани (момр)












