Спосіб одержання {2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]-етоксі}оцтової кислоти і проміжні сполуки
Номер патенту: 72949
Опубліковано: 16.05.2005
Автори: Ваго Паль, ШІМІГ Дьюла, НЕМЕТ Норберт, Реітер Йожеф, Тьомпе Петер, Верецкейне Донат Дьйордь, Цлементіш Дьйордь, Трінка Петер, Барта Ференц, Надь Кальман
Формула / Реферат
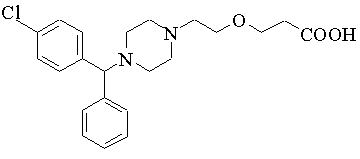
1. Спосіб одержання {2-[4-(![]() -феніл-п-хлорбензил)піперазин-1-іл]етоксі}оцтової кислоти формули:
-феніл-п-хлорбензил)піперазин-1-іл]етоксі}оцтової кислоти формули:
 I
I
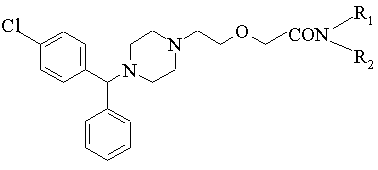
або її фармацевтично прийнятної кислотно-адитивної солі або солі металу шляхом гідролізу відповідного ацетаміду в лужному або кислому середовищі і, при необхідності, перетворення отриманого продукту в кислотно-адитивну сіль або сіль металу і/або вивільнення основи з кислотно-адитивної солі або солі металу, який відрізняється тим, що {2-[4-(![]() -феніл-п-хлорбензил)піперазин-1-іл]етоксі}ацетамід формули:
-феніл-п-хлорбензил)піперазин-1-іл]етоксі}ацетамід формули:
 , II
, II
де R1 і R2 незалежно являють собою С1-4алкіл, який може бути заміщений фенілом, С2-4алкеніл або циклогексил, або
R1 і R2 утворюють разом із сусіднім атомом азоту морфолінову групу, або його кислотно-адитивну сіль використовують як ацетамід.
2. Спосіб за пунктом 1, який відрізняється тим, що гідроліз проводять у присутності міжфазного каталізатора.
3. Спосіб за пунктом 1, який відрізняється тим, що {2-[4-(![]() -феніл-п-хлорбензил)-піперазин-1-іл]етоксі}ацетамід формули II являє собою (RS)-N,N-диметил-{2-[4-(
-феніл-п-хлорбензил)-піперазин-1-іл]етоксі}ацетамід формули II являє собою (RS)-N,N-диметил-{2-[4-(![]() -феніл-п-хлорбензил)піперазин-1-іл]етоксі}ацетамід.
-феніл-п-хлорбензил)піперазин-1-іл]етоксі}ацетамід.
4. {2-[4-(![]() -феніл-п-хлорбензил)піперазин-1-іл]етоксі}ацетамід формули II, де R1 і R2 визначені в пункті 1, або його кислотно-адитивна сіль.
-феніл-п-хлорбензил)піперазин-1-іл]етоксі}ацетамід формули II, де R1 і R2 визначені в пункті 1, або його кислотно-адитивна сіль.
5. (RS)-N,N-диметил-{2-[4-(![]() -феніл-п-хлорбензил)піперазин-1-іл]етоксі}ацетамід або його кислотно-адитивна сіль.
-феніл-п-хлорбензил)піперазин-1-іл]етоксі}ацетамід або його кислотно-адитивна сіль.
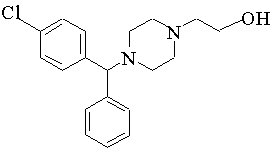
6. Спосіб одержання {2-[4-(![]() -феніл-п-хлорбензил)піперазин-1-іл]етоксі}ацетаміду формули II, де R1 і R2 визначені в пункті 1, або його кислотно-адитивної солі, який відрізняється тим, що сіль лужного металу {2-[4-(
-феніл-п-хлорбензил)піперазин-1-іл]етоксі}ацетаміду формули II, де R1 і R2 визначені в пункті 1, або його кислотно-адитивної солі, який відрізняється тим, що сіль лужного металу {2-[4-(![]() -феніл-п-хлорбензил)піперазин-1-іл]}етанолу формули:
-феніл-п-хлорбензил)піперазин-1-іл]}етанолу формули:
 III
III
піддають реакції з 2-галогенацетамідом формули:
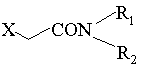 , IV
, IV
де R1 і R2 визначені вище, Х означає атом галогену, переважно атом хлору, і, при необхідності, отриману основу формули II перетворюють у кислотно-адитивну сіль з неорганічною або органічною кислотою, або основу вивільняють з його кислотно-адитивної солі.
Текст
Винахід стосується нового способу одержання {2-[4-(a-феніл-п-хлорбензил)-піперазин-1-іл]етокси}оцтової кислоти, що має наступну формулу: {2-[4-(a-Феніл-п-хлорбензил)піперазин-1-іл]етокси}оцтова кислота відома під міжнародною непатентованою назвою цетиризин і широко використовується як інгредієнт протиалергічних фармацевтичних композицій. Винахід також стосується нових {2-[4-(окреніл-п-хлорбензил)піперазин-1-іл]етокси}-ацетамідів, що мають наступну формулу: де R1 і R2 незалежно являють собою С 2-4алкіл, який може бути заміщений фенілом, С2-4-алкеніл чи циклогексил, чи R1 і R2 утворюють разом із сусіднім атомом азоту морфолінову груп у, і їх кислотних адитивних солей, які є корисними проміжними сполуками при синтезі цетиризину. Відомо декілька способів одержання цетиризину формули І. Відповідно до Європейської латентної заявки №58146 (Chem. Abstr., 98, 34599г), ефір чи амід формули: де Υ являє собою групу формули -OR1 чи аміногрупу, де R1 означає алкіл, гідролізують для одержання сполуки формули І. Використовуючи в якості вихідної речовини метиловий ефір формули V, при гідролізі з гідроксидом калію одержують калієву сіль цетиризину з виходом 59%. З калієвої солі утворюється відповідна кислота з виходом 81%, а вихід очікуваного дигідрохлориду цетиризину становить 80%. Таким чином, загальний вихід при одержанні за відомим способом становить 38,2%. Істотним недоліком відомого способу є те, що одержання ефірів формули V, які використовуються в якості ви хідних сполук, пов'язано з великими труднощами і з маленьким виходом. Так, 1-[(4-хлорфеніл)фенілметил]піперазин формули VI реагує з метил-2-хлоретоксиацетатом формули VII з утворенням метилового ефіру формули V з виходом до 10,6% після хроматографії. У вже згадуваній Європейській патентній заявці говориться про те, що це тиризин можна одержувати також з ацетамідів формули V, де Υ являє собою аміногрупу, шля хом гідролізу. Проте гідроліз ацетаміду формули V не підтверджується ні прикладами, ні даними виходу. Відповідно до більш пізнього повідомлення (Synthesis, 1995. 766), ацетамід формули V гідролізують у соляній кислоті при 50°С для одержання цетиризину з виходом 71%. Для одержання ацетаміду формули V відомі ще три способи. Наприклад, 1-[(4хлорфеніл)фенілметил]піперазин формули VI реагує з 2-хлоретоксиацетамідом формули: у присутності з'єднауючого кислоту агента з утворенням ацетаміду формули V з ви ходом 47%. Відповідно до другого способу {2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]}-етанол формули: реагує з гідридом натрію, даючи натрієву сіль, а сіль реагує з хлорацетамідом формули: де X означає атом хлору, R1 і R2 означають атом водню. Проте вихід цієї реакції всего 11%. Відповідно до третього методу, ацетамід формули V може бути отриманий також з відповідного метилового ефіру формули V, де Υ означає метоксигрупу, шляхом реакції з аміаком з виходом 54%. Через низький вихід (27,8%) реакції одержання метилового ефіру, загальний вихід становить 15,0%. Отже, останній згаданий спосіб синтезу цетиризину також неекономічний. Спосіб, описаний у патенті UK №2225320 (Chem. Abstr., 113, 191395s), спрямований на усунення недоліків згаданих вище відомих способів шляхом одержання цетиризину з {2-[4-(a-феніл-п-хлорбензил)піперазин-1іл]}етанолу формули Ш, який перетворюється в калієву сіль, реагуючи з трет-бутилатом калію. Калієву сіль піддають реакції з хлорацетатом натрію для одержання дигідрохлориду цетиризину з ви ходом 48,8%. Крім того, одержують 5,1% побічного продукту реакції. Описаний також покращений спосіб одержання {2-[4-(aфеніл-п-хлорбензил)піперазин-1-іл]}етанолу формули III, відповідно до якого 1-[(4хлорфеніл)фенілметил]піперазин формули VI піддають реакції з хлоргідрином етилену з виходом 90,4%; загальний вихід похідної піперазину формули VI у процесі синтезу становить усього лише 48,7%. Останній з відомих способів має ще один недолік. Реакцію похідної етанолу формули III із хлорацетатом натрію можна здійснити з відносно прийнятним виходом, якщо додавати реагенти в розчин похідної етанолу формули III декількома порціями. Додавання реагентів потрібно програмувати на основі постійного моніторингу сполуки реакційної суміші. Ця те хнологія дуже незручна, особливо в промисловому масштабі. Останній з відомих способів намагаються покращати за допомогою способу, описаному в патенті PL №163415 (Chem. Abstr., 123. 55923s), відповідно до якого реакцію проводять у системі, що має дві фази, у присутності нейтрального органічного розчинника і водного розчину гідроксиду натрію, одержуючи дигідрохлорид цетиризину з виходом 60%. Хоча цей спосіб менш складний, ніж спосіб, опублікований у патенті UK №2225320, загальний вихід становить всього 54%, як розраховано для похідної етанолу формули III, яка може бути отримана більш придатним способом. Інший спосіб одержання цетиризину відомий з патенту UK №2225321 (Chem. Abstr., 113, 191396t), відповідно до якого 1-[(4-хлорфеніл)фенілметил]піперазин формули VI піддають реакції з хлоретоксиацетонітрилом, одержуючи похідну нітрилу, що має наступну формулу: яку гідролізують у кислому чи лужному середовищі до цетиризину. У цьому способі дигідрохлорид цетиризину одержують з похідної нітрилу формули IX із загальним виходом 60,5% у випадку кислотного гідролізу і 65,5% у випадку лужного гідролізу. Проте реакція 1-[(4-хлорфеніл)фенілметил]піперазину формули VI із хлоретоксиацетонітрилом дає похідну нітрилу з виходом 86,4%, зменшуючи загальний вихід у процесі синтезу до 52,2% і 56,6%, відповідно. Варто брати до уваги також, що, згідно з літературою (E.J. Salmi, R. Leimu and Η. Kallio, Suomen Kemistilehti, 17B. 17-19 (1944)), хлоретоксиацетонітрил може бути отриманий із хлоргідрину етилену в дві стадії з використанням дуже отруйного ціаніду міді (І) із загальним виходом 58%. Нарешті, простий спосіб одержання можливий завдяки способу, відомому з опублікованої Європейської патентної заявки №801064, відповідно до якої цетиризин одержують з 1-[{4-хлорфеніл)фенілметил]піперазину формули VI шляхом реакції з 2-хлоретоксиоцтовою кислотою в нейтральному розчиннику в присутності з'єднувального кислоту агента. У даній публікації наводиться тільки один Приклад, який не містить ні даних виходу, ні якісних даних про продукт. До того ж, великим недоліком цього способу є недоступність 2хлоретоксиоцтової кислоти в промислових масштабах. Метою даного винаходу є створення економічного способу одержання цетиризину, який задовольняв би самим строгим вимогам, які пред'являють до якості речовини. Було виявлено, що описана вище ціль досягається завдяки створенню способу одержання {2-[4-(a-фенілп-хлорбензил)піперазин-1-іл]етокси}оцтової кислоти формули І чи її фармацевтично прийнятної кислотної адитивної солі чи солі металу за допомогою гідролізу відповідного ацетаміду в лужному чи кислому середовищі і, при необхідності, перетворення отриманого продукту в кислотну адитивну сіль чи сіль металу і/чи вивільнення основи з кислотної адитивної солі чи солі металу, причому сполука формули II чи її кислотна адитивна сіль використовується в якості ацетаміду, і, при необхідності, гідроліз проводять у присутності міжфазного каталізатора. Винахід включає {2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}ацетаміди формули II, які є новими сполуками. У способі винаходу ви хідною сполукою є ацетамід формули II чи його кислотна адитивна сіль, що утворюється з органічною чи неорганічною кислотою, і вихідну сполук у піддають лужному чи кислотному гідролізу способом, відомим per se, і, при необхідності, у присутності міжфазного каталізатора. При бажанні, отриманий продукт перетворюють у фармацевтично прийнятну кислотну адитивну сіль чи сіль металу, і/чи основу ви вільняють з кислотної адитивної солі способом , відомим per se. Гідроліз {2-[4-(a-феніл-п-хлорбензил)пїперазин-1-іл]етокси}ацетамідів формули ІІ відбувається дуже швидко і цілком, без утворення побічних продуктів, за 1-8 годин, у залежності від природи R1 і R2. Цетиризин чи його дигідрохлорид можуть бути легко виділені з реакційної суміші в дуже чистому вигляді, який задовольняє надзвичайно жорстким вимогам Європейської фармакопеї (3, 1997, 1084) по ВЕЖХ. Експерта може здивувати те, що гідроліз {2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]-етокси}ацетамідів формули II протікає так швидко, тому що з літератури відомо, що діалкілацетаміди являють собою стабільні сполуки, гідроліз яких протікає повільно і вимагає жорстких умов реакції. Наприклад, Ν,Ν,Ν’,N’-тетраетил-5,5диметил-3,7-діоксанондіамід гідролізували в 3н. водному розчині гідроксиду натрію при кип'ятінні протягом 5 днів для одержання відповідної дикарбонової кислоти з виходом 91,5% [J. Chem. Soc. Perkin Trans. I., 1981. 741-745, Chem. Abstr., 95, 42286q (1981)]. Проте після кип'ятіння протягом 5 днів тільки 39,8% відповідного Ν,Ν,Ν’,N’-тетраметилової похідної перетворювалося у відповідну дикарбонову кислоту, яку виділяли у вигляді метилового ефіру. Крім того, коли, наприклад, трео-10,11-дипдрокси-N,N-диметилнонадеканамід кип'ятили в етанолі з 2н. водним розчином гідроксиду натрію протягом 1 години, розпаду, у результаті якого одержують відповідну карбонову кислоту, не спостерігалося. [J. Chem. Soc., 1961. 351-356, Chem. Abstr., 55, 12276q (1961)]. Це є причиною того, що аміди карбонових кислот звичайно гідролізують до карбонових кислот у концентрованому лужному чи краще концентрованому кислотному середовищі в присутності нітритів [HoubenWeyl: Methoden der Organischen Chemie, Vol. 8, 432; A. R. Katritzky et al., Comprehensive Organic Functional Group Transformations, Vol. 5, 34-36 (1995)]. У якості ацетаміду формули II краще використовувати N,N-диметил-{2-[4-(a-фент-п-хлорбензил)піперазин1-іл]етокси}ацетамід. Згідно з кращим способом винаходу, гідроліз {2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}ацетамідів формули II здійснюють у водному розчині гідроксиду лужного металу, краще гідроксиду натрію чи калію, де концентрація лугу в розчині становить 2-25мас. %, краще 6-16мас. %, найкраще приблизно 12мас. %, звичайно при 40-110°С, краще при 70-110°С, найкраще при точці кипіння розчину. Після лужного гідролізу продукт виділяють таким способом: реакційну суміш розбавляють водою, підкислюють соляною кислотою до рН=3,8-4,0, цетиризинову основу розчиняють в органічному розчиннику, який не змішується з водою, переважно у дихлорметані, органічний розчин упарюють до сухого стану під зниженим тиском, і осад схожий на мед, що залишився, розчиняють у 5-36%, краще у 10-20%, найкраще у 16% соляній кислоті. Потім до розчину додають органічний розчинник, що змішується з водою, переважно ацетон, метилетилкетон чи тетрагідрофуран, для кристалізації дигідрохлориду, чи розчин соляної кислоти концентрують під зниженим тиском до вмісту води 20-25мас. %, і до концентрованого розчину додають згаданий вище органічний розчинник, що змішується з водою, і схожий на мед дигідрохлорид цетиризину перекристалізовують. Після гідролізу і доведення рН до 3,8-4,0 можлива екстракція розчину цетиризинової основи в дихлорметані краще за допомогою 5-30% соляної кислоти, водний розчин концентрують під зниженим тиском для зменшення вмісту води до 20-25мас. %, і потім далі за процедурою, описаної вище для одержання дигідрохлориду цетиризину. Схожий на мед осад, отриманий після упарювання розчину цетиризинової основи в дихлорметані, може бути розчинений в органічному розчиннику, що змішується з водою, переважно в ацетоні, метилетилкетоні чи тетрагідрофурані, і отриманий таким способом розчин цетиризинової основи в органічному розчиннику потім обробляють соляною кислотою. Кислий розчин піддають кожній з вищеописаних процедур для одержання дигідрохлориду цетиризину. Згідно із ще одним кращим способом винаходу, гідроліз ацетаміду формули II здійснюють у водному розчині неорганічної кислоти, переважно соляній чи сірчаній кислоті, при 40-110°С, краще при 70-110°С, найкраще при точці кипіння розчину. Звичайно використовують 2-25мас. %, краще 10-20мас. %, найкраще 15мас. % розчин неорганічної кислоти. Для відокремлення продукту отриманий кислотний гідролізат розбавляють водою, доводять рН до значення 3,8-4,0 шляхом додавання водного розчину гідроксиду натрію, і потім далі за процедурою, описаною для лужного гідролізу. І лужний, і кислотний гідроліз можна проводити в присутності міжфазного каталізатора і, при необхідності, також співрозчинника. У якості міжфазного каталізатора може бути використаний галід тетраалкіламонію, краще хлорид тетрабутиламонію, хлорид триетилбензиламонію чи хлорид триоктиметиламонію (Aliquat 336) чи краун-ефір, переважно 15-краун-5 чи 18-краун-6. Співрозчинником може бути органічний розчинник, що змішується з водою, як, наприклад, етанол, бутанол, етиленгліколь чи діоксан. Якщо в способі винаходу в якості вихідної сполуки використовується кислотна адитивна сіль ацетаміду формули II, отримана з органічною кислотою, ця органічна кислота кристалізується з реакційної суміші після осадження продукту кислотою. У цьому випадку органічну кислоту, що випала в осад, можна відокремити шляхом фільтрації перед екстракцією продукту ди хлорметаном, для того щоб домогтися більш легкого поділу фаз. Проте з реакційною сумішшю можна працювати і без відокремлення органічної кислоти. Таким чином, спосіб винаходу економічний, може бути легко виконаний і дає цетиризин чи його кислотну адитивну сіль у дуже чистому вигляді. Другий аспект даного винаходу стосується нових проміжних сполук формули II, де R1 і R2 визначені вище, і їх кислотних адитивних солей, утворених при взаємодії з органічними і неорганічними кислотами. Винахід включає ізомери {2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}ацетамідів формули II і їх суміші. У формулі II, при визначенні R1 і R2, С1-4алкіл, який може бути заміщений фенілом, може мати прямий чи розгалужений ланцюг, наприклад, метил, етил, ізопропіл, трет-бутил чи бензил і так далі. С2-4алкєніл може бути, наприклад, алілом чи металілом. Кращою сполукою формули II є (RS)-N,N-диметил-{2-[4-(a-фент-п-хлорбензил)пiперазин-1іл]етокси}ацетамід. {2-[4-(a-Феніл-n-хлорбензил)піперазин-1-іл]етокси}ацетамід формули II одержують при взаємодії солі лужного металу {2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]}-етанолу формули III з 2-галогенацетамідом формули IV, де R1 і R2 такі, як визначені для формули II, X означає атом галогену, переважно хлору, в органічному апротонному розчиннику, і, при необхідності, шляхом перетворення отриманої основи формули II у кислотну адитивн у сіль чи шляхом вивільнення основи з його кислотної адитивної солі. Реакцію проводять при температурі не вище 120°С, переважно при 60-90°С. Сіль лужного металу {2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]}етанолу формули III одержують у нейтральному апротонному розчиннику, використовуючи гідрид, амід чи алкоголят лужного металу, переважно гідрид натрію, амід натрію чи метилат натрію. Нейтральний апротонний розчинник являє собою органічний апротонний розчинник, нейтральний з погляду реакції, переважно бензол, толуол, ксилол чи Ν,Νдиметилформамід. Нові {2-[4-{a-феніл-п-хлорбензил)піперазин-1-іл]етокси}ацетаміди формули II виділяються з реакційної суміші способом, відомим per se. Відповідно до кращого способу, сполуку формули і І піддають поділу між водою й органічним розчинником, що незмішується з водою, фази розділяють, і органічну фазу, що містить сполуку формули II, упарюють. Згідно з найкращим способом поділу, під час описаного вище поділу сполуки формули II між водою й органічним розчинником, що незмішується з водою, домішки видаляють з органічного розчину шляхом доведення рН розчину до 6,2-6,7, переважно до 6,4, за допомогою водного розчину неорганічної чи органічної кислоти, краще соляної кислоти, під час виконання екстракції і поділу фаз. Потім до органічного розчину додають ще одну порцію води, доводять рН приблизно до 4 додаванням водного розчину кислоти, таким чином перетворюючи продукт у його кислотну адитивну сіль, яка розкладається у водній фазі. Після поділу фаз основу вивільняють лугом, переважно водним розчином гідроксиду натрію, і знову екстрагують органічним розчинником, що незмішується з водою, переважно дихлорметаном. Після упарювання розчину залишок розчиняють у більш низькому алканолі, краще ізопропанолі, і отриманий розчин обробляють алканолом, що містить хлористий водень, переважно ізопропанолом, що містить хлористий водень, для одержання дигідрохлориду, який осаджують у кристалічній формі додаванням розчинника, який не розчиняє продукт, краще ді(нижчий алкіл)кетону, найкраще ацетону. Відповідно до іншого кращого способу виділення дигідрохлориду ацетаміду формули II після упарювання розчину основи в органічному розчиннику осад розчиняють у холодній соляній кислоті, упарюють воду під зниженим тиском і до осаду додають ді(нижчий алкіл)кетон, найкраще ацетон для кристалізації дигідрохлориду. Таким чином, ацетамід формули II одержують у дуже чистому вигляді, що краще для одержання чистого цетиризину. {2-(4-(a-феніл-п-хлорбензил)піперазин-1-іл)етанол формули Ill, що використовується в якості вихідної сполуки для одержання ацетаміду формули II, давно відомий з літератури [Н. Morren et ai., Belg. Chem. Industrie. XIX. 1176-1185 (1954), Chem. Abstr., 53, 2240e (1959)]. Для одержання дуже чистого цетиризину найкраще використовувати {2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]}етанолу дигідрохлориду моногідрат [т.пл. -196-205°С (при розкладанні), вміст води (згідно Karl Fisher): 4,6%]. 2-Галогенацетаміди формули IV також відомі з літератури [W. E.Weaver and W. Μ. Whaley, J. Amer. Chem. Soc., 69> 516 (1947); J. Kasprzyk et al., J. Heterocycl. Chem. 30, 119 (1993)] і можуть бути легко отримані способами, описаними в зазначених ви ще посиланнях. Винахід далі пояснюється наступними Прикладами: Одержання {2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}ацетамідів формули II Приклад 1 (RS)-N,N-Диметил-{2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}ацетаміду дигідрохлорид До розчину 99,3г (0,3моль) (RS)-{2-[4-(a-феніл-п-хлорбензил]піперазин-1-іл]}етанолу в 500мл толуолу додають 25,8г (0,33моль) 50% суспензії аміду натрію в толуолі при 25°С в потоці азоту. Реакційну суміш поміщають у масляну баню, нагріту до 105°С, і витримують 3 години. Під час реакції внутрішня температура реакційної суміші залишається 80-85°С. Потім реакційну суміш охолоджують до 40°С, додають до неї по краплі 40,1г (0,33моль) N,N-диметил-2-хлорацетаміду і перемішують при 50°С ще 2 години. До реакційної суміші додають 120г товченого льоду і доводять рН до 6,4 додаванням 8мл концентрованої соляної кислоти. Фази розділяють, до толуольної фази додають 150мл води і рН суміші доводять до 4 додаванням приблизно 21мл концентрованої соляної кислоти. Водну фазу відокремлюють, додають до неї 300мл дихлорметану і доводять рН до 7-8 додаванням приблизно 28мл (0,28моль) 40% водного розчину гідроксиду натрію. Органічну фазу відокремлюють, екстрагують за допомогою 40мл насиченого водного розчину хлориду натрію, висушують над безводним сульфатом магнію, фільтрують і упарюють під зниженим тиском. Схожий на мед осад (124г, 99%) розчиняють у 50мл ізопропанолу, і до отриманого розчину по краплях при перемішуванні додають 90мл ізопропанолу, що містить 25мас. % хлористого водню, при кімнатній температурі. До реакційної суміші при енергійному перемішуванні додають 1000мл ацетону, і суміш перемішують ще годину. Кристали, що випали в осад, відфільтровують, промивають 3 рази по 50мл ацетону, потім 100мл діізопропілового ефіру. Таким чином одержують 120г (81,1%) (RS)-N,N-диметил-{2-[4-(a-феніл-п-хлорбензил)-піперазин-1іл]етокси}ацетаміду дигідрохлориду, т.пл. 182-190°С. Спектральні дані основи: ІК(КВr); n С=О 1658см-1 ПМР (СОСІ3): d м.д. 2,41 (уш.с, 4Н, піперазин-3,5-NСН2), 2,53 (т, J=5,8Гц, 4Н, піперазин-2,6-NCH2), 2,62 (т, J=7,0Гц, 2Н, етокси-NСН2), 2,92 і 2,98 (подвійний с, 2х3Н, NСН3), 3,63 (т, J=7,0Гц, 2Н етокси-ОСН 2), 4,14 (с, 2Н, СОСН2), 4,20 (с, 1Н, СН), 7,15-7,37 (м, 9Н, АrН). Приклад 2 (RS)-N,N-Диметил-{2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}ацетаміду дигідрохлорид Виконують процедуру, описану в Прикладі 1, з тією різницею, що схожий на мед осад основи розчиняють у 100мл 20% соляної кислоти, отриманий розчин концентрують при 10-20°С під зниженим тиском для зменшення вмісту води приблизно до 5%, осад розчиняють у 100мл ізопропанолу, до отриманого розчину додають 1000мл ацетону і потім знову виконують процедуру, описану в Прикладі 1. Таким чином одержують 110г (76,4%) названої сполуки, т.пл.: 184-189°С. Приклад 3 (RS)-N,N-Диметил-{2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}ацетаміду дигідрохлорид Виконують процедуру, описану в Прикладі 1, з тією різницею, що схожий на мед осад розчиняють у 30мл метанолу і до отриманого розчину додають 80мл метанолу, що містить 27% хлористого водню, потім відокремлюють дипдрохлорид, як описано в Прикладі 1. Таким чином одержують 108,9г (75,6%) названої сполуки, т.пл.: 185-190°С. Приклад 4 (RS)-N,N-Диметил-{2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}ацетаміду дигідрохлорид 126,8г (0,3моль) (RS)-{2-[4-(a-феніл-п-хлорбензил)піперазин-1-iл]}етанолу дигідрохлориду моногідрату розчиняють у 300мл води і до отриманого розчину додають 100г товченого льоду. До о триманого розчину додають 200мл толуолу і доводять рН до 8 додаванням приблизно 60мл 40мас. % водного розчину гідроксиду натрію. Фази розділяють, водну фазу екстрагують 50мл толуолу. Об'єднані розчини толуолу промивають 50мл насиченого водного розчину хлориду натрію, висушують над безводним сульфатом магнію, фільтрують, потім виконують процедуру, описану в Прикладі 1. Таким чином одержують 129,2г (88,1%) названої сполуки, т.пл.: 185-190°С. Чистота: більше 99,6%, як визначено ВЕЖХ. Приклад 5 (RS)-N,N-Диметил-{2-[4-(-феніл-п-хлорбензил)піперазин-1-іл]етокси}ацетаміду фумарат Виконують процедуру, описану в Прикладі 1, з тією різницею, що реакцію проводять з 0,025моль, схожу на мед основу (10,3г, 98%) розчиняють у 10мл ізопропанолу, до отриманого розчину додають 2,9г (0,024моль) фумарової кислоти і суміш нагрівають до розчинення. До теплого розчину додають 40мл етилацетату для наступної кристалізації продукту. Після охолодження кристали відфільтровують і промивають етилацетатом. Таким чином одержують 11,2г (84,0%) названої сполуки, т.пл.: 138-141°С. Приклад 6 (RS)-N,N-Діетил-{2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}ацетамід Виконують процедуру, описану в Прикладі 1, з тією різницею, що реакцію проводять з 0,025моль, і замість N,N-диметил-2-хлорацетаміду використовують 4,11г (0,0275моль) N,N-діетил-2-хлорацетаміду. У процесі обробки реакційної суміші схожу на мед основу (9,98 г, 89,9%) не перетворюють у дигідрохлорид, а очищають за допомогою хроматографії на колонці із силікагелем, яку елююють хлороформом, що містить 1-10% метанолу, при постійному збільшенні полярності суміші. Таким чином одержують 9,16г (82,5%) названої сполуки у вигляді блідо-жовтого, схожого на мед продукту. Rf=0,45 (пластина Kieselgel Merck, хлороформ-метанол=9:1). IK(KBr);n C=О 1646cм-1 ПМР (СОСІ3): d м.д. 1,10 і 1,15 (подвійний т, J=7,0Гц, 2х3Н, СН3), 2,42 (уш.с, 4Н, піперазин-3,5-NCH2), 2,54 (уш.с, 4Н, піперазин-2,6-МСН2), 3,30 і 3,33 (подвійний м, 2х2Н, етил-NСН2), 3,65 (т, J=5,9Гц, 2Н, етокси-ОСН 2), 4,14-(с, 2Н, СОСН2), 4,20 (с, 1Н, СН), 7,17-7,37 (м, 9Н, АrН). Приклад 7 (RS)-N,N-Дiаліл-{2-[4-(a-фент-п-хлорбензил)піперазин-1-іл]етокси}ацетамід Виконують процедуру, описану в Прикладі 1, з тією різницею, що замість N,N-діаліл-2-хлорацетаміду використовують 4,77г (0,0275моль) N,N-діаліл-2-хлорацетаміду. Схожу на мед основу (10,5г, 89%), отриману після обробки реакційної суміші, очищають за допомогою хроматографії на колонці із силікагелем, використовуючи в якості елюента суміш хлороформу і 2% метанолу. Таким чином одержують 9,45г (80,1%) названої сполуки у вигляді блідо-жовтого, схожого на мед продукту. Rf=0,5 (пластина Kieselgel Merck, хлороформ-метанол=9:1). IK(KBr); n C=O 1657cм-1 ПМР (СОСІ3): d 2,42 (уш.с, 4Н, піперазин-3,5NСН2), 2,53 (уш.с, 4Н, піперазин-2,6-NСН2), 2,62 (т, J=5,8Гц, 2Н, етокси-NСН2), 3,65 (т, J=5,8Гц, 2Н, етокси-ОСН2) 3,86 (т, J=5,8Гц, 2Н, NCH2), 3,96. (т, J=5,8Гц, 2H, NCH 2), 4,15 (с, 2Н, СОСН2), 4,20 (с, 1Н, СН), 5,16 (м, 4Н, ССН 2), 5,72 (м, 2Н, СН), 7,17-7,38 (м, 9Н, АгН). Приклад 8 (RS)-{2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}ацетилморфолід Виконують процедуру, описану в Прикладі 1, з тією різницею, що реакцію проводять з 0,05моль, і замість N,N-диметил-2-хлорацетаміду використовують 8,9г (0,05моль) хлорацетилморфоліду. Схожу на мед основу (10,4г, 45,4%), отриману після обробки реакційної суміші, очищають за допомогою хроматографії на колонці із силікагелем, використовуючи в якості елюента суміш етилацетату і 10% метанолу. Таким чином одержують 8,3г (36,2%) названої сполуки у вигляді маслянистого продукту. RrO,35 (пластина Kieselgel Merck, хлороформ-метанол=9:1). ІК(КВг); n С=О 1655см -1 ПМР (СОСІ 3): d 2,41 (уш.с, 4Н, піперазин-3,5-NCH2), 2,53 (уш.с, 4Н, піперазин-2,6-NCH2), 2,61 (т, J=5,6Гц, 2Н, eтокси-NCH2), 3,50 (м, 4Н морфоліно-NСН2), 3,57 (м, 4Н, морфоліно-ОСН2), 3,62 (т, J=5,6Гц, 2Н, етоксиОСН2,), 4,13 (с, 2Н, СОСН2), 4,20 (с, 1Н, СН), 7,16-7,36 (м, 9Н, АrН). МС(Сl):(М+1)+=458 Приклад 9 (RS)-N,N-Дициклогексил-{2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}ацетамід. Виконують процедуру, описану в Прикладі 1, з тією різницею, що реакцію проводять з 0,02моль, і замість N,N-диметил-2-хлорацетаміду використовують 5,2г (0,02моль) Ν,Ν-дихлоргексил-2-хлорацетаміду. Таким чином одержують 9,8г (88,9%) названої сполуки у вигляді схожого на мед продукту. Чистота: більше 99%, як визначено ВЕЖХ. ІК(КВr); n С=О 1656см -1 ПМР (CDCI3): d 1,23 (м, 4Н, циклогексил-4-СН2), 1,46-1,78 (м, 16Н, циклогексил-2,3,5,6-CH2), 2,45 (уш.с, 4Н, піперазин-3,5-МСН2), 2,59 (уш.с, 4Н, піперазин-2,6-МСН2), 2,67 (м, 2Н, етокси-NСН2), 3,48 (м, 2Н, циклогексилСН), 3,67 (м, 2Н, етокси-ОСН 2), 4,08 (с, 2Н, СОСН 2), 4,21 (с, 1Н, СН), 7,17-7,36 (м, 9Н, АrН). Приклад 10 (RS)-N,N-Дициклогексил-{2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}ацетаміду дималеїнат 1,1г схожої на мед основи, отриманої за способом, описаним в Прикладі 9, розчиняють у 3мл ізопропанолу, до отриманого розчину при кімнатній температурі додають розчин 0,23г малеїнової кислоти в 2мл ізопропанолу і реакційну суміш перемішують при кімнатній температурі протягом 14 годин. Кристали, що випали в осад, відфільтровують і промивають деякою кількістю ізопропанолу. Таким чином одержують 9,8г (88,9%) названої сполуки. Чистота: 99,6%, як визначено ВЕЖХ. Приклад 11 (RS)-N,N-Дибензил-{2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}ацетамід Виконують процедуру, описану в Прикладі 1, з тією різницею, що реакцію проводять з 0,05моль, і замість N,N-диметил-2-хлорацетамщу використовують 13,7г (0,05моль) N.N-дибензил-2-хлорацетаміду. Схожу на мед основу (9,98г,89,9%), отриману після обробки реакційної суміші, очищають за допомогою хроматографії на колонці із силікагелем, яку елююють сумішшю етилацетату і н-гексану при постійному збільшенні полярності суміші. Таким чином одержують 17,0г (57%) названої сполуки у вигляді схожого на мед продукту. Rf=0,7 (пластина Kieselgel Merck, етилацетат-метанол=1:1). ІК(КВr); n С=О 1654см -1 ПМР (CDCI3): d 2,35 (уш.с, 4Н, піперазин-3,5-NСН2), 2,49 (уш.с, 4Н, піперазин-2,6-NСН2), 2,59 (т, J=5,5Гц, 2Н, етокси-NСН2), 3,68 (т, J=5,5Гц, 2Н, етокси-ОСН 2), 4,16 (с, 1Н, СН), 4,25 (с, 2Н, СОСН 2), 4,43 (с, 2Н, PhCH2), 4,55 (с, 2Н, PhCH 2), 7,16-7,36 (м, 9Н, АrН). Приклад 12 (RS)-N,N-Диметил-{2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}ацетаміду дигідрохлорид До розчину 99,3г (0,3моль) (RS)-{2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]}етанолу в 500мл толуолу додають 17,8г (0,33моль) метилату натрію при 25°G при інтенсивному перемішуванні в потоці азоту. Реакційну суміш нагрівають до кипіння, і упарюють 200мл розчинника, потім додають 500мл абсолютного толуолу з тією же швидкістю, з якою відбувається упарювання, підтримуючи таким чином об'єм реакційної суміші від 250 до 350мл. Після припинення додавання толуолу в дистиляті не виявляється метанол. Реакційну суміш припиняють нагрівати, додають 200мл абсолютного толуолу, температур у суміші доводять до 40°С і додають по краплі 40,1г (0,33моль) Ν,Ν-диметил-2-хлорацетаміду, і реакційну суміш перемішують при 50°С протягом 2 годин. Реакційну суміш обробляють, як описано в Прикладі 1. Таким чином одержують 120г (81,8%) (RS)-N,N-{2-[4-(a-феніл-п-хлорбензил)піперазин-1іл]етокси}ацетаміду дигідрохлориду з чисто тою, ідентичній чистоті продукту з Приклада 1. Одержання {2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}оцтової кислоти формули І Приклад 13 (RS)-{2-[4-(a-Феніл-п-хлорбензил)піперазин-1-іл]етокси}оцтової кислоти дигідрохлорид До розчину 97,8г (0,2моль) (RS)-{2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}-ацетаміду дигідрохлориду в 340мл води при перемішуванні додають розчин 80г (2,0моль) гідроксиду натрію в 200мл води, і суспензію кип'ятять протягом 2,5 годин, продуваючи крізь неї азот. Реакційну суміш охолоджують до 40°С, розбавляють 500мл води, підкислюють до рН 3,8 додаванням 120мл концентрованої соляної кислота й екстрагують спочатку за допомогою 400мл дихлорметану, потім 200мл дихлорметану. Об'єднані органічні фази упарюють під зниженим тиском, осад розчиняють у 50мл води, підкислюють додаванням 24мл концентрованої соляної кислоти й упарюють до сухого стану під зниженим тиском. Густий маслянистий осад розчиняють у 50мл ацетону, до отриманого розчину потім додають 550мл ацетону і суміш перемішують протягом 1 години. Кристалічний продукт, що випав в осад, відфільтровують, промивають ацетоном, потім діетиловим ефіром і висушують під зниженим тиском. Таким чином одержують 74,3г (80,5%) чистої названої сполуки, т.пл.: 226-228°С. Чистота продукту відповідає вимогам Європейської Фармакопеї, 3,1997,1084. Приклад 14 (RS)-{2-[4-(a-Феніл-п-хлорбензил)піперазин-1-іл]етокси}оцтової кислоти дигідрохлорид Виконують процедуру, описану в Прикладі 13, з тією різницею, що замість (RS)-N,N-диметил-{2-[4-(aфеніл-п-хлорбензил)піперазин-1-іл]етокси}ацетаміду дигідрохлориду використовують 83,2г (0,2моль) (RS)-N,Nдиметил-{2-[4-(a-феніл-п-хлорбензил) піперазин-1-іл]етокси}ацетамідної основи. Таким чином одержують 75,0г (81,3%) названої сполуки, т.пл.: 225-228°С. Чистота продукту відповідає вимогам Європейської Фармакопеї, 3,1997,1084. Приклад 15 (RS)-{2-[4-(a-Феніл-п-хлорбензил)піперазин-1-іл]етокси}оцтової кислоти дигідрохлорид Виконують процедуру, описану в Прикладі 13, з тією різницею, що замість (RS)-N,N-диметил-{2-[4-(aфеніл-п-хлорбензил)піперазин-1-іл]етокси}ацетаміду дигідрохлориду використовують 106,4г (0,2моль) (RS)N,N-диметил-{2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}ацетаміду фумарат, і після підведення рН реакційної суміші до 3,8 фумарову кислоту, що випала в осад, відфільтровують для полегшення екстракції за допомогою дихлорметану. Таким чином одержують 71,8г (77,8 %) названої сполуки, т.пл.: 225-228°С. Чистота продукту відповідає вимогам Європейської Фармакопеї, 3,1997,1084. Приклад 16 (RS)-{2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]етокси}оцтової кислоти дигідрохлорид Виконують процедуру, описану в Прикладі 14, з тією різницею, що замість (RS)-N,N-диметил-{2-[4-(aфеніл-п-хлорбензил)піперазин-1-іл]етокси}ацетаміду використовують 104,4г (0,2моль) (RS)-N,N-діетил-{2-[4-(aфеніл-п-хлорбензил)піперазин-1-іл]етокси}-ацетаміду, у якості співрозчинника використовують 100мл діоксану, і під час лужного гідролізу реакційну суміш кип'ятять 4 години. Таким чином одержують 69,1г (74,9 %) названої сполуки, т.пл.: 225-228°С. Чистота продукту відповідає вимогам Європейської Фармакопеї, 3,1997,1084. Приклад 17 (RS)-{2-[4-(a-Феніл-п-хлорбензил)піперазин-1-іл]етокси}оцтової кислоти дигідрохлорид Виконують процедуру, описану в Прикладі 14, з тією різницею, що замість (RS)-N,N-диметил-{2-[4-(aфеніл-п-хлорбензил)піперазин-1-іл]етокси}ацетаміду використовують 110,0г (0,2моль) (RS)-N,N-діаліл-{2-[4-(aфеніл-п-хлорбензил)піперазин-1-іл]етокси}-ацетаміду, у якості співрозчинника використовують 100мл діоксану, і під час лужного гідролізу суміш кип'ятять протягом 10 годин. Таким чином одержують 64,0г (69,3 %) названої сполуки, т.пл.: 225-228°С. Чистота продукту відповідає вимогам Європейської Фармакопеї, 3,1997,1084 Приклад 18 (RS)-{2-[4-(a-Феніл-п-хлорбензил)піперазин-1-іл]етокси}оцтової кислоти дигідрохлорид Виконують процедуру, описану в Прикладі 14, з тією різницею, що замість (RS)-N,N-диметил-{2-[4-(aфеніл-п-хлорбензил)піперазин-1-іл]етокси}ацетаміду використовують 107,7г (0,2моль) (RS)-N,N-{2-[4-(a-фенілп-хлорбензил)піперазин-1-іл]етокси}ацетил-морфоліду, і гідроліз проводять протягом 5 годин при кип'ятінні. Таким чином одержують 72,4г (78,4%) названої сполуки, т.пл.: 225-228°С. Чистота продукту відповідає вимогам Європейської Фармакопеї, 3, 1997,1084. Приклад 19 (RS)-{2-[4-(a-Феніл-п-хлорбензил)піперазин-1-іл]етокси}оцтової кислоти дигідрохлорид Виконують процедуру, описану в Прикладі 13, з тією різницею, що після гідролізу реакційну суміш розбавляють 3500мл води, екстрагують 600мл етилацетату і 200мл діізопропілового ефіру, залишки органічних розчинників видаляють з водного розчину під зниженим тиском і продовжують виконувати процедуру з Приклада 13. Таким чином одержують 68,1г (73,8%) названої сполуки, т.пл.: 225-228°С. Чистота продукту відповідає вимогам Європейської Фармакопеї, 3,1997,1084. Приклад 20 (RS)-[2-[4-(a-Феніл-п-хлорбензил)піперазин-1-іл]етокси}оцтової кислоти дигідрохлорид Виконують процедуру, описану в Прикладі 13, з тією різницею, що після гідролізу реакційну суміш розбавляють 3500мл води, охолоджують до 0°С, кристалічну натрієву сіль цетиризину, що випала в осад, осаджують протягом 1 години, фільтрують, потім розчиняють у 1000мл води, доводять рН до 3,8 додаванням соляної кислоти, потім продовжують виконувати процедуру з Приклада 13. Таким чином одержують 65,7г (71,2%) названої сполуки, т.пл.: 225-228°С. Чистота продукту відповідає вимогам Європейської Фармакопеї, 3,1997,1084. Приклад 21 (RS)-{2-[4-(a-Феніл-п-хлорбензил)піперазин-1-іл]етокси}оцтової кислоти дигідрохлорид Виконують процедуру, описану в Прикладі 13, з тією різницею, що гідроліз проводять у присутності 170мл (2,0моль) концентрованої соляної кислоти, і до кінця гідролізу рН реакційної суміші доводять до потрібного рівня 3,8 за допомогою приблизно 270мл 40% водного розчину гідроксиду натрію. Таким чином одержують 70,6г (76,5%) названої сполуки, т.пл: 225-228°С. Чистота продукту відповідає вимогам Європейської Фармакопеї, 3,1997,1084. Приклад 22 (RS)-{2-[4-(a-Феніл-п-хлорбензил)піперазин-1-іл]етокси}оцтової кислоти дигідрохлорид Виконують процедуру, описану в Прикладі 13, з тією різницею, що гідроліз проводять у присутності 170мл (0,9моль) 50% сірчаної кислоти, і до кінця гідролізу рН реакційної суміші доводять до потрібного рівня 3,8 за допомогою приблизно 260мл 40% водного розчину гідроксиду натрію. Таким чином одержують 67,3г (72,9%) названої сполуки, т.пл.: 225-228°С. Чистота продукту відповідає вимогам Європейської Фармакопеї, 3,1997,1084. Приклад 23 (RS)-{2-[4-(a-Феніл-п-хлорбензил)піперазин-1-іл]етокси}оцтової кислоти дигідрохлорид Виконують процедуру, описану в Прикладі 13, з тією різницею, що до реакційної суміші крім водного розчину гідроксиду натрію додають 2г Aliquat 336 (хлорид триоктиметиламонію). Таким чином одержують 74,9г (81,2%) названої сполуки, т.пл.: 226-228°С. Чистота продукту відповідає вимогам Європейської Фармакопеї, 3, 1997,1084. Приклад 24 (RS)-{2-[4-(a-Феніл-п-хлорбензил)піперазин-1-іл]етокси}оцтової кислоти дигідрохлорид Виконують процедуру, описану в Прикладі 13, з тією різницею, що до реакційної суміші крім водного розчину гідроксиду натрію додають 1г 15-краун-5 (1,4,7,10,13-пентаоксациклопентадекан). Таким чином одержують 76,1г (82,5%) названої сполуки, т.пл.: 226-228°С. Чистота продукту відповідає вимогам Європейської Фармакопеї, 3, 1997,1084. Приклад 25 (RS)-{2-[4-(a-Феніл-п-хлорбензил)піперазин-1-іл]етокси}оцтової кислоти дигідрохлорид Виконують процедуру, описану в Прикладі 13, з тією різницею, що гідроліз проводять у присутності 280мл 40% водного розчину гідроксиду калію. Таким чином одержують 75,0г (81,3%) названої сполуки, т.пл.; 226228°С. Чистота продукту відповідає вимогам Європейської Фармакопеї, 3, 1997,1084.
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for the preparation of {2-[4-(a-phenyl-p-chlorobenzene-1-yl]-ethoxy}acetic acid and intermediary compounds
Автори англійськоюTrinka Peter, Bartha Ferenc, Nagy Kalman, Vereczkeyne Donath Gyoergyi, Nemeth Norbert
Назва патенту російськоюСпособ получения {2-[4-(а-фенил-п-хлорбензил)пиперазин-1-ил]-этокси}уксусной кислоты и промежуточные соединения
Автори російськоюТринка Петер, Барта Ференц, Надь Кальман, Верецкейне Донат Дьйордь, Немет Норберт
МПК / Мітки
МПК: A61P 37/08, C07D 295/088, A61K 31/495, C07D 295/08, C07B 61/00
Мітки: сполуки, кислоти, 2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]-етоксі}оцтової, одержання, спосіб, проміжні
Код посилання
<a href="https://ua.patents.su/7-72949-sposib-oderzhannya-2-4-a-fenil-p-khlorbenzilpiperazin-1-il-etoksioctovo-kisloti-i-promizhni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання {2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]-етоксі}оцтової кислоти і проміжні сполуки</a>
Попередній патент: Заміщені похідні фенілпіперазину, фармацевтична композиція та спосіб лікування афективних або неврологічних захворювань і розладів
Наступний патент: Спосіб одержання пасти соняшникової
Випадковий патент: Вогнетривка маса для виготовлення плавильних тиглів











