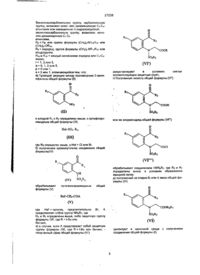
Індолінові похідні, а також їх фармацевтично прийнятні солі, що є антагоністами вазопресинових v1-рецепторів, спосіб їх одержання, проміжні продукти і фармацевтична композиція
Номер патенту: 27238
Опубліковано: 15.08.2000
Автори: Серадей-Легаль Клодін, Ваньон Жан, Нісато Діно, Плузан Клод, Тоннер Бернар
Текст
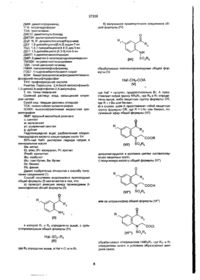
27238 бензилоксикарбонильную группу, карбамоильную группу, возможно моно- или дизамещенную Cj-C^алкилами или замещенную N-гидроксигруппой, аминотиокарбамоильну группу, возможно моноили дизамещенную С1-С4 алкилами, Ra - Re- или группа формулы (CH2)p-NRioRio- или (CH2)p-OR10, 1 Ra = водород, группа формулы (ChfeJs-NRioRio или азидогруппа, 1 Rio и Rio = каждый независимо водород или С1-С4алкил, г = 1, 2 или 3, q = 0, 1. 2 и л и З , р = 0 или1, s = 0 или 1, отличающийся тем, что: а) Проводят реакцию между производным 2-аминофенона общей формулы (II) депротектируют в условиях снятия соответствующих защитных групп, г) Полученную кислоту общей формулы {VI") NH2 (ID O2R5 в которой Ri и R2 определены выше, с сульфопроизводным общей формулы (Ш) или ее хлорангидрид общей формулы (VIій) О Hal-SO 2 -R 5f (Ш) где R5 определен выше, a Hal = СІ или Вг, б) полученное промежуточное соединение общей формул bi(lV) обрабатывают соединением HNReRr, где Re и R? определены выше, в условиях образования амидной связи, д) полученный на стадии б) или г) амид общей формулы (VI) NH (IV) обрабатывают формулы (V) SO 2 R 5 галогенопроизводным общей На1'-СН2-СОА (V) где НаГ- галоген, предпочтительно Вг, представляет собой группу NReR7, где Re и R7 определены выше, либо защитную группу формулы OR, где R = t-Bu или бензил, в) в случае, если А представляет собой защитную группу формулы OR, где R = t-Bu или бензил, полученный эфир общей формулы (VIі) циклизуют в щелочной среде с соединения общей формулы (I). получением 27238 13.Соединения общей формулы СОА 1 Rio и Rio = каждый независимо водород или С1-С4алкил, г = 1,2 или 3, q = 0, 1, 2 или 3, р = 0 или 1, s = 0 или 1, в качестве промежуточных веществ для получения соединений общей формулы (I). 14. Индолиновые производные общей формулы (Г) O2R5 где А = группа, выбранная из Rt = галоген, Сі-С4-алкил или Сі-С4-алкокси, R3 = С3-С7-циклоалкил или моногалогенфенил, Rs ~ фенил, моно- или дизамещенный Ci-C4алкилом или Сі-С4-алкокси, R6 = С1-Сб-алкил или группа формулы (СН2)гСООСі-С4-алкил, R7 ~ 4-пиперидинил, замещенный по азоту СгС 4 алкилом, или группа формулы (СНг)гХі, где Хі представляет собой водород, пиридил, гидроксигруппу, аминофуппу, возможно моно- или дизамещенную С 1-С4-ал килами, карбоксильную группу, Сі-С4алкилоксикарбонильную фуппу, бензилоксикарбонильную группу, карбамоильную группу, возможно моно- или дизамещенную С-|-С4-ал килами, или Re, R7 вместе с атомом азота образуют гетероцикл, выбранный из группы, включающей: морфолин, тиоморфолин, азиридин, замещенный в положении 2 радикалом R?, азетидин, замещенный в положении 2 аминогруппой, либо один из циклов формулы а1) где Ri = галоген, Ci-Cf-алкил или Сі-Сі-алкокси, R2 = Сз-С7-циклоалкил или моногалогенфенил, Rs^H, R4= карбамоильная группа формулы CONR6R7, Rs = фенил, моно- или диамещенный Сі-С4-алкилом или СгС 4 -алкокси, Re = Сі-Сє-алкил, R7 = группа формулы (СНз)гСООН, или Re, R7 вместе с атомом азота образуют гетероцикл, выбранный из группы, включающей один из циклов формулы или где Ra- = группа формулы (CH2)q-X2, где Х 2 представляет собой водород, карбоксильную группу, Ci-C 4 алкилоксикарбонильную группу, бензилоксикарбонильную группу, карбамоильную группу, возможно моно- или дизамещенную Сі-С4-алкилами или замещенную N-гидроксигруппой, аминотиокарбамоильну группу, возможно моно- или дизамещенную Сі-С4-алкилами, Re = Re1 или группа формулы (CH2)P-NRioRio- или (CH2V-OR10, Rg - водород, группа формулы (CH2)s-NRioRio- или азидогруппа, -/ \ Rg ИЛИ где Re1 = группа формулы (СНг)ч-СООН, RS^RBS R9 = водород, х= 1,2илиЗ, q = 0, 1,2илиЗ, как промежуточные вещества для синтеза имеющих ту же конфигурацию заместителей отьосительно связи 2,3 индолина соединений общей формулы (I) 27238 (I) где Ri, R2, R3, R4, R5, R6, г, q указаны выше, R7 = группа формулы (СНг)гН, или Rg, R7 вместе с атомом азота образуют гетероцикл, выбранный из группы, включающей один из циклов формулы ИЛИ где Rep = группа формулы (CH2)q-H, Rs = На; Нэ = водород, 15 Фармацевтическая композиция, обладающая свойствами антагониста вазопрессиновых Vi-peцепторов, содержащая активный компонент и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного компонента она содержит индолиновое производное общей формулы (I) где1 Ri = галоген, Сі-Сл-алкил или С-і-Сі-алкокси, R2 = Сз-С7-циклоалкил или моногалогенфенил, R3 = H, R4 = карбамоильная группа формулы CONRsR?, R5 - фенил, моно- или дизамещенный Cf-d-алкилом или Сі-См-алкокси, Re = Cj-Сб-алкил или группа формулы (СНгїгСООСіСл-алкил, R7 = 4-пиперидинил, замещенный по азоту С1-С4алкилом или фуппа формулы (СНг)гХі, где Хі представляет собой водород, пиридил, гидроксигруппу, аминогруппу, возможно моно- или дизамещенную Сі-Сл-алшлами, карбоксильную группу, Сі-С4-алкилоксикарбонильную группу, бензилоксикарбонильную группу, карбамоильную группу, возможно моно- или дизамещенную СгСі-алкилами, или Re, R7 вместе с атомом азота образуют гетероцикл, выбранный из группы, включающей, морфолин, тиоморфолин, аэиридин, замещенный в положении 2 радикалом Re-, азетидин, замещенный в положении 2 аминогруппой, либо один из циклов формулы о или где Re- = группа формулы (СНг)ч-Х2, где Хг представляет собой водород, карбоксильную группу, Ci-C4алкилоксикарбонильную группу, бензилокси карбонильную группу, карбамоильную группу, возможно моно- или дизамещенную С-Сл-алкилами или замещенную N-гидроксигруппой, аминотиокарбамоильну группу, возможно моно- или дизамещенную Сі-64-ал килами, RB = R& или группа формулы (CHj)p-NRioRio1 или (CH2)P-OR10, R9 = водород, группа формулы (CH2)s-NRi0Rioi или азидогруппа, Rio и Rio- = каждый независимо водород или С1-С4алкил. г = 1 , 2 или 3, q = О, 1,2 илиЗ, р = О или 1, s = О или 1, или его фармацевтически приемлемую соль в эффективном количестве 27238 Изобретение относится к N-сульфонилиндолиновым производным, к способу их получения и к фармацевтическим композициям на их основе Известны некоторые производные N-сульфонилиндола[1], соответствующие формуле COR; N (1) 1 4 so 2 fy в которой -Ri" является водородом, алкилом или замещенным или незамещенным фенилом; -Иг" является галогеном, алкилом, -алкокси, нитро или трифторметилом; -Ra" является алкипом, фенилом или алкилфенилом; -Ft}" является алкилом, замещенным или незамещенным фенилом, алкокси или фенокси; п1 = 0, 1 или 2. Эти соединения (1) представляют собой промежуточные соединения для получения индольных производных, являющихся активными по отношению к центральной нервной системе, имеющих формулу COR" в которой R" является алкилом, замещенным или незамещенным фенилом или гидроксилом. Индолиновые производные, соответствующие данному изобретению, обладают сродством по отношению к вазопрессиновым и оцитоциновым рецепторам Вазопрессин является известным гормоном антидиуретического действия, известна также его роль в регулировании артериального давления. Он стимулирует деятельность нескольких типов рецепторов Vi, V2, Vi a ,Vib и таким образом обладает сердечно-сосудистым, гепатическим, антидиуретическим, рвотным и агрегирующим действием, а также проявляет пролиферативный и митотический эффекты, особенно в сердечно-сосудистых и печеночных тканях. Антагонисты рецепторов вазопрессина могут воздействовать на регулирование центрального или периферического кровообращения, особенно коронарного, почечного и желудочного кровообращения, а также на метаболизм воды и выделение адренокортикотропного гормона (АКТГ) Вазопрессиновые рецепторы аналогично рецепторам оцитоцина имеет пептидную структуру, аналогичную структуре вазопрес сина Его рецепторы найдены также в миоэпителиальных клетках молочной железы и в центральной нервной системе (Presse Medicale 1987,16 (10)481-485, J. Lab. Chin. Med . 1989,114 {6), 617632 и Pharmacol* Rev. 1991, 43 (1), 73-108). Таким образом, соединения, соответствующие изобретению, могут быть полезными, в частности, при лечении заболеваний центральной нервной системы, сердечно-сосудистой системы и в желудочной области людей и животных. Изобретение относится к индолиновым производным общей формулы (I) где - Ri = галоген, Сі-С4-алкил или Сі-С4-алкокси, - R2 - Сэ-С7-Циклоапкил или моногало генфенил, - R* = Н, - R4 = карбамоильная группа формулы CONR6R7, - Rs = фенил, моно- или дизамещенный С1-С4алкилом или Сі-С4-алгакси, - Re= Сі-Сб-алкил или группа формулы (СНг)г СООСгОгалкил, - R? ~ 4-пиперидинил, замещенный по азоту СгС4-алкилом или группа формулы (СН 2 )гХі, где Хі представляет собой водород, пиридил, гидроксигруппу, аминогруппу, возможно моно- или дизамещенную СгС4-алкилами, карбоксильную группу, Сі-Сі-алкипоксикарбонильную группу, бензилоксикарбонильную группу, карбамоильную группу, возможно моно- или дизамещенную Сі-С4-алкилами, илиR6, R7 вместе с атомом азота образуют гетероцикл, выбранный из группы, включающей: морфолин, тиоморфолин, азиридин, замещенный в положении 2 радикалом Rff, азетидин, замещенный в положении 2 аминогруппой, либо один из циклов формулы —N или где - Re- = группа формулы (CH 2 ) q -X 2 где Х 2 представляет собой водород, карбоксильную группу, СгС4-алкилоксикарбонильную группу, бензилокси 27238 карбонильную группу, карбамоильную группу, возможно моно- или дизамещенную Сі-С4-алкилами или замощенную N-гидроксигоуппой, аминотиокарбамоильну группу, возможно моно- или дизамещенную Сі-Сл-алкилами, - Re = Re- или группа формулы (CH2)p-NRioRio или (CH2)P-ORio, - R9 = водород, группа формулы (СНгЬNRioRio-или азидогруппа, - Rio и Rio = каждый независимо водород или С г С4-алкил, - г * 1, 2или 3, - q = 0, 1,2 или 3, - р = 0 или 1, - s = 0 или 1, а также их фармацевтически приемлемые соли, являющиеся антагонистами вазопрессиновых V]рецепторов Соли соединений формулы (1) включают соли с неорганическими или органическими кислотами, которые позволяют провести соответствующее выделение или кристаллизацию соединений формулы (1), такие, как пикриновая кислота, щавелевая кислота, или с оптически активными кислотами, например миндальная кислота или камфарсульфокислота, и с такими кислотами, которые образуют фармацевтически приемлемые соли, такие, как гидрохлориды, гид роге нсульфат, дигидрогенфосфат, метан сул ьфонат, малеинат, фумарат или 2-нафтапинсульфонат Соли соединений формулы (1) включают также соли с органическими или неорганическими основаниями, например соли щелочных или щелочноземельных металлов, такие, как соли натрия, калия или кальция, предпочтительными являются соли натрия и калия, или с амином, такими, как трометомол, или соли аргинина, или лизина, или любого фармацевтически приемлемого амина Соединения (1) проявляют цис-трансизомерию по отношению к связи 2,3 индолина Различные изомеры входят в объем изобретения Соединения (1), в которых R2 и R4 расположены по одну сторону кольца, называются цисизомерами Соединения (1), в которых R2 и R^ располагаются по разные стороны от кольца, называются трансизомерами цис-изомер транс-изомер Кроме того, соединения, соответствующие изобретению, имеют 2 асимметричных углеродных атома или более, когда R4 содержит 1 или 2 асимметричных углерода Оптические изомеры соединений (1) составляют часть изобретения В представленном описании под галогеном следует понимать атом фтора, хлора, брома или йода, под алкильной группой обозначаются линейный или разветвленные углеводородные группы Предпочтительными соединениями (1), соответствующими изобретению, являются такие, которые удовлетворяют следующим условиям, Ri является атомом хлора или брома или метокси группой, а п = 1, R2 представляет собой хлорфенил, метоксифенил или циклогексил, R4 является группой CONR6 R7 , в которой Re и R7 или NRe R7 имеют одно из следующих значений NR 6 R7 является пирролидино группой, которая является замещенной в положении 2 группой (СНЬЬ, которая сама является замещенной карбоксильной или карбамоильной группой с значением q = 0, 1,2 или 3, NRs R7 является пиперидино группой, которая в положении 4 замещается амино группой, Сі -С4 -алкиламино или Сі -С4 -диалкиламино, NRe R7 является триазолидино группой, которая замещается группой (CH2)q, которая в свою очередь замещается карбоксильной или карбамоильной группой с значением q = 0, 1,2 или 3 NR 5 R7 является пирролидино группой, которая замещается в положении 2 группой (CH 2 ) q , которая сама замещается карбоксильной или карбамоильной группой при значении q = 0, 1, 2 или 3 и которая в положении 4 замещается амино группой Сі - С 4 -алкиламино или Сі - С4 диалкиламино,Re представляет собой Сі - Сді-алкил, a R7 является группой (СНгіг, которая сама замещается карбоксильной группой или карбомоильной группой при значении г = 1, 2 или 3 Rs является фенилом, замещенным в положении 3 и 4 или в положении 2 и 4 метокси группой или Rs представляет собой фенил, замещенный в положении 4 метильной группой - т = О Наиболее предпочтительными являются соединения (1) в виде цисизомеров В описании и примерах используются следующие аббревиатуры ДХМ дихлорметан Эфир изо изопропиловый эфир AcOEt этила цетат МеОН метанол EtcOH этанол Эфир этиловый эфир 27238 ДМФ: диметилформамид ТГФ: тетрагидрофуран ТЭА: триэтиламин ДМСО: диметилсульфоксид ДИПЭА1 диизопропилэтиламин ДЦК' N, N'-дициклогексилкарбодиимид ДБУ' 1,8-диазабицикло[5.4.0] ундек-7-ен ТБД: 1,5,7-триазабицикло[4.4 0] дек-5-ен ДБН: 1,5-диазабицикло [4.3.0] нон-5-ен ДМАП: 4-диметиламинопиридин ДМП: З-диметил-2-оксогексагидропиримидинон ТМЭДА: тетраметипэтилендиамин ЛДА: литий диизопропиламид ГМФА: гексэ мети л фосфорам ид ГОБТ: 1-гидроксибензотриазол гидрат БОФ: бензотриазолилокситрисдиметиламинофосфоний гексафторфосфат ТФУ: трифторуксусная кислота Реактив Лавессона: 2,4-бис(4-метоксифенил)1,3-дитиа2,4-дифосфэтэн-2,4-дисульфид Т. пл.: точка плавления Соленой раствор: вода, насыщенная хлоридом натрия Сухой лед: твердая двуокись углерода ТСХ: тонкослойная хроматография ВЭЖХ: высокоэффективная жидкостная хроматография ЯМР: ядерный магнитный резонанс с: синглет м: мультиплет ус: уширенный синглет д: дублет Гидрохлоридная вода: разбавленная хлористоводородная кислота концентрации около 1Н 80%-ный NaH: дисперсия гидрида натрия в минеральном масле Me: метил Et: этил; іРг: изопропил, Рг: пропил iPentil: изопентил iBu: изобутил tBu: трет-бутил. Ви:бутил Bz: бензил Ph: фенил Далее изобретение относится к способу получения соединений (1) Способ получения индолиновых производных общей формулы (I) заключается в том, что: а) проводят реакцию между производным 2аминофенона общей формулы (II) б) полученное промежуточное соединение общей формулы (IV) SO2R5 обрабатывают галогенопроизводным общей формулы (V) Hal'-CHz-COA (V) где Hal' = галоген, предпочтительно Вг, А представляет собой группу NR6R7, где R6 и R7 определены выше, либо защитную группу формулы OR, где R = t-Bu или бензил, в) в случае, если А представляет собой защитную группу формулы OR, где R = t-Bu или бензил, полученный эфир общей формулы (VIі) N COOR депротектируется в условиях снятия соответствующих защитных групп, г) полученную кислоту общей формулы (VIй) соон (VI") S O R 2 5 или ее хлорангидрид общей формулы (VI'") в которой Ri и R2 определены выше, с сульфопроизводным общей формулы (III) СОС! (VI*") HaI-S02-R5 (Ml) где R5 определен выше, a Hal = СІ или Вг, S O 2R5 обрабатывают соединением HNReRz, где Re, и R7 определены выше, в условиях образования амидной связи, 27238 д) полученный на стадии б) или г) амид общей формулы (VI) N CONR6R7 SO2R5 циклизуют в щелочной среде с получением соединения общей формулы (І). 2-аминофеноновые производные формулы (II) являются известными или получаются известными методами, аналогичными тем, которые описаны А. К. Singh и др. Synth Conunun 1986,16 (4), 485 и G N. Walker, J. Org. Chem. 1962,21 1929 2-амино-2'-трифторметилбензофеноны и другие трифторметилированные производные получаются в соответствии с методом, описанным в патенте США 3341592. 2,4-диметоксибензолсульфонил хлорид получается в соответствии с описанием в J. Am. Chem. Soc. 1952,74,2008. Сульфонильные производные формулы (III) являются известными и получаются известными методами. Так, например, 4-ди метил аминобензолсульфонилхпорид получается в соответствии с работой С. N. Sukenic и др J. Am. Chem. Soc. 1977, 19,851 -858, получение п-бензилоксибензолсульфонилхлорида описано в Европейской патентной заявке ЕР 229,566. Алкоксибензолсульфонилхлорид получается из натрий -алкоксибензолсульфоната, который в свою очередь получается взаимодействием галоидного алкида с гидроксибензолсульфонатом натрия. Галоидированные производные формулы (V) являются известными или получаются известными методами, такими, как описанные A J. Vogel A Text Book of Practical Organic Chemistry: Longman 3rd. , 1956, p 383 или G. Kirchner и др. J. Am. Chem. Soc. 1985,107,14,7072. Взаимодействие соединения формулы II с соединением формулы III осуществляется в пиридине нагреванием при температуре между комнатной и точкой кипения растворителя в течение времени от нескольких часов до нескольких дней. Если нужно, реакцию можно проводить в присутствии диметиламинопиридина, который используется в каталитическом или стехиометрическом количестве. Стадия обработки сульфонамида формулы (IV) соединением формулы (V) осуществляется при избытке гало ге ни ро ванн о го производного формулы (V) в растворителе, таком, как диметилформамид или диметилсульфоксид, в инертной атмосфере при температуре от 0° С до комнатной температуры, в течение периода времени от нескольких часов до 24 ч в присутствии гидрида натрия. В том случае, когда группа ~NR 6 R7 содержит вторичную амино-группу, то есть когда R6 и/или R7 являются замещенными амино группой, предпочитают использовать галогенированное производное (V) формулы НаГ-СНг -СО2 R, в которой R представляет собой трет-бутил или бензил для того, чтобы получить промежуточные соединения формулы (VIі) И затем (VI"). В этом случае этап образования кислоты формулы (V)") осуществляется либо действием галогена в присутствии катализатора, такого, как палладий на угле, если R представляет собой бензил, либо в кислой среде, если R является трет-бутилом, например, в присутствии ТФУ-кислоты или в присутствии бромистоводородной кислоты в уксусной кислоте, или даже в присутствии ZnBr2 в дихлорметане. Обработка соединения формулы (VI") или (VIі") амином проводится в стандартных условиях амидного сочетания, например в присутствии БОФ или ГОБТ и ДЦК. Соединения HNReRr ЯВЛЯЮТСЯ известными или получаются известными методами. В качестве примера стереоспецифический синтез (R) и (S) 2-пирролидинилуксусных кислот проводится в соответствии с работой Н. Rueger и др. в Heterocycles, 1982, 19, (9), 1677 из лролинового производного соответствующей конфигурации Получение метил N-Boc3,4-дегидро-апьфа-пролината осуществляется в соответствии с работой J R. Dormoy Synthesis 1982, 753. Получение оптических чистых производных пипеколовой кислоты описывается, например в Tetrahedron 1992, 48, (3), 431-442 и Tetrahedron, 1991,47, (24), 4039-4062. Получение производных азиридинкарбоксильной кислоты осуществляется в соответствии с работой К. Nakajima и др. в Bull. Chem. Soc. Jap. 1978,51 (5), 1577. Этап циклизации протекает по типу реакции альдолизации: метиленовая группа в альфа-положении амида депротонируется, а карбонильная группа фенона затем выступает в качестве внутреннего акцептора эпектронов, приводя к циклизации с появлением двух асимметричных углеродов (С"). Реакция может быть проиллюстрирована следующей схемой: 27238 Chem. Commen, 1990, 1657) В качестве примера можно отметить использование диизопропиламида лития в интервале температур -78° С и -80° С в безводном ТГФ в инертной атмосфере или ТГФ в присутствии добавок, таких, как, например, тетрамелиндиамин, ДМП или ГМФА. Примерами других известных амидов, которые могут быть использованы, являются цикпогексиламид лития, и 2,2,6,6тетраметилциклогексиламид лития. Возможно также получение других амидов взаимодействием требуемого количества бутиплития в гексане с линейными или циклическими вторичными аминами, при этом реакция протекает в одном из перечисленных выше растворителей. Принципы альдольной реакции присоединения рассмотрены С Н Heathcock в Asymetric Synthesis, vol. 3: Stereodifferentiating additions reactions, часть В, 111-112, Academic Press, 1984, издание J. D Morrison. Известно, что альдольная реакция ахиральных амидных анионов приводит к образованию двух рацемических диастереоизомеров бета-гидроксиламидов в соотношении, которое в значительной степени зависит от используемых условий эксперимента. Среди, этих условий могут быть отмечены следующие: природа используемого неорганического или органического основания, природа катионов или противоионов, возможное присутствие добавок в реакционной среде, растворитель, температура реакции и структура соединения, участвующего в этой реакции. Другую группу оснований, которые могут быть использованы, составляют силиламиды лития, натрия или калия, среди которых могут быть упомянуты (Ме 3 Si) 2 NLi, (Me2 PhSi}2 NLi, (Efe Si) 2 NLi, (Мез Si)2 NK,(Me3 Si)2 NNa, Возможно также использование смешанных амидов, например литиевой соли М-(триметилсилил)бензиламина или аналога, в котором бензиламин заменен хиральным первичным амином, таким, как (R)- или (S) альфа-метилбензиламин. Когда соединение формулы (1), которое должно быть получено, имеет 2 асимметричных углеводородных атома, использование хиральных амидов или алкоголятов в этапе циклизации делает возможным энантиомерное обогащение каждым из цис-или трансстереоизомеров. Затем определяется пропорция каждого из энантиомеров методом высокоэффективной жидкостной хроматографии на хиральной колонке. Когда соединение формулы (1), которое должно быть получено, имеет 3 или 4 асимметричных углеродных атома, этап циклизации соединение формулы (VIі) может сопровождаться диастереоизомерным обогащением и использование соответствующего хирального основания делает возможным изменение диастереоизомерного обогащения. На последнем этапе цис-и трансгеометрические изомеры соединения (1) экстрагируются по стандартным методам и разделяются хроматографическим методом или фракционной кристаллизацией. Если необходимо, оптические изомеры каждого из цис-и трансизомеров разделяются, например, препаративной хроматографией на хиральной колонке, за которой следуют, если нужно, фракционная кристаллизация или образование оптически активной соли в присутствии соответственно выбранной хиральной кислоты или основания. Таким образом, в том случае, если соединение, соответствующее изобретению, имеет 2 асимметричных углеродных атома, энантиомеры могут быть разделены хиральной ВЭЖХ. Когда соединение, соответствующее изобретению, имеет 3 или 4 асимметричных атома углерода, диастереоизомеры могут быть выделены с использованием хроматографических методов и методов фракционной кристалпизации. Для идентификации цисизомеров и трансизомеров соединений формулы (1) могут быть использованы несколько методов. В том случае, когда R3 является водородом, используется сравнительный анализ с применением высокой области ЯМР В том случае, когда группы Re и R7 не содержат группы, гидролизующейся в щелочной среде, можно использовать гидроокись натрия в воде в присутствии сорастворителя, с добавлением или без добавления катализатора фазового перехода, можно также использовать гидроокиси четвертичного аммония, например гидроокиси бензилтриметиламмония в метаноле. Для проведения такой реакции адольдолизации возможно также использование органических оснований, например гуанидинов, таких, как 1,5,7триазабицикло[4.4.0]-дек-5-ен, амидинов, таких, как 1,8-диазабицикло[5.4.0] ундек-5-ен или 1,5-диазабицикло[4.3.0] нон-5-ен в растворителе или смеси растворителей, выбираемых, например, из бензола, ТГФ, дихлорметана, метанола и диметилформамида, реакция осуществляется в инертной атмосфере в интервале от-10° С до 110° С, количество использованного основания по меньшей мере является стехиометрическим, реакция может проводиться также и без растворителя при температуре бани. Предпочтительно этап циклизации проводить в присутствии 1,8- диазабицикло[5.4.01 ундек-5ена, (ДБУ) в растворителе, таком, как дихлорметан или метанол, при температуре в интервале от -10 °С до температуры рефлюкса растворителя. Возможно также использование алкоголята первичного, вторичного и третичного спирта с литием, натрием, калием, кальцием и магнием. Алкоголят используется в каталитическом или стехиометрическом количестве в безводном растворителе, например, в спирте (если нужно в присутствии сорастворителя, такого, как ТГФ), или в стехиометрическом количестве в ТГФ, ДМФ или ДМСО, если необходимо "в присутствии краун-эфиров, например, дициклогексил-18-краун-б, реакция проводится в интервале температур от-15 до 80 °С. Использование амида типа RR'NLr или RR'NMgBr, в котором R и R" одновалентные радикалы в качестве депротонирующего агента, является методом образований енолятов амидов, которые являются промежуточными соединениями в реакции альдолизации, этот метод был рассмотрен R. Е. Ireland и др. J- Org. Chem. , 1991, 56, 650. Растворителем реакции может быть бензол, гексан или ТГФ, используемые в безводной форме в инертной атмосфере. Мэгут быть добавлены адьюванты, такие, как LiF, LiCI, LJBr, Lil, LiBu ТМЭДА, ДМП, ГМФА, или краун-эфир. (M. Mu-rakate и др J. 10 27238 (250 МГц) в сочетании, например, с изучением эффекта Оверхаузера (N О Е), например, между протоном индолина {Rs = Н) и протоном гидроксила. ИК-спектры цис-и трансизомеров в растворе ДХМ различны. Цисизомер в большинстве случаев имеет интенсивную четкую и симметричную полосу абсорбции в области 3550-3520 см"1 , относящуюся к колебанию гидроксила, в то время как трансизомер не имеет разрешающей колебательной линии в этой области На основании обобщенных данных установлено, что цисизомер является в основном более подвижным в ТСХ иа окисной алюминиевой пластинке (60F 254 нейтральная Тип Е Merok) при элюировании ДХМ, содержащим различные количества AcOEt. Аналогично при хроматографировании на колонке с алюминием (окись алюминия 90, размер частиц 0,063-0,200 мм), цисизомер в большинстве элюировался первым, при этом элюентом являлся ДХМ, содержащий различные количества AcOEt или МеОН. Таким образом, цис-и трансизомерия соединения (1) в большинстве случаев может быть определена аналитическим методом Возможно также использовать аналогию между сходными соединениями или между соединениями, полученными один из другого. Абсолютная конфигурация некоторых соединений, соответствующих изобретению, была определена рентгенографическим анализом. Исходя из него, принимая во внимание значение вращения плоскости поляризации, можно также установить абсолютную конфигурацию других соединений, полученных аналогичным образом. Из соединений (1), в которых заместители Rs и/или R> или группа NRe Я? содержат Сі - Сл -алкоксикарбонильную группу, можно получить путем гидролиза эфира соединения (1), в которых Ren/или R7 или группа NRe R7 содержат карбоксильную группу, а другие заместители соединения (1) остаются неизменными. Кроме того, из соединений, в которых Re и/или R7 или NRs R7 содержат карбоксильную группу, могут быть получены реакцией стандартного амидного сочетания соединения (1), в которых Re и/или Rz или группа NRe R7 содержат карбамоильную группу, которая является свободной или замещена одним или двумя С-гСл-алкилами, а другие заместители являются идентичными. сиэфир, карбоксил или карбамоил, затем осуществляется этап циклизации и затем группу -предшественник аминогруппы превращают в аминогруппу, например гидролизуют карбоксиэфирную группу соединения (I) до карбоксильной группы, которая затем превращается в карбамоильную группу и затем в аминогруппу посредством перегруппировки Гофмана; 2) либо осуществляют обработку соединения (IV) галогенированным производным (V) формулы Наі'-СНг COOR, в котором R является бензилом или трет-бутилом; снимают защиту с эфира соединения (VIі), полученного таким образом, подвергая соответствующей обработке, затем осуществляют сочетание с соединением HNR6 R7 , в котором аминогруппа радикалов R6 и/или R7 может быть защищена, затем полученное таким образом соединение (V[) подвергают циклизации и, если необходимо, получают соединение ()), в котором аминогруппа является свободной, путем снятия защитных групп с амина Соединения формулы (VI), используемые в качестве промежуточных соединений для получения соединений (I), являются новыми и составляют часть изобретения. Таким образом, представленное изобретение относится к промежуточным соединениям общей формулы СОА SO 2 R 5 где - А = группа, выбранная из NReR7, - R1 = галоген, d-Cd-алкил или Сі-Сд-алкокси, - R2 = Сз-С7-циклоалкил или моногалогенфенил, - Rs = фенил, моно- или ди замещенный С1-С4алкилом или Сі-С4-алкокси, - Rs = СгСб-алкил или группа формулы (СНг)г СООСгС4-алкил, - R? = 4-пиперидинил, замещенный по азоту С г С4-алкилом, или группа формулы (СНг)гХі, где Хі представляет собой водород, пиридил, гидроксигруппу, аминогруппу, возможно моно- или диэамещенную Сі-С^-алкилами, карбоксильную группу, С г Сл-алкилоксикарбонильную группу, бензилоксикарбонильную группу, карбамоильную группу, возможно моно- или дизамещенную Сі-С4-алкилами, - или Re, RT вместе с атомом азота образуют гетероцикл, выбранный из группы, включающей морфолин, тиоморфолин, азиридин, замещенный в попожении 2 радикалом Re, азетидин, замещенный в положении 2 аминогруппой, либо один из циклов формулы Наконец, из соединений (1), в которых R6 и/или R7 , или группа NRei R7 содержит карбамоильную группу, могут быть получены реакцией перегруппировки Гофмана соединения (1), в которых Re и/или R7 или группа NRei R7 содержат аминогруппу, то другие заместители являются идентичными (J Org. Chem. 1979,41 (10) 1746). Таким образом, в соответствии с изобретением способ получения соединений (1), в которых R6 и/или R7 или группа NRe R7 содержат аминогруппу, которая является свободной или замещена одним или двумя Сі -Сд -алкилами, может иметь два варианта 1) На этапе взаимодействия соединения формулы (IV) с соединением (V) осуществляют обработку соединения (IV) галогенированным производным формулы (V) НаГ-СНг CONR6 R7 . в котором R6 и/или R7 или группа NRsi R7 содержат группу предшественник аминогруппы, например карбок R. — N 11 — N 27238 - r = 1, 2 или З, - q = 0, 1, 2 или 3, которые являются промежуточными веществами для синтеза имеющих ту же конфигурацию заместителей относительно связи 2,3 индолина соединений общей формулы (I), —N или где - Rff = группа формулы (СНг^-Хг. где Х2 представляет собой водород, карбоксильную группу, Сі-С-і-алкилоксикарбонильную группу, бензилоксикарбонильную группу, карбамоильную группу, возможно моно- или дизамещенную Сі-С4-алкилами или замещенную N-гидроксигруппой, аминотиокэрбамоильну группу, возможно моно- или дизамещенную Сі -Сі-ал килами, - Re = Re- или группа формулы (CH2)p-NRioRioили (CH2)P-ORio, - Rg = водород, группа формулы (CH2)So1 или азидогруппа, - Rio и RIQ> - каждый независимо водород или где - Rt,_R2, Рз. R4, Rs, Re,r, q указаны выше, - R7 ~ группа формулы (СНг)г-Н, - nnnRe, R7 вместе с атомом азота образуют гетероцикл, выбранный из группы, включающей один из циклов формулы -г=1,2илиЗ, - q = 0, 1,2 или 3, * - р - 0 или 1, - s = 0 или 1. Кроме того, данное изобретение относится также к индолиноаым производным общей формулы (!') R. —N где - Rg' = группа формулы (СНг)ч-Н - R8 = Re - R9 = водород. Сродство соединений, соответствующих изобретению, к рецепторам вазопрессина было установлено in vitro с использованием метода, описанного в J. Biol. Chem., 1985, 260 (5), 28442851. Этот метод состоит в изучении смещения меченного тритием вазопрессина, связанного с участками Х/трецептора в мембранах печени крысы, 50%-ные концентрации ингибирования (ICso) Для соединений, соответствующих изобретению, в отношении связывания меченного тритием вазопрессина, имеют низкие значения, достигающие 10" 9 М. Кроме того, на примере человеческой плазмы, богатой тромбоцитами, отмечалось ингибирование агрегирования тромбоцитов, наведенного вазопрессином, при использовании метода, описанного в работе Thrombosis Res. 1987,45,7-16. Соединения, соответствующие изобретению, ингибируют агрегирование, вызванное концентрациями вазопрессина от 50 до 100 нМ при низком значении IDso (ингибирующая доза), подходящем до 10 9 М. Эти результаты показывают антагонистическую активность соединений, соответствующих изобретению, в отношении рецепторов Vi. где - Ri = галоген, Сі-Сд-алкил или Сі-С4-алкокси, - R2 = Сз-С7-циклоалкил или моногалогенфенип, - R3 = Н, - R4 = карбамоильная фуппа формулы CONReR?, - Rs = фенил, моно- или ди замещенный С1-С4алкилом или Сі-С4-алкокси, - Re= Сі-Сб-алкил, - R7 = группа формулы (СНг}гСООН, - или Re, R7 вместе с атомом азота образуют гетероцикл, выбранный из группы, включающей один из циклов формулы R. —N или Сродство соединений (1) к рецепторам V2 измерялось методом, предложенным P. Crause и др. Molecular and Cellular Endocrinobgy 1982,28,529-541. Соединения, соответствующие изобретению и имеющие цискон фигурацию по отношению к связи где - Re = группа формулы (CH2)q-COOH, - Ra = Re-, - R9 = водород. 12 27238 2,3 индолина, характеризуются заметной селективностью в отношении рецепторов V] . Сродство соединений (1), соответствующие изобретению, к оцитоциновым рецепторам было определено in virto по смещению меченного тритием оцитоцина, связанного с рецепторами в мембранном препарате желез беременной крысы. Значения ICso соединений, соответствующих изобретению, являются низкими и лежат между 10'5М и ІО^М. Соединения, соответствующие изобретению, активны при различных путях приема, особенно при оральном введении. У этих соединений не наблюдается симптомов токсичности при приеме фармакологически активных доз. Следовательно, соединения изобретения могут быть использованы при лечении или профилактике различных, связанных с вазопрессином нарушений, особенно сердечно-сосудистых нарушений, таких, как артериальная гипертония, сердечная недостаточность, тромбоз или коронарный вазоспазм, в частности у курильщиков, нарушений центральной нервной системы, например при мозговых отеках, психотических состояниях, расстройствах аппетита или расстройствах памяти, нарушений почечной системы, таких, как почечный вазоспазм или некроз коркового вещества почек, расстройства желудочной системы, например язвы, или синдром несоответствующей секреции антидиуретического гормона. Каждая единичная доза может содержать 0,5 -1000 мг, предпочтительно 1 - 500 мг активного ингредиента в сочетании с фармацевтическим носителем. Такая единичная доза может приниматься от 1 до 5 раз в день так, чтобы ежедневная дозировка составила 0,5 - 5000 мг, предпочтительно 1 - 2 5000 мг. Для получения твердой композиции в виде таблеток активный ингредиент смешивают с фармацевтическим наполнителем, таким, как желатина, крахмал, лактоза, стеарат магния, тальк, гуммиарабик или подобные им. Таблетки могут быть покрыты сахарозой, целлюлозными производными или другими соответствующими веществами или они могут быть также обработаны для обеспечения пролонгирующего действия с тем, чтобы выделять непрерывно предварительно определенное количество активного компонента. Препарат в форме желатиновых капсул готовится смешением активного ингредиента с разбавителем и разливкой образующейся смеси в мягкие или твердые желатиновые капсулы. Препарат в форме сиропа или эликсира или для приема в форме капель может содержать активный ингредиент в сочетании с подслащивающим некалорийным веществом, предпочтительно и с метил па рабеном и пропилпарабеном в качестве антисептиков, а также агент для придания вкуса и соответствующий краситель. Вододиспергируемые гранулы и порошки должны содержать активный ингредиент, смешанный с диспергаторами или увлажняющими агентами или с суспендирующими агентами, такими, как поливинилпирролидон, а также с подслаивающими веществами или с веществами, придающими вкус. Для ректального приема используют свечи, которые готовят на основе связующих, плавящихся при ректальной температуре, например, с какаомаслом или полиэтиленгликолем. Для парентерального приема используют водные суспензии, изотонические солевые растворы или стерильные растворы для инъекции, которые содержат фармакологически совместимые дислергаторы и/или увлажняющие агенты, например, пропилен гликоль или бутил енгл и коль. Активное соединение может быть использовано в виде макрокапсул, если необходимо с одним или несколькими носителями или добавками. Помимо соединений формулы 1 и их фармацевтически приемлемых солей композиции могут содержать другие активно-действующие компоненты, которые могут быть использованы при лечении названных выше расстройств и болезней Соединения характеризуются их точкой плавления (Т. пл. ° С) (или их точкой кипения Т кип ) и/или их ЯМР спектром, снятым при 200 МГц в ДМСО и/или показателем вращения плоскости Бполяризации (альфаО), измеренной при 25 °С (если нет других указаний). Измеренное значение вращения плоскости поляризации зависит от количества остаточного растворителя, присутствующего в приготовленном продукте. За исключением особо указанных случаев обозначение "цисизомер" или "трансизомер" означает, что выделенное соединение является смесью зка Соединения, соответствующие изобретению, могут быть использованы также в качестве антирвотных средств, особенно при болезни укачивания, и в качестве антипролиферирующих агентов, например, при раке или атеросклерозе У женщин соединения, соответствующие изобретению, могут быть использованы также для лечения дисменореи или преждевременных родов.Изобретение относится также к фармацевтической композиции, содержащей эффективную дозу соединения, соответствующего изобретению, или его фармацевтически приемлемой соли и фармацевтически приемлемые добавки Названные добавки выбираются в соответствии с фармацевтической формой и необходимым способом приема. В фармацевтических композициях, предназначенных для орального, подъязычного, подкожного, внутримышечного, внутривенного, местного, внутритрахеального, носового, чрезкожного или ректального приемов, содержание активного вещества формулы (1) или его солей соответствует единичной дозе приема и смешивается со стандартными фармацевтическими носителями. Соответствующие единичные дозы выпускаются для орального приема а виде таблеток, желатиновых капсул, порошков, гранул и растворов или суспензий, или в соответствующих формах для подъязычного, защечного, внутритрахеального или носового приема, для подкожного, внутримышечного или внутривенного приема и для ректального приема Для местного применения соединения могут быть использованы в кремах, мазях или лосьонах Для получения желаемого профилактического или терапевтического эффекта дозы активного содержимого могут варьироваться в интервале 0,01 - 50 мг на 1 кг веса тела в день 13 27238 нтиомеров или цисконфигурацией, или трансконфигурацией. Оптическая чистота соединений исследуется с использованием высокоэффективной жидкостной хроматографией (ВЭЖХ) Пример 1 М-метил-М-метоксикарбонилметил-5-бром-3-(2-фторфенил)-1-(3,4-диметоксифенилсульфонил)-3-гидрокси-2-индолинкарбоксамид, цисизомер. A) Метил-^-бромацетилсаркосинат Это соединение получается в соответствии с Т. D. Harris и др. в J. Heterocyclic. Chem., 1981,18 423. B) 5-бром-2-{3,4-диметоксифенилсульфонэмид)2'-фторбензофенон 20 г 2-амино-5-бром-2-фторбензофенона нагревают при 85° С в течение 48 ч в 120 мл сухого пиридина в присутствии 20 г 3,4-диметоксифенилсульфонилхлорида. Смесь охлаждают, выливают в охлажденную льдом воду, твердое вещество отфильтровывают, экстрагируют с помощью AcOEt, органическую фазу промывают водой, раствором хлористоводородной кислоты (1Н), водой и затем соленой водой. После высушивания над сульфатом магния и испарения растворителя в вакууме получают твердое вещество, которое пере кристалл изовывают из смеси (ДХМ) изопропиловый эфир. гп = 28г Т. пл. 125-128° С C) 5-Бром-2-1 [Ы-(3,4-диметоксифенилсульфонил)-М-(Ы'-метил-Ы'-метоксикарбонилкарбамоилметил)]-2-амино-2'-фторбензофенон. 3,5 г соединения, полученного на этапе В, растворяют в безводном ДМФ при 0° С в атмосфере аргона и добавляют 80%-ный гидрид натрия, через 15 мин добавляют 4,85 г соединения, полученного на этапе А и смесь оставляют перемешиваться при комнатной температуре на 12 ч. Реакционную смесь выливают в воду, твердое вещество отфильтровывают, затем его растворяют в AcOEt, органическую фазу промывают водой, затем соленой водой, и растворитель выпаривают в вакууме. Полученное масло фильтруют на двуокиси кремния при элюировании смесью ДХМ/AcOEt (85/15, по объему) Т пл. 95 °С с выделением газа Примеры 2 и 3. [(4-Бензилоксикарбонил)-1пиперазинил] 2-карбонил-5-хлор-3-(2-хлорфенил)1-(3,4-диметоксифенилсульфонил)-3-гидроксииндоли-н, цисизомер и трансизомер A) 1-Бромацетил-4-(бензилоксикарбонил) пиперазин Смесь из 22 г 4-бензилоксикарбонилпиперазина и 10,1 г триэтиламина в 200 мл эфира охлаждае ют до 0 С. В течение 30 мин добавляют 20,2 г бромацетилбромида в 100 мл эфира, и смесь доводят до комнатной температуры. Спустя 4 ч реакционную смесь промывают водой, сушат, концентрируют и затем хроматографируют на двуокиси кремния. Целевое соединение элюиругот смесью ДХМ/AcOEt (95/5 по объему) и пе ре кристалл из овывают из ДХМ/изопропиловый эфир. т = 9г Т пл 100-101° С B) 2',5-дихлор-2-(3,4-диметоксифенилсульфонамидо)бензофенон 5,6 г 2- амино-2', 5-дихлорбензофенона и 5 г 3,4-диметоксифенилсульфонилахлорида нагревают в течение ночи в пиридине при 100° С. Пиридин выпаривают до сухого состояния, добавляют воду и проводят экстракцию этилацетатом, содержащим небольшое количество ДХМ. После неоднократного промывания водой и высушивания над сульфатом натрия экстракт выпаривают в вакууме, и 7,7 г целевого продукта перекристаллизовывают из смеси ДХМ/AcOEt Тпл.164°С C) 2',5-Дихлор-2-1 [М-(3,4-диметоксифенилсульфонил)-Ы(4-бензилоксикарбонил-1-пиперазинкарбонилметил)]-аминобензофенон 2,3 г бензофенона, полученного на этапе В, помещают в 10 мл ДМФ и обрабатывают 200 мг 80%-ного гидрида натрия в масле. Спустя 30 мин добавляют 5,3 г соединения, полученного на этапе А и смесь перемешивают в течение 60 ч при комнатной температуре. Смесь выливают в воду, осадок фильтруют, растворяют в ДХМ, высушивают и затем концентрируют и хроматографируют на двуокиси кремния. Целевой продукт элюируют смесью ДХМ/AcOEt (90/10, по объему) и кристаллизуют из смеси ДХМ/изопропиловый эфир. m = 3.2 г Т. пл 136-137 "С Д) 14-метил-г\1-метоксикарбонилметил-5-бром-3(2-фторфенил)-1-(3,4-диметоксифенилсульфонил)-3ждрокси-2-индолинкарбоксамид, цисизомер. 3,2 г продукта, полученного на предшествующей стадии, растворяют в ДХМ (3 мл), добавляют 750 мг ДБУ, и смесь оставляют при перемешивании на 24 "ч при комнатной температуре. Реакционную смесь выливают в силикагельную колонку, при злюировании смесью ДХМ/AcOEt (90/10 по объему), полученный продукт является смесью изомеров (цис и транс) целевого соединения Этот продукт растирают в порошок в смеси гексан/изопропиловый эфир, и полученное твердое вещество фильтруют. Отфильтрованные жидкости хроматографируют на окисно-алюминиевой колонке, которая была предварительно уравновешена смесью ДХМ/AcOEt (70/30 по объему). Наименее полярное соединение элюируется смесью ДХМ/AcOEt (60/40 по объему) и затем перекристаллизовывается из смеси ДХМ/гексан/изопропиловый эфир. т = 2г Т. пл. 173-175 °С Д)[(4-Бензилоксмарбонил)-1-пиперазинил]-2-карбонил-5-хлор-3-(2-хлорфенил)-1-(3,4-ДИметоксифенилсульфонил)-3-гмдроксииндолин, цисизомер и трансизомер. 1 г соединения, полученного на предыдущем этапе, суспендируют в 20 мл метанола и 20 мл ТГФ и подвергают действию 75 мг метилата натрия. Спустя 2 ч смесь нейтрализуют добавлением небольших количеств сухого льда, концентрируют до сухого состояния и затем поглощают водой, затем смесь экстрагируют с помощью ДХМ, экстракт высушивают и концентрируют. Неочищенный продукт подвергают хроматографии на колонке с окисью алюминия, при элюировании смесью ДХМ/AcOEt (80/20 по объему) получают последовательно два изомера. Наименее полярный изомер перекристаллизовывают из смеси ДХМ/гексан Это соединение представляет собой цисизомер. 14 27238 m = 262 мг Л Т. пл. 169-179 С Наиболее полярный изомер перекристаллизовывают из смеси ДХМ/изопропиловый эфир m = 200 мг Т. пл. 209-211 "С Пример 4. 5-Хлор-3-(2-хлорфенил)-1-(3,4-диметоксифенилсульфонил)-3-гидрокси-2-(1-пиперазинилкарбонил)индолин, цисизомер 200 мг цисизомера, полученного в предыдущем примере, растворяют в 10 мл этанола и 5 мл ТГФ и гидрируют при комнатной температуре в присутствии 10%ного палладия на угле. Через 30 мин смесь фильтруют через целит, отфильтрованные жидкости концентрируют и затем подвергают хроматографированию на двуокиси кремния. Целевой продукт подвергают элюированию смесью МеОН/ДХМ (10/90 по объему) и перекристаллизовывают из смеси ДХМ/изопропиловый эфир. m = 110 мг Т. пл. 230-233 °С Примеры 5 и 6. 5-Хлор-3-(2-хлорфенил)-1-(3,4диметоксифенилсульфонил)-3-гидрокси-2-морфолинокарбонилиндолин, цисизомер и трансизомер A) 2\5-Дихлор[М-(3,4-диметоксифенилсульфонил)-г>Цморфолинокарбонилметил)]-2-аминобензофенон. 5 г 2\ 5-дихлор-2-(3,4-диметоксифенилсульфонамидо)бензофенон подвергают действию 350 мг 80%-ного гидрида натрия в 30 мл ДМФ при комнатной температуре в течение 20 мин. Добавляют 4,5 г морфолинобромацетамида и затем смесь перемешивают при комнатной температуре в течение 48 ч. Смесь выливают в воду, осадок отфильтровывают, растворяют в ДХМ, раствор сушат и концентрируют Образованный продукт перекристаллизовывают из смеси ДХМ/изопропиловый эфир. Получают 3,4 г продукта. Т. пл. 173-176 °С B) 5-Хлор-3-(2-хлорфенил)-1 -{3,4-диметоксифенилсульфонил)-3-гидрокси-2-морфолинокарбонилиндолин, цисизомер 1 г продукта, полученного на предыдущем этапе, растворяют в смеси метанола (10 мл) и ТГФ (20 мл), и на образующийся продукт действуют 92 мг метилата натрия при комнатной температуре в течение 1 ч. Смесь нейтрализуют сухим льдом, растворители частично испаряют, смесь растворяют в воде, экстрагируют с помощью ДХМ, а экстракт сушат, концентрируют и хроматографируют на окиси алюминия. Элюирование смесью ДХМ/AcOEt (70/30 по объему) дает наименее полярный изомер, который перекристаллизовывают из смеси ДХМ/изопропиловый эфир. т = 215 мг цисизомер Т. пл. 260-264 °С C) 5-Хлор-З- (2-хлорфенил)-1-(3,4-диметоксифенилсульфонил)-3-гидрокси-2-морфолинокарбонилиндолин, трансизомер Хроматографированием продукта предыдущего этапа и элюироеанием смесью AcOEt/MeOH (90/10 по объему) получают наиболее полярный продукт После перекристаллизации из смеси ДХМ/изопропиловый эфир получают m = 513 мг трансизомер Т. ПЛ. 240-241° С Пример 7. Ы-метил-Ы-карбоксиметил-5-бром 3(2-фторфенил)-1-(3,4-диметоксифенилсульфонил)З-гидрокси-2-индолин-карбоксамид, цисизомер 200 мг соединения, полученного в примере 1, растворяют в 3 мл МеОН и 1 мг воды, содержащей 13 мг гидроокиси натрия После перемешивания в течение 24 ч при комнатной температуре добавляют одну каплю концентрированного раствора гидроокиси натрия для завершения реакции, а затем спустя 15 мин смесь подкисляют до рН 3 добавлением раствора гидросульфата калия. Добавляют воду, смесь экстрагируют AcOEt и экстракт промывают водой и сушат над сульфатом магния, а растворитель выпаривают в вакууме. Полученный продукт перекристаллизовывают из смеси ДХМ/изопропиловый эфир. Т. пл. 206-208 °С Примеры 8 и 9. 5-Хлор-3-(2-хлорфенил)-1(3,4-диметоксифенилсульфонил)-3-гидрокси-2-(4этилкарбоксилатпиперидинокарбонил) индолин, цисизомер, трансизомер. A) Этил-М-бромацетил-4-пиперидинкарбоксилат Этот продукт получают из зтил-4-пиперидинкарбоксилата, который является коммерчески доступным. B) 2',5-Дихлор-[Ы-{3.4-диметоксифенилсульфонил)-М-(4-этилкарбоксилатпиперидинокарбонилметил)]-2-аминобензофенон. 8 г 2',5-дихлор-2-(3,4-диметоксифенилсульфонамидо)бензофенона растворяют в 100 мл ДМФ и затем добавляют 541 мг гидрида натрия После перемешивания в течение 30 мин добавляют 9,5 г соединения этапа А смесь оставляют стоять при перемешивании при комнатной температуре на 18 ч. Смесь концентрируют в вакууме, растворяют в воде, экстрагируют этилацетатом и экстракт высушивают и концентрируют Полученное масло хроматографируют на двуокиси кремния с использованием в качестве элюента смеси этилацетат ДХМ/гексан (40/10/50 по объему). Экстрагированный продукт кристаллизуют из эфира. m = 3.5 г Т.пл 128 °С C) 5-хлор-3-(2-хпорфенил)-1-(3,4-диметоксифенилсульфонил)-3-гидрокси-2-(4-этилкарбоксилатпиперидинокарбонил) индолин цисизомер, трансизомер Смесь, содержащую 3,4 г соединения, полученного на предыдущем этапе, и 869 мг ДБУ в 10 мл хлороформа в течение 18 ч нагревают до 60 °С. Затем реакционную смесь фильтруют через колонку с окисью алюминия с использованием в качестве элюента смеси ДХМ/эти л ацетат (90/10 по объему) с целью получения цисизомера. m = 700 мг Т.пл.110 °С Чистый этилацетат элюирует трансизомер. m = 610 мг Т п л 187 °С Примеры 10 и 11. Ы-метил-М-(2-пиридилэтил)5-хлор-3-(2-хлорфенил)-1-(3,4-диметоксифенилсульфонил)-3-гидрокси-2-индолинкарбоксамид, цисизомер, трансизомер А)Ы-[2-(2-хлорфенилкарбонил)-5-хлорфенил] М-(3,4-диметоксифенилсульфонил) аминоуксусная кислота 27238 а) 2',5-дихлор-2-(3,4-диметоксифенилсульфонамидо) бензофенон. Это соединение получается в примере 2 — 3, этап В. в) 2",5-дихлор-[М-(3,4-диметоксифенилсульфонил)-М-бензилоксикарбонилметил] 2-аминобензофенон 172 г продукта, полученного на предшествующей стадии, растворяют в 800 мл ДХМ и охлаждают до 0 °С. Постепенно в атмосфере азота добавляют 11,7 г 80%-ного гидрида натрия, а затем, спустя 30 мин, добавляют 256 г бензилбромацетата и смесь оставляют перемешиваться при комнатной температуре на 24 ч, ДМФ испаряют, остаток растворяют в воде, экстрагируют в ДХМ, и экстракт высушивают и концентрируют. Целевой продукт кристаллизуют из изопропилового эфира, а затем перекристаллизовывают из смеси ДХМ/изопропиловый эфир. т = 136,5 г Т. пл. 102-104 °С с)Ы-[2-(2-Хлорфенилкарбонил)-5-хлорфенил]Ы-(3,4-диметоксифенилсульфонил) аминоуксусная кислота 50 г бензилового эфира, полученного на предыдущем этапе, растворяют в 500 мп этилацетата и в атмосфере азота добавляют 2,5 г 5%-го палладия на угле. Раствор интенсивно перемешивают и через него пропускают в течение 5 ч ток водорода. В конце гидрогенерирования продукт кристаллизуют. Смесь фильтруют через целит, осадок обильно промывают горячим ДХМ и затем органическую фазу концентрируют. Целевой продукт кристаллизуют, а затем перекристаллизовывают из смеси ДХМ/изопропиловый эфир. Пример 12. 2-(4- Карбоксил ипер иди н карбон ил)-5-хлор-3- (2хлорфенил)-1-(3,4-диметоксифенилсульфонил)-3гидрокси-индолин, цисизомер 500 мг изомера, полученного в примере 9, помещают в 5 мл метанола в присутствии 48 мг гидроксида натрия а 1 мл воды После перемешивания в течение 18 ч смесь выливают в воду, подкисляют разбавленной хлористоводородной кислотой, затем экстрагируют в ДХМ и экстракт высушивают и концентрируют. Полученное твердое вещество очищают хроматографией на двуокиси кремния, элюируют смесью ДХМ/МеОН (95/5 по объему) и полученный продукт затем кристаллизуют из смеси ДХМ/изопропиловый эфир. m = 250 мг Т.пл.150°С Примеры 13 и 14. Ы-метил-М(1-метил-пиперидин-4-ил)-5-хлор-3(2-хлорфенил)-1-(3,4-диметоксифенилсульфонил)З-гидрокси-2-индолин-карбоксамид, цисизомер и трансизомер А)2',5-дихлор-[[^-(3.4-диметоксифенилсульфонил)-Ы-(Ы'-метил-Ы'-метил-пиперидин-4-ил)карбамоилметил]2-аминобензофенон 2 г кислоты, приготовленной в пр имере 10-11, этап А. в 50 мп ДХМ смешивают с 650 мг 4-метиламино-1-метилпиперидина в присутствии 1,90 г БОФ. После перемешивания при комнатной температуре в течение 2 ч органическую фазу промывают карбонатной водой, высушивают и концентрируют. Затем остаток хроматографируют на двуокиси кремния с элюированием смесью ДХМ/МеОН (90/10 по объему) Получают 1,2 г целевого продукта. Т пл. 165-166° С В) М-метил-М-(метил-пиперидин-4-ил)-5-хлор(2-хлорфенил)-1-(3,4-диметоксифенилсульфонил)З-гидрокси-2-индолинкарбоксамид, цисизомер и трансизомер 650 мг продукта, полученного на предыдущем этапе, обрабатывают в течение ночи 100 мг метилата натрия в 5 мл метанола. Добавляют сухой лед, растворитель выпаривают, остаток растворяют в карбонатной воде, экстрагируют в ДХМ и концентрируют, затем хроматографируют на двуокиси кремния. Смесь метанол/ДХМ (5/95 по объему) элюирует последовательно 2 изомера. Затем каждый изомер перекристаллизовывают из смеси ДХМ/изопропиловый эфир. Трансизомер является в этих условиях наименее полярным m = 205 мг Т.пл.181 С Цисизомер m 150 мг Т пл. 97 е С. содержит 0,25 М изопропилового эфира. Примеры 15 и 16. 5-Хлор-3-(2-хлорфенил)-1-(3,4-диметоксифенилсульфонил)-3-гидрокси-2[(4-метил)-пиперазин1-илкарбонил]-индолин, цисизомер и трансизомер А) 2"5-Дихлор-[М-(3,4-диметоксифенилсульфонил)-М-((4-метилпиперазин-1-ил)карбамоилметил)-2-аминобензофенон Это соединение получается действием N-метил-пиперазина на кислоту, полученную в примерах 10 и 11,этап А Т пл. 165-167 С т = 33,7г Т. пл. 177-178 °С В)2',5-дихлор-[Ы-(3,4-диметоксифенилсульфонил)-М(М'-2-пирид-2-ил-этил-М'-метил) карбамоилметил]2-аминобензофенон 2 г кислоты, полученной на стадии А вводят в 30 мл ДХМ и добавляют 1,13 г 2-(2-метиламиноэтил)-пиридина, затем S44 мг триэтиламина и, наконец, 1,92 г БОФ, после чего смесь оставляют стоять на 18 ч при комнатной температуре с перемешиванием. Смесь растворяют в воде, органическую фазу отделяют, промывают раствором карбоната натрия, высушивают и концентрируют. После хромэтографирования на двуокиси кремния целевой продукт получают элюированием смесью ДХМ/МеОН (95/5 по объему) т = 2г Т.пл.150ос" С) М-метил-Ы-(пирид-ил-этил)-5-хлор-3-(2-хлорфенил)-1-(3,4-диметоксифенилсульфонил)-3-гидрокси-2- и нд ол и н ка рбокса м ид. Смесь, состоящую из 1,7 г продукта, полученного на предшествующем этапе, и 422 мг ДБУ в ДХМ нагревают в течение 18 ч при 55° С. Реакционную смесь хроматографируют на окиси алюминия. Элюирование смесью этилацетат/ДХМ (40/60, по объему} дает цисизомер т = 410 мг Т.пл.19ГС ЧИСТЫЙ этилацетат элюирует трансизомер m = 790 мг Т.пл.154°С 16 27238 В) 5-Хлор-3-(2-хлорфенил)-1-(3,4-Диметоксифенилсульфонил)-3-гидрокси-2-[(4-метил)пиперазин-1илкарбонил]-индолин, цисизомер и трансизомер. Соединение предшествующего этапа циклизуют согласно методике примеров 12-13 Два образованных изомера разделяют хроматографией на окиси алюминия. Смесь ДХМ/ этилацетат (75/25 по объему) элюирует наименее полярный продукт цисизомер, который перекристаллизовывают из смеси ДХМ/ изопропиловый эфир, Т. ил. 120 °С. содержит 0,25 М изопропилового эфира. Смесь ДХМ/ МеОН элюирует наиболее полярное соединение, трансизомер, который затем перекристаллизовывают из метанола. Т.пл.189°С Примеры 17 и 18. Ы-изопропил-Ы-метоксикарбонилэтил-5-хлор-3-(2-хлорфенил)-1-(3.4-диметоксифенилсульфонил) -З-гидрокси-2-индолинкарбоксамид, цисизомер и трансизомер. A) М-изопропил-М-(метоксикарбонилэтил) брома цетам ид. 90 г изопропиламина по каплям добавляют к 130 г раствора метилакрилата в 300 мл метанола, охлажденного до -10° С. После 72 ч выдержки при комнатной температуре смесь выпаривают, а затем остаток перегоняют. Образованное масло представляет собой метил-(Ы-изопропил) -3-аминопропионат. Т. кип. 73-78 °С при 15 мм рт. ст. 29 г полученного соединения в 100 мл ДХМ смешивают с 20,2 бром ацетил бром ид а в 100 мл ДХМ при 0° С. После выдерживания смеси при комнатной температуре в течение 12 ч растворитель выпаривают, остаток растворяют в воде, экстрагируют этилацетатом и экстракт сушат и концентрируют Полученное масло используется как таковое на следующем этапе B) 2',5-дихлор-М-(3.4-диметоксифенилсульфс~ нил)-!Ч-(М'-изолролил-г^'-метоксикарбонилэтил)карбамоилметил]-2-аминобензофенон Это соединение получается использованием следующих обычных методов, т. е. взаимодействием продукта, полученного на этапе А с 2',5-дихлор-2-(3,4-диметоксифенилсульфонамидо)-бензофеноном в присутствии гидрида натрия. Т. пл. 135-137 °С (перекристаллизация: ДХМ/ изопропиловый эфир). C) Ы-изопропил-М-метоксикарбонилэтил-5-хлор3-(2-хлорфенил)-1-(3,4-диметоксифенилсульфонил)З-гидрокси-2-индолинкарбоксамид, цисизомер и трансизомер. Этот продукт получается циклизацией соединения, полученного на этапе В в присутствии ДБУ. Цисизомер выделяется хроматографированием на окиси алюминия при элюировании смесью ДХМ/этилацетат (90/10 по объему) Затем продукт перекристаллизуют из смеси этилацетат/гексан. Т. пл. 153-155 °С Трансизомер получается элюированием колонки из окиси алюминия этилацетатом Затем продукт перекристаллизовывают из смеси метанол/изопропиловый эфир. Т пл 182-185 С Примеры 19 и 20. N-Метил-М-метоксикарбонилметил-5-хлор-3-(2-хпорфенил)-1-(3,4-диметоксифенилсульфонил)-3-гидрокси-2-индолинкарбоксамид, цисизомер и трансизомер 2 изомера этого соединения получают в соответствии с методикой, описанной в примере 1 Они разделяются хроматографически на окиси алюминия Смесь ДХМ/зтилацетат (80/20 по объему) элюирует цисизомер. Его кристаллизуют из смеси ДХМ/изопропиловый эфир в виде белого порошка, содержащего 0,25 моль изопропилового эфира. Он превращается в пенящееся вещество при нагревании в вакууме. ЯМР-спектр цисизомера (пример 19) дается на фиг 1. Трансизомер элюируется чистым этилацетатом. Его перекристаллизовывают из смеси ДХМ/изопропиловый эфир. Т. пл. 176-178 °С ЯМР- спектр трансизомера (пример 20) дается на фиг. 2. Примеры 21 и 22. N-мети л- N-ка рбо ксиметил-5-хлор-3-(2-хл орфенил)-1-(3,4-диметоксифенилсульфонил)-3-гидрокси2-индолинкарбоксамид, цисизомер и трансизомер Каждый из этих соединений получается из соединений, описанный в примерах 19 и 20 в соответствии с методикой, приведенной в примере 8. Цисизомер: Т. пл. 220-222 С после перекристаллизации из смеси ДХМ/изопропиловый эфир/метиловый спирт Трансизомер: Т. пл. 222-225 С после перекристаллизации из смеси ДХМ/изопропиловый эфир. Примеры 23 и 24. М-метил-Кі-карбамоилметил5-хлор-3-(2-хлорфенил)-1-(3,4-диметоксифенилсульфонил)-3-гидрокси-2-индол ин ка рбоксам ид, цисизо мер и трансизомер Каждый изомер получается из соответствующего изомера кислоты, приготовленного в примерах 21 и 22. 605 мг трансизомера кислоты, полученной в предшествующем примере, растворяют в 10 мл ДХМ и к ним добавляют 435 мг БОФ и 260 мг ДИПЗА После выдерживания в течение 5 мин при комнатной температуре при интенсивном перемешивании добавляют 6 мл 20%-ного водного раствора аммиака и смесь перемешивают еще 4 ч. Добавляют раствор карбоната натрия, затем смесь экстрагируют в ДХМ. Органическую фазу последовательно промывают водой, раствором гидросульфата натрия, снова водой и затем сушат над сульфатом магния. После выпаривания остаток хроматографируют на силикагеле и элюируют смесью этилацетат/метанол (95/5 по объему). Полученный продукт дважды кристаллизуют из смеси ДХМ/ метанол при 0 С. Т пл 236 °С ЯМР-спектр трансизомера (пример 23) дается на фиг. 3. При использовании той же самой методики получается цисизомер. Целевой продукт кристаллизуют из смеси ДХМ/изопропиловый эфир. Измельченное соединение, высушенное в вакууме при 70 С в течение 8 ч, содержит 0,25 моль изопропилового эфира. Спектр ЯМР-цисизомера (пример 24) дается на фиг. 4. Примеры 25 и 26. 5-хлор-3-(2-хлорфенил)-1-(3,4-диметоксифенилсульфонил)-3-гидрокси(4-гидрокси-пиперидин1-ил)-1-карбонилиндолин, трансизомер 17 27238 Это соединение получают из М-[2-(2-хлорфенилкарбонил)-5-хлорфенил]-М-(3,4-диметоксифенилсульфонил) аминоуксусной кислоты, получаемой в примерах 10 и 11, этап А Затем процесс продолжают в соответствии с методикой примеров 11 и 12, стадия В, но используя 4-гидроксипиперидин в присутствии БОФ и триэтиламина. Затем полученный продукт циклизуют в соответствии с обычной методикой в присутствии ДБУ. Два изомера разделяют хроматографически на окиси алюминия. Смесь ДХМ/метанол (99/1 по объему) элюирует цисизомер. Продукт кристаллизуют из смеси ДХМ/гексан/метанол и затем полученное твердое вещество растирают в порошок в смеси ДХМ/гексан, образуя аморфный порошок Цисизомер характеризуется по его спектру ЯМР при 388 К. 1-1,8 м. д.. м. 4Н. СНг в положениях 3 и 5 пиперидина 2.8- 3 65 м. д.: м: 5 Н : СНг в положениях 2 и 6 пиперидина и СН в положении 4. 3 75мд..2с-6Н.20СНз 4.15 м. д.: д". 1 Н". ОН в пиперидине 5.45 м. д : с: 1Н: СН (индолин) 6.1 м. д.: с. 1Н: ОН индилин 6.8-7.6 м. д.: м: ЮН: Н ароматический ДМСО 2 4м.д. ДОН: 2.75м. д. Смесь ДХМ/метанол (97/3 по объему) элюирует трансизомер, который перекристаллизоеывается из смеси ДХМ/иэопропиловый эфир. Т. пл. 232-234 "С Синтез в (L)-n роли новой серии: примеры 27 - 30. Примеры 27 и 27а. 5-хлор-3-(2-хлорфенил)1-(3,4-диметоксифенилсульфонил)-3-гидрокси-2[(23)-(2-метоксикарбонил)пирролидинокарбоиил] индолин, (цисизомер: 2 соединения) A) Метил (Ц-Ы-(бромацетил)пролинат 20 г триэтиламина и 20 г бромацетилбромида в 30 мл ДХМ одновременно добавляют к раствору, содержащему 16,7 г метил-(1_)-пролинат гидрохлорида в 20 мл ДХМ при поддержании температуры при -5° С, после чего смесь перемешивают в течение 24 ч при комнатной температуре. Добавляют воду, и смесь промывают раствором KHSO4 , водой,раствором бикарбоната натрия, снова водой, после чего высушивают над сульфатом магния. После выпаривания получают масло, которое сушат в вакууме. Это масло, очищенное с помощью ТСХ, используется фактически на следующем этапе. B) 2',5-дихлор-[Ы-(3,4-диметоксифенилсульфонил)-М-((28)-(2-метоксикарбонил) пирролидинокарбонилметил)] 2-аминобензофенон. 4,66 г 2',5-дихлор-2-(3,4-диметоксифенилсульфонамидо)бензофенона растворяют в 40 мл безводного ДМФ в атмосфере аргона при 0 °С, добавляют 340 мг 80%-ного гидрида натрия и затем, спустя 30 мин, 6,5 г соединения, полученного на этапе А После выдерживания в течение 4 дней при комнатной температуре смесь выливают в воду, экстрагируют зтилацетатом, экстракт промывают водой, соленой водой и затем сушат над сульфатом магния и выпаривают в вакууме. Твердое вещество, содержащее небольшое количество исходного бромированного производного, элюируют смесью ДХМ/эти л ацетат (85/15 по объему) хрома тографированием на силикагеле Образец перекристаллизовывают из смеси ДХМ/изопролиловый эфир т=1,2г Т пл 141-142 °С 25 CCD =-43,7° С (с=1, метанол/ тетрагидрофуран: 8/2 по объему) Анализ Рассчитано, %• С 54,81; Н 4,44, N 4,41 Установлено, %: С 54,40; Н 4,54, N 4 55 С) 5-хлор-3-(2-хлорфенил)-1-(3,4-диметоксифенил)пирролидинокарбонил] индолин (цисизомер) 1.1 соединения, полученного на предыдущем этапе, нагревают в 4 мл метиленхлорида в течение 24 ч с эквивалентным количеством ДБУ. Анализ аликвотной доли, выполненный с использованием ВЭЖХ, выявляет наличие 4 целевых изомеров. Через 24 ч реакционную смесь выливают в колонку с окисью алюминия, предварительно уравновешенную смесью ДХМ/этилацетат (90/10 по объему), и элюируют смесью ДХМ/ этилацетат (от 90/10 по объему до 70/30 по объему), полумают 510 мг смеси 2-х наименее полярных соединений при соотношении А\\ (измеренном с помощью ВЭЖХ). Г ) Две последовательных кристаллизации из смеси ДХМ/ изопропиловый эфир в холодном состоянии дает соединение, находящееся в наибольшем количестве. m = 180 мг 25 = -247 °С (С = 0.4, хлороформ) aD Т. пл. 187-190 °С 2°) Кристаллизационные маточные растворы полученного соединения подвергают хроматографированию с использованием окиси алюминия при элюировании смесью ДХМ/этилацетат (85/15 по объему). Таким образом полученное выше соединение отделяется от второго, и второе соединение растворяют в минимальном количестве ДХМ и затем осаждают добавлением минимального количества гексана. aD25 = +136° С (с = 0,24, хлороформ) Пример 28. 2-((23)-2-карбоксипирролидинкарбонил)-5-хлор-3-(2-хлорфенил)-1-(3,4-диметоксифенилсульфонил)-3-гидроксииндрлин, цисизомер 430 мг соединения, полученного в примере 27, растворяют в 6 мл метанола, добавляют 41 мг гидроокиси натрия в 1 мл воды, и смесь перемешивают при комнатной температуре в течение 24 ч. Смесь подкисляют до рН 3 несколькими каплями раствора гидросульфата калия и экстрагируют зтилацетатом. Экстракт промывают водой, затем высушивают над сульфатом магния. Проводится хроматографирование на колонке с двуокисью кремния, обработанной смесью ДХМ/пентан (80/20 по объему). Непрореагировавший эфир элюируют смесью ДХМ/AcOEt (70/30 об). Смесь AcOEt/MeOH (80/20 по объему) элюирует целевую кислоту, которую перекристаллизовывают из смеси ДХМ/изопропиловый эфир. Т. пл. 232-234 С a D 2 6 =-254 С (с = 0,3, хлороформ) Примеры 29 и 29а. 2-((2ё)-2-карбамоилпирролидинкарбонил)-5-хлор-3-(2-хпорфенил)-1-(3,4-диметоксифенилсульфонип)-3-гидроксииндолин, (цисизомер' два соединения) 230 мг соединения, 18 27238 полученного в примере 28, растворяют в 5 мл ДХМ, добавляют 50 мг ДИПЭА и затем 165 мг БОФ, и смесь оставляют при комнатной температуре на 5 мин. Смесь охлаждают на ледяной бане и через нее пропускают ток газообразного аммиака в течение 1 мин, а спустя 15 мин еще в течение 1 мин. Добавляют воду, а затем большой объем этилацетата - для получения двух фаз. Органический раствор промывают раствором карбоната натрия, водой, раствором гидросульфата калия, водой, а затем соленой водой. После сушки остаток подвергают хроматографированию на двуокиси кремния с элюированием смесью ДХМ/метанол (93/7 по объему). Полученный продукт растирают в порошок в смеси ДХМ/изопропиловый эфир/гексан. Он содержит 1/3 моль изопропилового эфира. осо26 =-189"С (с =0,23, хлороформ) Соединение примера 29 может быть получено с использованием другой методики. сю 25 =-196° (с = 0,351, хлороформ) Анализ спектра ЯМР обнаруживает прис>тствие одного моля метанола в моле продукта. Перекристаллизация продукта из этанола дает возможность удалить растворитель из кристаллов. Т. пл 154-162 X 25 CCD = -204 (с = 0,3, хлороформ) 25 ао =-131" (с = 0,27, хлороформ/метанол, 8/2 по объему) Это соединение является идентичным, исключая растворитель, соединению, полученному согласно первой методике данного примера. Соединение, которое кристаллизуется на этапе В) выше, названное циссоединение 1, перекристалл изовывают из метанола. Т.пл.190 С CCD = +115° (с = 0,3, хлороформ) Пример 30. 5-хлор-3-(2-хлорфенил)-1-(3,4-диметоксифенилсульфонил)-3-гидрокси-2-[(23)(2-гидрокси метил) пирролидинкарбонил] индолин, цисизомеры. A) 2',5-дихлор-[Ы-(3,4-диметоксифенилсульфонил)-ІЧ((2-гидроксиметил)пирролидинкарбонилметил)]-2-аминобензофенон. Это соединение получают взаимодействием (І-)-пролинола с кислотой, полученной в примерах 10 и 11, этап А согласно следующей стандартной методике. B) 5-хлор-3-(2-хпорфенил)-1 -(3,4-диметоксифенилсульфонил)-3-гидрокси-2-((23)(2-гидроксиметил)пирролидинокарбонил] индолин, цисизомер. 1,5 г соединения предыдущего этапа циклизуют в присутствии 380 мг ДБУ в 2 мл ДХМ. После выдерживания при комнатной температуре в течение 3 дней добавляют 1 мл ДХМ, и затем смесь нагревают в течение ночи при 40 °С. При применении ТСХ на двуокиси кремния (элюант этилацетат) обнаруживается образование трех соединений, находящихся в наибольшем количестве. Наименее полярная фракция элюируется при хроматографировании на двуокиси кремния с использованием смеси ДХМ/ этилацетат от 60/40 до 80/20 по объему. Затем осуществляют хроматографирование на окиси алюминия с элюированием ДХМ/метанол (99/1 по объему) Полученная фракция является гомогенной по данным ТСХ. Продукт перекристаллизовывают три раза из смеси ДХМ/изопропиловый эфир. Целевой продукт получают с использованием ВЭЖХ с чистотою более чем 99%. m = 155 мг Т. пл. 194-197 °С ао 2 5 =-195D (с = 0,2, хлороформ) Синтез с (D) - Пролиновыми фракциями Пример 31. 5-хлор-3-(2-хлорфенил)-1-(3,4-диметоксифенилсульфонил)-3-гидрокси-2-х(2К)(2-метоксикарбонил)пирролидинкарбонил] индолин, цисизомер. А) 2",5-Дихлор-[М-(3,4-диметоксифенилсульфонил)-Ы((2Р)(2-метоксикарбонил)пирропидинокарбонилметил)]-2-аминобензофенон. Это соединение получают из кислоты, приготовленной в примерах 10 и 11, этап А (3 г), к которой добавляют 1,2 г метил р))-лролината и 2,8 г БОФ в 10 мл ДХМ в присутствии 1,15 г триэтиламина Смесь оставляют на 1 ч при комнатной температуре и затем разбавляют ДХМ, органическую A) 2\5-дихлор-[М-(3,4-диметоксифенилсульфонил)-Ы-((25)-2-карбамоилпирролидинкарбонилметил)]2-аминобензофенон 33,9 г кислоты, полученной в примере 10-11, этап А, растворяют в 300 мл хлороформа. Добавляют 15 г ти он и л хлорида, и смесь в течение 1,5 ч выдерживают при рефлюксе. Смесь выпаривают до сухого состояния, затем остаток растворяют в ДХМ, доводят до 0 "С и к ней добавляют 10,5 г хлоргидрата (L) - пролинамида, а затем 18 г ДИПЭА в 20 мл ДХМ - последнее добавляют медленно с тем, чтобы температура реакционной смеси не превысила 3 °С. После выдерживания в течение ночи при комнатной температуре реакционную смесь промывают бикарбонатом натрия (дважды), а затем -гидросульфатом калия (дважды), реакционную смесь сушат и концентрируют. Полученный неочищенный продукт растворяют в минимальном количестве ДХМ и по каплям добавляют к иэопропиловому эфиру (1,2 л) при перемешивании. После перемешивания в течение 2 ч полученный осадок фильтруют и затем высушивают в вакууме при 60 °С в течение 6 ч Получают 42 г продукта. CCDZS =-40 8° (с =1,007, хлороформ) B) 2-((25)2-карбамоилпирролидикокарбонил)5-хлор-3-(2-хлорфенил)-1-(3,4-диметоксифенилсульфонил)-3-гидроксииндолин), (цисизомеры: 2 соединения) 5 г продукта, приготовленного на предшествующей стадии, растворяют в 50 мл метанола. Раствор охлаждают до -10 "С, добавляют 1,35 г ДБУ, и смесь выдерживают в течение 60 ч при -10°С. Соединение кристаллизуется, его отфильтровывают (циссоединение 1). Кристаллизационные маточные растворы нейтрализуют КНЭСч, и смесь выпаривают до сухого состояния Ее растворяют в еоде, дважды экстрагируют ДХМ, а экстракт сушат и концентрируют Полученный неочищенный продукт хроматографируют на двуокиси кремния с использованием в качестве элюента смеси этилацетата/ДХМ (28/72 по объему). Полученную смесь в горячем виде растворяют в минимальном количестве метанола, нерастворившееся вещество отфильтровывают, жидкости затем выдерживают в течение ночи при -4° С, и циссоединение 2 кристаллизуется гл=25г 19 27238 лацетат (90/10, по объему) и перекристаллизацией из смеси ДХМ/изопропиловый эфир. Т пл. 158-160 С В)Ы-Метил-Ы-метоксикарбонилметил-5-хлор3-(2-хлорфенил)- 1- (4-этоксифенилсульфонил)3-гидрокси-2-индолинкарбоксамид, трансизомер 1 г соединения, полученного на предыдущей стадии, растворяют в 4 мл ДХМ и обрабатывают в течение 90 мин при комнатной температуре с помощью 312 мг ТБД. Добавляют раствор гидросульфата калия, ДХМ испаряют в вакууме, смесь экстрагируют этилацетатом, а экстракт промывают и сушат над сульфатом магния. Целевой продукт получают хроматографией на силикагеле при элюировании ДХМ/этил ацетат (90/10 по объему). m = 590 мг Т. пл. 168-171°С после перекристаллизации из смеси ДХМ/ гексан С)М-метил-М-метоксикарбонилметил-5-хпор-3(2-хлорфенил) - 1 - (4-этоксифенипсульфонил)-3-гидрокси-2-индолинкарбоксамид, цисизомер. 2,96 г соединения, полученного на этапе А суспендируют в 20 мл метанола и 10 мл ТГФ. добавляется 100 мг метилата натрия, после чего смесь оставляют на 7 ч в холодильнике. Добавляют воду, смесь нейтрализуют раствором гидросульфата калия, и часть метанола выпаривают в вакууме. После экстракции этилацетатом остаток хроматографируют на окиси алюминия и затем элюируют смесью ДХМ/этил ацетат (80/20, по объему). Получают 850 мг целевого продукта, который перекристаллизовывают из смеси ДХМ/изопропиловый эфир. фазу промывают карбонатом натрия и гидросульфатом калия, сушат и концентрируют. Неочищенный продукт хроматографируют на двуокиси кремния при элюировании смесью ДХМ/этил ацетат (95/5 по объему). Полученный продукт затем перекристаллизовывают из смеси ДХМ/изопропиповый эфир. Т. пл. 140-141 °С ао25= +28,5 (с = 0.27 хлороформ) В) 5-хлор-3-(2-хлорфенил)-1-(3,4-диметоксифенилсульфонил)-3-гидрокси-2-[(2Р)(2-метоксикарбонил)пирролидинокарбонил] индолин, цисизомер. 1,5 г полученного на предыдущей стадии соединения кипятят в течение ночи с обратным холодильником в 5 мл ДХМ в присутствии 360 мг ДБУ Смесь хроматографируют на окиси алюминия. Смесь ДХМ/этил ацетат (95/5, по объему) элюирует наименее полярную фракцию (т = 300 мг), которую дважды перекристаллизовывают из смеси ДХМ/изопропиловый эфир. Т. пп. 186-188 °С CCD25 = +245° (с = 0,4, хлороформ) Это соединение представляет собой энантиомер, полученный из (DJ-пролина, описанного в примере 27. Примеры 32 и 32а. М-метил-Ы-метоксикарбонилметил-б-хлор-З(2-хлорфенил)-1-(4-этоксифенилсульфонил)-3-гидрокси-2-индолин-карбоксамид, трансизомер и цисизомер. А) 2',5-Дихлор-[М-(4-этоксифенилсульфонил)М-(М-метил-№'-метоксикарбонилметил)карбам,оипметил]-2-аминобензофенон. 5,7 г 2',5-дихлор-4-этокси-2-фенилсульфонамидобензофенона растворяют в атмосфере аргона в 40 мл ДМФ и добавляют 400 мг 80%-го гидрида натрия при 0°С, через 15 мин добавляют 4,3 г метил-Ы-{бромацетил)саркосината. Спустя 48 ч экстрагируют обычным способом и затем очищают хроматографированием на двуокиси кремния при элюировании смесью ДХМ/эти ЯМР-спектр дается на фиг. 6. При использовании методов, аналогичных описанным выше, были получены промежуточные соединения (VI) для синтеза соединений (I), соответствующих изобретению. Полученные соединения (VI) описываются в табл.1. Таблица 1 R'i R"s Br СНзО-3,4 F Т. пл. "С или ИК растворитель R"a —N-CH2CO2CH2C6H5 20 82-83 ДХМ/эфир изо 27238 /R. R's R'i —N R'2 Т. пл. °С или ИК растворитель V CH1 3 —N-CH2CH2CO2CH3 164-166 ДХМ/эфир изо Cl СНзО-3,4 Cl Cl СНзО-3,4 Cl Cl СНзО-3,4 Cl Cl СНзО-2,4 Cl CH3O СНз-3,4 Cl Cl СНзО-3,4 Cl Br СНзО-3,4 Cl Cl СНзО-3,4 Cl Cl СНзО-3,4 Cl Pr 1 —N-CH2CO2CH3 135 эфир изо/ДХМ/АсОН Cl СНзО-3,4 Cl Pr 1 — N-CH 2 CH 2 CO 2 CH 3 113 ДХМ/эфир изо Cl СНзО-3,4 Cl Cl СНзО-3,4 Cl Cl СНзО-3,4 Cl CH3 ft —N-CH2CH2N—Et Et —N-CH2CH2CO2CH3 — N N—CO 2 CH 2 C 6 H 5 Et — N-CH 2 CH 2 CO 2 CH 3 iPentyl —N-CH2CH2CO2CH3 Et I — N-CH 2 CH 2 CO 2 CH 3 —N S Et ИК/1/ /ДХМ/ /ДХМ/ N ^-со2сн2с6н5 1735 см'1 1660-1680 см' ^>—NH2—CO—tBu -
ДивитисяДодаткова інформація
Назва патенту англійськоюIndoline derivatives, their pharmaceutical acceptable salts which are antagonists of vasopressin vi-receptors, method for their synthesis, intermediate compounds and pharmaceutical composition
Автори англійськоюWagnon Jean, Plouzane Claude, Serradeil-Legal Claudine, Nisato Dino, Tonnerre Bernard
Назва патенту російськоюИндолиновые производные, а также их фармацевтически приемлемые соли, являющиеся антагонистами вазопресиновых v1-рецепторов, способ их получения, промежуточные продукты и фармацевтическая композиция
Автори російськоюЖан, Плузан Клод, Серадей-Легаль Клодин, Нисато Дино, Тоннер Бернар
МПК / Мітки
МПК: A61K 31/495, A61P 9/00, C07D 403/06, A61P 7/02, A61K 31/445, C07D 417/06, A61P 9/08, A61K 31/403, C07D 401/12, A61K 31/40, A61P 25/04, A61P 9/10, A61P 25/18, A61P 9/12, C07D 401/06, A61P 13/02, C07D 209/42, A61K 31/55, C07C 311/08, A61P 15/00, A61P 1/04, C07C 317/30, A61K 31/535, A61K 31/425, A61K 31/4427, A61K 31/54, A61K 31/404
Мітки: солі, також, v1-рецепторів, вазопресинових, індолінові, продукти, похідні, композиція, одержання, прийнятні, антагоністами, проміжні, фармацевтична, фармацевтично, спосіб
Код посилання
<a href="https://ua.patents.su/122-27238-indolinovi-pokhidni-a-takozh-kh-farmacevtichno-prijjnyatni-soli-shho-eh-antagonistami-vazopresinovikh-v1-receptoriv-sposib-kh-oderzhannya-promizhni-produkti-i-farmacevtichna-kompoz.html" target="_blank" rel="follow" title="База патентів України">Індолінові похідні, а також їх фармацевтично прийнятні солі, що є антагоністами вазопресинових v1-рецепторів, спосіб їх одержання, проміжні продукти і фармацевтична композиція</a>
Попередній патент: Клейова композиція
Наступний патент: Одинарний основов’язаний прокладний матеріал
Випадковий патент: Спосіб лікування дисбактеріозу кишечнику у дітей раннього віку