Спосіб одержання бензонорборненів
Номер патенту: 101072
Опубліковано: 25.02.2013
Автори: Антельманн Бьйорн, Жіордано Фанні, Грібков Деніс, Вальтер Харальд, де Месмакер Ален
Формула / Реферат
1. Спосіб одержання 9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метанонафталін-5-іламіну формули І
 , (I)
, (I)
який включає
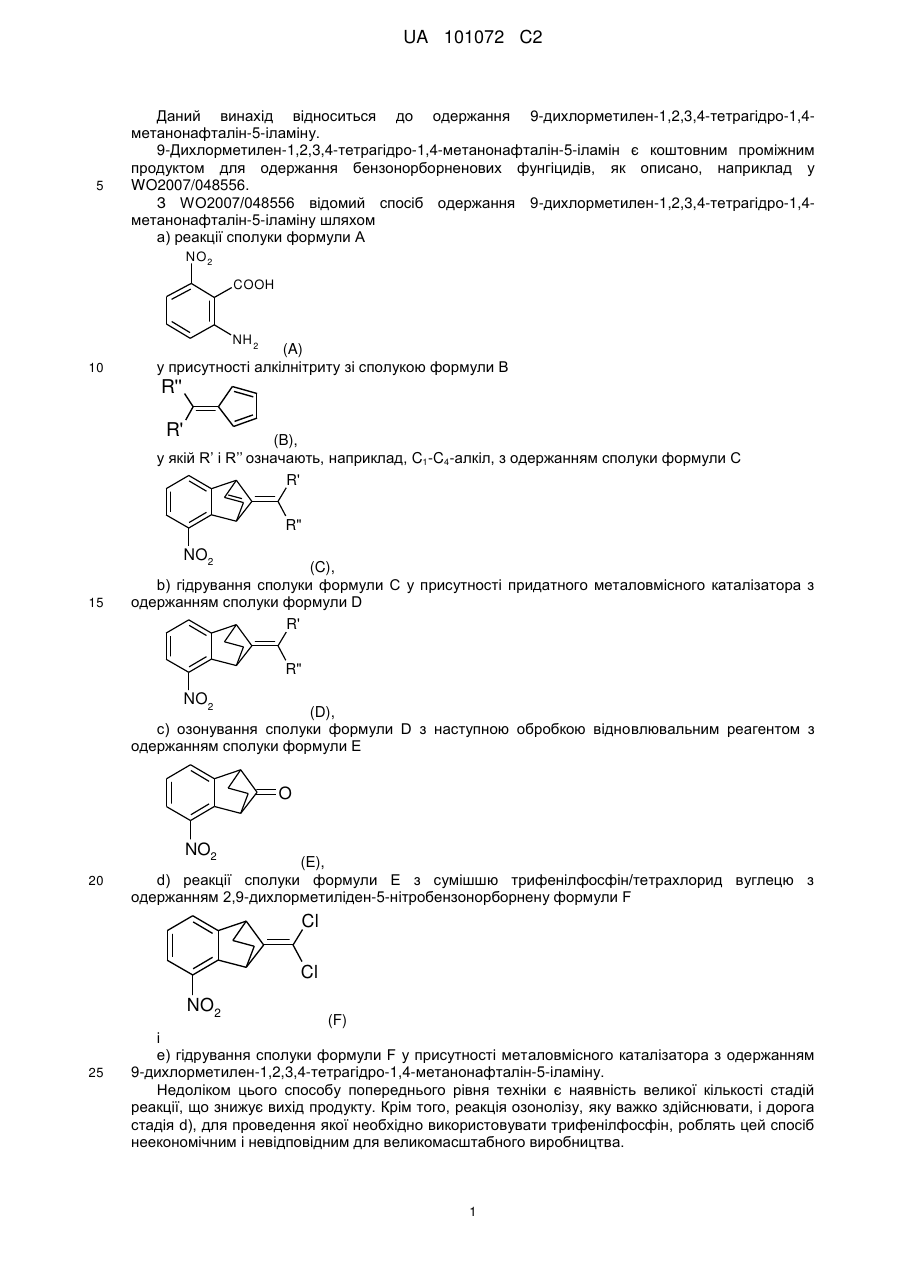
a) реакцію циклопентадієну з СХСl3, де X означає хлор або бром, у присутності радикального ініціатора з одержанням сполуки формули II
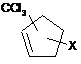 , (II)
, (II)
у якій X означає хлор або бром,
або аа) реакцію циклопентадієну з СХСl3, де X означає хлор, у присутності металовмісного каталізатора з одержанням сполуки формули II
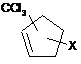 , (II)
, (II)
у якій X означає хлор,
b) реакцію сполуки формули II з основою у присутності придатного розчинника з одержанням сполуки формули III
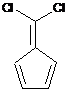 , (III)
, (III)
c) і перетворення сполуки формули III у присутності 1,2-дигідро-6-нітробензолу у сполуку формули IV
 (IV)
(IV)
і
d) гідрування сполуки формули IV за допомогою джерела водню у присутності металовмісного каталізатора.
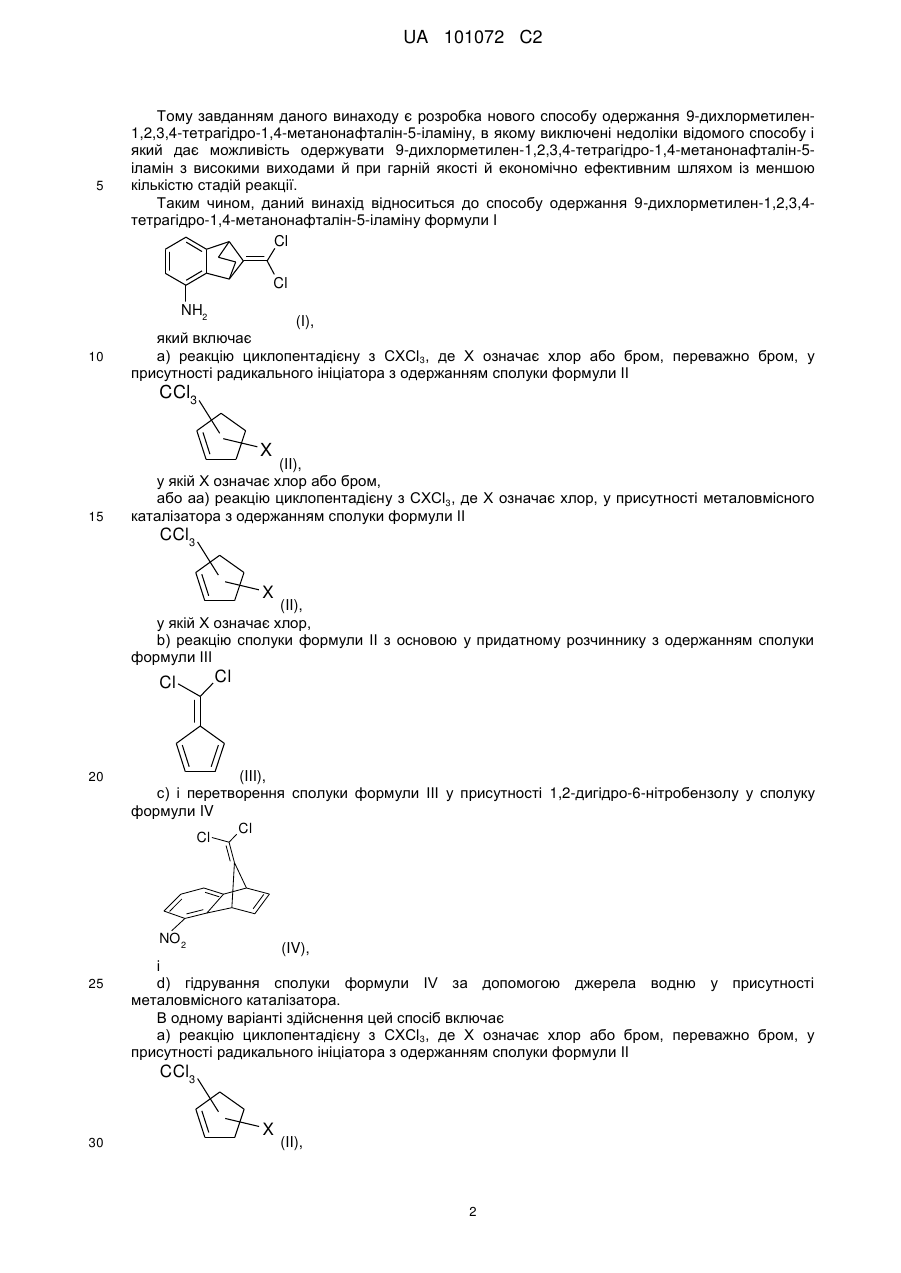
2. Спосіб за п. 1, який включає а) реакцію циклопентадієну з СХСl3,де X означає хлор або бром, у присутності радикального ініціатора з одержанням сполуки формули II
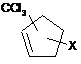 , (II)
, (II)
у якій X означає хлор або бром.
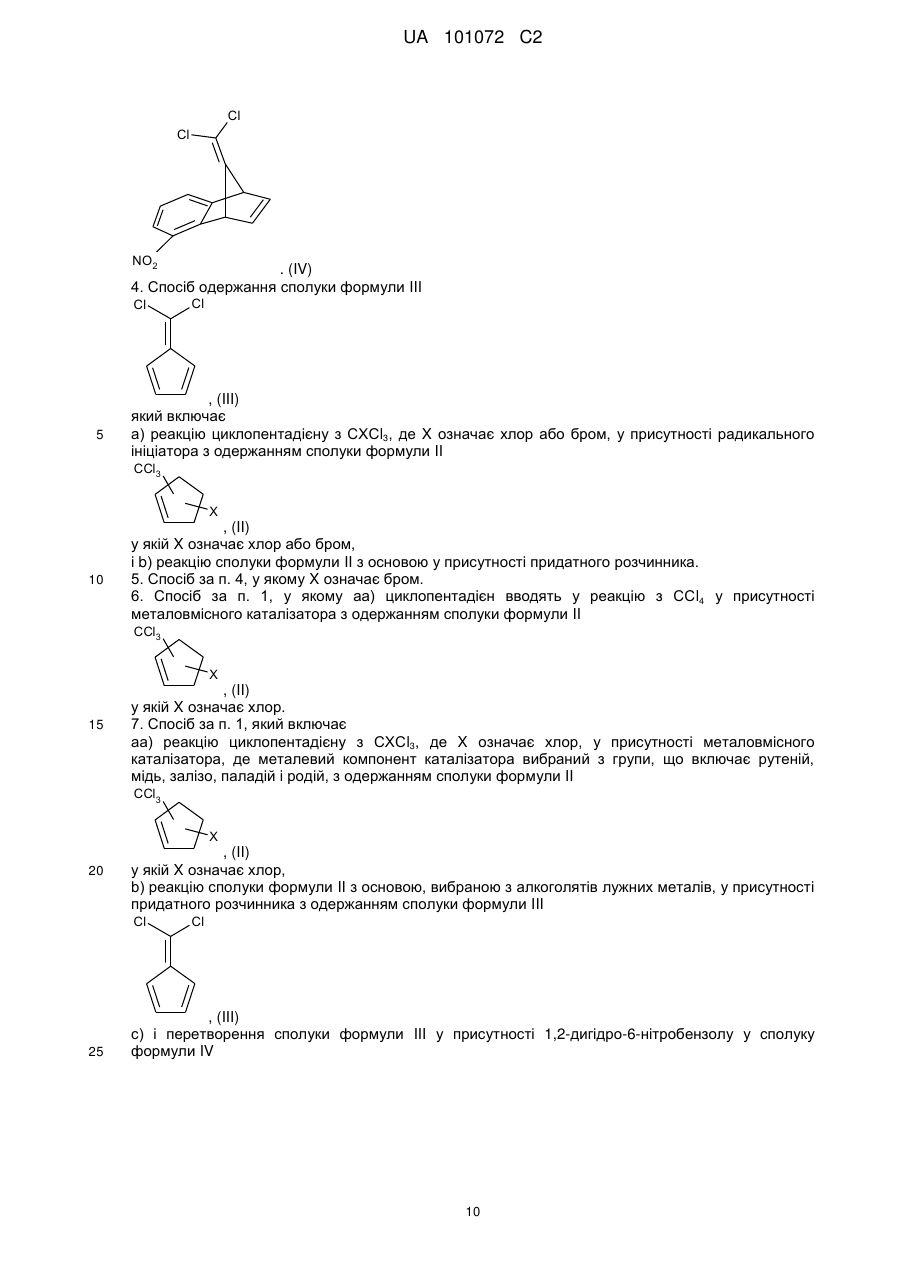
3. Сполука формули IV
 . (IV)
. (IV)
4. Спосіб одержання сполуки формули III
 , (III)
, (III)
який включає
а) реакцію циклопентадієну з СХСl3, де X означає хлор або бром, у присутності радикального ініціатора з одержанням сполуки формули II
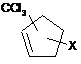 , (II)
, (II)
у якій X означає хлор або бром,
і b) реакцію сполуки формули II з основою у присутності придатного розчинника.
5. Спосіб за п. 4, у якому X означає бром.
6. Спосіб за п. 1, у якому аа) циклопентадієн вводять у реакцію з ССl4 у присутності металовмісного каталізатора з одержанням сполуки формули II
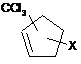 , (II)
, (II)
у якій X означає хлор.
7. Спосіб за п. 1, який включає
аа) реакцію циклопентадієну з СХСl3, де X означає хлор, у присутності металовмісного каталізатора, де металевий компонент каталізатора вибраний з групи, що включає рутеній, мідь, залізо, паладій і родій, з одержанням сполуки формули II
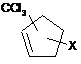 , (II)
, (II)
у якій X означає хлор,
b) реакцію сполуки формули II з основою, вибраною з алкоголятів лужних металів, у присутності придатного розчинника з одержанням сполуки формули III
 , (III)
, (III)
c) і перетворення сполуки формули III у присутності 1,2-дигідро-6-нітробензолу у сполуку формули IV
 (IV)
(IV)
і
d) гідрування сполуки формули IV за допомогою джерела водню у присутності металовмісного каталізатора.
Текст
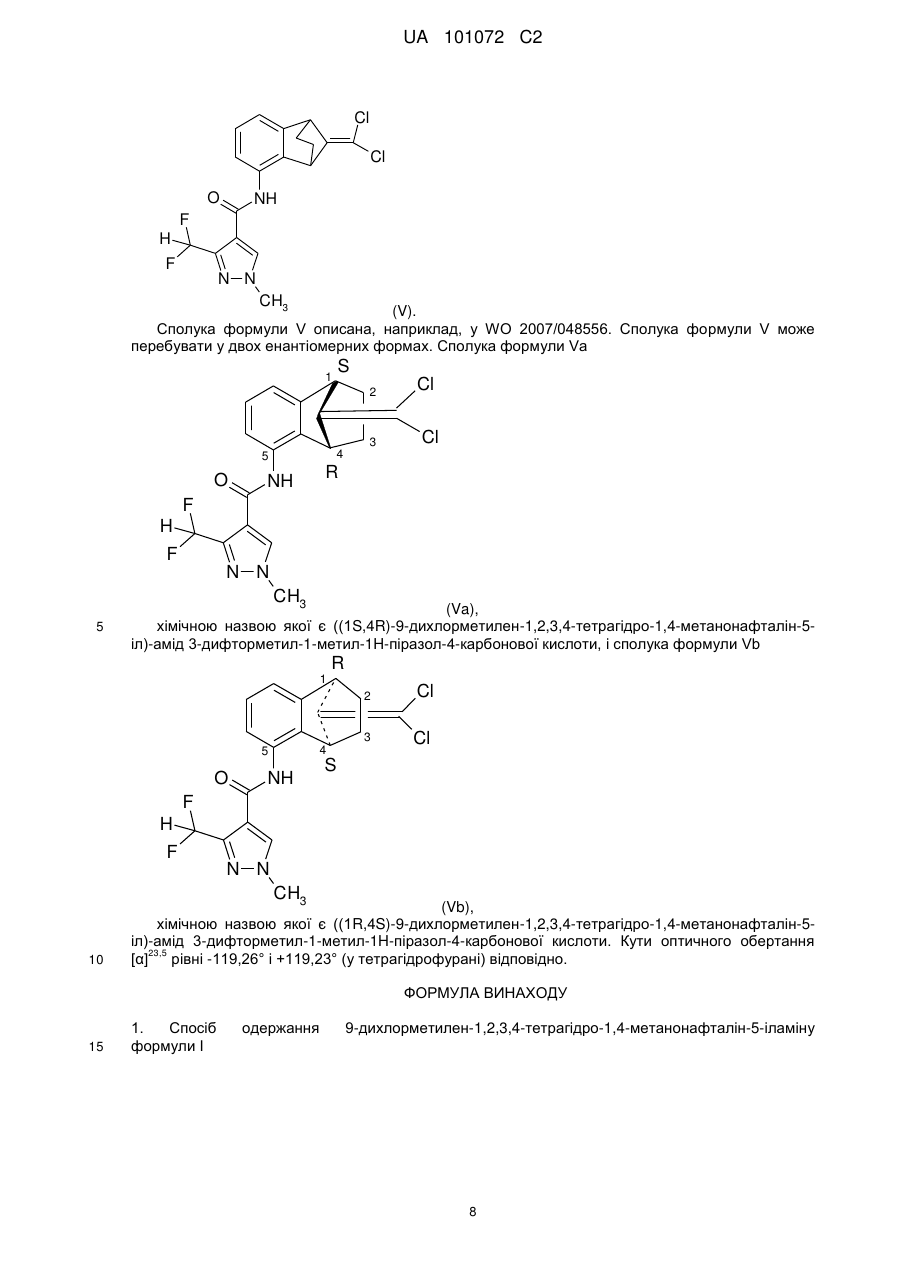
Реферат: У заявці описаний спосіб одержання 9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метанонафталін-5іламіну, що включає а) реакцію циклопентадієну у присутності радикального ініціатора й СХСl3, де X означає хлор або бром, з одержанням сполуки формули II, або аа) реакцію циклопентадієну з СХСl3, де X означає хлор, у присутності металовмісного каталізатора з одержанням сполуки формули II, у якій X означає хлор, b) реакцію сполуки формули II з основою у присутності придатного розчинника з одержанням сполуки формули III, с) перетворення сполуки формули III у присутності 1,2-дигідро-6-нітробензолу у сполуку формули IV, і d) гідрування сполуки формули IV у присутності металовмісного каталізатора. UA 101072 C2 (12) UA 101072 C2 Cl Cl Cl Cl CCl3 X (II) (III) NO2 (IV) UA 101072 C2 5 Даний винахід відноситься до одержання 9-дихлорметилен-1,2,3,4-тетрагідро-1,4метанонафталін-5-іламіну. 9-Дихлорметилен-1,2,3,4-тетрагідро-1,4-метанонафталін-5-іламін є коштовним проміжним продуктом для одержання бензонорборненових фунгіцидів, як описано, наприклад у WO2007/048556. З WO2007/048556 відомий спосіб одержання 9-дихлорметилен-1,2,3,4-тетрагідро-1,4метанонафталін-5-іламіну шляхом a) реакції сполуки формули A NO2 COOH NH 2 10 (A) у присутності алкілнітриту зі сполукою формули B R'' R' (B), у якій R’ і R’’ означають, наприклад, C1-C4-алкіл, з одержанням сполуки формули C R' R" NO2 15 (C), b) гідрування сполуки формули C у присутності придатного металовмісного каталізатора з одержанням сполуки формули D R' R" NO2 (D), c) озонування сполуки формули D з наступною обробкою відновлювальним реагентом з одержанням сполуки формули E O NO2 20 (E), d) реакції сполуки формули E з сумішшю трифенілфосфін/тетрахлорид вуглецю з одержанням 2,9-дихлорметиліден-5-нітробензонорборнену формули F Cl Cl NO2 25 (F) і e) гідрування сполуки формули F у присутності металовмісного каталізатора з одержанням 9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метанонафталін-5-іламіну. Недоліком цього способу попереднього рівня техніки є наявність великої кількості стадій реакції, що знижує вихід продукту. Крім того, реакція озонолізу, яку важко здійснювати, і дорога стадія d), для проведення якої необхідно використовувати трифенілфосфін, роблять цей спосіб неекономічним і невідповідним для великомасштабного виробництва. 1 UA 101072 C2 5 Тому завданням даного винаходу є розробка нового способу одержання 9-дихлорметилен1,2,3,4-тетрагідро-1,4-метанонафталін-5-іламіну, в якому виключені недоліки відомого способу і який дає можливість одержувати 9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метанонафталін-5іламін з високими виходами й при гарній якості й економічно ефективним шляхом із меншою кількістю стадій реакції. Таким чином, даний винахід відноситься до способу одержання 9-дихлорметилен-1,2,3,4тетрагідро-1,4-метанонафталін-5-іламіну формули I Cl Cl NH2 10 (I), який включає a) реакцію циклопентадієну з CXCl3, де X означає хлор або бром, переважно бром, у присутності радикального ініціатора з одержанням сполуки формули II CCl3 X 15 (II), у якій X означає хлор або бром, або aa) реакцію циклопентадієну з CXCl3, де X означає хлор, у присутності металовмісного каталізатора з одержанням сполуки формули II CCl3 X (II), у якій X означає хлор, b) реакцію сполуки формули II з основою у придатному розчиннику з одержанням сполуки формули III Cl 20 Cl (III), c) і перетворення сполуки формули III у присутності 1,2-дигідро-6-нітробензолу у сполуку формули IV Cl Cl NO2 25 (IV), і d) гідрування сполуки формули IV за допомогою джерела водню у присутності металовмісного каталізатора. В одному варіанті здійснення цей спосіб включає a) реакцію циклопентадієну з CXCl3, де X означає хлор або бром, переважно бром, у присутності радикального ініціатора з одержанням сполуки формули II CCl3 30 X (II), 2 UA 101072 C2 у якій X означає хлор або бром. Стадії реакції a) і aa): Сполуки формули II можуть перебувати у наступних ізомерних формах або у вигляді їх сумішей: X X X 5 10 15 20 Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl X X X Cl Cl Cl (IIe) і Cl Cl Cl (IIf), (IIa), (IIb), (IIc), (IId), в яких X означає хлор або бром. Продукт, отриманий на стадії реакції a) і aa), можна використовувати без обробки на наступній стадії реакції b). Виділення або очищення певного ізомеру або суміші ізомерів формули II не є необхідними. Сполука формули II та її ізомери й сполука формули IV є новими й спеціально розроблені для способу, запропонованого у даному винаході, і тому утворюють ще один об'єкт даного винаходу. У принципі для проведення стадії реакції a) можна використовувати велику кількість радикальних ініціаторів наступних класів: органічні пероксиди (наприклад, метилетилкетонпероксид, бензоїлпероксид), органічні азосполуки, солі й комплекси металів (Cu, Ru). Кращі радикальні ініціатори вибрані з групи, що включає азобісізобутиронітрил, дибензоїлпероксид і біс(трет-бутилциклогексил)пероксидикарбонат. Особливо кращим є азобісізобутиронітрил. Стадію реакції a) переважно проводять при підвищених температурах, переважно при температурі від 20 до 100°C, переважно від 60 до 100°C, найбільше переважно від 80 до 90°C. Використання бромтрихлорметану є кращим, особливо при умовах ініціювання за допомогою пероксиду або азосполук. В особливо кращій методиці проведення стадії реакції aa) циклопентадієн вводять у реакцію з CCl4 у присутності металовмісного каталізатора з одержанням сполуки формули II CCl3 X 25 30 35 40 45 50 (II), у якій X означає хлор. Для проведення стадії aa) присутність радикального ініціатора не є необхідною, але може бути корисною для зменшення вмісту каталізатора (використання меншої кількості каталізатора). Придатними металевими компонентами каталізатора є, наприклад вибрані з групи, що включає рутеній, мідь, залізо, палладій і родій. Кращі каталізатори містять комплекси рутенію(II) або міді(I). Особливо кращі каталізатори вибрані з групи, що включає Ru(PPh 3)3Cl2, Ru(кумол)PPh3Cl2, Ru(Cp)PPh3Cl2, каталізатор Граббса I (бензиліден-біс(трициклогексилфосфін) дихлоррутеній) і CuCl у комбінації з аміном-лігандом, особливо з діаміновим або триаміновим лігандом. Каталізатор Граббса I, CuCl/тетраметилетилендіамін (ТМЕДА) або пентаметилдіетилентриамін є найбільше кращими каталізаторами. Стадію реакції aa) можна проводити у присутності інертного розчинника, переважно у відсутності розчинника, якщо використовують Ru-каталізатор. Стадію реакції aa) переважно проводять при підвищених температурах, зокрема при температурі від 20 до 100°C, переважно від 60 до 100°C, найбільше переважно від 60 до 80°C. Продукт, отриманий на стадії реакції aa), являє собою суміш трьох можливих ізомерів. Виділення або очищення певного ізомеру або суміші ізомерів не є необхідними. В особливо кращому варіанті здійснення стадію реакції aa) можна успішно провести шляхом нагрівання суміші циклопентадієну й 1,5-3 екв., переважно 2 екв., тетрахлориду вуглецю в ацетонітрилі у присутності 0,5-2 мол. %, переважно 1 мол. %, що містить мідь(I) каталізатора, переважно CuCl, і 1-4 мол. %, переважно 2 мол. %, тетраметилетан-1,2-діаміну (ТМЕДА) і після перегонки одержати виділений продукт із виходом 70-80%. Додавання до реакційної суміші каталітичної кількості (звичайно 1 мол.%) радикального ініціатора, зазначеного вище, особливо N,N-азобісізобутиронітрилу, може зменшити вміст каталізатора (використання меншої кількості каталізатора). Стадія реакції aa) має додаткові переваги. Використання CCl4 є менше дорогим, продукт приєднання з тетрахлоридом вуглецю (CTCM-циклопентен) є набагато більше стійким, ніж бромовмісне похідне (BTCM-циклопентен), реакція набагато менш екзотермічна й тому є більше 3 UA 101072 C2 5 10 15 20 25 30 придатною для великомасштабного виробництва, і на наступній стадії не утворюється броміданіон. На стадіях реакції a) і aa) CCl3Br або CCl4 використовують у надлишку стосовно циклопентадієну, переважно 1,5-5 екв., більше переважно 2-3 екв. CCl3Br або CCl4 у перерахуванні на 1 екв. циклопентадієну. Стадія реакції b): Основами, кращими для використання на стадії реакції b), є алкоголяти лужних металів, наприклад, трет-бутоксид натрію й трет-бутоксид калію, або аміди металів, такі як NaNH2 або діізопропіламід літію. За винятком кетонів і складних ефірів можна використовувати всі інертні розчинники. Розчинники, що підходять для використання на стадії реакції b), вибрані з групи, що включає метил-трет-бутиловий ефір (МТБЕ), метилциклогексан (МЦГ) або їхня суміш, тетрагідрофуран (ТГФ), диглім і толуол. Додатковим розчинником, що підходить для використання на стадії реакції b), є хлорбензол. Стадію реакції b) переважно проводять при температурі у діапазоні від -20 до +20°C, переважно при температурі від -10 до 10°C, найбільше переважно від -5 до 5°C. У кращому варіанті здійснення даного винаходу сполуку формули III (її розчин) використовують безпосередньо на наступній стадії без виділення. Сполука формули III є коштовним проміжним продуктом для одержання сполуки формули I. Сполука формули III відома з наступних публікацій (a) Moberg, C.; Nilsson, M. J. Organomet. Chem. 1973, 49, 243-248. (b) Siemionko, R. K.; Berson, J. A. J. Am. Chem. Soc. 1980, 102, 3870-3882. Однак методика одержання, описана у зазначеній публікації, є дуже несприятливою, оскільки: 1) Методику, у тому вигляді, як вона описана, неможливо відтворити (одержували сполуку з низьким виходом). 2) Використовують дуже дорогу й токсичну вихідну речовину (нікелоцен). 3) Утворюється велика кількість відходів металу (нікельвмісні сполуки). 4) Методику неможливо масштабувати для промислового використання (відсутність великих кількостей нікелоцену, небезпека переробки великих кількостей нікелоцену). На відміну від цього одержання сполуки формули III з циклопентадієну є новим і дуже ефективним способом і тому утворює ще один об'єкт даного винаходу. Тому іншим об'єктом даного винаходу є спосіб одержання сполуки формули III Cl Cl (III), який включає a) реакцію циклопентадієну у присутності радикального ініціатора й CXCl 3, де X означає хлор або бром, переважно бром, з одержанням сполуки формули II CCl3 35 40 X (II), у якій X означає хлор або бром, і b) реакцію сполуки формули II з основою у присутності придатного розчинника. Стадія реакції c) 1,2-Дигідро-6-нітробензол утворюється in situ [наприклад, з 6-нітроантранілової кислоти формули (A), NO2 COOH NH 2 45 (A), так, як це описано у публікаціях L. Paquette et al, J. Amer. Chem. Soc. 99, 3734 (1977) і H. Seidel, Chemische Berichte, 34, 4351 (1901)]. Стадію реакції c) проводять при підвищених температурах, переважно при температурі від 30 до 60°C, найбільше переважно від 30 до 40°C. Стадія реакції d) 4 UA 101072 C2 5 10 Металовмісні каталізатори, кращі для використання у реакції гідрування, вибрані з групи, що включає нікель Ренея, платину, переважно платину на носії, такому як вуглець, палладій, переважно палладій на носії, такому як вуглець, але не обмежуються зазначеною групою. Особливо кращим каталізатором є нікель Ренея. Придатними джерелами водню є водень або гідразин, переважно водень. Стадію реакції d) проводять при температурі у діапазоні від низьких до підвищених температур, переважно при температурі від 0 до 80°C, переважно від 30 до 60°C. Кращий варіант способу, запропонованого у даному винаході, включає aa) реакцію циклопентадієну з CXCl3, де X означає хлор, у присутності металовмісного каталізатора, де металевий компонент каталізатора вибраний з групи, що включає рутеній, мідь, залізо, палладій і родій, з одержанням сполуки формули II CCl3 X 15 (II), у якій X означає хлор, b) реакцію сполуки формули II з основою, вибраною з числа алкоголятів лужних металів, у присутності придатного розчинника з одержанням сполуки формули III Cl Cl (III), c) і перетворення сполуки формули III у присутності 1,2-дигідро-6-нітробензолу у сполуку формули IV Cl Cl NO2 20 (IV), і d) гідрування сполуки формули IV за допомогою джерела водню у присутності металовмісного каталізатора. Приклади одержання: Приклад P1: Одержання сполуки формули IIa: CCl3 25 30 35 Br (IIa) Азобісізобутиронітрил (2,5 г) розчиняли у бромтрихлорметані (250 г). Бромтрихлорметан (650 г) в інертній атмосфері (азот) поміщали у скляний ректор і нагрівали до 85°C. У реактор однією порцією додавали 1/3 розчину азобісізобутиронітрилу (84 г) і вміст реактора повторно нагрівали до 85°C, потім при 85°C протягом 2,5 год одночасно додавали 2/3 розчину, що залишилися азобісізобутиронітрилу (168,5 г) і суміш циклопентадієну (100 г, свіжоперегонений) і метилциклогексану (10 г). Реакційну суміш перемішували при 85°C протягом ще 1 год і потім охолоджували до температури навколишнього середовища. Більшу частину розчинника (бромтрихлорметан) випарювали у вакуумі (60→70°C, 150→50 мбар). До залишку після перегонки додавали метилциклогексан (50 г) і перегонку продовжували (60→70°C, 150→15 мбар). Неочищений продукт (залишок після перегонки) сушили у вакуумі протягом ще 30 хв (70°C, 15 мбар). Одержували 389 г сполуки формули IIa у вигляді коричневого масла, чистота 94%, вихід 92%, суміш регіоізомерів. Приклад P2: Одержання сполуки формули III: 5 UA 101072 C2 Cl 5 10 15 Cl (III). У скляний реактор в інертній атмосфері (азот) поміщали бром(трихлорметил)циклопентен (27,83 г, сполука IIa), метилциклогексан (62 мол), метил-трет-бутиловий ефір (62 мл) і біс(2метоксіетил)овий ефір (диглім, 6,7 г). Суміш охолоджували до -10°C у лазні з сумішшю лід/NaCl. У реактор протягом 10 хв додавали трет-бутоксид натрію (20,3 г) у вигляді твердої речовини, підтримуючи температуру нижче +5°C. Після завершення додавання реакційну суміш перемішували при 0-5°C протягом 2 год. Реакцію зупиняли сумішшю охолодженої льодом води (80 мл) і льоду (40 г) і потім 32% розчином HCl (приблизно 3 мл) значення pH водної фази доводили до ≤2. Водну фазу відокремлювали й органічну фазу сушили при 0°C над безводним карбонатом калію. Карбонат калію відфільтровували й промивали метил-трет-бутиловим ефіром (10 мл). До об'єднаного фільтрату додавали метилетилкетон (10 г), що використовували як внутрішній стандарт, і концентрацію 6,6-дихлорфульвену (сполука формули III) визначали за 1 допомогою спектроскопії H ЯМР (ядерний магнітний резонанс). Вихід 81% [9,7 г 9,9% (приблизно 0,53 M) розчину]. Розчин зберігали у холодильнику й потім використовували на наступній стадії. Приклад P3: Одержання сполуки формули IV: Cl Cl NO2 20 25 30 35 (IV). Холодний розчин 6,6-дихлорфульвену, отриманого на попередній стадії (9% розчин у суміші метил-трет-бутиловий ефір/метилциклогексан = 1:1), поміщали у скляний реактор і швидко нагрівали до 35°C. У реактор додавали трет-пентилнітрит (2,66 г), потім при 35°C протягом 80 хв одночасно додавали трет-пентилнітрит (9,46 г) і розчин 6-нітроантранілової кислоти (11,6 г, 96,6%) у метилетилкетоні (42 мл). Реакційну суміш перемішували при такій же температурі протягом ще 30 хв, і потім всі летучі речовини видаляли у роторному випарнику. Отриманий залишок кристалізували з метанолу (20 мл) при +5°C протягом 15 год. Коричневу кристалічну речовину відфільтровували, промивали холодним метанолом (15 мл) і сушили на повітрі. Вихід 7,10 г (42%, чистота продукту 98%). Приклад P4: Гідрування сполуки формули IV: В автоклав поміщали ТГФ (130 мл), вологий нікель Ренея (2 г) і сполуку формули IV (20 г). Автоклав закривали, вміст починали перемішувати, тричі продували азотом для видалення кисню й потім тричі продували воднем. У реакторі створювали тиск водню, який дорівнює 5 бар. Потім вміст автоклава нагрівали при 40°C, підтримуючи тиск шляхом додавання додаткової кількості водню у міру необхідності. Після припинення споживання водню, звичайно через 3-4 год, реакційну суміш витримували при 40°C протягом ще 30 хв. Потім тиск скидали й вміст охолоджували до температури навколишнього середовища. Розчинник видаляли у вакуумі, і отримане масло кристалізувалося при витримуванні, і одержували 18 г сполуки формули I від жовтуватого до коричнюватого кольору (96%, чистота продукту 94%). Приклад P5: Одержання CTCM-циклопентену формули IIa з використанням каталізатора Граббса I: CCl3 Cl 40 (IIa) Суміш циклопентадієну (2,0 г), азобісізобутиронітрилу (0,5 г), бензиліденбіс(трициклогексилфосфін)дихлоррутенію (каталізатор Граббса першого покоління, 12,2 мг, 0,05 мол. %) і тетрахлориду вуглецю (14 г) нагрівали в інертній атмосфері (аргон) при 75°C. За ходом перетворення стежили за допомогою ГХ (газова хроматографія). Через 4 год реакція завершувалася й одержували хлор(трихлорметил)циклопентен у вигляді суміші трьох ізомерів з 6 UA 101072 C2 виходом 85% (ГХ, як стандарт використовували додекан). Приклад P6: Одержання CTCM-циклопентену формули IIa з використанням каталізатора CuCl/ТМЕДА. CCl3 Cl 5 10 15 20 (IIa) Розчин каталізатора: Суміш хлориду міді(I) (0,99 г), тетраметилетилендіаміну (ТМЕДА, 2,32 г) і ацетонітрилу (100 мл) нагрівали в атмосфері азоту при 75°C протягом 25 хв і потім охолоджували до кімнатної температури. Розчин циклопентадієну: Свіжовиготовлений циклопентадієн (66,0 г) розчиняли у тетрахлориді вуглецю (307 г). Реакція: У скляний реактор в атмосфері азоту поміщали ацетонітрил (80 г) і 40% розчину каталізатора. Суміш нагрівали при 75°C. Потім у реактор однією порцією додавали 40% розчину циклопентадієну, потім одночасно додавали кількості, що залишилися, розчину каталізатора й розчину циклопентадієну, підтримуючи температуру у діапазоні від 60 до 70°C. Розчин циклопентадієну додавали протягом 1 год і розчин каталізатора додавали протягом 1,5 год. Реакційну суміш перемішували при 70°C протягом ще 1 год, охолоджували до температури навколишнього середовища й фільтрували. Розчинник видаляли у роторному випарнику й залишок фракціонували за допомогою перегонки у вакуумі (40-45°C, 0,1 мбар). Вихід 170 г (75%, чистота 97-98%), суміш трьох регіоізомерів. Приклад P7: Одержання сполуки формули III: Cl 25 30 35 40 Cl (III). Трет-бутоксид натрію (69,2 г) перемішували з хлорбензолом (175 мл) при кімнатній температурі протягом 30 хв і одержували тонкодисперсну суспензію. У скляний реактор в інертній атмосфері (азот) поміщали хлор(трихлорметил)циклопентен (69,1 г), хлорбензол (275 мол) і біс(2-метоксіетил)овий ефір (диглім, 21,1 г). Суміш охолоджували до -20°C і у реактор протягом 35 хв порціями додавали суспензію трет-бутоксиду натрію, підтримуючи температуру нижче +3°C. Після завершення додавання реакційну суміш перемішували при -5°C протягом 3 год. Реакцію зупиняли сумішшю 0,5 M водного розчину HCl (300 мл) і льоду (200 г). Значення pH водної фази підтримували рівним ≤ 2. Водну фазу відокремлювали й органічну фазу двічі екстрагували такою ж сумішшю води з льодом (необхідно для повного видалення трет-бутанолу 1 й дигліму). Концентрацію 6,6-дихлорфульвену визначали за допомогою спектроскопії H ЯМР з використанням хлорбензолу (розчинник) як внутрішній стандарт. Вихід 75% [510 г 6,8% (приблизно 0,52 M) розчину]. Розчин зберігали у морозильнику або у твердому діоксиді вуглецю й потім використовували на наступній стадії. Примітка: Вихід безпосередньо після зупинки реакції (без додаткових екстракцій) становив 85%. Частина розчину була загублена при поділі фаз. Кращим бензонорборненовим фунгіцидом, який можна успішно одержати з використанням способу, запропонованого у даному винаході, є (9-дихлорметилен-1,2,3,4-тетрагідро-1,4метанонафталін-5-іл)-амід 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти формули V 7 UA 101072 C2 Cl Cl O NH F H F N N CH3 (V). Сполука формули V описана, наприклад, у WO 2007/048556. Сполука формули V може перебувати у двох енантіомерних формах. Сполука формули Va S 1 2 3 Cl 4 5 O Cl R NH F H F N N CH3 5 (Va), хімічною назвою якої є ((1S,4R)-9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метанонафталін-5іл)-амід 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти, і сполука формули Vb R 1 2 3 4 5 O NH Cl Cl S F H F N N CH3 10 (Vb), хімічною назвою якої є ((1R,4S)-9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метанонафталін-5іл)-амід 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти. Кути оптичного обертання 23,5 [α] рівні -119,26° і +119,23° (у тетрагідрофурані) відповідно. ФОРМУЛА ВИНАХОДУ 15 1. Спосіб формули І одержання 9-дихлорметилен-1,2,3,4-тетрагідро-1,4-метанонафталін-5-іламіну 8 UA 101072 C2 Cl Cl NH2 , (I) який включає a) реакцію циклопентадієну з СХСl3, де X означає хлор або бром, у присутності радикального ініціатора з одержанням сполуки формули II CCl3 X 5 , (II) у якій X означає хлор або бром, або аа) реакцію циклопентадієну з СХСl3, де X означає хлор, у присутності металовмісного каталізатора з одержанням сполуки формули II CCl3 X 10 , (II) у якій X означає хлор, b) реакцію сполуки формули II з основою у присутності придатного розчинника з одержанням сполуки формули III Cl Cl 15 , (III) c) і перетворення сполуки формули III у присутності 1,2-дигідро-6-нітробензолу у сполуку формули IV Cl Cl NO2 20 ,(IV) і d) гідрування сполуки формули IV за допомогою джерела водню у присутності металовмісного каталізатора. 2. Спосіб за п. 1, який включає а) реакцію циклопентадієну з СХСl3, де X означає хлор або бром, у присутності радикального ініціатора з одержанням сполуки формули II CCl3 X , (II) у якій X означає хлор або бром. 3. Сполука формули IV 9 UA 101072 C2 Cl Cl NO2 . (IV) 4. Спосіб одержання сполуки формули III Cl 5 Cl , (III) який включає а) реакцію циклопентадієну з СХСl3, де X означає хлор або бром, у присутності радикального ініціатора з одержанням сполуки формули II CCl3 X 10 , (II) у якій X означає хлор або бром, і b) реакцію сполуки формули II з основою у присутності придатного розчинника. 5. Спосіб за п. 4, у якому X означає бром. 6. Спосіб за п. 1, у якому аа) циклопентадієн вводять у реакцію з ССl4 у присутності металовмісного каталізатора з одержанням сполуки формули II CCl3 X 15 , (II) у якій X означає хлор. 7. Спосіб за п. 1, який включає аа) реакцію циклопентадієну з СХСl3, де X означає хлор, у присутності металовмісного каталізатора, де металевий компонент каталізатора вибраний з групи, що включає рутеній, мідь, залізо, паладій і родій, з одержанням сполуки формули II CCl3 X 20 , (II) у якій X означає хлор, b) реакцію сполуки формули II з основою, вибраною з алкоголятів лужних металів, у присутності придатного розчинника з одержанням сполуки формули III Cl 25 Cl , (III) c) і перетворення сполуки формули III у присутності 1,2-дигідро-6-нітробензолу у сполуку формули IV 10 UA 101072 C2 Cl Cl NO2 (IV) і d) гідрування сполуки формули IV за допомогою джерела водню у присутності металовмісного каталізатора. 5 Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 11
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of benzonorbornenes
Автори англійськоюGribkov, Denis, Antelmann, Bjorn, Giordano, Fanny, Walter, Harald, de Mesmaeker, Alain
Назва патенту російськоюСпособ получения бензонорборненов
Автори російськоюГрибков Денис, Антельманн Бьйорн, Жиордано Фанни, Вальтер Харальд, де Месмакер Ален
МПК / Мітки
МПК: C07C 211/61, C07C 17/25, C07C 22/00, C07C 23/00, C07C 205/12
Мітки: спосіб, бензонорборненів, одержання
Код посилання
<a href="https://ua.patents.su/13-101072-sposib-oderzhannya-benzonorborneniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання бензонорборненів</a>
Попередній патент: Спосіб швидкого трифазного автоматичного повторного включення ліній електропередачі з поперечною компенсацією
Наступний патент: Застосування композиції для боротьби з кліщами у тварин
Випадковий патент: Пристрій для тимчасової інтубації ушкодженого бронха