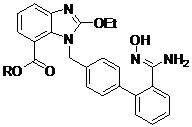
Спосіб виробництва 2-етокси-1-((2′-((гідроксіаміно)імінометил)біфеніл-4-іл)метил)-1н-бензо[d]імідазол-7-карбонової кислоти та її естерів
Формула / Реферат
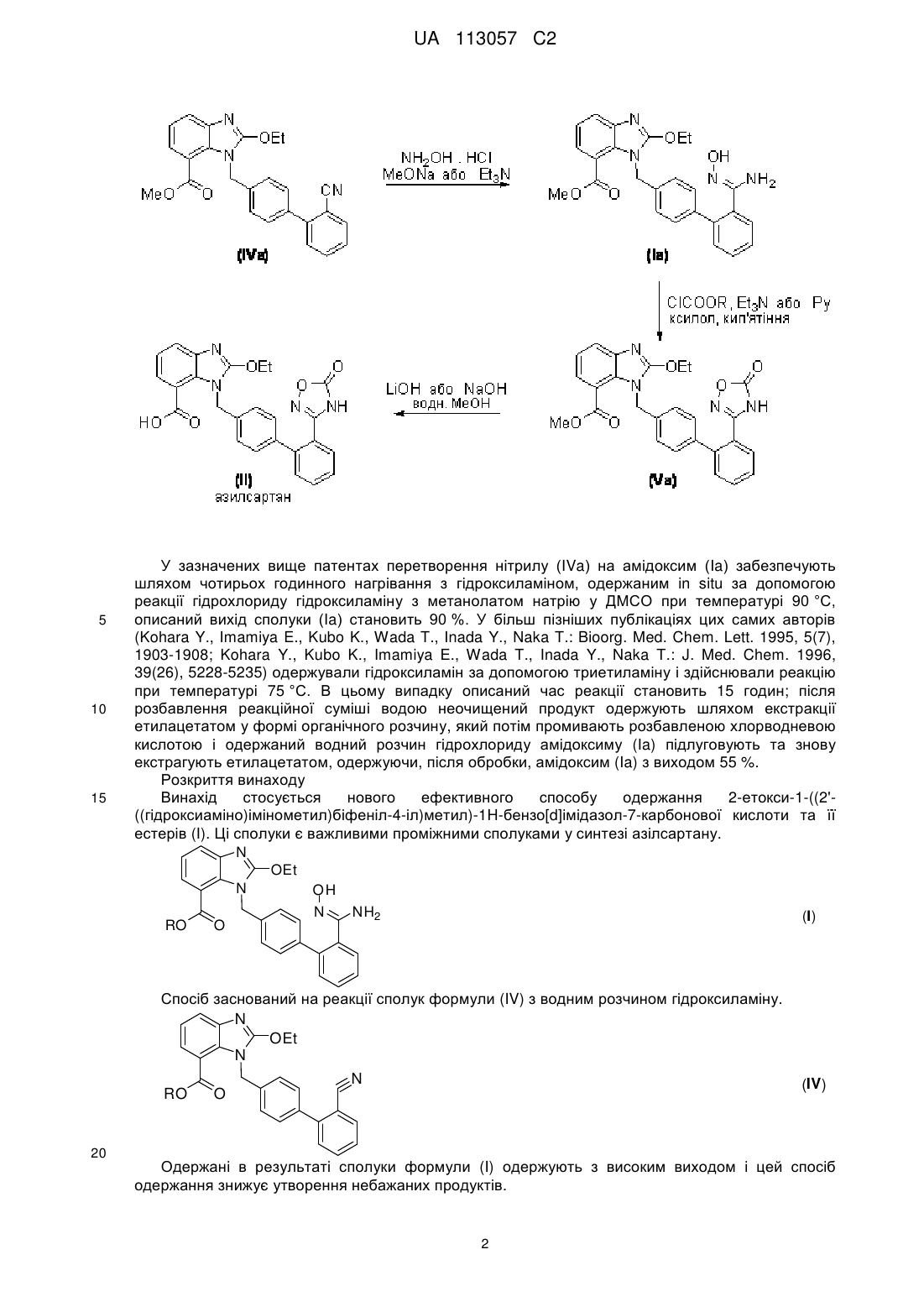
1. Спосіб виробництва 2-етокси-1-((2'-((гідроксіаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]імідазол-7-карбонової кислоти та її естерів формули I
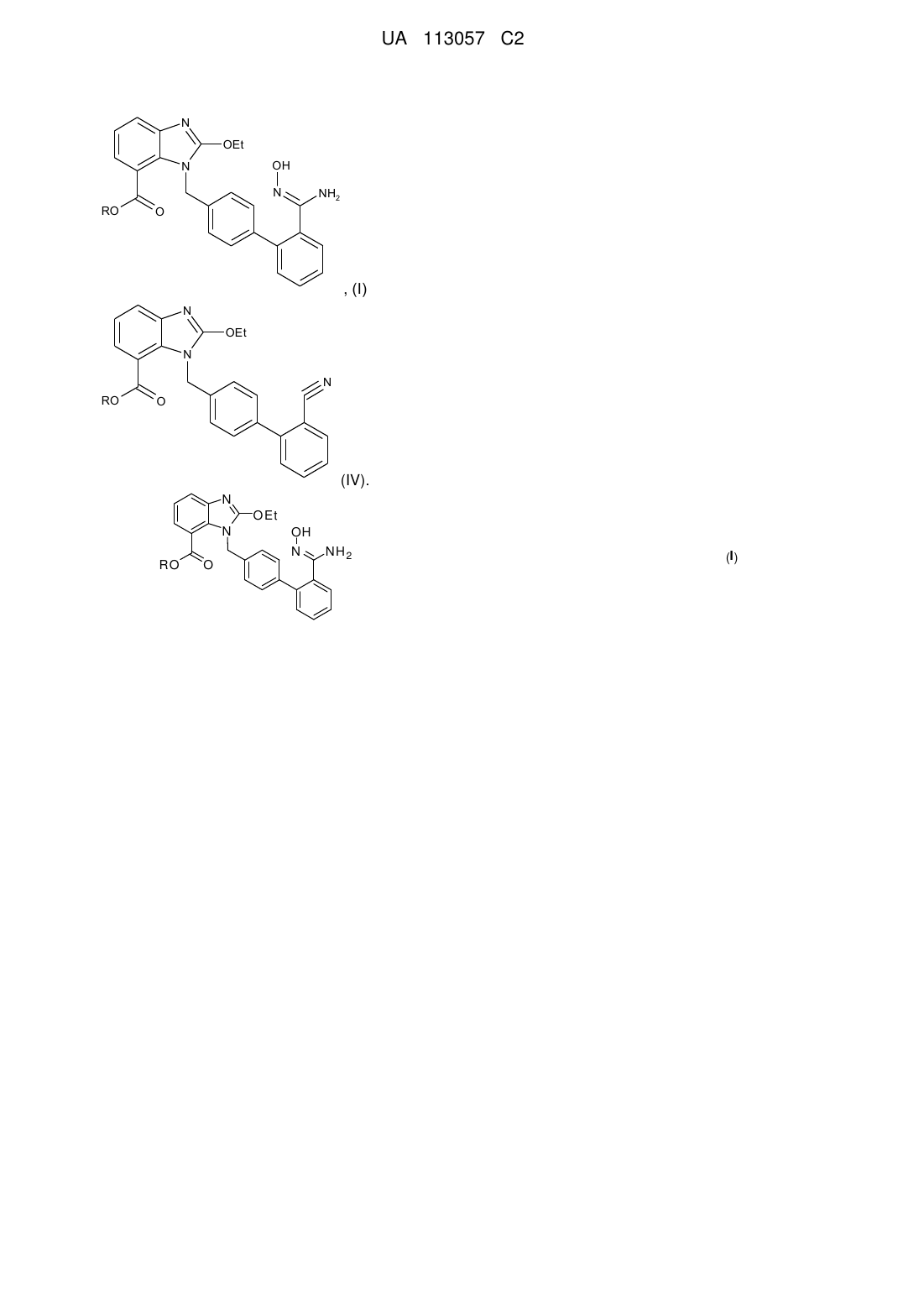
 , (І)
, (І)
в якій R означає або H, або (не)розгалужений C1-C4алкіл, ArCH2, Ar2CH або Ar3C, де Ar означає (не)заміщений феніл,
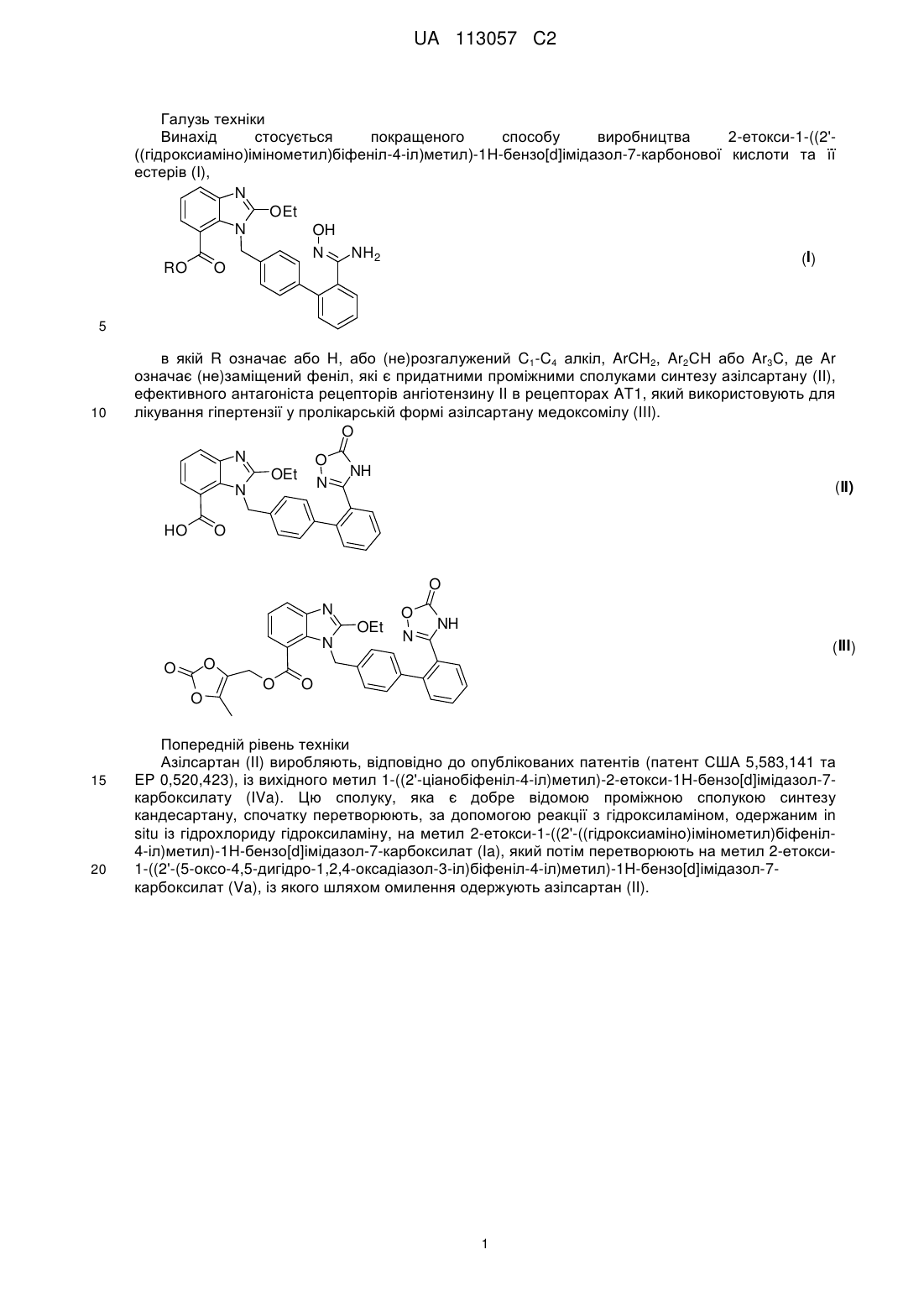
який відрізняється тим, що відповідний нітрил формули IV
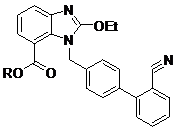 , IV
, IV
в якій R має значення, як визначено вище, піддають взаємодії з водним гідроксиламіном у полярному апротонному розчиннику або у суміші полярних апротонних розчинників.
2. Спосіб за п. 1, який відрізняється тим, що R означає H, метил, етил, бензил, бензгідрил або тритил.
3. Спосіб за будь-яким одним з пп. 1 і 2, який відрізняється тим, що реакцію здійснюють з водним розчином гідроксиламіну, що містить 20-80 мас. % гідроксиламіну.
4. Спосіб за п. 3, який відрізняється тим, що реакцію здійснюють з водним розчином гідроксиламіну, що містить 40-60 мас. % гідроксиламіну.
5. Спосіб за будь-яким одним з пп. 1-4, який відрізняється тим, що реакцію здійснюють при температурі від 40 до 100 °C.
6. Спосіб за п. 1, який відрізняється тим, що полярний апротонний розчинник вибирають із групи, що включає диметилсульфоксид, N,N-диметилформамід, N,N-диметилацетамід, 1-метилпіролідон, 1,1,3,3-тетраметилсечовину, 1,3-диметилімідазолідин-2-он, 1,3-диметил-3,4,5,6-тетрагідро-2(1H)-піримідинон та гексаметилфосфорамід, та їх суміші.
7. Спосіб за п. 6, який відрізняється тим, що згаданий розчинник є ДМСО або NMP.
8. Спосіб за будь-яким одним з пп. 1-7, який відрізняється тим, що реакційну суміш розбавляють водою або реакційну суміш виливають у воду і потім нерозчинний продукт виділяють шляхом фільтрації або центрифугування.
9. Спосіб за будь-яким одним з пп. 1-8, який відрізняється тим, що спосіб додатково включає стадію очистки сполуки формули І, яку здійснюють шляхом кристалізації з прийнятних розчинників, вибраних з групи, що включає естери аліфатичних кислот, наприклад метилацетат, етилацетат, ізопропілацетат, аміди, наприклад, N,N-диметилформамід, N,N-диметилацетамід, 1-метилпіролідон, етери, наприклад тетрагідрофуран, діоксан, 1,2-диметоксіетан, 1-метокси-2-(2-метоксіетоксі)етан, та їх суміші.
Текст
Реферат: Спосіб виробництва 2-етокси-1-((2'-((гідроксіаміно)імінометил)біфеніл-4-іл)метил)-1Нбензо[d]iмідазол-7-карбонової кислоти та її естерів формули І, в якій R означає або Н, або (не)розгалужений С1-С4алкіл, АrСН2, Аr2СН або Аr3С, де Аr означає (не)заміщений феніл, ключовими проміжними сполуками для синтезу азилсартану, де реакцію відповідного нітрилу формули IV здійснюють з водним гідроксиламіном у полярному апротонному розчиннику або у суміші таких розчинників. UA 113057 C2 (12) UA 113057 C2 N OEt OH N N RO NH2 O , (І) N OEt N N RO O (IV). N OEt N RO O OH N NH 2 (I) UA 113057 C2 Галузь техніки Винахід стосується покращеного способу виробництва 2-етокси-1-((2'((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]імідазол-7-карбонової кислоти та її естерів (I), N OEt N OH N NH 2 (I) RO O 5 10 в якій R означає або H, або (не)розгалужений C1-C4 алкіл, ArCH2, Ar2CH або Ar3C, де Ar означає (не)заміщений феніл, які є придатними проміжними сполуками синтезу азілсартану (II), ефективного антагоніста рецепторів ангіотензину II в рецепторах AT1, який використовують для лікування гіпертензії у пролікарській формі азілсартану медоксомілу (III). O N O N OEt N HO NH (II) O O N OEt N O 20 N NH ( III ) O O 15 O O O Попередній рівень техніки Азілсартан (II) виробляють, відповідно до опублікованих патентів (патент США 5,583,141 та EP 0,520,423), із вихідного метил 1-((2'-ціанобіфеніл-4-іл)метил)-2-етокси-1H-бензо[d]імідазол-7карбоксилату (IVa). Цю сполуку, яка є добре відомою проміжною сполукою синтезу кандесартану, спочатку перетворюють, за допомогою реакції з гідроксиламіном, одержаним in situ із гідрохлориду гідроксиламіну, на метил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл4-іл)метил)-1H-бензо[d]імідазол-7-карбоксилат (Ia), який потім перетворюють на метил 2-етокси1-((2'-(5-оксо-4,5-дигідро-1,2,4-оксадіазол-3-іл)біфеніл-4-іл)метил)-1H-бензо[d]імідазол-7карбоксилат (Va), із якого шляхом омилення одержують азілсартан (II). 1 UA 113057 C2 5 10 15 У зазначених вище патентах перетворення нітрилу (IVa) на амідоксим (Ia) забезпечують шляхом чотирьох годинного нагрівання з гідроксиламіном, одержаним in situ за допомогою реакції гідрохлориду гідроксиламіну з метанолатом натрію у ДМСО при температурі 90 °C, описаний вихід сполуки (Ia) становить 90 %. У більш пізніших публікаціях цих самих авторів (Kohara Y., Imamiya E., Kubo K., Wada T., Inada Y., Naka T.: Bioorg. Med. Chem. Lett. 1995, 5(7), 1903-1908; Kohara Y., Kubo K., Imamiya E., Wada T., Inada Y., Naka T.: J. Med. Chem. 1996, 39(26), 5228-5235) одержували гідроксиламін за допомогою триетиламіну і здійснювали реакцію при температурі 75 °C. В цьому випадку описаний час реакції становить 15 годин; після розбавлення реакційної суміші водою неочищений продукт одержують шляхом екстракції етилацетатом у формі органічного розчину, який потім промивають розбавленою хлорводневою кислотою і одержаний водний розчин гідрохлориду амідоксиму (Ia) підлуговують та знову екстрагують етилацетатом, одержуючи, після обробки, амідоксим (Ia) з виходом 55 %. Розкриття винаходу Винахід стосується нового ефективного способу одержання 2-етокси-1-((2'((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]імідазол-7-карбонової кислоти та її естерів (I). Ці сполуки є важливими проміжними сполуками у синтезі азілсартану. N OEt N OH N NH2 (I) RO O Спосіб заснований на реакції сполук формули (IV) з водним розчином гідроксиламіну. N OEt N N RO 20 (IV) O Одержані в результаті сполуки формули (I) одержують з високим виходом і цей спосіб одержання знижує утворення небажаних продуктів. 2 UA 113057 C2 5 Детальний опис винаходу Винахід стосується нового ефективного способу одержання 2-етокси-1-((2'((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]імідазол-7-карбонової кислоти та її естерів (I), в якій R означає або H, або (не)розгалужений C1-C4 алкіл, ArCH2, Ar2CH або Ar3C, де Ar означає (не)заміщений феніл. Ці сполуки є важливими проміжними сполуками у синтезі азілсартану. N OEt N OH N NH2 (I) RO O Спосіб заснований на реакції сполук формули (IV) N OEt N N RO 10 (IV) O з водним розчином гідроксиламіну у полярному апротонному розчиннику. Одержані сполуки формули (I) одержують з високим виходом і цей спосіб одержання пригнічує утворення небажаних продуктів, особливо утворення сполук формули (VI), H N O N N RO 15 20 25 30 35 (VI) O , в якій R має значення, як визначено вище. Для реакції, використовують водний розчин гідроксиламіну при концентрації 20 – 80 мас. %, у переважному втіленні, розчин з концентрацією 40 – 60 мас. %. Використовувані полярні апротонні розчинники включають диметилсульфоксид (ДМСО), N, N-диметилформамід (ДМФ), N, N-диметилацетамід (DMAc), 1-метилпіролідон (NMP), 1,1,3,3-тетраметилсечовину (TMU), 1,3диметилімідазолідин-2-он (DMI), 1,3-диметил-3,4,5,6-тетрагідро-2(1H)-піримідинон (DMPU), гексаметилфосфорамід (HMPA) або їх суміші, або можливі сумішіі з іншими розчинниками. У переважному втіленні, використовують ДМСО або NMP. Реакцію здійснюють при температурі в інтервалі 40-100 °C, переважно при температурі в інтервалі 50-90 °C. Реакційну суміш нагрівають протягом достатньо тривалого часу в інтервалі 12-48 годин; після завершення реакції, реакційну суміш обробляють шляхом розбавлення водою або шляхом виливання реакційної суміші на воду. Відокремлений продукт потім виділяють за допомогою фільтрації або центрифугування. Неочищені сполуки формули (I) одержують з чистотою щонайменше 95 % з низьким вмістом сполук (VI). При необхідності, неочищені сполуки формули (I) можуть бути очищені шляхом кристалізації із прийнятних розчинників, включаючи естери аліфатичних кислот (наприклад, метилацетат, етилацетат, ізопропілацетат), аміди (N, N-диметилформамід, N, Nдиметилацетамід, 1-метилпіролідон), етери (наприклад, тетрагідрофуран, діоксан, 1,2диметоксиетан, 1-метокси-2-(2-метоксиетокси)етан або суміші цих розчинників. При відтворенні попередньо описаних процесів синтезу амідоксиму (Ia) було виявлено, що у реакційній суміші, поміж бажаних продуктів, присутні вихідна сполука, а також значна кількість дезетилнітрилу (VIa). Побічний продукт (VIa) є формально продуктом гідролізу етоксигрупи у положенні 2 бензімідазольного скелету нітрилу (IVa). 3 UA 113057 C2 H N O N N MeO 5 10 15 20 25 30 35 40 45 50 (VIa) O де Me=CH3 За допомогою відтворення способу відповідно до EP 0,520,423 (дивіться Приклади 1 та 5), були одержані неочищені продукти, що містять 17,6 % і 19,7 %, відповідно, сполуки (VIa). Повторення експериментів при суворому дотриманні умов безводного середовища надавало зіставлювані результати. Утворення відповідних дезетилнітрилів було також виявлено у подібних реакціях етилового естеру (IVb) та бензилового естеру (IVc) (дивіться Приклади 6, 8 та 9). Шляхом змінення зазначених способів було виявлено, що ні зміна температури ні змінення основи не надає результату для суттєвого зниження кількості цього побічного продукту (дивіться Приклади 3, 6, 7 та 9). Хоча у попередніх патентах або цитованих публікаціях утворення сполуки (VIa) не визначалось зовсім, їх автори безперечно стикалися з проблемами такого утворення, які вони вирішували за допомогою зазначеного вище очищення неочищеного продукту, яким дійсно можна видалити цей побічний продукт із неочищеного продукту (дивіться Приклади 2 і 7). При відтворенні способу відповідно до EP 0,520,423, з наступною кристалізацією, авторами було виявлено, що значна кількість сполуки (VIa) може бути знижена; наприклад, від 18,9 % до 1,3 %. Однак, такі операції приводять до значного зниження виходу. Представлений винахід заснований на висновку, що за певних суворо визначених умов, може бути забезпечено майже повне пригнічення утворення дезетилнітрилів (VI). Було виявлено, що утворення цих сполук у реакційній суміші протягом утворення in situ гідроксиламіну у вигляді основи відбувається як у присутності надлишку солі гідроксиламіну (наприклад, гідрохлориду гідроксиламіну), так і у присутності надлишку більшості основ, широко використовуваних для вивільнення гідроксиламіну у вигляді основи. При дослідженні умов авторами було виявлено, що ця проблема може бути вирішена, як шляхом використання слабких основ для вивільнення гідроксиламіну, так і шляхом здійснення послідовного додавання гідроксиламіну у деяких розчинниках при лише незначно підвищеній температурі. Типовим прикладом є використання NaHCO3 або NaOAc у киплячому метанолі або у суміші толуол-метанол. На жаль, за цих умов реакція відбувається дуже повільно і для досягнення завершення перетворення необхідно здійснювати нагрівання протягом декількох днів. Щодо структури побічних продуктів (IV), то дуже несподівано було виявлено, що якщо реакцію здійснюють, використовуючи водний розчин гідроксиламіну, дезетилнітрили практично зовсім не утворюються. При численних дослідженнях різноманітних модифікацій визначених вище способів як джерела гідроксиламіну використовували і гідрохлорид гідроксиламіну, і сульфат гідроксиламіну, і фосфат гідроксиламіну. Для виділення гідроксиламіну у вигляді основи, був досліджений ряд речовин, включаючи аміни (наприклад, триетиламін, DIPEA, DBU, 1,8-біс(диметиламіно)нафтален), алкоголяти (наприклад, MeONa, MeOK, EtONa, т-BuONa, т-BuOK, тAmONa, т-AmOK), гідроксиди (NaOH, KOH, CsOH), карбонати (Na2CO3, K2CO3, CsCO3), гідрокарбонати (NaHCO3, KHCO3) та ацетати (NaOAc, KOAc), в ряді розчинників та їх сумішей. Значне зниження утворення дезетилнітрилів (VI) досягалось, коли реакцію здійснювали у метанолі або його суміші з толуолом, при використанні слабких основ. Установлено, що найбільш зручним є використання NaHCO3 або NaOAc у метанолі або його суміші з толуолом за умов кипіння зі зворотним холодильником. На жаль, за даних умов реакція відбувається в значній мірі повільно і значна частина вихідної сполуки залишається не прореагованою, навіть після 48 годин. Значне покращення досягалось використанням водного розчину гідроксиламіну. Цей спосіб не потребує додавання будь-яких неорганічних або органічних основ і таким чином не виникає ризик забруднення продукту. Процедура здійснення реакції є дуже простою і полягає лише у нагріванні вихідного нітрилу (IV) з водним гідроксиламіном у прийнятному розчиннику. Після досягнення бажаного перетворення додають воду (або реакційну суміш виливають у воду), одержаний продукт (I) відділяють у формі осаду, що добре піддається фільтрації, та після 4 UA 113057 C2 5 10 15 20 25 30 35 40 45 50 55 промивання, одержують високо очищений продукт. Він може бути потім перекристалізований або переважно використаний після сушіння, безпосередньо для подальшої реакції. Водний гідроксиламін, що містить 20 – 80 мас. % гідроксиламіну, переважно 40 – 60 %, може використовуватись для реакції нітрилів (IV). Використання водного гідроксиламіну, що містить 50 мас. % гідроксиламіну, є найбільш зручним, з точки зору можливості промислового виробництва. Реакція перебігає навіть при кімнатній температурі, але зважаючи на її тривалість, здійснення реакції при підвищеній температурі є більш ефективним, переважно в інтервалі 40100 °C. Навіть при вищих температурах не спостерігається наявність більш значних кількостей дезетилнітрилів (VI). Найбільша перевага надається здійсненню реакції при температурі 50 – 90 °C. Через обмежену розчинність вихідних нітрилів (IV), кількість прийнятних розчинників обмежується полярними апротонними розчинниками, такими як сульфоксиди (наприклад, ДМСО), аміди (наприклад, N, N-диметилформамід (ДМФ), N, N-диметилацетамід (DMAc), 1метилпіролідон (NMP)), похідні сечовини (наприклад, 1,1,3,3-тетраметилсечовина (TMU), 1,3диметилімідазолідин-2-он (DMI), 1,3-диметил-3,4,5,6-тетрагідро-2(1H)-піримідинон (DMPU)), гексаметилфосфорамід (HMPA) або їх суміші. Реакція також може бути здійснена у суміші зазначених вище розчинників з іншими спів-розчинниками, такими як естери (наприклад, алкілацетати, такі як метилацетат або етилацетат) або ароматичні вуглеводні (наприклад, толуол), або диглім. Протягом розвинення синтезу алкіл 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4іл)метил)-1H-бензо[d]імідазол-7-карбоксилатів, реакції за стандартною методикою контролювали за допомогою ВЕРХ у пристрої HP 1050, оснащеному колонкою Phenomenex Luna 5 мкм C18(2), 250 × 4,6 мм, оснащеною 227 нм УФ детектором. Фаза A: 1,2 г NaH2PO4/1 л води (pH=3,0; Фаза B: метанол. Винахід висвітлюється більш докладно у наступних робочих прикладах. Приклади, які ілюструють покращення способу відповідно до винаходу, мають тільки ілюстративний характер і не обмежують рамки винаходу у будь-якому відношенні. Робочі Приклади Порівнювальні приклади: Приклад 1 Метил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ia) – відтворення процесу (US 5,583,141; EP 0,520,423) 30 % розчин MeONa у MeOH (9,1 г) додавали до перемішуваної суміші тонко подрібненого гідрохлориду гідроксиламіну (3,5 г, 50 ммоль) у сухому ДМСО (40 мл) і суміш перемішували в атмосфері азоту при кімнатній температурі протягом 10 хвилин. Потім, додавали нітрил (IVa; 4,11 г, 10 ммоль) і суміш перемішували при температурі 90 °C протягом 4 годин. Відповідно до ВЕРХ суміш містить 32,3 % продукту (Ia), 49,9 % вихідного нітрилу (IVa) і 17,6 % дезетилнітрилу (VIa). Реакційну суміш охолоджували до кімнатної температури, потім додавали воду (25 мл), суміш, нагріту шляхом розбавлення, охолоджували та перемішували при кімнатній температурі протягом 30 хвилин. Нерозчинну фракцію відсмоктували, промивали водою та сушили повітрям. Одержували 3,9 г речовини, що містить, відповідно до ВЕРХ, 30,7 % продукту (Ia), 49,8 % вихідного нітрилу (IVa) та 18,9 % дезетилнітрилу (VIa). Приклад 2 Метил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ia) – модифікація процесу (US 5,583,141; EP 0,520,423) Продукт, одержаний з використанням способу Прикладу 1 (3,9 г), розчиняли у дихлорметані (400 мл) та одержаний, все ще мутний розчин промивали 4 × 50 мл 5 % HCl. Одержаний в такий спосіб водний розчин, підлуговували концентрованим (20 %) розчином гідроксиду натрію і одержаний осад відсмоктували, і промивали водою. Після сушіння одержували 1,6 г (загальний вихід Прикладу 1 і Прикладу 2 становить 36,0 %) речовини (Ia), що містить, відповідно до ВЕРХ, 96,7 % продукту (Ia), невиявну кількість вихідного нітрилу (IVa) та 1,3 % дезетилнітрилу (VIa). Приклад 3 Метил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ia) – модифікація процесу (US 5,583,141; EP 0,520,423) Використовуючи спосіб, описаний у Прикладі 1, але здійснюючи реакцію при температурі 90 °C протягом 20 годин, одержували реакційну суміш, що містить, відповідно до ВЕРХ 44,7 % продукту (Ia), 11,4 % вихідного нітрилу (IVa) та 40,5 % дезетилнітрилу (VIa). Приклад 4 5 UA 113057 C2 5 10 15 20 25 30 35 40 45 50 55 Метил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ia) – модифікація процесу (US 5,583,141; EP 0,520,423) Використовуючи спосіб, описаний у Прикладі 1, але здійснюючи реакцію при температурі 75 °C протягом 24 годин, одержували реакційну суміш, що містить, відповідно до ВЕРХ, 30,7 % продукту (Ia), 49,8 % вихідного нітрилу (IVa) та 18,8 % дезетилнітрилу (VIa). Приклад 5 Метил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ia) – відтворення процесу (J. Med. Chem. 1996, 39(26), 5228-5235) Триетиламін (1,7 мл = 1,24 г) додавали до суспензії гідрохлориду гідроксиламіну (0,85 г, 12,2 ммоль) у ДМСО (4 мл) і суміш перемішували при кімнатній температурі протягом 15 хвилин. Потім згущений осад відсмоктували та промивали тетрагідрофураном (10 мл). Фільтрат концентрували у вакуумі (більшість тетрагідрофурану випарювалась). До цього розчину додавали нітрил (IVa; 1,03 г, 2,5 ммоль) і суміш перемішували при температурі 75 °C протягом 15 годин. Відповідно до ВЕРХ, суміш містить 44,2 % продукту (Ia), 35,2 % вихідного нітрилу (IVa) та 19,7 % дезетилнітрилу (VIa). Приклад 6 Етил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ib) – модифікація процесу (US 5,583,141; EP 0,520,423) Використовуючи спосіб, описаний у Прикладі 1, але здійснюючи реакцію з етиловим естером (IVb; 8,5 г, 20 ммоль) при температурі 90 °C протягом 14 годин, одержували реакційну суміш, що містить відповідно до ВЕРХ, 68,8 % продукту (Ib), 5,2 % вихідного нітрилу (IVb) та 22,9 % дезетилнітрилу (VIb). Після виливання реакційної суміші на воду, відсмоктували одержаний осад, промивали водою і сушили (9,45 г). Розчин цієї речовини у дихлорметані (900 мл) збовтували з 5 % HCl (4 × 100 мл), об'єднані водні фракції підлуговували концентрованою NaOH і одержану тонкодисперсну суспензію перемішували при кімнатній температурі протягом ночі. Потім нерозчинну фракцію відсмоктували, промивали водою та сушили. Після кристалізації із етилацетату 4,7 г (51,2 %) одержували кремоподібні кристали, що містять, відповідно до ВЕРХ, 96,8 % продукту (Ib), 0 % вихідного нітрилу (IVb) та 0,2 % дезетилнітрилу (VIb). Приклад 7 Етил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ib) – модифікація процесу (US 5,583,141; EP 0,520,423) Використовуючи спосіб, описаний у Прикладі 4, але здійснюючи реакцію з етиловим естером (IVb; 1,7 г, 4 ммоль) при температурі 75 °C протягом 24 годин, одержували реакційну суміш, що містить, відповідно до ВЕРХ, 58,9 % продукту (Ib), 8,3 % вихідного нітрилу (IVb) та 20,7 % дезетилнітрилу (VIb). Після виливання реакційної суміші на воду, одержаний осад відсмоктували, промивали водою та сушили (1,7 г). Розчин цієї речовини у дихлорметані (300 мл) збовтували з 5 % HCl (3 × 35 мл), об'єднані водні фракції підлуговували концентрованою NaOH і, одержану тонкодисперсну суспензію екстрагували дихлорметаном. Після промивання водою екстракт сушили над MgSO4 і після випаровування, одержували 0,8 г (43,6 %) випареного продукту (100 % чистий продукт) відповідно до ВЕРХ. Приклад 8 Етил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ib) – модифікація процесу (J. Med. Chem. 1996, 39(26), 5228-5235) Використовуючи спосіб, описаний у Прикладі 5, але здійснюючи реакцію з етиловим естером (IVb), одержували реакційну суміш, що містить, відповідно до ВЕРХ, 42,5 % продукту (Ib), 39,7 % вихідного нітрилу (IVb) та 17,6 % дезетилнітрилу (VIb). Приклад 9 Етил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ib) – модифікація процесу (J. Med. Chem. 1996, 39(26), 5228-5235) Триетиламін (3,4 мл = 2,48 г) додавали до суспензії гідрохлориду гідроксиламіну (1,7 г, 25 ммоль) у ДМСО (8 мл) і суміш перемішували при кімнатній температурі протягом 15 хвилин. Згущений осад потім відсмоктували і промивали тетрагідрофураном (10 мл). Фільтрат концентрували у вакуумі (найбільша частина тетрагідрофурану випарювалась). До цього розчину додавали нітрил (IVa; 2,06 г, 5 ммоль) і суміш перемішували при кімнатній температурі протягом 15 хвилин. Потім, суміш розподіляли до 4 реакційних пробірок і перемішували при кімнатній температурі (A), при температурі 50 °C (B), 75 °C (C) та 100 °C (D) протягом 48 годин. Потім реакційні суміші аналізували за допомогою ВЕРХ. Результати наводили у Таблиці I. 6 UA 113057 C2 Таблиця I Склад реакційної суміші Прикладу 9 Позиція A B C D 5 10 15 20 25 30 35 40 45 Температура 20 °C 50 °C 75 °C 100 °C % Ia 3,2 33,1 54,4 29,4 % IVa 96,1 49,6 1,0 0 % VIa 0,4 11,7 32,8 27,0 % Інші 0,3 5,6 11,8 43,6 Приклад 10 Бензил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол7-карбоксилат (Ic) – модифікація процесу (US 5,583,141; EP 0,520,423) Використовуючи спосіб, описаний у Прикладі 4, але здійснюючи реакцію з бензиловим естером (IVc) при 75 °C протягом 24 годин, одержували реакційну суміш, що містить, відповідно до ВЕРХ, 52,8 % продукту (Ic), 13,4 % вихідного нітрилу (IVc) та 23,7 % дезетилнітрилу (VIc). Приклад 11 Етил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ib) – з використанням NaHCO3 як основи Гідрокарбонат натрію (0,2 г, 2,4 ммоль) додавали до суспензії гідрохлориду гідроксиламіну (0,15 г, 2,2 ммоль) у метанолі (10 мл) і суміш перемішували при кімнатній температурі протягом 10 хвилин. Потім, додавали нітрил (IVb, 0,43 г, 1 ммоль) і суміш нагрівали при помірному кип'ятінні протягом 24 годин. Відповідно до ВЕРХ, суміш містить 32,1 % продукту (Ib), 65,9 % вихідного нітрилу (IVb) та 2,0 % дезетилнітрилу (VIb). До суміші додавали другу частину гідрокарбонату натрію (0,2 г, 2,4 ммоль) та гідрохлориду гідроксиламіну (0,15 г, 2,2 ммоль) і суміш нагрівали при помірному кип'ятінні ще протягом 24 годин. Відповідно до ВЕРХ, суміш містить 56,2 % продукту (Ib), 33,2 % вихідного нітрилу (IVb) та 5,1 % дезетилнітрилу (VIb). Після охолодження суміш виливали у воду (50 мл), нерозчинну фракцію відсмоктували і промивали водою. Після сушіння, одержували 0,35 г речовини, що містить, відповідно до ВЕРХ, 54,7 % продукту (Ib), 31,3 % вихідного нітрилу (IVb) та 6,8 % дезетилнітрилу (VIb). Приклад 12 Метил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ia) – з використанням NaOAc як основи Ацетат натрію (0,2 г, 2,4 ммоль) додавали до суспензії гідрохлориду гідроксиламіну (0,15 г, 2,2 ммоль) у толуолі (10 мл) і суміш перемішували при кімнатній температурі протягом 10 хвилин. Потім, додавали нітрил (IVa, 0,41 г, 1 ммоль) і суміш нагрівали при помірному кип'ятінні протягом 24 годин. Відповідно до ВЕРХ, суміш містить 36,2 % продукту (Ia), 58,7 % вихідного нітрилу (IVa) та 3,4 % дезетилнітрилу (VIa). До суміші додавали другу частину ацетату натрію (0,2 г, 2,4 ммоль) та гідрохлориду гідроксиламіну (0,15 г, 2,2 ммоль) і суміш нагрівали при помірному кип'ятінні протягом ще 24 годин. Відповідно до ВЕРХ, суміш містить 58,1 % продукту (Ia), 32,5 % вихідного нітрилу (IVa) та 7,1 % дезетилнітрилу (VIa). Реакційну суміш виливали у воду (50 мл) при перемішуванні, нерозчинну фракцію відсмоктували і, після сушіння, одержували 0,26 г речовини, що містить, відповідно до ВЕРХ, 78,3 % продукту (Ia), 3,6 % вихідного нітрилу (IVa) та 13,2 % дезетилнітрилу (VIa). Фільтрат розділяли і толуоловий шар аналізували за допомогою ВЕРХ – він містить 10,6 % продукту (Ia), 85,9 % вихідного нітрилу (IVa) та 2,7 % дезетилнітрилу (VIa). Робочі приклади з використанням водного гідроксиламіну: Приклад 13 Метил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ia) – з використанням водного гідроксиламіну 50 % водний гідроксиламін (0,3 мл) додавали до розчину нітрилу (IVa; 0,41 г, 1 ммоль) у відповідному розчиннику (4 мл) і суміш перемішували у реакційній посудині при температурі 75 °C протягом 24 годин і реакційні суміші аналізували за допомогою ВЕРХ. Результати наводили у Таблиці II. 7 UA 113057 C2 Таблиця II Склад реакційної суміші Прикладу 12 Позиція A B C * D E F Розчинник ДМСО ДМФ DMAc NMP DMI DMPU % Ia 84,3 61,9 45,3 76,2 81,5 86,1 % IVa 7,6 16,1 37,1 15,1 12,1 3,6 % VIa 2,2 13,7 15,0 0,6 2,1 1,2 % Інші 5,9 8,3 2,5 8,1 4,3 9,1 * 5 10 - Після наступних 24 годин суміш містила, відповідно до ВЕРХ, 81,6 % продукту (Ia), 2,7 % вихідного нітрилу (IVa) та 1,2 % дезетилнітрилу (VIa). Приклад 14 Етил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ib) – з використанням водного гідроксиламіну 50 % водний гідроксиламін (0,3 мл) додавали до розчину нітрилу (IVb; 0,43 г, 1 ммоль) у відповідному розчиннику (4 мл) і суміш перемішували в реакційній посудині при температурі 75 °C протягом 24 годин і реакційні суміші аналізували за допомогою ВЕРХ. Результати наводили у Таблиці III. Таблиця III Склад реакційної суміші Прикладу 13 Позиція A B C D E F 15 20 25 30 35 Розчинник ДМСО ДМФ DMAc NMP DMI DMPU % Ib 88,0 71,2 43,7 76.7 81,2 87,8 % IVb 7,1 16,5 41,3 17,6 15,4 5,3 % VIb 1,4 5,8 12,5 1,0 1,5 0,9 % Інші 3,5 6,5 2,5 4,7 1,9 6,0 Приклад 15 Етил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ib) – з використанням водного гідроксиламіну 25 % водний гідроксиламін (1,5 мл) додавали до розчину нітрилу (IVb; 0,86 г, 2 ммоль) у ДМСО (8 мл) і суміш перемішували при температурі 75 °C протягом 24 годин. Охолоджену реакційну суміш виливали на воду (25 мл), нерозчинну фракцію відсмоктували, промивали водою та сушили. Одержували 0,8 г продукту, що містить, відповідно до ВЕРХ, 89,6 % продукту (Ib), 6,3 % вихідного нітрилу (IVb) та 2,5 % дезетилнітрилу (VIb). Приклад 16 Етил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ib) – з використанням водного гідроксиламіну 50 % (мас./мас.) водний розчин гідроксиламіну (3 мл) додавали до перемішуваної суміші нітрилу (IVb, 8,6 г, 20 ммоль) та ДМСО (60 мл), і суміш перемішували в атмосфері азоту при температурі 75 °C протягом 17 годин. Потім, додавали другу частину 50 % водного гідроксиламіну (2 мл) і продовжували нагрівання протягом ще 7 годин. Відповідно до ВЕРХ, суміш містить 72,8 % продукту (Ib), 20,2 % вихідного нітрилу (IVb) та 2,3 % дезетилнітрилу (VIb). Після додавання ще одної частини 50 % водного гідроксиламіну (2 мл) нагрівання продовжували протягом ще 12 годин. Відповідно до ВЕРХ, суміш містить 91,3 % продукту (Ib), 0,5 % вихідного нітрилу (IVb) та 2,9 % дезетилнітрилу (VIb). Після охолодження, додавали краплями воду (50 мл), суміш перемішували протягом 30 хвилин і потім нерозчинну фракцію відсмоктували і промивали водою (100 мл). Після сушіння, одержували 8,9 г продукту (97,1 %), що містить, відповідно до ВЕРХ, 98,6 % продукту (Ib), 0,3 % вихідного нітрилу (IVb) та 0,2 % дезетилнітрилу (VIb). Шляхом кристалізації зразка із етилацетату, одержували абсолютно 1 чистий продукт (відповідно до ВЕРХ), що має температуру плавлення 209-211 °C. H ЯМР 1 спектр (ДМСО-d6): H ЯМР (500 МГц, ДМСО) δ (млн. ч.): 9,19 (шс, 1H, OH), 7,69 (дд, J=7,9, 1,2 8 UA 113057 C2 5 10 15 20 25 30 35 40 45 50 55 60 Гц, 1H, Ar), 7,46 (дд, J=7,9, 1,2 Гц, 1H, Ar), 7,45-7,32 (м, 3H, Ar), 7,35 (д, J=8,4 Гц, 2H, Ar), 7,27 (дд, J=7,6, 1,5 Гц, 1H, Ar), 7,19 (т, J=7,9 Гц, 1H, Ar), 6,93 (д, J=8,4 Гц, 2H, Ar), 5,55 (шс, 2H, NH2), 5,53 (с, 2H, N-CH2-Ar), 4,62 (к, J=7,1 Гц, 2H, OCH2CH3), 4,22 (к, J=7,1 Гц, 2H, COOCH2CH3), 1,42 (т, J=7,1 Гц, 3H, OCH2CH3), 1,18 (т, J=7,1 Гц, 3H, COOCH2CH3). Приклад 17 Метил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ia) – з використанням водного гідроксиламіну В результаті здійснення процедури, описаної у Прикладі 16, використовуючи нітрил (IVa), одержували 96,3 % продукту, що містить, відповідно до ВЕРХ, 96,9 % продукту (Ia), 1,6 % вихідного нітрилу (IVa) та 0,7 % дезетилнітрилу (VIa). Шляхом кристалізації зразка із метилацетату, одержували абсолютно чистий продукт (відповідно до ВЕРХ), що має 1 1 температуру плавлення 208-210 °C. H ЯМР спектр (ДМСО-d6): H ЯМР (500 МГц, ДМСО) δ (млн. ч.): 9,18 (с, 1H, OH), 7,70 (дд, J=7,9, 1,2 Гц, 1H, Ar), 7,46 (дд, J=7,9, 1,2 Гц, 1H, Ar), 7,457,33 (м, 3H, Ar), 7,35 (д, J=8,3 Гц, 2H, Ar), 7,29 (дд, J=7,6, 1,5 Гц, 1H, Ar), 7,19 (т, J=7,9 Гц, 1H, Ar), 6,94 (д, J=8,3 Гц, 2H, Ar), 5,55 (шс, 2H, NH2), 5,51 (с, 2H, N-CH2-Ar), 4,62 (к, J=7,1 Гц, 2H, OCH2CH3), 3,71 (с, 3H, OCH3), 1,42 (т, J=7,1 Гц, 3H, OCH2CH3) Приклад 18 Бензил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол7-карбоксилат (Ic) – з використанням водного гідроксиламіну В результаті здійснення процедури, описаної у Прикладі 16, використовуючи нітрил (IVc), одержували 89,7 % продукту, що містить, відповідно до ВЕРХ, 87,7 % продукту (Ic), 2,7 % вихідного нітрилу (IVc) та 3,5 % дезетилнітрилу (VIc). Шляхом кристалізації зразка із ізопропілацетату, одержували абсолютно чистий продукт (відповідно до ВЕРХ), що має 1 температуру плавлення 171-173 °C. H ЯМР спектр (ДМСО-d6): 9,19 (с, 1H, OH), 7,70 (дд, J=7,9, 1,2 Гц, 1H, Ar), 7,51 (дд, J=7,9, 1,2 Гц, 1H, Ar), 7,45-7,29 (м, 8H, Ar), 7,31 (д, J=8,4 Гц, 2H, Ar), 7,23 (дд, J=7,6, 1,5 Гц, 1H, Ar), 7,19 (т, J=7,9 Гц, 1H, Ar), 6,90 (д, J=8,4 Гц, 2H, Ar), 5,54 (шс, 2H, NH2), 5,53 (с, 2H, N-CH2-Ar), 5,27 (с, 2H, COOCH2-Ph), 4,63 (к, J=7,1 Гц, 2H, OCH2CH3), 1,43 (т, J=7,1 Гц, 3H, OCH2CH3). Приклад 19 Бензгідрил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-benzo[d]імідазол-7-карбоксилат (Id) – з використанням водного гідроксиламіну В результаті здійснення процедури, описаної у Прикладі 16, використовуючи нітрил (IVd), одержували 84,9 % продукту, що містить, відповідно до ВЕРХ, 93,7 % продукту (Id), 4,2 % вихідного нітрилу (IVd) та 2,1 % дезетилнітрилу (VId). Шляхом кристалізації зразка із ізопропілацетату, одержували абсолютно чистий продукт (відповідно до ВЕРХ), що має 1 температуру плавлення 234-237 °C. H ЯМР спектр (ДМСО-d6): 9,19 (с, 1H, OH), 7,76-7,70 (м, 2H, Ar), 7,53-7,44 (м, 4H, Ar), 7,42-7,28 (м, 9H, Ar), 7,25 (т, J=7,9 Гц, 1H, Ar), 7,17 (д, J=8,3 Гц, 2H, Ar), 7,10-6,99 (м, 2H, Ar), 6,82 (д, J=8,3 Гц, 2H, Ar), 5,53 (шс, 2H, NH2), 5,48 (с, 2H, N-CH2-Ar), 4,63 (к, J=7,1 Гц, 2H, OCH2CH3), 1,43 (т, J=7,1 Гц, 3H, OCH2CH3); Приклад 20 Тритил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол7-карбоксилат (Ie) – з використанням водного гідроксиламіну В результаті здійснення процедури, описаної у Прикладі 16, використовуючи нітрил (IVe), одержували 89,2 % продукту, що містить, відповідно до ВЕРХ, 84,4 % продукту (Ie), 2,1 % вихідного нітрилу (IVe) та 5,2 % дезетилнітрилу (VIe). Шляхом кристалізації зразка із ізопропілацетату, одержували продукт (відповідно до ВЕРХ), що має температуру плавлення 222-238 °C (розкл.), що містить 92,4 % продукту (Ie) і 7,6 % дезетилнітрилу (VIe) відповідно до ВЕРХ. Приклад 21 Метил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ia) – з використанням водного гідроксиламіну 50 % (мас./мас.) водний розчин гідроксиламіну (5 мл) додавали до перемішуваної суміші нітрилу (IVa, 4,1 г, 10 ммоль) та ДМСО (30 мл) і суміш перемішували під тиском у закритій колбі при температурі 75 °C протягом 18 годин. Відповідно до ВЕРХ, суміш містить 78,2 % продукту (Ia), 0,2 % вихідного нітрилу (IVa) та 2,2 % дезетилнітрилу (VIa). Після охолодження, суміш виливали у воду (50 мл), і потім нерозчинну фракцію відсмоктували і промивали водою (50 мл). Після сушіння, одержували 4,1 г продукту (92,2 %), що містить, відповідно до ВЕРХ, 99,1 % продукту (Ia), невиявну кількість вихідного нітрилу (IVa) та 0,1 % дезетилнітрилу (VIa). Шляхом кристалізації із ізопропілацетату одержували продукт з температурою плавлення 206-209 °C, що містить, відповідно до ВЕРХ, 99,9 % продукту (Ia). 9 UA 113057 C2 5 10 15 20 25 30 35 40 45 50 55 Приклад 22 Етил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ib) – з використанням водного гідроксиламіну 50 % (мас./мас.) водний розчин гідроксиламіну (5 мл) додавали до перемішуваної суміші нітрилу (IVb, 8,6 г, 20 ммоль) та NMP (50 мл), і суміш перемішували в атмосфері азоту при температурі 90 °C протягом 10 годин. Потім, додавали другу частину 50 % водного гідроксиламіну (3 мл) і продовжували нагрівання протягом ще 5 годин. Відповідно до ВЕРХ, суміш містить 83,6 % продукту (Ib), невиявну кількість вихідного нітрилу (IVb) та 2,2 % дезетилнітрилу (VIb). Після охолодження, суміш виливали у воду (100 мл), і потім нерозчинну фракцію відсмоктували і промивали водою (100 мл). Після сушіння, одержували 8,9 г продукту (97 %), що містить, відповідно до ВЕРХ, 96,6 % продукту (Ib). Шляхом кристалізації із етилацетату одержували продукт з температурою плавлення 209-211 °C, що містить, відповідно до ВЕРХ, 99,7 % продукту (Ib). Приклад 23 Метил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d] імідазол-7карбоксилат (Ia) – з використанням водного гідроксиламіну 50 % (мас./мас.) водний розчин гідроксиламіну (6 мл) додавали до перемішуваної суміші нітрилу (IVa, 8,2 г, 20 ммоль) та DMPU (50 мл), і суміш перемішували під тиском у закритій колбі при температурі 75 °C протягом 24 годин. Відповідно до ВЕРХ, суміш містить 89,8 % продукту (Ia), 2,2 % вихідного нітрилу (IVa) та 1,9 % дезетилнітрилу (VIa). Після охолодження суміш виливали у воду (100 мл), і потім нерозчинну фракцію відсмоктували і промивали водою (100 мл). Після сушіння, одержували 8,35 г продукту (93,9 %), що містить, відповідно до ВЕРХ, 99,4 % продукту (Ia), 0,2 % вихідного нітрилу (IVa) та 0,2 % дезетилнітрилу (VIb). Приклад 24 Метил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ia) – з використанням водного гідроксиламіну 50 % (мас./мас.) водний розчин гідроксиламіну (10 мл) додавали до перемішуваної суміші нітрилу (IVa, 8,2 г, 20 ммоль) та NMP (50 мл), і суміш перемішували під тиском у закритій колбі при температурі 75 °C протягом 48 годин. Відповідно до ВЕРХ, суміш містить 74,0 % продукту (Ia), невиявну кількість вихідного нітрилу (IVa) та 1,5 % дезетилнітрилу (VIa). Після охолодження, суміш виливали у воду (100 мл), і потім нерозчинну фракцію відсмоктували і промивали водою (100 мл). Після сушіння, одержували 7,1 г продукту (79,9 %), що містить, відповідно до ВЕРХ, 89,4 % продукту (Ia), невиявну кількість вихідного нітрилу (IVa) та 2,2 % дезетилнітрилу (VIa). Шляхом кристалізації із тетрагідрофурану одержували продукт, що містить, відповідно до ВЕРХ, 98,3 % продукту (Ia). Приклад 25 Метил 2-етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]-імідазол-7карбоксилат (Ia) – з використанням водного гідроксиламіну 50 % (мас./мас.) водний розчин гідроксиламіну (5 мл) додавали до перемішуваної суміші нітрилу (IVa, 4,1 г, 10 ммоль), NMP (20 мл) та толуолу (5 мл), і суміш перемішували під тиском у закритій колбі при температурі 90 °C протягом 18 годин. Відповідно до ВЕРХ, суміш містить 76,3 % продукту (Ib), невиявну кількість вихідного нітрилу (IVb) та 1,8 % дезетилнітрилу (VIb). Після охолодження, суміш виливали у воду (50 мл), і потім нерозчинну фракцію відсмоктували і промивали водою (50 мл). Після сушіння, одержували 3,7 г продукту (83,2 %), що містить, відповідно до ВЕРХ, 88,5 % продукту (Ib), невиявну кількість вихідного нітрилу (IVb) та 2,7 % дезетилнітрилу (VIb). Шляхом кристалізації із 1,2-диметоксиетану одержували продукт, що містить, відповідно до ВЕРХ, 99,3 % продукту (Ia). Приклад 26 2-Етокси-1-((2'-((гідроксиаміно)імінометил)біфеніл-4-іл)метил)-1H-бензо[d]імідазол-7карбонової кислоти (If) – з використанням водного гідроксиламіну 50 % (мас./мас.) водний розчин гідроксиламіну (0,3 мл) додавали до перемішуваної суміші кислоти (IVf, 0,4 г, 1 ммоль) та ДМСО (3 мл), і суміш перемішували у пробірці при температурі 50 °C протягом 24 годин. Після охолодження, суміш виливали у воду (10 мл) та після підкислення оцтовою кислотою, відокремлену нерозчинну фракцію відсмоктували і промивали водою. Після сушіння, одержували 0,4 г продукту (91,6 %), що містить, відповідно до ВЕРХ, 86,5 % продукту (If). Шляхом повторної кристалізації із етилацетату одержували продукт, що 1 містить, відповідно до ВЕРХ, 98,7 % продукту (If) з температурою плавлення 208-212 °C. H ЯМР спектр (ДМСО-d6): 13,19 (шс, 1H, COOH), 9,22 (шс, 1H, OH), 7,65 (дд, J=7,9, 1,2 Гц, 1H, Ar), 7,53 (дд, J=7,9, 1,2 Гц, 1H, Ar), 7,45-7,32 (м, 3H, Ar), 7,35 (д, J=8,4 Гц, 2H, Ar), 7,29 (дд, J=7,6, 1,5 10 UA 113057 C2 Гц, 1H, Ar), 7,17 (т, J=7,9 Гц, 1H, Ar), 6,99 (д, J=8,4 Гц, 2H, Ar), 5,65 (с, 2H, N-CH2-Ar), 5,57 (шс, 2H, NH2), 4,61 (к, J=7,1 Гц, 2H, OCH2CH3), 1,42 (т, J=7,1 Гц, 3H, OCH2CH3). ФОРМУЛА ВИНАХОДУ 5 1. Спосіб виробництва 2-етокси-1-((2'-((гідроксіаміно)імінометил)біфеніл-4-іл)метил)-1Hбензо[d]імідазол-7-карбонової кислоти та її естерів формули I N OEt N OH N NH2 (I) RO O 10 , (І) в якій R означає або H, або (не)розгалужений C1-C4алкіл, ArCH2, Ar2CH або Ar3C, де Ar означає (не)заміщений феніл, який відрізняється тим, що відповідний нітрил формули IV N OEt N N RO 15 20 25 30 35 (IV) O , IV в якій R має значення, як визначено вище, піддають взаємодії з водним гідроксиламіном у полярному апротонному розчиннику або у суміші полярних апротонних розчинників. 2. Спосіб за п. 1, який відрізняється тим, що R означає H, метил, етил, бензил, бензгідрил або тритил. 3. Спосіб за будь-яким одним з пп. 1 і 2, який відрізняється тим, що реакцію здійснюють з водним розчином гідроксиламіну, що містить 20-80 мас. % гідроксиламіну. 4. Спосіб за п. 3, який відрізняється тим, що реакцію здійснюють з водним розчином гідроксиламіну, що містить 40-60 мас. % гідроксиламіну. 5. Спосіб за будь-яким одним з пп. 1-4, який відрізняється тим, що реакцію здійснюють при температурі від 40 до 100 °C. 6. Спосіб за п. 1, який відрізняється тим, що полярний апротонний розчинник вибирають із групи, що включає диметилсульфоксид, N,N-диметилформамід, N,N-диметилацетамід, 1метилпіролідон, 1,1,3,3-тетраметилсечовину, 1,3-диметилімідазолідин-2-он, 1,3-диметил3,4,5,6-тетрагідро-2(1H)-піримідинон та гексаметилфосфорамід, та їх суміші. 7. Спосіб за п. 6, який відрізняється тим, що згаданий розчинник є ДМСО або NMP. 8. Спосіб за будь-яким одним з пп. 1-7, який відрізняється тим, що реакційну суміш розбавляють водою або реакційну суміш виливають у воду і потім нерозчинний продукт виділяють шляхом фільтрації або центрифугування. 9. Спосіб за будь-яким одним з пп. 1-8, який відрізняється тим, що спосіб додатково включає стадію очистки сполуки формули І, яку здійснюють шляхом кристалізації з прийнятних розчинників, вибраних з групи, що включає естери аліфатичних кислот, наприклад метилацетат, етилацетат, ізопропілацетат, аміди, наприклад, N,N-диметилформамід, N,N-диметилацетамід, 1-метилпіролідон, етери, наприклад тетрагідрофуран, діоксан, 1,2-диметоксіетан, 1-метокси-2(2-метоксіетоксі)етан, та їх суміші. Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 11
ДивитисяДодаткова інформація
Автори англійськоюRadl, Stanislav
Автори російськоюРадл Станислав
МПК / Мітки
МПК: C07D 235/26
Мітки: спосіб, 2-етокси-1-((2'-((гідроксіаміно)імінометил)біфеніл-4-іл)метил)-1н-бензо[d]імідазол-7-карбонової, естерів, кислоти, виробництва
Код посилання
<a href="https://ua.patents.su/13-113057-sposib-virobnictva-2-etoksi-1-2-gidroksiaminoiminometilbifenil-4-ilmetil-1n-benzodimidazol-7-karbonovo-kisloti-ta-esteriv.html" target="_blank" rel="follow" title="База патентів України">Спосіб виробництва 2-етокси-1-((2′-((гідроксіаміно)імінометил)біфеніл-4-іл)метил)-1н-бензо[d]імідазол-7-карбонової кислоти та її естерів</a>
Попередній патент: Пристрій для вимірювання параметрів поверхні об’єкта
Наступний патент: Кристалічна форма vii агомелатину, спосіб її приготування і застосування і фармацевтична композиція, яка її містить
Випадковий патент: Регулятор витрати