Серотонінергічні похідні ерголіну і фармацевтична композиція
Номер патенту: 41880
Опубліковано: 15.10.2001
Автори: БРАМБІЛЛА Ензо, КАЧЧА Карла, КАРФАНЬЯ Нікола, МАНТЕГАНІ Серджіо
Формула / Реферат
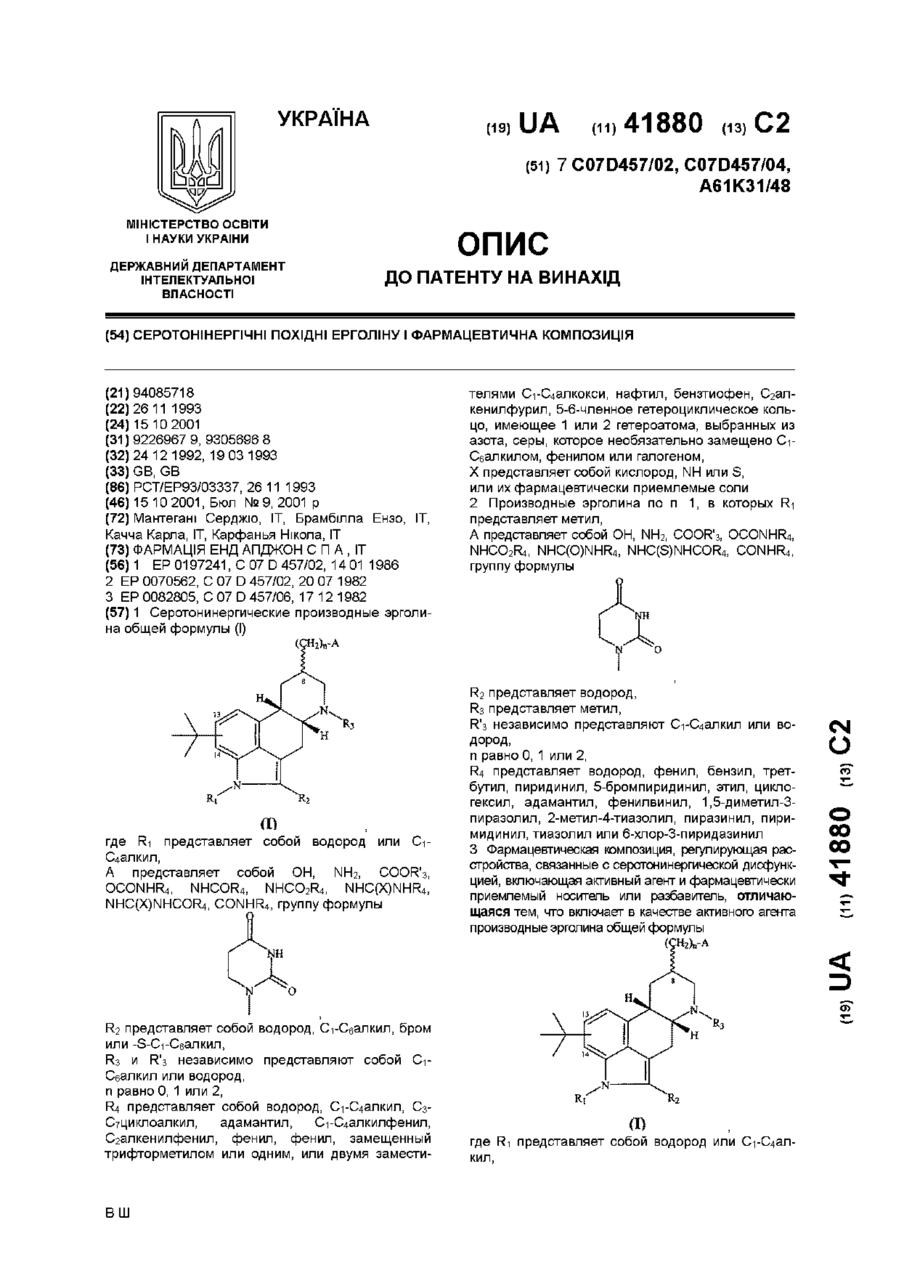
1. Серотонинергические производные эрголина общей формулы (I)
,
где R1 представляет собой водород или С1-С4алкил;
А представляет собой ОН, NH2, СООR'3, OCONHR4 NHCOR4, NHCO2R4, NHC(X)NHR4, NHC(X)NHCOR4, CONHR4, группу формулы:
,
R2 представляет собой водород, С1-С6алкил, бром или -S- С1-С6алкил;
R3 и R'3 независимо представляют собой С1-С6алкил или водород;
n равно 0, 1 или 2;
R4 представляет собой водород, С1-С4 алкил, С3-С7 циклоалкил, адамантил, С1-С4алкилфенил, С2алкенилфенил, фенил, фенил, замещенный трифторметилом или одним, или двумя заместителями С1-С4 алкокси, нафтил, бензтиофен, С2алкенилфурил, 5-6-членное гетероциклическое кольцо, имеющее 1 или 2 гетероатома, выбранных из азота, серы, которое необязательно замещено С1-С6алкилом, фенилом или галогеном;
Х представляет собой кислород, NH или S;
или их фармацевтически приемлемые соли.
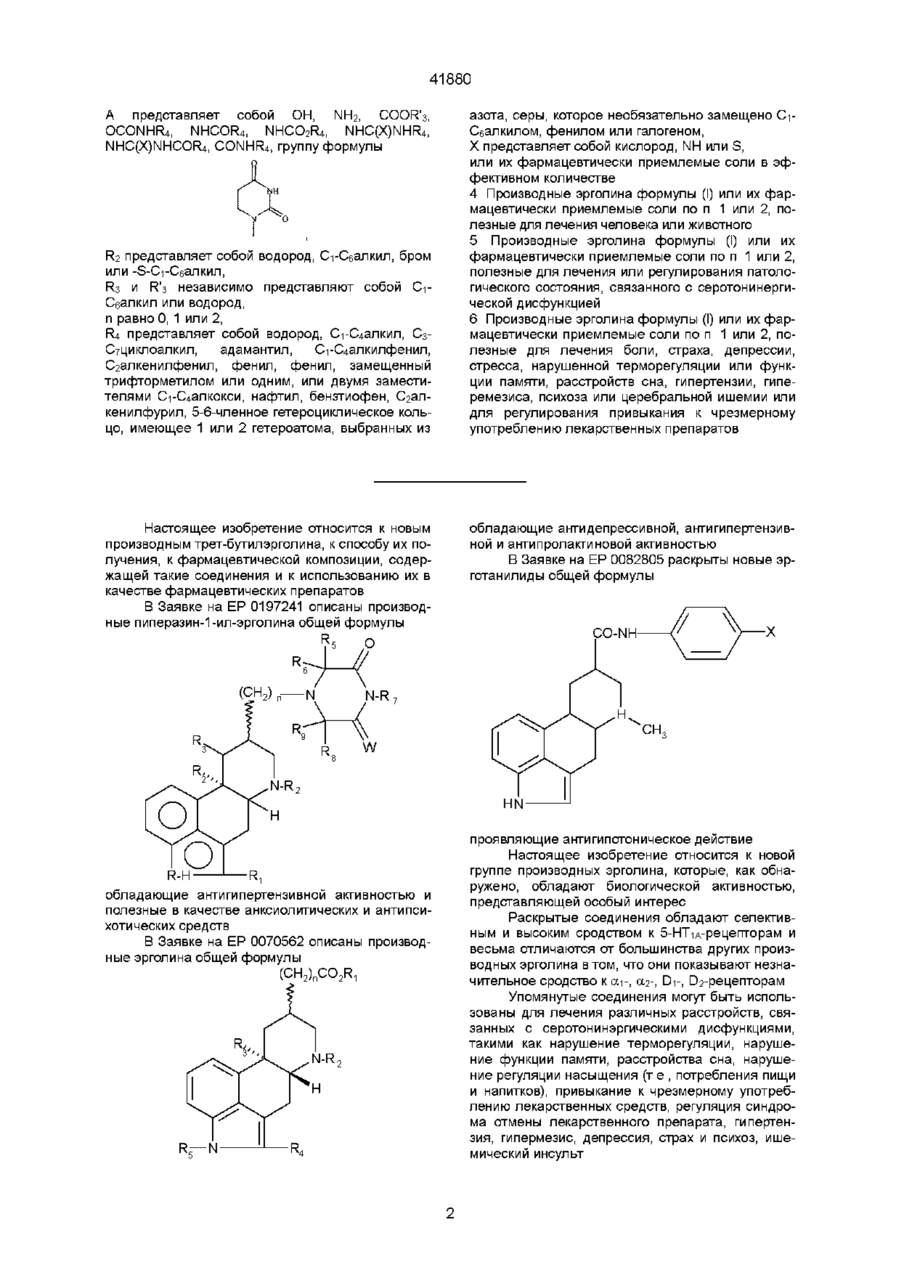
2. Производные эрголина по п. 1, в которых R1 представляет метил;
А представляет собой ОН, NH2, СООR'3, OCONHR4, NHCO2R4, NHC(O)NHR4, NHC(S)NHCOR4, CONHR4, группу формулы:
,
R2 представляет водород;
R3 представляет метил;
R'3 независимо представляют С1-С4 алкил или водород;
n равно 0, 1 или 2;
R4 представляет водород, фенил, бензил, трет-бутил, пиридинил, 5-бромпиридинил, этил, циклогексил, адамантил, фенилвинил, 1,5-диметил-3-пиразолил, 2-метил-4-тиазолил, пиразинил, пиримидинил, тиазолил или 6-хлор-3-пиридазинил.
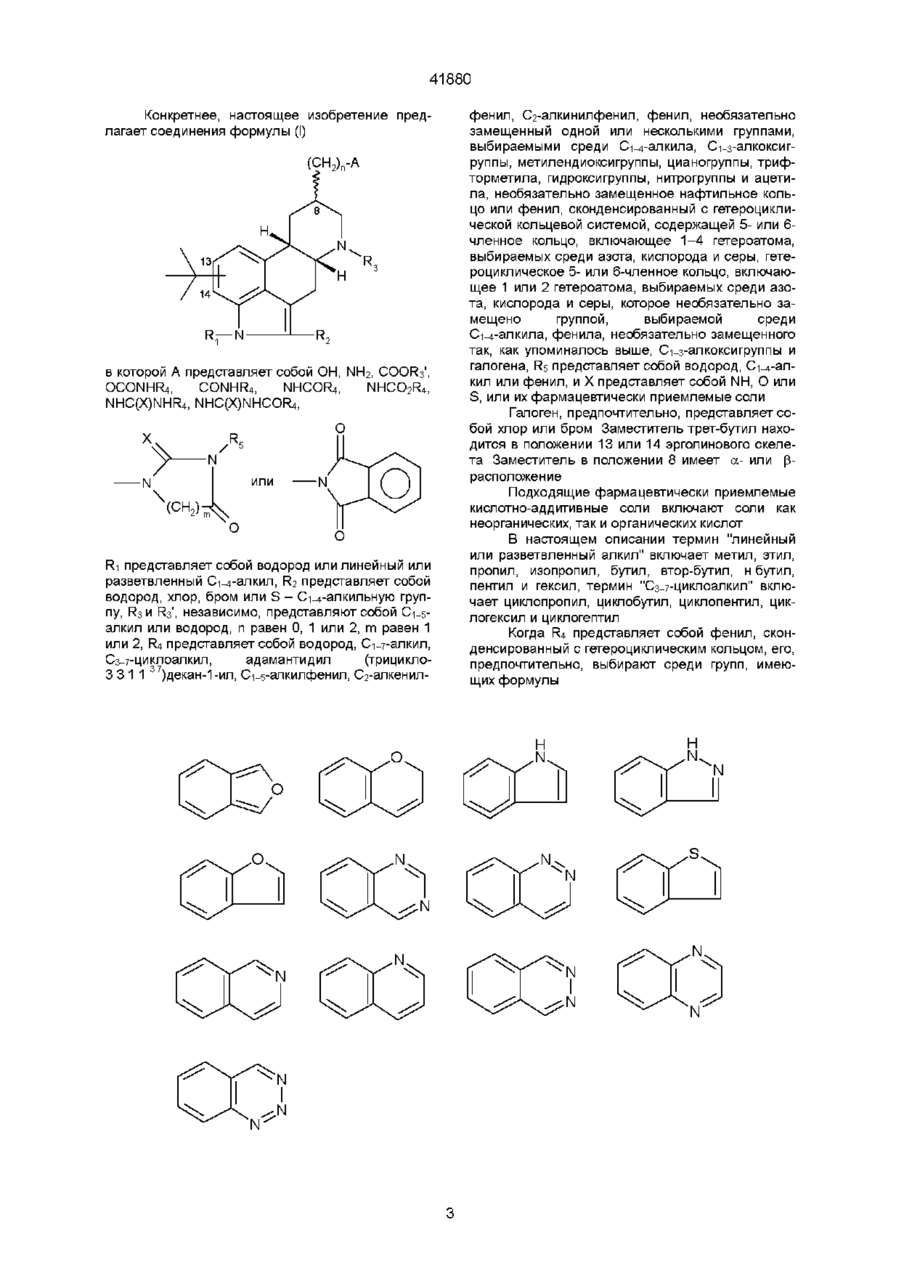
3. Фармацевтическая композиция, регулирующая расстройства, связанные с серотонинергической дисфункцией, включающая активный агент и фармацевтически приемлемый носитель или разбавитель, отличающаяся тем, что включает в качестве активного агента производные эрголина общей формулы:
,
где R1 представляет собой водород или С1-С4 алкил;
А представляет собой ОН, NH2, СООR'3, OCONHR4, NHCOR4, NHCO2R4, NHC(X)NHR4, NHC(X)NHCOR4, CONHR4, группу формулы:
,
R2 представляет собой водород, С1-С6алкил, бром или -S- С1-С6алкил;
R3 и R'3 независимо представляют собой С1-С6алкил или водород;
n равно 0, 1 или 2;
R4 представляет собой водород, С1-С4 алкил, С3-С7циклоалкил, адамантил, С1-С4алкилфенил, С2алкенилфенил, фенил, фенил, замещенный трифторметилом или одним, или двумя заместителями С1-С4 алкокси, нафтил, бензтиофен, С2алкенилфурил, 5-6-членное гетероциклическое кольцо, имеющее 1 или 2 гетероатома, выбранных из азота, серы, которое необязательно замещено С1-С6алкилом, фенилом или галогеном;
Х представляет собой кислород, NH или S;
или их фармацевтически приемлемые соли в эффективном количестве.
4. Производные эрголина формулы (I) или их фармацевтически приемлемые соли по п. 1 или 2, полезные для лечения человека или животного.
5. Производные эрголина формулы (I) или их фармацевтически приемлемые соли по п. 1 или 2, полезные для лечения или регулирования патологического состояния; связанного с серотонинергической дисфункцией.
6. Производные эрголина формулы (I) или их фармацевтически приемлемые соли по п. 1 или 2, полезные для лечения боли, страха, депрессии, стресса, нарушенной терморегуляции или функции памяти, расстройств сна, гипертензии, гиперемезиса, психоза или церебральной ишемии или для регулирования привыкания к чрезмерному употреблению лекарственных препаратов.
Текст
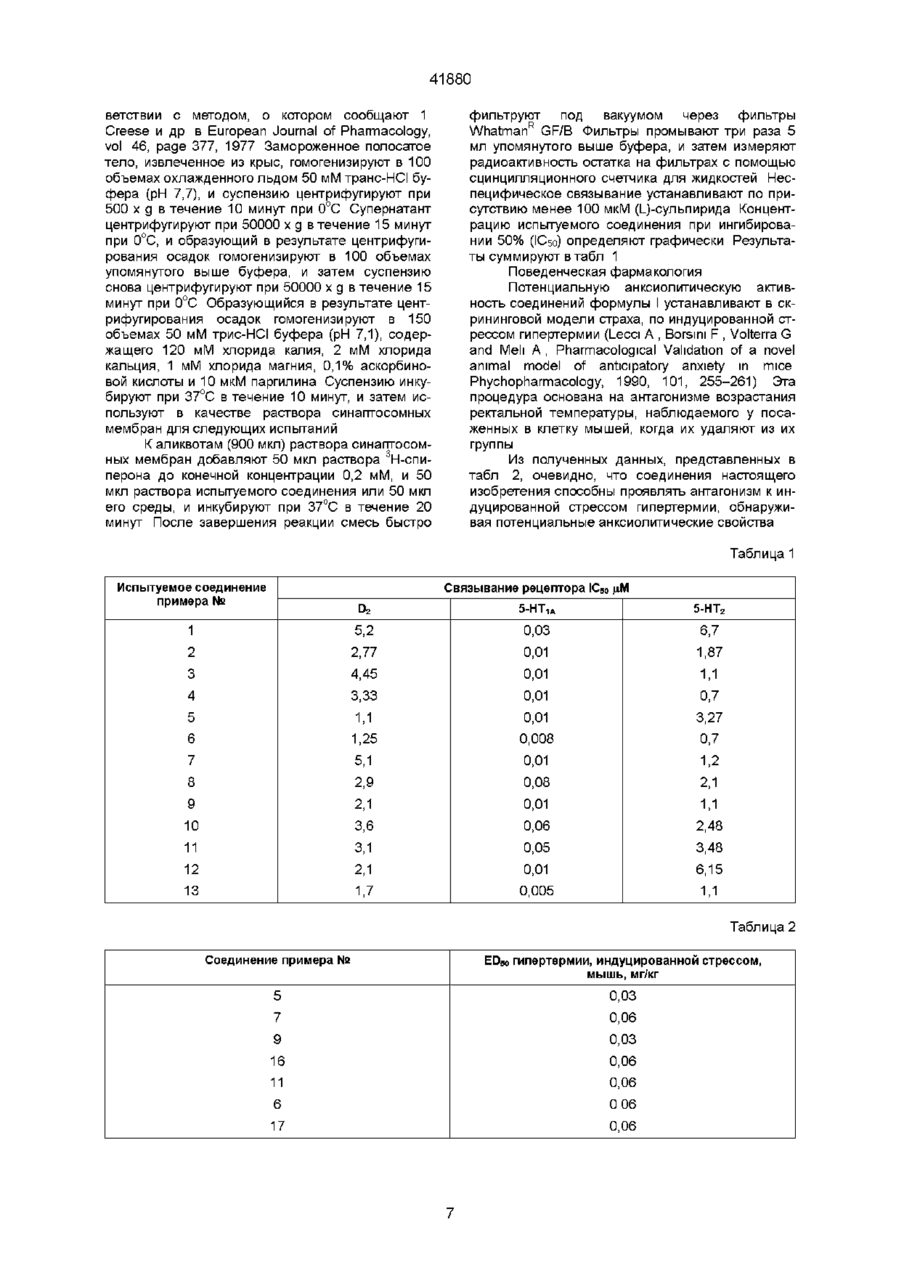
1 Серотонинергические производные эрголина общей формулы (I) телями Сі-С4алкокси, нафтил, бензтиофен, кенилфурил, 5-6-членное гетероциклическое кольцо, имеющее 1 или 2 гетероатома, выбранных из азота, серы, которое необязательно замещено d Сбалкилом, фенилом или галогеном, X представляет собой кислород, NH или S, или их фармацевтически приемлемые соли 2 Производные эрголина по п 1, в которых Ri представляет метил, А представляет собой ОН, NH2, COOR3, OCONHR4, NHCO2R4, NHC(O)NHR4, NHC(S)NHCOR4, CONHR4, группу формулы R2 представляет водород, R3 представляет метил, R^ независимо представляют СгС4алкил или водород, п равно 0, 1 или 2, R4 представляет водород, фенил, бензил, трет где Ri С4ЭЛКИЛ, представляет собой водород или d А представляет собой ОН, NH2, COOR'3, OCONHR4, NHCOR4, NHCO2R4, NHC(X)NHR4, NHC(X)NHCOR4, CONHR4, группу формулы R2 представляет собой водород, Сі-Сєалкил, бром или -S-Ci-Сбалкил, R3 и R'a независимо представляют собой d Сбалкил или водород, п равно 0, 1 или 2, R4 представляет собой водород, Сі-С4алкил, СзСуциклоалкил, адамантил, СгС4алкилфенил, Сгалкенилфенил, фенил, фенил, замещенный трифторметилом или одним, или двумя замести вш бутил, пиридинил, 5-бромпиридинил, этил, циклогексил, адамантил, фенил винил, 1,5-диметил-Зпиразолил, 2-метил-4-тиазолил, пиразинил, пиримидинил, тиазолил или 6-хлор-З-пиридазинил 3 Фармацевтическая композиция, регулирующая расстройства, связанные с серотонинергической дисфункцией, включающая активный агент и фармацевтически приемлемый носитель или разбавитель, отличающаяся тем, что включает в качестве активного агента производные эрголина общей формулы О) где Ri представляет собой водород или Сівалки л, О о 00 00 41880 А представляет собой ОН, NH2, COOR'3, OCONHR4, NHCOR4, NHCO2R4, NHC(X)NHR4, NHC(X)NHCOR4, CONHR4, группу формулы R2 представляет собой водород, Сі-Сєалкил, бром или -S-Ci-Сбалкил, R3 и R'a независимо представляют собой d Сбалкил или водород, п равно 0, 1 или 2, R4 представляет собой водород, Сі-С4алкил, СзСуциклоалкил, адамантил, СгС4алкилфенил, Сгалкенилфенил, фенил, фенил, замещенный трифторметилом или одним, или двумя заместителями Сі-С4алкокси, нафтил, бензтиофен, Сгалкенилфурил, 5-6-членное гетероциклическое кольцо, имеющее 1 или 2 гетероатома, выбранных из Настоящее изобретение относится к новым производным трет-бутилэрголина, к способу их получения, к фармацевтической композиции, содержащей такие соединения и к использованию их в качестве фармацевтических препаратов В Заявке на ЕР 0197241 описаны производные пиперазин-1-ил-эрголина общей формулы азота, серы, которое необязательно замещено d Сбалкилом, фенилом или галогеном, X представляет собой кислород, NH или S, или их фармацевтически приемлемые соли в эффективном количестве 4 Производные эрголина формулы (I) или их фармацевтически приемлемые соли по п 1 или 2, полезные для лечения человека или животного 5 Производные эрголина формулы (I) или их фармацевтически приемлемые соли по п 1 или 2, полезные для лечения или регулирования патологического состояния, связанного с серотонинергической дисфункцией 6 Производные эрголина формулы (I) или их фармацевтически приемлемые соли по п 1 или 2, полезные для лечения боли, страха, депрессии, стресса, нарушенной терморегуляции или функции памяти, расстройств сна, гипертензии, гиперемезиса, психоза или церебральной ишемии или для регулирования привыкания к чрезмерному употреблению лекарственных препаратов обладающие антидепрессивной, антигипертензивной и антипролактиновой активностью В Заявке на ЕР 0082805 раскрыты новые эрготанилиды общей формулы CO-NH N-R R-H ' R1 обладающие антигипертензивной активностью и полезные в качестве анксиолитических и антипсихотических средств В Заявке на ЕР 0070562 описаны производные эрголина общей формулы проявляющие акти гипотоническое действие Настоящее изобретение относится к новой группе производных эрголина, которые, как обнаружено, обладают биологической активностью, представляющей особый интерес Раскрытые соединения обладают селективным и высоким сродством к 5-НТіА-рецепторам и весьма отличаются от большинства других производных эрголина втом, что они показывают незначительное сродство к ой-, аг-, Dr, Ог-рецепторам Упомянутые соединения могут быть использованы для лечения различных расстройств, связанных с серотонинэргическими дисфункциями, такими как нарушение терморегуляции, нарушение функции памяти, расстройства сна, нарушение регуляции насыщения (те , потребления пищи и напитков), привыкание к чрезмерному употреблению лекарственных средств, регуляция синдрома отмены лекарственного препарата, гипертензия, гипермезис, депрессия, страх и психоз, ишемический инсульт 41880 Конкретнее, настоящее изобретение предлагает соединения формулы (I) (СН2)П-А в которой А представляет собой ОН, NH2, COOR3' OCONHR4, CONHR4, NHCOR4, NHCO2R4. NHC(X)NHR4, NHC(X)NHCOR4, X или N Ri представляет собой водород или линейный или разветвленный Сі^-алкил, R2 представляет собой водород, хлор, бром или S - Сі^-алкильную группу, R3 и R3', независимо, представляют собой C-i_5алкил или водород, п равен 0, 1 или 2, m равен 1 или 2, R4 представляет собой водород, Сі_7-алкил, Сз-7-Циклоалкил, адамантидил (трицикло3 3 1 1 37)декан-1-ил, Сі-5-алкилфенил, Сг-алкенил фенил, Сг-алкинилфенил, фенил, необязательно замещенный одной или несколькими группами, выбираемыми среди Сі^-алкила, Сі_з-алкоксигруппы, метилендиоксигруппы, цианогруппы, трифторметила, гидроксигруппы, нитрогруппы и ацетила, необязательно замещенное нафтильное кольцо или фенил, сконденсированный с гетероциклической кольцевой системой, содержащей 5- или 6членное кольцо, включающее 1-4 гетероатома, выбираемых среди азота, кислорода и серы, гетероциклическое 5- или 6-членное кольцо, включающее 1 или 2 гетероатома, выбираемых среди азота, кислорода и серы, которое необязательно замещено группой, выбираемой среди Сі^-алкила, фенила, необязательно замещенного так, как упоминалось выше, Ci-з-алкоксигруппы и галогена, Rs представляет собой водород, С-і^-алкил или фенил, и X представляет собой NH, О или S, или их фармацевтически приемлемые соли Галоген, предпочтительно, представляет собой хлор или бром Заместитель трет-бутил находится в положении 13 или 14 эрголинового скелета Заместитель в положении 8 имеет а- или ррасположение Подходящие фармацевтически приемлемые кислотно-аддитивные соли включают соли как неорганических, так и органических кислот В настоящем описании термин "линейный или разветвленный алкил" включает метил, этил, пропил, изопропил, бутил, втор-бутил, н бутил, пентил и гексил, термин "Сз-7-Циклоалкил" включает циклопропил, циклобутил, циклопентил, циклогексил и циклогептил Когда R4 представляет собой фенил, сконденсированный с гетероциклическим кольцом, его, предпочтительно, выбирают среди групп, имеющих формулы 41880 Когда F 4 представляет собой гетероцикли? ческое кольцо, его предпочтительно, выбирают среди групп, имеющих формулы N— N N —N У V Все упомянутые выше гетероциклические системы необязательно замещенные, могут быть полностью или частично восстановлены Более предпочтительными соединениями формулы I являются те соединения, в которых Ri представляет собой водород или метил, F 2 предс? тавляет собой водород, бром или S-Ci-4-алкильную группу, R3 представляет собой метил, п равен 0, 1 или 2, и А выбирают среди ОН, NH2, COOR3', NHCO2R4, NHCONHR4, CONHR4, OCONHR4, NHCONHCOR4, NHCSNHCOR4, О и N где m равен 1 или 2, R31 представляет собой C-i^алкил или водород, и R4 представляет собой фенил, бензил, трет-бутил, пиридил, 5-бромпиридил, этил, циклогексил, адамантидил, фенилвинил, 1,5диметил-3-пиразил, 2-метил-4-тиазолил, пиразинил, пиримидинил, тиазолил или 6-хлор-З-пиридазинил Предпочтительно, R3 представляет собой метильную группу Настоящее изобретение также представляет собой получения соединений формулы (I) и их кислотно-аддитивных солей, который включает (а) взаимодействие соединения формулы (II) (CH2)n-CO2R2 R —N в которой n, Ri и R3 имеют установленные выше значения, и R представляет собой Сі^-алкил или фенил, с трет-бутилирующим агентом в присутствии кислоты, отделение полученного в результате 13-изомера от 14-изомера, и удаление 2-SR-rpynпы посредством восстановителя, (і) либо гидролиз получающегося 8-карбоксилата и конденсацию образовавшейся 8-карбоновой кислоты, необязательно после активации, с амином формулы R4-NH2, в которой R4 имеет установленные выше значения, (м) либо восстановление образующегося 8карбоксилата и взаимодействие получающегося в результате 8-гидроксиметильного производного с соединением формулы R4-N=C=O или с п-нитрофенилхлоркарбонатом, и затем с соединением формулы R4-NH2, где R4 имеет установленные выше значения, (ш) либо восстановление образующегося в результате 8-карбоксилата и восстановление получающегося в результате 8-гидроксиметильного производного трифенилфосфином, диэтилазодикарбоксилатом и фталимидом, и гидролиз полученного соединения, 41880 (b) взаимодействие соединения, полученного на стадии а (ш), имеющего формулу (III) (CH2)n-NH: в которой п, R-i, R2 и R3 имеют установленные выше значения, (і) с соединением формулы (IV) R4-COOH, в которой R4 имеет установленные выше значения, или с его реакционноспособным функциональным производным, или (м) с соединением формулы (V) R4-N=C=X, или (м1) С п-нитрофенилхлоркарбонатом,и взаимодействие полученного в любом случае соединения, с соединением формулы R4-NH2, где R4 и X имеют установленные выше значения, или (ш) с соединением формулы (VI) На1-(СН2)т-СООСі 2-алкил, где т имеет установленные выше значения, и Hal означает галоген, и циклизацию полученного в результате соединения с соединением формулы R5-N=C=X, где Rs и X имеют установленные выше значения, или (iv) с соединением формулы (VII) R4OCOY, где R4 имеет установленные выше значения, и Y представляет собой хлор или п-нитрофенильную группу, или (v) с соединением формулы (VIII) R4-CON=C=X, где R4 и X имеют установленные выше значения, (c) если желательно, превращение соединения формулы (I), полученного таким образом, в другое соединение формулы (I) и/или, если желательно, превращение свободного соединения формулы (І) в его кислотно-аддитивную соль, и (d) извлечение получающегося в результате соединения формулы (I) как такового или в виде его кислотно-аддитивной соли Трет-бутилирующий агент, применяемый на стадии (а), может представлять собой, например, изобутен или трет-б ути л ацетат Подходящей кислотой для этой стадии является три фтору ксусная кислота Подходящим восстановителем для стадии (а) является никель Ренея Когда 8-карбоновую кислоту, полученную на стадии (a)-(i), активируют, подходящим образом этот процесс осуществляют путем взаимодействия с таким соединением, как смешанный ангидрид, ацилазид или N.N'-замещенная изомочевина Соединение формулы (І), в котором R2 представляет собой водород, может быть хлорировано или бромировано с целью получения соединения формулы (І), в котором R2 представляет собой хлор или бром Соединение формулы (І), в котором Ri представляет собой водород, может быть N-алки лировано с получением соединения формулы (I), в котором Ri представляет собой Сі^-алкил Соединение формулы (І), в котором заместитель X в заместителе А представляет собой серу, может быть превращено в соответствующее соединение формулы (І), в котором X представляет собой кислород, путем обработки солью серебра Процесс стадии (Ь) может быть осуществлен в соответствии со стандартной методикой Подходящие реакционноспособные функциональные производные соединений формулы (IV) включают соответствующие галоидангидриды, имидазолиды, ацилазиды Взаимодействие с ацилгалогенидами подходящим образом осуществляют в присутствии органического основания, такого как пиридин или этиламин Взаимодействие с имидазолидами (полученными взаимодействием соединений формулы (IV) с г\І,І\І-карбонилдиимидазолом) подходящим образом осуществляют в инертном растворителе, таком как тетрагидрофуран Реакцию с ацилазидами (полученными взаимодействием соединения формулы (IV) с дифенилфосфороилазидом DPPA) подходящим образом осуществляют в инертном растворителе, таком как тетрагидрофуран, при 0°С в присутствии органического основания, такого кактриэтиламин Взаимодействие с соединениями формулы (V) или (VIII) (которые можно получить, например, исходя из соединения формулы (IV) по известным реакциям) подходящим образом осуществляют в инертном растворителе, таком как тетрагидрофуран или диоксан, при температуре в интервале от 65доЮ0°С Взаимодействие с п-нитрофенилхлоркарбонатом может быть осуществлено в инертном растворителе, таком как тетрагидрофуран или метиленхлорид, при температуре от 0°С до 30°С, в присутствии основания, такого как триэтиламин или карбонат калия Взаимодействие с соединением формулы R4-NH2 под индексом (м1) или взаимодействие с соединениями формулы (VI) осуществляют подходящим образом в инертном растворителе, таком как диметилформамиде или тетрагидрофуран, при температуре от 30°С до 100°С Циклизацию по п (ш) предпочтительно осуществляют путем нагревания в растворителе подобном диоксану или толуолу, или путем плавления при пониженном давлении Взаимодействие с соединением формулы (VII) выполняют в инертном растворителе, таком как пиридин или тетрагидрофуран, при комнатной температуре в присутствии органического основания, такого кактриэтиламин Хлорирование или бромирование соединения формулы (І), в котором R2 представляет собой водород, может быть осуществлено по известным методикам с использованием стандартных хлорирующих или бромирующих агентов, таких как N-CI или N-Br-сукцинимид или сульфурилхлорид Реакцию обычно осуществляют в инертном растворителе, таким как хлорформ, метиленхлорид или тетрагидрофуран N-Алкилирование соединения формулы (I), в котором Ri представляет собой водород, может быть осуществлено в соответствии с известными 41880 методами N-алкилирования индолов, например, при использовании соединения формулы (IX) R-iZ, в котором Ri представляет собой Сі^-алкил, и Z представляет собой отщепляющуюся группу, такую как хлор, бром, йод Реакцию обычно осуществляют в инертном растворителе, таком как диметилсульфоксид, и в присутствии сильного основания, такого как гидроксид калия или натрия Конверсия заместителя X от серы в кислород может быть осуществлена в подходящем растворителе, таком как этанол или раствор метансульфоновой кислоты в воде, причем соль серебра представляет собой нитрат или сульфат серебра Исходные соединения формул (II), (IV), (V), (VI), (VII), (VIII), (IX) и амин формулы R4NH2 являются известными соединениями, или могут быть получены хорошо известными способами, исходя из известных соединений Соединения настоящего изобретения проявляют удивительные фармацевтические свойства Испытания на связывание показывают, что соединения общей формулы (I) обладают высоким и селективным сродством к 5-НТід-рецепторньім участкам, имеющим агонистическую или антагонистическую активность на главном уровне Соединения настоящего изобретения могут найти применение при оказании помощи при страхе, депрессии, шизофрении и боли (Pharmacology and Toxicology 1989, 64, р 3-5, Drug of the future, 1988, 13 (5), p 429-437 J Neural Transm , 1988, 74, p 195-198), для лечения стресса (Neuropharmac, 1989, 25 (5), p 471-476), и облегчения синдрома отмены лекарственного препарата (абстинентного синдрома) - благодаря подавлению бензодиазепинов, кокаина, спирта и никотина, или для модификации всасывания пищи и секусуального поведения (J Receptor Research, 1988, 8, р 59-81), и для облегчения боли при нейронных повреждениях, следующих за церебральной ишемией, действуя как нейропротектанты (Stroke 1990, 21 (IV) р 161, J Cereb Blood Flow Metabol 1911, 11 (II) p 426, Pharmacology of cerebral ischemia, 1990, Suttgart, 1990, p 493-497) Следующие далее эксперименты иллюстрируют профиль связывания соединений общей формулы I Эксперимент 1 Сродство к серотонину 1А(5-НТід)-рецептора (испытание связывания 3Н-8-гидрокси-2-дипропиламинотетралина (3H-8-OH-DPAT)) Приготовление неочищенной синагтгосомной фракции и анализ связывания проводят в соответствии со способом, о котором сообщают Hall и др в Journal of Neurochemistry, vol 44, page 1685, 1985 Замороженный гиппокампус, извлеченный из крыс, гомогенизируют в 40 объемах охлажденного льдом 50 мМ трис-НСІ буфера (рН 7,4), и суспензию центрифугируют при 500 х g в течение 10 минут при 0°С Супернатант центрифугируют при 40000 х g в течение 20 минут при 0°С, и образующийся после центрифугирования осадок гомогенизируют в 40 объемах вышеупомянутого буфера и инкубируют при 37°С в течение 10 минут После завершения реакции суспензию центрифугируют при 40000 х g в течение 20 минут при 0°С Образующийся в результате осадок дважды промывают путем повторного суспендирования в 40 объемах вышеупомянутого буфера и центрифугирования, и в заключение суспендируют в 60 объемах охлажденного льдом 50 мМ трис-НСІ буфере (рН 7,4), содержащего 1мМ хлорида марганца для использования в следующем испытании К аликвотам (900 мкл) раствора синаптосомных мембран добавляют 50 мкл раствора тритированного 8-OH-DPAT до конечной концентрации 0,2 мМ, и 50 мкл раствора испытуемого соединения или 50 мкл его среды, и инкубируют в течение 10 минут при 37°С Затем к смеси добавляют 5 мл охлажденного льдом 50 мМ трис-НСІ буфера (рН 7,4, быстро фильтруют под вакуумом через фильтры WhatmanR GF/B и промывают дважды 5 мл того же буфера Радиоактивность остатка на фильтрах измеряют сцинтилляционным счетчиком для жидкости Неспецифическое связывание устанавливают по присутствию менее 10 5 М серотонина (5-НТ) Концентрацию испытуемого соединения при 50% ингибирования (ICso) определяют графически Результаты суммируют в табл 1 Эксперимент 2 Сродство к серотонину 2(5-НТ2)-рецептора (испытание на связывание 3Н-кетонсерина) Получение неочищенной синагтгосомной фракции и анализ связывания проводят в соответствии с методом, о котором сообщают Leysen и др в Molecular Pharmacology, vol 21, page 301, 1981 Замороженную кору головного мозга, извлеченную из крыс, гомогенизируют в 30 объемах охлажденного льдом 0,32 М раствора сахарозы, и суспензию центрифугируют при 1000 х g в течение 10 минут при 0°С Супернатант центрифугируют при 4000 х g в течение 20 минут при 0°С, и образующийся в результате центрифугирования осадок гомогенизируют в 30 объемах охлажденного льдом 50 мМ трис-НСІ буфера (рН 7,7), и инкубируют при 37°С в течение 10 минут Суспензию снова центрифугируют при 40000 х g в течение 20 минут при 0°С Полученный в результате центрифугирования осадок гомогенизируют в 100 объемах вышеупомянутого буфера и используют в качестве раствора синаптосомных мембранных в следующем испытании К аликвотам (900 мкл) раствора синаптосомных мембран добавляют 50 мкл раствора 3Н-кетансерина до конечной концентрации 0,2 мМ, и 50 мкл испытуемого соединения или его среды и инкубируют при 37°С в течение 20 минут После завершения реакции смесь быстро фильтруют под вакуумом через фильтры Whatman GF/B Фильтры три раза промывают 5 мл упомянутого выше буфера, и затем измеряют радиоактивность осадка, оставшегося на фильтрах, с помощью сцинтилляционного счетчика для жидкостей Неспецифическое связывание устанавливают по присутствию менее 10 мкМ миансерина Концентрацию испытуемого соединения при 50% ингибирования (ICso) определяют графически Результаты суммируют в таблице 1 Эксперимент 3 Сродство к допамину 2(О2)-рецептора (испытания на связывание 3Н-спиперона) Получение неочищенной синаптосомной фракции и анализ связывания проводят в соот 41880 ветствии с методом, о котором сообщают 1 Creese и др в European Journal of Pharmacology, vol 46, page 377, 1977 Замороженное полосатое тело, извлеченное из крыс, гомогенизируют в 100 объемах охлажденного льдом 50 мМ транс-НСІ буфера (рН 7,7), и суспензию центрифугируют при 500 х g в течение 10 минут при 0°С Супернатант центрифугируют при 50000 х g в течение 15 минут при 0°С, и образующий в результате центрифугирования осадок гомогенизируют в 100 объемах упомянутого выше буфера, и затем суспензию снова центрифугируют при 50000 х g в течение 15 минут при 0°С Образующийся в результате центрифугирования осадок гомогенизируют в 150 объемах 50 мМ трис-НСІ буфера (рН 7,1), содержащего 120 мМ хлорида калия, 2 мМ хлорида кальция, 1 мМ хлорида магния, 0,1% аскорбиновой кислоты и 10 мкМ паргилина Суспензию инкубируют при 37°С в течение 10 минут, и затем используют в качестве раствора синаптосомных мембран для следующих испытаний К аликвотам (900 мкл) раствора синаптосомных мембран добавляют 50 мкл раствора 3Н-спиперона до конечной концентрации 0,2 мМ, и 50 мкл раствора испытуемого соединения или 50 мкл его среды, и инкубируют при 37°С в течение 20 минут После завершения реакции смесь быстро фильтруют под вакуумом через фильтры WhatmanR GF/B Фильтры промывают три раза 5 мл упомянутого выше буфера, и затем измеряют радиоактивность остатка на фильтрах с помощью сцинцилляционного счетчика для жидкостей Неспецифическое связывание устанавливают по присутствию менее 100 мкМ (І_)-сульпирида Концентрацию испытуемого соединения при ингибировании 50% (IC50) определяют графически Результаты суммируют в табл 1 Поведенческая фармакология Потенциальную анксиолитическую активность соединений формулы I устанавливают в скрининговой модели страха, по индуцированной стрессом гипертермии (Lecci A , Borsmi F , Volterra G and Meh A , Pharmacological Validation of a novel animal model of anticipatory anxiety in mice Phychopharmacology, 1990, 101, 255-261) Эта процедура основана на антагонизме возрастания ректальной температуры, наблюдаемого у посаженных в клетку мышей, когда их удаляют из их группы Из полученных данных, представленных в табл 2, очевидно, что соединения настоящего изобретения способны проявлять антагонизм к индуцированной стрессом гипертермии, обнаруживая потенциальные анксиолитические свойства Таблица 1 Испытуемое соединение примера № D2 5-НТ1А 5-НТ2 1 5,2 0,03 6,7 2 2,77 0,01 1,87 3 4,45 0,01 1,1 4 3,33 0,01 0,7 Связывание рецептора IC50 цМ 5 1,1 0,01 3,27 6 1,25 0,008 0,7 7 5,1 0,01 1,2 8 2,9 0,08 2,1 9 2,1 0,01 1,1 10 3,6 0,06 2,48 11 3,1 0,05 3,48 12 2,1 0,01 6,15 1,7 0,005 1,1 13 Таблица 2 Соединение примера № ED50 гипертермии, индуцированной стрессом, мышь, мг/кг 5 0,03 7 0,06 9 0,03 16 0,06 11 0,06 6 0 06 17 0,06 41880 Токсичность соединений настоящего изобретения в самом деле является незначительной, и они, следовательно, могут безопасно использоваться в качестве полезных лекарственных препаратов В соответствии с настоящим изобретением пациента лечат по способу, заключающемуся во введении пациенту эффективного количества соединения формулы I или его фармацевтически приемлемой соли Соединение формулы I или его фармацевтически приемлемая соль могут быть использованы для регуляции состояний, которые можно отнести за счет серотонинэргических дисфункций, таких как ухудшение терморегуляции или функции памяти, расстройства сна, привыкание к чрезмерному употреблению лекарственных средств, гипертензия, гиперемезис, депрессия, страх или психоз, или регуляция насыщения или синдром отмены лекарственного препарата, церебральная ишемия Изобретение также предлагает фармацевтическую композицию, включающую производное эрголина общей формулы I или его фармацевтически приемлемую соль в смеси с фармацевтически приемлемым разбавителем или носителем Соединения формулы I и их соли, описанные здесь, могут быть введены парентеральным или оральным способом, предпочтительно оральным способом В зависимости от способа введения, композиции могут находиться в твердой, полутвердой или жидкой форме дозировочной форме такой как, например, таблетки, пилюли, капсулы, порошки, жидкости, суспензии и т п Композиция может включать обычные фармацевтические носители, адъюванты и т д Дозировка настоящих лекарственных средств изменяется в соответствии с полом, возрастом, состоянием или медицинскими картами пациентов, а также в соответствии со способом или целью введения Вообще, лекарственные препараты могут вводиться как единичные дозы или в виде раздельных доз, чтобы обеспечить, скажем, 0,1-10 мг/кг веса тела в день эффективного ингредиента, предпочтительно - 0,1-5 мг/кг веса тела Фармацевтические композиции, содержащие соединения изобретения, готовят обычными способами с обычными ингредиентами Так, для орального введения, фармацевтические композиции, содержащие соединения изобретения, представляют собой, предпочтительно, таблетки, пилюли или капсулы, которые содержат активное вещество вместе с разбавителями, такими как, например, лактоза, декстроза, маннит, сорбит, сахароза, целлюлоза, смазывающими веществами, например, кремнеземом, тальком, стеариновой кислотой, стеаратом кальция или магния или полиэтиленгликолями, или они также могут содержать связывающие вещества, такие, как, например, крахмалы, желатин, метилцеллюлоза, аравийская камедь, трагакант, поливинилпирролидон, диспергирующие средства, такие как, например, крахмалы, альгиновая кислота, альгинаты, вспенивающую смесь, красящее вещество, подслащивающие вещества, смачиватели, такие как, например, лецитин, полисорбаты, лаурилсульфаты, и вообще нетоксичные и фармакологи чески неактивные вещества, применяемые при изготовлении фармацевтических препаратов Упомянутые фармацевтические препараты могут быть изготовлены известными способами, например, посредством процессов смещения, гранулирования, таблетирования, нанесения сахарного или пленочного покрытия Упомянутые фармацевтические формулировки, содержащие соединения изобретения, также могут быть изготовлены известными способами, и они могут представлять собой, например, сироп или капли для орального введения, стерильные растворы для инъекций или суппозитории Следующие далее примеры иллюстрируют изобретение Пример 1. 2-Тиометил-6-метил-8р-метоксикарбонил(13,14)-трет-бутилэрголин (I Ri = Н, R2 = SCH3, R3 = СНз, А = СО2СН3, п = 0) К раствору 23 г 2-ти о мети л-6-мети л-8 рметоксикарбонилэрголина в 230 мл трифгоруксусной кислоты добавляют по каплям 24,5 мл третбутилацетата Образующийся в результате раствор нагревают при 40°С в течение 5 часов Растворитель испаряют, и темный остаток обрабатывают этилацетатом и 0,1 N гидроксидом аммония Органическую фазу промывают соляным раствором и сушат (Na2SO4) Растворитель удаляют, и пенистый остаток растворяют в минимальном количестве метанола Посредством охлаждения кристаллизуют 13,7 г 13-производного, т пл 259261 °С Посредством хроматографирования маточной жидкости получают 4,2 г соответствующего 14-производного, т пл 280-283°С Пример 2. 6-Метил-8р-метоксикарбонил-13-трет-бутилэрголин (I Ri = R2 = Н, R3 = СНз, А = СО2СН3, п = 0) К кипящему с обратным холодильником раствору 5,75 г 2-тиометил-6-метил-13-трет-бутилэрголина в 300 мл метанола в атмосфере азота добавляют частями 10 г никеля Ренея После 10-минутного кипячения кипящую смесь фильтруют, и Ni Ренея тщательно промывают метанолом Растворитель удаляют, и остаток кристаллизуют из этилацетата, и получают 4,3 г названного в заголовке соединения, т пл 175-177°С Пример 3. 6-Метил-8р-гидроксиметил-13-трет-бутилэрголин (I Ri = R2 = Н, R3 = СНз, А = ОН, п = 1) К раствору 4,5 г борогидрида натрия в 50 мл метанола добавляют по каплям раствор 4,5 г 6-метил-8р-метоксикарбонил-13-трет-бутилэрголина в 30 мл метанола Получающуюся в результате суспензию при перемешивании нагревают при 50°С в течение 1 часа Образующийся в результате мутный раствор разбавляют 200 мл воды, и затем экстрагируют хлороформом Органическую фазу промывают соляным раствором и сушат Упаривание растворителя и кристаллизация из этанола дают 3,3 г названного в заголовке соединения, т пл 240-243°С Пример 4 6-Метил-8р-аминометил-13-трет-бутилэрголин (I Ri = R2 = H, R3 = СНз, А = NH2, n = 1) 41880 К суспензии 3 г 6-мети л-8 р-гид роке и мети л13-бутилэрголина, 3 г трифенилфосфина и 2 г фталимида в 30 мл тетрагидрофурана при перемешивании добавляют по каплям раствор 2,35 г диэтилазодикарбоксилата в 20 мл тетрагидрофурана Перемешивание продолжают в течение 2 часов, затем образовавшийся в результате оранжевый раствор разбавляют 200 мл 0,1 метансульфоновой кислоты и экстрагируют етилацетатом Водную фазу подщелачивают гидроксидом аммония и затем экстрагируют этилацетатом После промывания соляным раствором и высушивания раствор концентрируют при пониженном давлении, и получают 4 г 6-метил-8р-фталимидометил13-трет-бутилэрголина, т пл 132-137°С К раствору, содержащему это фталимидное производное в 100 мл этанола, добавляют 10 мл 98% гидразингидрата После перемешивания в течение 3 часов суспензию фильтруют, и фильтрат после упаривания растворителя растворяют в этилацетате, и раствор тщательно промывают 0,1 N гидроксидом натрия Органическую фазу промывают соляным раствором и сушат Концентрацией раствора получают 2,4 г названного в заголовке соединения, т пл 321-233°С Пример 5. 6-Метил-8р-бензоиламинометил-13-трет-бутилэрголин (I Ri = R2 = H, R3 = СН3, А = NHCOPh, п = 1) К раствору 2 г 6-метил-8р-аминометил-13трет-бутилэрголина в 50 мл пиридина добавляют 0,95 гбензоилхлорида После перемешивания при комнатной температуре в течение 3 часов образующийся в результате раствор разбавляют этилацетатом и промывают 0,1 N раствором гидроксида натрия и затем соляным раствором После высушивания растворитель удаляют, и остаток растворяют в обработанном углем метаноле, затем дважды кристаллизуют из ацетона, и получают 2,4 г названного в заголовке соединения, т пл 190-193°С Пример 6 6-Мети л-8р-фен ил ацетилам и нометил-13трет-бутилэрголин (I Ri = R2 = Н, R3 = СН3, А = NHCOCH2Ph, n = 1) Действуя как в примере 5, но используя вместо бензоилхлорида фенилацетилхлорида получают названное в заголовке соединение с выходом 74%, т пл 165-167°С Пример 7. 6-Метил-8р-пивалоиламинометил-13-третбутилэрголин (I Ri = R2 = Н, R3 = СН3, А = NHCO+, п = 1) Действуя как в примере 5, но используя вместо бензоилхлорида пивалоилхлорид, получают названное в заголовке соединение с выходом 60%, т пл 235-238°С Пример 8. 6-Метил-8р-изоникотиноиламинометил-13трет-бутилэрголин (I Ri = R2 = Н, R3 = СН 3 , А = NHCOC5H4N, п = 1) Действуя как в примере 5, но используя вместо бензоилхлорида гидрохлорид изоникотиноилхлорида, получают названное в заголовке соединение с выходом 45%, т пл 241-243°С Пример 9. 6-Метил-8р-(5-бромникотиноил)аминометил13-трет-бутилэрголин (I Ri = R2 = H, R3 = СН3, А = NHCOC5H3NBr, n = 1) Действуя как в примере 5, но используя вместо бензоилхлорида гидрохлорид 5-бромникотиноилхлорида, получают названное в заголовке соединение с выходом 75%, т пл 285-287°С. Пример 10. 6-Метил-8р-бензилоксикарбониламинометил13-трет-бутилэрголин (I Ri = R2 = I, R3 = СН3, А = NHCOOPh, n = 1) Действуя как в примере 5, но используя вместо бензоилхлорида бензилоксикарбонилхлорид, получают названное в заголовке соединение с выходом 55%, т пл 139-142°С Пример 11 6-Метил-8р-этоксикарбониламинометил-13трет-бутилэрголин (I Ri = R2 = Н, R3 = СН 3 , А = NHCO2C2H5, п = 1) Действуя как в примере 5, но используя вместо бензоилхлорида этоксикарбонилхлорид, получают названное в заголовке соединение с выходом 80%, т пл 235-237°С Пример 12. 6-Метил-8р-фениламинокарбониламинометил-13-трет-бутилэрголин (I Ri = R2 = Н, R3 = СН3, А = NHCONHPh, n = 1) К раствору 3,2 г 6-метил-8р-аминометил-13трет-бутилэрголина в 50 мл диоксана добавляют 1,5 г фенилизоцианата Образующийся в результате раствор кипятят с обратным холодильником в течение 1 часа Растворитель удаляют, и остаток хроматографируют на прокладке из силикагеля, элюируя хлороформом После упаривания растворителя и кристаллизации из этанола получают названное в заголовке соединение с выходом 70%, т пл 238-240°С Пример 13. 6-Метил-8р-циклогексилкарбониламинометил-13-трет-бутилэрголин (I Ri = R2 = Н, R3 = СН3, А = NHCOCeHu, n = 1) К раствору 1,92 г циклогексанкарбоновой кислоты в 30 мл тетрагидрофурана добавляют 1,7 г карбонилдиимидазола Полученный в результате раствор нагревают при 50°С в течение 10 минут К образующемуся в результате прозрачному раствору добавляют 3,1 г 6-метил-8р-аминометил-13трет-бутилэрголина, и нагревание продолжают в течение 3 часов Растворитель удаляют испарением, остаток обрабатывают этилацетатом и промывают насыщенным раствором гидрокарбоната натрия После промывания соляным раствором и сушки получающийся в результате раствор концентрируют, и получают 3,8 г названного в заголовке соединения, т пл 151-154°С Пример 14. 6-Метил-8р-(1-адамантил)карбониламинометил-13-трет-бутилэрголин (I Ri = R2 = Н, R3 = СН3, А = NHCOAd, n = 1) Действуя как в примере 13, но используя вместо циклогексанкарбоновой кислоты адамантан-1-карбоновую кислоту, получают названное в заголовке соединение с выходом 60%, т пл 240243°С 41880 Пример 15. 6-Метил-8р-(3-фенил)акрилоиламинометил13-трет-бутилэрголин (I Ri = R2 = H, R3 = СН3, А = NHCOC2H2Ph, n = 1) Действуя как в примере 13, но используя вместо циклогексанкарбоновой кислоты 3-(фенил)акриловую кислоту, получают названное в заголовке соединение с выходом 35%, с т пл 190— 191 °С Пример 16. 6-Метил-8р-(1,5-диметил-3-пиразоил)аминометил-13-трет-бутилэрголин (I Ri = R2 = H, R3 = СНз, А = NHCOC3HN2(CH3)2, n = 1) К раствору 2,2 г 1,5-диметилпиразол-З-карбоновой кислоты и 1,5 мл триэтиламина в 20 мл диметилформамида при 0°С добавляют по каплям 1,1 г этилхлоркарбоната После перемешивания в течение 5 минут добавляют по каплям раствор 3,1 г 6-метил-8раминометил-13-трет-бутилэрголина в 20 мл диметилформамида, и образующийся в результате раствор перемешивают в течение ночи при комнатной температуре После удаления растворителя остаток обрабатывают метиленхлоридом, и раствор промывают раствором 0,1 N гидроксида натрия После промывания соляным раствором и сушки растворитель удаляют, и остаток дважды кристаллизуют из ацетона, получают 2,7 г названного в заголовке соединения, т пл 262-265°С Пример 17. 6-Метил-8р-(2-метил-4-тиазоил)аминометил13-трет-бутилэрголин (I Ri = R2 = H, R3 = СН3, А = NHCOC3H2NS(CH3), n = 1) Действуя как в примере 16, но используя вместо 1,5-диметилпиразол-З-карбоновой кислоты 2-метил-4-ти а зол карбоновую кислоту, получают названное в заголовке соединение с выходом 45%, т пл 265-268°С Пример 18. 6-Метил-8р-бензоиламиноэтил-13-трет-бутилэрголин (I Ri = R2 = H, R3 = СН3, А = NHCOPh, n = =2) Действуя как в примерах 1-5, но используя в качестве исходного вещества 2-тиометил-6-метил8р-метоксикарбонилметилэрголин вместо 2-тиометил-6-метил-8р-метоксикарбонилэрголина, получают названное в заголовке соединение с выходом 55%, т пл 187-189°С Пример 19. 2-Бром-6-метил-8р-бензоиламинометил-13трет-бутилэрголин (I Ri = Н, R2 = Br, R3 = СН3, А = NHCOPh, n = 1) К раствору 2 г 6-метил-8р-бензоиламинометил-13- трет-бутилэрголина в 75 мл диоксана добавляют порциями 0,9 г N-бромсукцинимида После перемешивания при 40°С в течение 2 часов растворитель удаляют, и остаток хроматографируют на силикагеле, элюируя этилацетатом После кристаллизации из изопропанола получают 1,3 г названного в заголовке соединения, т пл 151-155°С Пример 20 6-Метил-8р-аминометил-14-трет-бутилэрголин (I Ri = R 2 = H, R3 = CH3, A = NH2, n = 1, 14-изомер) Действуя как в примерах 2-4, но используя в качестве исходного вещества 2-тиометил-6-метил8р-метоксикарбонил-14 -трет-бутилэрголин, получают названное в заголовке соединение, т пл 215-217°С Пример 21. 6-Метил-8р-бензоиламинометил-14-трет-бутилэрголин (I Ri = R2 = H, R3 = СН3, А = NHCOPh, п = 1, 14-изомер) Действуя как в примере 5, но используя 6метил-8р-аминометил-14-трет-бутилэрголин, получают названное в заголовке соединение с выходом 80%, т пл 173-175°С Пример 22. 6-Метил-8р-карбокси-13-трет-бутилэрголин (I Ri = R2 = Н, R3 = СН3, А = СО2Н, п = 0) К раствору 6,2 г 6-метил-8р-метоксикарбонил-13-трет-бутилэрголина в 50 мл метанола при перемешивании добавляют по каплям 20 мл 1М NaOH После выдерживания при комнатной температуре в течение 2 часов, растворитель удаляют, и остаток разбавляют 100 мл Н2О и обрабатывают 20 мл 1 М HCI Образующийся в результате осадок отфильтровывают, промывают водой, затем кристаллизуют из кипящего метанола, и получают 5,1 г названного в заголовке соединения, т пл 237-239°С Пример 23. 6-Метил-8р-(2-пиразинил)-аминокарбонил13-трет-бутилэрголин (I Ri = R2 = H, R3 = СН3, А = CONHCH4H3N2, n = 0) К раствору 4 г 6-метил-8р-карбокси-13-третбутилэрголина и 1,7 г N-гидроксибензотриазола в 50 мл диметилформамида добавляют 2,5 г дициклогексилкарбодиимида, и образующийся в результате раствор перемешивают при 0°С в течение получаса, затем оставляют нагреваться до комнатной температуры и обрабатывают 1,2 г 2 аминопиразина Образующийся в результате мутный раствор греют при 80°С в течение 5 часов, и затем удаляют растворитель Остаток обрабатывают этилацетатом и промывают насыщенным раствором гидрокарбоната натрия После промывания соляным раствором и сушки удаляют растворитель, и сырую реакционную смесь хроматографируют на силикагеле, элюируя метиленхлоридом Кристаллизация из ацетона дает 3,7 г названного в заголовке соединения, т пл 271-273°С Пример 24. 6-Метил-8р-(2,6-диметил-4-пиримидинил)аминокарбонил-14-трет-бутилэрголин (I Ri = R2 = Н, R3 = СН3, А = CONHC4N2(CH3)2, n = 0, 14-изомер) Действуя как в примерах 22 и 23, но используя вместо 6-метил-8р-метоксикарбонил-13-третбутилэрголина 6-метил-8р-метоксикарбонил-14трет-бутилэрголин, а вместо 2-аминопиразина-2,6диметил-4-аминопиримидин, получают названное в заголовке соединение с выходом 45%, т пл 284-287°С Пример 25 6-Метил-8р-(2-тиазолидинил)аминокарбонил13-трет-бутилэрголин (I Ri = R2 = H, R3 = СН3, А = CONHC3H2NS, n = 0) 10 41880 Пример 31. г\|-/(6-Метилэрголин-14-трет-бутил-8р-ил)метилАІМ'-бензоилмочевина (I Ri = R2 = Н, R3 = СНз, А = NHCONHCOCeHs, n = 1) К раствору 4,4 г 1\1-/(6-метилэрголин-14-третбутил-8р-ил)-метил/-г\Г-бензоилтиомочевины в 50 мл этанола добавляют по каплям раствор 3,5 г нитрата серебра в 20 мл воды Получающийся в результате черный раствор кипятят с обратным холодильником в течение 10 минут, и затем фильтруют через целитную прокладку Растворитель удаляют, и остаток обрабатывают этилацетатом После промывания соляным раствором и сушки (MgSC^) растворитель испаряют, и сырой продукт дважды перекристаллизовывают из ацетона, получают 2,8 г названного в заголовке соединения, т пл 293-297°С Пример 32. 6-Метил-8р-бензоиламина-13-трет-бутилэрголин (I Ri = R2 = H, R3 = СНз, А = NHCOPh, n = =0) Действуя как в примере 5, но используя вместо 6-метил-8р-аминометил-13-трет-бутилэрголина 6-метил-8р-амино-13-трет-бутилэрголин, получают названное в заголовке соединение с выходом 60%, т пл 143-145°С Пример 33 6-Метил-8р-(2-фурил)акрилоиламинометил13-третбутилэрголин (I Ri = R2 = H, R3 = СН3, А = NHCOC2H2C4H3O, П = 1) Действуя как в примере 13, но используя вместо циклогексанкарбоновой кислоты 3-(2-фурил)акриловую кислоту (Е), получают названное в заголовке соединение с выходом 25%, т пл 173178°С Пример 34 6-Метил-8р-(3,4-диметоксибензоил)аминометил-13-третбутилэрголин (I Ri = R2 = Н, R3 = СНз, А = NHCOC8H9O2, n = 1) Действуя как в примере 5, но используя вместо бензоилхлорида 3,5-диметоксибензоилхлорида, получают названное в заголовке соединение с выходом 75%, т пл 153-157°С Пример 35. 6-Метил-8р-(1-фенил-2-пирролил)аминометил-13-третбутилэрголин (I Ri = R2 = Н, R3 =СНз, А = NHCOC4H3NC6H5, п = 1) Действуя как в примере 16, но используя вместо 1,5-диметилпиразол-З-карбоновой кислоты 1-фенилпиррол-2-карбоновую кислоту, получают названное в заголовке соединение с выходом 35%, т пл 135-137°С Пример 36. Приготовление таблеток Соединение примера 5 (FCE 23892) 5 мг -лактоза 200 мг - кукурузный крахмал 50 мг - стеарат магния 5 мг Способ приготовления FCE 23892, лактозу и кукурузный крахмал смешивают и равномерно увлажняют водой После просеивания увлажненной массы и сушки на полочной сушилке смесь снова пропускают сквозь сито, и добавляют стеарат магния Получающуюся в результате смесь прессуют в таблетки весом в 260 мг каждая Действуя как в примере 23, но используя вместо 2-аминопиразина 2-аминотиазол, получают названное в заголовке соединение с выходом 70%, т пл 230-234°С Пример 26. 6-Метил-8р-(6-хлор-3-пиридазинил)аминокарбонил-13-трет-бутилэрголина (I Ri = R2 = Н, R3 = СНз, А = CONHC4H2N2CI, n = 0) Действуя как в примере 23, но используя вместо 2-аминопиразина 6-хлор-З-аминопиридазин, получают названное в заголовке соединение с выходом 35%, т пл 257-259°С Пример 27. 6-Метил-8р-/(1Н,ЗН)-2,4-диоксодигидро-1-пиримидинилметил/-13-трет-бутилэрголин (I Ri = =R2 = 1, R3 = СНз, А = C4H5N2O2, n = 1) Смесь 5,1 г 6-метил-8р-аминометил-13-третбутилэрголина и 1,8 мл метилакрилата в 100 мл метанола кипятят с обратным холодильником в течение 4 часов Растворитель удаляют испарением, и остаток кристаллизуют из этилацетата, получают 6 г 6-метил-8р-1\1-(2-метоксикарбонилэтил)аминометил-13-трет-бутилэрголина, плавящегося при 153-157°С (I Ri = R2 = H, R3 = СН3, А = NCH2H4CO2CH3, П = 1) К раствору 2,9 г цианата калия в 30 мл воды добавляют по каплям раствор 6 г 6-метил-8р-ІЧ-(2метоксикарбонилэтил)-аминометил-13-трет-бутилэрголина в 120 мл воды и 35 мл 1N HCI Реакционную смесь нагревают при 80°С в течение 4 часов, и затем оставляют стоять при комнатной температуре в течение ночи Твердое вещество отделяют, промывают водой и кристаллизуют из этанола, получают 4,3 г названного в заголовке соединения, т пл 297-302°С Пример 28. 6-Метил-8р-(2-тиазолидинил)аминокарбонил14-трет-бутилэрголин (I Ri = R2 = H, R3 = СН3, А = CONCH3H2NS, n = 0) Действуя как в примере 25, но используя вместо 6-метил-8р-карбокси-13-трет-бутилэрголина 6-метил-8р-карбокси-14-трет-бутилэрголин, получают названное в заголовке соединение с выходом 609, т пл 243-247°С Пример 29 г\|-/(6-Метилэрголин-14-трет-бутил-8р-ил)метил/-ІЧ'-ацетилтиомочевина (I Ri = R2 = Н, R3 = СНз, А = NH-CS-NHCOCH3, n = 1) К раствору 3,2 г 6-метил-8р-аминометил-14трет-бутилэрголина в 30 мл тетрагидрофурана добавляют 1,5 г свежеприготовленного ацетилизотиоцианата После перемешивания в течение 3 часов получающийся в результате желтый раствор упаривают досуха, и остаток фильтруют через тонкий слой силикагеля, элюируя дихлорметаном После кристаллизации из ацетона получают названное в заголовке соединение с выходом 40%, т пл 220-223°С Пример 30. г\|-/(6-Метилэрголин-14-трет-бутил-8р-ил)метил/-І\Г-бензоилтиомочевина (I Ri = R2 = I, R3 СНз, А = NHCS-NHCOCeHe, n = 1) Действуя как в примере 29, но используя вместо ацетилизотиоцианата бензоилизотиоцианат, получают названное в заголовке соединение с выходом 75%, т пл 287-289°С 11 41880 Пример 37. Приготовление капсул - Соединение примера 9 (FCE-27823) -лактоза - стеарат магния Способ приготовления FCE 27823 смешивают с остальными добавочными продуктами, образующуюся в результате смесь пропускают через сито и перемешивают до однородного состояния в подходящем аппарате Образующейся в результате смесью заполняют твердые желатиновые капсулы (по 210 мг на капсулу) 5 мг 200мг 5 мг Тираж 50 екз Відкрите акціонерне товариство «Патент» Україна, 88000, м Ужгород, вул Гагаріна, 101 (03122) 3-72-89 (03122) 2-57-03 12 41880 13
ДивитисяДодаткова інформація
Назва патенту англійськоюSerotoninergic derivatives of ergolin and a pharmaceutical composition
Автори англійськоюMANTEGANI Sergio, BRAMBILLA Enzo, CACCIA Carla, CARFAGNA Nicola
Назва патенту російськоюСеротонинэргические производные эрголина и фармацевтическая композиция
Автори російськоюМАНТЕГАНИ Серджио, БРАМБИЛЛА Энзо, КАЧЧА Карла, КАРФАНЬЯ Никола
МПК / Мітки
МПК: A61P 1/08, A61P 25/26, A61P 25/22, A61P 9/12, A61P 25/02, A61K 31/48, A61P 9/00, A61P 25/04, A61P 25/20, A61P 25/24, A61P 25/30, A61P 25/18, C07D 457/00, A61P 43/00, A61P 9/10, A61P 25/28
Мітки: фармацевтична, композиція, похідні, серотонінергічні, ерголіну
Код посилання
<a href="https://ua.patents.su/13-41880-serotoninergichni-pokhidni-ergolinu-i-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Серотонінергічні похідні ерголіну і фармацевтична композиція</a>
Попередній патент: Паливна композиція
Наступний патент: Лікарській засіб для лікування або профілактики запалення та спосіб лікування або профілактики запалення (варіанти)
Випадковий патент: Лезо різального елемента